Ocriplasmin (Jetrea®)
Werbung

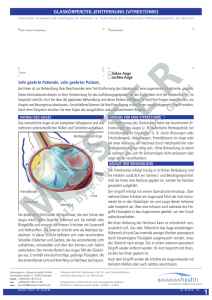
Pharmazeutische Chemie - Ocriplasmin Ocriplasmin (Jetrea ) Mit dem Fertigarzneimittel Jetrea steht nun erstmals eine medikamentöse Option zur Therapie der sogenannten vitreomakulären Traktion (VMT) zur Verfügung und wird wahrscheinlich in vielen Fällen die bislang einzige Therapiemöglichkeit, die chirurgische Vitrektomie, ersetzen. Die VMT ist eine Erkrankung, die im Alter auftritt. Der Glaskörper des Auges schrumpft natürlicherweise mit zunehmendem Alter, er löst sich dabei von der Retina ab. Die VMT entsteht, wenn sich der Glaskörper nicht vollständig löst, sondern durch Proteinstränge mit der Retina verbunden bleibt. Hauptsächlich betroffen von dieser Adhäsion des Glaskörpers ist die Makula, was durch Zugkräfte der Proteinstränge zu einem verzerrten Sehen führen kann. Die Kräfte können mitunter so stark sein, dass es zu einer Lochbildung innerhalb der Makula verbunden mit der Einbüßung an Sehschärfe bis hin zur Erblindung kommen kann. Bei der VMT kann es durchaus zu einer Spontanheilung kommen (ca. 10 %), nämlich in dem Fall, dass sich der Glaskörper doch noch vollständig vom Augenhintergrund abhebt. Demzufolge stehen Patienten mit VMT anfangs unter „aktiver Beobachtung“, erst in späteren Stadien wird die bislang einzige Therapieoption des invasiven, chirurgischen Eingriffs (s.o.) in Erwägung gezogen. Jetrea als intravitreale Inkektion enthält den rekombinant hergestellten Arzneistoff Ocriplasmin und ist zugelassen zur Therapie der VMT bis hin zu einem Makulaloch von bis zu 400 µm. Die Therapie besteht nur aus einer einmaligen Injektion, danach ist Schluss (Fachinformation Jetrea 2013). Der Glaskörper (Corpus vitreum) des Auges liegt zwischen Linse und Retina. Er besteht zu 99 % aus Wasser und bildet ein Hydrogel, die Proteinkonzentration liegt bei 40 mg/dl, was weniger als ein Prozent ausmacht. An strukturbildenen, festen Proteinen finden sich insbesondere Kollagenfasern, die ein dichtes Netzwerk ausbilden und über Glykosaminoglykane - vorzugsweise Hyaluronsäure und zu einem geringeren Anteil Chondroitinsulfat - miteinander verbunden sind. Zur Retina hin verdichten sich die Fasern und bilden so eine Grenzmembran. Die Retina und der Glaskörper sind über Haftproteine der extrazellulären Matrix miteinander verbunden (vitreoretinale Adhärenz), wobei sich gerade im Bereich der Makula stärkere Proteinverknüpfungen finden (Ulrich 2004, Schneider und Johnson 2011). Die Entwicklung eines vitreolytisch wirkenden Arzneistoffs wird ausgehend von verschiedenen Wirkmechanismen verfolgt. Einerseits kann die Wirkung eines Vitreolytikums dadurch zustande kommen, dass es eine vitreale Verflüssigung, d.h. eine Verflüssigung der Hydrogel-Struktur des Glaskörpers, induziert, man spricht in diesem Fall von einem „Liquefactant“, andererseits kann es eine Schwächung bzw. im Idealfall eine komplette Aufhebung der Adhäsion des Glaskörpers an der Retina hervorrufen. Ein solches Vitreolytikum wird als „Interfactant“ bezeichnet. Bei den in der klinischen Erprobung befindlichen Substanzen wie auch beim Ocriplasmin liegt oftmals eine Kombination aus „Liquefactant“ und „Interfactant“ vor (Sebag 1998, Sebag 2009). Diese molekularen Veränderungen des Glaskörpers bzw. der vitreoretinalen Grenzschicht können entweder nichtenzymatisch oder – was wesentlich häufiger ist – enzymatisch erfolgen. 1 CA 18.6.2013 Pharmazeutische Chemie - Ocriplasmin Ein typisches Enzym, das als vitreolytisch wirkendes Agens getestet wird, ist beispielsweise die Hyaluronidase. Aufgrund des erhöhten Vorkommens und insbesondere aufgrund der großen Bedeutung von Hyaluronsäure für die Aufrechterhaltung der Gelstruktur im Glaskörper, scheint Hyaluronidase Potential als „Liquefactant“ zu besitzen (Schneider und Johnson 2011). Ein anderes „Liquefactant“, die bakterielle Kollagenase aus Clostridium histolyticum, ist eines der wenigen Enzyme, welches in der Lage ist, das spezielle Kollagennetzwerk und die –fibrillen im Glaskörper zu spalten. Die resultierenden Fragmente sind löslich und können durch nichtspezifische Proteasen weiter abgebaut werden (O’Neill und Shea 1973, Bishop 2009). Weitere vitreolytisch wirksame Verbindungen – vorwiegend Enzyme – sind getestet worden oder befinden sich noch in der Testung (Schneider und Johnson 2011). Die Protease Plasmin, die Fibrin zu Fibrinspaltprodukten umwandelt, ist wahrscheinlich das am intensivsten studierte Vitreolytikum. Allerdings ist Plasmin sehr instabil (Inaktivierung entweder durch Autolyse oder durch Bindung an α2Antiplasmin), weshalb klinische Testapplikationen in der Regel vom Proenzym Plasminogen ausgehen, welches dann unmittelbar vor Gebrauch durch Plasminogenaktivatoren in das aktive Plasmin umgewandelt wird (Schneider und Johnson 2011). Wegen der Instabilität des Plasmins und der Schwierigkeiten, rekombinantes Plasminogen zu produzieren (Whitefleet-Smith et al. 1989), haben sich die Forschungen auf kürzerkettige Plasmin-Derivate konzentriert, die nach wie vor fibrinolytische Aktivität besitzen aber wesentlich stabiler sind. Ocriplasmin – auch bekannt unter dem Namen Microplasmin – ist ein solches wesentlich stabileres, verkürztes Plasmin-Derivat (Ocriplasmin ~22 kDa vs. Plasmin ~88 kDa (Schneider und Johnson 2011). Es wird mittels rekombinanter Techniken hergestellt in einem Pichia pastoris-Expressionssystem (Nagai et al. 2003). Ursprünglich wurde die Bildung von Ocriplasmin aus Plasmin durch autolytischen Abbau bei sehr hohen pH-Werten beobachtet (Wu et al. 1987). Ocriplasmin besteht aus insgesamt 249 Aminosäuren aufgeteilt auf zwei Polypeptid-Ketten mit 19 und 230 Aminosäuren. Die beiden Ketten sind durch zwei Dislufidbrücken zwischen Cys6 und Cys124 sowie Cys16 und Cys24 miteinander verbunden, das 230-Aminosäuren umfassende Polypeptid wird weiterhin durch vier intramolekulare Disulfibrücken stabilisiert (Aerts et al. 2012). Humanes Plasmin besteht aus zwei Polypetidketten, wobei die A-Kette fünf sogenannte Kringel-Domänen (homologe Dreifachschleifen) und die B-Kette das aktive Zentrum mit der katalytischen Triade enthält. Ocriplasmin hat die A-Kette deutlich verkürzt (nur 19 Aminosäuren), die Kringel-Domänen des humanen Plasmins fehlen (Ocriplasmin: „des-Kringel 1-5 Plasmin“), das aktive Zentrum der Serin-Protease Plasmin ist aber vorhanden. Microplasmin ist in der Lage, eine Reihe von Proteinen zu spalten, z.B. Fibrinaggregate, Laminin und Fibronectin, wobei insbesondere Laminin und Fibronectin an der vitreoretinalen Grenzschicht lokalisiert sind, wo sie eine wichtige Rolle innerhalb der Pathogenese der VMT einnehmen (Chen et al. 2009, Hermel et al. 2010). Dementsprechend kann Ocriplasmin auch eher als „Interfactant“ bezeichnet werden, auch wenn es durch Fibrinspaltungen zu einer Verflüssigung der vitrealen Gel-Struktur führt (Wirkung als “Liquefactant“). Literatur: Aerts, F. et al. Biophys Chem 2012, 165-166, 30 Bishop, P.N. Dev Ophthalmol 2009, 44, 7 2 CA 18.6.2013 Pharmazeutische Chemie - Ocriplasmin Chen, W. et al. Curr Eye Res 2009, 34, 1057 Fachinformation Jetrea 2013 ThromboGenicsNV Hermel, M. et al. Curr Eye Res 2010, 35, 419 Nagai, N. et al. J Thromb Haemost 2003, 1, 307 O’Neill, R. und Shea, M. Can J Ophthalmol 1973, 8, 366 Ulrich, J.N. Dissertation 2004 „Veränderungen der Komponenten des fibrinolytischen Systems im Glaskörper bei vitreoretinalen Erkrankungen“ LMU München Schneider, E.W. und Johnson, M.W. Clin Ophthalmol 2011, 5, 1151 Sebag, J. Retina 1998, 18, 1 Sebag, J. Retina 2009, 29, 871 Whitefleet-Smith, J. et al. Arch Biochem Biophys 1989, 271, 390 Wu, H.L. et al. Proc Natl Acad Sci USA 198784, 8292 3 CA 18.6.2013