Verbesserung der Bewertungskriterien von Herzoperationen mittels
Werbung

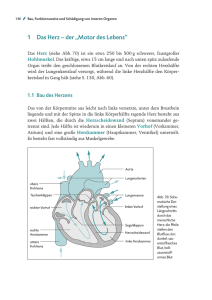
Verbesserung der Bewertungskriterien von Herzoperationen mittels Strömungsmechanik Ausarbeitung im Seminar „Das virtuelle Labor“ von Marwin Wiechert Datum Januar 2011 Inhaltsverzeichnis Inhaltsverzeichnis ................................................................................................................................. 02 0. Abstract ............................................................................................................................................. 03 1. Einführung ........................................................................................................................................ 04 2. Grundlagen ....................................................................................................................................... 05 3. Die Modellierung und Validierung der KaHMo............................................................................... 06 5. Das Karlsruher Heart Modell in der Praxis ...................................................................................... 07 6. Zusammenfassung und Ausblick ...................................................................................................... 09 Abbildungsverzeichnis/ Literaturverzeichnis........................................................................................ 10 2 0 Abstract Diese Arbeit hat den Anspruch zu einer Verbesserung der Bewertungsverfahren von Herzoperationen beizutragen. Hierbei ist es entscheidend, dass sich aus den entwickelten Kennzahlen ablesen lässt in welchem Grad eine Operation erfolgreich war. Die Forschung auf diesem Gebiet ist unerlässlich, da Herzerkrankungen und -operationen, beziehungsweise deren Folgen, die häufigste Todesursache in Deutschland sind. Diese Arbeit beruht auf dem Karlsruher Heart Modell der Universität Karlsruhe. Dieses wird innerhalb dieser Arbeit weiterentwickelt bis hin zur Integration in den klinischen Einsatz. Die technische Grundlage dieser Arbeit bildet die Strömungsmechanik, welche bei der Simulation des Blutes innerhalb eines Herzzyklus Anwendung findet. Teilziel dieser Arbeit ist die Erarbeitung geometrischer Modelle der einzelnen Bestandteile des menschlichen Herzens. 3 1 Einführung 1.1 Motivation Das Herz spielt seit vielen Jahrhunderten eine entscheidende Rolle im Bewusstsein des Menschen. Ein Überleben des menschlichen Daseins ist ohne dieses Organ nicht denkbar. Daher muss es unser Ziel sein, dieses Organ möglichst lange funktionstüchtig zu halten. Aus physiologischer Sicht ist das Herz die Grundlage unseres Herz- Kreislaufsystems und für die Nährstoffversorgung unseres Organismus verantwortlich. Zur Erfüllung dieser lebenslangen Aufgabe schlägt das Herz ca. 3 Milliarden mal, dabei werden ca. 250 Liter Blut durch unseren Körper gepumpt. Diese Leistung wurde bisher noch von keinem technisch hergestelltem Gerät erreicht. Diese enorme Beanspruchung führt verstärkt zu Verschleißerscheinungen, die sich in verschiedenen Herzerkrankungen widerspiegeln. Diese reichen von Bluthochdruck bis hin zum Herzinfarkt. Eben solche Krankheiten stellen eine große Gefahr für den Menschen dar. Somit ist es nicht verwunderlich, dass mehr als 50% der Todesfälle in Deutschland auf Herz- Kreislauf Erkrankungen zurückzuführen sind. [STA08] Die moderne Medizin versucht seit geraumer Zeit diesen Zahlen entgegenzuwirken, allerdings nur mit mäßigem Erfolg. Es existieren mittlerweile künstliche Ersatzherzen, diese dienen jedoch lediglich als mangelhafte Übergangslösung zu einem Spenderherzen. Auf Grund der begrenzten Anzahl dieser Spenderherzen, können nur ca. 50% der benötigten Organe bereitgestellt werden. Daher ist es umso wichtiger, dass ein implantiertes Organ nicht abgestoßen wird und voll funktionsfähig ist. Zur Verbesserung der Operationsergebnisse werden kontinuierlich neue Techniken entwickelt bzw. bestehende Techniken verbessert. Diese Arbeit beschäftigt sich mit der Entwicklung eines patientenspezifischen virtuellen Modell des Herzens, welches mittels strömungsmechanischer Planung von Herzoperationen deren Erfolg erhöhen soll. Weiterhin sollen neue Möglichkeiten zur Bewertung von Herzoperationen geschaffen und deren Einbindung in den klinischen Alltag realisiert werden. 1.2 Ansatz: Das Karlsruhe Heart Model (KaHMo) Bei dem Karlsruher Heart Model handelt es sich um ein virtuelles Modell des menschlichen Herzens. Die Daten stammen aus MRT (Magnet Resonanz Tomographie)- und CT (Computer Tomographie)Daten der einzelnen Bestandteile des Herzen. Momentan existieren zwei aufeinander aufbauende Modelle, welche die Grundlage für die Weiterentwicklung bilden. Zum einen das KaHMoMRT und zum andern das KaHMoFSI. Ersteres spiegelt den derzeitigen Befund, also den Zustand des Herzens, wieder. Des Weiteren bietet dieses Modell eine Möglichkeit die geometrischen Daten, also beispielsweise die Strömungsgeschwindigkeit, des Blutflusses während eines Zyklus zu extrahieren. Das zweite Modell benötigt zu einem gewissen Teil die Daten des ersten Modells, um eine „what – if“ – Simulation zu realisieren. Dieses Modell errechnet aus den patientenspezifischen Daten mögliche Auswirkungen von Operationen und ermöglicht dem Chirurgen vor einem Eingriff somit eine bestmögliche Vorbereitung und Planung. Diese Modelle sollen im folgendem erweitert und verbessert werden. 4 2 2.1 Grundlagen Das Herz Der menschliche Blutkreislauf besteht sowohl aus einem Niederdruck-, als auch einem Hochdrucksystem, welche mit ihrer jeweiligen Pumpe das Herzorgan bilden. Ein gesundes Herz hat, abhängig von Zustand und Geschlecht, durchschnittlich die Größe einer geballten Faust und wiegt ca. 200-350g [NOV10]. Die beiden Teilsysteme des Herzens bestehen jeweils aus einem Vorhof(Atrium) und einer Herzkammer(Ventrikel). Das Blut gelangt aus der linken Herzhälfte über die Aorta in den Organismus, wohingegen die Pulmonal Arterie für den Blutfluss der rechten Seite verantwortlich ist. Auf Grund der Tatsache, dass die Richtung des Blutflusses im menschlichen Organismus geregelt sein muss, ist es notwendig über eine Steuerungseinheit zu verfügen. Diese Aufgabe übernehmen im menschlichen Organismus die Herzklappen, welche sich nur unter bestimmten Druckverhältnissen in eine feste Richtung öffnen. Wie erwähnt arbeitet das Herz in Zyklen, die parallel in [Abb. 1] Das Herz den Ventrikeln ablaufen. Diese gliedern sich in die Diastole, zu der sowohl die Entspannungsphase als auch die Füllungsphase gehört und die Systole, also die Anspannungs- bzw. Auswurfphase. Die einzelnen Vorgänge dieser Phasen können in [SPI09] nachgelesen werden. [Abb. 2] Das Herzkreislaufsystem 2.2 Der Kreislauf beginnt mit dem sauerstoffreichen Blut in dem linken Ventrikel, dieses „unverbrauchte Blut“ wird durch die Aorta über die Arterien in die einzelnen Organe bzw. Muskelgruppen transportiert. Um den Kreislauf zu schließen wird nun das verbrauchte Blut über die Venen zurück zum rechten Herzflügel gepumpt, von hier aus wird es mittels der Pulmonal Arterie zu der Lunge befördert. Hier wird das Blut wieder mit Sauerstoff versorgt und anschließend in den linken Ventrikel geleitet. Von hier an startet der Kreislauf erneut. Das Blut Der Aufbau des menschlichen Blutes bildet eine Suspension, ein heterogenes Stoffgemisch bestehend aus ca. 42 Prozent zellulären Bestandteilen. Das restliche Plasma besteht zu 90% aus Wasser. Das besondere an dem Blut ist, dass es über eine variable Viskosität verfügt, also an verschiedenen Stellen unterschiedliche Strömungsverhältnisse aufweist. 2.3 Theoretische Grundlagen Dieses Simulationsverfahren basiert auf gewissen strömungsmechanischen Gleichungen, diese im Einzelnen zu erläutern würde den Umfang dieser Arbeit jedoch übersteigen. Wissenswert ist jedoch, dass es sich bei den entwickelten Gleichungen um Differentialgleichungen handelt und diese für komplexe Strömungen, wie sie im Herzen vorkommen, analytisch nicht lösbar sind. Die Lösung dieser Gleichung wird mittels eines Systems von algebraischen Gleichungen sowohl zeitlich als auch räumlich approximiert. 5 3. Die Modellierung und Validierung des KaHMo 3.1. Datensegmentierung Durch die stetige Verbesserung der Detailgenauigkeit ist es heutzutage möglich, Strömungsstrukturen im menschlichen Herzen auslesen zu können. Aus diesen Daten können Durchschnittsmodelle erarbeitet werden, auf welche das spezielle Herz angenähert werden kann. Bislang war eine exakte Modellierung komplexer Geometrien, wie die der Oberfläche eines bewegten Vorhofs, nicht möglich, da aus den MRT Daten nur Konturen ausgelesen werden konnten. Mit einer neuen Software ist nun jedoch eine dreidimensionale Darstellung des gesamten Herzens samt angrenzender Gefäße möglich. [Abb. 3] Geometrische Daten des Herzens 3.2 Modellierung der Herzklappen Basierend auf der Funktionsweise der sich im Herzzyklus öffnenden bzw. schließenden Herzklappen muss eine Möglichkeit gefunden werden, diesen Vorgang zu simulieren. Da das KaHMoMRT auf MRTund CT-Daten beruht, deren Auflösung nicht fein genug ist für eine Modellierung, wird eine spezielle Simulation eingesetzt, um das Modell zu verbessern. Wie zu sehen ist, besteht am Anfang eines Zyklus sowohl in der Mitral (oben)-, als auch in der Aortenklappe (unten), ein hoher Widerstand (rote Färbung). Im Verlaufe des Pumpvorgangs verringert sich dieser Widerstand jedoch und das Blut kann einfließen (grüne Färbung). Dies geschieht bis die Klappe sich [Abb. 4] Herzklappenzyklus vollends öffnet und somit das Blut sich die Klappe und eröffnet den nächsten ungehindert einfließen lässt. Im nächsten Schritt schließt Zyklus. 3.3 Versuchsaufbau zur Validierung des KaHMo Die für die Simulation getroffenen Annahmen müssen noch hinsichtlich Genauigkeit und physikalischer Richtigkeit validiert werden. Hierzu wurde ein Versuch mit einem Silikonherzen durchgeführt. Die Bewegung des Herzens wird durch eine spezielle Pumpe simuliert, welche der Messkammer pulsatil(stoßweise) Flüssigkeit entzieht. Dieses Vorgehen simuliert einen kompletten Herzzyklus, da der Ventrikel bis auf seine enddiastolische Größe anwächst und sich im folgenden wieder entspannt. Der Ventrikel beruht auf patientenspezifischen MRT – Daten und wird aus Silikon gefertigt. Zur Simulation des Blutes wird eine Wasser – Glycerin Mischung verwendet, der man der Einfachheit halber keine Partikel beifügt. Bei der Durchführung wird eine Pumpfrequenz von 60/min angesetzt. Sowohl die Ventrikel Bewegung als auch die Strömung werden in 18 verschiedenen Punkten ausgewertet. 6 3.4 Interpretation der Strömungsstruktur Die Ergebnisse aus dem Versuch sind für die klinische Anwendung noch zu ungenau und müssen daher mit einer speziellen Software approximiert werden. Dies geschieht zu sechs signifikanten Zeitpunkten. Am Beginn der Diastole (t=0,13) bildet sich eine wirbelartige Strömung zwischen dem neu einströmenden Fluid und dem ruhenden bereits vorhandenen Gemisch. Während der letzten Systole haben sich nicht alle Wirbelstrukturen aufgelöst, daher befindet sich im linken vorderen Bereich noch eine Wirbelformation. Diese bewegt den neu gebildeten Wirbel dazu, sich immer weiter in den Ventrikel hinab zu bewegen, bis er schließlich zum [Abb. 5] Strömungsstrukturen 1 Zeitpunkt (t=0,22) auf die untere Ventrikelwand stößt. Bei diesem Aufprall (t=0,28) wird der Wirbel aufgebrochen und der Großteil des Gemisches bewegt sich zum Zeitpunkt (t=0,39) in Richtung Ventrikelspitze. [Abb. 6] Strömungsstrukturen 2 Zum Ende der Diastole erreicht die Strömung die Ventrikelspitze und zerfällt in mehrere Wirbelstrukturen mit gleicher Drehrichtung (t=0,63). Die Wirbelstruktur ist bis über das Ende der Systole erkennbar und beeinflusst somit den nächsten Zyklus (t=0,86). [Abb. 7] Strömungsstrukturen 3 Diese Ergebnisse decken sich allerdings nur bedingt mit den Simulationsergebnissen. Der Fehler wird auf bis zu ca. 21 Prozent geschätzt. In weiteren Untersuchungen wurde jedoch festgestellt, dass die Unterschiede nicht auf eine falsche Berechnung während der Simulation zurückzuführen sind, sondern auf einen mangelnden Versuchsaufbau. Somit gilt die Simulation als validiert. 4 Das KaHMo in der Praxis 4.1 Voraussetzungen zum klinischen Einsatz des KaHMo Die Grundvoraussetzung für einen klinischen Einsatz des Modells ist, dass die derzeitigen im Tomographen erfassten Daten als Grundlage für die Simulation ausreichen. Das bedeutet, dass es keine zusätzlichen Untersuchungen geben darf. Zur Beurteilung des prae- bzw. postoperativen Zustands dienen spezifische Kennzahlen, welche im Verlauf der Arbeit noch behandelt werden. Diese wurden anhand der bestehenden patientenspezifischen Datengrundlage ermittelt. Des weiteren musste ein Weg zur Automatisierung der Simulation gefunden werden, um die Bearbeitungszeit von mehreren Wochen auf wenige Tage zu verkürzen. 7 4.2 Leitfaden zur praktischen Umsetzung 1. 2. 3. 4. 5. 6. 7. 8. Datenerhebung der gesamten Geometrieinformationen von Ventrikel und Aorta. Anpassung des Mittleren Modells an das patientenspezifische Herz. Zonenanpassung der projizierten Öffnungsflächen der Herzklappen.* Extraktion der topologischen identischen Oberflächennetze.* Übergabe der Daten an die Workstation.* Automatische Volumenvernetzung und Parametereinstellung. Berechnung des approximierten Volumenverlaufs.* Automatisierte Anpassung der Öffnungs- und Schließungsprozesse der Herzklappen anhand des Volumenverlaufes.* 9. Schnittebenendefinition zur anschließenden graphischen Auswertung der Herzströmung.* 10. Simulation inklusive Auswertungsroutinen zur Ermittlung der Kennzahlen. 11. Graphische Auswertung in den zuvor definierten Schnittebenen (* wird in dieser Arbeit nicht thematisiert) 4.3 Erfassung der Ventrikleströmung Die folgende Simulation basiert auf dem Datensatz eines Patienten mittleren Alters, welcher einen Herzinfarkt erlitten hat. Vor der Operation wies der Ventrikel eine starke Ausbeulung auf, diese wurde operativ gestrafft, um das Herz wieder auf die ursprüngliche Größe zu bringen. Die Interpretation der dreidimensionalen Strömungsstruktur erfolgt zu vier signifikanten Zeitpunkten im Herzzyklus. Zu Beginn bildet sich der charakteristische Wirbel im oberen rechten Herzen. Man kann deutlich erkennen, dass durch die Operation die Fließgeschwindigkeit erhöht werden konnte. Im weiteren Verlauf wandert der Ringwirbel in Richtung Ventrikelmitte. Durch den Infarkt ist die linke Ventrikelseite schwächer ausgeprägt, folglich kippt der Wirbel nicht in die Ventrikelspitze ab. Im praeoperativen Fall versperrt die linke Ringwirbelseite halbseitig den Herzeingang. Dadurch wird das Strömungsverhalten im Vorhof beeinflusst. Zum Ende der Diastole weisen die Untersuchungen deutliche Unterschiede auf. Das Strömungsbild während der Systole zeigt im Vorhof die bekannte Ausbreitung eines rotierenden Wirbels. Im Aneurysma bildet sich eine Wirbelwalze, welche sich nicht auflöst und somit den nächsten Zyklus wieder beeinflusst. Hier konnte durch die Operation eine Verbesserung geschaffen werden. Aus Sicht der Analyse der Strömungsstruktur war die Operation ein Erfolg. Allerdings konnte eine vollständige Rekonstruktion des Organs nicht erreicht werden. Daher könnte das postoperative Gesamtergebnis besser ausfallen. [Abb. 8] Strömungssimulation 8 5.4 Gewonnene Kennzahlen Der Erfolg einer Operation wird unter folgenden Kennzahlen bewertet(Ausschnitt): • Druck – Volumen – Arbeit o Der Faktor gibt Aufschluss über die Aktivität des Herzens. • Verweilzeit o Die Verweilzeit besagt, wie lange Blut im Herzen bleibt bevor es wieder weitergepumpt wird. • Schlagvolumen o Das Schlagvolumen gibt Auskunft darüber, wie viel Blut pro Herzzyklus in den Kreislauf ausgeworfen wurde. Da diese Menge bei erkrankten Herzen immer geringer wird, ist das Schlagvolumen ein wichtiges Indiz für den Zustand eines Herzens. • Cardiac Output o Der Cardiac Output besagt, wie viel Blut pro Minute in den Körperkreislauf gepumpt wird. [Abb. 9] Kennzahlenübersicht (Auswahl) 5 Zusammenfassung und Ausblick Diese Arbeit verfolgt das Ziel, einen auf Strömungsmechanik basierenden Beitrag zur Planung und Auswertung von Herzoperationen zu schaffen. Hierzu wurden zwei Modelle zugrunde gelegt. Sowohl das KaHMoMRT, sowie das KaHMoFSI sollten zu einem einsatzfähigen System in der klinischen Anwendung entwickelt werden. Hierzu musste zuerst ein anatomisch korrektes Modell des Herzens erarbeitet werden. Des Weiteren wurden charakteristische Kennzahlen zur strömungsmechanischen Bewertung von Herzoperationen entwickelt und validiert. Als letztes musste ein Weg zur Automatisierung des Modells gefunden werden. Begonnen mit der Datensegmentierung zur Schaffung eines Metamodells des Vorhofs konnten ebenfalls die Herzklappen in ausreichendem Detailgrad modelliert werden. Die Validierung des Modells wurde mittels eines Versuchs realisiert. In diesem Versuch wurde aus patientenspezifischen Daten ein Silikonherz erstellt, welches zusammen mit einer speziellen Pumpe einen Herzzyklus simulieren konnte. Die aus der Messung extrahierten Oberflächeninformationen dienten wiederrum der Modellerstellung. Auf diese Weise ließen sich die numerischen Informationen denen aus dem Modell gegenüberstellen. Da diese zu einem ausreichenden Prozentsatz übereinstimmten, konnte das Modell validiert werden. Ein weiteres erreichtes Teilziel dieser Arbeit war die Schaffung von spezifischen Kennzahlen zur Beurteilung eines Operationsergebnisses. Zuletzt musste eine Möglichkeit geschaffen werden, um den Modellierungsvorgang zu automatisieren. Die notwendigen Schritte konnten innerhalb dieser Arbeit aufgezeigt werden. Mit der Validierung und der Entwicklung aussagekräftiger Kennzahlen ist das KaHMo nun auf dem Stand, in der Praxis eingesetzt zu werden. Weiterführend wäre es sicherlich aufschlussreich, das erarbeitete geometrische Modell des Herzens zu verfeinern, indem man zusätzlich die geometrischen Daten des Inneren Herzens simuliert. 9 Abbildungsverzeichnis • [Abb. 1] Spiegel, K. (2009). Strömungsmechanischer Beitrag zur Planung von Herzoperationen. Karlsruhe: Universitätsverlag Karlsruhe. • [Abb. 2] Spiegel, K. (2009). Strömungsmechanischer Beitrag zur Planung von Herzoperationen. Karlsruhe: Universitätsverlag Karlsruhe. • [Abb. 3] Spiegel, K. (2009). Strömungsmechanischer Beitrag zur Planung von Herzoperationen. Karlsruhe: Universitätsverlag Karlsruhe. • [Abb. 4] Spiegel, K. (2009). Strömungsmechanischer Beitrag zur Planung von Herzoperationen. Karlsruhe: Universitätsverlag Karlsruhe. • [Abb. 5] Spiegel, K. (2009). Strömungsmechanischer Beitrag zur Planung von Herzoperationen. Karlsruhe: Universitätsverlag Karlsruhe. • [Abb. 6] Spiegel, K. (2009). Strömungsmechanischer Beitrag zur Planung von Herzoperationen. Karlsruhe: Universitätsverlag Karlsruhe. • [Abb. 7] Spiegel, K. (2009). Strömungsmechanischer Beitrag zur Planung von Herzoperationen. Karlsruhe: Universitätsverlag Karlsruhe. • [Abb. 8] Spiegel, K. (2009). Strömungsmechanischer Beitrag zur Planung von Herzoperationen. Karlsruhe: Universitätsverlag Karlsruhe. • [Abb. 9] Spiegel, K. (2009). Strömungsmechanischer Beitrag zur Planung von Herzoperationen. Karlsruhe: Universitätsverlag Karlsruhe. Literaturverzeichnis • [SPI09] Spiegel, K. (2009). Strömungsmechanischer Beitrag zur Planung von Herzoperationen. Karlsruhe: Universitätsverlag Karlsruhe. • [NOV10] Novafeel, 2010, http://www.novafeel.de/anatomie/herz/anatomie-­‐herz.htm • [STA08] Statistisches Bundesamt, (2008), http://www.destatis.de/jetspeed/portal/cms/ 10