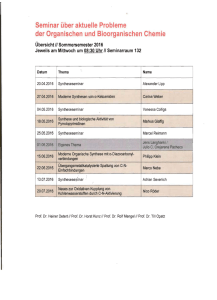
Synthese des A´-Rings von Labyrinthopeptin A2 und
Werbung

Synthese des A´-Rings von Labyrinthopeptin A2 und eines Referenzstandards zum Nachweis der ungewöhnlichen Aminosäure Labionin vorgelegt von Diplom-Chemiker Maik Henkel aus Luckenwalde Von der Fakultät II - Mathematik und Naturwissenschaften der Technischen Universität Berlin zur Erlangung des akademischen Grades Doktor der Naturwissenschaften Dr. rer. nat. genehmigte Dissertation Promotionsausschuss: Vorsitzender: Prof. Dr. rer. nat. Martin Lerch Berichter/Gutachter: Prof. Dr. rer. nat. Roderich Süßmuth Berichter/Gutachter: Prof. Dr. rer. nat. Michael Bienert (FMP Berlin) Tag der wissenschaftlichen Aussprache: 25. April 2011 Berlin 2011 D 83 Die vorliegende Arbeit wurde unter der Leitung von Herrn Prof. Dr. Roderich Süssmuth in der Zeit von November 2006 bis Januar 2011 am Institut für Chemie der Fakultät II der Technischen Universität Berlin angefertigt. Danksagung Mein besonderer Dank gilt Herrn Prof. Dr. Roderich Süssmuth für die Überlassung des Themas, hervorragende Arbeitsbedingungen und die ausgezeichnete Betreuung während der Durchführung dieser Arbeit. Herrn Prof. Dr. Michael Bienert danke ich herzlich für die bereitwillige Übernahme der zweiten Berichterstattung. Herrn Prof. Dr. Martin Lerch danke ich für die Übernahme des Prüfungsvorsitzes. Herrn Dr. Mark Brönstrup, Herrn Dr. Luigi Toti und Herrn Dr. Joachim Wink (SanofiAventis,Frankfurt, Deutschland) danke ich für die Bereitstellung der Labyrinthopeptine. Herrn Dipl. Chem. Alexander Pesic danke ich für die Hilfe bei der Herstellung der Labyrinthopeptinderivate, die Durchführung der GC-Analytik mit dem Referenzstandardsubstanz zum Labioninnachweis und die gute Zusammenarbeit bei diesem Projekt. Herrn Dipl. Chem. Julian Kretz danke ich für die Durchführung der GC-Analytik der γ-Methylenglutaminsäurederivate und möchte ihm viel Erfolg bei der Weiterführung dieses Projekts wünschen. Herrn Dipl. Chem. Paul Ensle danke ich für die vielen interessanten Gespräche und die Hilfestellung bei der Benutzung des Peptidsynthesizers. Frau Dr. Maria Schlangen und Frau Christine Klose danke ich für die Durchführung der zahlreichen MS-Messungen. Frau Dr. Elisabeth Irran danke ich für die Kristallstrukturbestimmung. Für zahlreiche konstruktive Gespräche, das gute Arbeitsklima und Hilfestellungen möchte ich mich bei meinen Kollegen aus der Arbeitsgruppe Süssmuth bedanken, namentlich: Dr. Srinivas Banala, Todor Baramov, Dr. Diane Butz, Dr. Brian Davis, Alexander Denisiuk, Paul Ensle, Dr. Sven C. Feifel, Dr. Elvira Gottardi, Anne Hänchen, Soliman Alsayd Helali, Manuela Hügelland, Bahar Kalyon, Dr. Simone Keller, Joanna Krawczyk, Bartlomieij Krawczyk, Ginka Kazakova, Julian Kretz, Benjamin Landmann, Khai Ming Lie, Marius Löhken, Diana Matthes, Eva Mösker, Dr. Agnes Mühlenweg, Jane Müller, Wolfgang Müller, Jonny Nachtigall, Florian Oldach, Alexander Pesic, Vanessa Peters, Dr. Stefan Pohle, Marta Ramirez Hernandez, Saskia Rausch, Dr. Pierre-Loic Saaidi, Georg Sambeth, Nicole Sattler, Dr. Heiko Schadt, Caroline Schloßer, Dr. Timo Schmiederer, Dr. Kathrin Schneider, Vivien Schubert, Hanna von Suchodoletz, Kamil Stelmaszyk, Dr. Suada Turkanović, Stefanie Uhlmann, Kati Winter, Dr. Falko Wolter und David Wagner. Für ihre stetige Unterstützung und ihr sehr großes Verständnis möchte ich mich bei meiner Lebenspartnerin Ina bedanken. Mein Dank gilt zudem meinen Eltern, die mir das Studium der Chemie ermöglicht haben. Inhaltsverzeichnis Inhaltsverzeichnis 1. Einleitung .............................................................................................................................. 1 1.1 Conotoxine ....................................................................................................................... 2 1.2 Lantibiotika ...................................................................................................................... 3 1.2.1 Biologische Aktivität der Lantibiotika ...................................................................... 4 1.2.2 Biosynthese der Lanthionine und Methyllanthionine ............................................... 6 1.2.3 Klassifizierung von Lantibiotika............................................................................. 10 1.3 Die Labyrinthopeptine.................................................................................................... 13 1.3.1 Struktur von Labyrinthopeptin A2 .......................................................................... 14 1.3.2 Biosynthese von Labyrinthopeptin A2.................................................................... 16 1.3.3 Weitere Labionin-haltige Peptide............................................................................ 18 1.3.4 Biologische Aktivität der Labyrinthopeptine .......................................................... 20 1.4 Totalsynthesen von Lantibiotika .................................................................................... 22 1.4.1 Totalsynthese von Nisin .......................................................................................... 22 1.4.2 Totalsynthese von Bis(desmethyl)-Lacticin 3147 A2 und Lactocin S.................... 23 1.5 Mechanistische Details wichtiger Schlüsselreaktionen.................................................. 24 1.5.1 Stereoselektive Alkylierung von Glycin ................................................................. 25 1.5.2 Synthese von α,α-disubstitutierten Aminosäuren aus zyklischen Sulfiten............. 27 1.5.3. Synthese von α,α–disubstituierten Aminosäuren durch chelatverbrückte ClaisenUmlagerung...................................................................................................................... 29 2. Aufgabenstellung................................................................................................................ 33 3. Ergebnisse und Diskussion ................................................................................................ 35 3.1 Synthese von 2,4-Diamino-2-hydroxymethylglutarsäure .............................................. 35 3.1.1. Synthese von 2,4-Diamino-2-hydroxymethylglutarsäure über ein Oxazolidin ..... 36 3.1.2. Synthese von 2,4-Diamino-2-hydroxymethylglutarsäure durch eine chelatverbrückte Claisen-Umlagerung ............................................................................. 40 3.1.3. Synthese von 2,4-Diamino-2-hydroxymethylglutarsäure aus Pyrazolderivaten.... 41 3.1.4 Synthese von 2,4-Diamino-2-hydroxymethylglutarsäure aus γ-Methylenglutaminsäure ................................................................................................................................. 42 3.2 Studien zur Synthese von Labionin................................................................................ 46 3.3 Synthese des A´-Rings von Labyrinthopeptin A2.......................................................... 48 3.4 Synthese eines analytischen Referenzstandards zum Labioninnachweis ...................... 57 3.5 Derivatisierung der Naturstoffe Labyrinthopeptin A1 und A2 ...................................... 61 4. Zusammenfassung und Ausblick ...................................................................................... 65 5. Experimenteller Teil .......................................................................................................... 69 5.1. Allgemeine Informationen ............................................................................................ 69 5.2 Synthesevorschriften ...................................................................................................... 73 5.2.1. Vesuch der Synthese von 2,4-Diamino-2-hydroxymethylglutarsäure aus Oxazolidinen .................................................................................................................... 73 5.2.2. Synthese von 2,4-Diamino-2-hydroxymethylglutarsäure aus Pyrazolderivaten.... 82 5.2.3. Synthese von 2,4-Diamino-2-hydroxymethylglutarsäure aus γ-Methylenglutaminsäure ................................................................................................. 85 5.2.4. Studien zur Synthese von Labionin........................................................................ 98 5.2.5. Synthese des Dipeptides des A´-Ring, des Tripeptids des B´-Rings und des Modellpeptids................................................................................................................. 101 5.2.6. Synthese des A´-Rings von Labyrinthopeptin A2................................................ 112 5.2.7. Synthese eines analytischen Refenzenzstandards zum Labioninnachweis .......... 123 5.2.8. Derivatisierung der Labyrinthopeptine ................................................................ 134 5.3. Analytische Daten ....................................................................................................... 139 5.3.1 NMR-Spektren ausgewählter Verbindungen ........................................................ 139 Inhaltsverzeichnis 5.3.2. MS/MS-Spektrum von Peptid 117 ....................................................................... 170 5.3.3. LC-MS-Analytik der Peptide 122, 123 und 124 .................................................. 171 5.3.4. Röngenstrukturdaten von (2R,4S)-5-tert-Butyl-1-methyl-2-azido-4-(bis-Bocamino)-2-(hydroxymethyl)pentandioat .......................................................................... 174 6. Anhang .............................................................................................................................. 180 6.1. Literaturverzeichnis..................................................................................................... 180 6.2. Abkürzungsverzeichnis ............................................................................................... 185 Einleitung 1. Einleitung Peptide beeinflussen eine Vielzahl wichtiger physiologischer und biochemischer Lebensfunktionen. Bei Wirbeltieren kennt man ca. 100 Peptide mit Funktionen im zentralen und peripheren Nervensystem, wo sie z.B. als Neurotransmitter und Neuromodulatoren eine bedeutende Rolle spielen. Darüber hinaus sind sie an der Regulation einer Vielzahl biochemischer Prozesse, wie beispielsweise Stoffwechsel, Schmerzgeschehen, Reproduktion und Immunabwehr beteiligt. Historisch betrachtet, ist die chemische Peptidsynthese eine klassische Methode, die sich in den letzten Jahrzehnten entscheidend weiter entwickelt hat, obwohl schon um die Jahrhundertwende des vergangenen Jahrhunderts durch Theodor Curtius und Emil Fischer der Grundstein dafür gelegt wurde. Bei vielen oft nur in kleinen Mengen isolierten Peptiden konnte erst mittels chemischer Synthese der endgültige Strukturbeweis erbracht werden[1] Auch die umfangreichen Studien zur Erforschung der Beziehung zwischen Struktur und biologischer Aktivität am Beispiel einer Vielzahl sequenzvariierter Analoga, die oft nichtproteinogene Bausteine und Strukturelemente enthalten, belegen die Bedeutung der chemischen Peptidsynthese, die nicht zuletzt durch die Realisierung des Merrifieldschen Konzepts der Festphasen-Peptidsynthese den entscheidenden Aufschwung erhalten hat. Die Gewinnung von Polypeptiden und Proteinen durch DNA-Rekombination bedeutete einen weiteren methodischen Fortschritt. Mit der gentechnischen Herstellung von pharmazeutisch relevanten Proteinen lässt sich das Konzept der Therapie endogener Proteinwirkstoffe verifizieren, deren wichtigste Indikationsgebiete Herz-Kreislauf-, Tumor- und Autoimmunerkrankungen sowie Infektionen sind. Mit Sicherheit wird durch diese Entwicklung die klassische Peptidsynthese nicht in Frage gestellt. Kleine Peptide, wie der Peptidsüßstoff Aspartam mit dem Bedarf von 5000 Jahrestonnen, und Peptide mittlerer Kettenlänge, insbesondere mit nichtproteinogenen Aminosäuren oder mit 13 C-markierten Aminosäuren für spezielle NMR-Untersuchungen, werden Objekte der klassischen Synthese bleiben. Für die Lösung vielschichtiger biologischer Zielstellungen nimmt der Bedarf an synthetischen Peptiden ständig zu. Die neuen Aufgabenstellungen erlauben keine isolierte Position einer allein syntheseorientierten Peptidchemie, vielmehr müssen Synthese, Analytik, Isolierung und Strukturaufklärung integrativer Teil einer interdisziplinären Zusammenarbeit sein[2]. Die Natur bringt eine große Vielfalt von bioaktiven Peptiden mit interessanten Strukturen hervor, auf die im Folgenden genauer eingegangen wird. 1 Einleitung 1.1 Conotoxine Conotoxine sind eine Gruppe von Toxinen die aus dem Gift der Kegelschneckengattung Conus isoliert wurden[3, 4]. Dabei handelt es sich um ribosomal synthetisierte Peptide, die aus 15 bis 30 Aminosäuren bestehen und einen hohen Cysteinanteil aufweisen. Diese Cysteine bilden je nach Art des Conotoxins zwei bis vier Disulfidbrücken aus, die dadurch maßgeblich zur Struktur und zur Wirkung dieser Peptide beitragen. Eine Kegelschnecke verfügt je nach Art über eine Vielzahl von Conotoxinen. Diese werden bei der Jagd in ein Beutetier injiziert und blockieren mit hoher Selektivität spannungsabhängige Ionenkanäle, was zur Lähmung der Beute führt[5]. Aufgrund dieser Eigenschaften sind Conotoxine als Analgetika von großem Interesse. Ein Conotoxin, das als Medikament genutzt wird, ist Ziconotid®. Dabei handelt es sich um die synthetische Form von ω-Conotoxin MVIIA, das aus Conus magus isoliert wurde[6]. Dieses aus 25 Aminosäuren bestehende Peptid (Abb. 1) ist ein Nicht-OpioidAnalgetikum das selektiv die spannungsabhängigen Calcium-Ionenkanäle blockiert, die im gesamten zentralen und peripheren Nervensystem zu finden sind und somit die Freisetzung von Neurotransmittern und die Signalweitergabe verhindert[7]. A) B) Abbildung 1: Struktur von ω-Conotoxin MVIIA als Kugelmodell (A) und 3D-Modell (B) des Peptidrückgrats. Die Stabilität von ω-Conotoxin MVIIA beruht auf seiner Struktur, in der zwei Disulfidbrücken das Peptidrückgrat verbinden und einen eingebetteten Ring bilden, der von der dritten Disulfidbrücke durchstoßen wird (Abb. 1B). Dieses Strukturmotiv verleiht den Conotoxinen ihre hohe konformationelle Stabilität im Vergleich zu Peptiden ohne Disulfidbrücken[8]. 2 Einleitung 1.2 Lantibiotika Eine weitere Gruppe bioaktiver schwefelhaltiger Peptide sind Lantibiotika. Das charakteristische Strukturelement dieser Peptide ist die ungewöhnliche Aminosäure Lanthionin (Lan) bzw. β-Methyllanthionin (MeLan)[9]. Dabei handelt es sich formal um Alanin bzw. 2-Aminobutylsäure im Fall von MeLan, die an ihren β-Kohlenstoffatomen über eine Thioetherverbrückung mit einem weiteren Alanin verbunden sind (Abb. 2). O (S) HN NH S (R) O HN O meso-Lanthionin (Lan) (S) (S) NH S (R) O (2S,3S,6R)-3-Methylanthionin (MeLan) Abbildung 2: Struktur von meso-Lanthionin und Methyllanthionin, die charakteristischen Strukturelemente der Lantibiotika. Die Aminosäure Lanthionin wurde 1941 bei der Behandlung von Wolle (latein.: lana = Wolle) mit Natriumcarbonat zum ersten Mal beobachtet.[10] Die Namensgebung der Lantibiotika leitet sich aus der Bezeichnung lanthioninhaltiger antibiotischer Peptide ab[11]. Zur Klasse der Lantibiotika gehören stark posttranslational modifizierte Peptide mit einer Kettenlänge von 19 bis 38 Aminosäuren, wobei der Modifizierungsgrad in Lactocin S[12] mit 24% am geringsten und im Lantibiotikum 10789[13] mit 58 % am stärksten ist. Neben dem charakteristischen Strukturelement Lanthionin, können noch weitere Modifikationen auftreten (Abb. 3). So kann z.B. ein C-terminales Cystein S-Aminovinyl-D-cystein oder S-Aminovinyl-3-Methyl-D-cystein bilden, während ein N-terminales Didehydroalanin oder Didehydrobutyrin zu 2-Oxopropionyl- bzw. 2-Oxobutyrylresten hydrolysiert wird[14]. Aufgrund der zahlreichen posttranslationalen Modifikationen zeigen Lantibiotika eine erhöhte Stabilität gegenüber Proteaseaktivität[15], oxidativen und sauren Bedingungen[16]. Diese Eigenschaft von lanthioninhaltigen Peptiden wird auch eingesetzt um die Stabilität bioaktiver Peptide mit einer Disulfidbrücke durch den Austausch von Cystin gegen Lanthionin zu erhöhen[17-19]. 3 Einleitung O NH S HN HN S HN O meso-Lanthionin (Lan) O O N H 4 O O NH O HO 2-Hydroxypropionyl 2-Oxopropionyl O O H2N H N HO O O 2-Oxobutyryl NH AviMeCys O O H N S HN AviCys (2S,9R)-Lysinoalanin 2,3-Didehydrobutyrin (Dhb) 2,3-Didehydroalanin (Dha) S HN O O H N O (2S,3S,6R)-3-Methylanthionin (MeLan) NH O H N NH O H N O D-Alanin O O N O NH OH HO HO OH Cl erythro-3-HydroxyL-Aspartat allo-Isoleucin Chlortryptophan Monohydroxyprolin Dihydroxyprolin Abbildung 3: Bisher entdeckte Modifikationen in Lantibiotika. 1.2.1 Biologische Aktivität der Lantibiotika Das neuerliche Interesse an Lantiobiotika hat seinen Ursprung im alarmierenden Anstieg der Vancomycinresistenzen in Klinikisolaten[20]. Vancomycin, das Reserveantibiotikum zur Behandlung von Infektionen mit Methicillin-resistenten Staphylococcus aureus (MRSA)Stämmen, hat durch vermehrte Resistenzen in seiner Wirkung und Bedeutung nachgelassen, sodass es von enormer Bedeutung ist, neue Antibiotika zur Behandlung von Infektionen mit multiresistenten Erregern zu finden. Tab. 1 fasst pharmazeutisch interessante Lantibiotika und deren möglichen medizinischen Einsatz zusammen. Das größte Potential der Lantibiotika liegt in der Behandlung von Infektionen mit multiresistenten S. aureus-Stämmen. Lantibiotika wie Mersacidin und Actagardin zeigen eine beachtliche Aktivität gegen multiresistente S. aureus Stämme, einschließlich der MRSAStämme[21]. Bisher wurden Infektionen mit diesen Stämmen vorrangig mit Vancomycin behandelt, was zu einem vermehrten Auftreten von Resistenzen gegen dieses Antibiotikum 4 Einleitung führte. Diese Vancomycin-resistenten Stämme bleiben aber sensitiv gegenüber Mersacidin[22], weshalb auf einen anderen Wirkmechanismus als beim Vancomycin geschlossen werden kann. Tabelle 1: Lantibiotika und ihre potentielle medizinische Verwendung[21]. Lantibiotikum Produzent Inhibitor-Aktivität Potentielle medizinische mit kommerziellem Anwendung Interesse Nisin A Lacticin 3147 Lactococcus lactis Lactococcus lactis Gram-positive und Mundhygiene, Behandlung -negative Bakterien von MRSA- und Entero- inkl. Helicobacter kokkeninfektionen, Mastitis, pylori Behandlung von Enterokolitis Gram-positive Mundhygiene, Behandlung Bakterien von MRSA- und Enterokokkeninfektionen; Mastitis, Akne Mutacin 1140 Streptococcus Streptococcus mutans Vorbeugung vor Zahnkaries mutans Mersacidin/ Bacillus subsp./ Staphylokokken Behandlung von MRSA- und Actagardin Actinoplanes subsp. inklusive Streptokokkeninfektionen methicillinresistenter Stämme Duramycin Streptomyces subsp. Inhibitor der Entzündungen Phospholipase A2 Zystische Fibrose Streptomyces Inhibitor der Entzündungen, cinnamoneus Phospholipase A2, Blutdruckregulation, ACE und des Herpes viraler Infektionen, und Streptoverticillium subsp. Cinnamycin simplex Virus Ancovenin Streptomyces subsp. Inhibitor der ACE 5 Blutdruckregulation Einleitung Durch Untersuchungen am Nisin und an anderen strukturell verwandten Lantibiotika, zu denen auch Mersacidin gehört, konnte Lipid II der bakteriellen Zellwand als target identifiziert werden[23] (Abb. 4). Die Bindung von Nisin an Lipid II führt zu einer Porenbildung in der Zellmembran. Diese Poren haben eine Lebensdauer von wenigen bis zu mehreren hundert Millisekunden und eine Größe von 0,2 bis 2 nm[24]. Die Porenbildung wird durch die H-Brücken-Wechselwirkung des sog. Pyrophosphatkäfigs (Abb. 4A), der aus den beiden N-terminalen Thioetherbrücken des Nisins besteht, mit dem Pyrophosphat von Lipid II eingeleitet. Nun kommt es durch eine Konformationsänderung zur Einlagerung des C-terminalen Bereichs von Nisin in die Lipiddoppelschicht. Durch die Ausbildung eines Komplexes aus acht Nisin- und vier Lipid II-Molekülen wird eine Pore gebildet und die strukturelle Integrität der Zellwand zerstört (Abb. 4B)[25]. A) B) Abbildung 4: A) Wechselwirkung des Pyrophosphatkäfigs des Nisins mit dem Pyrophosphat von Lipid II. B) Einlagerung des Nisins in die Lipiddoppelschicht und Ausbildung der Pore durch einen Komplex aus acht Nisin- und vier Lipid II-Molekülen[25]. Neben der Wirkung auf Lipid II werden noch weitere Aktivitäten von Lantibiotika gefunden, so inhibiert Nisin z.B. die Transglykosylierung und Transpeptidierung bei der Zellwandbiosynthese.[25] Die Lantibiotika Duramycin und Cinnamycin zeigen wiederum einen ganz anderen Wirkmechanismus, da sie als Inhibitor der Phospholipase A2 wirken, indem sie dessen natürliches Substrat Phosphatidylethanolamin binden[26]. 1.2.2 Biosynthese der Lanthionine und Methyllanthionine Für die Einteilung von Peptiden in die Klasse der Lantibiotika ist die Anwesenheit von mindestes einer Lanthionin- bzw. Methyllanthioninverbrückung notwendig[11]. Alle Lantibiotikavorläufer-Peptide (sog. Präpropeptide) enthalten eine C-terminale Strukturregion 6 Einleitung (Propeptid), in der die posttranslationalen Modifikationen auftreten, und eine relativ lange N-terminale Leaderregion, die aus 23 bis 59 Aminosäuren besteht und während der Biosynthese nicht modifiziert wird. Beide Teile des Präpropeptids enthalten die Aminosäuren Serin und Threonin, während die Aminosäure Cystein nur im Propeptid gefunden wird[24]. Durch den Sequenzvergleich einer Vielzahl von Leaderregionen, hat sich gezeigt, dass zwei verschieden konservierte Sequenzmotive auftreten. Zum einen ein FNLD-Motiv zwischen den Positionen -20 und -15 und einem Prolin an der Position -2 vor der Spaltstelle, zum anderen das konservierte Strukturmotiv GG oder GA und mehrere Asparaginsäuren und Glutaminsäuren [27] (Abb. 5). Abbildung 5: Sequenzvergleich der Leaderpeptide von verschiedenen Lantibiotika und die daraus resultierende Einordnung in zwei Gruppen[28]. Die Peptide mit dem FNLD-Motiv benutzen für die Einführung des Lanthionin- bzw. Methyllanthioninmotivs die Enzymklassen LanB und LanC. Die selektive Dehydratisierung von Serin- und Threoninresten im Strukturpeptid der Lantibiotika erfolgt durch die LanBEnzyme. Diese Enzyme zeigen keine Homologie mit anderen bekannten Proteinen, auch die Homologie innerhalb der Gruppe der LanB-Enzyme ist mit ca. 30% sehr gering. Ein möglicher Grund für die geringe Übereinstimmung ist der starke Unterschied zwischen den Präpropeptiden. So zeigen LanB-Enzyme von strukturell sehr ähnlichen Peptiden wie z.B. EriB und SpaB eine Homologie von 83%[29]. Die Aktivität und Wirkung von LanB-Enzymen wurde durch Experimente gezeigt, in denen nach der Inaktivierung von pepC in einem Pep5-produzierenden Stamm nur noch das dehydratisierte Peptid gefunden wurde[30]. Des Weiteren konnten nach der Inaktivierung des Gens eriB im Ericingencluster die Peptide Ericin A und Ericin S nicht produziert werden[29]. Die Aufgabe der Zyklase LanC für die sich anschließende Michael-Typ-artige Lanthioninsynthese liegt in der Kontrolle der Stereo- und Regioselektivität und in der Aktivierung des Thiols 7 [31] . Die Analyse der Enzyme NisC und Einleitung SpaC ergab, dass jedes Enzym eine stöchiometrische Menge an Zink enthält[32]. Die Kristallstruktur des Enzyms NisC zeigt ein Protein mit 14 α-Helices. Sieben dieser Helices bilden die innere Schicht eines α/α-Fasses, in deren Zentrum sich ein Zinkion befindet[33]. Dieses Ion ist tetraedrisch durch zwei Cysteine, ein Histidin und ein Wassermolekül koordiniert (Abb. 6). Zur Katalyse der Zyklisierung im neutralen pH-Bereich muss NisC die Thiolgrupppe des Cysteins zunächst deprotonieren, um die nukleophile Addition an α,β-ungesättigte Aminosäuren durch Aktivierung als Thiolat zu beschleunigen. Bei der Zyklisierung bildet sich ein Enolat-Zwischenprodukt. Bei dessen Protonierung kommt es zur Inversion der Konfiguration am α-Kohlenstoff im Vergleich zur Konfiguration von Serin oder Threonin. Das Cystein behält seine Konfiguration bei und es bildet sich (2S,6R)-Lanthionin oder (2S,3S,6R)-β-Methyllanthionin (Abb. 6)[31, 33]. Abbildung 6: Mechanismus der Thioetherbiosynthese durch das Enzym NisC[33]. Die LanC-Enzyme bestimmen nicht nur Regio- und Stereoselektivität der Lanthioninbildung sondern auch deren N-terminale bzw. C-terminale Orientierung. So erfolgt diese bei Typ-ALantibiotika immer vom N-Terminus zum C-Terminus, während Typ-B-Lantibiotika vom C-Terminus zum N-Terminus zyklisiert werden. LanC-Enzyme sorgen auch dafür, dass die Zyklisierung von Lanthionin in der Natur ähnlich schnell verläuft wie die von 8 Einleitung β-Methyllanthion. In biomimetischen Studien wurden hier Unterschiede um mehrere Größenordnungen ermittelt[34]. Im Folgenden sollen Peptide, die das Doppelglycinmotiv im Leaderpeptid aufweisen, näher betrachtet werden. Diese Peptide benötigen das Enzym LanM zur Synthese der Thioetherbrücke. Der C-Terminus dieses Enzyms weist eine Sequenzhomologie von 20-27% gegenüber LanC auf. Es besitzt aber keine Homologie zu LanB-Enzymen, sodass der Ursprung dieses Enzyms nicht in einer Fusion aus LanB und LanC liegen kann[35]. Die Funktion des LanM-Enzyms LctM als Dehydratase und Zyklase konnte am Lacticin 481 nachgewiesen werden[36], wobei das Enzym LctM ATP und Mg2+ für die posttranslationale Modifikation benötigt. Die exakte Rolle der Cofaktoren im Reaktionsverlauf war anfangs unklar, da das Enzym LctM kein ATP-Bindungsmotiv und kein sog. Walkermotiv, charakteristisch für eine phosphatbindende Schleife, aufweist. Nachfolgende Untersuchungen zeigten, dass das Magnesiumion an die zwei nichtverbrückenden Sauerstoffatome des β- und γ-Phosphats des ATPs koordiniert und dadurch das ATP aktiviert. Dem folgt ein Phosphoryltransfer auf den benachbarten Serin- bzw. Threoninrest und die anschließende Eliminierung des Phosphatrestes, Deprotonierung des α-Kohlenstoffs des Serin- bzw. Threoninrestes und Bildung der Doppelbindung (Abb. 7). Zum gegenwärtigen Zeitpunkt ist noch nicht bekannt, ob die Eliminierung und Deprotonierung des α-Kohlenstoffs konzertiert ablaufen[37]. Der detaillierte Mechanismus der Zyklisierung mit LanM ist ebenfalls noch nicht bekannt. Abbildung 7: Mechanismus der Dehydratisierung eines Serinrestes durch LctM[37]. 9 Einleitung Dha/Dhb R=H/R=CH3 O R H N N H O Dehydratisierung R LanB Ser/Thr Cys R=H/R=CH3 O R O H H N N N H On R OH SH Cys H N n O SH Dehydratisierung/Zyklisierung LanM Zyklisierung LanC O HN S n NH R O Abbildung 8: Möglichkeiten zur Bildung der Thioetherbrücken in Lantibiotika, zum einen mit den Enzymen LanB und LanC, zum anderen direkt mit dem Enzym LanM. Zusammenfassend lässt sich sagen, dass es zwei Wege zur Biosynthese der Lanthioninbrücke gibt: mit den zwei Enzymen LanB und LanC oder mit einem bifunktionalen Enzym, LanM. Der grundlegende Mechanismus der Thioethersynthese unterscheidet sich in beiden Synthesewegen nicht (Abb. 8). Auf welche Art und Weise die Lantibiotika von ihren bakteriellen Produzenten erzeugt werden, hängt von ihrer genetischen Ausstattung ab. 1.2.3 Klassifizierung von Lantibiotika Die gegenwärtig bekannten Lantibiotika variieren in ihrer Struktur, Größe und Wirkungsweise. Allen gemein ist der hohe Grad an posttranslationalen Modifikationen der ca. ein Viertel aller Aminosäuren in den Peptiden betrifft. Eine Klassifizierungsmöglichkeit gründet auf deren Topologie und Wirkmechanismus und unterteilt die Lantibiotika in Klasse A und B [38] . Dabei umfasst Typ A gestreckte, schraubenförmige Peptide, die primär an der Zellmembran wirken. Der Prototyp dieser Peptide ist das in Abb. 9 gezeigte Nisin. Im Allgemeinen bestehen diese Peptide aus 20 bis 34 Aminosäuren und besitzen eine positive Ladung. Der Typ B hingegen umfasst globuläre Lantibiotika, die bei pH 7 keine oder eine negative Ladung tragen und als Inhibitoren von Enzymen wirken. Bedeutende Vertreter dieses Typs sind Cinnamycin (Abb. 10) und Mersacidin. Eine zweite Möglichkeit zur Klassifizierung von Lantibiotika besteht in der Einteilung in drei Klassen, basierend auf ihrem Biosyntheseweg[39] und auf der Präsenz einer antibiotischen Aktivität[14]. Die Klasse-I-Lantibiotika werden durch zwei verschiedene Enzyme modifiziert. Das Enzym LanB, welches die Threonin- und Serinreste dehydratisiert und das Enzym LanC, das die Lathioninringe formt (siehe 1.2.2). Zur Gruppe der Klasse-I-Lantibiotika gehört z.B. Nisin und Subtilin (Abb. 9). 10 Einleitung Nisin A Subtilin Abbildung 9: Struktur von Nisin A und Subtilin, zwei Vertreter der Klasse-I-Lantibiotika. Die Gruppe der Klasse-II-Lantibiotika weist die größte Zahl von Mitgliedern auf und ist strukturell sehr heterogen, doch benötigen alle Peptide dieser Klasse nur das Enzym LanM für die Einführung des Lanthioninmotivs. Im Folgenden werden einige Subgruppen von Klasse-II-Lantibiotika vorgestellt. Lacticin 481 und seine 20 verwandten Lantibiotika[40] bilden solch eine Subgruppe. Sie alle sind hydrophob und weise keine Ladung bei neutralem pH auf. Der N-Terminus dieser Peptide ist linear, während der C-Terminus eine globuläre Struktur bildet, die durch drei überlappende Thioetherbrücken gebildet wird. Diese drei Thioetherbrücken sind essentiell für die volle Aktivität dieser Peptide[41]. Es wird vermutet, dass die antibiotische Aktivität dieser Peptide auf einer Porenbildung in der Zellmembran beruht[40]. Eine weitere Subgruppe beinhaltet Cinnamycin (Abb. 10) und die drei Duramycine A, B und C. Diese Lantibiotika werden von Streptomyzeten gebildet und weisen eine globuläre Struktur mit erstaunlich vielen Zyklen auf, inklusive eines Lysinoalanin-Ringes[14]. Sehr interessant ist die Gruppe der Zwei-Komponenten-Lantibiotika, zu denen beispielsweise Lacticin 3147 und Haloduracin zählen. Jedes Einzelpeptid eines Zwei-KomponentenLantibiotikums zeigt entweder keine oder nur eine schwache antibiotische Aktivität, aber die Interaktion beider Peptide führt zu einer starken synergetischen antibiotischen Aktivität[42]. Für Lacticin 3147 wird ein Nisin-ähnlicher Wirkmechanismus postuliert, in dem Lacticin 3147 A1 an Lipid II bindet und Lacticin 3147 A2 die Pore in der Zellmembran bildet[43]. In dieser Gruppe ähneln alle LanA1 Komponenten, mit Ausnahme von Cytolysin, dem 11 Einleitung Mersacidin und weisen eine eher globuläre Struktur auf, während die LanA2 Komponenten relativ lang und flexibel sind[42]. Cynamycin Cinnamycin Lacticin S Lacticin 481 Abbildung 10: Vertreter der Klasse-II-Lantibiotika. In der Klasse III sind alle lanthioninhaltigen Peptide zusammengefasst, die keine signifikante antibiotische Aktivität besitzen. Diese Gruppe umfasst bisher die Peptide SapB, SapT und Labyrinthopeptin A1 bis A3. Letztere werden im Kapitel 1.3 genauer vorgestellt. Die Peptide dieser Klasse sind 18 bis 21 Aminosäuren lang und weisen eine Funktion als oberflächenaktive Biomoleküle im Lebenszyklus von Streptomyzeten auf[44]. Aus dieser Klasse wurden bisher nur die Strukturen von Labyrinthopeptin A2 Röntgenstrukturanalyse, und von SapT [46] [45] (Abb. 14) mittels (Abb. 11) durch NMR-Spektroskopie, exakt aufgeklärt. SapT Abbildung 11: Struktur von SapT einem Vertreter der Klasse-III-Lantibiotika. 12 Einleitung 1.3 Die Labyrinthopeptine Im Jahre 1988 wurde in der Wüste von Namibia der neuartige Aktinomyzet Actinomadura namibiensis DSM 6313 im Rahmen eines von der Firma Sanofi-Aventis durchgeführten Screeningprogramms nach neuen Antibiotikaproduzenten isoliert. Dieser lachsrosafarbende Stamm formt ein Luftmycel mit spiralförmigen Sporenketten (Abb. 12) [47]. Abbildung 12: Spiralförmige Sporenketten des Luftmycels von Actinomadura namibiensis in licht- und elektronenmikroskopischen Aufnahmen[47]. Aus dem Kulturüberstand von Actinomadura namibiensis wurden drei Peptide mit der vorläufigen Bezeichnung A1, A2 und A3 isoliert. Die Peptide A1 und A2 konnten einer Aminosäureanalytik unterzogen werden (Tab. 2). Tabelle 2: Analytische Daten zu den Peptiden A1-A3[45]. ESI-FTICR-MS ASA Edman-Abbau DTT-Reduktion n.d.= nicht detektiert A1 2073,7624 amu (C92H119N23O25S4) L-Ala(1), L-Thr(1), L-Asx(1), L-Cys(2), L-Phe(1), L-Glx(1), L-Trp(2), L-Gly(1), L-Val(2), L-Pro(1) Xxx-Asn eine Disulfidbrücke A2 1922,6930 amu (C85H110N20O24S4) L-Ala(1), L-Thr(1), L-Asx(1), L-Cys(2), L-Phe(1), L-Glx(1), L-Trp(2), L-Gly(1), L-Leu(2) Xxx-Asp eine Disulfidbrücke A3 2188,7946 amu n.d. Asp-Xxx-Asn n.d. Die dabei erhaltenen Daten zeigten eine beträchtliche Differenz zur Gesamtmasse des jeweiligen Moleküls, die mit den bekannten Modifikationen von Peptiden nicht in Einklang gebracht werden konnte. 13 Einleitung 1.3.1 Struktur von Labyrinthopeptin A2 Die Strukturaufklärung der Peptide A1 bis A3 mittels NMR-Spektroskopie war auf Grund der starken Signalverbreiterung nicht möglich[45]. Erst die Kristallisation und anschließende Röntgenstrukturanalyse des Peptids A2 ermöglichte die Interpretation der analytischen Daten und offenbarte die einzigartige, verknotete Struktur. Aufgrund dessen wurde die Verbindung Labyrinthopeptin A2 genannt (Abb. 13). Abbildung 13: Röntgenstruktur und Kugelmodell von Labyrinthopeptin A2[45]. Labyrinthopeptin A2 (LabA2) hat eine globuläre, vor allem aus hydrophoben Aminosäuren bestehende Struktur. Das Peptid kann formal in zwei Nonapeptide zerlegt werden, von denen jedes ein C-terminales Cystein enthält. Diese Cysteine bilden eine Disulfidbrücke, eine vergleichsweise seltene Modifikation in Lantibiotika, die z.B. in Sublancin 168 vorkommt[48]. Jedes Nonapeptid besteht aus einem zyklischen Tetrapeptid, den A-Ringen, und einem zyklischen Pentapeptid, den B-Ringen, die sich ein quartäres α−Kohlenstoffatom teilen. Die 14 Einleitung A-Ringe von LabA2 werden durch eine Methylenbrücke zwischen den α−Kohlenstoffatomen von Lab1 und Lab4 sowie zwischen Lab10 und Lab13 gebildet (Abb. 13). Eine Verbrückung dieser Art war bisher in Peptiden und Proteinen unbekannt. Die quartäre Aminosäure, die diese Verbrückungen formt, wird Labionin (Abb. 14) genannt[45]. Strukturell verwandte Verbindungen sind α-Aminoisobuttersäure und Isovalin, die in Peptaibol-Antibiotika aus Pilzen enthalten sind[49]. Abbildung 14: Die Aminosäure Labionin. Labionin weist eine 2S,4S,8R-Konfiguration auf, die mit der 2S,6R-Konfiguration von Lanthionin in anderen Lantibiotika übereinstimmt. Die Bildung der elfgliedrigen A-Ringe zwingt das Peptidrückgrat gemäß der Röntgenkristallstruktur in eine Konformation mit cis-Amidbindungen zwischen Asp2-Trp3 und Thr11-Gly12. Die Gegenwart der cis-Amidbindungen und das Fehlen einer Wasserstoffbrücke zwischen Lab1 und Lab4 sowie zwischen Lab10 und Lab13 zeigen, dass sich das Turnmotiv in LabA2 klar von einem β-Turnmotiv unterscheidet[45]. Abbildung 15: cis-Amidbindungen in den A-Ringen von LabA2. 15 Einleitung Die B-Ringe im LabA2 werden durch eine Thioetherbrücke gebildet, die ebenfalls vom Labionin ausgeht. Aufgrund dieser Lanthioninbrücken wird LabA2 als Lantibiotikum klassifiziert. Zusammenfassend lässt sich sagen, dass es sich bei LabA2 um ein stark verbrücktes Peptid, mit einer sehr gespannten Struktur handelt. Das herausragende Merkmal dieses Peptids ist die Aminosäure Labionin (Abb. 14), die im Lab A2 zum ersten Mal beschrieben wurde[45]. 1.3.2 Biosynthese von Labyrinthopeptin A2 Das Biosynthesegencluster von Labyrinthopeptin (Abb. 16) besteht aus fünf Genen einer 6,4 kb großen DNA-Sequenz. Das Strukturgen labA2 von Labyrinthopeptin A2 kodiert 38 Aminosäuren, in denen ein 20 Aminosäuren langes Leaderpeptid enthalten ist. Abbildung 16: Das Biosynthesegencluster der Labyrinthopeptine[45]. Direkt stromaufwärts von labA2 kodiert das Gen labA1/A3 für das Strukturgen der Labyrinthopeptine A1 und A3, auf die später noch genauer eingegangen wird. Nun folgen die Gene labT1 und labT2, die die ATP-abhängigen ABC-Transporter kodieren, welche vermutlich eine Exportfunktion für die Labyrinthopeptine haben[45]. Das Gen labKC kodiert das bifunktionale Enzym LabKC, das aus zwei Domänen besteht. Einer konservierten N-terminalen Domäne mit Merkmalen einer eukaryotischen Serin/Threonin-Kinase, sowie einer C-terminalen Domäne mit geringer Sequenzhomologie zur LanC-Zyklase. Für eine erwartete Funktion als LanC-Zyklase fehlen LabKC jedoch wichtige Reste des aktiven Zentrums, z.B. das Zinkbindemotiv der Nisin-Zyklase. Weiterhin zeigt die Aminosäuresequenz von LabKC eine sehr große Homologie zum SapB-modifizierenden Enzym RamC und zu Sequenzen von Genclustern vieler weiterer, bereits vollständig sequenzierter Actinomyzeten-Stämme[50]. Untersuchungen zur Biosynthese von LabA2 zeigten, dass es sich beim Enzym LabKC um eine Kinase-Zyklase handelt, die in einem zweistufigen Mechanismus arbeitet. Der erste Schritt ist die Phosphorylierung der Serine unter Verwendung von GTP als Cosubstrat[50], anstelle von ATP, wie es zuvor bei der in vitro-Biosynthese von anderen Lantibiotika beschrieben wurde[36]. Anschließend folgt die Dehydratisierung des phosphorylierten Serin 16 Einleitung und es entstehen formal zwei α,β-Didehydroalanine. Im zweiten Schritt erfolgt die doppelte Michael-Addition, die mit dem nucleophilen Angriff eines C-terminalen Cysteins beginnt und intermediär ein Lanthionin entstehen lässt (Abb. 17). Bei dieser Reaktion wird ein Carbanion am α-Kohlenstoff des vormaligen α,β-Didehydroalanins stabilisiert. Dieses Anion greift nun als Kohlenstoffnucleophil das N-terminale α,β-Didehydroalanine an und schließt somit den Carbazyklus. Ähnliche Funktionen wie die von LabKC werden auch bei den Enzymen zur Biosynthese weiteren Lantibiotika mit verwandten Biosynthesegenclustern wie z.B. Streptomyces coelicolor, Streptomyces avermitilis, Streptomyces griseus und Saccharopolyspora erythrea vermutet[50]. Abbildung 17: Modell zur Labyrinthopeptin A2 Biosynthese, die mit der Phosphorylierung und Dehydratisierung der Serine beginnt, gefolgt von der Zyklisierung der Ringe, der Abspaltung des Leaderpeptids und der Bildung der Disulfidbrücke[50]. 17 Einleitung 1.3.3 Weitere Labionin-haltige Peptide Wie bereits im Kapitel 1.3 angesprochen, wurden im Kulturextrakt von Actinomadura namibiensis außer LabA2 noch zwei weitere Peptide, LabA1 und LabA3, identifiziert. Bei längeren Fermentationszeiten konnte man beobachten, dass sich LabA3 in LabA1 umwandelt. Abbildung 18: Aminosäuresequenz der Präpropeptide von LabA2 und LabA1/A3, identische Aminosäuren im Leaderpeptid sind blau und im Propeptid grau dargestellt[45]. Das in Kapitel 1.3.2 angesprochene Biosynthesegencluster enthält neben dem Strukturgen labA2, das für Labyrinthopeptin A2 kodiert, noch das Strukturgen labA1/3. Der Vergleich der Konsensussequenzen dieser Strukturgene zeigt eine große Homologie des Präpropeptides von LabA1/A3 zum Präpropeptid von LabA2 (Abb. 18). Der Sachverhalt, dass LabA2 und LabA1/A3 in ungefähr gleichen Mengen bei der Fermentation gebildet werden, spricht für eine gemeinsame Transkription von labA2 und labA1/A3 desselben Genclusters und deutet auf ähnliche Prozessierungseffizienzen der Präpropeptide durch LabKC und proteolytische Enzyme hin. Durch die Kombination der genetischen Informationen, der Strukturdaten von Lab A2, der massenspektroskopischen Analytik und der Aminosäurenanalytik (Tab. 2) wurden die Strukturen von LabA1 und LabA3 bisher nur abgeleitet (Abb. 19). Die Grundstruktur von LabA1 ist mit der von LabA2 identisch, wobei der B´-Ring zu einem Heptapeptid erweitert wurde und das darin enthaltene Threonin (Abb. 18) zu einem α,β-Didehydrobutyrin umgewandelt wurde. LabA3 ist mit LabA1 identisch trägt aber zusätzlich am N-Terminus noch einen Asparaginsäurerest[45] (Abb. 19). Abbildung 19: Kugelmodell mit der abgeleiteten Struktur von LabA1 und LabA3[45]. 18 Einleitung Die Anordnung der Gene und die Leadersequenz der Strukturgene labA1/A3 und labA2 zeigen signifikante Homologien zu Biosynthesegenclustern aus anderen Aktinomyzeten (Abb. 20)[45]. Abbildung 20: Biosynthesegencluster von verschiedenen Aktinomyzeten, Homologie zum Biosynthesegencluster der Labyrinthopeptine zeigen[45]. die eine Das trifft besonders auf das ram-Gencluster des Modellorganismus Streptomyces coelicolor zu. Der Sequenzvergleich mit Genen der Serin/Threonin-Kinase (ramC), des Strukturgens (ramS) und der ABC-Transporter (ramA, ramB) unterstreichen die evolutionäre Beziehung beider Gencluster. Das Biosynthesprodukt des ram-Genclusters ist das Lantibiotikum SapB[51]. Die Kenntnisse der Struktur von SapB sind zum aktuellen Zeitpunkt jedoch nicht vollständig. Auch die Beteiligung von RamC an der Biosynthese wird bisher nur aufgrund der LanC-Domäne vermutet[51]. Ein Vergleich der Konsensussequenz zeigt, dass das SXXS(X)3-5C-Motiv sowohl in den Labyrinthopeptinen als auch im SapB vorhanden ist (Abb. 20). Dieser Sachverhalt und die starke Homologie zwischen den Biosynthesegenclustern der Labyrinthopeptine und SapB lassen eine weite hypothetische Struktur von SapB (Abb. 21) zu[28]. Der Unterschied des publizierten Strukturvorschlags nach J. Willey et al. liegt darin, dass die zwei Didehydroalaninreste in zwei Labionine eingebunden 19 Einleitung sind. Die bisher publizierten Daten stimmen für beide Modelle überein, da die beiden Strukturen bezüglich der Molekülmasse isobar sind[28]. Das Vorhandensein lab-homologer Gencluster (Abb. 20) in Streptomyces avermitilis, Streptomyces griseus und dem Erythromycin-Produzenten Saccharopolyspora erythrea mit bislang unbekannten Biosyntheseprodukten lässt auf das Vorhandensein der ungewöhnlichen Aminosäure Labionin in weiteren Peptiden schließen[45]. xxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxx Struktur nach Willey et al. Hypothetische Struktur nach Süßmuth et al. Abbildung 21: Vergleich der publizierten Struktur mit einer alternativen labioninhaltigen Struktur[28] von SapB, beide Strukturen sind im Einklang mit den bisher publizierten Daten[51]. 1.3.4 Biologische Aktivität der Labyrinthopeptine Untersuchungen zur biologischen Aktivität erbrachten eine moderate antivirale Aktivität von Labyrinthopeptin A2. Beide Peptide verfügen über keine signifikante antibiotische Aktivität, weshalb sie den Klasse-III-Lantibiotika zugeordnet werden. In weiterführenden Profilierungsexperimenten wurde Labyrinthopeptin A2 in vivo in einem murinen Nervenverletzungsmodell[52] gegen neurophatische Schmerzen getestet. Neurophatische Schmerzen sind eine Dysfunktion des zentralen oder peripheren Nervensystems, die sich beispielsweise in einer Schmerzüberempfindlichkeit (Allodynie) äußert. In Deutschland leiden ca. sechs Prozent der Bevölkerung an neurophatischen Schmerzen, das entspricht knapp fünf Millionen Menschen. Nach einer Operation leiden ca. 20 % der Patienten an chronischen neurophatischen Schmerzen. Auch sog. Phantomschmerzen, an denen 60 % aller Patienten nach einer Amputation leiden, gehören zu den neurophatischen Schmerzen. Weitere 20 Einleitung Ursachen sind beispielsweise Schlaganfall, Multiple Sklerose, Rückenmarksverletzungen, Stoffwechselkrankheiten wie Diabetes mellitus, virale Infektionen wie Gürtelrose, Alkoholmissbrauch oder Chemotherapie. In dem erwähnten Nervenverletzungsmodell werden Mäusen zwei von drei Nervenästen des Hüftnervs (Nervus ischiadicus) durchtrennt und so neurophatische Schmerzen erzeugt. Nun wird für die Dauer von maximal 20 Sekunden oder bis zum Zeitpunkt, an dem die Maus ihre Hinterpfote wegzieht ein steigender Druck auf die Hinterpfote der Maus ausgeübt. Mit diesem Modell kann die Allodynie der Maus in Abhängigkeit vom verabreichten Medikament untersucht werden[45, 52]. Die intravenöse Gabe von Labyrinthopeptin A2 (0,01–3,0 mg/kg) führte zu einer signifikanten Verminderung taktiler Allodynie mit einem ED50-Wert von 50 µg/kg. Die Effizienz erreichte 100 % und war über einen Zeitraum von sechs Stunden stabil. Erst 24 Stunden nach der Verabreichung war der anti-allodynische Effekt verschwunden, wie bei der etablierten Vergleichssubstanz Gabapentin (Abb. 22). Abbildung 22: Neurophatisches Schmerzmodell in der Maus. 7 Tage nach der chirurgischen Nervenverletzung (SNI) wurde die taktile Allodynie gemessen. Nach intravenöser Gabe von Labyrinthopeptin A2, Gabapentin (GP) oder einer Pufferkontrolle wurde die taktile Allodynie als Paw Withdrawal Threshold (PWT) über sechs Stunden und nach 24 Stunden an der beschädigten Pfote gemessen. Die gestrichelten Linien zeigen die Messergebnisse für die intakte Pfote[45]. 21 Einleitung 1.4 Totalsynthesen von Lantibiotika 1.4.1 Totalsynthese von Nisin Die erste Synthese eines Lantibiotikums wurde im Jahre 1988 von der Arbeitsgruppe Shiba aus Osaka/Japan publiziert[53]. Hierbei handelt es sich um die Totalsynthese von Nisin, dem zu diesem Zeitpunkt am besten untersuchten Lantibiotikum. Die Totalsynthese erfolgte durch die Kondensation der in Abb. 23 gekennzeichneten Fragmente in Lösung und unter Verwendung von säure- und hydrogenolyselabilen Schutzgruppen. A B C D E Abbildung 23: Prinzip der Fragmentkondensation zur Totalsynthese von Nisin[53]. Alle Fragmente bis auf das C-terminale Fragment enthalten mindestens einen Ring, der durch eine Thioetherbrücke gebildet wird. Dieser Thioether wurde durch Desulfurierung aus Disulfidbrücken gebildet. Dazu wurde für jeden Ring ein lineares Vorläuferpeptid synthetisiert. Die Positionen des zu bildenden Lanthionins wurden jeweils durch Cysteine ersetzt, im Fall von β-Methyllanthionin wurden β-Methyl-D-Cystein und Cystein verwendet. Anschließend wurde eine Disulfidbrücke generiert und diese nun durch Desulfurierung in eine Lanthioninbrücke umgewandelt[54] (Abb. 24). 22 Einleitung Abbildung 24: Prinzip der Synthese des B-Ringfragments von Nisin. 1.4.2 Totalsynthese von Bis(desmethyl)-Lacticin 3147 A2 und Lactocin S Da sich durch die Desulfurierung von Cystin[55] Lanthionin synthetisieren lässt, aber die Stereoselektivität dieser Reaktion nicht immer gewährleistet ist[56], wurden andere Methoden für die Lanthioninsynthese entwickelt. Hierzu zählen z.B. die Ringöffnung von Serinlactonen[57] und Aziridinen[58] und die nukleophile Substitution von Brom-[59] und Iodalaninen[60] mit geschützten Cysteinderivaten. Im Jahr 2005 folgte die Synthese eines C-Ring-Analogons von Nisin an der festen Phase[61]. Aufbauend auf diese Experimente entwickelte die Arbeitsgruppe Vederas eine Methode zur Lantibiotikasynthese an der festen Phase. Im Jahr 2008 wurde die Synthese von Bis(desmethyl)-Lacticin 3147 A2 mit dieser Methode veröffentlicht[62]. Dabei wurde erst ein vollgeschütztes Lanthionin ausgehend von Fmoc-Cys-OtBu und Alloc-BrAla-OAllyl synthetisiert und anschließend auf 2-Chlor-Tritylharz geladen. Nun folgte die SPPS und Zyklisierung des ersten Ringes an der festen Phase. Für die folgenden Ringe wurde der gleiche Ablauf wiederholt und schließlich nach Abspaltung vom Harz ein N-terminales didehydroaminosäurenreiches Peptidfragment gekuppelt (Abb. 25). Ein Jahr später wurde ebenfalls von der Arbeitsgruppe Vederas die Totalsynthese des Naturstoffs Lactocin S analog zur Synthese von Bis(desmethyl)-Lacticin 3147 A2 veröffentlicht[63]. Da es sich bei Bis(desmethyl)-Lacticin 3147 A2 um ein Derivat von Lacticin 3147 A2 handelt, bei dem die β-Methyllanthionine durch Lanthionin ersetzt wurden, um die Synthese zu vereinfachen, wurden bis zum gegenwärtigen Zeitpunkt nur zwei in der Natur auftretende Lantibiotika synthetisiert: Nisin im Jahr 1988 und Lactocin S im Jahr 2009. 23 Einleitung Abbildung 25: Schema der Bis(desmethyl)-Lacticin 3147 A2-Synthese an fester Phase[63]. 1.5 Mechanistische Details wichtiger Schlüsselreaktionen α-Aminosäuren gehören zu den bedeutendsten Bausteinen von Naturstoffen und besitzen zudem in der industriellen Produktion von z.B. Arzneistoffen und Tierfuttermitteln große Bedeutung. Doch auch im Labormaßstab besteht ein Bedarf an enantiomerenreinen Aminosäuren, z.B. zur Synthese von Naturstoffen oder deren Derivaten. Die technische Produktion von Aminosäuren erfolgt einerseits durch die Extraktion von Proteinhydrolysaten, die durch Fermentation mit Hilfe von Mikroorganismen erzeugt werden. Aus diesen Hydrolysaten können dann die einzelnen Aminosäuren durch Extraktion, fraktionelle Kristallisation und Ionenaustauschchromatographie isoliert werden. Eine weitere biotechnologische Produktionsmethode ist die so genannte Fermentationsmethode. In diesem Fall werden spezielle Mikroorganismen verwendet, bei denen durch die Verwendung günstiger Nährmedien und Kulturbedingungen bestimmte Aminosäuren angereichert werden. Ein Beispiel hierfür ist die Produktion von Glutaminsäure durch Brevibacterium flavum aus Rübenmelasse. Diese Methode ist aber auf einige Aminosäuren beschränkt und liefert jene auch nur in begrenzten Konzentrationen. Durch die Verwendung von gentechnisch veränderten Mikroorganismen lässt sich diese Beschränkung jedoch überwinden, da hier durch die Ausschaltung von Rückkopplungsmechanismen, die die Bildung von Aminosäuren regulieren, neue Hochproduzenten für bestimmte Aminosäuren erzeugt werden[64]. Doch lässt sich nicht jede beliebige Aminosäure durch biotechnologische Verfahren herstellen. Zur großtechnischen chemischen Synthese werden klassische Methoden wie z.B. die Strecker-Synthese[65] verwendet, bei der die Aminosäuren razemisch synthetisiert werden. 24 Einleitung Durch die Überführung des Razemats in diastereomere Ester, N-Acylverbindungen oder Salze und anschließender Kristallisation oder Umsetzung mit Acylasen können die D- und L-Aminosäuren voneinander getrennt werden[66, 67]. Für die Synthese von Aminosäuren im Labormaßstab werden aber andere Methoden benutzt, bei der die gewünschte Aminosäure stereoselektiv erzeugt wird. Als Beispiel soll hier die Aminosäuresynthese nach Schöllkopf über einen Bislactimether[68]genannte werden, welche sich der chiralen Induktion durch sterische Wechselwirkungen mit dem chiralen Auxilliar, bedient. Dieser Effekt, aber über eine andere chirale Hilfsgruppe, wird auch bei der Aminosäuresynthese nach Evans benutzt[69]. 1.5.1 Stereoselektive Alkylierung von Glycin Die in der vorliegenden Arbeit benutzt Methode zur stereoselektiven Alkylierung von Glycin wurde 1978 in der Arbeitgruppe Yamada[70] entwickelt. OH O OH LDA 5 H2N COOtBu N 1 OH COOtBu 2 3 OH R RX N H3O+ CO2tBu 6 4 Abbildung 26: Stereoselektive Hydroxypinanon[70]. OtBu R H2N CO2tBu OLi N Alkylierung unter Verwendung von (1S,2S,5S)- Hierzu wird das C-terminal geschützte Glycin 1 mit (1S,2S,5S)-2-Hydroxypinanon 5 in eine Schiffsche Base 2 überführt. Diese chirale Verbindung wird nun mit LDA deprotoniert (3) und stereoselektiv 4 alkyliert. Anschließend wird durch saure Hydrolyse die gewünschte Aminosäure 6 freigesetzt. Wurden jedoch zur Alkylierung Verbindungen (R-X) eingesetzt, die funktionelle Gruppen im Rest enthielten, wie z.B. Carbonsäuren, Carbonsäureester, Carbonylverbindungen oder Amide, wird eine Verminderung der Stereoselektivität festgestellt. Untersuchungen zu diesem Sachverhalt zeigten zudem einen starken Einfluss des verwendeten Metallsalzes bei der Reaktion[71]. Bei der Reaktion der Schiffschen Base 3 mit LDA können die monomeren Metallkomplexe 7, 8 oder 9 gebildet werden[71] (Abb. 27). 25 Einleitung H N H N OR O Li(S)3 Li(S)2 O O O Li (S)2 Li(S)3 7 H N OR OR O Li (S)2 O (S)2 Li 9 8 R Br Abbildung 27: Monomere Lithiumkomplexe als Intermediate der Alkylierung nach Schwarz et al.[71] (S= engl. solvent, Lösungsmittel). Doch zeigen die bei der Chelatisierung durch die Sauerstoffanionen und über das Elektronenpaar des Stickstoffs gebildeten Komplexe 7 und 8 keine Strukturen, die auf den stereoselektiven Verlauf der Reaktion einen Einfluss haben können. Ein weiterer Komplex kann durch die Koordination des Bromatoms des Elektrophils an das elektropositive Lithiumkation 9 gebildet werden. Der daraus resultierende Übergangszustand würde aber zu einem anderen Strereoisomer führen als das bei der Reaktion gebildete Stereoisomer. Das führte zum Postulat eines dimeren Metallkomplexes 10 (Abb. 28)[71], da ähnliche Metallkomplexe in anderen Arbeiten NMR-spektroskopisch und kristallographisch nachgewiesen wurden[72]. Die Bildung von Tetrameren oder Hexameren erscheint ebenfalls möglich. Die Hypothese für die postulierte dimere Struktur 10 wird durch die Verwendung von THF als Lösungsmittel gestützt, da THF mit seinen koordinierenden Elektronenpaaren das Metall absättigt und so die Bildung polymerer Strukturen unterdrückt. Heteroatome wie hier das Stickstoffatom der Schiffschen Base 2 dienen ebenfalls als Elektronendonor für das Metall und sättigen so das Metall zusätzlich ab. Der postulierte dimere Komplexe 10, der mit einem Sandwichkomplex vergleichbar ist, kann an der Unter- und Oberseite alkyliert werden, doch wird aufgrund der im Molekül herrschenden Punktsymmetrie stereoselektiv ein Produkt gebildet. Alkylierung R O H N Li O Li O O Li 10 O O R Li N H Alkylierung Abbildung 28: Postulierter dimerer Komplex 10 als Intermediat der stereoselektiven Alkylierung[71]. 26 Einleitung Die Selektivität der Reaktion wird durch tiefe Temperaturen erhöht, was auf eine Verringerung der intermolekularen Austauschrate zwischen den Metallkomplexen zurückzuführen ist. Durch die Zugabe von Magnesiumsalzen wird die Selektivität der Reaktion erhöht[71]. Das ist auf die Fähigkeit der Magnesiumionen zurückzuführen, stärker zu koordinieren und somit den dimeren Komplex zu stabilisieren. Bis jetzt konnte der LithiumMagnesium-Austausch aber noch nicht nachgewiesen werden. So könnte die Stabilisierung des Komplexes auch über eine zusätzliche Koordination des Magnesiums zustande kommen. Wie bereits erwähnt, vermindern Elektrophile, die ein Sauerstoff- oder Stickstoffatom besitzen die Selektivität der Reaktion. Das ist auf eine zusätzliche Koordination des Alkylierungsreagenzes an das Lithiumionen zurückzuführen, die die Ausbildung eines dimeren Komplexes behindert. Auch in diesem Fall führt die Zugabe von Magnesiumsalzen zu einer Erhöhung der Selektivität [71]. Darüber hinaus hat die Natur der eingesetzten Schiffschen Base einen Einfluss auf die Selektivität und auf die Reaktivität. So wird durch raumerfüllende C-terminale Schutzgruppen die Stereoselektivität erhöht bzw. erst ermöglicht, da bei der Verwendung von Methylestern zur Synthese von α-monosubstituierten Aminosäuren ein razemisches Gemisch entsteht[73]. Bei der Verwendung von Alanin als Ausgangsverbindung zur Synthese von α,α-disubstituierten Aminosäuren wurde der gleiche Einfluss in Abhängigkeit vom verwendeten Ester beobachtet. Doch führte hier der Einsatz des Methylesters zu 69 % de. Sperrige Esterreste erhöhen in diesem Fall die Selektivität, jedoch auf Kosten der Ausbeute, die stark zurückgeht[74]. So beträgt die Ausbeute bei einem tBu-Ester nur noch 7 %[73]. Es zeigt sich jedoch, dass α-Aminosäuremethylester mit sperrigen Seitenketten, wie beispielsweise Valin sowohl mit guten Ausbeuten (69 %) als auch mit hoher Selektivität ( 98 % de) mit Methylbromid alkyliert werden können[73]. 1.5.2 Synthese von α,α-disubstituierten Aminosäuren aus zyklischen Sulfiten α,α-disubstituierten Aminosäuren sind wichtige Bausteine in synthetischen Peptiden, da deren in vivo-Stabilität im Vergleich zu α-monosubstituierten Aminosäuren erhöht ist und deren erhöhte konformative Stabilität, aufgrund der eingeschränkten Rotation zu einer Erhöhung der biologischen Aktivität führt[75]. Aufgrund dieser Eigenschaften sind sie bedeutende Substrate in der biologischen Chemie und der Medizinalchemie. Die Synthese solcher Aminosäuren in enantiomerenreiner Form ist ein herausforderndes Ziel[76]. In den meisten Fällen werden hier Aminosäuren[73] oder Aminosäurederivate[77, 78] alkyliert und so direkt der gewünschte Alkylrest eingeführt. In der Literatur sind jedoch auch wenige 27 Einleitung Methoden beschrieben, bei denen eine Aminogruppe am α-Kohlenstoffatom erst am Ende der Synthese eingeführt wird. Das kann über eine Umlagerung[79] oder über die Reaktion mit Elektrophilen[80] erfolgen. Die α-Aminogruppe kann aber auch ausgehend von einem Alkohol synthetisiert werden. Dies kann durch eine Mitsunobu-Reaktion mit einer quartären α-Hydroxysäure[76] erfolgen, bei der aber die explosive Stickstoffwasserstoffsäure verwendet werden muss oder durch Verwendung zyklischer Sulfate und Sulfite[81-83]. Als Ausgangsverbindung für eine solche Synthese dient eine α,β-ungesättigte Carbonsäure, deren Doppelbindung mit der asymmetrischen Dihydroxylierung nach Sharpless[84] funktionalisiert wird. Das resultierende Diol wird nun mit Thionylchlorid in ein zyklisches Sulfid umgewandelt, das mit einem Azid unter Inversion der Konfiguration geöffnet wird[81] (Abb. 29). HO CO2Me SOCl2 CO2Me O S HO 11 O NaN3 CO2Me Pd/C; H2 HO CO2Me HO NH2 N3 O 15 14 12 NaIO4 RuCl3 Pd/C; H2 CO2Me NaN 3 O CO2Me CO2Me H2SO4 HO NaO3SO N3 N3 O S O O 13b 17 16 Abbildung 29: Synthese von α,α-disubstituierten Aminosäuren aus zyklischen Sulfiten und Sulfaten[81]. Die Oxidation des Sulfits 12 zum Sulfat (13b) führt zu einer geringfügigen Verbesserung der Regioselektivät zugunsten eines Angriffs am α-Kohlenstoffatom, eine Ringöffnung am β-Kohlenstoffatom kann nur als Nebenprodukt in geringen Mengen beobachtet werden. Mechanistische Untersuchungen bei denen die Carbonylfunktionalitäten variiert wurden (Abb. 30), zeigten einen starken Einfluss von Estern bzw. Säureamiden auf die Regioselektivität. So wurde bei der Verwendung der Säureamide 13a und 13c die Regioselektivität umgekehrt und der Ring am β-Kohlenstoffatom durch das Azid geöffnet[85]. O O O S O O 13a OMe N Me Abbildung 30: Variation Reaktionsmechanismus[85]. O O OMe O O S O O 13b der O N O S O O 13c Carbonylfunktionalitäten 28 zur Untersuchung des Einleitung Da die Ester 13b und 13c eine ähnliche Elektronenverteilung aufweisen, zeigte sich, dass die Elektronenverteilung im Gegensatz zur Ringöffnung von Epoxiden[86] hier keinen Einfluss auf die Regioselektivität hat[85]. Berechnungen der relativen Energie der Übergangszustände (Abb. 31) zeigen ein Minimum für 13a im Übergangszustand 13_af und für 13b im Übergangszustand[85]. Abbildung 31: Berechnete Übergangszustände mit Bindungslängen für den Angriff des Azids am Cβ (f) und Cα (h) an 13a und 13b jeweils syn (s) und anti (a) relativ zur α-Methylgruppe [85]. Diese Übergangszustände führen zu der im Experiment beobachteten Regioselektivität. Die Bevorzugung des Angriffs am α-Kohlenstoffatom in 13b ist auf einen Lösungsmitteleffekt zurückzuführen, der zu kleinen Unterschieden im Ladungstransfer in den verschiedenen Übergangszuständen führt. 1.5.3. Synthese von α,α–disubstituierten Aminosäuren durch chelatverbrückte ClaisenUmlagerung Der Isoleucin Antagonist Cyclopentylglycin 18[87] und das antibiotische Furanomycin 19[88] (Abb. 32) sind natürlich vorkommende γ,δ-ungesättigte Aminosäuren mit interessanten Bioaktivitäten. Aber nicht nur das macht γ,δ-ungesättigte Aminosäuren zu einem Ziel der Synthesechemie, sie stellen auch interessante funktionalisierten Aminosäuren dar[89]. 29 Zwischenstufen zur Synthese von Einleitung O H2N CO2H H2N CO2H 18 19 Abbildung 32: Die natürlich vorkommenden γ,δ-ungesättigten Aminosäuren Cyclopentylglycin 18 und Furanomycin 19. Die erste Synthese einer α-Allylaminosäure durch eine Claisen-Umlagerung wurde 1975 von Steglich beschrieben[90]. Bei dieser Synthese wird ein N-Benzoyl-Aminosäureallylester 20 mit einem dehydratisierenden Reagenz zu einem Allyloxazolinon 21 umgesetzt. Dieses Allyloxazolinon 21 reagiert über eine Claisen-Umlagerung zu einem Oxazolon 22, das anschließend mit Natriumhydroxid geöffnet wird und nun die α-Allylaminosäure 23[90] liefert (Abb. 33). Aufgrund der starren Geometrie im Oxazolonring und des sesselförmigen Übergangszustandes wird die disubstituierte α-Allylaminosäure mit einer hohen Diastereoselektivität gebildet. Leider ist diese Methode zur Synthese von α-Allylaminosäuren auf aromatische und heteroaromatische N-Acyl-Aminosäuren beschränkt, da die überwiegend verwendeten Carbamatschutzgruppen keine Zyklisierung zum Oxazol erlauben. Einen weiteren Zugang zu α-Allylaminosäure bietet die Ireland-Claisen-Umlagerung[91] von geschützten Glycinallylestern (Abb. 33), die intensiv von Bartlett et al. untersucht wurde[92]. R2 O O Oxazol-Umlagerung O R1 N R2 Ph 21 O R1 N 22 Ph COCl2 Pyridin O Ph NaOH 1 R N H O R2 R1 HN R2 O 20 LDA Ph O 23 OH O MeOH OLi R1 Ph Li R2 O N O Ireland-Claisen Umlagerung R2 R1 O N OH 25 24 Ph OSiMe3 Abbildung 33: Synthese von γ,δ-ungesättigten Aminosäuren durch Oxazol- und IrelandClaisen Umlagerung (R1, R2= Alkylrest). 30 Einleitung Diese Methode toleriert eine Vielzahl an Schutzgruppen und kann zur Synthese von α-monound α,α-disubstituierten Aminosäuren verwendet werden. Die Diastereoselektivität der Reaktion ist sehr stark abhängig von Parametern wie der verwendeten Base, dem Lösungsmittel, der N-terminalen Schutzgruppe und dem Substitutionsmuster des Allylesterrestes. Daher ist diese Methode nicht als allgemeine Methode zur Synthese von γ,δ-ungesättigten Aminosäuren geeignet[93]. Aus diesem Grund wurde die Claisen-Umlagerung von N-terminal geschützten Glycinallylestern in der Arbeitsgruppe Kazmaier weiterentwickelt[94]. Hierzu wurden Glycinesterenolate chelatisiert, da diese Chelate gegenüber den nichtchelatisierten Aminosäuren wesentlich stabiler sind und Nebenreaktionen wie Eliminierungen unterdrückt werden können. Die chelatisierten Enolate besitzen eine relativ starre Geometrie und zeigen dadurch bei der Umlagerung einen hohen Grad an Diastereoselektivität[95]. Für die Chelatisierung kann eine Vielzahl von Metallsalzen verwendet werden, so z.B. ZnCl2, MgCl2, EtAlCl2, SnCl2 und CoCl2, wobei die besten Resultate in der Regel bei der Verwendung von ZnCl2 erzielt wurden. Die Metallchelate zeichnen sich gegenüber den Silylketenacetalen 25 durch eine höhere Reaktivität und Selektivität aus. Die treibende Kraft der Reaktion ist die Bildung des hochenergetischen Esterenolats 27, der dann zum stabilen Carboxylat 28 umlagert (Abb. 34). LDA O CbzHN ZnCl2 O O CbzN Zn 27 26 28 O O NZ O O Zn O CO2H CbzHN O NZ H Zn O O O Wannenkonformation 27 Sesselkonformation 27 Abbildung 35: Chelatverbrückte Claisen-Umlagerung von N-terminal geschützten Glycinallylesterderivaten und der Übergangszustand in der Sessel- und Wannenkonformation mit THF an den weiteren Koordinationsstellen des Metallkations. 31 Einleitung Diese chelatverbrückte Umlagerung liefert eine hohe Diastereoselektivität unabhängig von der verwendet Schutzgruppe und des Substitutionsmusters am Allylester[96]. So können auch zyklische Allylester in der Reaktion verwendet werden[97]. Auch sterisch anspruchsvollere Substrate können für die Umlagerung verwendet werden, so ist die Synthese von quartären β-Kohlenstoffzentren aus Glycinderivaten [93] sowie die Synthese von α,α-disubstituierten Aminosäuren aus α-alkylierten Aminosäureallylestern möglich[98]. Es ist mit dieser Reaktion sogar möglich, quartäre Kohlenstoffzentren in der α- und β-Position zu generieren[99]. Die Reaktion ist nicht auf aliphatische und aromatische Aminosäurereste beschränkt, auch Tryptophan, Lysin und Methionin lassen sich in der Reaktion verwenden[93]. Die Einschränkungen dieser Reaktion, die im Rahmen der vorliegenden Arbeit ermittelt wurden, werden im Kapitel 3.1.2. diskutiert. 32 Aufgabenstellung 2. Aufgabenstellung Der Naturstoff Labyrinthopeptin A2 (Abb. 13) stellt durch seine einzigartige Struktur ein interessantes Ziel der Synthese dar, da in diesem Peptid eine bisher unbekannte Modifikation auftritt, die Triaminotrisäure Labionin (Abb. 14), deren Existenz auch in weiteren Peptiden vermutet wird (Kapitel 1.3.3.). Aus diesem Grund ist die Synthese von Labionin und dem ersten bekannten labioninhaltigen Peptid Labyrinthopeptin A2 von großem akademischem Interesse. Labionin verleiht dem Labyrinthopeptin A2 eine starre Struktur, die wiederum eine interessante biologische Aktivität zeigt (Kapitel 1.3.4). Will man nun die Aktivität dieser Verbindung verstehen und sie gegebenenfalls verbessern, ist deren Synthese unumgänglich. Denn nur durch die Totalsynthese ist ein Zugang zu einer großen Anzahl von Labyrinthopeptin-Derivaten möglich, von denen bereits jetzt absehbar ist, dass es keinen biochemischen Zugang geben wird. Dazu ist zunächst die Synthese der Aminosäure Labionin notwendig, da sie das zentrale Strukturelement im Labyrinthopeptin A2 darstellt. Bis zum gegenwärtigen Zeitpunkt ist keine Synthese einer derart komplexen Aminosäure in der Literatur beschrieben, da Labionin eine Vielzahl von Aminosäuremodifikationen in sich vereinigt. So etwa ein quartäres α-Kohlenstoffatom, ein Lanthioninmotiv, drei Amino- und drei Carboxygruppen, die für die nachfolgende Labyrinthopeptin-Synthese mit den geeigneten, orthogonal abspaltbaren Schutzgruppen versehen sein müssen. Nach der Synthese des quartären Aminosäurebausteins soll die Aufbau des A´-Ringes erfolgen. Die A-Ringe bestehen aus 11 Atomen und beinhalten drei Peptidbindungen von denen jeweils eine als cis-Amidbindung in der Kristallstruktur vorliegt, was auf den gespannten Charakter der Ringe hinweist. In der Literatur sind bisher nur zwei Synthesen von derartigen zyklischen Peptiden beschrieben, jedoch ist in diesen Zyklen keine α,α-disubstituierte Aminosäure enthalten[100, 101] . Anschließend soll die Synthese des B´-Ringes erfolgen. Dann soll das A´B´-Fragment mit dem AB-Fragment gekuppelt werden. Das AB-Fragment sollte von Dipl. Chem. Georg Sambeth als Bestandteil seiner Dissertation synthetisiert werden, und so nach Ausbildung einer Disulfidbrücke (C-Ring) die Totalsynthese von Labyrinthopeptin A2 vollendet werden (Abb. 35). Des Weiteren sollten entweder aus dem synthetischen Labionin oder über eine separate Syntheseroute eine Referenzsubstanz zum Nachweis der Aminosäure Labionin in anderen Peptiden erzeugt werden und ausgehend vom Naturstoff Labyrinthopeptin A1 und A2 Derivate zur weitergehenden Testierung auf biologische Aktivität generiert werden. 33 Aufgabenstellung Abbildung 35: Retrosyntheseplan für den Aufbau von Labyrinthopeptin A2; die Synthese des A´B´-Fragments war das Ziel dieser Dissertation. 34 Ergebnisse und Diskussion 3. Ergebnisse und Diskussion 3.1 Synthese von 2,4-Diamino-2-hydroxymethylglutarsäure Die Schlüsselverbindung zur Totalsynthese von Labyrinthopeptin A2 ist die Aminosäure Labionin (Abb. 36), da sie die A- und B-Ringe ausbildet und somit die zentrale Struktureinheit im Labyrinthopeptin bildet. Auf Grund von retrosynthetischen Betrachtungen wurde das Labionin in zwei Segmente zerlegt: Ein Diaminoglutarsäure-Derivat 29, das ein quartäres α-Kohlenstoffatom trägt, und ein Cystein (Abb. 36). Die Verknüpfung des Diaminoglutarsäure-Derivats mit dem Cystein soll zu einem späteren Zeitpunkt über eine nukleophile Substitution erfolgen. Zu diesem Zweck wurde das Diaminoglutarsäure-Derivat 29 mit einer Alkoholfunktion am β-Kohlenstoff versehen, da sich diese funktionelle Gruppe in eine gute Abgangsgruppe überführen lässt und im Gegensatz zu einem Thioalkohol eine hohe Stabilität und Toleranz aufweist. OR O OR O OR O S NHR NHR RO OR NHR O OH NHR NHR 29 O HS NHR + RO O Abbildung 36: Retrosynthetische Zerlegung des Labionins in ein Diaminoglutarsäure-Derivat und Cystein. Die Synthese des Diaminoglutarsäure-Derivats 29 erwies sich als äußerst schwierig. In den folgenden Kapiteln werden die verschiedenen Synthesewege zur Synthese von 29 vorgestellt. In Anlehnung an in der Literatur beschriebene Synthesen für quartäre Aminosäuren[77, 98, 102] wurden nun die ersten Versuche zur Synthese von 29 durchgeführt, bei denen erst das quartäre Kohlenstoffzentrum aufgebaut wurde und dann die Synthese der Amino- und der Carboxygruppe in der Seitenkette erfolgen sollte. 35 Ergebnisse und Diskussion 3.1.1. Synthese von 2,4-Diamino-2-hydroxymethylglutarsäure über ein Oxazolidin Die Synthese von α,α-disubstituierten Aminosäuren ausgehend von Oxazolidinen ist in der Literatur bereits beschrieben[77, 102] . In der im Folgenden vorgestellten Synthese wurde ein Ansatz gewählt der von Alezra et al.[102] entwickelt wurde. Hierzu wird aus R-Phenylglycinol über vier Stufen ein Oxazolidin synthetisiert, das nun stereoselektiv mit Allyliodid zur Verbindung 30 alkyliert werden kann[102]. Er folgte die Funktionalisierung der Doppelbindung durch asymmetrische Dihydroxylierung, selektive Schützung der endständigen Hydroxygruppe mit TBDMSCl, die Einführung einer Azidfunktion über eine Mitsunobu-Reaktion und anschließend die Entschützung des Alkohols (Abb. 37). sdjflkjsdfjasfjaskfjkasfjkasjs O O O N KHMDS; THF AllylBr; THF -78°C; 3h O O O O N AD-Mixβ tBuOH; H2O RT; 16h O 91% 97% 30 O O O N OH OH TBDMSCl Imidazol; DMF RT; 16h O 70% O O O N 31 O O O N OTBDMS PPh3 ; DEAD DPPA; THF OH -20°C; 20h O 65% 32 OTBDMS N3 O TBAF; THF 0°C; 4h O O O N OH N3 O 71% 34 33 Abbildung 37: Funktionalisierung der Doppelbindung am Oxazolidin-Derivat 30 zur Synthese von Labionin. 36 Ergebnisse und Diskussion Im Folgenden wurden zeitgleich Versuche zur Oxidation des Alkohols 34 zur entsprechenden Säure und Versuche zur Öffnung des Oxazolidins durchgeführt. Für die Oxidation des Alkohols 34 zur Carbonsäure wurden Testversuche im LC-MS-Maßstab durchgeführt, die jedoch keine Quantifizierung erlaubte. Hierbei wurden die Swern-Oxidation[103], bei der aber keine Produktbildung beobachtet werden konnte, und die TEMPO-Oxidation[104] untersucht. Unter den Reaktionsbedingungen der TEMPO-Oxidation konnte die korrespondierende Carbonsäure von 34 erzeugt werden. Eine Optimierung und Quantifizierung der Oxidationsreaktion wurde nicht durchgeführt, da die Öffnung des Oxazolidinringes sich als äußerst schwierig erwies. Die Ringöffnung von Oxazolidinen ist im Allgemeinen unter sauren Bedingungen möglich[102, 105, 106], jedoch verlief die Öffnung von 32 unter diesen Bedingungen in schlechten Ausbeuten (48%)(Abb. 38). Aus diesem Grund wurde das Oxazolidin 33 mit Propandithiol und BF3*Et2O versetzt (Abb. 38). Unter diesen Bedingungen wurden Ringöffnungen von ähnlichen Substraten beschrieben[107], doch auch nach einer Reaktionszeit von 24 h unter Rückfluss wurde keine Reaktion beobachtet. Nun wurde mit 32 eine Hydrogenolyse durchgeführt, um den benzylischen Rest am Amin zu entfernen. Die Reaktion mit Pd/C und Wasserstoff fand bei Normaldruck nicht statt, ein wiederholter Versuch unter einem Druck von 50 bar lieferte dann das gewünschte Reaktionsprodukt 37 in einer Ausbeute von 80%. Die Öffnung des Oxazolidinringes in 37 unter sauren Bedingungen und mit Propandithiol schlug jedoch fehl (Abb. 38). Da sich die Methylenverbrückung zwischen dem Stickstoff und dem Sauerstoffatom im Oxazolidin nicht einfach entfernen ließ, musste es in einen Rest umgewandelt werden, der sich anschließend unter milden Bedingungen aus dem offenkettigen Molekül entfernen lässt. Eine Möglichkeit bildet im Fall von Oxazolidinen die Ringöffnung mit Benzylmagnesiumbromid[108]. Die Reaktion von 33 mit Benzylmagnesiumbromid (Abb. 38) führte zwar zum gewünschten Produkt 39, doch war eine Ausbeute von nur 26%, bei der kein Edukt mehr zurück gewonnen werden konnte nicht hinnehmbar, da noch eine Vielzahl weiterer Reaktionsschritte zur Darstellung der quartäre Aminosäure 29 folgen sollten und diese auch in ausreichenden Mengen für die folgende Peptidsynthese zur Verfügung stehen musste. 37 Ergebnisse und Diskussion O O HCO2H;THF RT; 7h OH N O O OTBDMS O HO HN O OTBDMS OH O 48% 32 35 Pd/C; THF; H2 50 bar; 16h 80% O O NH OTBDMS OH O O OTBDMS X O A) Propandithiol BF3*Et2O; DCM 75°C; 16h B)HCl/Dioxan MeOH; 75°C; 2h OH HO 37 NH2 38 Propandithiol BF3*Et2O; DCM 75°C; 16h O O O N OTBDMS N3 O BnMgBr Et2O; 0°C; 2h 26% X 33 O O HO HN OTBDMS O O HO N OTBDMS N3 O N3 O Ph 36 39 Abbildung 38: Ringöffnungsversuche an verschieden Oxazolidinen. Aus diesem Grund wurde die Synthesestrategie überarbeitet und die Öffnung des Oxazolidins erfolgte nun an 30, also direkt nach der Alkylierung des Oxazolidins (Abb. 39). Nach Schützung der freien Hydroxygruppe konnte nun die Doppelbindung funktionalisiert werden. Das geschah wieder über eine Sharpless Asymmetrische Dihydroxylierung und Schützung des 38 Ergebnisse und Diskussion primären Alkohols (Abb. 39). Alle diese Reaktionsschritte konnten in moderaten bis guten Ausbeuten durchgeführt werden. Doch bei der anschließenden Einführung einer Azidfunktion mit Hilfe der Mitsunobu-Reaktion konnte das gewünschte Produkt 44 nicht erhalten werden. Ein möglicher Grund ist der sterische Anspruch, der bei der Mitsunobu-Reaktion verwendeten Reagenzien, insbesondere DPPA und PPh3 und zudem eine Reihe sterisch anspruchsvoller Schutzgruppen in Verbindung 43 die die Reaktion verhindern. Da auch dieser Ansatz zur Labionin-Synthese fehlschlug, wurde die Synthese ausgehend von einem Oxazolidin verworfen. O O O N O O PhMgBr Et2O; 0°C 2h 60% Ph N O O MOMCl; DIPEA nBu4NI; DCM MOMO RT; 3d Ph 67% O O OH MOMO 72% N Ph OH N TBDMSCl Imidazol; DMF RT; 16h 73% O X O O Ph N O 41 O O OTBDMS MOMO OH N O Ph 42 DEAD; DPPA PPh3; THF -20°C; 20h O 40 30 AD-Mixβ tBuOH;H2O 2d O HO 43 OTBDMS MOMO N3 O 44 Abbildung 39: Oxazolidinöffnung mittels Grignard-Reaktion Funktionalisierung der Doppelbindung zur Synthese von Labionin. 39 und nachfolgende Ergebnisse und Diskussion 3.1.2. Synthese von 2,4-Diamino-2-hydroxymethylglutarsäure durch eine chelatverbrückte Claisen-Umlagerung Wie bereits im Kapital 1.5.3 ausführlich beschrieben wurde, ist es möglich, aus α−monoalkylierten Aminosäuren durch eine chelatverbrückte Claisen-Umlagerung α,αdisubstituierte Aminosäuren zu synthetisieren[93, 98, 99]. Mit Hilfe dieser Umlagerung sollte es möglich sein, die quartäre Aminosäure 29 aus Serin zu synthetisieren. So könnte theoretisch der vollgeschütze Serinallylester 46 zu geschütztem α-Allyl-Serin 45 umgelagert werden und anschließend die Synthese des Aminosäureseitenkette aus der Doppelbindung erfolgen (Abb. 40). CO2R5 R4HN R3O R3O OR2 R1HN 29 R3O OR2 R1HN O 45 O R1HN O O 46 Abbildung 40: Retrosyntheseschema zur Synthese der quartären Aminosäure 29 durch eine chelatverbrückte Claisen-Umlagerung aus einem Serinallylester (R1-6 repräsentieren entsprechende Schutzgruppen). Zunähst erfolgte die Synthese von Boc-Ser-OAll aus kommerziell verfügbarem Boc-Ser-OH. Bei der folgenden Umlagerung (Abb. 41) konnte aber keine Produktbildung beobachtet werden, lediglich das Edukt konnte vollständig zurückgewonnen werden. Des Weiteren erfolgte eine Testreaktion mit selbst hergestelltem Cbz-Phe-OAll, um die Reaktionsbedingungen zu überprüfen, da eine Umlagerung mit diesem Aminosäureester in der Literatur beschrieben wurde[98]. LDA ZnCl2; THF X X O RHN X OH RHN O N-terminale Schutzgruppe R Seitenkettensubstituent X O Boc OBn Z OTHP Z OIPDMS Z OH Z OTrt Boc SBn Abbildung 41: Übersicht über die zu Umlagerungsversuchen verwendeten Aminosäurederivate. 40 Ergebnisse und Diskussion Da das Umlagerungsprodukt mit der in der Literatur beschriebenen Ausbeute gebildet wurde, konnten fehlerhafte Reaktionsbedingungen beim der Umlagerung ausgeschlossen werden. Die weitere Variation der Schutzgruppen am N-Terminus und in der Seitenkette (Abb. 41) brachte keinen Erfolg. Die hier verwendeten Aminosäuren tragen im Gegensatz, zu den in der Literatur verwendeten Aminosäuren[98] ein Heteroatom am β-Kohlenstoff. Daher könnte eine Fehlkoordination im Übergangszustand, die durch dieses Heteroatom hervorgerufen wird, die mögliche Ursache für die Unterdrückung der Umlagerung sein. 3.1.3. Synthese von 2,4-Diamino-2-hydroxymethylglutarsäure aus Pyrazolderivaten Ein weiterer Syntheseansatz beruht auf der Spaltung der Stickstoff-Stickstoff-Bindung in einem Pyrazolderivat[109-111], die sich leicht über eine [2+3]-dipolare Zykloaddition aus geeigneten Edukten darstellen lassen. Das Pyrazolderivat 51 wurde in einer Ausbeute von 63% synthetisiert (Abb. 42)[112]. Die Synthese des Pyrazols zeichnet sich durch die geringe Anzahl von Syntheseschritten und die günstigen Ausgangsverbindungen aus. CO2tBu ClH*H2N 47 (HCHO)n; DABCO H3PO4; THF; H2O 60°C; 16h 57% CO2Et 48 H2SO4; NaNO2 Et2O; H2O RT; 1min 69% CO2Et N2 HO 49 CO2tBu 50 EtO2C N H 51 Raney-Ni; H2 MeOH; HCO2H EtO2C OH RT; 16h H2N H2N CO2tBu Cbz-Cl; RT NaHCO3 EtO2C OH H2O; 2d CbzHN H2N CO2tBu EtO2C OtBu Raney-Ni H2; MeOH 16h; RT X N N Boc CO2tBu 53 CO2tBu 162 52 Boc2O; DMAP TEA; DCM RT; 16h 51% OH X N DABCO RT; 16h 63% EtO2C OtBu H2N BocHN CO2tBu 54 Abbildung 42: Pyrazolsynthese und Versuche zur anschließenden reduktiven Spaltung der Stickstoff-Stickstoffbindung zur Synthese der quartären Aminosäure 29. 41 Ergebnisse und Diskussion Jedoch führte die Zykloaddition zu einem razemischen Gemisch von 51. Die anschließende Spaltung der Stickstoff-Stickstoff-Bindung von 51 verlief quantitativ. Bei dem Versuch, das Rohprodukt mit einer Schutzgruppe zu versehen (Abb. 42), konnte keine Produktbildung beobachtet werden. Ein möglicher Grund kann die Bildung eines Lactams, als Konkurrenzreaktion, unter den basischen Reaktionsbedingungen sein[113]. Auch eine erfolgreiche Einführung einer Schutzgruppe an 52 hätte im besten Fall zu einer bevorzugten Schützung des N-Terminus an der γ-Position geführt. Aus diesen Gründen wurde nun 51 mit einer Boc-Schutzgruppe versehen (Abb. 42). Der elektronenziehende Charakter der Schutzgruppe oder die dadurch hervorgerufen sterische Hinderung führten dazu, dass nun keine Spaltung der Stickstoff-Stickstoff-Bindung zu 54 mehr möglich war (Abb. 42). 3.1.4 Synthese von 2,4-Diamino-2-hydroxymethylglutarsäure aus γ-Methylenglutaminsäure In den bisher verwendeten Synthesestrategien erfolgte die Synthese des quartären α-Kohlenstoffatom immer zu Beginn der Synthese. Nun wurde ein anderer Ansatz verfolgt, bei dem das quartäre Zentrum am Ende der Synthese aus der Doppelbindung einer γ-Methylenglutaminsäure erfolgen sollte. Die Synthese der γ-Methylenglutaminsäure erfolgte durch die stereoselektive Alkylierung[114] eines Glycinesters, deren Mechanismus im Kapitel 1.5.1. ausführlich beschrieben wurde. Als Ausgangssubstanzen für die Alkylierung dienten 2-Brommethylacrylsäuremethylester 57 (Abb. 43) und die Schiffschen Base 62 (Abb. 44). Der Brommethylacrylsäuremethylester 57 wurde über zwei Stufen aus Acrylsäuremethylester, Formaldehyd und Bromwasserstoff synthetisiert. Zwar beträgt die Ausbeute über beide Stufen nur 23%, doch die Ausgangsmaterialien sind extrem günstig und der Aufwand ist sehr gering. CH2O; NEt3 H2O; 60°C; 16h CO2Me OH 36% CO2tBu 68% CO2Me 56 55 ClH3N 48%ige HBr; DCM konz. H2SO4; RT; 16h Cbz-Cl ges. NaHCO3-Lösung RT; 16h CbzHN CO2tBu 91% Br CO2Me 57 Pd/C; H2 EtOAc; RT; 16h H2N CO2tBu 90% 58 59 60 Abbildung 43: Synthese der Ausgangssubstanzen für die Darstellung des γ-Methylenglutaminsäureesters 63. 42 Ergebnisse und Diskussion Die Schiffsche Base wurde aus (1R,2R,5R)-2-Hydroxypinanon und Glycin-tert-butylester 60 hergestellt, wobei H-Gly-OtBu 60 als freies Amin vorliegen muss. Eine Synthese aus dem kommerziell verfügbaren Salzsäureaddukt von Glycin-tert-butylester 58 unter Zusatz einer Base führt zu keiner Reaktion. Auch eine einfache Entsalzung durch Lösen des Salzsäureaddukts von Glycin-tert-butylester 58 in ges. NaHCO3-Lösung und anschließende Extraktion mit EtOAc ist nicht ausreichend. Zur Generierung des freien Amins 60 musste eine Hydrogenolyse von Cbz-Gly-OtBu 59 erfolgen. Erst nach diesem Umweg ist die Bildung der Schiffschen Base 62 in quantitativer Ausbeute möglich, während bei der Verwendung der anderen Entsalzungverfahren kein Produkt gebildet wurde. BF3*Et2O Benzol; 60 95°C; 16h; 99% O OH MeMgBr; 57 LDA; THF -85°C; 5h; 82% N HO CO2Me CO2tBu N HO 63 62 61 CO2tBu HO 1.15% Zitronensäure THF; RT; 2d; 72% 2. Boc2O; DCM RT;16h; 91% CO2Me BocHN AD-Mixβ tBuOH:H2O; 0°C; 3d; 94% OH CO2Me BocHN CO2tBu 65 a) SOCl2; CCl4 80°C; 16h; 62% b) SOCl2; NEt3; DCM 0°C; 1h; 82% O SO O CO2Me BocHN CO2tBu 66 HO HO NaN3; DMF 50°C; 3d; 40% CO2tBu N3 CO2Me + BocHN CO2tBu 69a 68 N3 O tBuO2C N Boc 69b Abbildung 44: Unerwünschte Lactambildung bei der Synthese der quartären Aminosäure aus einer mono-Boc-geschützten γ-Methylenglutaminsäure. Durch die Alkylierung von 62 mit 57 konnte der γ-Methylenglutaminsäureester 63 mit einem Enantiomerenüberschuss von 84 % (GC) synthetisiert werden. Nun folgten die Hydrolyse der Schiffschen Base, die Boc-Schützung der Aminogruppe und die asymmetrische Dihydroxylierung der Doppelbindung. Das Diol 66 wurde nun durch die Reaktion mit Thionylchlorid aktiviert. Anfangs wurde diese Reaktion in Tetrachlormethan bei 80 °C über einen Zeitraum von 16 h durchgeführt (Abb. 44; Reaktionsbedingungen a). Unter diesen Bedingungen war die Reaktion nur schwer reproduzierbar, da die Ausbeuten zwischen 0 % und 62 % schwankten. Aus diesem Grund wurden die Reaktionsbedingungen geändert. Indem etwas wasserfreies Triethylamin zugesetzt und die Reaktion in DCM bei 0 °C durchgeführt wurde (Abb. 44; Reaktionsbedingungen b), konnte die Reaktionszeit auf 1 h verkürzt werden 43 Ergebnisse und Diskussion und die Ausbeute und die Reproduzierbarkeit deutlich verbessert werden. Das zyklische Sulfit 68 wurde nun mit Natriumazid nukleophil geöffnet; dabei trat eine erwünschte Nebenreaktion auf und es bildete sich das Lactam 69b. Das gewünschte Produkt 69a konnte nur in Spuren identifiziert werden. Jedoch konnten an 69b weitere wichtige Strukturuntersuchungen durchgeführt werden. Zum einen wurde die Regioselektivität der Ringöffnung mit dem Azid untersucht, da diese am endständigen Kohlenstoffatom oder am quartären Kohlenstoffatom erfolgen können. Mit Hilfe eines 1H-1H-COSY-NMR-Spektrums konnte die in Abb. 45 gezeigte Konstitution bestätigt werden. 1 Abbildung 45: NMR-Spektrum H-1H-COSY- von 69b in DMSO-d6. Das charakteristische Signal für den Konstitutionsnachweis von 69b ist die Korrelation des 1 H-Signals der exozyklischen CH2-Gruppe bei 3,5 ppm mit dem 1 H-Signal der Hydroxyfunktion bei 5,5 ppm. Da es sich bei dem Lactam 69b um einen kristallinen Feststoff handelt, konnte eine Röntgenstruktur von 69b erhalten werden und damit die Konstitution und Konfiguration von 69b bestätigt werden (Abb. 46). Abbildung 46: Röntgenstruktur von 69b. 44 Ergebnisse und Diskussion Die Bildung des unerwünschten Regioisomers konnte bei dieser Reaktion nicht beobachtet werden. In analoger Weise wurde die in Abb. 44 gezeigte Syntheseroute auch mit einer Fmoc-Schutzgruppe (Verbindung 144 bis 147; siehe experimenteller Teil) durchgeführt. Damit sollten die Verbindungen eine UV-Aktivität erhalten um eine schnelle Analyse aller Reaktionsprodukte mit Hilfe einer chiralen HPLC durchzuführen und die Reaktion damit besser kontrollieren zu können. Doch zersetzte sich das Fmoc-Derivat (147) von 68 bei der Ringöffnung mit Natriumazid. Um die Lactambildung zu unterdrücken musste der sterische Anspruch an der Aminogruppe von 68 erhöht werden. Zu diesem Zweck wurde eine zweite Boc-Schützung am CarbamatStickstoff von 65 durchgeführt. Wie Abb. 47 zu entnehmen ist, konnte nun die Zyklisierung unterdrückt werden und die quartäre Aminosäure in geschützter Form mit einer Ausbeute von 12,8 % über 10 Stufen erfolgreich synthetisiert werden. Die Auswertung des 1H-1H-COSYSpektrums von 73 in DMSO-d6 zeigt die Korrelation des 1H-Signals der CH2-Gruppe in β-Position von 73 mit dem 1H-Signal der Hydroxyfunktion, was auf das korrekte Regioisomer hinweist. Eine Röntgenstruktur von 73 konnte nicht erhalten werden, da es sich bei 73 um ein Öl handelt, das nicht in einen Feststoff überführt werden konnte. Mit Verbindung 73 konnten nun weitergehende Untersuchungen zur Zyklisierung der A-Ringe und zur Bildung der Thioetherbrücke durchgeführt werden. HO CO2Me BocHN Boc2O; DMAP CH3CN; 79% RT; 16h CO2Me Boc2N CO2tBu AD-Mixβ tBuOH:H2O 0°C; 2d; 99% CO2tBu Boc2N 70 65 O SO O CO2Me SOCl2; NEt3 DCM; 94% 0°C; 1h Boc2N OH CO2Me CO2tBu 71 HO NaN3; DMF 50°C; 3d; 40% CO2tBu N3 CO2Me Boc2N CO2tBu 73 72 Abbildung 47: Synthese der Aminosäure 73 über eine γ-Methylenglutaminsäure unter Verwendung von zwei Boc-Schutzgruppen. 45 Ergebnisse und Diskussion 3.2 Studien zur Synthese von Labionin Nach der erfolgreichen Synthese von 73 konnte nun die Anknüpfung der Thioetherbrücke zum Labionin begonnen werden. Der Thioether sollte durch die Reaktion von geschütztem Cystein mit einem aktivierten [59, 60] Lanthioninsynthesen Derivat von 73 in Anlehnung an publizierte erfolgen (Abb. 48). CO2All NHFmoc N3 CO2Me N3 CO2Me N3 CO2Me Boc2N HO X S Boc2N CO2tBu Boc2N CO2tBu CO2tBu 73 Abbildung 48: Retrosyntheseplan (X =Abgangsgruppe). zur Synthese von geschütztem Labionin Die Hydrogruppe von 73 sollte zunächst unter Verwendung der Appel-Reaktion in ein Iodatom transformiert werden (Abb. 49), da Beispiele für Appel-Reaktionen in Gegenwart von Azidfunktionen publiziert wurden[115, 116]. Doch kam es bei der Verwendung von 73 zu einer Zersetzungsreaktion, sodass weder das Produkt 80 noch das Edukt 73 nach der Reaktion isoliert werden konnten (Abb. 49). Zur direkten Umwandlung der Hydroxygruppe in ein Bromatom wurden Reaktionen Phosphortribromid [117, mit 118] und mit Dibromtriphenylphosphan[119] durchgeführt, bei denen das gewünschte Produkt 79 nicht detektiert werden konnte (Abb. 49). Aus diesem Grund wurde der Alkohol 73 in den Methansulfonsäureester 76 umgewandelt, der wiederum in die Verbindung 80 und 79 umgewandelt werden sollte[120, 121]. In beiden Fällen konnte lediglich das Edukt 73 vollständig zurückgewonnen werden. Ausgehend von 76 wurden nun Versuche unternommen, den Essigsäurethioester 77 durch Substitution oder durch Verwendung eines Schwefeltransferreagenzes[122] zu synthetisieren. Doch auch diese Versuche schlugen fehl. Die Synthese des Trifluormethansulfonsäureesters 78, mit dem eine Reaktion mit Cystein zur Labionin-Synthese möglich gewesen wäre[123], misslang, da sich 73 unter den verwendeten Reaktionsbedingungen zersetzte (Abb. 49). In der Literatur findet sich nur ein Beispiel für die Synthese eines α-Methyllanthionins[124]. Auch beim Labionin handelt es sich um ein α-Alkyllanthioninderivat[124]. Nach dieser Vorschrift wird α-Methyllanthionin aus einem geschützten α−Methylserin und einem Cystein synthetisiert, wobei sich die Umwandlung der 46 Ergebnisse und Diskussion HO AcS 77 CO2tBu Boc2N CO2tBu 76 R CO2Me CO2tBu Boc2N Tf2O Pyridin Boc2N CO2tBu 73 R= N3 149 R= NHCbz O S O O N3 CO2Me Boc2N CO2tBu 78 A. PBr2Ph3; DCM B. PBr3; Pyridin; DCM Br N3 CO2Me N3 CO2Me 79 F3C I Br Boc2N PPh3; Iod; Imidazol DCM CO2tBu 75 R= N3 162 R= NHCbz HO X NaI; Aceton 55°C O Boc2N LiOH; THF 99% X X X KBr; DMF; 85°C Boc2N CO2tBu 74 R= N3 81 R= NHCbz X A. AcSH; DBU; RT; B. AcSH; NaHCO ; 50°C X C. (BnNEt3)2MoS43; MeCN; Ac2O O S O O Ms-Cl; TEA N3 CO2Me 88% O R X Boc2N PPh3; DEAD THF R CO2H N3 CO2Me CO2tBu 80 N3 CO2Me Boc2N 79 CO2tBu Abbildung 49: Transformationsversuche der Hydroxygruppe von 73 in eine gute Abgangsgruppe für darauf folgende nukleophile Substitutionen. Hydroxyfunktion in eine geeignete Abgangsgruppe als äußerst schwierig erwies. Das α−Methylserin zeigte das gleiche Reaktionsverhalten wie 73; so war auch am α−Methylserin eine Appel-Reaktion nicht möglich. Man konnte das α-Methylserin auch in einen Methansulfonsäureester umwandeln, eine weiterführende Reaktion war nicht möglich[124]. Deshalb wurde dieses α−Methylserin in ein α−Methylserin-β-lacton umgewandelt und durch eine Ringöffnung mit Cystein und Kaliumcarbonat als Base erfolgreich α-Methyllanthionin synthetisiert[124]. Basierend auf diesen Erkenntnissen sollte nun die Säure 73 über eine Mitsunobu-Reaktion in das β-Lacton 75 umgewandelt werden, doch die Lactonisierung konnte nicht erfolgreich durchgeführt werden. In einem weiteren Versuch wurde die Reaktion mit einem Cbz-2-Amino-Derivat (81) von 74 durchgeführt, doch auch hier konnte das Lacton nicht synthetisiert werden. Der in Abb. 50 gezeigte Ansatz stellt eine effiziente Methode zur Synthese von Labionin da, der durch die Verwendung anderer Lactonsynthesen[125] weiter verfolgt werden sollte. Weitere Möglichkeiten zur Labioninsynthese ergeben sich durch die nukleophile Öffnung von Aziridinen[124, 126] und zyklischen Sulfamidaten[126] mit geschütztem Cystein. 47 Ergebnisse und Diskussion CO2All NHFmoc S O N3 O Boc2N Fmoc-Cys-OAll K2CO3; DMF; RT CO2tBu N3 CO2H Boc2N CO2tBu 75 Abbildung 50: Hypothetische Labioninsynthese durch Öffnung des β-Lactons 75. 3.3 Synthese des A´-Rings von Labyrinthopeptin A2 Die Synthese der Ringe im Labyrinthopeptin A2 (Abb. 13) stellt nach der Synthese des quartären Aminosäurebausteins 73 eine große Herausforderung bei der Totalsynthese von Labyrinthopeptin A2 dar. Die Synthese des A´-Rings soll hier vor der Synthese des B´-Rings erfolgen. Da es sich beim A´-Ring um ein gespanntes Ringsystem handelt, soll dessen Synthese aus dem offenkettigen Peptid erfolgen. Der A´-Ring wird durch eine Methylenbrücke zwischen den α-Kohlenstoffatomen der Aminosäurepositionen Lab10 und Lab13 gebildet, die das Dipeptid Thr-Gly umschließen (Abb. 51). Der dadurch gebildete Ring besteht aus 11 Atomen und besitzt im Kristall eine cis-Amidbindung zwischen den Aminosäuren Thr und Gly, was ein Indiz auf eine starke Ringspannung im A´-Ring ist. Der konformative Einfluss carbazyklischer Ringe in Peptiden wurde ausführlich in der Arbeitsgruppe Verdine untersucht[127-129], dabei überspannt eine acht Kohlenstoffatome zählende Brücke ein Penta- bzw. Heptapeptid. Aus diesen Carbozyklen resultieren stabile α-Helices. Doch im Vergleich zum A´-Ring (Abb. 51), der aus 11 Atomen besteht, weisen die von Verdine untersuchten zyklischen Peptide, die aus 21 bzw. 27 Atomen bestehen, eine deutlich geringere Ringspannung auf. Kleinere carbozyklische Peptide wurden in der Arbeitsgruppe von Vederas bei der Synthese eines Analogons des Lantibiotikums Lacticin 3147 A2 dargestellt[130]. Dabei handelt es sich um Tetra- bzw. Pentapeptide, die von einer Brücke aus vier Kohlenstoffatomen überspannt werden. Die resultierenden Ringe bestehen aus 14 bzw. 17 Atomen und sind damit größer als die A-Ringe im Labyrinthopeptin. Außerdem bestehen die Brücken im Lacticin 3147 A2 Analogon aus vier Kohlenstoffatomen[130], während die carbozyklischen Brücken im Labyrinthopeptin nur aus einem Kohlenstoffatom bestehen, was zu einer deutlich geringeren Spannung in den Ringen führt. 48 Ergebnisse und Diskussion Abbildung 51: Der A´- und B´-Ring im Kugelmodell von Labyrinthopeptin A2. In der Literatur sind lediglich zwei Beispiele für die Synthese von Peptiden dieser Ringgröße beschrieben[100, 101] , bei denen jedoch keine α,α-disubstituierte Aminosäure im Peptid enthalten ist. Aus diesem Grund wurde die Zyklisierung erst an einem Modellsystem erprobt, um mögliche Probleme bei der Zyklisierung zu erkennen und ggf. die Notwendigkeit einer vorgeformten cis-Amidbindung zwischen den Aminosäuren Thr und Gly bei der Zyklisierung zu untersuchen. In diesem Modellsystem wurde das Labionin durch eine geschützte Glutaminsäure ersetzt, da die Ringgröße des Modellpeptids mit der des A´-Ringes identisch ist und sie kommerziell verfügbar ist. Die cis-Amidbindung im Dipeptid Thr-Gly wurde durch die Verwendung eines Trimethoxybenzylrest (Tmb) am N-Terminus von Glycin vorgeformt. Die Verwendung von solchen benzylischen Gruppen zur Formung von cis-Amidbindungen ist in der Literatur ausführlich beschrieben[131-135]. Eine vorgeformte cis-Amidbindung bringt den N- und C-Terminus des linearen Peptides in räumliche Nähe und erleichtert dadurch die Zyklisierung des Peptids[136]. Darüber hinaus wird gegebenenfalls die Bildung von unerwünschten Oligomeren des Peptides unterdrückt[136]. Die Verwendung von N-alkylierten Aminosäuren ist besonders dann sinnvoll, wenn in der Aminosäurensequenz des Peptids nur L- oder DAminosäuren und keine Proline enthalten sind[136]. So erweist sich beispielsweise die Synthese von zyklischen Tripeptiden, die nur aus α-L-Aminosäuren bestehen, ohne die Verwendung N-alkylierter Aminosäuren als nahezu unmöglich[137-139]. Als ähnlich schwierig ist die Zyklisierung von Tetrapeptiden, die ebenfalls nur aus α-L-Aminosäuren bestehen, da ein 12-gliedriger Ring, der nur trans-Amidbindungen enthält, die Zyklisierung behindert[137]. Auch hier kann durch die Verwendung von N-alkylierten Aminosäuren das Peptid in eine für die Zyklisierung günstige Konformation gebracht werden[140, 141]. Die Synthese von 83 erfolgte durch Peptidkupplung von 82 und Fmoc-Thr(tBu)-OH in Lösung unter Verwendung von HATU (Abb. 52). Die Reaktionszeit umfasste 4 Tage, um das Produkt in einer Ausbeute von 60 % zu erhalten. Bei einer Verringerung der Reaktionszeit auf 49 Ergebnisse und Diskussion einen Tag erzielt man nur eine Ausbeute von 10 %. Die Entschützung des Peptids 83 bzw. 88 am N-Terminus mit DBU unter Verwendung eines Scavenger[142] führte aber zur Bildung des Diketopiperazins 89 (Abb. 52). Durch die Verwendung einer raumerfüllenden Schutzgruppe am C-Terminus sollte diese Reaktion unterdrückt werden. Zu diesem Zweck wurde die Diphenylmethylschutzgruppe (Dpm) verwendet (Verbindung 87 und 88), die zudem durch Hydrogenolyse abgespalten werden kann. Verbindung 87 wurde über drei Stufen durch Veresterung und anschließender reduktiven Aminierung ausgehend von Boc-Gly-OH synthetisiert. Die Verwendung einer säurelabilen Schutzgruppe, wie der tertButyl-Schutzgruppe, hätte zu einem Orthogonalitätsproblem mit der Tmb-Schutzgruppe geführt. Doch leider bildete sich auch bei der Verwendung der Dpm-Schutzgruppe das Diketopiperazin 89 in quantitativer Ausbeute (Abb. 52). Die Darstellung des C-terminal entschützten Dipeptids 84 ausgehend vom 83 war ohne Probleme möglich (Abb. 52), jedoch ist dieses Peptid für die folgende Synthese des A´-Ringes von Labyrinthopeptin aufgrund der Schutzgruppenstrategie ungeeignet. OR TmbHN O 82 R= Bn 87 R= Dpm Fmoc-Ser(tBu)-OH HATU; DCM R= Bn 60% R= Dpm 45 % Tmb tBuO OH N Pd/C; H2 THF O O NHFmoc 84 82% Tmb tBuO N O O NHFmoc 83 R= Bn 88 R= Dpm OR Tmb N O MAH; DBU THF 98% O N H 89 OtBu Abbildung 52: Synthese des Peptids (Tmb)Thr(tBu)-Gly-OR in verschiedenen Schutzgruppenvarianten mit einer vorgeformten cis-Amidbindung für die Synthese des A´Ringes von Labyrinthopeptin A2. Da aufgrund der Diketopiperazinbildung kein Zyklisierungsversuch mit den Tmb-haltigen Dipeptiden durchgeführt werden konnte, wurden Zyklisierungsversuche Tmb-Gruppe durchgeführt und mit drei Kupplungsreagenzien getestet (Abb. 53). 50 ohne die Ergebnisse und Diskussion OtBu H N BocHN CO2Bn 1. HCl/Dioxan RT; 1h; 98% 2. EDAC; HOAt; THF Cbz-Glu-OtBu; 60% RT; 16h O tBuO2C NHCbz 90 O Pd/C; H2 91% N H OtBu H N O tBuO2C NH2 N H O 93 CO2H OtBu H N O 92 tBuO2C A) DPPA, B) HATU, DIPEA C) DEPBT,Collidin CO2Bn Cbz O N DMF; RT; 2d NH 94 O HN O OtBu Abbilddung 53: Zyklisierung des A´-Ringes am Modelltripeptid 93 zu Modellpeptid 94. Da bei allen diesen Versuchen das zyklische Peptid 94 detektiert werden konnte, erscheint eine Vorformung der cis-Amidbindung für die Zyklisierung nicht zwingend nötig und es wurde daher auf die Tmb-Gruppe verzichtet. Mit der erfolgreichen Synthese der quartären Aminosäure 73, konnte nun die Synthese des A´-Ringes begonnen werden. Die Zyklisierung sollte zwischen Gly12 und dem quartären Kohlenstoffzentrum Lab13 erfolgen, um eine mögliche Razemisierung des aktivierten C-Terminus zu vermeiden. Bei der Entfernung der säurelabilen Schutzgruppen in 73 und einer anschließenden Schützung besteht die Gefahr einer 5-Ring-Lactambildung, wie bei Verbindung 69b in Abb. 45 beobachtet wurde. Um diese Reaktion zu vermeiden wurde das Peptid H-Leu-Phe-Ala-OMe 101 an den C-Terminus am quartären α-Kohlenstoffatom von 74 gekuppelt (Abb. 54). HO HO N3 CO2Me Boc2N LiOH;THF RT;4h N3 CO2H 99% CO2tBu 73 Boc2N CO2tBu HO 101; EDAC HOAt; THF RT; 16h N3 74% Boc2N 74 Leu Phe OMe O CO2tBu 102 Abbildung 54: Kupplung von 74 mit H-Leu-Phe-Ala-OMe (101) zur Vermeidung einer Lactambildung während der folgenden Synthese. Nach der Kupplung des Tripeptids 101 an 74 konnten die säurelabilen Schutzgruppen entfernt, eine Boc-Schützung der freien Aminogruppen durchgeführt und das Peptid 91 gekuppelt werden (Abb. 55). Es folgten die Reduktion des Azids und die Abspaltung des Benzylesters in einem Schritt durch Hydrogenolyse. Das erhaltene Peptid 106 sollte nun analog zum Modellpeptid 93 zyklisiert werden, doch konnte kein Produkt nach der Reaktion detektiert werden (Abb. 55). 51 Ergebnisse und Diskussion HO HO N3 Leu Phe OMe O Boc2N CO2tBu 102 Leu Phe OMe 99%a O CO2H 91; EDAC HOAt; THF RT; 16h 103 N3 O 105 O BocHN 106 O X OMe 95%a Boc OBn Phe CH 2 Lab Leu Ala OMe Lab Thr Gly DMF; RT; 2d Thr Gly OMe Pd/C; H2 MeOH; RT; 2d OtBu A. DPPA; NaHCO3 B. HATU; DIPEA C. DEPBT; Collidin Phe Leu Phe Thr Gly BocHN NH2 Leu 95%a O 104 HO Boc2O; TEA OMe MeCN; RT; 16h Leu Phe HO 95%a O CO2H BocHN N3 H2N HO N3 TFA; TES RT; 4h OH 107 OtBu OH OtBu Abbildung 55: Syntheseversuch des A´-Ringes von Labyrinthopeptin A2 durch Zyklisierung zwischen Gly12 und dem quartären Kohlenstoffzentrum Lab 13( a Umsatz nach LC-MS). Die Ringspannung im Peptid 107 sollte nicht unbedingt der Grund für die nicht erfolgte Zyklisierung sein, da im Modellpeptid 93 (Abb. 53) ein Ring gleicher Größe unter den gleichen Reaktionsbedingungen synthetisiert werden konnte. Der Hauptunterschied zwischen dem Modellpeptid 93 und dem Peptid 106 ist das quartäre Kohlenstoffzentrum, an dem die Zyklisierung erfolgt. Aus diesem Grund wurde die Zyklisierungsrichtung umgekehrt. Dazu war die Synthese eines geeigneten Dipeptids nötig. Um die Orthogonalität der Schutzgruppen zu gewährleisten, war die Verwendung der α-Azidosäure 97 nötig, mit der dann das Dipeptid 99 synthetisiert werden konnte (Abb. 56). OBn H2N CO2H 96 N3 OBn H N CuSO4* 5H2O; 95 K2CO3; MeOH RT; 16h 73% CO2tBu OBn N3 97 Abb. 56: Synthese Labyrinthopeptin A2. CO2H TFA; TES; RT; 4h 99% N3 O 98 des Cl-HOBt; TEA; THF EDAC;H-Gly-OtBu RT; 16h Azidodipeptids 52 99 44% OBn H N 99 O CO2H zur Synthese des A´-Ringes von Ergebnisse und Diskussion Nachdem in Vorversuchen die Bedingungen für die Kupplung einer Aminosäure an das quartäre Zentrum ermittelt wurden, konnte nun mit dem neuen Zyklisierungsversuch begonnen werden (Abb. 57). Nach der Kupplung des Dipeptids 99 an das quartäre Zentrum von 109 folgten die Entfernung der säurelabilen Schutzgruppen, die Boc-Schützung der freien Aminogruppe und die Reduktion der Azidogruppe in 112 (Abb. 57). Nun folgte die Zyklisierung von 113 mit DEPBT, bei der die Molekülmasse des Zyklisierungsproduktes 114 detektiert werden konnte. PBu3 H2O; THF OMe RT; 16h HO N3 Leu Phe 99% O Boc2N CO2tBu 102 OBn Thr Gly N3 Boc2N 99% Leu Phe O CO2tBu 110 OBn H2N Thr Gly OMe Leu Phe 99; THF HATU; DIPEA RT; 2d OMe 32% O Boc2N CO2tBu 109 1.TFA; TES RT; 5h 2.Boc2O; TEA MeCN; RT 16h OBn N3 Thr Gly OH H N Leu Phe 99% a OMe O CO2H BocHN 112 OH H N a BocHN 113 DEPBT Collidin;DMF RT; 7d Leu Phe OMe X PBu3 H2O; THF RT; 2d H N OH a HO H2N Phe CH 2 Boc Leu Lab Ala OMe Lab Thr Gly O CO2H OH OBn 114 Abbildung 57: Synthesevesuch des A´-Ringes von Labyrinthopeptin A2 durch die Umkehrung der Zyklisierungsrichtung mit dem Dipeptid 99 (a Umsatz nach LC-MS). Da bei der Reaktion auch eine Lactonbildung möglich ist, bei der 115 entstehen kann (Abb. 58), wurden MS/MS-Experimente mit dem Peptid 116 bzw. 117 durchgeführt um zu ermitteln um welche der isobaren Verbindungen es sich beim Reaktionsprodukt handelt. OBn CH 2 RHN Lab Phe Leu Lab Thr Gly OBn Ala OMe H2N 114 R= Boc 116 R= H OH Thr Gly O H N Leu Phe O NHR OMe 115 R= Boc 117 R= H O Abbildung 58: Die zwei möglichen isobaren Reaktionsprodukte der Zyklisierung von 113. Die Fragmentierungsmuster der Peptide 115 und 116 unterscheiden sich, da man beim Peptid 116 nur Fragmente erwartet, die durch eine Spaltung im C-terminalen Tripeptid Leu-Phe-Ala-OMe entstehen, während 117 zusätzliche Fragmente zeigen muss, die durch 53 Ergebnisse und Diskussion Spaltung im N-terminalen Dipeptid Thr-Gly entstehen. Ein Vergleich der errechneten Fragmentmassen aller möglichen Fragmentierungsserien mit dem beobachteten Fragmentierungsmuster in Abb. 59 zeigt aber deutlich, dass das Produkt der Zyklisierung das unerwünschte Peptid 115 ist. Abbildung 59: Schema einer Peptidfragmentierung im MS/MS-Experiment und Tabelle mit den errechneten Fragmenten. In rot sind die charakteristischen Fragmente für das Peptid 116 abgebildet und in schwarz die gemeinsamen Fragmente beider Peptide 116 und 117. „x“ kennzeichnet ein detektiertes Fragment, während „nd“ ein nicht detektiertes Fragment kennzeichnet. a1 164,108 X x5 603,277 nd a2 221,129 X x4 546,256 nd a3 377,182 X x3 390,203 nd a4 490,267 X x2 277,118 nd a5 637,335 X x1 130,050 nd b1 192,102 nd y5 577,283 X b2 249,124 X y4 520,261 X b3 405,177 X y3 364,208 nd b4 518,261 X y2 251,124 X b5 665,33 X y1 104,055 nd c1 209,113 nd z5 560,272 nd c2 266,134 nd z4 503,251 nd c3 422,188 nd z3 347,197 nd c4 535,272 nd z2 234,113 nd c5 682,341 nd z1 87,044 nd Aufgrund dieser Ergebnisse wurde die Hydroxygruppe am β-Kohlenstoffatom von 73 mit einer Schutzgruppe versehen. Die verwendete Schutzgruppe sollte möglichst klein sein, um eine Abschirmung des quartären Zentrums in 73 zu verhindern. Da eine Schützung als Allylether synthetisch nicht zugänglich war, wurde der Methylether 118 bzw. 119 vewendet (Abb. 60). HO N3 CO2Me Boc2N CO2tBu 73 MeI; Ag2O Me2S; MeCN RT; 16h 83% MeO N3 CO2Me Boc2N CO2tBu 118 LiOH;THF RT; 16h MeO N3 CO2H 99% Boc2N CO2tBu 119 Abbildung 60: Synthese des Methylethers 118 und anschließende Verseifung des Methylesters. Bei der Darstellung von 118 aus 73 wurde eine teilweise Epimerisierung am γ-Kohlenstoffatom festgestellt, da im 1H-NMR eine Signaldopplung in einem Verhältnis von 2:1 beobachtet werden konnte. Eine Trennung der Diastereomere war weder bei Verbindung 118 noch 119 möglich. Daraufhin wurde der Baustein 119 als ein Gemisch aus 54 Ergebnisse und Diskussion Diastereomeren in der Peptidsynthese eingesetzt (Abb. 61), wobei das in Abb. 57 gezeigte Syntheseschema verwendet wurde. Die Trennung der Diastereomere erfolgte stufenweise, bei der Reinigung der Peptide 120 (de = 74 %) und 121 (de = 86 %) konnte der Anteil des unerwünschten Diastereomers bereits reduziert werden (Abb. 61). Doch erst bei der Reinigung von Peptid 122 war es möglich das gewünschten Peptid vom unerwünschten Diastereomer zu trennen, wobei neben der Reinfraktion von Peptid 122 (de = 99 %) eine Mischfraktion der Diastereomere im Verhältnis 4:1 zugunsten der Reinfraktion erhalten wurde. Durch die Verwendung der Methyl-Schutzgruppe konnte der A´-Ring erfolgreich geschlossen werden. Hieraus ist erkennbar, dass die Schützung der Hydroxyfunktion zwingend notwendig ist, da ohne diese nicht das gewünschte Produkt gebildet werden kann, sondern das Lacton 114 (Abb. 58) entsteht. Doch ist der Einsatz eines Methylethers als Schutzgruppe durchaus problematisch, da sich diese Schutzgruppe nur unter harschen Reaktionsbedingungen wieder entfernen lässt und dadurch eine orthogonale Entschützung der Hydroxygruppe unmöglich ist. MeO MeO N3 CO2H Boc2N EDAC; HOBt THF; 101; RT; 16h Pd/C; H2 OMe EtOAc; RT; 16h Leu Phe O Boc2N CO2tBu 120 62% CO2tBu N3 119 65% OBn MeO H2N Boc2N 121 Leu Phe O CO2tBu Thr Gly Boc2N OBn Thr Gly 94% über 2 Stufen BocHN OBn Thr Gly N3 H N BocHN 125 H N OMe Leu Phe OMe OMe H N 73% 1.TFA; TES 8h; RT 2.Boc2O; TEA N3 MeCN; RT 16h H2N OMe 99; THF; HATU DIPEA; RT; 2d Leu Phe OMe O CO2tBu 122 PPh3-pb H2O; THF RT; 4d O CO2H 124 OMe Leu Phe HATU DIPEA; THF Boc OMe RT; 2d O CO2H Phe CH2 Leu Lab Ala Lab Thr Gly OMe OBn 126 Abbildung 61: Synthese des A´-Ringes unter Verwendung des Methylethers 119. 55 OMe Ergebnisse und Diskussion Durch den Einsatz von geschütztem Labionin (Abb. 50) in der Peptidsynthese könnte dieses Problem umgangen werden, doch momentan ist, wie bereits in Kapitel 3.2 dargestellt, keine Labioninsynthese etabliert. Die hier gezeigte erfolgreiche Synthese des A´-Rings bietet jedoch die Voraussetzung für die Totalsynthese des Labyrinthopeptins. Der A-Ring von Labyrinthopeptin A2 enthält aber im Vergleich zum A´-Ring raumerfüllendere Aminosäuren unter anderem die Aminosäure Tryptophan, die leicht Nebenreaktionen wie eine Alkylierung und Oxidation des Indolrings eingeht[2]. Aus diesen Gründen ist der A´-Ring bzw. das A´B´Fragment leichter synthetisch handhabbar als der A-Ring bzw. das AB-Fragment. 56 Ergebnisse und Diskussion 3.4 Synthese eines analytischen Referenzstandards zum Labioninnachweis Die Aminosäure Labionin (Abb. 14) wurde bisher nur im Labyrinthopeptin A2 durch Röntgenstrukturanalyse nachgewiesen. Sie wird jedoch auch in anderen Typ III-Lantibiotika vermutet (s. Kapitel 1.3.3). Eine Methode zur Labioninbestimmung in Peptiden ist der direkte Nachweis von Labionin im Totalhydrolysat (Abb. 62) des Peptids mittels Massenspektrometrie. Ein direkter Nachweis von Labionin durch LC-MS konnte bisher nicht erbracht werden. Dafür gibt es mehrere mögliche Ursachen, zum einen kann die Aminosäure Labionin durch seine jeweils drei Amino- und Carboxygruppen mehrere Ladungen tragen, wodurch LC-MS-Messungen negativ beeinflusst werden können, da es aufgrund der genannten funktionellen Gruppen als einfach, zweifach und dreifach geladenes Ion vorliegen kann. Das Wert des dreifach geladenen Ions von Labionin im Positivionenmodus beträgt 99,5 m/z, die Detektion solch kleiner und hochgeladenen Massen im LC-MS erweist sich als schwierig. Zum anderen kann das Schwefelatom der Lanthioninbrücke oxidiert vorliegen, wodurch die Intensität der Messung ebenfalls negativ beeinflusst wird. Der direkte Nachweis von Labionin aus dem Hydrolysat des Peptids kann aber auch mit GC-MS erfolgen. Der Vorteil der GC-MS gegenüber der LC-MS besteht in der höheren Empfindlichkeit und der Verminderung von Mehrfachladungen. Für die GC-MS-Analyse müssen die Aminosäuren des Hydrolysats am N-Terminus trifluoracetyliert und am C-Terminus verestert werden. Für den exakten Nachweis ist jedoch die Verwendung eines Referenzstandards notwendig. Mit der GC-MS lässt sich auch die Stereochemie von Aminosäuren bestimmen. Dazu muss jedoch eine chirale Trennsäule benutzt werden und Referenzaminosäuren mit bekannter Stereochemie vorhanden sein. Nach einer Optimierung der Trennmethode ist es möglich die Stereoisomere der entsprechenden Aminosäuren voneinander zu trennen und somit sicher deren Stereochemie zu bestimmen. Da bisher die Synthese von Labionin nicht verwirklicht werden konnte und Labionin somit nicht als Referenzstandard verwendet werden kann, erschien es notwendig die Aminosäure Labionin im Peptid durch eine Abbaureaktion in eine synthetisch leichter zugängliche und besser analysierbare Verbindung zu überführen. Eine geeignete Abbaureaktion stellt die Desulfurierung des labioninhaltigen Peptids dar (Abb. 62)[42, 143] . Durch diese Reaktion wird Labionin in 2,4-Diamino-2-methylglutarsäure umgewandelt, die das Ziel der Synthese des Referenzstandards ist. 57 Ergebnisse und Diskussion Abbildung 62: Hydrolyse eines labioninhaltigen Peptids und Hydrolyse eines labioninhaltigen Peptids nach einer Desulfurierung, mit den jeweils dabei resultierenden Aminosäuren des Hydrolysats (Xxx kennzeichnet beliebige Aminosäuren; R entspricht variablen Aminosäurenseitenketten). Ausgangsmaterial für die Synthese des Refenzstandards ist Cbz-α-Allylalanin 129 das durch eine chelatverbrückte Claisen-Umlagerung aus Cbz-Ala-OAll 128 (Abb. 63) synthetisiert wurde. Nun wurde durch eine Sharpless Asymmetrische Dihydroxylierung das Diol 131 synthetisiert und im folgenden Schritt wurde die endständige Hydroxygruppe mit TBDMS geschützt. Nun konnten die Diastereomere, die aus dem razemischen Cbz-AllylAla-OtBu (130) entstanden, voneinander getrennt werden (Abb. 63). Eine Analyse der TBDMS-Ether (+/-132a & b; Abb. 64) auf der chiralen HPLC zeigte, dass die asymmetrische Dihydroxylierung mit AD-Mixβ in dieser Reaktion zu einem razemischen Gemisch führte, da Absorbtion (AU) zwei Peaks mit nahezu gleicher Intensität beobachtet wurden (Abb. 63). Retentionszeit (min) Abbildung 63: Chromatogramm des TBDMS-Ethers +/- 132a auf der chiralen HPLC, die zwei Signale zeigen das die Verbindung als eine Mischungen aus Enantiomeren vorliegt. 58 Ergebnisse und Diskussion Bei der Verwendung vom AD-Mixα für die Dihydroxylierung zeigten die entsprechenden TBDMS-Ether das gleiche Verhalten auf der chiralen HPLC. Die mangelnde Stereoselektivität der Sharpless Dihydroxylierung an ähnlichen Substraten ist in der Literatur beschrieben[144, 145], doch ist die Ursache der geringen Stereoselektivtät bisher unbekannt[146]. Da, wie gesagt, die Diastereomerenpaare voneinander getrennt werden konnten, wurde diese als Enantiomerenpaar weiter in der Synthese verwendet (Abb. 64). Die sekundäre Hydroxygruppe wurde in ein Azid umgewandelt, der TBDMS-Ether gespalten und der entstehende Alkohol zur Säure oxidiert. Nun wurde die tert-Butyl-Schutzgruppe entfernt und eine Hydrogenolyse durchgeführt (Abb. 64). Bei der Hydrogenolyse der Verbindungen +/-137a bzw. +/-137b traten eine Reihe von Nebenreaktionen auf. Die Zuordnung der Stereochemie war durch den Vergleich der Retentionszeiten der synthetischen Verbindungen +/-137a bzw. +/-137b, mit der Retentionszeit von (2R/4S)-2,4-Diamino-2-methylglutarsäure möglich, welches aus dem Totalhydrolysat des desulfurierten Labyrinthopeptin A2 gewonnen werden konnte. Eine Reinigung konnte bisher nur durch präparative DC und anschließende Extraktion des Kieselgels mit Methanol erfolgen, wobei große Mengen des Kieselgels mitextrahiert wurden. Eine Trennung über eine C18-Säule zeigte keine Wirkung, da das Produkt wie auch die Nebenprodukte sehr polare Verbindungen sind, die keine Wechselwirkung mit C18-Trennmaterial eingehen. Theoretisch sollte die Reinigung dieser Substanzen mit einer HILIC-Säule möglich sein, da dieses Säulenmaterial speziell für die Trennung sehr polarer Substanzen wie Aminosäuren entwickelt wurde[147-149]. Eine enantiomerenreine Synthese des Standards ist möglich, wenn man von enantiomerenreinem Cbz-α-Allylalanin ausgeht und die in Abb. 74 gezeigte Syntheseroute verwendet. Die Dihydroxylierung verläuft zwar nicht stereoselektiv, doch lassen sich die Diastereomere gut als TBDMS-Ether von einander trennen. Die Verbindungen +/-137a und. +/-137b werden zurzeit innerhalb der Arbeitsgruppe zum Labioninnachweis verwendet. 59 Ergebnisse und Diskussion OAll CbzHN 1.LDA; ZnCl2 -78°C; THF; 86% 2.TBTA; BF3*OEt2 DCM; 60% OtBu CbzHN O 128 130 O AD-Mixβ tBuOH-H2O 61% HO HO CbzHN 131 O OBu TBDMSCl Imidazol; DMF 68% TBDMSO TBDMSO TBDMSO TBDMSO HO HO HO HO OtBu CbzHN +/-132a O OtBu CbzHN OtBu CbzHN CbzHN +/-132b O O HO HO OtBu CbzHN O OtBu CbzHN N3 OtBu CbzHN CbzHN +/-134b O O +/-134a HO N3 N3 N3 CO2H OH H2N O +/-137a CO2H H2N CO2H H2N OH H2N OtBu O 1.TEMPO; NaOCl Aceton; 95% 2. TFA; TES; 80% 3. Pd/C; H2; THF 1.TEMPO; NaOCl Aceton; 95% 2. TFA; TES; 80% 3. Pd/C; H2; THF H2N O 1.DPPA; DEAD; PPh3 THF;68% 2.TBAF; THF; 80% 1.DPPA; DEAD; PPh3 THF; 49% 2.TBAF; THF; 70% HO OtBu OH H2N O O +/-137b CO2H H2N OH H2N O Abbildung 64: Synthesen des analytischen Referenzstandards zum Labioninnachweis. 60 Ergebnisse und Diskussion 3.5 Derivatisierung der Naturstoffe Labyrinthopeptin A1 und A2 Durch die Derivatisierung von biologisch aktiven Naturstoffen und die dadurch im Molekül hervorgerufenen Änderungen der Struktur, der Ladung oder der Löslichkeit besteht eine Möglichkeit die Aktivität des betreffenden Naturstoffs zu erhöhen, seine Wirkung besser zu verstehen und für die Aktivität notwendige Strukturen des Naturstoffs zu erkennen. Im Rahmen dieser Arbeit wurde Derivatisierungen ausgehend von Labyrinthopeptin A1 und A2 vorgenommen. Diese umfassen eine selektive Desulfurierung der B-Ringe von Labyrinthopeptin A1 und A2 und führen so zu einer Strukturänderung in den Peptiden (Abb. 65). Diese Reaktion ist ebenfalls der Schlüsselschritt zum Labioninnachweis mit dem im vorhergehenden Kapitel beschriebenen Aminosäurestandard. Die Desulfurierung kann durch die Reaktion mit NiCl2 und NaBH4 erfolgen[42, 143] . Dabei ist es von Vorteil nur kleine Mengen, in diesem Fall 1 mg Substanz, je Reaktionsansatz zu verwenden, da eine Vergrößerung des Ansatzes die Bildung von nicht charakterisierten Nebenprodukten begünstigt. Im Fall von Labyrinthopeptin A2 bietet sich eine Desulfurierung mit RaneyNickel an, da die Reaktion mit diesem Reagenz hier zu weniger Nebenprodukten führt, während die Reaktion von Labyrinthopeptin A1 mit Raney-Nickel nicht zum gewünschten Reaktionsprodukt führte. Abbildung 65: Derivatisierung von Labyrinthopeptin A2 durch Desulfurierung und NTCB-Spaltung. Durch eine Spaltung mit dem Reagenz NTCB[150] (der Mechanismus dieser Reaktion ist in Abb. 66 gezeigt) konnte nach einer Öffnung der Disulfidbrücke das AB- und das A´B´Fragment von Labyrinthopeptin A2 erzeugt werden. Durch die NTCB-Spaltung von 61 Ergebnisse und Diskussion Labyrinthopeptin A1 konnte bisher nur das AB-Fragment erzeugt werden, da sich das A´B´Fragment von Labyrinthopeptin A1 zersetzt. Die Ursache für die Zersetzung des A´B´Fragments von Labyrinthopeptin A1 ist wahrscheinlich die Aminosäure Dhb, die im B´-Ring von Labyrinthopeptin A1 enthalten ist (Abb. 19). Diese Vermutung wird dadurch gestützt, das die NTCB-Spaltung von Labyrinthopeptin A2 (Abb. 65) ohne Probleme verläuft, die Spaltung von Labyrinthopeptin A1 nach dem gleichen Protokoll erfolgt und der einzige signifikante Unterschied zwischen den beiden Peptiden das Vorhandensein der Aminosäure Dhb ist. Die bei der Spaltung erhaltenen Peptide sollen auf ihre biologische Aktivität getestet werden. Durch den Vergleich der Aktivitäten der Fragmente eines Peptids kann das für die biologische Aktivität notwendige Strukturelement ermittelt werden und basierend auf diesen Ergebnissen eine weitere Derivatisierung erfolgen oder die Größe des Peptids weiter reduziert werden. CO2H NO2 CO2H NO2 OH N H H N O O N H SH S NCS N H pH 9; 37 °C 16 h N H pH 8; 36 °C 15-30 min O OH HN H N O O N H SCN O O N H S O H N O Abbildung 66: Mechanismus der NTCB-Spaltung[150]. Weitere durchgeführte Derivatisierungen sind die PEGylierung der N-Termini von Labyrinthopeptin A1 (155) (Abb. 67) und A2 (154), durch die die Hydrophilie der Labyrinthopeptine erhöht wird. Zur Einführung der PEG-Einheit Succinimidaktivester benutzt. Abbildung 67 Struktur des N-terminal PEGylierten Labyrinthopeptin A1. 62 wurde ein Ergebnisse und Diskussion Abbildung 68: Struktur des Dimers von Labyrinthopeptin A2. Die Synthese von Wirkstoffdimeren ist eine weit verbreitete Methode in der Medizinalchemie[151-153]. Für die Synthese eines Labyrinthopeptindimers (Abb. 68) war dabei die Synthese des Linkers 140 notwendig (Abb. 69). Bedingt durch die positiven Erfahrungen der Verwendung von Succinimidaktivestern bei der PEGylierung der Labyrinthopeptine A1 und A2, sollte der Linker ebenfalls als Succinimidaktivester (141) eingesetzt werden. Doch das gewünschte Produkt 141 konnte nicht isoliert werden und somit wurde die Synthese eines Labyrinthopeptindimers verworfen. O O 138 Br Hexaethylenglycol; KOH Toluol; Bu4NHSO4; RT; 1h 44% O O 140 OH 6 O O A. HOSu; EDAC; DCM DIPEA; RT; 16h B. HOSu; C2O2Cl2 Pyridin; THF; DCM DMF; RT; 2h O O 139 TFA; DCM RT; 4h O 6 99% O O O N X HO O O O O O O O O 6 141 N O O Abbildung 69: Synthese eines Linkers zur Erzeugung von Labyrinthopeptindimeren. Weitere Derivatisierungsversuche wurden an der Doppelbindung des Dhbs im Labyrinthopeptin A1 vorgenommen (Abb. 70). Dabei sollte die Doppelbindung analog zu der in der Literatur beschriebenen Hydrierungen von Dha bzw. Dhb in anderen Peptiden [154, 155] hydriert werden (Abb. 70) oder durch den Angriff eines Schwefelnukleophils die Doppelbindung beseitigt werden[156]. Doch alle diese Versuche scheiterten. Ein möglicher Grund könnte die Abschirmung der Doppelbindung durch die umgebenden Aminosäuren sein. Des Weiteren wurde ein Versuch durchgeführt, in dem die Disulfidbrücke von Labyrinthopeptin A2 in eine Lanthioninbrücke (Abb. 70) durch Monodesulfurierung in alkalischer Umgebung[56, 157] umgewandelt werden sollte. Dabei wurde das gewünschte Produkt (163) aber nur in Spuren gebildet und eine Isolierung ist auf Grund des geringen Unterschieds in der Retentionszeit auf der HPLC nicht möglich. Durch die Verwendung von Phosphiden[54] in dieser Reaktion kann die Ausbeute vielleicht erhöht werden. 63 Ergebnisse und Diskussion Abbildung 70: Struktur des C-Ring-Lanthionin Analoga von Labyrinthopeptin A2 (163) und des Hydrierungsprodukt von Labyrinthopeptin A1 (164), die synthetisch nicht darstellbar waren. 64 Zusammenfassung und Ausblick 4. Zusammenfassung und Ausblick Labyrinthopeptin A2 wurde 1988 im Rahmen eines von der Firma Sanofi-Aventis durchgeführten Screeningprogramms aus dem Aktinomyzeten Actinomadura namibiensis DM 6313 isoliert[47]. Die Strukturaufklärung dieses Naturstoffs gelang erst im Rahmen einer Kooperation der Arbeitsgruppen Süßmuth (TU-Berlin) und Sheldrick (Universität Göttingen)[45]. Labyrinthopeptin A2 typischerweise in vorkommenden Lantibiotika weist neben einer Disulfidbrücke Lanthioninbrücken eine und zwei strukturelle Besonderheit auf, die als Labionin bezeichnet wurde. Diese Aminosäure weist eine Methylenverbrückung zu einem Glycinrest auf, ausgehend von einem α,α-disubstituierten Kohlenstoffatom, das wiederum die bereits erwähnte Lanthioninbrücke bildet. Diese Brücken bilden, zusätzlich zur Disulfidbrücke, vier Ringe im Labyrinthopeptin A2, da die Aminosäure Labionin zweimal im Naturstoff auftritt. Die durch die Methylenbrücken gebildeten A-Ringe und durch die Thioetherbrücken gebildeten B-Ringe werden N-terminal als Ring A und B bezeichnet, während sie C-terminal Ring A´ und B´ genannt und von einer Disulfidbrücke überspannt werden. Durch die Kenntnis der Struktur konnte der Biosynthesegencluster[45] von Labyrinthopeptin A2 und später auch dessen Biosynthese[50] in unserem Arbeitskreis aufgeklärt werden. Von einer anderen Klasse von Peptiden, den Conotoxinen, ist eine analgetische Wirkung bekannt. Aus diesem Grund wurde Labyrinthopeptin durch die Firma Sanofi-Aventis auf diese Eigenschaft getestet, wobei sich zeigte dass es zur Behandlung neurophatischer Schmerzen geeignet ist. Derzeit wird Labyrinthopeptin in der präklinischen Phase als Analgetikum durch Sanofi-Aventis untersucht. Aufgrund dieser interessanten Eigenschaft von Labyrinthopeptin A2 und seiner außerordentlichen Struktur sind die Synthese von Labyrinthopeptin und die Erzeugung von Derivaten von großem Interesse. Im Rahmen dieser Arbeit wurden umfangreiche Studien zur Synthese von Vorläufern des Labyrinthopeptins durchgeführt (Abb. 71). So konnte die geschützte quartäre Aminosäure (2R,4S)-5-tButyl-1-methyl-2-azido-4-(bis-Boc-amino)-2(hydroxymethyl)pentandioat (73), die Ausgangsverbindung zur Synthese des zentrale Strukturmotivs im Labyrinthopeptin A2, Labionin, nach mehrmaliger Änderung der Synthesestrategie, ausgehend von Glycin über 10 Stufen in einer Ausbeute von 12,8 % synthetisieren werden (Abb. 71). Dabei handelt es sich um die erste Synthese einer derart komplexen Aminosäure. Ausgehend von dieser Verbindung konnte nun die Synthese des A´Rings von Labyrinthopeptin A2 begonnen werden. Da es sich bei den A-Ringen des 65 Zusammenfassung und Ausblick Labyrinthopeptin A2 um gespannte Ringe handelt, die eine cis-Amidbindung beinhalten[45], wurde die Zyklisierung vorher an einem Modellpeptid untersucht, um die Notwendigkeit eines Einsatzes einer N-alkylierten Aminosäure zu überprüfen. Nach einer Korrektur der Zyklisierungsrichtung und der zusätzlichen Schützung der freien Hydroxygruppe von 73 war nun die erfolgreiche Synthese des A´-Ringes möglich (Abb. 71). Des Weiteren konnte die quartäre Aminosäure 73 unabhängig von dieser Arbeit innerhalb des Arbeitskreises zur erfolgreichen Synthese des A-Ringes von Labyrinthopeptin A2 genutzt werden. Aufbauend auf die in dieser Arbeit vorgestellte Synthese von 73 und die folgende Synthese des A´Ringes kann nun die Totalsynthese von Labyrinthopeptin A2 und weiterer möglicher labioninhaltiger Peptide begonnen werden. Für die Synthese der Aminosäure Labionin wurden im Rahmen dieser Arbeit zahlreiche Versuche ausgehend von 73 durchgeführt. Diese Versuche blieben ohne Erfolg, da die Transformation der Hydroxygruppe von 73 in eine geeignete Abgangsgruppe nicht möglich war. Dieses Problem soll in Zukunft durch die Transformation von 73 in ein β-Lacton[124], ein Aziridin[124, 126] oder in ein Sulfamidat[124, 126] überwunden werden. Da sich die Synthese der Aminosäure Labionin als schwierig erwies, aber eine Standardsubstanz zum Nachweis von Labionin in anderen Peptiden synthetisiert werden sollte, wurde das Desulfurierungsprodukt von Labionin, das der 2,4-Diamino-2methylglutarsäure entspricht, synthetisiert. Die Desulfurierung von Peptiden ist eine gängige Methode zur Sequenzierung von Lantibiotika und wurde verwendet, um das Labionin im Peptid zu 2,4-Diamino-2-methylglutarsäure abzubauen und nach Hydrolyse des Peptids nachzuweisen. Zur sicheren Bestimmung von Labionin bzw. dessen Abbauprodukt der 2,4-Diamino-2-methylglutarsäure ist die Verwendung einer Referenzsubstanz notwendig. Die Synthese des Standards erfolgte über eine chelatverbrückte Claisen-Umlagerung[98] ausgehend von Cbz-Gly-OAll. Das bei dieser Reaktion gebildete razemische Cbz-α-Allylalanin wurde nach einer Schützung des C-Terminus nach Sharpless Asymmetrischer Dihydroxylierung in das entsprechende Diol transformiert. Die Asymmetrische Dihydroxylierung zeigte bei diesem Substrat jedoch keine Stereoselektivität, sodass nach der Reaktion vier Stereoisomere gebildet wurden, bei denen sich die Diastereomere auf der folgenden Stufe trennen ließen. Die Enantiomerenpaare wurden in weiterfolgenden Reaktionen eingesetzt und die jeweilige +/2,4-Diamino-2-methylglutarsäure 137a/b konnte erfolgreich synthetisiert werde (Abb. 71). Diese Standardsubstanz wird zurzeit innerhalb der Arbeitsgruppe zum Nachweis von Labionin in anderen Peptiden verwendet. Des Weiteren wurde eine Vielzahl von Modifikationen an den Naturstoffen Labyrinthopeptin A1 und A2 vorgenommen (Abb. 71). So konnten die B-Ringe von Labyrinthopeptin A1 und 66 Zusammenfassung und Ausblick A2 desulfuriert werden (Abb. 71) und somit eine Änderung der Konformation vorgenommen werden. Ferner konnten beide Peptide N-terminal PEGylierten werden (Abb. 71) und somit die Polarität dieser Moleküle verändert werden. Außerdem war eine Spaltung der Peptide an den Cycteinen mit dem Reagenz NTCB möglich (Abb. 71), wodurch die Fragmente AB und A´B´ von Labyrinthopeptin A2 synthetisiert wurden. Bei der Spaltung von Labyrinthopeptin A1 konnte nur des AB-Fragment isoliert werden, da sich das A´B´-Fragment während der Reaktion zersetzte. Durch diese Spaltung sollen die jeweiligen Fragmente in künftigen Studien auf ihre biologische Aktivität getestet werden, um das für die analgetische Wirkung relevante Strukturmotiv im Labyrinthopeptin zu bestimmen. 67 Abbildung 71: Schematische Darstellung der Ergebnisse dieser Dissertation. In der Abbildung oben links ist die Synthese der quartären Aminosäure 73 aus der Schiffschen Base 62 dargestellt. Diese Verbindung bildete die Grundlage für die Synthese des A´-Rings von Labyrinthopeptin A2. Oben rechts sind die synthetisierten analytischen Referenzstandards dargestellt, die zum Nachweis der Aminosäure Labionin in anderen Klasse-III-Lantibiotika verwendet werden. Unten in der Abbildung sind die Derivate von Labyrinthopeptin A1 und A2 abgebildet, die im Rahmen dieser Arbeit dargestellt wurden und für Struktur-Aktivitäts-Studien verwendet werden sollen. Zusammenfassung und Ausblick 68 Experimenteller Teil 5. Experimenteller Teil 5.1. Allgemeine Informationen Arbeitstechniken: Arbeiten mit luft- und wasserempfindlichen Verbindungen wurden unter Schutzgas durchgeführt (Argon bzw. Stickstoff). Hierzu wurde das Reaktionsgefäß durch Erhitzen mit der Heizpistole von Wasser befreit und unter Schutzgas gesetzt. Feststoffe wurden dem Reaktionsgefäß im Gegenstrom zugegeben, Lösungsmittel (abs.) und flüssige Reaktanden mit Spritzen durch ein Septum. Chemikalien: Die Chemikalien wurden von den Firmen Karl Roth GmbH und Co. Kg (Karlsruhe), (SigmaAldrich (Taufkirchen), Iris Biotech GmbH (Marktredwitz), Orpegen (Heidelberg), ABCR (Karlsruhe), Alfa Aesar (Karlsruhe), Merck (Darmstadt) und Acros (Geel, Belgien) bezogen und ohne weitere Aufreinigung eingesetzt. Lösungsmittel wurden von der Firma Acros (Geel, Belgien) bezogen und wasserfrei, wie gekauft verwendet. Als deuterierte Lösungsmittel für die NMR-Spektroskopie wurden Chloroform-d1 (99.8 %), Methanol-d4 (99,8%), Wasser-d2 und Dimethylsulfoxid-d6 der Firma DEUTERO GmbH (Kastellaun) verwendet. Chromatographie: Dünnschichtchromatogramme (DC) wurden mit kieselgelbeschichteten Aluminiumfolien der Firma Merck (Darmstadt) (TLC Kieselgel 60, F254) aufgenommen. Verbindungen wurden entweder mit UV-Licht einer Wellenlänge von λ = 254 nm oder durch Eintauchen in Permanganat-Reagenz (3 g KMnO4, 20 g K2CO3, 300 ml dest. Wasser, 5 ml NaOH-Lsg. (5 %)) mit anschließendem Erhitzen unter Zuhilfenahme einer Heizpistole sichtbar gemacht. Die Säulenchromatographie wurde mit Kieselgel der Firma Acros (Geel, Belgien) (0.04-0.064 mm 60) durchgeführt. Eluiert wurde unter erhöhtem Druck (N2) mit unterschiedlichen Laufmittelgemischen. 69 Experimenteller Teil Analysenmethoden: 1 H-NMR-Spektren wurden mit dem Gerät AM 400 (400 MHz) der Firma Bruker (Karlsruhe) aufgenommen. Als Lösungsmittel dienten Deuterochloroform (CDCl3), deuteriertes Methanol (MeOD-d4), deuteriertes Wasser-d2 und deuteriertes DMSO (DMSO-d6). Die chemischen Verschiebungen sind in δ-Werten (ppm) angegeben. Als Referenz wurde das Restsignal des undeuterierten Lösungsmittels verwendet. Kopplungskonstanten J sind in Hertz (Hz) angegeben. Signalmultiziplitäten sind wie folgt gekennzeichnet: (s) Singulett, (d) Duplett, (dd) Duplett von Duplett, (t) Triplett, (dt) Duplett von Triplett, (td) Triplett von Duplett, (q) Quartett, (dq) Duplett von Quartett, (m) Multiplett. Die Spektren wurden, sofern nicht anders angegeben bei 298 K aufgenommen. Zur Auswertung der Spektren wurde das Programm ACDLabs 5 (Toronto, Kanada) verwendet. 13 1 C-NMR-Spektren wurden mit dem Gerät AM 400 (100 MHz) der Firma Bruker (Karlsruhe) H-Breitband entkoppelt aufgenommen. Als Lösungsmittel dienten Deuterochloroform (CDCl3), deuteriertes Methanol (MeOD-d4), deuteriertes Wasser-d2 und deuteriertes DMSO (DMSO-d6). Die chemischen Verschiebungen sind in δ-Werten (ppm) angegeben. Als Referenz wurde das Restsignal des undeuterierten Lösungsmittels verwendet. Die Zuordnungen der Signale wurden durch DEPT-135 und APT-Experimente ermittelt. Die Spektren wurden, sofern nicht anders angegeben bei 298 K aufgenommen. Zur Auswertung der Spektren wurde das Programm ACDLabs 5 verwendet. MS-Spektren (auch Hochauflösung) wurden auf einem Finnigan MAT 95S aufgenommen. Die Ionisierung erfolgte durch Elektronenstoß (EI) mit einem Ionisierungspotential von 70 eV. HPLC-MS-Kopplungen wurden mit dem ESI-Massenspektrometer (electro spray ionisation) QTrap 2000 ESI-Quadrupol-MS (Niederauflösung) der Firma Applied Biosystems (Forster City, USA) in Kopplung mit einem Agilent 1200 Series HPLC-System der Firma Agilent Technologies (Waldbronn) unter Verwendung einer RP-C18-Säule der Fima Phenomenex (Aschaffenburg) vorgenommen (Lösungsmittel A: Wasser / 0,1 % HCOOH, Lösungsmittel B: Acetonitril / 0,1 % HCOOH, Flussrate: 1,5 ml/min). Alternativ wurde eine Orbitrap LTX (Hochauflösung) der Firma Thermo Scientific (Waltham, USA) in Kopplung mit einem Agilent 1200 Series HPLC-System der Firma Agilent Technologies (Waldbronn) unter Verwendung einer Hypersil-100 C18-Säule der Firma Thermo Scientific (Waltham, USA) verwendet (Lösungsmittel A: Wasser / 0,025 % HCOOH, Lösungsmittel B: Methanol / 0,025 % HCOOH, Flussrate: 1,3 ml/min). Zur Auswertung der Spektren wurden die Programme Xcalibur und Analyst verwendet. 70 Experimenteller Teil GC-MS-Messungen wurden an einem 5975C der Firma Agilent Technologies (Waldbronn) aufgenommen. Es wurde in einem Scanbereich von 50-800 amu, einer Detektionstemperatur von 150 °C und einer Quellentemperatur von 300 °C gearbeitet. Die Ionisierungsenergie betrug 91 eV. Als Trägergas wurde Helium verwendet. Als Säule wurde eine Agilent 190913433 der Firma Agilent Technologies (Waldbronn) eingesetzt (30 m, ID 0,25 mm, Phase: 5% Phenyl methyl siloxan). Chirale GC-MS-Messungen wurden an einem GC800 Top Voyager der Firma ThermoQuest (Rodano, Italien) aufgenommen. Es wurde in einem Scanbereich von 45-465 amu, einer Detektionstemperatur von 210 °C und einer Quellentemperatur von 220 °C gearbeitet. Die Injektionstemperatur betrug 250 °C. Die Detektorspannung betrug 350 V mit einer Energie von 70 eV. Als Trägergas wurde Helium verwendet. Als chirale Säule wurde eine FSLipodex E der Firma Macherey-Nagel GmbH & Co. KG (Düren) eingesetzt (25 m, ID 0,25 mm, Phase: Octakis-(2,6-di-O-pentyl-3-O-butyryl)-γ-cyclodextrin). Drehwerte wurden mit einem Polarimeter P-2000 Series der Firma Jasco Labor- und Datentechnik GmbH (Groß-Umstadt) aufgenommen. Als Lösungsmittel dienten Dichlormethan (DCM) und Ethylacetat (EtOAc). Die Drehwerte wurden bei 298 K und den jeweils angegeben Konzentrationen aufgenommen. Flash-Chromatographie wurde mit CombiFlash Rf der Firma Teledyne ISCO (Lincoln, USA) durchgeführt. Als Lösungsmittel wurden Ethylacetat (EtOAc) und Hexan (Hex) verwendet. Als Säulenmaterial wurden RediSep Rf-Kartuschen der Firma Teledyne ISCO (Lincoln, USA) verwendet. Präparative RP-HPLC-Trennungen wurden auf einer Agilent HP 1100 HPLC-Anlage mit UVDetektor (Beobachtungswellenlänge: λ = 280 nm bzw. 210 nm) der Firma Agilent Technologies (Waldbronn) unter Verwendung der RP-C18-Säule Grom-Sil 300 ODS-5 ST der Firma Grom (Rottenburg-Hailfingen) durchgeführt. Als Lösungsmittelsysteme wurden Wasser (Lösungsmittel A) und Acetonitril (Lösungsmittel B) bei einer Flussrate von 15 ml/min verwendet. Die jeweiligen Gradienten sind an entsprechender Stelle angegeben (Auswertungssoftware: Agilent ChemStation). Die HPLC-Analytik wurde mit einer analytischen 1100-HPLC-Anlage der Firma Agilent Technologies (Waldbronn) mit DAD-Detektor (Beobachtungswellenlänge: λ = 280 nm bzw. 210 nm) und einer Luna RP-C18-Säule der Firma Phenomenex (Aschaffenburg) durchgeführt (Lösungsmittel A: Wasser; Lösungsmittel Methanol; Flussrate: 1,5 ml/min; Gradient: 0 min 5 % B → 10 min 100 % B → 12 min 100 % B → 12.1 min 5 % B → 15 min 5 % B; Auswertungssoftware: Agilent ChemStation). 71 Experimenteller Teil Die chirale HPLC-Analytik wurde an einem Merck-Hitachi LaChrom System der Firma Hitachi (Tokyo, Japan) unter Verwendung einer CHIRALPAK AD-H- oder OD-H-Säule der Firma Chiral Technologies Europe (Illkirch, Frankreich) mittels UV-Detektion durchgeführt (Beobachtungswellenlänge: λ = 210 nm). Als isokratisches Lösungsmittelsystem diente isoPrOH und n-Hexan. ee-Werte [%] wurden über die Verhältnisse der Peakintegrale errechnet (Auswertungssoftware: VWR HPLC System Manager). Röntgenstrukturanalysen wurden mit einem Oxford-Diffraction Xcalibur Diffraktometer, ausgerüstet mit einem CCD area detector Sapphire S und einem Graphit Monochromator unter Nutzung der Mo-Kα Strahlung (λ = 0.71073 Å) bei 150 K aufgenommen. Allgemeine Synthesevorschriften für GC-Derivatisierungen Entfernung der Boc-Schutzgruppen: Die Aminosäuren werden mit 200 µl einer HCl-Lösung (0,1 M) aufgenommen und für 30 min auf 110 °C erhitzt. Die Lösungsmittel werden bei 110 °C im Stickstoffstrom entfernt. Derivatisierung des C-Terminus: Das Hydrochlorid-Addukt der Aminosäure wird mit einer HCl-Lösung in Ethanol (2 M) versetzt, die aus Acetylchlorid und Ethanol (abs.) im Verhältnis 1:4 erzeugt wurde. Derivatisierung des N-Terminus: Die N-terminal entschützten Aminosäuren werden in 100 µl abs. Dichlormethan gelöst und mit 50 ml Trifluoressigsäureanhydrid versetzt. Es wird für 10 min auf 110 °C erhitzt. Nachdem die Proben auf 20 °C gebracht wurden, wird das Lösungsmittel im Stickstoffstrom entfernt und der Rückstand in 100 ml Toluol (abs.) aufgenommen. 72 Experimenteller Teil 5.2 Synthesevorschriften 5.2.1. Versuch der Synthese von 2,4-Diamino-2-hydroxymethylglutarsäure aus Oxazolidinen Synthese von (4R)-4-((R)-2,3-dihydroxypropyl)-3-(R)-2-methoxy-1- phenylethyl)oxazolidin-4-carbonsäure-tert-butylester (31) O O OH OH O N O Der (R)-4-Allyl-3-((R)-2-methoxy-1-phenylethyl)oxazolidin-4carbon-säure-tert-butylester 30[102] (0,5 g; 1,44 mmol) wird in tBuOH (4,4 ml) und Wasser (4,4 ml) gelöst und bei RT mit AD-Mixβ (2 g) versetzt. Nachdem 16 h bei RT stark gerührt wurde, wird die Reaktion durch Zugabe von Na2SO3 (2 g) beendet und das Reaktionsgemisch mit EtOAc (3x10 ml) extrahiert. Die organische Phase wird mit Wasser (6 ml) und ges. NaCl-Lösung (6 ml) gewaschen und der Rückstand chromatographisch gereinigt (Hex: EtOAc; 1:1). Man erhält 0,48 g eines viskosen Öls (Ausbeute 91%). Rf 0,21 (Hex: EtOAc; 1:1) 1 H-NMR (CDCl3): 1,5 (s, 9H); 1,88 (dd, J1= 15,31 Hz, J2= 1,88 Hz, 1H); 2,09 (dd, J1= 15,38 Hz, J2= 11,08 Hz, 1H); 3,24 (s, 3H); 3,50 (dd, J1= 9,87 Hz, J2= 4,37 Hz, 1H); 3,53 (m, 1H); 3,69 (dd, J1= 11,15 Hz, J2= 3,56 Hz, 1H); 3,77 (dd, J1= 9,87 Hz, J2= 7,32 Hz, 1H); 4,08 (d, J= 9,00Hz, 1H); 4,13 (m, 1H); 4,21 (dd, J1= 5,84 Hz, J2= 3,02 Hz, 2H); 4,28 (d, J= 2,82 Hz, 1H); 4,46 (dt, J1= 7,46 Hz, J2= 3,79 Hz, 1H); 7,30 (m, 5H) 13 C-NMR (CDCl3): 28,10; 35,46; 58,56; 61,45; 67,30; 67,91; 68,42; 75,01; 77,41; 82,24; 86,56; 127,67; 128,11; 128,28; 128,35; 128,99; 139,59; 171,79 MS (ESI): 382,2227 [MH+]; 404,2042 [MNa+] [α]D = -14,3 (c = 11,35 mg/ml, T = 22,62 °C, CHCl3) 73 Experimenteller Teil Synthese von (4R)-4-((2R)-3-(tert-Butyl-dimethylsilyloxy)-2-hydroxypropyl)-3-((R)-2- methoxy-1-phenylethyl)oxazolidin-4-carbonsäure-tert-butylester (32) O O O N OTBDMS Das Diol 31 (0,48 g; 1,36 mmol) wird in DMF (6 ml) gelöst und mit Imidazol (0,13 g; 1,9 mmol) und TBDMSCl (0,2 g; 1,5 mmol) OH versetzt. Nun wird 16 h bei RT gerührt und die Reaktion durch O Zugabe von Wasser beendet. Das Reaktionsgemisch wird mit EtOAc (20 ml) verdünnt und mit ges. NaCl-Lösung (5x 15 ml) gewaschen. Die organische Phase wird getrocknet und das Lösungsmittel im Vakuum entfernt. Anschließend wird das Rohprodukt chromatographisch gereinigt (Hex: EtOAc; 5:1). Man erhält 0,43 g des gewünschten Produkts (Ausbeute 70%). Rf 0,47 (Hex: EtOAc; 3:1) 1 H-NMR (CDCl3): 0,08 (d, J= 1,34; 6H); 0,9 (s, 9H); 1,49 (s, 9H); 1,86 (dd, J1= 15,11 Hz; J2= 10,01 Hz; 1H); 2,15 (dd, J1= 15,18 Hz; J2= 1,75 Hz; 1H); 3,24 (s, 3H); 3,52 (m, 2H); 3,70 (dd, J1= 9,81 Hz; J2= 4,97; 1H); 3,77 (dd, J1= 9,81 Hz; J2= 6,98 Hz; 1H); 3,99 (m, 1H); 4,10 (d, J= 8,87 Hz; 1H); 4,18 (d, J= 8,90; 1H); 4,22 (d, J= 2,69; 1H); 4,26 (d, J= 2,69; 1H); 4,43 (dd, J1= 7,12 Hz; J2= 4,70 Hz; 1H); 7,29 (m, 5H) 13 C-NMR (CDCl3): -5,29; 25,98; 28,08; 37,05; 58,52; 61,29; 67,50; 67,98; 68,83; 75,09; 77,32; 81,90; 86,33; 127,74; 128,04; 128,23; 128,80; 139,89; 171,98 MS (ESI): 496,3093 [MH+]; 518,2911 [MNa+] Synthese von (4R)-4-((2S)-2-Azido-3-(tert-butyl-dimethylsilyloxy)-propyl)-3-((R)-2- methoxy-1-phenylethyl)oxazolidin-4-carbonsäure-tert-butylester (33) O O O N OTBDMS Der TBDMS-Ether 32 (0,5 g; 1,04 mmol) und PPh3 (0,69 g; 2,63 mmol) werden in THF (8 ml) gelöst und bei -20 °C mit DEAD N3 O (1,08 ml; 6,86 mmol) und DPPA (0,55 ml; 2,55 mmol) versetzt. Nachdem 20 h bei -20°C gerührt wurde, wird das Lösungsmittel im Vakuum entfernt und der Rückstand chromatographisch gereinigt (14:1). Man erhält 0,48 g eines Öls (Ausbeute 91%). Rf 0,18 (Hex: EtOAc; 9:1) 74 Experimenteller Teil 1 H-NMR (CDCl3): 0,13 (d, J= 1,34, 6H); 0,95 (s, 9H); 1,46 (s, 9H); 1,84 (dd, J1= 15,18 Hz, J2= 2,42 Hz, 1H); 2,15 (dd, J1= 15,3 Hz, J2= 8,87 Hz, 1H); 3,20 (s, 3H); 3,41 (dd, J1= 10,01 Hz, J2= 4,63 Hz, 1H); 3,47 (dd, J1= 10,00 Hz, J2= 6,90, 1H); 3,73 (dd, J1= 10,21 Hz, J2= 7,66 Hz, 1H); 3,83 (dd, J1= 10,10 Hz, J2= 4,30 Hz, 1H); 4,02 (m, 1H); 4,09 (d, J= 8,60 Hz, 1H); 4,18 (d, J= 8,90, 1H); 4,34 (dd, J1= 6,92 Hz, J2= 4,62 Hz, 1H); 4,26 (d, J= 2,69 Hz, 1H); 4,38 (d, J= 10,75 Hz, 1H); 7,33 (m, 5H) 13 C-NMR (CDCl3): 25,86; 28,00; 35,75; 58,56; 60,19; 60,81; 66,69; 67,51; 75,86; 76,48; 81,63; 86,11; 126,11; 127,67; 127,80; 128,46; 130,04; 140,83; 172,52 LC-MS (ESI): 521,3 [MH+] Synthese von (4R)-4-((2S)-2-Azido-3-hydroxy-propyl)-3-((R)-2-methoxy-1- phenylethyl)oxazolidin-4-carbonsäure-tert-butylester (34) O O O N OH Das Azid 34 (270 mg; 0,53 mmol) wird in THF (6,5 ml) gelöst und bei 0°C mit TBAF-Lösung (0,85 ml; 1,1 eq.) versetzt. Nachdem 4 h bei 0°C N3 O gerührt wurde, wird die Reaktion durch Zugabe von ges. NH4Cl-Lösung beendet und das Reaktionsgemisch mit EtOAc (3x) extrahiert. Die organische Phase wird getrocknet und das Lösungsmittel im Vakuum entfernt. Der Rückstand wird chromatographisch gereinigt (Hex:EtOAc; 5:1 auf 3:1). Man erhält 147 mg eines Öls (Ausbeute 71%). Rf 0,25 (Hex: EtOAc; 3:1) 1 H-NMR (CDCl3): 1,46 (s, 9H); 2,02 (m, 2H); 3,20 (s, 3H); 3,44 (dd, J1= 10,34 Hz, J2= 6,31 Hz, 1H); 3,50 (dd, J1= 10,40 Hz, J2= 3,90 Hz, 1H); 3,78 (dd, J1= 11,28 Hz, J2= 5,24 Hz, 1H); 3,83 (dd, J1= 11,30 Hz, J2= 6,24 Hz, 1H); 4,04 (m, 1H); 4,09 (d, J= 8,73, 1H); 4,21 (dd, J1= 5,84 Hz, J2= 3,02 Hz, 2H); 4,28 (d, J= 2,82, 1H); 4,33 (dd, J1= 6,18 Hz, J2= 3,90 Hz, 1H); 4,37 (m, 1H); 7,31 (m, 5H) 13 C-NMR (CDCl3): 28,05; 34,96; 58,74; 60,37; 61,07; 65,94; 66,54; 75,48; 76,85; 82,09; 86,15; 127,85; 128,02; 128,55; 140,25; 171,46 MS (ESI): 407,2294 [MH+]; 429,2110 [MNa+] [α]D = -53,3 (c = 10,65 mg/ml, T = 22,23 °C, CHCl3) 75 Experimenteller Teil Synthese von (2R,4S)-2-((R)-2-Methoxy-1-phenylethylamino)-5-(tbutyl- dimethylsilyloxy)-4-hydroxy-2-(hydroxymethyl)pentansäure-tert-butylester (35) O O Der TBDMS-Ether 32 (100 mg; 0,202 mmol) wird in THF (1 ml) OTBDMS und Wasser (2,5 ml) gelöst. Nun wird Ameisensäure(99-100 %) OH HO HN zugegeben bis pH 2 erreicht wird. Das Reaktionsgemisch wird 7 h O bei RT gerührt. Anschließend wird mit ges. K2CO3-Lösung neutralisiert und mit EtOAc extrahiert. Die organische Phase wird getrocknet und das Lösungsmittel im Vakuum entfernt. Der Rückstand wird chromatographisch gereinigt (Hex:EtOAc; 5:1 auf 1:1). Man erhält 47 mg des gewünschten Produkts (Ausbeute 48%). Rf 0,35 (Hex: EtOAc; 1:1) 1 H-NMR (CDCl3): 0,02 (s, 6H); 0,84 (s, 9H); 1,47 (m, 11H); 3,18 (m, 3H); 3,36 (s, 3H); 3,64 (m, 3H); 3,82 (dd, J1= 9,6 Hz, J2= 6,11 Hz, 2H), 7,30 (m, 5H) 13 C-NMR (CDCl3): -5,38; 25,90; 27,92; 29,71; 58,84; 64,08; 67,21; 68,26; 77,76; 127,21; 127,71; 128,63; 135,03 LC-MS (ESI): 484,3 [MH+] Synthese von (4R)-4-((2R)-3-(tert-Butyl-dimethylsilyloxy)-2-hydroxypropyl)oxazolidin-4carbonsäure-tert-butylester (37) O O OTBDMS OH O NH Der TBDMS-Ether 37 (1 g; 2,02 mmol) wird in THF (55 ml) gelöst und mit Pd/C (0,1 g) versetzt. Nun wird das Reaktionsgemisch bei RT unter H2-Atmosphäre (50 bar) 16 h gerührt. Anschließend wird der Katalysator abfiltriert und das Lösungsmittel im Vakuum entfernt. Der Rückstand wird chromatographisch gereinigt (Hex: EtOAc; 1:1). Man erhält 0,66 g (Ausbeute 80%) des gewünschten Produktes. Rf 0,41 (Hex: EtOAc; 1:1) 1 H-NMR (MeOD-d4): 0,07 (s, 6H); 0,9 (s, 9H); 1,45 (d, J= 13,37 Hz, 1H); 1,49 (s, 9H); 1,86 (d, J= 13,30 Hz, 1H); 3,52 (m, 3H); 3,65 (m, 2H); 4,37 (d, J= 10,07 Hz, 1H); 4,50 (d, J= 10,21 Hz, 1H) 76 Experimenteller Teil 13 C-NMR (MeOD-d4): -5,15; 19,19; 26,39; 28,31; 33,28; 63,31; 67,67; 68,74; 75,98; 77,36; 82,92; 173,38 LC-MS (ESI): 362,3 [MH+] Versuch zur Synthese von (2R,4R)-2-Amino-5-(tert-butyl-dimethylsilyloxy)-4-hydroxy-2(hydroxymethyl)pentansäure-tert-butylester (38) O HO O NH2 OTBDMS OH Das Oxazolidin 37 wird in MeOH (10 ml) gelöst und 2 h bei 75 °C gerührt. Nun wird das Lösungsmittel im Vakuum entfernt. Es fand keine Ringöffnung statt. Das Oxazolidin 37 (41 mg; 0,166 mmol) wird in DCM (0,5 ml) gelöst und mit 1,3Propandithiol (0,167 ml; 1,66 mmol) und Bortrifluoridetherat (0,063 ml; 0,498 mmol) versetzt. Die Reaktionslösung wird 16 h bei 75 °C gerührt. Nun wird das Lösungsmittel im Vakuum entfernt. Es fand keine Ringöffnung statt. Das Oxazolidin 37 (24 mg; 0,1 mmol) wird in THF (0,5 ml) gelöst, Natriumborhydrid (38 mg; 1 mmol) suspendiert in THF (0,5 ml) zugegeben und das Reaktionsgemisch 16 h bei RT gerührt. Anschließend wird die Reaktion durch Zugabe von 5% HCl beendet. Das gewünschte Reaktionsprodukt konnte nur in Spuren gefunden werden, das Hauptprodukt ist die N-Methyl-Aminosäure. Das Oxazolidin 37 wird in MeOH (20 ml) gelöst und mit HCl/Dioxan (4M; 0,25 ml) versetzt. Nun wird das Reaktionsgemisch 2 h bei 70 °C refluxiert. Das gewünschte Reaktionsprodukt konnte nicht isoliert werden. Es fand lediglich eine vollständige TBDMS-Abspaltung (0,21 g) statt. Synthese von Benzylmagnesiumbromid (142) MgBr In wasserfreiem Diethylether (5 ml) werden Mg-Späne (1,21 g; 0,05 mol) suspendiert. Nun wird Brombenzol (0,26 ml) zugeben bis eine braune Lösung entsteht, anschließend wird weiteres Brombenzol (5 ml) gelöst in wasserfreiem Diethylether (15 ml) langsam zutropft. Die Reaktionslösung wird 1 h bei 35 °C gerührt, anschließend wird die Lösung mit Diethylether (96 ml) verdünnt und direkt weiter verwendet. 77 Experimenteller Teil Synthese von (2R,4S)-2-((R)-Benzyl-2-methoxy-1-phenylethylamino)-4-azido-5-tert- butyl-dimethylsilyloxy)-2-(hydroxymethyl)pentansäure-tert-butylester (39) O N HO Das Azid 33 (137 mg; 0,26 mmol) wird in wasserfreiem OTBDMS O Diethylether (10 ml) gelöst und bei 0°C langsam mit einer N3 Benzylmagnesiumbromidlösung (3 M; 0,26 ml; 3 eq.) versetzt. O Nachdem die Reaktionslösung 2 h bei 0 °C gerührt wurde, wird die Ph Reaktion durch Zugabe von ges. NH4Cl-Lösung beendet und das Reaktionsgemisch mit DCM (3x) extrahiert. Das Rohprodukt wird chromatographisch gereinigt (Hex: EtOAc; 14:1 auf 9:1). Man erhält 40 mg eines gelben Öls (Ausbeute 26%). Rf 0,27 (Hex: EtOAc; 14:1) 1 H-NMR (CDCl3): 0,10 (s, 6H); 0,92 (s, 9H); 1,41 (s, 4H); 1,96 (dd, J1= 13,43 Hz, J2= 8,72 Hz, 1H); 2,08 (m, 1H); 3,22 (s; 3H); 3,52 (d, J= 15,85 Hz, 1H); 3,66 (m, 2H); 3,81 (m, 2H); 3,91 (m, 2H); 4,32 (dd, J1= 10,28 Hz, J2= 1,54 Hz, 1H); 4,32 (dd, J1= 10,21 Hz, J2= 4,84 Hz, 1H); 7,25 (m, 10H) 13 C-NMR (CDCl3): -5,52; 18,15; 25,74; 27,86; 27,86; 33,71; 49,99; 57,69; 58,36; 60,24; 62,88; 67,45; 69,85; 73,94; 82,09; 126,96; 127,43; 127,98; 128,03; 128,24; 129,32; 137,80; 142,26; 172,40 LC-MS (ESI): 599,3 [MH+] Synthese von (2R)-2-((R)-Benzyl-2-methoxy-1-phenylethylamino)-2- (hydroxymethyl)pent-4-ensäure-tert-butylester (40) O Das Allyl-Oxazolidin 30 (0,41 g; 1,18 mmol) wird in wasserfreiem O Diethylether gelöst und bei 0 °C mit einer BenzylmagnesiumbromidN HO O Lösung (3,5 M; 1 ml; 3 eq.) versetzt und bei 0°C gerührt. Nach 2 h wird die Reaktion durch Zugabe von ges. NH4Cl-Lösung beendet und das Ph Reaktionsgemisch mit DCM (3x) extrahiert. Die organische Phase wird getrocknet und das Lösungsmittel im Vakuum entfernt. Der Rückstand wird chromatographisch gereinigt (Hex: EtOAc; 14:1 auf 9:1). Man erhält 286 mg eines gelben Öls (Ausbeute 57%). Rf 0,40 (Hex: EtOAc; 5:1) 78 Experimenteller Teil 1 H-NMR (CDCl3): 1,38 (s, 9H); 2,65 (dd, J1= 12,09 Hz, J2= 7,25 Hz, 1H); 2,82 (dd, J1= 12,09 Hz, J2= 7,25 Hz, 1H); 3,24 (s, 3H); 3,30 (m, 2H); 3,63 (d, J= 15,85 Hz, 1H); 3,78 (d, J= 16,12 Hz, 1H); 3,81 (d, J= 6,85 Hz, 1H); 4,45 (ddd, J1= 12,36 Hz, J2= 6,58 Hz, J3= 6,31 Hz, 1H); 4,59 (dd, J1= 9,94 Hz, J2= 4,97 Hz, 1H); 5,13 (dd, J1= 10,07 Hz, J2= 2,01 Hz, 1H); 5,22 (dd, J1=16,52 Hz, J2= 1,48 Hz, 1H); 5,76 (m, 1H); 7,27 (m, 10H) 13 C-NMR (CDCl3): 28,13; 37,90; 50,67; 58,02; 58,34; 62,61; 71,74; 73,87; 81,78; 119,28; 126,92; 127,35; 128,00; 128,15; 128,19; 129,18; 132,27; 142,20; 172,51 MS (ESI): 426,2643 [MH+]; 448,2458 [MNa+] Synthese von (2R)-2-((R)-Benzyl-2-methoxy-1-phenylethylamino)-2- ((methoxymethoxy)methyl)pent-4-ensäure-tert-butylester (41) 40 (270 mg; 0,63 mmol) wird in DCM (4 ml) gelöst und bei 0°C mit O O MOMO N Ph Tetrabutylammoniumiodid (24 mg), DIPEA (1,1 ml; 6,3 mmol) und MOM-Cl O (0,25 ml; 3,15 mmol) versetzt. Nun wird die Reaktionslösung auf RT erwärmt und unter Lichtausschluss gerührt. Nach 3 d wird das Reaktionsgemisch mit ges. NaHCO3-Lösung (5 ml) und Diethylether (10 ml) versetzt. Die Phasen werden getrennt und die wässrige Phase mit Diethylether (3x 10 ml) extrahiert. Nun wird die vereinigte organische Phase mit 1% HCl-Lösung und ges. NaCl-Lösung gewaschen. Das Lösungsmittel wird im Vakuum entfernt und der Rückstand chromatographisch gereinigt (Hex: EtOAc; 9:1). Man erhält 170 mg eines gelben Öls (Ausbeute 67 %). Rf 0,64 (Hex: EtOAc; 5:1) 1 H-NMR (CDCl3): 1,41 (s, 9H); 2,65 (dd, J1= 13,84 Hz, J2= 7,52 Hz, 1H); 2,81 (dd, J1= 13,45 Hz, J2= 7,46 Hz, 1H); 3,15 (s, 3H); 3,23 (s, 3H); 3,34 (d, J= 9,67 Hz, 1H); 3,50 (m, 1H); 3,63 (d, J= 15,85 Hz, 1H); 3,70 (s, 2H); 4,10 (d, J= 17,46 Hz, 1H); 4,33 (d, J1= 17,50 Hz, 1H); 4,43 (m, 2H); 5,09 (m, 2H); 5,82 (m, 1H); 7,23 (m, 10H) 13 C-NMR (CDCl3): 28,01; 37,55; 48,74; 55,48; 61,48; 69,24; 70,04; 74,52; 81,40; 96,91; 118,53; 126,10; 127,01; 127,08; 127,86; 127,93; 129,31; 133,73; 140,27; 143,98; 172,52 MS (ESI): 470,2903 [MH+]; 492,2720 [MNa+] 79 Experimenteller Teil Synthese von (2R,4R)-2-((R)-Benzyl-2-methoxy-1-phenylethylamino)-2- ((methoxymethoxy)methyl)-4,5-dihydroxy-pentansäure-tert-butylester (42) Der MOM-Ether 41 (0,17 g; 0,36 mmol) wird in einem Gemisch aus tBuOH und Wasser (je 4,4 ml) gelöst und mit AD-Mix β (0,5 g) O O MOMO N OH versetzt. Nun wird kräftig gerührt und nach 24 h nochmals AD-Mixβ (0,5 g) zugegeben. Nach weiteren 24 h wird die Reaktion durch OH O Ph Zugabe von Na2SO3 beendet. Die Reaktionslösung wird mit Wasser verdünnt und mit EtOAc (3x) extrahiert. Die organische Phase wird mit ges. NaCl-Lösung gewaschen und getrocknet. Anschließend wird das Lösungsmittel im Vakuum entfernt und das Rohprodukt chromatographisch gereinigt (Hex: EtOAc; 3:1 auf 1:1). Man erhält 125 mg eines gelben Öls (Ausbeute 72%). Rf 0,12 (Hex: EtOAc; 1:1) 1 H-NMR (CDCl3): 1,13 (s, 9H); 2,38 (m, 2H); 3,20 (s, 3H); 3,23 (s, 3H); 3,35 (m, 3H); 3,47 (m, J= 8,73 Hz, 3H); 3,85 (d, J= 9,95 Hz, 1H); 3,93 (d, J= 9,94 Hz, 1H); 4,38 (m, 4H); 4,78 (dd, J1= 9,47 Hz, J2= 4,90 Hz, 1H); 7,23 (m, 10H) 13 C-NMR (CDCl3): 27,69; 34,60; 48,36; 55,78; 61,19; 67,27; 67,75; 69,51; 71,68; 74,13; 81,39; 97,12; 126,57; 126,97; 127,22; 127,73; 128,06; 128,37; 129,32; 138,37; 143,31; 172,38 MS (ESI): 504,2959 [MH+]; 526,2774 [MNa+] Synthese von (2R,4R)-2-((R)-Benzyl-2-methoxy-1-phenylethylamino)-5-(tert-butyl- dimethylsilyloxy)-4-hydroxy-2-(hydroxymethyl)pentansäure-tert-butylester (43) O O OTBDMS OH N MOMO Ph O Das Diol 42 (115 mg; 0,23 mmol) wird in DMF (1,1 ml) gelöst und mit Imidazol (23 mg; 35 mmol) und TBDMSCl (38 mg; 25 mmol) versetzt. Nachdem die Lösung 16 h bei RT gerührt wurde, wird die Reaktion durch Zugabe von Wasser beendet. Das Reaktionsgemisch wird mit EtOAc (20 ml) verdünnt und mit ges. NaCl-Lösung (5x) gewaschen. Die organische Phase wird getrocknet und das Lösungsmittel im Vakuum entfernt. Der Rückstand wird chromatographisch gereinigt (Hex: EtOAc; 5:1). Man erhält 92 mg eines gelben Öls (Ausbeute 73%). 80 Experimenteller Teil 1 H-NMR (CDCl3): 0,00 (d, J= 3,76 Hz, 1H); 0,04 (d, J= 5,24 Hz, 1H); 0,87 (s, 5H); 0,88 (s, 4H); 1,29 (s, 6H); 1,43 (s, 4H); 1,95 (dd, J1= 14,20 Hz, J2= 1,75 Hz, 0,3H); 2,06 (dd, J1= 15,50 Hz, J2= 10,41 Hz, 0,3H); 2,15 (dd, J1= 15,45 Hz, J2= 2,82 Hz, 0,6H); 2,22 (dd, J1= 15,15 Hz, J2= 7,66 Hz, 0,6H); 3,17 (s, 1,8H); 3,19 (s, 1,2H); 3,22 (s, 1,8H); 3,26 (s, 1,2H); 3,34 (dd, J1= 9,87 Hz, J2= 7,05 Hz, 1H); 3,49 (m, 1H); 3,58 (m, 1H); 3,67 (m, 1H); 4,25 (dd, J1= 16,95 Hz, J2= 14,71 Hz, 1H); 4,38 (m, 2H); 4,47 (dd, J1=16,55 Hz, J2= 6,39 Hz, 1H); 4,64 (t, J= 5,24 Hz, 1H); 7,25 (m, 10H) 13 C-NMR (CDCl3): -5,39; -5,29; 25,90; 25,97; 27,85; 27,99; 35,67; 48,77; 48,92; 55,69; 58,40; 58,55; 60,98; 61,47; 67,50; 68,06; 68,14; 68,69; 70,17; 70,26; 71,09; 73,88; 74,38; 81,42; 97,11; 126,16; 126,29; 127,04; 127,18; 127,32; 127,36; 127,89; 128,04; 128,08; 128,12; 129,38; 129,47; 172,61 Versuch zur Synthese von (2R,4S)-2-((R)-Benzyl-2-methoxy-1-phenylethylamino)-4Azido-5-(tbutyl-dimethylsilyloxy)-2-(hydroxymethyl)pentansäure-tert-butylester (44) O O MOMO N Ph OTBDMS Der MOM-Ether 43 (90 mg; 0,146 mmol) und Triphenylphosphin (96 mg; 0,366 mmol) werden in THF N3 O (1,3 ml) gelöst und bei -20°C mit DEAD (169 µl; 1,077 mmol) und DPPA (78 µl; 0,362 mmol) versetzt. Nachdem 20 h bei -20 °C gerührt wurde, wird das Lösungsmittel im Vakuum entfernt. Das gewünschte Produkt konnte nicht isoliert werden. 81 Experimenteller Teil 5.2.2. Synthese von 2,4-Diamino-2-hydroxymethylglutarsäure aus Pyrazolderivaten Synthese von 2-Hydroxymethylacrylsäure-tert-butylester (49)[158] HO CO2tBu Paraformaldehyd (2 g; 0,066 mol) wird in einem THF-Wasser-Gemisch (je 4,5 ml) suspendiert und mit 1 N Phosphorsäure (0,24 ml) versetzt. Nun wird 2 h bei 80°C gerührt. Nachdem die Reaktionslösung auf 40°C abgekühlt wurde, wird die Reaktionslösung mit DABCO (0,74 g; 0,1 eq.) und Acrylsäure-tbutylester (1,9 ml; 0,2 eq.) versetzt. Nachdem 16 h bei 60°C gerührt wurde, wird die Reaktion durch Zugabe von ges. NaCl-Lösung beendet und mit Diethylether extrahiert. Die organische Phase wird getrocknet und das Lösungsmittel im Vakuum entfernt. Der Rückstand wird chromatographisch gereinigt (Hex: EtOAc; 9:1 auf 3:1). Man erhält 0,44 g eines farblose Öls (Ausbeute 21%). Rf 0,4 (Hex: EtOAc; 3:1) 1 H-NMR (CDCl3): 1,48 (s, 9H); 4,19 (t, J= 1,54 Hz, 2H); 5,81 (q, J=1,73 Hz, 1H); 6,19 (q, J=1,34 Hz, 1H) 13 C-NMR (CDCl3): 28,05; 68,97; 80,92; 124,47; 138,62 MS(ESI): 159,1012 [MH+] ; 181,0829 [MNa+] Synthese von Diazoessigsäureethylester (50)[159] N2 CO2Et H-Gly-OEt*HCl (8 g; 47,88 mol) wird in Wasser (10 ml) gelöst und mit Diethylether (10 ml) versetzt. Nun wird eine NaNO2-Lösung (5,8 g in 14 ml Wasser) gefolgt von 4 N Schwefelsäure (0,57 ml) zugesetzt. Das Reaktionsgemisch wird 1 min im Scheidetrichter geschüttelt und die gelbe Etherphase in einen Kolben mit Na2CO3-Lösung überführt. Nun wird die wässrige Phase nochmals mit 4 N Schwefelsäure (0,57 ml) versetzt und die Phasen wieder getrennt. Dieser Vorgang wird so lange wiederholt bis keine Färbung der organischen Phase mehr auftritt. Die organische Phase wird mit 1 N NaHCO3-Lösung gewaschen bis keine Färbung der wässrigen Phase mehr beobachtet wird. Nun wird die organische Phase getrocknet und das Lösungsmittel im Vakuum bei 20°C entfernt. Man erhält 4,5 g (Ausbeute 69%) einer gelben Flüssigkeit. Rf 0,62 (Hex: EtOAc; 3:1) 1 H-NMR (CDCl3): 1,86 (t, J= 7,12 Hz, 3H); 4,20 (q, J= 7,12 Hz, 2H); 4,70 (br, 1H) 82 Experimenteller Teil 13 C-NMR (CDCl3): 14,39; 46,06; 60,81; 166,77 MS(EI): 114,0947 [M+] Synthese von rac-5-tert-Butyl-3-ethyl-4,5-dihydro-5-(hydroxymethyl)-1H-pyrazol-3,5dicarboxylat (51) EtO2C OH N N H CO2tBu In einen Reaktionskolben werden Diazoessigsäureethylester (50) (0,114 g; 1 mmol), 2-Hydroxymethylacrylsäure-tbutylester (49) (0,156 g; 1 mmol) und DABCO (0,011 g; 1 mmol) gegeben und 16 h bei RT gerührt. Nun wird das Reaktionsgemisch chromatographisch gereinigt (Hex: EtOAc; 3:1 auf 1:1). Man erhält 203 mg (Ausbeute 75%) eines gelben Öls. Rf 0,32 (Hex: EtOAc; 1:1) 1 H-NMR (CDCl3): 1,33 (t, J= 7,12 Hz, 3H); 1,46 (s, 9H); 3,03 (d, J= 18,00 Hz, 1H); 3,29 (d, J= 18,00 Hz, 1H); 3,68 (d, J= 11,15 Hz, 1H); 3,79 (d, J= 11,15 Hz, 1H); 4,29 (q, J= 7,12 Hz, 2H); 6,79 (s, 1H) 13 C-NMR (CDCl3): 14,19; 27,91; 37,44; 61,39; 65,32; 74,11; 83,56; 143,61; 161,91; 171,31 MS(ESI): 273,1441[MH+]; 295,1261 [MNa+] Synthese von rac-2,4-Diamino-1-tert-butyl-5-ethyl -2-(hydroxymethyl)-1,5-dicarboxylat (52) Das Pyrazol 51 (10 mg; 0,037 mmol) wird in Methanol (0,8 ml) gelöst EtO 2 C OH H2N H 2N CO 2 tBu und mit Essigsäure (0,1 ml) versetzt. Nun wird Raney-Nickel zugesetzt und 16 h unter Wasserstoffatmosphäre (50 bar) gerührt. Die Reaktion wurde mittels LC-MS untersucht und die gewünschte Produktmasse gefunden, das Produkt konnte aber nicht isoliert werden. MS(ESI): 277,1732 [MH+] 83 Experimenteller Teil Synthese von rac-N-Boc-5-tert-Butyl-3-ethyl-4,5-dihydro-5-(tert-butyloxymethyl)- pyrazol-3,5-dicarboxylat (53) EtO2C OtBu N N Boc CO2tBu Das Pyrazolderivat 51 (30 mg; 0,11 mmol) wird in DCM (0,7 ml) gelöst und mit TEA (3 µl; 0,14 eq.), Boc2O (50 µl; 2 eq.) und DMAP (13 mg; 1 eq.) versetzt. Nun wird 16 h bei RT gerührt. Anschließend wird das Lösungsmittel im Vakuum entfernt und der Rückstand chromatographisch gereinigt (Hex: EtOAc; 7:1 auf 5:1). Man erhält 24 mg (Ausbeute 51%) eines gelben Öls. Rf 0,61 (Hex: EtOAc; 2:1) H-NMR (CDCl3): 1,35 (t, J= 7,12 Hz, 3H); 1,44 (s, 9H); 1,45 (s, 9H); 1,53 (s, 9H); 3,28 (d, J= 18,40 Hz, 1H); 3,41 (d, J= 18,60 Hz, 1H); 4,31 (m, 3H); 4,85 (d, J= 11,82 Hz, 1H) 13 C-NMR (CDCl3): 14,12; 27,65; 27,83; 28,05; 61,86; 66,06; 70,18; 82,67; 83,39; 143,28; 153,06; 167,89 Versuch zur Synthese von rac-2-Boc-2,4-Diamino-1-tert-butyl-5-ethyl -2- (hydroxymethyl)-1,5-dicarboxylat (54) EtO2C OtBu H2 N BocHN CO2tBu Das Pyrazol 53 (10 mg; 0,023 mmol) wird in Methanol (0,8 ml) gelöst. Nun wird Raney-Nickel zugesetzt und 16 h Wasserstoffatmosphäre (50 bar) gerührt. Das Produkt konnte nicht identifiziert werden. 84 unter Experimenteller Teil 5.2.3. Synthese von 2,4-Diamino-2-hydroxymethylglutarsäure aus γ-Methylenglutaminsäure Synthese von 2-Hydroxymethylacrylsäuremethylester (56)[160] OH CO2Me Acrylsäuremethylester (90 ml; 990 mmol), Formaldehyd (30%; 37,2 ml; 495 mmol), Triethylamin (83,55 ml, 600 mmol) und Wasser (15 ml) werden in einem Kolben vorgelegt und bei 60°C gerührt. Nach 16 h wird die Reaktion durch die Zugabe von eiskaltem Wasser beendet und das Reaktionsgemisch im Vakuum eingeengt. Nun wird mit Ethylacetat (3x150 ml) extrahiert. Die organische Phase wird mit ges. NaCl-Lösung und Wasser gewaschen, anschließend getrocknet und das Lösungsmittel im Vakuum entfernt. Man erhält 20,6 g (Ausbeute 35,9 %) eines farblosen Öls. Rf 0,38 (Hex: EtOAc; 2:1) 1 H-NMR (CDCl3): 3,79 (s, 3H); 4,33 (s, 2H); 5,84 (q, J=1,34 Hz, 1H); 6,26 (td, J1= 1,01 Hz, J2=0,81 Hz, 1H) 13 C-NMR (CDCl3): 51,88; 62,53; 125,80; 139, 36 MS(CID): 117,0533 [M+] Synthese von 2-Brommethylacrylsäuremethylester (57)[160] Br CO2Me 2-Hydroxymethylacrylsäuremethylester (56) (10 g; 86,15 mmol) wird in DCM (120 ml) gelöst und bei 0°C langsam mit einer 48%igen Bromwasserstofflösung (35,2 ml) versetzt. Nach Beendigung der Zugabe wird weitere 5 min gerührt und anschließend konz. Schwefelsäure (32,2 ml) ebenfalls bei 0°C langsam zugetropft. Nachdem 1 h bei 0°C gerührt wurde, wird das Kühlbad entfernt und 12 h bei RT gerührt. Nun wird die Reaktion durch Zugabe von eiskaltem Wasser beendet und die Reaktionslösung mit DCM (4x500 ml) extrahiert. Die organische Phase wird mit Wasser und ges. NaCl-Lösung gewaschen, anschließend getrocknet und das Lösungsmittel im Vakuum entfernt. Der Rückstand wird chromatographisch gereinigt (Hex: EtOAc; 14:1). Man erhält eine klare, farblose Flüssigkeit (11,4 g; Ausbeute 74 %). Rf 0,79 (Hex: EtOAc; 2:1) 85 Experimenteller Teil 1 H-NMR (CDCl3): 3,79 (s, 3H); 4,16 (d, J=0,81 Hz, 2H); 5,84 (d, J=0,81 Hz, 1H); 6,31 (d, J= 0,54 Hz, 1H) 13 C-NMR (CDCl3): 29,18; 52,22; 129,14; 137, 30;165,26 Synthese von Cbz-Glycin-tert-butylester (59) O O N H O O H-Gly-OtBu*HCl (5 g; 29,9 mmol) wird in einer ges. NaHCO3-Lösung (770 ml) gelöst und mit Cbz-Cl (9 ml) versetzt. Nun wird 16 h bei RT gerührt und anschließend mit Ethylacetat (4x100 ml) extrahiert. Die organische Phase wird getrocknet und das Lösungsmittel im Vakuum entfernt. Der Rückstand wird chromatographisch gereinigt (Hex: EtOAc; 5:1). Man erhält 7,23 g (Ausbeute 91 %) einer farblosen Flüssigkeit. Rf 0,5 (Hex: EtOAc; 3:1) 1 H-NMR (CDCl3): 1,45 (s, 9H); 3,85 (d, J=5,24 Hz; 2H); 5,11 (s, 2H); 5,27 (br; 1H); 7,32 (m, 5H) 13 C-NMR (CDCl3): 28,04; 43,44; 66,96; 82,22; 136,36, 156,25 MS (ESI): 266,1384 [MH+]; 288,1203 [MNa+] Synthese von Glycin-tert-butylester (60) O H2N O Cbz-Gly-OtBu 59 (6,5 g; 24,5 mmol) wird in Ethylacetat (70 ml) gelöst und mit Pd/C (10%; 500 mg) versetzt. Nun wird mit Stickstoff gespült und der Reaktionskolben mit Wasserstoff gefüllt. Nachdem 16 h bei RT gerührt wurde, wird die Reaktionslösung filtriert und das Lösungsmittel im Vakuum entfernt. Man erhält 3,2 g eines farblosen Öls in quantitativer Ausbeute. Rf 0,51 (CHCl3: MeOH; 9:1) 1 H-NMR (CDCl3): 1,44 (s, 9H); 3,29 (s, 2H) 13 C-NMR (CDCl3): 28,08; 44,70; 81,00; 173,54 MS (ESI): 132,1019 [MH+]; 154,0838 [MNa+] 86 Experimenteller Teil Synthese von 2-((E)-((1R,2R,5R)-2-hydroxy-2,6,6-trimethylbicyclo[3.1.1]heptan-3yliden)amino) essigsäure-tert-butylester (62)[114] HO N CO2tBu H-Gly-OtBu (60) (2,7 g; 20,6 mmol) wird in Benzol (40 ml) gelöst und mit (1R,2R,5R)-2-Hydroxypinanon (1,85 g; 11 mmol) und Bortrifluoridetherat (0,063 ml) versetzt. Nun wird 20 h unter Wasserabscheidung refluxiert (95°C). Das Lösungsmittel wird im Vakuum entfernt und der Rückstand chromatographisch gereinigt (Hex: EtOAc; 5:1 auf 3:1). Man erhält 3,09 g (Ausbeute 99 %) eines leicht gelben Öls. Rf 0,22 (Hex: EtOAc; 3:1) 1 H-NMR (CDCl3): 0,84 (s, 3H); 1,30 (s, 3H); 1,46 (s, 9H); 1,49 (s, 3H); 1,54 (d, J= 10,61 Hz, 1H); 2,00 (ddd, J1= 8,76 Hz, J2= 5,88 Hz, J3= 2,96 Hz, 1H); 2,05 (t, J= 5,91 Hz, 1H); 2,31 (m, 1H); 2,45 (dd, J1= 6,58 Hz, J2= 2,96 Hz, 1H); 4,40 (q, J= 1,07 Hz, 1H) 13 C-NMR (CDCl3): 22,90; 27,31; 28,09; 28,12; 38,26; 38,55; 50,25; 53,42; 76,50; 81,32; 169,33; 179,67 MS (ESI): 282,2053 [MH+]; 304,1873 [MNa+] [α]D = 0,4405 ° (c = 13,6 mg/ml, T = 22,6 °C, EtOAc)[161] Synthese von (S)-1-tert-Butyl-5-methyl-2-((E)-((1R,2R,5R)-2-hydroxy-2,6,6- trimethylbicyclo[3.1.1]heptan-3-yliden)amino)-4-methylenpentandioat (63) Diisopropylamin (0,6 ml; 4,27 mmol) wird in THF (18 ml) gelöst CO2Me HO N CO2tBu und bei -30°C mit 2,2 M nButhyllithium-Lösung (1,48 ml) versetzt. Nachdem 1 h bei -30°C gerührt wurde, wird auf -85°C herabgekühlt. Währenddessen wird die Schiff´sche Base 62 (0,92 g; 3,26 mmol) gelöst in THF (12 ml) bei 0°C mit einer Methylmagnesiumbromid-Lösung (3 M; 1,62 ml) versetzt und bei 0°C gerührt bis keine Gasentwicklung mehr beobachtet werden kann. Nun wird diese Lösung zur LDA-Lösung gegeben. Nachdem 1 h bei -85°C gerührt wurde, wird 2-Brommethylacrylsäuremethylester (57) (0,72 ml) zugegeben und weitere 4 h bei -85°C gerührt. Über einen Zeitraum von 12 h wird die Lösung auf -30°C erwärmt. Durch Zugabe von ges. NH4Cl-Lösung wird die Reaktion beendet und mit Ethylacetat (4x10 ml) extrahiert. Das Lösungsmittel wird im Vakuum entfernt und der Rückstand chromatographisch gereinigt (Hex: EtOAc; 7:1 auf 3:1). Man erhält 1,02 g (Ausbeute 82 %) eines gelben Öls. 87 Experimenteller Teil Rf 0,26 (Hex: EtOAc; 5:1) ee = 98% (GC-MS) 1 H-NMR (CDCl3): 0,77 (s, 3H); 0,94 (dd, J1= 13,70 Hz, J2= 6,45 Hz, 1H); 1,29 (s, 3H); 1,41 (s, 3H); 1,43 (s, 9H); 1,52 (d, J= 10,61 Hz, 1H); 1,98 (ddd, J1= 8,50 Hz, J2= 5,68 Hz, J3= 2,62 Hz, 1H); 2,03 (t, J= 5,91 Hz, 1H); 2,29 (m, 1H); 2,39 (dt, J1= 17,93 Hz, J2= 2,18 Hz, 1H); 2,59 (dd, J1= 17,87 Hz, J2= 2,96 Hz, 1H); 2,71 (dd, J1= 13,57 Hz, J2= 9,00 Hz, 1H); 3,00 (dd, J1= 13,16 Hz, J2= 5,37 Hz, 1H); 3,72 (s, 3H); 4,40 (dd, J1= 9,00 Hz, J2= 4,97 Hz, 1H); 5,63 (d, J= 0,81 Hz, 1H); 6,16 (d, J= 1,48 Hz, 1H) 13 C-NMR (CDCl3): 22,70; 27,30; 28,04; 28,36; 33,31; 35,70; 38,22; 38,32; 50,06; 51,84; 61,22; 76,53; 81,48; 128,49; 136,43 MS(ESI) :380,2435 [MH+]; 402,2252 [MNa+] [α]D = 104,6 (c = 7,6 mg/ml; T = 23,8 °C; EtOAc)[161] Synthese von (S)-1-tert-Butyl-5-methyl-2-amino-4-methylenpentandioat (64) CO2Me H2N CO2tBu 63 (0,36 g; 1,293 mmol) wird in THF (2,2 ml) gelöst und mit 15%iger Zitronensäure (1,78 ml) versetzt. Nun wird 2 d bei RT gerührt, anschließend mit Wasser (10 ml) verdünnt und mit Diethylether (3x10 ml) gewaschen. Nun wird mit ges. NaHCO3-Lösung auf pH 7-8 eingestellt und mit Diethylether (5x 10 ml) extrahiert. Die organische Phase wird getrocknet und das Lösungsmittel im Vakuum entfernt. Man erhält 155 mg (72 %) eines farblosen Öls. Rf 0,16 (Hex: EtOAc; 1:1) ee = 98 % (GC-MS) 1 H-NMR (CDCl3): 1,43 (s, 9H); 2,48 (ddd, J1= 13,90 Hz, J2= 8,26 Hz, J3= 1,07 Hz, 1H); 2,70 (ddd, J1= 13,90 Hz, J2= 6,11 Hz, J3= 1,07 Hz, 1H); 3,56 (dd, J1= 8,26 Hz, J2= 6,11 Hz, 1H); 3,75 (s, 3H); 5,63 (q, J= 1,21 Hz, 1H); 6,23 (d, J= 1,48 Hz, 1H) 13 C-NMR (CDCl3): 28,02; 37,97; 51,93; 53,96; 81,32; 127,64; 136,85 MS (ESI): 230,1379 [MH+]; 272,1122 [MNa+] [α]D = 6,3 (c = 21,9 mg/ml; T = 23,1 °C; EtOAc)[161] 88 Experimenteller Teil Synthese von (S)-1-tert-Butyl-5-methyl-2-(Boc-amino)-4-methylenpentandioat (65) 1-tert-Butyl-5-methyl-2-amino-4-methylenpentandioat (64) (155 mg; CO2Me BocHN CO2tBu 0,676 mmol) wird in DCM (4,7 ml) gelöst und mit Boc2O (0,16 ml) versetzt. Nun wird 16 h bei RT gerührt, anschließend wird das Lösungsmittel im Vakuum entfernt und der Rückstand chromatographisch gereinigt (Hex; EtOAc; 9:1). Man erhält 202 mg (Ausbeute 91 %) eines farblosen Öls. Rf 0,55 (Hex: EtOAc; 3:1) ee = 72 % (GC-MS) 1 H-NMR (CDCl3): 1,41 (s, 9H); 1,43 (s, 9H); 2,62 (dd, J1= 13,90 Hz, J2= 8,40 Hz, 1H); 2,75 (dd, J1= 14,10 Hz, J2= 5,64 Hz, 1H); 3,76 (s, 3H); 4,35 (q, J= 6,45 Hz, 1H); 5,10 (d, J= 8,46 Hz, 1H) ; 5,63 (d, J= 1,07 Hz, 1H); 6,23 (s, 1H) 13 C-NMR (CDCl3): 27,98; 28,28; 35,23; 52,04; 53,37; 79,59; 82,09; 128,12; 136,06; 155,18; 167,17; 171,06 MS(ESI) :330,1901 [MH+]; 352,1717 [MNa+] [α]D = 3,4 (c = 9,5 mg/ml; T = 23,2 °C; EtOAc)[161] Synthese von (2S,4S)-5-tert-Butyl-1-methyl-4-(Boc-amino)-2-hydroxy-2(hydroxymethyl)pentandioat (66) HO OH CO2Me BocHN CO2tBu Die Boc-geschütze Aminosäure 65 (200 mg; 0,607 mmol) wird einem tBuOH–Wassergemisch (je 1 ml) gelöst und bei 0° C mit AD-Mixβ (0,84 g) gelöst in einem tBuOH–Wasser Gemisch (je 2 ml) versetzt. Nachdem 3 d bei 0°C gerührt wurde, wird die Reaktion durch Zugabe von Na2SO3 beendet und das Reaktionsgemisch mit Ethylacetat (4x10 ml) extrahiert. Die organische Phase wird getrocknet und das Lösungsmittel im Vakuum entfernt. Man erhält 207 mg (Ausbeute 94 %) eines farblosen Feststoffs als ein Gemisch aus Diastereomeren. Rf 0,25 (Hex: EtOAc; 1:1) de = 80 % (NMR) 1 H-NMR (CDCl3):1,44 (s, 9H); 1,45 (s, 9H); 2,09 (m, 2H); 3,59 (dd, J1= 20,08 Hz, J2= 11,35 Hz, 1H); 3,71 (m, 1H); 3,77 (s, 3H); 4,45 (m, 1H); 4,98 (d, J= 8,87 Hz, 1H) 13 C-NMR (CDCl3): 27,91; 28,31; 37,71; 49,88; 52,89; 68,59; 76,42; 80,62; 82,53; 155,99; 171,45; 174;63 89 Experimenteller Teil + + MS(ESI) :364,1970 [MH ]; 386,1788 [MNa ] [α]D =-3,3 (c = 10,34 mg/ml; T = 24,1 °C; DCM) Synthese von (2S,4S)-5-tert-Butyl-1-methyl-λ4-2-[1,3,2]dioxathiolan-[4]-carbacyclo-4(Boc-amino)-pentandioat (68) O SO O CO2Me BocHN CO2tBu Das Diol 67 (40 mg; 0,11 mmol) wird in Tetrachlormethan (1 ml) gelöst und mit frisch destilliertem Thionylchlorid (0,012 ml; 0,165 mmol) versetzt. Nun wird 16 h bei 80°C gerührt. Die Reaktionslösung wird mit Triethylamin neutralisiert und das Lösungsmittel im Vakuum entfernt. Der Rückstand wird chromatographisch gereinigt (Hex: EtOAc; 3:1). Man erhält 28 mg (Ausbeute 62 %) eines braunen Öls. Das Diol 67 (120 mg; 0,33 mmol) wird in DCM (1 ml) gelöst und bei 0°C mit NEt3 (0,1 ml) versetzt. Nun wird frisch destilliertes Thionylchlorid (0,036 ml; 0,5 mmol) zugegeben und bei 0°C gerührt. Nach 45 min wird die Reaktion durch Zugabe von Wasser beendet und das Reaktionsgemisch mit DCM extrahiert. Die organische Phase wird getrocknet und das Lösungsmittel im Vakuum entfernt. Der Rückstand wird chromatographisch gereinigt (Hex: EtOAc; 5:1). Man erhält 111 mg (Ausbeute 82%) eines braunen Öls. Rf 0,27 (Hex: EtOAc; 3:1) MS (ESI): 410,1471 [MH+]; 432,1289 [MNa+] Synthese von (2S,4R)-1-tert-Butyl-2-tert-butyl-4-azido-4-(hydroxymethyl)-5oxopyrrolidin-1,2-dicarboxylat (69b) HO Das zyklische Sulfit 68 (291 mg; 0,713 mmol) wird in DMF (3,6 ml) N3 O tBuO 2C N Boc gelöst und mit Natriumazid (69 mg; 1,07 mmol) versetzt. Die Reaktionslösung wird 3 d bei 50°C gerührt. Nun wird mit Ethylacetat verdünnt und mit ges. NaCl-Lösung gewaschen. Das Lösungsmittel wird im Vakuum entfernt. Der Rückstand wird chromatographisch gereinigt (Hex:EtOAc; 5:1 auf 2:1). Man erhält 100 mg (Ausbeute 40 %) des Lactams als einen kristallinen farblosen Feststoff. Rf 0,55 (Hex: EtOAc; 1:1) 90 Experimenteller Teil de = 98 % (NMR) 1 H-NMR (DMSO-d6): 1,42 (s, 9H); 1,43 (s, 9H); 1,76 (dd, J1= 14,17 Hz, J2= 3,56 Hz, 1H); 2,63 (dd, J1= 14,17 Hz, J2= 9,47 Hz, 1H); 3,58 (dd, J1= 11,01 Hz, J2= 5,64 Hz, 1H); 3,72 (dd, J1= 11,15 Hz, J2= 5,85 Hz, 1H); 4,50 (dd, J1= 9,40 Hz, J2= 3,49 Hz, 1H); 5,62 (t, J= 5,64 Hz, 1H); 13 C-NMR (DMSO-d6): 27,41; 29,64; 56,08; 62,42; 67,71; 81,88; 83,09, 169,40; 169,54 MS(ESI) :357,1765 [MH+]; 379,1580 [MNa+] [α]D =-17,6 (c = 3,93 mg/ml; T = 23,5 °C; DCM) Synthese von (S)-1-tert-Butyl-5-methyl-2-(Fmoc-amino)-4-methylenpentandioat (144) CO2Me FmocHN CO2tBu 1-tert-Butyl-5-methyl-2-amino-4-methylenpentandioat 64 (100 mg, 0,45 mmol) wird in DCM (2 ml) gelöst und mit FmocOSu (182 mg; 0,54 mmol) versetzt. Nun wird 16 h bei RT gerührt, anschließend wird das Lösungsmittel im Vakuum entfernt und der Rückstand chromatographisch gereinigt (Hex:EtOAc; 5:1 auf 3:1). Man erhält 158 mg (Ausbeute 78 %) eines farblosen Öls. Rf 0,35 (Hex: EtOAc; 3:1) 1 H-NMR (CDCl3): 1,45 (s, 9H); 2,68 (dd, J1= 14,04 Hz, J2= 8,26 Hz, 1H); 2,84 (dd, J1= 14,10 Hz, J2= 5,51 Hz, 1H); 3,77 (s, 3H); 4,13 (t, J= 7,12 Hz, 1H); 4,35 (dd, J1= 7,12 Hz, J2= 2,28 Hz, 2H); 4,45 (td, J1= 8,26 Hz, J2= 5,78 Hz, 1H); 5,50 (d, J= 8,19 Hz, 1H); 5,65 (s, 1H); 6,25 (d, J= 1,07 Hz, 1H); 7,30 (t, J= 7,46 Hz, 2H); 7,52 (t, J= 7,52 Hz, 2H); 7,58 (dd, J1= 7,32 Hz, J2= 3,43 Hz, 2H); 7,75 (d, J= 7,52 Hz, 2H) 13 C-NMR (CDCl3): 28,01; 35,7; 47,14; 52,17; 53,37; 66,99; 82,49; 119,97; 125,17; 127,06; 127,69; 128,57; 135,82; 141,29; 143,87; 143;95; 155,76; 167,28; 170,76 MS (ESI): 452,2065 [M+H]; 474,1884 [M+Na] [α]D = 2,4 (c = 4,08 mg/ml; T = 24,0 °C; DCM) Synthese von (2S,4S)-5-tert-Butyl-1-methyl-4-(Fmoc-amino)-2-hydroxy-2- (hydroxymethyl)pentandioat (145) HO OH CO2Me FmocHN CO2tBu Die Fmoc-geschütze Aminosäure 144 (529 mg; 1,17 mmol) wird in einem tBuOH–Wassergemisch (je 2 ml) suspendiert und bei 0°C mit AD-Mixβ (1,62 g) gelöst in einem tBuOH–Wassergemisch (je 4 ml) versetzt. Nachdem 2 d bei 0 °C gerührt wurde, wird die Reaktion durch Zugabe von 91 Experimenteller Teil Na2SO3 (1,74 g) beendet und das Reaktionsgemisch mit Ethylacetat (4x 25 ml) extrahiert. Die organische Phase wird getrocknet und das Lösungsmittel im Vakuum entfernt. Man erhält 350 mg (Ausbeute 62 %) eines weißen Feststoffs. Rf 0,25 (Hex: EtOAc; 1:1) 1 H-NMR (CDCl3): 1,45 (s, 9H); 2,13 (m, 2H); 3,59 (s, 3H); 3,69 (m, 1H); 4,21 (t, J= 6,65 Hz, 1H); 4,43 (d, J= 6,58 Hz, 2H); 4,53 (m, 1H); 5,19 (d, J= 9,94 Hz, 1H); 7,30 (t, J= 6,78 Hz, 2H); 7,39 (td, J1= 7,35 Hz, J2= 3,43 Hz, 2H); 7,59 (dd, J1= 7,12 Hz, J2= 2,96 Hz, 2H); 7,75 (d, J= 7,52 Hz, 2H) 13 C-NMR (CDCl3): 27,91; 37,61; 47,00; 50,37; 52,92; 67,32; 68,50; 76,38; 82,82; 119,99; 124,98; 127,05; 127,69; 127,73; 141,31; 143,66; 143;72; 170,09; 174,67 MS (ESI): 486,2126 [MH+]; 508,1944 [MNa+] [α]D = 0,3 (c = 12,00 mg/ml; T = 24,1 °C; DCM) Synthese von (2S,4S)-5-tert-Butyl-1-methyl-λ4-2-[1,3,2]dioxathiolan-[4]-carbacyclo-4(Fmoc-amino)-pentandioat (146) O SO O CO2Me FmocHN CO2tBu Das Diol 145 (53 mg; 0,11 mmol) wird in Tetrachlormethan (1 ml) gelöst und mit frisch destilliertem Thionylchlorid (0,012 ml; 0,165 mmol) versetzt. Nun wird 16 h bei 80 °C gerührt. Die Reaktionslösung wird mit Triethylamin neutralisiert und das Lösungsmittel im Vakuum entfernt. Das gewünschte Produkt konnte nicht isoliert werden. Das Diol 145 (42 mg; 0,09 mmol) wird in DCM (0,4 ml) gelöst und bei 0°C mit NEt3 (0,027 ml) versetzt. Nun wird frisch destilliertes Thionylchlorid (0,01 ml) zugegeben und bei 0°C gerührt. Nach 45 min wird die Reaktion durch Zugabe von Wasser beendet und das Reaktionsgemisch mit DCM extrahiert. Die organische Phase wird getrocknet und das Lösungsmittel im Vakuum entfernt. Der Rückstand wird chromatographisch gereinigt (Hex:EtOAc; 3:1). Man erhält 47 mg (Ausbeute 98 %) eines braunen Öls. Rf 0,17 (Hex: EtOAc; 3:1) 92 Experimenteller Teil Versuch zur Synthese von (2R,4S)-5-tert-Butyl-1-methyl-2-azido-4-(Fmoc-amino)-2(hydroxymethyl)pentandioat (147) HO N3 CO2Me FmocHN CO2tBu Das zyklische Sulfit 146 (50 mg; 0,092 mmol) wird in DMF (0,5 ml) gelöst und mit Natriumazid (9,5 mg; 0,146 mmol) versetzt. Die Reaktionslösung wird 2 d bei 50 °C gerührt. Nun wird mit Ethylacetat verdünnt und mit ges. NaCl-Lösung gewaschen. Das Lösungsmittel wird im Vakuum entfernt. Das gewünschte Produkt konnte nicht isoliert werden. Synthese von (S)-1-tert-Butyl-5-methyl-2-(bis-Boc-amino)-4-methylenpentandioat (70) CO2Me Boc2N CO2tBu Die Boc-geschützte Aminosäure 65 (194 mg; 0,589 mmol) wird in Acetonitril (3,2 ml) gelöst und mit DMAP (72 mg; 0,589 mmol) und Boc2O (0,67 ml; 2,94 mmol) versetzt. Nun wird 16 h bei RT gerührt und das Lösungsmittel anschließend entfernt. Der Rückstand wird in EtOAc (10 ml) gelöst und mit ges. NH4ClLösung, Wasser und ges. NaCl-Lösung gewaschen. Die organische Phase wird getrocknet und das Rohprodukt chromatographisch gereinigt (Hex: EtOAc; 14:1). Man erhält 189 mg (Ausbeute 79%) eines farblosen Öls. Rf 0,42 (Hex: EtOAc; 5:1) ee = 68 % (GC-MS) 1 H-NMR (CDCl3): 1,44 (s, 9H); 1,46 (s, 18H); 2,83 (dd, J1= 13,90 Hz, J2= 11,08 Hz, 1H); 3,13 (dd, J1= 13,70 Hz, J2= 3,76 Hz, 1H); 3,74 (s; 3H); 5,05 (dd, J1= 10,88 Hz, J2= 4,43 Hz, 1H); 5,53 (s, 1H); 6,18 (d, J= 1,34 Hz, 1H) 13 C-NMR (CDCl3): 27,94; 32,38; 51,84; 57,48; 81,45; 82,72; 128,35; 136,77; 152,20; 166,84; 169,13 MS(ESI): 430,2431 [MH+]; 452,2246 [MNa+] [α]D = -23,1 (c = 11,3 mg/ml; T = 23,6 °C; EtOAc)[161] Synthese von (2S,4S)-5-tert-Butyl-1-methyl-4-(bis-Boc-amino)-2-hydroxy-2(hydroxymethyl)pentandioat (71) HO OH CO2Me Boc2N CO2tBu 70 (2,54 g; 5,91 mmol) wird einem tBuOH–Wassergemisch (27 ml:7 ml) gelöst und bei 0°C mit AD-Mixβ (8,33 g) gelöst in Wasser (40 ml) 93 Experimenteller Teil versetzt. Nachdem 1 d bei 0°C gerührt wurde, wird weiterer AD-Mix-β (1 g) zugegeben. Nach einem weiteren Tag wird die Reaktion durch Zugabe von Na2SO3 (10 g) beendet und das Reaktionsgemisch mit Ethylacetat (4x100 ml) extrahiert. Die organische Phase wird getrocknet und das Lösungsmittel im Vakuum entfernt. Das Rohprodukt wird chromatographisch gereinigt (Hex: EtOAc; 5:1 auf 1:1) Man erhält das Diol als ein Gemisch aus Diastereomeren in quantitativer Ausbeute. Rf 0,38 (Hex: EtOAc; 1:1) de = 73 % (NMR) 1 H-NMR (CDCl3): 1,42 (s, 9H); 1,50 (s, 18H); 2,35 (dd, J1= 15,04 Hz, J2= 4,03 Hz, 1H); 2,41 (m, 1H); 3,60 (d, J= 11,15 Hz, 1H), 3,74 (s; 3H); 3,74 (d, J= 10,88 Hz, 1H); 5,06 (dd, J1= 9,94 Hz, J2= 3,90 Hz, 1H) 13 C-NMR (CDCl3): 27,88; 28,00; 33,99; 53,24; 54,62; 68,78; 76,42; 81,62; 83,26; 152,06; 169,41; 174,75 MS(ESI): 464,2475 [MH+]; 486,2292 [MNa+] [α]D =12,4 (c = 10.0 mg/ml; T = 22.8 °C; EtOAc)[161] Synthese von (2S,4S)-5-tert-Butyl-1-methyl-λ4-2-[1,3,2]dioxathiolan-[4]-carbacyclo-4(bis-Boc-amino)-pentandioat (72) O SO O CO2Me Boc2N CO2tBu Das Diol 71 (1,3 g; 2,8 mmol) wird in DCM (13 ml) gelöst und bei 0°C mit NEt3 (0,86 ml) versetzt. Nun wird frisch destilliertes Thionylchlorid (0,31 ml; 4,32 mmol) zugegeben und bei 0°C gerührt. Nach 45 min wird die Reaktion durch Zugabe von Wasser beendet und das Reaktionsgemisch mit DCM extrahiert. Die organische Phase wird getrocknet und das Lösungsmittel im Vakuum entfernt. Der Rückstand wird chromatographisch gereinigt (Hex:EtOAc; 5:1). Man erhält 1,354 g (Ausbeute 94 %) eines braunen Öls. Rf 0,46 (Hex: EtOAc; 3:1) 94 Experimenteller Teil Synthese von (2R,4S)-5-tert-Butyl-1-methyl-2-azido-4-(bis-Boc-amino)-2(hydroxymethyl)pentandioat (73) Das zyklische Sulfit 72 (1,292 g; 2,535 mmol) wird in DMF (13 ml) HO N3 CO2Me Boc2N CO2tBu gelöst und mit Natriumazid (250 mg; 3,845 mmol) versetzt. Die Reaktionslösung wird 3 d bei 50°C gerührt. Nun wird mit Ethylacetat verdünnt und mit ges. NaCl-Lösung gewaschen. Die organische Phase wird getrocknet und das Lösungsmittel im Vakuum entfernt. Der Rückstand wird chromatographisch gereinigt (Hex: EtOAc; 5:1 auf 3:1). Man erhält 254 mg (Ausbeute 40 %) eines farblosen Öls als ein Gemisch aus Diastereomeren. Rf 0,26 (Hex: EtOAc; 3:1) de = 78 % (NMR) 1 H-NMR (DMSO-d6): 1,35 (s, 9H); 1,44 (s, 18H); 1,97 (dd, J1= 15,11 Hz, J2= 8,66 Hz, 1H); 2,39 (dd, J1= 15,04 Hz, J2= 3,63 Hz, 1H); 3,67 (m, 1H); 3,71 (s; 3H); 3,79 (dd, J1= 11,20 Hz, J2= 5,10 Hz, 1H); 4,78 (dd, J1= 8,60 Hz, J2= 3,90 Hz, 1H); 5,58 (t, J= 5,37 Hz, 1H) 13 C-NMR (DMSO-d6): 27,37; 27,50; 32,52; 52,75; 54,58; 66,92; 69,66; 81,02; 81,35; 151,56; 168,42; 170,25 MS(ESI): 489,2556 [MH+]; 511,2365 [MNa+] [α]D =-6,3 (c = 8,13 mg/ml; T = 23,47 °C; DCM) Synthese von (2R,4S)-4-(tert-Butoxycarbonyl)-4-(bis-Boc-amino-2-azido-2(hydroxymethyl)butansäure (74) Das Azid 73 (25 mg; 0,0512 mmol) wird in THF (0,5 ml) gelöst und mit HO N3 CO2H Boc2N CO2tBu Lithiumhydroxid (1,77 mg; 0,074 mmol; 1,5 eq) gelöst in Wasser (0,5 ml) versetzt. Nun wird 4 h bei RT gerührt. Anschließend wird das Reaktionsgemisch mit Wasser verdünnt und mit EtOAc extrahiert (3x). Die organische Phase wird getrocknet und das Lösungsmittel im Vakuum entfernt. Man erhält 24 mg (Ausbeute 99 %) eines farblosen Öls. Rf 0,25 ( CHCl3: MeOH; 9:1) 1 H-NMR (DMSO-d6): 1,35 (s, 9H); 1,43 (s, 18H); 1,95 (dd, J1= 15,18 Hz, J2= 9,00 Hz, 1H); 2,37 (dd, J1= 15,18 Hz, J2= 3,09 Hz, 1H); 3,62 (d, J= 11,01 Hz, 1H); 3,75 (d, J= 11,01 Hz, 1H); 4,81 (dd, J1= 9,00 Hz, J2= 3,09 Hz, 1H) 95 Experimenteller Teil 13 C-NMR (DMSO-d6): 27,43; 27,55; 32,46; 55,00; 67,08; 69,57; 80,99; 82,23; 151,55; 168,63; 171,46 MS(ESI): 473,2239 [MH-] [α]D = -14,8 (c = 9,74 mg/ml; T = 23,53 °C; EtOAc) Synthese von (2R,4S)-5-tert-Butyl-1-methyl-2-azido-4-(bis-Boc-amino)-2(methoxymethyl)pentandioat (118) Das Azid (73) (150 mg; 0,307 mmol) wird in Acetonitril (400 µl) gelöst MeO N3 CO2Me Boc2N CO2tBu und mit Silberoxid (142 mg; 0,614 mmol), Methyliodid (382 µl; 6,14 mmol) und einer katalytischen Menge von Methylsulfid versetzt. Nachdem das Reaktionsgemisch 16 h bei RT unter Lichtausschluss gerührt wurde, wird das Silberoxid abfiltriert, das Lösungsmittel im Vakuum entfernt und der Rückstand chromatographisch gereinigt (Hex: EtOAc; 9:1). Man erhält 127 mg (Ausbeute 83%) das gewünschte Produkt als ein Gemisch aus Diastereomeren. Rf 0,54 (Hex: EtOAc; 3:1) de = 30 % (NMR) 1 H-NMR (CDCl3): 1,41 (s, 9H); 1,50 (s, 18H); 2,13 (dd, J1= 15,04 Hz, J2= 8,46 Hz, 0,71H); 2,21 (dd, J1= 14,98 Hz, J2= 2,89 Hz,, 0,35H); 2,39 (dd, J1= 15,00 Hz, J2=10 ,27 Hz, 0,35H); 2,59 (dd, J1= 15,04 Hz, J2= 3,90 Hz,, 0,66H); 3,55 (s, 3H); 3,60 (dd, J1= 14,44 Hz, J2= 9,34 Hz, 1H); 3,76 (s, 0,92H); 3,79 (s, 2,13H); 3,79 (dd, J1= 30,75 Hz, J2= 9,40 Hz, 1H); 4,95 (dd, J1= 8,53 Hz, J2= 3,96 Hz, 0,64H); 5,07 (dd, J1= 10,34 Hz, J2= 2,82 Hz, 1H) 13 C-NMR (CDCl3): 27,85; 27,92; 28,02; 33,31; 33,04; 52,99; 53,13; 54,96; 59,47; 67,91; 68,45; 79,16; 81,59; 81,67; 82,94; 83,02; 151,64; 152,12; 169,08; 169,25; 170,50; 170,70 MS(ESI): 525,2542 [MNa+] Synthese von (2R,4S)-4-(tert-Butoxycarbonyl)-4-(bis-Boc-amino-2-azido-2(methoxymethyl)butansäure (119) Der Methylether 118 (127 mg; 0,253 mmol) wird in THF (2,5 ml) gelöst MeO N3 CO 2 H Boc2N CO 2tBu und mit Lithiumhydroxid (9 mg; 0,38 mmol) gelöst in Wasser (2,5 ml) versetzt. Nun wird 16 h bei RT gerührt und weiteres Lithiumhydroxid (6 mg; 0,253 mmol) zugesetzt. Nachdem weitere 16 h bei RT gerührt wurde, wird die Reaktionslösung angesäuert und mit EtOAc extrahiert. Die vereinigte organische Phase wird getrocknet und das Lösungsmittel im Vakuum entfernt. Man erhält das gewünschte Produkt als ein Gemisch aus Diastereomeren in quantitativer Ausbeute. 96 Experimenteller Teil Rf 0,3 (CHCl3: MeOH; 9:1) de = 37 % (NMR) 1 H-NMR (CDCl3): 1,41 (s, 9H); 1,49 (s, 5H); 1,50 (s, 13H); 2,23 (m, 1H); 2,42 (dd, J1= 14,84 Hz, J2= 10,68 Hz, 0,31H); 2,64 (dd, J1= 15,18 Hz, J2= 3,49 Hz, 0,67H); 3,37 (s, 2H); 3,38 (s, 0,89H); 3,64 (dd, J1= 14,91 Hz, J2= 9,40 Hz,, 1H); 3,81 (m, 1H); 4,99 (dd, J1= 8,93 Hz, J2= 3,43 Hz, 0,67H); 5,14 (dd, J1= 10,48 Hz, J2= 2,82 Hz, 0,31H) 13 C-NMR (CDCl3): 27,86 27,88; 28,00; 33,16; 52,02; 52,09; 59,45; 68,22; 81,65; 81,83; 83,23; 83,65; 152,13; 168,95; 170,30 MS(ESI): 487,2403 [MH-] 97 Experimenteller Teil 5.2.4. Studien zur Synthese von Labionin Synthese von (2R,4S)-5-tert-Butyl-1-methyl-2-azido-4-(bis-Boc-amino)-2(Methylsulfonyloxymethyl)pentandioat (76) MsO N3 CO2Me Boc2N CO2tBu Das Azid (73) (50 mg; 0,102 mmol) wird in DCM (3 ml) gelöst und bei 0°C mit TEA (43 µl; 0,31 mmol; 3 eq.) und Mesylchlorid (10 µl; 0,13 mmol) versetzt. Nun wird 5 h bei RT gerührt. Anschließend mit EtOAc verdünnt und mit Wasser und ges. NaCl-Lösung gewaschen. Die organische Phase wird getrocknet und das Lösungsmittel im Vakuum entfernt. Man erhält 48 mg (Ausbeute 83 %) eines farbloses Öl als ein Gemisch aus Diastereomeren Rf 0,26 (Hex: EtOAc; 3:1) de = 57 % (NMR) 1 H-NMR (DMSO-d6): 1,35 (s, 9H); 1,44 (s, 18H); 2,13 (dd, J1= 15,18 Hz, J2= 8,06 Hz, 1H); 2,54 (dd, J1= 15,11 Hz, J2= 4,10 Hz, 1H); 3,23 (s, 3H); 3,76 (s, 3H); 4,48 (d, J= 10,75 Hz, 1H); 4,57 (d, J= 10,60 Hz, 1H); 4,84 (dd, J1= 7,99 Hz, J2= 4,10 Hz, 1H) 13 C-NMR (DMSO-d6): 27,39; 27,50; 32,98; 36,69; 53,52; 54,10; 67,16; 72,10; 81,14; 82,78; 151,49; 168,15; 168,43 MS(ESI): 567,2334 [MH+]; 589,2148[MNa+] [α]D = -6,3 (c = 10,00 mg/ml; T = 23,5 °C; DCM) Versuch zur Synthese von (2R,4S)-5-tert-Butyl-1-methyl-2-azido-4-(bis-Boc-amino)-2(brommethyl)pentandioat (79) Br N3 CO2Me Boc2N CO2tBu Der Sulfonsäureester (76) (42 mg; 0,074 mmol) wird in DMF (2 ml) gelöst und mit Kaliumbromid (88 mg; 0,74mmol; 10 eq) versetzt. Nun wird 16 h bei 70 °C gerührt. Anschließend wird das Reaktionsgemisch mit EtOAc verdünnt und mit ges. NaCl-Lösung gewaschen (5x). Die organische Phase wird getrocknet und das Lösungsmittel im Vakuum entfernt. Man erhielt nur das Edukt der Reaktion. 98 Experimenteller Teil Versuch zur Synthese von 2R,4S)-5-tert-Butyl-1-methyl-2-azido-4-(bis-Boc-amino)-2(acetylmercaptomethyl)pentandioat (77) AcS N3 CO2Me Boc2N CO2tBu Der Sulfonsäureester (76) (40 mg; 0,072 mmol) wird in DMF (0,75 ml) gelöst und mit Kaliumcarbonat (22 mg; 0,16 mmol) versetzt. Nun wird 16 h bei 50 °C gerührt. Anschließend wird das Reaktionsgemisch mit EtOAc verdünnt und mit ges. NaCl-Lösung gewaschen (5x). Die organische Phase wird getrocknet und das Lösungsmittel im Vakuum entfernt. Man erhält nur das Edukt der Reaktion. Synthese von (2R,4S)-5-tert-Butyl-1-methyl-2-amino-4-(bis-Boc-amino)-2(hydroxymethyl)pentandioat (148) HO NH2 CO2Me Boc2N CO2tBu Das Azid (73) (50 mg; 0,102 mmol) wird in THF (3 ml) gelöst und mit Pd/C (20 mg) versetzt. Nun wird die Reaktionslösung 16 h bei RT unter H2-Atmosphäre (1 bar) gerührt. Anschließend wird der Katalysator abfiltriert und das Lösungsmittel im Vakuum entfernt. Man erhält 45 mg (Ausbeute 95 %) eines leicht gelben Öls. Das Rohprodukt wird ohne weitere Reinigung zur Synthese von 149 direkt weiterverwendet. Rf 0,2 (Hex: EtOAc; 1:1) MS(ESI): 463,2632 [MH+] Synthese von (2R,4S)-5-tert-Butyl-1-methyl-2-(Cbz-amino)-4-(bis-Boc-amino)-2(hydroxymethyl)pentandioat (149) HO NHCbz CO2Me Boc2N CO2tBu Das freie Amin 148 (45 mg; 0,097 mmol) wird in THF (0,25 ml) und Acetonitril (0,4 ml) gelöst und anschließend mit TEA (15 µl; 0,107 mmol) und Cbz-OSu (27 mg; 0,108 mol) versetzt. Nachdem die Reaktionslösung 4 d bei RT gerührt wurde, wird das Lösungsmittel im Vakuum entfernt und der Rückstand in EtOAc aufgenommen. Nun wird mit ges. NaHCO3-Lösung gewaschen. Die Phasen werden getrennt, die organische Phase wird getrocknet und das Lösungsmittel im Vakuum entfernt. Das Rohprodukt wird chromatographisch gereinigt (Hex: EtOAc; 9:1 auf 3:1). Man erhält 44 mg (Ausbeute 76%) eines gelben Öls. 99 Experimenteller Teil Rf 0,57 (Hex: EtOAc; 1:1) 1 H-NMR (CDCl3): 1,41 (s, 9H); 1,48 (s, 18H); 2,37 (dd, J1= 14,91 Hz, J2= 5,10 Hz, 1H); 2,79 (dd, J1= 15,25 Hz, J2= 5,31 Hz, 1H); 3,75 (s, 3H); 3,85 (m, 1H); 4,16 (d, J= 13,57 Hz, 1H); 4,85 (t, J= 5,17 Hz, 1H); 4,99 (d, J= 12,36 Hz, 1H); 5,13 (m, 1H); 6,14 (s, 1H); 7,34 (m, 5H) 13 C-NMR (CDCl3): 27,78; 28,01; 33,99; 52,98; 54,89; 64,95; 66,81; 82,05; 83,35; 128,02; 128,44; 129,90; 152,15; 155,45; 169,88; 172,39 MS(ESI): 619,2840 [MNa+] [α]D = -13,8 (c = 12 mg/ml; T = 24,46 °C; CHCl3) Synthese von (2R,4S)-4-(tert-Butoxycarbonyl)-4-(bis-Boc-amino-2-(Cbz-amino)-2(hydroxymethyl)butansäure (81) HO NHCbz CO2H Boc2N CO2tBu Die Aminosäure 149 (41 mg; 0,069 mmol) wird in THF (0,7 ml) gelöst und mit Wasser (0,7 ml) versetzt. Anschließend wird die Suspension mit Lithiumhydroxid (3,2 mg; 0,138 mmol) versetzt und 16 h bei RT gerührt. Nun wird die Reaktionslösung angesäuert und mit EtOAc extrahiert. Die vereinigte organische Phase wird getrocknet und das Lösungsmittel im Vakuum entfernt. Man erhält 30 mg (Ausbeute 75 %) des Produktes. Rf 0,27 ( CHCl3: MeOH; 9:2) MS(ESI): 583,2869 [MH+]; 605,2682[MNa+] 100 Experimenteller Teil 5.2.5. Synthese des Dipeptids des A´-Ring, des Tripeptids des B´-Rings und des Modellpeptids Synthese von Fmoc-Thr(tBu)-(Tmb)Gly-OBn (83) OMe Fmoc-Thr(tBu)-OH (805 mg; 2,027 mmol) und Tmb-Gly-OBn *HCl (500 mg; 1,36 mmol) werden in DCM (50 ml) gelöst und bei 0°C MeO OMe OBn N tBuO O O NHFmoc mit HATU (770 mg; 2,03 mmol) und N-Ethylmorpholin (0,26 ml; 2,05 mmol) versetzt. Nach 15 min wird das Kältebad entfernt. Das Reaktionsgemisch wird nun 5 d bei RT gerührt und anschließend mit Wasser verdünnt und mit DCM (3x) extrahiert. Die organische Phase wird mit ges. NaHCO3-Lösung gewaschen und getrocknet, dass Lösungsmittel wird im Vakuum entfernt. Der Rückstand wird chromatographisch gereinigt (Hex:EtOAc; 5:1 auf 3:1). Man erhält 600 mg (Ausbeute 60%) eines farblosen Feststoffs. Rf 0,26 (Hex:EtOAc; 3:1) 1 H-NMR (CDCl3): 1,15 (d, J= 6,54 Hz, 3H); 1,25 (s, 9H); 3,66 (s, 6H); 3,79 (s, 3H); 3,83 (d, J=17,19 Hz, 1H); 3,97 (m, 1H); 4,25 (t, J= 7,25 Hz, 1H); 4,33 (d, J=17,06 Hz, 1H); 4,40 (m, 1H); 4,44 (d, J=15,72 Hz, 1H), 5,00 (d, J= 12,49 Hz, 1H); 5,05 (d, J= 14,91 Hz, 1H); 5,11 (d, J= 12,40 Hz, 1H); 5,38 (dd; J1= 7,86 Hz, J2= 3,83 Hz, 1H); 6,03 (s, 2H); 7,31 (m, 7H); 7,40 (t, J= 7,39 Hz, 2H); 6,72 (t, J= 6,72 Hz, 2H); 7,77 (d, J= 7,39 Hz, 2H) 13 C-NMR(CDCl3): 18,52; 28,13; 41,25; 46,11; 47,29; 55,36; 55,85; 66,40; 66,76; 69,27; 74,56; 90,11; 104,05; 119,94; 125,21; 125,30; 127,07; 127,07; 127,67; 128,14; 128,45; 135,79; 141,31; 143,97; 155,64; 159,83; 161,52; 169,17; 170,33; MS (ESI): 725,3449 [MH+] Synthese von Fmoc-Thr(tBu)-(Tmb)Gly-OH (84) OMe Das Dipeptid 83 (600 mg, 0,92 mmol) wird in THF (4 ml) gelöst und MeO N tBuO mit 5% Pd/C (130 mg) versetzt. Nun wird der Reaktionskolben mit OMe O O NHFmoc OH Stickstoff gespült und anschließend mit Wasserstoff befüllt. Nun wird 2 d bei RT und Normaldruck gerührt. Der Katalysator wird nach der Reaktion abfiltriert und das Lösungsmittel im Vakuum entfernt. Das Rohprodukt wird chromatographisch gereinigt (CHCl3: MeOH; 9:0,2 auf 9:1). Man erhält 420 mg (Ausbeute 82%) eines weißen Feststoffs. 101 Experimenteller Teil Rf 0,46 (CHCl3: MeOH; 9:1) 1 H-NMR (CDCl3): 1,13 (d, J= 6,31 Hz, 3H); 1,29 (s, 9H); 3,74 (s, 6H); 3,80 (s, 3H); 4,24 (t, J= 6,92 Hz, 1H); 4,43 (m, 4H); 4,95 (d, J= 14,51 Hz, 1H); 5,37 (dd; J1= 7,59 Hz, J2= 4,23 Hz, 1H); 5,93 (d, J= 7,66 Hz, 1H); 6,08 (s, 2H); 7,39 (t, J= 7,39 Hz, 2H); 7,40 (t, J= 7,39 Hz, 2H); 7,61 (t, J= 7,52 Hz, 2H); 7,77 (d, J= 7,52 Hz, 2H) 13 C-NMR(CDCl3): 14,33; 28,22; 42,10; 46,86; 47,39; 55,49; 55,64; 55,75; 60,55; 66,92; 69,06; 75,52; 90,36; 103,58; 120,14; 125,21; 125,31; 127,19; 127,84; 141,45; 143,94; 144,01; 155,76; 159,84; 161,95; 171,14; 171,91 MS 635,2966 [MH+]; 657,2782 [MNa+] Synthese von Boc-Glycindiphenylmethylester (85) Boc-Gly-OH (4 g; 22,83 mmol) werden in DMF (130 ml) gelöst O BocHN und mit Kaliumcarbonat (3,2 g; 23,15 mmol) versetzt. Nun wird O Bromdiphenylmethan (5,64 g; 22,83 mmol) zugegeben und 16 h bei RT gerührt. Anschließend wird das Reaktionsgemisch mit EtOAc (200 ml) verdünnt und mit ges. NaCl-Lösung (4x 200 ml) gewaschen. Die organische Phase wird getrocknet und das Lösungsmittel im Vakuum entfernt. Der Rückstand wird chromatographisch gereinigt (Hex: EtOAc; 9:1). Man erhält 2,24 g (Ausbeute 29%) eines farblosen Öls. Rf 0,53 (Hex: EtOAc; 5:1) 1 H-NMR (CDCl3): 1,44 (s, 9H); 4,02 (d, J= 5,24 Hz; 2H), 4,99 (s, 1H); 6,93 (s, 1H); 7,29 (m, 10H); 13 C-NMR (CDCl3): 28,29; 42,72; 77,78; 80,02; 127,11; 128,10; 128,55; 139,59; 155,61; 169,48 MS (ESI): 342,1697 [MH+]; 364,1509 [MNa+] Synthese von Glycindiphenylmethylester (86) Boc-Gly-ODpm (85) (200 mg; 0,586 mmol) wird in Dioxan (1,4 ml) O H2N O gelöst und bei 0°C mit HCl in Dioxan (4 M; 11 ml) versetzt. Nun wird 1 h bei RT gerührt anschließend das Lösungsmittel im Vakuum 102 Experimenteller Teil entfernt. Der Rückstand wird mit ges. NaHCO3-Lösung versetzt und mit EtOAc (2x 50 ml) extrahiert. Die organische Phase wird getrocknet und das Lösungsmittel im Vakuum entfernt. Man erhält ein farbloses Öl in quantitativer Ausbeute. Rf 0,77 (CHCl3:MeOH; 9:2) 1 H-NMR (MeOH-d4): 3,76 (s, 1H); 3,99 (s, 2H); 6,98 (s,1H); 7,33 (m, 10H) 13 C-NMR (MeOH-d4): 41,26; 80,45; 128,13; 129,35; 129,66; 140,76; 167,88 MS (ESI): 242,1146 [MH+] Synthese von N-2,4,6-Trimethoxybenzylglycindiphenylmethylester (87) MeO OMe H N H-Gly-ODpm (86) (141 mg; 0,585 mmol) wird in DCM O (18 ml) gelöst und mit Natriumborhydridtriacetat (172 O mg; 0,811 mmol) und 2,4,6-Trimethoxybenzaldehyd OMe (161 mg; 0,82 mmol) versetzt. Nachdem das Reaktionsgemisch 2 h bei RT gerührt wurde, wird die Reaktion durch Zugabe von Wasser (15 ml) beendet und mit EtOAc (3x 50 ml) extrahiert. Die organische Phase wird getrocknet und das Lösungsmittel im Vakuum entfernt. Der Rückstand wird chromatographisch gereinigt (CHCl3: MeOH; 9:0,5). Man erhält 146 mg (Ausbeute 53%) eines gelben Öls. Rf 0,5 (CHCl3: MeOH; 9:1) 1 H-NMR (CDCl3): 3,5 (s, 2H); 3,71 (s, 6H); 3,78 (s, 3H); 3,87 (s, 2H); 6,06 (s, 2H), 6,88 (s, 1H); 7,29 (m, 10H) 13 C-NMR (CDCl3): 41,26; 49,07; 55,27; 55,55; 77,16; 90,34; 127,14; 127,90; 128,43; 139,94; 159,52; 160,84; 170,99 MS (ESI): 422,1949 [MH+] Synthese von Fmoc-Thr(tBu)-(Tmb)Gly-ODpm (88) OMe Fmoc-Thr(tBu)-OH (830 mg; 2,088 mmol) und 87 (592 mg; MeO N tBuO 1,40 mmol) werden in DCM (100 ml) gelöst und bei 0°C mit OMe O O NHFmoc O HATU (793 mg; 2,087 mmol) und N-Ethylmorpholin (0,27 ml; 2,133 mmol) versetzt. Nach 15 min wird das Kältebad entfernt. Das Reaktionsgemisch wird 16 h bei RT gerührt und anschließend mit Wasser verdünnt und mit DCM (3x) extrahiert. Die organische 103 Experimenteller Teil Phase wird mit ges. NaHCO3-Lösung gewaschen und getrocknet, dass Lösungsmittel wird im Vakuum entfernt. Der Rückstand wird chromatographisch gereinigt (Hex:EtOAc; 2:1). Man erhält 508 mg (Ausbeute 45 %) eines farblosen Öls. Rf 0,375 (Hex:EtOAc; 2:1) 1 H-NMR (CDCl3): 1,12 (d; J= 6,45 Hz, 3H); 1,26 (s, 9H); 3,55 (s, 6H); 3,77 (s, 3H); 3,83 (d, J= 17,06 Hz, 1H); 3,96 (ddd; J1= 6,45 Hz, J2= 5,91 Hz, J3= 3,36 Hz, 1H); 4,24 (t, J= 7,12 Hz, 3H); 4,43 (m, 4H); 5,10 (d, J= 14,78 Hz; 1H); 5,41 (dd, J1= 7,79 Hz, J2= 3,76 Hz, 1H); 5,99 (m, 3H), 6,82 (s, 1H); 7,26 (m, 14H); 7,38 (t, J= 7,46 Hz, 2H); 7,62 (t, J= 6,51 Hz, 2H); 7,75 (d, J= 7,52 Hz, 2H) 13 C-NMR(CDCl3): 18,41; 28,10; 41,26; 46,27; 47,32; 55,23; 55,80; 66,76; 69,29; 74,62; 77,19; 90,18; 104,10; 119,92; 125,19; 125,27; 127,05; 127,19; 127,27; 127,65; 127,75; 128,31; 128,34; 140,00; 141,32; 144,01; 155,59; 159,86; 161,56; 168,43; 170,99 MS (ESI): 801,3732 [MH+]; 823,3541 [MNa+] Synthese von cyclo [Thr(tBu)-(Tmb)Gly)] (89) MeO OMe Das N-(2-Mercaptoethyl)-aminomethyl-Harz (0,6 g; 1,4 mmol/g) wird in eine mit einer Fritte versehene Spritze gegeben und mit OMe N O Harz N H abfiltriert, O Fmoc-Thr(tBu)-(Tmb)Gly-ODpm (88) (60 mg, 0,075 mmol) OtBu gelöst in THF (2ml) versetzt. Nun wird DBU (20 µl 0,13 mmol) zugegeben und 1 h bei RT geschüttelt. Anschließend wird das das Lösungsmittel im Vakuum entfernt und das Rohprodukt chromatographisch gereinigt (DCM:MeOH 9:1 auf 9:2). Man erhält 300 mg eines farblosen Öls in quantitativer Ausbeute. Rf 0,63 (CHCl3: MeOH; 9:2) 1 H-NMR (DMSO-d6): 1,06 (s, 9H); 1,09 (d, J= 6,31Hz, 3H); 3,15 (d, J= 3,15Hz, 3H); 3,53 (dd, J1= 3,43 Hz, J2= 2,08 Hz, 1H); 3,64 (d, J= 16,79Hz, 1H); 3,75 (s, 6H); 3,79 (s, 3H); 4,02 (dd, J1= 6,51 Hz, J2= 2,08 Hz, 1H); 4,07 (d, J= 13,57Hz, 1H); 4,72 (d, J= 13,57Hz, 1H); 6,26 (s, 2H) 13 C-NMR (DMSO-d6): 20,13; 28,22; 37,04; 47,08; 55,24; 55,72; 61,45; 68,92; 73,33; 90,76; 101,92; 159,62; 161,26; 161,26; 165,84; 166,69 MS (ESI): 395,2163 [MH+]; 417,1980 [MNa+] 104 Experimenteller Teil Synthese von Boc-Thr(tBu)-Gly-OBn (90) OtBu H N BocHN H-Gly-OBn*pTos (1,27 g; 3,76 mmol) und Boc-Thr(tBu)-OH CO2Bn (1 g; 3,63 mmol) werden in THF (63 ml) gelöst und bei 0°C mit O HOAt (1,44 g; 10,57 mmol) versetzt. Nach 5 min wurde EDAC (2,02 g; 10,55 mmol) zugegeben und 5 h bei RT gerührt. Nun wird das Reaktionsgemisch mit Ethylacetat (250 ml) verdünnt und mit 5%iger HCl-Lösung (3x60 ml), ges. NaHCO3-Lösung (2x60 ml), Wasser (2x60 ml) und ges. Natriumchloridlösung (2x60 ml) gewaschen. Die organische Phase wird getrocknet und das Lösungsmittel im Vakuum entfernt. Der Rückstand wird chromatographisch gereinigt (Hex: EtOAc; 5:1 auf 2:1) Man erhält 0,52 g (Ausbeute 44%) eines weißen Feststoffs. Rf 0,42 (Hex:EtOAc; 3:1) 1 H-NMR (DMSO-d6): 1,02 (d, J= 6,04 Hz, 3H); 1,08 (s, 9H); 1,38 (s, 9H); 3,92 (m, 4H); 5,1 (s, 2H); 6,01 (d, J= 8,60 Hz, 1H), 7,33 (m, 5H) 13 C-NMR(CDCl3): 17,25; 28,26; 28,38; 41,53; 58,41; 66,90; 67,15; 75,34; 79,67; 128,44; 128,56; 128,66, 135,15; 155,60; 169,44; 170,25 MS (ESI): 423,2475 [M+H]; 445,2291 [M+Na] Synthese von H-Thr(tBu)-Gly-OBn (91) H2N OtBu H N O Boc-Thr(tBu)-Gly-OBn (92) (0,503 g; 1,19 mmol) wird in Dioxan CO2Bn (1,5 ml) gelöst und bei 0 °C mit HCl in Dioxan (4 M; 11 ml) versetzt. Nun wird 1 h bei RT gerührt anschließend das Lösungsmittel im Vakuum entfernt. Der Rückstand wird mit ges. NaHCO3-Lösung versetzt und mit EtOAc (2x 100 ml) extrahiert. Die organische Phase wird getrocknet und das Lösungsmittel im Vakuum entfernt. Man erhält ein farbloses Öl in quantitativer Ausbeute (0,382 g). Rf 0,51 (CHCl3: MeOH; 9:1) 1 H-NMR (DMSO-d6): 1,06 (d, J= 6,31 Hz, 3H); 1,08 (s, 9H); 3,02 (d, J= 4,16 Hz, 1H); 3,83 (dd, J1= 6,11 Hz, J2= 4,23 Hz, 1H); 3,92 (dd, J1= 5,51 Hz, J2= 2,55 Hz, 2H); 5,12 (s, 2H); 7,34 (m, 5H) 13 C-NMR (DMSO-d6): 20,12; 28,29; 40,67; 59,92; 65,75; 68,10; 73,07; 127,88; 127,99; 128,34; 135,84; 169,65; 173,38 105 Experimenteller Teil + + MS (ESI): 323,2969 [MH ]; 354,1788 [MNa ] Synthese von Cbz-γ-Glu-Thr(tBu)-Gly-OBn (92) O tBuO2C N H NHCbz OtBu H N CO2Bn O H-Thr(tBu)-Gly-OBn (91) 0,63 Cbz-Glu(OH)-OtBu mmol) und (0,203 g; (0,276 g; 0,819 mmol) werden in THF (11 ml) gelöst und bei 0 °C mit HOAt (0,3 g; 2,2 mmol) versetzt. Nach 5 min wird EDAC (0,36 g; 1,88 mmol) zugegeben und 16 h bei RT gerührt. Nun wird das Reaktionsgemisch mit Ethylacetat (50 ml) verdünnt und mit 5%iger HCl-Lösung (3x10 ml), ges. NaHCO3-Lösung (2x10 ml), Wasser (2x10 ml) und ges. Natriumchloridlösung (2x10 ml) gewaschen. Die organische Phase wird getrocknet und das Lösungsmittel im Vakuum entfernt. Der Rückstand wird chromatographisch gereinigt (Hex: EtOAc; 5:1 auf 2:1) Man erhält 240 mg (Ausbeute 60%) eines leicht gelben Öls. Rf 0,27 (Hex:EtOAc; 3:1) 1 H-NMR (DMSO-d6): 0,99 (d, J= 6,18 Hz, 3H); 1,10 (s, 9H); 1,38 (s, 9H); 1,73 (m, 1H); 1,91 (td, J1= 13,43 Hz, J2= 7,79 Hz, 1H); 2,27 (t, J= 7,66 Hz, 2H); 3,86 (m, 2H); 3,92 (d, J= 5,78 Hz, 2H); 4,29 (dd, J1= 8,73 Hz, J2= 4,16 Hz, 1H); 5,24 (d, J= 5,28 Hz, 2H); 5,11 (s, 2H); 7,34 (m, 10H); 7,61 (d, J= 7,66 Hz, 1H); 7,66 (d, J= 8,73 Hz, 1H); 8,14 (t, J= 5,57 Hz, 1H) 13 C-NMR (DMSO-d6): 19,28; 27,70; 28,16; 29,06; 31,59; 40,93; 54,23; 57,45; 65,48; 65,91; 67,33; 73,73; 80,61; 127,84; 127,90; 128,02; 128,14; 128,41; 128,49; 135,93; 137,06; 156,14 169,60; 170,31; 171,33; 173,48 MS (ESI): 642,3384 [MH+]; 664,3196 [MNa+] Synthese von H-γ-Glu-Thr(tBu)-Gly-OBn (93) O tBuO2C NH2 N H OtBu H N CO2H O Das Peptid Cbz-γ-Glu-Thr(tBu)-Gly-OBn (92) (205 mg; 0,32 mmol) wird in Methanol (10 ml) gelöst und Pd/C (20 mg) versetzt. Nun wird 16 h unter H2 (1 bar) gerührt. Anschließend wird der Katalysator abfiltriert und das Lösungsmittel im Vakuum entfernt. Man erhält 121 mg eines farblosen Feststoffs (Ausbeute 91%). Rf 0,625 (n-Butanol: EtOAc: AcOH: H2O; 2:1:1:1) 106 Experimenteller Teil 1 H-NMR (DMSO-d6): 0,99 (d, J= 6,31 Hz, 3H); 1,12 (s, 9H); 1,41 (s, 9H); 1,73 (m, 1H); 1,91 (td, J1= 13,43 Hz, J2= 7,79 Hz, 1H); 2,27 (t, J= 7,66 Hz, 2H); 3,86 (m, 2H); 3,92 (d, J= 5,78 Hz, 2H); 4,29 (dd, J1= 8,73 Hz, J2= 4,16 Hz, 1H); 7,61 (d, J= 7,66 Hz, 1H); 7,66 (d, J= 8,73 Hz, 1H); 8,14 (m, 2H) 13 C-NMR (DMSO-d6): 19,39; 27,72; 28,18; 28,41; 30,75; 41,98; 53,32; 55,47; 73,72; 81,04; 171,67; 172,21; 172,77; 174,13 MS (ESI): 418,2538 [MH+] Synthese von Cyclo[γ-Glu-Thr(tBu)-Gly] (94) Tabelle 3: Reagenzien zur Zyklisierung von 93 tBuO2C H N O Reagenz Mix 1 DPPA O HN NH O OtBu NaHCO3 Mix 2 HATU Collidin Mix 3 DEPBT N-Ethylmorpholin Menge 15,5 µl 3 eq 10,1 mg 5 eq 9,5 mg 1 eq 3,5 µl 3 eq 14,4 mg 1 eq 9,5 µl 2 eq H-γ-Glu-Thr(tBu)-Gly-OH (93) (10 mg; 24 µmol) wird in DMF (0,35 ml) gelöst und mit dem Kupplungsreagenz und der Base (siehe Tabelle; Mix 1-3) versetzt nun wird 2 d bei RT geschüttelt. Das gewünschte Produkt konnte mit allen genannten Reaktionsbedingungen massenspektrometrisch nachgewiesen werden. MS (ESI): 400,2267 [MH+]; 422,2267 [MNa+] Synthese von Imidazol-1-Sulforyl-Azid *Hydrochlorid (95)[162] N O N S N3 *HCl O NaN3 (0,63 g; 9,7 mmol) wird in Acetonitril (10 ml) suspendiert und bei 0 °C mit Sulfurylchlorid (0,8 ml; 9,9 mmol) versetzt. Nachdem die Reaktionslösung 20 h bei RT gerührt wurde, wird Imidazol (1,3 g; 19,1 mmol) bei 0 °C zugegeben und 3 h bei RT gerührt. Nun wird mit EtOAc (20 ml) verdünnt und mit Wasser (3x20 ml) und ges. NaHCO3-Lösung (2x20 ml) gewaschen. Die organische Phase wird getrocknet und bei 0 °C mit HCl/ EtOH (hergestellt aus 1 ml Acetylchlorid und 3,75 ml EtOH) versetzt. Das kristalline Produkt (1,36 g) wird abfiltriert (Ausbeute 67%). 107 Experimenteller Teil 1 H-NMR (D2O): 7,62 (m, 1H); 8,03 (m, 1H); 9,32 (m, 1H) 13 C-NMR (D2O): 120,32; 124, 68; 138,11 MS (ESI): 147,0078 [MH+] Synthese von (2S,3R)-2-Azido-3-(benzyloxy)butansäure (97) OBn OH N3 O H-Thr(Bn)-OH (0,8 g; 3,83 mmol), CuSO4*5H2O (20 mg; 0,08 mmol) und K2CO3 (1,24 g; 9 mmol) werden in Methanol (20 ml) gelöst. Nun wird Imidazol-1-Sulforyl-Azid *HCl (95) (0,96 g; 4,6 mmol) zugegeben und 16 h bei RT gerührt. Anschließend wird das Lösungsmittel im Vakuum entfernt und der Rückstand in Wasser (15 ml) aufgenommen, mit konz. Salzsäure angesäuert und mit EtOAc (3x20ml) extrahiert. Die organische Phase wird getrocknet und das Lösungsmittel im Vakuum entfernt. Das Rohprodukt wird chromatographisch gereinigt (Hex: EtOAc; 3:1 auf 1:1). Man erhält 0,66 g eines farblosen Öls (Ausbeute 73%). Rf 0,67 (CHCl3: MeOH; 9:1) ee = 99 % (LC-MS; Marfey-Derivatisierung) 1 H-NMR (DMSO-d6): 1,26 (d, J= 6,31 Hz, 3H); 3,91 (d, J= 2,96 Hz, 1H); 4,14 (ddd, J1= 12,49 Hz, J2= 6,18 Hz, J3= 2,94 Hz, 1H) ; 4,39 (d, J= 11,95 Hz, 1H); 4,60 (d, J= 12,09 Hz, 1H); 7,28 (m, 5H) 13 C-NMR (DMSO-d6): 16,55; 65,33; 70,25; 75,54; 127,03; 127,35; 128,16; 138;33; 170,45 MS (ESI): 234,0880 [MH-] [α]D = 11,3 (c = 9,33 mg/ml, T = 23,48 °C, EtOAc) Synthese von 2-((2S,3R)-2-Azido-3-(benzyloxy)butanazido)essigsäure-tert-butylester (98) N3 OBn H N O CO2tBu 97 (0,483 g; 2,05 mmol) und H-Gly-OtBu*HCl (1,02 g; 6,09 mmol) werden in THF (36 ml) gelöst und bei 0 °C mit TEA (0,28 ml; 2,05 mmol) und Cl-HOBt (1,2 g; 7,08 mmol) versetzt. Nachdem 15 min bei 0 °C gerührt wurde, wird EDAC (1,15 g; 6,014 mmol) zugeben. Nun wird das Kühlbad entfernt und 16 h bei RT gerührt. Anschließend wird das Reaktionsgemisch mit Ethylacetat (130 ml) verdünnt und mit 5%iger HCl-Lösung (2x30 ml), ges. NaHCO3-Lösung (2x30 ml), Wasser (2x30 ml) und ges. Natriumchloridlösung (3x10 ml) gewaschen. Die organische Phase wird getrocknet und das Lösungsmittel im Vakuum entfernt. Der Rückstand wird chromatographisch gereinigt (Hex: 108 Experimenteller Teil EtOAc; 5:1 auf 2:1). Man erhält 0,71 g eines leicht gelben viskosen Öls (Ausbeute quantitativ). Rf 0,44 (Hex:EtOAc; 3:1) 1 H-NMR (CDCl3): 1,33 (d, J= 6,31 Hz, 3H); 1,49 (s, 9H); 3,84 (dd, J1= 18,20 Hz, J2= 4,90 Hz, 1H); 4,00 (m, 3H); 4,51 (d, J= 11,69 Hz, 1H); 4,61 (d, J= 11,70 Hz, 1H); 6,97 (t, J= 4,16 Hz, 1H); 7,29 (m, 5H) 13 C-NMR (CDCl3): 16,49; 27,95; 41,90; 67,83; 70,25; 71,66; 75,53; 82,37; 127,73; 128,33; 137,63; 167;85; 168,85 MS (ESI): 349,1864 [MH+]; 371,1679 [MNa+] Synthese von 2-((2S,3R)-2-Azido-3-(benzyloxy)butanazido)essigsäure (99) N3 OBn H N CO2H Das Peptid 98 (0,19 g; 0,574 mmol) wird bei 0 °C mit TFA (4 ml) und TES (0,2 ml; 1,25 mmol) versetzt. Nun wird 4 h bei RT gerührt und O anschließend die TFA im Vakuum entfernt. Man erhält das gewünschte Peptid in quantitativer Ausbeute. Rf 0,36 (CHCl3: MeOH; 9:1) 1 H-NMR (DMSO-d6): 1,21 (d, J= 6,31 Hz, 3H); 3,81 (m, 3H); 3,93 (dt, J1= 12,29 Hz, J2= 6,21, 1H); 4,48 (d, J= 11,82 Hz, 1H); 4,58 (d, J= 11,9 Hz, 1H); 7,29 (m, 5H); 8,58 (t, J= 5,84 Hz, 1H) 13 C-NMR (DMSO-d6): 16,69; 40,74; 65,81; 70,44; 75,15; 127,43; 127,54; 128,19; 138;38; 168,37; 170,85 MS (ESI): 293,1245 [MH+]; 315,1061 [MNa+] Synthese von Boc-Leu-Phe-OH (150) H N BocHN O O Boc-Leu-OSu (1,24 g; 3,77 mmol) wird in THF (55 ml) gelöst und OH mit H-Phe-OH (0,62 g; 3,75 mmol) und NaHCO3 (0,32 g; 3,8 mmol) gelöst in Wasser (55 ml) versetzt. Nachdem 16 h bei RT gerührt wurde, wird das Reaktionsgemisch mit einer 5%igen NaOH-Lösung auf pH 10 eingestellt und mit Ethylacetat (2x 50 ml) gewaschen. Nun wird mit 5%iger HCl-Lösung auf pH 5 angesäuert und mit Ethylacetat (3x 50 ml) extrahiert. Die 109 Experimenteller Teil organische Phase wird getrocknet und das Lösungsmittel im Vakuum entfernt. Man erhält 1,34 g (Ausbeute 95%) eines weißen Feststoffs. Rf 0,36 (Hex: EtOAc; 1:1) 1 H-NMR (CDCl3): 0,88 (t, J= 7,05 Hz, 6H); 1,43 (s, 9H); 1,57 (m, 2H); 2,99 (dd, J1= 13,97 Hz, J2= 6,31 Hz, 1H); 3,18 (d, J= 13,16 Hz, 1H); 4,19 (m, 1H); 4,31 (d, J= 5,37 Hz, 1H); 5,06 (d, J= 6,85 Hz, 1H); 7,19 (m, 5H) 13 C-NMR (CDCl3): 24,61; 28,28; 37,37; 41,05; 52,89; 53,21; 53,17; 80,53; 127,01; 128,44; 129,46; 135,91; 155,23; 172,52 MS (ESI): 379,22 [MH+]; 401,20 [MNa+] Synthese von Boc-Leu-Phe-Ala-OMe (100) H N BocHN O O Das Dipeptid (150) (0,806 g; 2,13 mmol) wird in THF N H OMe O (37 ml) gelöst und bei 0°C mit HOAt (1 g; 7,34 mmol) und H-Ala-OMe*HCl (0,88 g; 6,32 mmol) versetzt. Nach 5 min wird EDAC (1,2 g; 6,27 mmol) zugegeben und 16 h bei RT gerührt. Nun wird das Reaktionsgemisch mit Ethylacetat (130 ml) verdünnt und mit 5%iger HCl-Lösung (2x30 ml), ges. NaHCO3-Lösung (2x30 ml), Wasser (2x30 ml) und ges. Natriumchloridlösung (2x60 ml) gewaschen. Die organische Phase wird getrocknet und das Lösungsmittel im Vakuum entfernt. Man erhält 2,14 g (Ausbeute 89%) eines weißen Feststoffs. Rf 0,35 (Hex: EtOAc; 1:1) 1 H-NMR (CDCl3): 0,79 (dd, J1= 15,78 Hz, J2= 6,51 Hz, 6H); 1,19 (m, 1H); 1,27 (d, J= 7,25 Hz, 3H); 1,35 (s, 1H); 1,45 (m, 1H); 2,77 (dd, J1= 13,84 Hz, J2= 9,27 Hz, 1H); 2,99 (dd, J1= 13,90 Hz, J2= 4,50 Hz, 1H); 3,61 (s, 3H); 3,86 (m, 1H); 4,26 (dd, J1= 14,37 Hz, J2= 7,19 Hz, 1H); 3,86 (m, 1H); 4,56 (dd, J1= 8,16 Hz, J2= 4,37 Hz, 1H); 6,84 (d, J= 8,46 Hz, 1H); 7,18 (m, 5H); 7,69 (d, J= 8,46 Hz, 1H); 8,42 (d, J= 6,98 Hz, 1H) 13 C-NMR (CDCl3): 16,94; 21,63; 22,90; 24,23; 28,23; 37,84; 40,99; 47,65; 51,94; 53,01; 53,17; 78,18; 126,26; 127,98; 129,38; 137,52; 155,23; 170,94; 172,14; 172,85 MS (ESI): 464,2740 [MH+]; 486,2556 [MNa+] [α]D = -20,6 (c = 11,49 mg/ml, T = 22,98 °C, CHCl3) 110 Experimenteller Teil Synthese von H-Leu-Phe-Ala-OMe (101) Das Tripeptid 100 (200 mg, 0,432 mmol) wird in Dioxan (1 ml) gelöst und bei 0 °C mit HCl in Dioxan H N H2N O O N H OMe O (4 M, 8 ml) versetzt. Das Kältebad wird entfernt und die Reaktionsmischung 1 h bei RT gerührt. Nun wird mit EtOAc (40 ml) verdünnt und mit 5%iger HCl-Lösung (2x 60 ml), ges. NaHCO3-Lösung (2x 60 ml), Wasser (2x 60 ml) und ges. NaCl-Lösung (2x 60 ml) gewaschen. Die organische Phase wird getrocknet und das Lösungsmittel im Vakuum entfernt. Man erhält einen weißen Feststoff in quantitativer Ausbeute (156 mg). Rf 0,45 (CHCl3: MeOH; 9:1) 1 H-NMR (DMSO-d6): 0,79 (dd, J1= 15,78 Hz, J2= 6,65 Hz, 6H); 1,04 (ddd, J1= 13,50 Hz, J2= 9,00 Hz, J3= 5,71 Hz, 1H); 1,22 (m, 1H); 1,28 (d, J= 7,25 Hz, 3H); 1,58 (m, 1H); 2,78 (dd, J1= 13,84 Hz, J2= 9,00 Hz, 1H); 3,02 (dd, J1= 13,84 Hz, J2= 4,70 Hz, 1H); 3,09 (dd; J1= 9,07 Hz, J2= 5,17 Hz, 1H); 3,62 (s, 3H), 4,28 (dt; J1= 14,41 Hz, J2= 7,24 Hz, 1H); 4,58 (m, 1H); 7,19 (m, 5H); 7,97 (d, J= 7,66 Hz, 1H); 8,45 (d, J= 7,12 Hz, 1H) 13 C-NMR (DMSO-d6): 16,83; 21,65; 23,13; 23,89; 37,87; 43,92; 47,49; 51,81; 52,54; 53,03; 126,14; 127,85; 129,28; 137,44; 170,95; 172,79; 175,10 MS (ESI): 364,2246 [MH+] [α]D = -29,32 (c = 10,1 mg/ml, T = 22,99 °C, CHCl3) 111 Experimenteller Teil 5.2.6. Synthese des A´-Rings von Labyrinthopeptin A2 Synthese von Peptid 102 Die Aminosäure 74 (100 mg; 0,21 mmol) und das HO N3 O N H O CO2tBu H N O Peptid N H CO2Me NBoc2 H-Leu-Phe-Ala-OMe*HCl (93,3 mg; 0,23 mmol) werden in THF (4 ml) gelöst und bei 0 °C mit HOAt versetzt. Nach 15 min wird das Kältebad entfernt, EDAC (116 mg; 0,607 mmol) zugegeben und bei RT gerührt. Nach 16 h wird mit EtOAc (100 ml) verdünnt und mit 5%iger HClLösung (3x 30 ml), ges. NaHCO3-Lösung (3x 30 ml), Wasser (3x 30 ml) und ges. NaClLösung (3x 30 ml) gewaschen. Die organische Phase wird getrocknet und das Lösungsmittel im Vakuum entfernt. Man erhält 128 mg (Ausbeute 74 %) eines Öls. Rf 0,65 (Hex: EtOAc; 1:1) de = 83 % (NMR) 1 H-NMR (CDCl3): 0,88 (dd, J1= 6,31 Hz, J2= 3,09 Hz, 6H); 1,34 (d, J= 7,25 Hz, 3H); 1,40 (d, J= 4,41 Hz, 1H); 1,43 (s, 9H); 1,46 (s, 18H); 1,48 (d, J= 2,15 Hz, 1H); 1,55 (m, 3H); 2,09 (dd, J1= 14,78 Hz, J2= 7,93 Hz, 1H); 2,50 (dd, J1= 14,64 Hz, J2= 3,49 Hz, 1H); 2,94 (dd, J1= 14,10 Hz, J2= 8,87 Hz, 1H); 3,29 (dd, J1= 13,90 Hz, J2= 5,57 Hz, 1H); 3,69 (s, 3H); 4,18 (dt, J1= 8,66 Hz, J2= 5,54 Hz, 1H); 4,27 (d, J= 11,55 Hz, 1H); 4,39 (d, J= 11,40 Hz, 1H); 4,44 (m, 1H); 4,66 (td, J1= 8,50 Hz, J2= 5,71 Hz, 1H); 5,12 (d, J= 6,72 Hz, 1H); 6,37 (d, J= 8,33 Hz, 1H); 6,65 (d, J= 6,18 Hz, 1H); 7,05 (d, J= 3, Hz, 1H); 7,22 (m, 5H) 13 C-NMR (CDCl3): 17,76; 21,91; 22,80; 24,60; 27,66; 27,86; 28,24; 35,10; 37,34; 39,93; 48,33; 52,29; 54,15; 67,91; 69,58; 77,20; 82,98; 83, 89; 126,79; 128,55; 129,18; 152,39; 168,93; 170,21; 170,29; 170,77; 172,65 MS(ESI): 820,4435 [MH+]; 842,4236 [MNa+] 112 Experimenteller Teil Synthese von Peptid 103 HO N3 O N H O CO2H Das Peptid 102 (120 mg; 0,146 mmol) wird in TFA O H N CO2Me (0,5 ml) gelöst und mit Triethylsilan (273 µl; N H 1,71 mmol) versetzt. Nun wird 4 h bei RT gerührt und NH2 anschließend TFA im Vakuum entfernt. Das Rohprodukt wird direkt weiter verwendet. MS(ESI): 564,2763 [MH+]; 586,2579 [MNa+] Synthese von Peptid 104 HO N3 O N H O CO2H Das Peptid 103 (82 mg; 0,146 mmol) wird in O H N Acetonitril (0,5 ml) gelöst und mit TEA (88 µl; 0,63 N H CO2Me mmol) und Boc2O (34 µl; 0,160 mmol) versetzt. Nun wird 16 h bei RT gerührt. Anschließend wird das NHBoc Lösungsmittel im Vakuum entfernt. Man 95 mg des gewünschten Produkts in einer Ausbeute von 98 %. MS(ESI): 664,3291 [MH+]; 686,3103 [MNa+] Synthese von Peptid 105 104 (14 mg; 0,021 mol) und H-Thr(tBu)-Gly-OBn HO N3 O N H O NHBoc H N (9,14 mg; 0,028 mmol) werden in THF (1 ml) O N H CO2Me gelöst und bei 0 °C mit HOBt (10 mg; 0,073 mmol) versetzt. Nach 15 min wird das Kältebad entfernt und EDAC (12 mg; 0,063 mmol) O NH tBuO O HN BnO O zugegeben. Nun wird 16 h bei RT gerührt. Anschließend wird das Reaktionsgemisch mit EtOAc verdünnt und mit 5%iger HCl-Lösung (3x), ges. NaHCO3-Lösung (3x), Wasser (3x) und ges. NaCl-Lösung (3x) gewaschen. Die organische Phase wird getrocknet und das Lösungsmittel im Vakuum entfernt. MS(ESI): 968,8099 [MH+]; 990,4912 [MNa+] 113 Experimenteller Teil Synthese von Peptid 106 Das Peptid 105 (20 mg; 0,021 mmol) wird in HO H2N O N H O NHBoc Methanol (1 ml) gelöst und mit Pd/C (4 mg) versetzt. O H N N H CO2Me Nun wird 2 d unter Wasserstoffatmosphäre (1 bar) gerührt. Anschließend wird der Katalysator abfiltriert und das Lösungsmittel im Vakuum entfernt. Man O NH tBuO erhält das gewünschte Produkt in einer Ausbeute 95 % ( 17 mg). O HN HO O LC-MS: 852,5 [MH+] Versuch zur Synthese von Peptid 107 Tabelle 4: Reagenzien zur Zyklisierung von 106 O HO H N HN Mix 1 DPPA O NaHCO3 HN O NH O tBuO Reagenz N H O NH O Boc Mix 2 HATU Collidin HN CO 2 Me Mix 3 DEPBT N-Ethylmorpholin Menge 0,4 µl 3 eq 2,4 mg 5 eq 0,3 mg 3 eq 0,1 µl 5 eq 0,4 mg 3 eq 0,1 µl 5 eq Das Peptid 106 (5,26 µmol) wird in DMF (1 ml) gelöst und mit dem Kupplungsreagenz und der Base (Mix 1-3; Tab. 4) versetzt nun wird 2 d bei RT geschüttelt. Das gewünschte Produkt konnte nicht identifiziert werden. 114 Experimenteller Teil Synthese von Peptid 109 HO H2N O N H O CO2tBu H N O Das Peptid 102 (48,5 mg; 0,059 mmol) wird in THF N H CO2Me (3,2 ml) gelöst und unter Argon mit PBu3 (64 µl; 0,25 mmol) und Wasser (32 µl) versetzt. Nun wird 1 NBoc2 6 h bei RT unter Argon gerührt. Anschließend wird das überschüssige PBu3 im Luftstrom oxidiert und das Lösungsmittel im Vakuum entfernt. Das erhaltene Produkt wird direkt weiterverwendet. Rf 0,26 (Hex: EtOAc; 1:1) MS(ESI): 794,4513 [MH+]; 816,4318 [MNa+] Synthese von Peptid 108 CbzHN HO H N O N H O CO 2 tBu O Das Peptid 109 (6 mg, 0,007 O H N N H CO 2Me mmol) wird THF (0,4 ml) gelöst und mit HATU (4,2 mg; 0,01 mmol), DIPEA (3 µl; 17,64 NBoc 2 µmol) und Cbz-Gly-OH (2,3 mg; 0,01 mmol) versetzt. Das Reaktionsgemisch wird 16 h bei RT gerührt. Nun wird das Reaktionsgemisch mit 5% HCl (1 ml) versetzt und 15 min bei RT gerührt, anschließend wird durch Zugabe von ges. K2CO3-Lösung pH 10 eingestellt und ebenfalls 15 min bei RT gerührt. Das gewünschte Produkt wurde nur massenspektrometrisch nachgewiesen. MS(ESI): 985,5146 [MH+]; 1007,4954 [MNa+] Synthese von Peptid 110 O N3 N H OBn HO H N O O N H O CO2tBu H N Das Peptid 109 (48,5 mg; 0,06 mmol) O N H CO2Me wird in THF (3,5 ml) gelöst und bei 0 °C mit HATU (36 mg; 0,095 mmol), DIPEA (36 µl; 0,221 mmol) und 99 NBoc2 (26,3 mg; 0,09 mmol) zugegeben. Das Reaktionsgemisch wird 2 d bei RT gerührt. Anschließend wird das Lösungsmittel im Vakuum entfernt und der Rückstand mittels 115 Experimenteller Teil Säulenchromatographie (CHCl3: MeOH; 9:0,5) grob gereinigt. Es wurden 20 mg des gewünschte Peptid erhalten ( Ausbeute 32 %). Rf 0,47 (CHCl3: MeOH; 9:1) MS(ESI): 1068,5607 [MH+]; 1090,5416 [MNa+] Synthese von Peptid 111 O N3 N H OBn HO H N O N H O CO2H O H N O Das N H CO2Me Peptid 110 (20 mg, 19 µmol) wird bei 0 °C mit TFA (200 µl) und TES (76 µl) versetzt. Nun wird NH2 5 h bei RT gerührt. Anschließend wird das Lösungsmittel im Vakuum entfernt. Das Rohprodukt wird ohne weitere Reinigung direkt weiter verwendet. Rf 0,37 (CHCl3: MeOH; 9:2) MS(ESI): 812,3930 [MH+]; 834,3741 [MNa+] Synthese von Peptid 112 O N3 N H OBn HO H N O Das Peptid 111 (15 mg; 19 µmol) wird O N H O CO2H H N O in Acetonitril (0,3 ml) gelöst und mit N H CO2Me TEA (11 µl; 79 µmol) und Boc2O (5 µl; 24 µmol) versetzt. Nun wird 16 h NHBoc bei RT gerührt. Anschließend wird das Lösungsmittel im Vakuum entfernt. Das Rohprodukt wird ohne weitere Reinigung direkt weiter verwendet. Rf 0,37 (CHCl3: MeOH; 9:1) 116 Experimenteller Teil Synthese von Peptid 113 HO H N O H2N N H OBn O N H O CO2H O Das Peptid 112 (19 µmol) wird in O H N N H CO2Me THF (0,4 ml) gelöst und mit H2O (10 µl) und PBu3 (16 µl; 64 µmol) versetzt. Nun wird 2 d bei RT gerührt. NHBoc Anschließend wird das Lösungsmittel im Vakuum entfernt. Das Rohprodukt wird ohne weitere Reinigung direkt weiterverwendet. MS(ESI): 886,4589 [MH+] Versuch zur Synthese von Peptid 114 O HO H N HN gelöst HN NH O BnO Peptid 113 (19 µmol) wird in DMF (2 ml) O N H mit DEPBT (28 mg; O 93,5 µmol) und 4-Ethylmorpholin (6 µl; HN 54 µmol) versetzt. Nun wird 7 d bei RT NH 2 O O und CO 2 Me gerührt. Anschließend wird das Reaktionsgemisch mit TFA (0,5 ml) versetzt, 0,5 h bei RT gerührt und das Lösungsmittel nun im Vakuum entfernt. Das gewünschte Produkt konnte nicht identifiziert werden. 117 Experimenteller Teil Synthese von Peptid 120 Das Tripeptid H-Leu-Phe-Ala-OMe 101 (152 mg; O N3 O N H O CO2tBu H N 0,419 mmol) und die Aminosäure 119 (127 mg; O N H NBoc2 CO2Me 0,253 mmol) werden in THF (5 ml) gelöst und bei 0 °C mit HOBt (170 mg; 1,26 mmol) versetzt. Nachdem 15 min bei RT gerührt wurde, wird EDAC (150 mg; 0,785 mmol) zugesetzt, das Kältebad entfernt und 16 h bei RT gerührt. Anschließend wird das Reaktionsgemisch mit EtOAc (150 ml) verdünnt und mit 5% HCl (2x 30 ml), ges. NaHCO3-Lösung (2x 30 ml), Wasser (30 ml) und ges. NaCl-Lösung (30 ml) gewaschen. Die organische Phase wird getrocknet und das Lösungsmittel im Vakuum entfernt. Der Rückstand wird chromatographisch gereinigt (Hex: EtOAc; 2:1). Man erhält 130 mg das Tetrapeptids als ein Gemisch aus Diastereomeren (Ausbeute 62 %). Rf 0,39 (Hex: EtOAc; 1:1) de = 74 % (NMR) 1 H-NMR (CDCl3): 0,80 (dd, J1= 10,61 Hz, J2= 6,45 Hz, 6H); 1,27 (d, J= 7,25 Hz, 3H); 1,34 (s, 9H); 1,38 (m, 1H); 1,43 (s, 18H); 1,49 (m, 1H); 2,36 (dd, J1= 15,51 Hz, J2= 9,87 Hz, 1H); 2,56 (dd, J1= 15,50 Hz, J2= 2,08 Hz, 1H); 2,75 (dd, J1= 14,04 Hz, J2= 9,60 Hz, 1H); 3,01 (dd, J1= 13,97 Hz, J2= 4,57 Hz, 1H); 3,22 (s, 3H); 3,52 (d, J= 10,07 Hz, 1H); 3,59 (s, 3H); 3,62 (d, J= 10,00 Hz, 1H); 4,22 (m, 2H); 4,53 (td, J1= 8,93 Hz, J2= 4,75 Hz, 1H); 4,69 (dd, J1= 9,81 Hz, J2= 2,15 Hz, 1H); 7,22 (m, 5H); 7,59 (d, J= 8,33 Hz, 1H); 7,96 (d, J= 8,46 Hz, 1H); 8,44 (d, J= 6,98 Hz, 1H) 13 C-NMR (CDCl3): 16,89; 21,76; 23,01; 24,02; 27,47; 27,64; 31,75; 37,66; 41,04; 47,67; 51,83; 51,94; 53,27; 55,27; 58,85; 69,21; 76,58; 81,19; 82,47; 126,28; 128,04; 129,27; 137,62; 152,10; 167,69; 168,44; 170,84; 171,17; 172,91 MS(ESI): 834,4606 [MH+]; 856,4415 [MNa+] 118 Experimenteller Teil Synthese von Peptid 121 Das Tetrapeptid 120 (40 mg; 0,48 mmol) wird in O H2N O N H O CO2tBu EtOAc (10 ml) gelöst und mit Pd/C (20 mg) O H N N H versetzt. CO2Me Nun wird Wasserstoffatmosphäre 16 (1 bar) h unter gerührt. Anschließend wird der Katalysator abfiltriert und NBoc2 der Rückstand chromatographisch gereinigt (Hex:EtOAc; 1:1). Man erhält 26 mg des entsprechenden Produktes als ein Gemisch aus Diastereomeren (Ausbeute 65%). Rf 0,45 (CHCl3: MeOH; 9:1) de = 86 % (NMR) 1 H-NMR (DMSO-d6): 0,80 (dd, J1= 10,81 Hz, J2= 6,51 Hz, 6H); 1,26 (d, J= 7,25 Hz, 3H); 1,33 (s, 9H); 1,43 (s, 18H); 1,84 (dd, J1= 14,91 Hz, J2= 7,89 Hz, 1H); 2,30 (dd, J1= 15,38 Hz, J2= 3,02 Hz, 1H); 2,74 (dd, J1= 14,04 Hz, J2= 9,60 Hz, 1H); 3,06 (dd, J1= 14,31 Hz, J2= 4,63 Hz, 1H); 3,14 (s, 3H); 3,18 (d, J= 5,10 Hz, 1H); 3,42 (d, J= 8,73 Hz, 1H); 3,59 (s, 3H); 4,23 (m, 2H); 4,53 (td, J1= 8,93 Hz, J2= 4,84 Hz, 1H); 4,82 (dd, J1= 7,52 Hz, J2= 3,09 Hz, 1H); 7,18 (m, 6H); 7,87 (m, 2H); 8,44 (d, J= 6,98 Hz, 1H) 13 C-NMR (DMSO-d6): 16,88; 21,88; 23,10; 24,13; 27,55; 27,66; 35,43; 37,43; 41,30; 47,70; 51,24; 51,91; 53,31; 54,98; 58,72; 60,07; 77,35; 80,68; 82,33; 126,28; 128,07; 129,21; 137,70; 152,01; 157,83; 158,14; 168,43; 170,81; 170,81; 171,56; 172,87 MS(ESI): 808,4697 [MH+]; 830,4501 [MNa+] Synthese von Peptid 122 Die O H N O N3 N H OBn O O N H O CO2tBu H N Peptide 121 (71 mg; 0,088 mmol) und 99 (74 mg; O N H CO2Me 0,253 mmol) werden in THF (5 ml) gelöst und bei 0°C mit DIPEA (100 µl; 0,58 mmol) und HATU NBoc2 (100 mg; 0,263 mmol) versetzt. Nachdem 2 d bei RT gerührt wurde, wird das Lösungsmittel im Vakuum entfernt. Der Rückstand wird in EtOAc aufgenommen und mit 1% HCl-Lösung, ges. NaHCO3-Lösung und ges. NaCl-Lösung gewaschen. Das Lösungsmittel wird im Vakuum entfernt und der Rückstand chromatographisch gereinigt (CHCl3:MeOH; 50:1). Wobei das unerwünschte 119 Experimenteller Teil Diastereomer in einer Mischfraktion mit dem Produkt entfernt werden konnte. Man erhält 73 mg (Ausbeute 73%) des gewünschten Hexapeptids. Rf 0,38 (CHCl3: MeOH; 9:1) de = 99 % (NMR) 1 H-NMR (CDCl3): 0,79 (dd, J1= 13,43 Hz, J2= 6,31 Hz, 6H); 1,32 (m, 1H) 1,39 (d, J= 6,45 Hz, 3H); 1,46 (s, 9H); 1,48 (s, 18H); 1,57 (m , 2H); 2,36 (dd, J1= 15,04 Hz, J2= 1,61 Hz, 1H); 2,68 (dd, J1= 15,04 Hz, J2= 7,93 Hz, 1H); 2,94 (dd, J1= 14,24 Hz, J2= 11,55 Hz, 1H); 3,30 (s, 3H); 3,50 (dd, J1= 14,31 Hz, J2= 3,83 Hz, 1H); 3,70 (s, 3H); 3,74 (d, J= 9,54 Hz, 1H); 3,82 (dd, J1= 16,93 Hz, J2= 5,91 Hz, 1H); 3,87 (dd, J1= 16,85 Hz, J2= 4,38 Hz, 1H); 3,04 (d, J= 3,90 Hz, 1H); 4,16 (ddd, J1= 12,63 Hz, J2= 6,25 Hz, J3= 3,96 Hz; 1H); 4,49 (d, J= 11,69 Hz, 1H); 4,53 (d, J= 7,32 Hz, 1H); 4,59 (d, J= 11,50 Hz, 1H); 4,72 (ddd, J1= 11,72 Hz, J2= 8,43 Hz, J3= 3,90 Hz; 1H); 5,44 (dd, J1= 7,66 Hz, J2= 1,61 Hz, 1H); 7,05 (t, J= 7,32 Hz, 1H); 7,14 (m, 3H); 7,29 (m, 10H); 7,41 (d, J= 8,73 Hz, 1H) 13 C-NMR (CDCl3): 16,91; 17,64; 21,04; 23,02; 24,80; 27,77; 28,04; 36,28; 39,48; 44,72; 48,34; 52,30; 53,53; 54,37; 54,78; 59,10; 60,74; 67,98; 71,83; 72,48; 75,69; 83,03; 83,36; 126,24; 127,67; 127,94; 128,17; 128,50; 129,20; 137,52; 138,40; 152,30; 169,12; 169,90; 171,33; 172,17; 172,91; 173,62 MS(ESI): 1082,5784 [MH+]; 1104,5583 [MNa+] Synthese von Peptid 123 O H N O N3 N H OBn O N H O CO2H O H N Das O N H CO2Me Peptid 122 (52 mg; 0,048 mmol) wird bei 0 °C in TFA (510 µl) gelöst und mit TES NH2 (196 µl) versetzt. Nun wird 8 h bei RT gerührt. Anschließend wird das Peptid mit eiskaltem Hexan ausgefällt. Man erhält 40 mg des gewünschten Peptids in quantitativer Ausbeute. Rf 0,50 (CHCl3: MeOH; 9:2) MS(ESI): 826,4637 [MH+]; 848,4436 [MNa+] 120 Experimenteller Teil Synthese von Peptid 124 O H N O N3 N H OBn Das Peptid 123 (0,048 mmol) wird O N H O CO2H O H N O in Acetonitril (0,76 ml) gelöst und N H CO2Me mit TEA (28µl; 0,202 mmol) und Boc2O NHBoc (13 µl; 0,072 mmol) versetzt. Nun wird 16 h bei RT gerührt, anschließend wird das Lösungsmittel im Vakuum entfernt. Der Rückstand wird chromatographisch gereinigt (CHCl3: MeOH; 9:0,5 auf 9:1). Man erhält 42 mg des gewünschten Produkt (Ausbeute 95%). Rf 0,5 (CHCl3: MeOH; 9:1) de = 99 % (NMR) 1 H-NMR (DMSO-d6): 0,71 (d, J= 6,58 Hz, 3H); 0,77 (d, J= 6,45 Hz, 3H); 1,19 (d, J= 5,91 Hz, 3H); 1,21 (m, 1H); 1,30 (d, J= 7,25 Hz, 3H); 1,36 (s, 9H); 1,51 (m, 1H); 2,03 (dd, J1= 14,78 Hz, J2= 6,72 Hz, 1H); 2,24 (m, 1H); 2,78 (dd, J1= 13,77 Hz, J2= 10,68 Hz, 1H); 3,12 (dd, J1= 13,77 Hz, J2= 3,83 Hz, 1H); 3,20 (s, 3H); 3,59 (s, 3H); 3,74 (m, 3H); 3,85 (d, J= 5,10 Hz, 1H); 3,93 (m, 4H); 4,23 (dt, J1= 14,10 Hz, J2= 7,05 Hz, 1H); 4,42 (td, J1= 9,44 Hz, J2= 4,63 Hz, 1H); 4,45 (d, J= 11,96 Hz, 1H); 4,57 (d, J= 11,80 Hz, 1H); 7,15 (m, 6H); 7,28 (m, 6H); 7,68 (d, J= 6,31 Hz, 1H); 7,73 (d, J= 7,39 Hz, 1H); 7,82 (d, J= 5,37 Hz, 1H); 8,56 (d, J= 7,39 Hz, 1H) 13 C-NMR (DMSO-d6): 16,70; 16,81; 21,20; 23,05; 23,89; 28,30; 37,05; 43,21; 47,89; 51,89; 51,89; 52,59; 53,75; 58,56; 61,07; 66,07; 70,48; 72,78; 75,18; 77,88; 126,13; 127,47; 128,03; 128,23; 129,18; 138,18; 138,44; 154,95; 168,86; 169,22; 170,91; 171,67; 172,68 MS(ESI): 926,4876 [MH+]; 948,4423 [MNa+] Synthese von Peptid 125 O H N O NH2 N H OBn O O N H O CO2H H N Das Peptid 124 (43 mg; 0,043 mmol) O N H CO2Me wird in THF (1 ml) gelöst und mit polymergebundenen NHBoc PPh3 (0,1 g; 0,086 mmol) und Wasser (30 µl) versetzt. Nun wird das Reaktionsgemisch 4 d bei RT geschüttelt. Anschließend wird das Lösungsmittel im Vakuum entfernt und das Rohprodukt direkt weiter verwendet. 121 Experimenteller Teil Rf 0,25 (CHCl3: MeOH; 9:2) MS(ESI): 900,4651 [MH+]; 922,4452 [MNa+] Synthese von Peptid 126 O O H N HN wird in THF (9,5 ml) gelöst und bei 0°C HN NH O BnO Das Peptid 125 (13 mg; 0,0145 mmol) O N H O NH O Boc mit DIPEA (13,2 µl; 0,08 mmol) und O HATU (29 mg; 0,076 mmol) versetz. HN CO 2 Me Nun wird 2 d bei RT gerührt. Anschließend wird das Lösungsmittel im Vakuum entfernt. Das gewünschte Produkt konnte bisher nur massenspektrometrisch charakterisiert werden. MS(ESI): 882,4607 [MH+] 122 Experimenteller Teil 5.2.7. Synthese eines analytischen Refenzenzstandards zum Labioninnachweis Synthese von L-Cbz-Ala-OH (127) OH CbzHN O Alanin (7 g; 78,57 mmol) wird in ges. Natriumhydrogencarbonat-Lösung (320 ml) gelöst und mit Cbz-Cl (16,8 ml; 117,7 mmol) versetzt. Nachdem das Reaktionsgemisch 16 h bei RT stark gerührt wurde, wird mit Diethylether (3x 250 ml) gewaschen. Die wässrige Phase wird mit 10%iger HCl-Lösung angesäuert und mit EtOAc (5x 250 ml) extrahiert. Die organische Phase wird mit Natriumsulfat getrocknet und das Lösungsmittel im Vakuum entfernt. Man erhält 17,19 g (Ausbeute 98 %) eines weißen Feststoffes. Rf 0,47 (CHCl3:MeOH; 9:2) 1 H-NMR (DMSO-d6): 1,22 (d, J=7,39 Hz, 3H); 3,99 (dt, J1=14,74 Hz, J2=7,34 Hz, 1H); 5,01 (s, 2H); 7,33 (m, 5H) 13 C-NMR (DMSO-d6): 17,14; 49,29; 65,42; 127,83; 128,42 ;137,11; 155,92; 174,47 MS (EI): 223,0847 [M+] Synthese von L-Cbz-Ala-OAll (128) O CbzHN O Cbz-Alanin (5 g; 22,4 mmol) wird in DMF (400 ml) gelöst und mit Cäsiumcarbonat (15 g; 46,03 mmol) und Allylbromid (2,14 ml; 24,7 mmol) versetzt. Nachdem 16 h bei RT gerührt wurde, wird mit EtOAc (300 ml) verdünnt und mit ges. NaCl-Lösung (5x 300 ml) gewaschen. Die organische Phase wird mit Na2SO4 getrocknet und das Lösungsmittel im Vakuum entfernt. Das überschüssige Allylbromid wird am Hochvakuum entfernt. Man erhält 5,77 g (Ausbeute 98 %) eines leicht gelben Öls. Rf 0,45 (Hex:EtOAc; 3:1) 1 H-NMR (DMSO-d6): 1,42 (d, J=7,39 Hz, 3H); 4,41 (dt, J1=14,67 Hz, J2=7,32 Hz, 1H); 4,57 (d, J=4,30 Hz, 2H), 5,02 (s, 2H); 5,19 (d, J=10,86 Hz, 2H); 5,29 (d, J=17,33 Hz, 2H); 5,86 (ddd, J1=22,23 Hz, J2=10,61 Hz, J3=5,44 Hz, 1H); 7,33 (m, 5H); 7,73 (d. J=6,98 Hz, 1H) 13 C-NMR (CDCl3): 18,68; 49,64; 65,92; 66,89; 118,72; 128,08; 128,14; 128,50; 131,50; 136,23; 155,54; 174,64 MS (EI): 263,1165 [M+] 123 Experimenteller Teil Synthese von rac-Cbz-α-Allyl-Ala-OH (129) Diisopropylamin (3,5 ml; 25 mmol) wird in THF (23 ml) gelöst und bei OH CbzHN O -30 °C mit nButyllithium (1,6 M; 15,7 ml) versetzt. Nun wird 1 h bei -30 °C gerührt und anschließend auf -78°C herabgekühlt. Der Reaktionslösung wird nun Cbz-Ala-OAll (3 g, 11,4 mmol) gelöst in THF (17 ml) zugetropft, gefolgt von in THF (17 ml) gelöstem Zinkchlorid (1,8 g, 13,2 mmol). Nach 4 h wird die Kühlung abgeschaltet und die Reaktionslösung über 12 h auf RT erwärmt. Nun wird mit EtOAc (100 ml) verdünnt und mit 5%iger HCl-Lösung gewaschen. Die organische Phase wird mit Natriumsulfat getrocknet und das Lösungsmittel im Vakuum entfernt. Der Rückstand wird chromatographisch gereinigt (Hex:EtOAc; 3:1 auf CHCl3:MeOH; 9:2;). Man erhält 2,4 g (Ausbeute 86 %) eines dunkelbraunen Öls. Rf 0,54 (CHCl3:MeOH; 9:1) 1 H-NMR (MeOD-d4): 1.44 (s, 3H); 2,59(dd, J1= 13,57 Hz, J2= 8,06 Hz, 1H); 2,68 (dd, J1= 13,40, Hz, J2= 7,23, Hz, 1H); 5,06 (m, 4H); 5,72 (m, 1H); 7,29(m, 6H) 13 C-NMR (MeOD-d4): 23,23; 41,94; 59,92; 67,27; 119,35; 128,73; 128,92; 129,41; 133,86; 138,28; 157,14; 177,27 MS (EI): 263,1157 [M] + Synthese von rac-Cbz-α-Allyl-Alanin-tert-butylester (130) Cbz-α-Allyl-Alanin (129) (3,9 g, 14,82 mmol) wird in tBuOH (150 ml) OtBu CbzHN O gelöst und mit DMAP (1,1 g; 2,08 mmol) und Boc2O (5,87 ml, 28,31 mmol) versetzt. Nachdem 2 d bei 25 °C gerührt wurde, wird das Lösungsmittel im Vakuum entfernt und der Rückstand chromatographisch (Hex:EtOAc; 6:1 auf 3:1) gereinigt. Man erhält 1,4 g (Ausbeute 30 %) eines farblosen Öls. Cbz-α-Allyl-Alanin (129) (2,21 g; 8,4 mmol) wird in DCM (14 ml) gelöst und mit tert-ButylAcetimidat (3,66 g; 16,75 mmol) gelöst in Hexan (18 ml) versetzt. Nun wird Bortrifluoridetherat (0,169 ml; 1,37 mmol) zugegeben und 16 h bei RT gerührt. Anschließend wird das Reaktionsgemisch filtriert, das Lösungsmittel im Vakuum entfernt und der Rückstand chromatographisch gereinigt (Pen: EtOAc; 5:1). Man erhält 1,61 g eines farblosen Öls (Ausbeute 60 %). 124 Experimenteller Teil Rf 0,66 (Hex:EtOAc; 3:1) ee = 5 % (chirale HPLC; OD-H) 1 H-NMR (DMSO-d6): 1,24 (s, 3H);1,31 (s, 9H); 2,37(dd, J1= 13,70 Hz, J2= 7,66 Hz, 1H); 2,53 (m, 1H); 5,02 (m, 4H); 7,31(m, 6H); 7,51 (s, 1H) 13 C-NMR (CDCl3): 23,28; 27,83; 41,00; 59,57; 66,18; 82,00; 119,04; 127,93; 127,96; 128,43; 136,65; 154,52; 172, 73 MS (EI): 319,1788 [M+] Synthese von rac-Cbz-2-amino-4,5-dihydroxy-2-methyl-pentansäure-tert-butylester (131) HO Der tert-Butylester 130 (1,78 g; 5,57 mmol) wird in einem tBuOH- HO Wassergemisch (1:1; 26 ml) gelöst und mit AD-Mix-β (7,84 g) versetzt, OtBu CbzHN O anschließend wird 16 h bei RT stark gerührt. Die Reaktion wird durch Zugabe von Natriumsulfit (8,6g; 68,28 mmol) beendet und mit EtOAc extrahiert (3x10 ml). Die organische Phase wird über Natriumsulfat getrocknet und das Lösungsmittel im Vakuum entfernt. Man erhält 1,2 g eines farblosen Öls (Ausbeute 61 %). Rf 0,22 (Hex:EtOAc; 1:1) de = 22 % (chirale HPLC; OD-H) 1 H-NMR (CDCl3): 1,42 (s, 3,6H); 1,44 (s, 5,2H); 1,54 (s, 1,8H); 1,58 (s, 1,3H); 1,84 (d, J= 14,24 Hz, 0,56H); 1,98 (dd, J1= 14,37 Hz, J2= 10,34 Hz, 1H); 2,08 (m, 0,74H); 2,22 (d, J= 14,37 Hz, 0,72H); 3,39 (dd, J1= 10,95 Hz, J2= 7,46 Hz, 1H); 3,52 (m, 1 H); 3,79 ( m, 1 H); 5,045 (m, 2H); 6,16 (s, 0,35H); 6,20 (s; 0,53H); 7,31 (m, 5H) 13 C-NMR (CDCl3): 24,06; 27,77; 39,22; 40,53; 58,37; 59,51; 66,37; 66,83; 66,91; 68,77; 69,40; 82,32; 82,39; 128,02; 128,07; 128,10; 128,50; 136,57; 154,68; 173,19; 173,70 MS (ESI): 354,1914 [MH+] 125 Experimenteller Teil Allgemeine Synthesevorschrift zur Darstellung von Cbz-2-Amino-5-tert-butylsilylether4-hydroxy-2-methyl-pentansäure-tert-butylester (+/-132a/b) Das Diol 131 (1 äq.) wird in DMF (6,25 ml/mmol) gelöst und mit TBDMSCl (1,05 äq.) und Imidazol (1,1 äq.) versetzt. Nachdem das Reaktionsgemisch 5 h bei RT gerührt wurde, wird die Reaktion durch Zugabe von Wasser beendet und das Reaktionsgemisch mit EtOAc (45 ml/mmol) verdünnt. Die organische Phase wird mit ges. NaCl-Lösung gewaschen (4x), über Natriumsulfat getrocknet und das Lösungsmittel im Vakuum entfernt. Der Rückstand wird chromatographisch gereinigt (Hex:EtOAc; 9:1) und die bei der Reaktion gebildeten Diastereomere konnten getrennt werden. (2S,4S)/ (2R,4R)-Cbz-2-Amino-5-tert-butylsilyloxy-4-hydroxy-2-methyl-pentansäure-tertbutylester (+/-132a) TBDMSO TBDMSO HO HO OtBu CbzHN OtBu CbzHN O O Ausbeute: 41 % (921 mg) Rf 0,57 (Hex:EtOAc; 5:1) de = 98 % (chirale HPLC; OD-H) 1 H-NMR (CDCl3): 0,04 (d, J= 0,94 Hz, 6H); 0,88 (s, 9H); 1,44 (s, 9H); 1,55 (s, 3H); 1,97 (dd, J1= 14,24 Hz, J2= 10,34 Hz, 1H); 2,14 (d, J= 14,80 Hz, 1H); 2,31 (d, J= 3,90 Hz, 1H); 3,36 (dd, J1= 9,87 Hz, J2= 7,05 Hz, 1H); 3,56 (dd, J1= 10,21 Hz, J2= 2,96 Hz, 1H); 3,73 (ddd, J1= 9,74 Hz, J2= 6,78 Hz, J3= 2,96 Hz, 1H); 5,07 (dd, J1= 16,25 Hz, J2= 12,48 Hz, 2H); 6,32(s,1H); 7,29 (m, 5H) 13 C-NMR (CDCl3): -5,46; -5,38; 18,23; 23,66; 25,84; 27;75; 39,17; 58,36; 66,07; 67,02; 68,40; 81,79; 86,60; 127,84; 127,42; 136,77; 154,53; 172,52 MS (ESI): 468,2767 [MH+] 126 Experimenteller Teil (2R,4S)/ (2S,4R)-Cbz-2-Amino-5-tert-butylsilyloxy-4-hydroxy-2-methyl-pentansäure-tertbutylester (+/-132b) TBDMSO TBDMSO HO HO OtBu CbzHN OtBu CbzHN O O Ausbeute: 27 % (606 mg) Rf 0,45 (Hex:EtOAc; 5:1) de = 98 % (chirale HPLC; OD-H) 1 H-NMR (CDCl3): 0,04 (d, J= 0,94 Hz, 6H); 0,88 (s, 9H); 1,42 (s, 9H); 1,61 (s, 3H); 1,82 (dd, J1= 14,78 Hz, J2= 2,15 Hz, 1H); 1,88 (dd, J1= 14,50 Hz, J2= 9,34 Hz, 1H); 2,66 (s, 1H); 3,35 (dd, J1= 9,81 Hz, J2= 3,76 Hz, 1H); 3,77 (dd, J1= 14,78 Hz, J2= 2,15 Hz, 1H); 5,07 (s, 2H); 6,40 (s, 1H); 7,32 (m, 5H) 13 C-NMR (CDCl3): -5,38; 18,27; 24,73; 25,85; 27,88; 40,68; 59,66; 66,25; 67,28; 69,30; 81,71; 86,60; 127,91; 128,07; 128,42, 136,81; 155,52; 172,96 MS (ESI): 468,2767 [MH] + Allgemeine Synthesevorschrift zur Darstellung von Cbz-2-Amino-4-azido-5-tertbutylsilyloxy-2-methyl-pentansäure-tert-butylester (+/-133a/b) Der TBDMS-Ether (+/-132a/b) (1 äq.) wird in wasserfreiem THF (10 ml/mmol) gelöst und mit Triphenylphosphin (2,5 äq.) versetzt. Die Reaktionslösung wird auf -78 °C herabgekühlt und langsam mit DEAD (7,5 äq.) und DPPA (2,5 äq.) versetzt. Nachdem 16 h bei -78 °C gerührt wurde, wird das Lösungsmittel im Vakuum entfernt und der Rückstand chromatographisch gereinigt (Hex: EtOAc; 14:1). (2S,4S)/ (2R,4R)-Cbz-4-2-Amino-4-azido-5-tert-butylsilyloxy-2-methyl-pentansäure-tertbutylester (+/-134a) TBDMSO TBDMSO N3 N3 OtBu CbzHN O OtBu CbzHN O 127 Experimenteller Teil Ausbeute: 49 % (156 mg) Rf 0,44 (Hex: EtOAc; 5:1) de = 97 % (chirale HPLC; OD-H) 1 H-NMR (CDCl3): 0,06 (d, J= 1,48 Hz, 6H); 0,90 (s, 9H); 1,44 (s, 9H); 1,56 (s, 3H); 1,93 (dd, J1= 14,84 Hz, J2= 3,02 Hz, 1H); 2,05 (m, 1H); 3,39 (m, 1H); 3,58 (dd, J1= 10,2 Hz, J2= 7,39 Hz, 1H); 3,64 (dd, J1= 10,2 Hz, J2= 4,43 Hz, 1H); 5,08 (dd,J1= 21,9 Hz, J2= 12,2 Hz, 2H); 5,79 (s, 1H); 7,33 (m, 5H) 13 C-NMR (CDCl3): -5,57; -5,54; 18,20; 24,28; 25,76; 27,81; 36,83; 56,51; 59,14; 60,62; 66,42; 66,95; 82,32; 128,02; 128,05; 128,46, 136,59; 154,92; 172,58 MS (ESI): 493,2830 [MH+]; 515,2646 [MNa+] (2R,4S)/ (2S,4R)-Cbz-2-Amino-4-azido-5-tert-butylsilyloxy-2-methyl-pentansäure-tert- butylester (+/-133b) TBDMSO TBDMSO N3 N3 OtBu CbzHN OtBu CbzHN O O Ausbeute: 68 % (188 mg) Rf 0,55 (Hex: EtOAc; 5:1) de = 92 % (chirale HPLC; OD-H) 1 H-NMR (CDCl3): 0,06 (d, J= 1,88 Hz, 6H); 0,90 (s, 9H); 1,54 (s, 9H); 1,57 (s, 3H); 1,87 (dd, J1= 14,37 Hz, J2= 10,61 Hz, 1H); 2,36 (d, J= 14,10 Hz, 1H); 3,36 (m, 1H); 3,54 (dd, J1= 10,34 Hz, J2= 7,66 Hz, 1H); 3,69(d, J= 8,19 Hz, 1H); 5,07 (s, 2H); 6,14 (s, 1H); 7,32 (m, 5H) 13 C-NMR (CDCl3): -5,58; -5,54; 18,20; 24,40; 25,78; 27,65; 36,63; 58,31; 60,28; 66,27; 66,76; 82,66; 127,86; 128,05; 128,51, 136,61; 154,30; 172,61 MS (ESI): 493,2823 [MH+]; 515,2639 [MNa+] 128 Experimenteller Teil Allgemeine Synthesevorschrift zur Darstellung von Cbz-2-Amino-4-azido-5-hydroxy-2methyl-pentansäure-tbutylester (+/-134a/b) Das Azid (133a/b) (1 äq.) wird in THF (7,4 ml/mmol) gelöst und bei 0 °C mit einer TBAFLösung (1M in THF; 1,2 äq.) versetzt. Nachdem 4 h bei 0 °C gerührt wurde, wird die Reaktion durch Zugabe von ges. NH4Cl-Lösung beendet und das Reaktionsgemisch mit EtOAc (3x) extrahiert. Die organische Phase wird getrocknet und das Lösungsmittel im Vakuum entfernt. Das Rohprodukt wird chromatographisch gereinigt (Hex:EtOAc; 3:1). (2S,4S)/ (2R,4R)-Cbz-2-Amino-4-azido-5-hydroxy-2-methyl-pentansäure-tert-butylester (+/-134a) HO HO N3 N3 OtBu CbzHN OtBu CbzHN O O Ausbeute: 70 % (128 mg) Rf 0,55 (Hex:EtOAc; 1:1) de = 98 % (chirale HPLC; OD-H) 1 H-NMR (CDCl3): 1,45 (s, 9H); 1,56 (s, 3H); 2,06 (dd, J1= 14,84 Hz, J2= 3,96 Hz, 1H); 2,27 (dd, J1= 14,71 Hz, J2= 7,72 Hz, 1H); 3,43 (m, 1H); 3,54 (dd, J1= 11,30 Hz, J2= 7,11 Hz, 1H); 3,62 (dd, J1= 11,15 Hz, J2= 4,23 Hz, 1H); 5,08 (dd, J1= 21,85 Hz, J2= 12,28 Hz, 2H); 5,78 (s, 1H); 7,33 (m, 5H) 13 C-NMR (CDCl3): 24,60; 27,78; 36,47; 58,98; 61,13; 65,49; 66,56; 82,80; 128,10; 128,49; 136,45; 154,89; 172,63 MS (ESI): 379,1965 [MH+]; 401,1778 [MNa+] (2R,4S)/ (2S,4R)-Cbz-2-Amino-4-azido-5-hydroxy-2-methyl-pentansäure-tert-butylester (+/-134b) HO HO N3 N3 OtBu CbzHN O OtBu CbzHN O 129 Experimenteller Teil Ausbeute: 80 % (154 mg) Rf 0,66 (Hex:EtOAc; 1:1) de = 98 % (chirale HPLC; OD-H) 1 H-NMR (CDCl3): 1,48 (s, 9H); 1,53 (s, 3H); 1,93 (dd, J1= 14,31 Hz, J2= 10,41 Hz, 1H); 2,47 (d, J= 15,04 Hz, 1H); 3,38 (ddd, J1= 12,69 Hz, J2= 7,39 Hz, J3= 3,39 Hz, 1H); 3,54 (m, 1H); 3,67 (d, J= 11,69 Hz, 1H); 5,05 (s, 2H); 6,16 (s, 1H); 7,33 (m, 5H) 13 C-NMR (CDCl3): 24,46; 27,61; 36,66; 58,30; 60,92; 65,73; 66,41; 82,89; 127,96; 128,10; 128,52; 136,45; 154,41; 172,79 MS (ESI): 379,1970 [MH+]; 401,1786 [MNa+] Allgemeine Synthesevorschrift zur Darstellung von Cbz-4-Amino-2-azido-4-(tertbutyloxycarbonyl)-pentansäure (+/-135a/b) Der Azidoalkohol (134a/b) (1äq.) wird in Aceton (5 ml/mmol) gelöst und bei 0 °C mit einer 5%igen NaHCO3-Lösung (2,5 ml/mmol) und KBr (0,1 äq.) versetzt. Nun wird der Reaktionslösung TEMPO (1,1 äq.) zugegeben, gefolgt von NaOCl (2,5 ml/ mmol). Nachdem 1 h bei 0 °C gerührt wurde, wird die Reaktion durch Zugabe von 5%iger HCl beendet und das Reaktionsgemisch mit EtOAc (3x) extrahiert. Die organische Phase wird getrocknet und das Lösungsmittel im Vakuum entfernt. Das Rohprodukt wird ohne weitere Reinigung weiter verwendet. (4S,2S)/(4R,2R)-Cbz-4-Amino-2-azido-4-(tert-butyloxycarbonyl)-pentansäure (+/-135a) CO2H N3 OtBu CbzHN O CO2H N3 OtBu CbzHN O Ausbeute: 95 % (135 mg) Rf 0,34 (CHCl3:MeOH; 9:1) MS (ESI): 393,1765 [MH+]; 415,1581 [M+Na+] 130 Experimenteller Teil (4R,2S)/(4S,2R)-Cbz-4-Amino-2-azido-4-(tert-butyloxycarbonyl)-pentansäure (+/-135b) CO2H N3 OtBu CbzHN CO2H N3 OtBu CbzHN O O Ausbeute: 91 % (146 mg) Rf 0,53 (CHCl3:MeOH; 9:1) MS (ESI): 393,2083 [MH+] Allgemeine Synthesevorschrift zur Darstellung von Cbz-2-Amino-4-azido-2-methylpentandisäure (+/-136a/b) Die Aminosäure (+/-135a/b) (1 äq.) wird in TFA (7,7 ml/mmol) gelöst, mit TES (5 äq.) versetzt und 5 h bei RT gerührt. Anschließend wird die TFA im Vakuum entfernt. Der Rückstand wird in EtOAc aufgenommen und mit K2CO3-Lösung extrahiert. Nun wird die wässrige Phase angesäuert und mit EtOAc extrahiert. Die organische Phase wird getrocknet und das Lösungsmittel im Vakuum entfernt. (2S,4S)/ (2R,4R)-Cbz-2-Amino-4-azido-2-methyl-pentandisäure (+/-136a) CO2H N3 OH CbzHN O CO2H N3 OH CbzHN O Ausbeute: 80 % (78 mg) Rf 0,42 (EtOAc:n-BuOH:AcOH:H2O; 2:1:1:1) 1 H-NMR (DMSO-d6): 1,37 (s, 3H); 2,26 (dd, J1= 14,91 Hz, J2= 9,54 Hz, 1H); 2,53 (m, 1H); 3,90 (dd, J1= 9,20 Hz, J2= 2,62 Hz, 1H); 5,00 (s, 2H); 7,31 (m, 5H); 7,65 (s, 1H) 13 C-NMR (DMSO-d6): 22,89; 36,42; 57,12; 57,15; 65,19; 127,59; 127,77; 128,32; 136,96; 154,88; 171,79; 174,74 MS (ESI): 335,0979 [M-] 131 Experimenteller Teil (2R,4S)/ (2S,4R)-Cbz-2-Amino-4-azido-2-methyl-pentandisäure (+/-136b) CO2H N3 OH CbzHN CO2H N3 OH CbzHN O O Ausbeute: 67 % (112 mg) Rf 0,53 (EtOAc:n-BuOH:AcOH:H2O; 2:1:1:1) 1 H-NMR (DMSO-d6): 1,36 (s, 3H); 2,26 (dd, J1= 14,91 Hz, J2= 9,54 Hz, 1H); 2,35 (dd, J1= 14,95 Hz, J2= 2,82 Hz, 1H); 3,91(dd, J1= 9,40 Hz, J2= 2,96 Hz, 1H); 5,00 (dd, J1= 16,55 Hz, J2= 12,76 Hz, 2H); 7,31 (m, 5H), 7,39 (s, 1H) 13 C-NMR (DMSO-d6): 22,87; 36,00; 56,85; 57,88; 65,19; 127,56; 127,71; 128,25; 136,92; 154,72; 171,81; 174,81 MS (ESI): 335,0978 [M-] Allgemeine Synthesevorschrift zur Darstellung von 2,4-Diamino-2-methyl- pentandisäure (+/-137a/b) Die Dicarbonsäure +/-136a/b wird in THF (34 ml/ mmol) gelöst und mit einer Spatelspitze Pd/C versetzt. Nun wird 16 h unter Wasserstoffatmosphäre bei RT gerührt. Das Rohprodukt wird direkt für die GC-Analytik derivatisiert (siehe allgemeine Synthesevorschrift für GC-Derivatisierung). (2S,4S)/ (2R,4R)-2,4-Diamino-2-methyl-pentandisäure (+/-137a) CO2H NH2 OH H2N O CO2H H2N OH H2N O GC-MS-Analytik nach der entsprechenden Derivatisierung (siehe allgemeine Synthesevorschrift) tr = 20,9 min (GC-MS: 70 °C (2 min isothermal), 300 °C, 5 °C/min (1 min isothermal)) GC-MS (PSI): 57 (100); 114 (40); 69 (32); 351 (24); 73 (16); 101 (16); 140 (10); 154 (9); 109 (9); 87 (9); 379 (8); 238 (8); 166 (7); 424 (5); 311 (5) 132 Experimenteller Teil (2R,4S)/ (2S,4R)-2,4-Diamino-2-methyl-pentandisäure (+/-137a) CO2H H2N OH H2N O CO2H H2N OH H2N O GC-MS-Analytik nach der entsprechenden Derivatisierung (siehe allgemeine Synthesevorschrift) tr = 20,6 min (GC-MS: 70 °C (2 min isothermal), 300 °C, 5 °C/min (1 min isothermal)) GC-MS (PSI): 114 (100); 57 (80); 351 (64); 109 (30); 69 (30); 101 (28); 140 (24); 154 (24); 238 (24); 87 (23); 166 (18); 73 (16); 424 (16); 379 (16); 331 (6); 311 (5); 198 (5) 133 Experimenteller Teil 5.2.8. Derivatisierung der Labyrinthopeptine Synthese von 3,6,9,12,15,18,21-Heptaoxatricosan-1,23-disäure-tert-butylester (139) Eine 50%ige KOH-Lösung (11 ml), O O O O O 6 Toluol O (11 ml) und Hexaethylenglycol (0,89 ml; 3,54 mmol) werden in einem Kolben vorgelegt. Bei 0 °C werden Tetrabutylammoniumhydrogensulfat (2,65 g; 7,8 mmol) und Bromessigsäuretert-butylester (2,1 ml; 14 mmol) zugegeben. Nach ca. 10 min wird das Kältebad entfernt und 40 min bei RT gerührt. Das Reaktionsgemisch wird mit 70 ml Wasser verdünnt, die Phasen werden getrennt und die organische Phase mit ges. NH4Cl-Lösung, ges. NaHCO3-Lösung und ges. NaClLösung gewaschen. Anschließend wird die organische Phase getrocknet und das Lösungsmittel im Vakuum entfernt. Der Rückstand wird chromatographisch gereinigt (Hex: EtOAc; 1:1 auf 0:1). Man erhält 0,8 g (Ausbeute 44 %) eines farblosen Öls. Rf 0,51 (CHCl3:MeOH; 9:1) 1 H-NMR (CDCl3): 1,46 (s, 9H); 3,63 (d, J=4,03Hz, 16H); 3,69 (m, 8H); 4,00 (s, 4H) 13 C-NMR (CDCl3): 28,10; 69,04; 70,56; 70,71; 81,50; 169,66 MS (ESI): 511,3118 [MH+]; 533,2925 [MNa+] Synthese von 3,6,9,12,15,18,21-Heptaoxatricosan-1,23-disäure (140) O HO O O OH 6 O Der Diester 139 (800 mg; 1,57 mmol) wird in Dichlormethan (10 ml) gelöst und mit Trifluoressigsäure (10 ml) versetzt. Nachdem 4 h bei RT gerührt wurde, wird das Lösungsmittel im Vakuum entfernt. Man erhält das gewünschte Produkt in quantitativer Ausbeute. Rf 0,43 (CHCl3:MeOH; 9:2) 1 H-NMR (CDCl3): 3,63 (m, 20H); 3,71 (m, 4H); 4,14 (s, 4H), 9,12 (br.s., 2H) 13 C-NMR (CDCl3): 68,86; 70,21; 70,27; 70,33; 70,39; 70,47; 71,21; 173,12 MS (ESI): 397,1699 [MH-] 134 Experimenteller Teil Synthese von 3,6,9,12,15,18,21-Heptaoxatricosan-1,23-disäure-succinimidester (141) O O N O O O O O O 6 O O N Die Disäure (140) (100 mg; 0,251 mmol) und HOSu (66 mg; 2,3 eq) werden in DCM (3,5 ml) gelöst und bei 0 °C mit EDAC (110 mg; 2,3 eq) versetzt. Nach 20 min wird das Kältebad entfernt und weiter 16 h bei RT gerührt. Nun wird das Reaktionsgemisch mit EtOAc (20 ml) verdünnt und mit 5% HCl-Lösung (2x10 ml) und ges. NaHCO3-Lösung (3x10 ml) gewaschen. Anschließend wird das Lösungsmittel im Vakuum entfernt. Das gewünschte Produkt konnte nicht isoliert werden. Die Säure (140) (60 mg; 0,15 mmol) wird in DCM (1,5 ml) gelöst und bei 0 °C mit Oxalylchlorid (77 µl; 0,9 mmol) und einem Tropfen DMF versetzt. Noch 15 min wird das Kältebad entfernt und 1,5 h bei RT gerührt. Anschließend wird das Lösungsmittel im Vakuum entfernt. Der Rückstand wird in DCM (1ml) gelöst und mit Pyridin (27 µl; 0,33 mmol) und HOSu (38 mg; 0,33 mmol) gelöst in THF (0,5 ml) bei -10 °C versetzt. Nun wird das Reaktionsgemisch 2 h bei RT gerührt. Das gewünschte Produkt konnte nicht isoliert werden. 135 Experimenteller Teil Pegylierung von Lab A1/2 (155/154) In Wasser (10 ml) wird Na3PO4 (71 mg) gelöst und durch Zugabe von 5%iger HCl auf eine pH-Wert von 7-8 eingestellt. Nun wird Labyrinthopeptin A1 bzw. A2 (10 mg) in dem Puffer gelöst und mit einer 250 mM Me-PEG8-OSu Lösung (50 µl) versetzt. Das Reaktionsgemisch wird 6 h bei RT geschüttelt und anschließend gefriergetrocknet. Das Rohprodukt wird mittels präparativer HPLC (MeCN 45 % auf 51% in 12 min) gereinigt. Peg-Lab A1 (155): 2 mg (Ausbeute 16 %) MS (ESI): 1235,5084 [M2+2H]; 2471,0029 [M+H] tr=4,24 min (MeCN 45 % auf 51% in 12 min) Peg-Lab A2 (154): 5 mg (Ausbeute 42%) MS (ESI): 1159,9723 [M2+2H]; 2318,9324 [M+H] tr=4,27 min (MeCN 45 % auf 51% in 12 min) 136 Experimenteller Teil NTCB-Spaltung von Lab A1/ A1 (156-159) DTT (154 mg; 20 eq.) wird in einer NaHCO3-Lösung (800 mg in 100 ml Wasser) gelöst, diese Lösung wird zum Peptid Lab A1 bzw. A2 (100 mg) gegeben. Die Reaktionslösung wird 1 h bei 50°C geschüttelt, nun wird die Reaktionslösung mit NTCB (448 mg, 40 eq.) versetzt und die Reaktionslösung mit 1N NaOH-Lösung auf pH 9-10 eingestellt, wobei der pH Wert im Verlauf der Reaktion beibehalten werden muss. Nach 6 h wird die Reaktionslösung neutralisiert und gefriergetrocknet. Das Reaktionsgemisch wird auf eine SPE C8-Säulen (Chromabond; Macherey-Nagel) aufgetragen und mit Methanol eluiert (0 % auf 100 % Methanol)[163]. Labyrinthopeptin A1 N-terminales Fragment (158): 15 mg (Ausbeute: 33 %) MS (ESI): 929,5 [M+H] C-terminales Fragment (159): Zersetzung Labyrinthopeptin A2 N-terminales Fragment (156): 4 mg (Ausbeute 8 %) MS (ESI): 989,5 [M+H] C-terminales Fragment (157): 1 mg (Ausbeute 2 %) MS (ESI): 895,4 [M+H] 137 Experimenteller Teil Desulfurierung von Lab A1 /A2 (160/161) Das Peptid Lab A1 bzw. A2 (1 mg) wird einer MeOH-Wasser-Lösung (1,3 ml; 0,64 ml) suspendiert und mit NiCl2*6H2O (4,74 mg) versetzt. Nun wird NaBH4 (2,5 mg) zugesetzt und 3 h bei 50°C geschüttelt. Bei der Reaktion bildet sich ein schwarzer Niederschlag, der nach der Reaktion mit TFA (30 µl) gefällt wird. Nach der Zentrifugation wird der Überstand aus dem Reaktionsgefäß entfernt und die Lösung gefriergetrocknet. Das Rohprodukt wird auf eine SPE C8-Säule (Chromabond ;Macherey-Nagel) aufgetragen, nun mit einer 50mmol EDTA-Lösung gewaschen und anschließend mit Methanol eluiert (0 % auf 100 % Methanol)[163]. Das Peptid Lab A1 /A2 (1 mg) wird in Wasser (0,5 ml) gelöst und mit einer Raney-Nickel Suspension (0,5 ml; 50 % in Wasser) versetzt. Nun wird 16 h bei 60°C geschüttelt. Das Rohprodukt wird auf eine SPE C8-Säule (Chromabond ;Macherey-Nagel) aufgetragen, nun mit einer 50 mmol EDTA-Lösung gewaschen und anschließend mit Methanol eluiert (0 % auf 100 % Methanol)[163]. Desulf-Lab A1(161): 0,44 mg (Ausbeute 44 %) MS (ESI): 1008,4424 [M2+2H]; 2015,8732 [M+H] Desulf-Lab A2 (160): 0,28 mg (Ausbeute 28 %) MS (ESI): 932,3937 [M2+2H]; 1863,7787 [M+H] 138 Experimenteller Teil 5.3. Analytische Daten 5.3.1 NMR-Spektren ausgewählter Verbindungen rac-Cbz-α-Allylalanin-tert-butylester (130) 1.31 1.24 7.34 DMSO-d6 0.30 5.01 5.00 0.25 4.97 0.05 5.70 5.70 5.68 5.68 5.66 5.66 5.64 5.62 7.32 7.31 7.30 7.29 7.30 0.10 7.51 0.15 2.56 2.54 2.52 2.37 2.35 2.33 2.31 7.35 5.07 0.20 0.00 4.73 7.0 6.5 6.0 3.99 5.5 5.0 1.00 4.5 4.0 3.5 3.0 2.5 8.39 2.0 1.5 1.0 27.83 128.43 127.93 7.5 1.00 132.41 0.20 23.28 0.15 0.10 0.05 0.00 119.04 -0.15 180 170 160 150 140 130 120 110 139 100 90 80 70 59.57 82.00 -0.10 66.18 Chloroform-d 41.00 136.65 154.52 172.73 -0.05 60 50 40 30 20 Experimenteller Teil rac-Cbz-2-amino-4,5-dihydroxy-2-methyl-pentansäure-tert-butylester (131) 7.33 1.44 Chloroform-d 0.50 1.42 0.45 0.40 7.34 0.30 1.54 0.35 0.25 2.24 2.20 2.11 2.08 2.02 1.99 1.98 1.95 3.41 3.39 3.39 3.37 0.05 5.01 0.10 6.20 6.16 7.32 7.30 7.29 7.29 0.15 3.80 3.79 3.79 3.78 3.56 3.53 3.53 5.07 5.04 1.58 0.20 0.00 5.03 7.5 0.92 7.0 6.5 2.03 6.0 5.5 5.0 1.05 4.5 4.0 1.05 0.72 1.00 3.5 3.0 2.5 2.0 9.68 1.5 Chloroform-d 27.73 0.30 0.25 24.03 40.49 39.19 66.79 58.33 59.47 136.53 154.65 173.67 173.16 0.05 82.29 0.10 66.34 0.15 69.37 68.73 128.04 127.99 128.47 0.20 0.00 170 160 150 140 130 120 110 100 140 90 80 70 60 50 40 30 Experimenteller Teil (2S, 4S)/ (2R, 4R)-Cbz-2-Amino-5-tert-butylsilyloxy-4-hydroxy-2-methyl-pentansäure- 0.04 0.88 1.44 tert-butylester (+/-132a) 0.30 Chloroform-d 7.33 0.25 1.55 0.20 7.34 0.15 2.12 2.00 1.97 1.96 2.32 2.31 3.57 3.57 3.55 3.54 3.38 3.37 3.36 3.34 3.74 3.73 5.09 5.06 5.02 0.05 6.32 7.30 7.29 7.29 7.28 5.05 0.10 0.00 4.91 7.5 0.88 7.0 6.5 1.94 6.0 5.5 5.0 1.01 4.5 4.0 0.99 3.5 0.89 1.02 3.0 2.5 2.0 9.20 9.57 1.5 1.0 6.11 0.5 0.0 27.75 25.84 Chloroform-d 0.30 128.42 0.25 -5.46 23.66 58.36 18.23 68.40 67.02 39.17 86.60 136.77 154.53 0.05 173.52 0.10 66.07 0.15 81.79 127.84 0.20 0.00 150 100 50 141 0 Experimenteller Teil (2R, 4S)/ (2S, 4R)-Cbz-2-Amino-5-tert-butylsilyloxy-4-hydroxy-2-methyl-pentansäure- 1.42 0.88 0.04 tert-butylester (+/-132b) 9.26 9.60 6.00 0.30 0.25 0.20 3.49 3.48 3.47 3.46 3.38 3.36 3.35 3.33 2.66 1.92 1.89 1.87 1.84 1.84 0.05 6.40 7.37 7.36 7.31 7.31 7.29 7.28 0.10 3.80 3.78 7.33 0.15 5.07 7.34 1.61 Chloroform-d 0.00 4.77 7.5 7.0 6.5 1.80 6.0 5.5 5.0 0.98 4.5 4.0 0.97 3.5 0.67 3.0 1.00 2.5 2.0 1.5 1.0 0.5 0.0 27.83 25.80 8.0 0.68 0.8 128.35 128.01 127.84 0.7 0.4 Chloroform-d 24.68 0.3 -5.44 0.5 69.25 0.6 0.2 0.1 0.0 18.21 59.61 -0.3 67.27 -0.4 40.70 66.19 81.62 136.80 155.48 -0.2 172.90 -0.1 150 100 50 142 0 Experimenteller Teil (2S,4S)/ (2R,4R)-Cbz-4-2-Amino-4-azido-5-tert-butylsilyloxy-2-methyl-pentansäure-tert- 0.90 1.44 butylester (+/-134a) 0.07 0.06 0.35 0.30 0.25 1.56 0.20 0.75 2.18 2.08 2.07 2.05 2.02 1.95 1.92 0.05 5.13 5.10 5.07 5.04 0.10 5.79 7.40 7.38 7.36 7.33 7.35 7.32 7.34 7.31 7.31 0.15 3.63 3.62 3.61 3.59 3.56 3.41 3.40 3.39 3.38 7.35 Chloroform-d 0.00 6.95 8.0 7.5 7.0 6.5 6.0 5.5 0.99 5.0 4.5 4.0 0.93 3.5 3.0 2.5 2.0 9.00 1.5 8.58 1.0 5.52 0.5 0.0 27.78 25.75 Chloroform-d 0.8 128.45 128.05 0.7 0.6 -5.55 18.19 24.25 36.72 66.39 60.58 136.54 0.1 154.89 0.2 172.57 0.3 66.95 82.31 0.4 59.11 0.5 0.0 150 100 50 143 0 Experimenteller Teil (2R,4S)/ (2S,4R)-Cbz-2-Amino-4-azido-5-tert-butylsilyloxy-2-methyl-pentansäure-tert- 0.90 1.48 butylester (+/-133b) 0.06 0.45 0.40 Chloroform-d 7.34 0.35 1.54 0.30 0.25 2.38 2.34 3.70 3.68 3.58 3.56 3.53 3.38 3.37 3.36 3.36 3.34 0.05 6.14 7.32 7.30 7.29 0.10 1.91 1.88 1.87 5.07 0.15 7.35 0.20 0.00 4.98 7.5 0.89 7.0 6.5 2.04 6.0 5.5 5.0 0.94 1.03 4.5 4.0 3.5 0.88 3.0 2.5 1.01 2.0 8.88 9.14 1.5 1.0 6.00 0.5 0.0 25.78 Chloroform-d 27.65 0.35 0.30 128.51 0.25 0.20 36.63 -5.58 24.40 18.20 58.31 66.76 66.27 60.28 136.61 154.30 0.05 172.81 0.10 82.66 127.86 0.15 0.00 150 100 50 144 0 Experimenteller Teil (2S,4S)/ (2R,4R)-Cbz-2-Amino-4-azido-5-hydroxy-2-methyl-pentansäure-tert-butylester 1.56 1.45 (+/-134a) 0.25 0.20 7.36 7.35 7.34 Chloroform-d 5.07 0.15 2.30 2.28 2.26 2.25 2.09 2.08 2.05 2.04 3.61 3.60 3.56 3.54 3.51 3.46 3.45 3.44 3.43 5.04 5.13 0.05 5.78 7.33 7.33 7.32 7.31 5.10 0.10 0.00 5.32 7.5 2.18 7.0 6.5 6.0 5.5 5.0 1.04 4.5 4.0 0.921.08 3.5 3.0 2.5 8.72 2.0 1.5 128.49 27.78 128.10 Chloroform-d 0.40 0.35 82.80 0.25 36.47 24.60 61.13 0.05 66.56 154.89 0.10 136.45 0.15 172.63 0.20 58.98 65.49 0.30 0.00 180 170 160 150 140 130 120 110 100 145 90 80 70 60 50 40 30 Experimenteller Teil (2R,4S)/ (2S,4R)-Cbz-2-Amino-4-azido-5-hydroxy-2-methyl-pentansäure-tert-butylester 1.48 (+/-134b) Chloroform-d 7.35 0.45 0.40 1.53 0.35 0.30 7.36 0.25 0.05 2.50 2.46 3.69 3.66 3.55 3.54 3.51 3.40 3.39 3.38 3.37 3.37 0.10 6.16 7.33 7.32 7.31 0.15 1.96 1.94 1.93 1.90 5.05 0.20 0.00 5.07 7.5 0.91 7.0 6.5 1.87 6.0 5.5 5.0 0.96 1.07 4.5 4.0 0.92 3.5 3.0 1.08 2.5 9.13 2.0 1.5 27.61 Chloroform-d 0.60 128.52 0.55 0.50 0.45 0.40 0.10 24.46 36.66 65.73 66.41 136.45 0.15 154.41 172.79 0.20 60.92 82.89 127.96 0.30 0.25 58.30 0.35 0.05 0.00 180 170 160 150 140 130 120 110 100 146 90 80 70 60 50 40 30 20 Experimenteller Teil (2S,4S)/ (2R,4R)-Cbz-2-Amino-4-azido-2-methyl-pentandisäure (+/-136a) 1.37 7.33 DMSO-d6 5.00 0.35 0.30 0.25 0.20 1.95 1.93 1.91 1.89 2.53 2.53 3.92 3.91 3.89 3.89 7.65 0.10 7.31 7.29 0.15 0.05 0.00 0.67 5.03 8.0 7.5 1.93 7.0 6.5 6.0 5.5 0.88 5.0 4.5 4.0 0.72 3.5 3.0 0.93 2.5 2.0 3.00 1.5 DMSO-d6 0.10 0.09 128.32 0.08 0.07 0.06 22.87 65.17 136.98 0.02 154.85 174.75 171.81 0.03 36.58 127.58 0.04 58.26 57.18 0.05 0.01 0.00 -0.01 -0.02 180 170 160 150 140 130 120 110 100 147 90 80 70 60 50 40 30 20 Experimenteller Teil (2R,4S)/ (2S,4R)-Cbz-2-Amino-4-azido-2-methyl-pentandisäure (+/-136b) 1.36 7.35 7.34 DMSO-d6 0.50 5.01 5.00 0.45 0.40 0.35 0.30 0.05 2.33 2.26 2.32 2.24 2.30 2.27 2.36 2.36 0.10 3.93 3.93 3.91 3.90 0.15 5.04 4.96 7.44 0.20 7.31 7.28 7.31 7.27 7.29 0.25 0.00 5.31 7.5 2.12 7.0 6.5 6.0 5.5 5.0 1.02 4.5 2.05 4.0 3.5 3.0 2.5 3.00 2.0 1.5 DMSO-d6 128.32 0.25 0.20 22.90 35.98 65.23 136.97 0.05 154.79 174.91 171.93 0.10 57.90 56.88 127.63 0.15 0.00 180 170 160 150 140 130 120 110 100 148 90 80 70 60 50 40 30 20 Experimenteller Teil (S)-1-tert-Butyl-5-methyl-2-((E)-((1R,2R,5R)-2-hydroxy-2,6,6- 3.72 1.43 1.41 trimethylbicyclo[3.1.1]heptan-3-yliden)amino)-4-methylenpentandioat (63) 1.29 0.35 0.77 0.30 0.25 0.20 0.05 0.97 0.95 0.93 0.92 3.00 2.98 2.75 2.73 2.71 2.62 2.62 2.58 2.57 2.41 2.41 2.05 2.03 2.02 1.98 1.96 1.96 1.54 1.51 4.42 4.40 4.39 4.38 0.10 5.63 6.17 6.16 0.15 0.00 0.86 6.5 0.91 6.0 5.5 0.89 5.0 4.5 3.00 4.0 0.90 3.5 1.34 1.27 3.0 1.18 2.5 12.65 2.0 1.5 2.67 1.0 Chloroform-d 28.03 0.25 0.20 38.32 35.69 33.30 28.35 27.30 22.69 61.21 76.53 81.48 128.48 136.42 170.04 167.29 0.05 178.93 0.10 51.83 50.05 0.15 0.00 180 170 160 150 140 130 120 110 100 149 90 80 70 60 50 40 30 Experimenteller Teil 1.43 3.75 (S)-1-tert-Butyl-5-methyl-2-amino-4-methylenpentandioat (64) 0.35 0.30 0.25 0.20 2.73 2.73 0.05 3.58 3.57 3.56 3.55 5.63 5.63 5.63 6.22 0.10 2.69 2.68 2.51 2.51 2.49 2.49 2.47 2.45 0.15 0.00 1.00 6.0 2.98 0.98 5.5 5.0 4.5 4.0 1.04 1.05 3.5 3.0 2.5 9.34 2.0 1.5 28.00 6.5 1.00 0.7 0.6 53.94 51.90 0.5 0.4 0.3 0.2 0.1 0.0 Chloroform-d 81.29 136.83 -0.1 -0.2 127.61 -0.4 37.95 -0.3 150 140 130 120 110 100 90 150 80 70 60 50 40 30 Experimenteller Teil 1.43 1.41 (S)-1-tert-Butyl-5-methyl-2-(Boc-amino)-4-methylenpentandioat (65) 3.76 0.60 0.55 0.50 0.45 0.40 0.35 0.30 0.25 0.20 0.05 2.80 2.78 2.76 2.75 2.65 2.63 2.61 2.59 4.38 4.36 4.35 4.33 5.11 5.09 6.23 0.10 5.64 5.63 0.15 0.00 6.0 5.5 5.0 4.5 4.0 3.5 3.0 2.5 2.0 1.5 Chloroform-d 0.35 27.97 0.30 0.25 28.26 0.20 35.22 53.35 82.08 79.58 128.11 136.05 155.16 167.16 171.05 0.10 0.05 52.03 0.15 0.00 170 160 150 140 130 120 110 100 151 90 80 70 60 50 40 30 Experimenteller Teil (2S,4S)-5-tert-Butyl-1-methyl-4-(Boc-amino)-2-hydroxy-2-(hydroxymethyl)pentandioat 1.45 (66) 0.60 0.55 0.50 0.45 0.40 0.35 0.30 3.76 0.25 0.20 3.81 3.72 3.69 3.62 3.59 3.57 3.54 4.46 4.44 4.42 4.99 4.97 0.10 0.05 2.14 2.13 2.10 2.09 2.07 2.03 2.03 0.15 0.00 0.69 6.0 5.5 5.0 2.91 4.5 4.0 2.00 3.5 3.0 2.5 18.00 2.0 1.5 28.31 27.91 6.5 1.45 0.40 0.35 52.89 49.88 0.30 0.25 0.20 0.15 0.10 0.05 0.00 Chloroform-d -0.10 37.71 -0.15 76.42 80.62 82.53 155.99 171.45 174.63 -0.05 -0.20 68.59 -0.25 -0.30 180 170 160 150 140 130 120 110 100 152 90 80 70 60 50 40 30 20 Experimenteller Teil (2S,4R)-1-tert-Butyl-2-tert-butyl-4-azido-4-(hydroxymethyl)-5-oxopyrrolidin-1,2- 1.43 1.42 dicarboxylat (69b) 0.50 0.45 0.40 0.35 0.30 0.25 DMSO-d6 0.20 1.78 1.77 1.75 1.74 2.67 2.64 2.63 2.61 5.60 4.52 4.51 4.50 4.49 3.74 3.73 3.72 3.70 3.70 3.60 3.59 3.57 3.56 0.05 5.63 0.10 5.61 0.15 0.00 0.98 0.98 5.5 5.0 1.160.97 4.5 4.0 1.00 3.5 3.0 0.99 2.5 2.0 9.29 1.5 DMSO-d6 1.0 29.64 62.42 67.11 169.54 169.40 83.09 81.88 0.5 0.0 56.08 -0.5 27.41 170 160 150 140 130 120 110 100 153 90 80 70 60 50 40 30 20 Experimenteller Teil 0.0 0.5 1.0 1.5 2.0 2.5 3.0 4.0 4.5 5.0 5.5 6.0 6.5 7.0 7.5 8.0 6.5 6.0 5.5 5.0 4.5 4.0 3.5 ppm 154 3.0 2.5 2.0 1.5 1.0 0.5 ppm 3.5 Experimenteller Teil 1.46 1.44 (S)-1-tert-Butyl-5-methyl-2-(bis-Boc-amino)-4-methylenpentandioat (70) 0.45 0.40 0.35 0.30 3.74 0.25 0.20 1.01 0.98 0.97 5.5 5.0 0.05 3.15 3.14 3.11 3.11 2.86 2.83 2.83 2.80 5.07 5.05 5.04 5.03 5.53 0.10 6.18 0.15 0.00 6.0 4.5 4.0 0.99 3.5 1.00 17.62 3.0 2.5 2.0 1.5 27.94 6.5 3.01 0.45 0.40 0.35 57.48 0.25 0.20 51.84 0.30 0.15 0.10 0.05 0.00 128.35 -0.15 170 160 150 140 130 120 110 100 155 90 80 32.38 81.45 82.72 136.77 152.20 -0.10 Chloroform-d 166.84 169.13 -0.05 70 60 50 40 30 20 Experimenteller Teil (2S,4S)-5-tert-Butyl-1-methyl-4-(bis-Boc-amino)-2-hydroxy-2- 1.50 1.42 (hydroxymethyl)pentandioat (71) 0.30 3.74 0.25 1.41 0.20 0.15 2.41 2.39 2.38 2.37 2.34 2.33 2.45 0.05 3.72 3.62 3.59 5.08 5.07 5.06 5.05 3.81 0.10 0.00 0.84 5.5 4.09 1.01 5.0 4.5 4.0 1.84 3.5 3.0 18.00 2.5 2.0 1.5 33.99 54.62 53.24 152.06 0.05 169.41 174.75 81.62 0.10 68.78 0.15 76.42 83.26 28.00 Chloroform-d 0.00 180 170 160 150 140 130 120 110 156 100 90 80 70 60 50 40 30 Experimenteller Teil 1.44 1.35 (2R,4S)-5-tert-Butyl-1-methyl-2-azido-4-(bis-Boc-amino)-2-(hydroxymethyl)pentandioat (73) 0.30 3.71 0.25 0.20 0.15 DMSO-d6 2.00 1.98 1.97 1.94 2.41 2.40 2.37 2.37 3.69 3.68 3.65 3.81 3.80 3.79 0.05 4.80 4.79 4.78 4.77 5.60 5.59 5.57 0.10 0.00 0.96 6.0 5.5 5.0 3.00 4.5 4.0 1.00 3.5 3.0 2.5 0.97 21.00 2.0 1.5 27.50 6.5 0.95 0.6 0.5 54.58 52.75 0.4 0.3 0.2 0.1 0.0 32.52 82.35 -0.3 66.92 69.66 81.02 -0.2 DMSO-d6 151.56 168.42 170.25 -0.1 -0.4 -0.5 180 170 160 150 140 130 120 110 100 157 90 80 70 60 50 40 30 20 Experimenteller Teil 1.0 1.5 2.0 2.5 3.0 3.5 ppm 4.0 4.5 5.0 5.5 6.0 6.5 7.0 6.0 5.5 5.0 4.5 4.0 3.5 ppm 158 3.0 2.5 2.0 1.5 1.0 7.5 Experimenteller Teil (2R,4S)-5-tert-Butyl-1-methyl-2-azido-4-(bis-Boc-amino)-2-(methoxymethyl)pentandioat 3.79 0.20 1.50 1.41 3.35 (118) 2.16 2.14 2.13 2.10 5.09 5.08 5.07 5.06 4.96 4.95 4.94 4.93 3.85 3.83 0.05 2.62 2.61 2.58 2.57 2.41 2.37 2.34 2.24 2.23 0.10 3.75 3.63 3.61 3.60 3.76 0.15 0.00 5.0 4.5 4.0 4.72 1.02 3.5 3.0 0.55 1.12 2.5 29.00 2.0 1.5 27.85 77.03 5.5 3.33 1.66 28.02 1.00 0.30 0.25 83.02 0.20 33.31 33.44 59.47 54.96 52.99 68.45 67.91 81.67 79.16 152.12 151.64 0.05 170.70 170.51 0.10 169.08 0.15 0.00 170 160 150 140 130 120 110 100 159 90 80 70 60 50 40 30 Experimenteller Teil (2R,4S)-4-(tert-Butoxycarbonyl)-4-(bis-Boc-amino-2-azido-2- 1.52 1.43 (methoxymethyl)butansäure (119) 3.40 0.25 0.20 0.15 2.30 2.27 2.26 2.24 2.68 2.68 2.65 2.64 5.01 5.00 4.99 4.98 0.05 3.80 3.78 3.69 3.66 0.10 0.00 1.00 1.03 4.5 4.0 1.01 3.5 0.99 3.0 2.5 18.30 2.0 1.5 27.86 28.00 5.0 3.16 0.0 55.09 59.46 0.5 Chloroform-d 33.14 68.17 76.59 81.85 83.22 152.13 168.91 172.88 -0.5 170 160 150 140 130 120 110 100 160 90 80 70 60 50 40 30 Experimenteller Teil 3.61 Boc-Leu-Phe-Ala-OMe (100) 1.35 0.60 0.55 0.50 0.45 0.35 1.28 1.26 7.22 0.40 DMSO-d6 7.23 0.82 0.78 0.80 0.76 0.30 0.25 0.20 0.05 3.02 3.01 2.99 2.97 2.80 2.78 2.77 2.74 7.19 7.18 7.17 7.16 6.85 6.83 7.70 7.68 8.43 8.42 0.10 4.59 4.58 4.57 4.56 4.55 4.28 4.26 4.25 3.87 0.15 0.00 0.77 9 0.91 5.19 0.78 8 1.01 7 6 5 3.03 4 1.00 8.06 3 2 6.85 1 0 DMSO-d6 40.86 37.71 78.05 137.39 155.10 0.5 172.71 172.01 170.81 1.0 0.0 22.77 24.09 52.87 53.04 16.81 28.10 129.24 51.80 47.51 126.12 -0.5 127.85 170 160 150 140 130 120 110 100 161 90 80 70 60 50 40 30 20 Experimenteller Teil 3.62 H-Leu-Phe-Ala-OMe (101) 0.8 0.7 DMSO-d6 1.29 1.28 0.5 0.82 0.80 0.78 0.76 0.6 1.23 1.21 0.1 3.10 3.09 3.08 3.07 3.01 3.00 2.81 2.79 2.76 1.60 1.58 1.58 1.56 7.98 7.96 8.46 8.44 0.2 4.57 7.25 7.24 7.19 7.18 7.14 7.16 0.3 4.30 4.28 4.27 4.25 7.22 7.21 0.4 0.0 0.70 8.5 8.0 5.15 7.5 7.0 0.991.00 6.5 6.0 5.5 5.0 4.5 3.01 4.0 1.10 1.00 3.5 3.0 0.92 2.89 2.5 2.0 1.5 5.99 1.0 0.5 129.28 127.85 0.90 53.03 52.54 51.81 47.49 126.14 0.5 23.89 23.13 DMSO-d6 16.83 1.0 0.0 160 150 140 43.92 170 130 120 110 100 162 90 80 70 60 50 37.87 180 137.44 170.95 172.79 175.10 -0.5 40 30 20 10 Experimenteller Teil (2S,3R)-2-Azido-3-(benzyloxy)butansäure (97) DMSO-d6 0.7 1.26 1.25 0.6 0.5 0.1 7.34 0.2 7.24 3.92 3.91 0.3 4.62 4.59 4.41 4.38 4.16 4.15 4.13 4.13 7.32 7.30 7.28 7.27 7.26 7.25 0.4 0.0 4.96 7.5 1.001.01 1.33 0.99 7.0 6.5 6.0 5.5 5.0 4.5 4.49 4.0 3.5 3.0 2.5 2.0 1.5 1.0 DMSO-d6 0.30 0.25 0.20 16.55 70.25 65.33 75.54 128.16 170.45 0.05 138.33 0.10 127.03 0.15 0.00 170 160 150 140 130 120 110 100 163 90 80 70 60 50 40 30 20 Experimenteller Teil 1.46 2-((2S,3R)-2-Azido-3-(benzyloxy)butanamido)essigsäure-tert-butylester (98) 0.40 0.35 Chloroform-d 7.31 0.30 1.34 1.32 0.25 0.20 0.05 7.32 7.31 7.29 7.28 7.28 7.26 6.97 6.96 0.10 4.62 4.59 4.52 4.49 4.02 3.99 4.05 3.98 3.95 3.94 3.87 3.86 3.82 0.15 0.00 4.96 0.88 7.5 1.01 7.0 6.5 6.0 5.5 5.0 3.01 4.5 8.93 4.0 3.5 3.0 2.5 2.0 1.5 128.33 27.95 127.73 Chloroform-d 0.7 0.6 0.2 16.49 75.53 137.63 168.32 167.85 0.3 82.37 0.4 41.90 71.66 67.83 0.5 0.1 0.0 170 160 150 140 130 120 110 100 164 90 80 70 60 50 40 30 20 10 Experimenteller Teil 7.32 2-((2S,3R)-2-Azido-3-(benzyloxy)butanamido)essigsäure (99) 0.6 1.22 DMSO-d6 0.5 7.33 3.78 0.4 3.96 3.95 3.93 3.80 3.74 0.1 7.28 7.27 7.26 7.25 8.60 8.58 8.57 4.60 0.2 4.47 4.57 4.50 0.3 0.0 0.94 9.0 8.5 5.13 8.0 7.5 1.13 7.0 6.5 6.0 5.5 5.0 4.5 3.52 4.0 3.00 3.5 3.0 2.5 2.0 1.5 DMSO-d6 0.30 0.25 128.19 127.54 0.20 16.69 40.74 65.81 70.44 138.38 170.85 168.37 0.10 75.15 0.15 0.05 0.00 180 170 160 150 140 130 120 110 100 165 90 80 70 60 50 40 30 20 0.03 0.02 170 0.01 160 150 140 130 120 0.07 27.39 27.56 5.0 110 4.5 100 166 3.85 3.88 4.0 90 3.5 80 2.13 3.0 70 1.00 2.5 60 2.0 50 40 30 23.94 22.93 21.68 16.81 5.5 0.20 0.85 0.83 3.38 3.71 1.41 0.60 31.66 6.0 1.02 40.96 37.58 1.15 53.13 51.86 51.74 47.59 1.01 58.77 0.04 4.82 4.81 4.79 4.79 4.74 4.73 4.45 4.43 4.42 3.77 3.75 3.70 3.54 3.36 3.34 3.33 2.81 2.79 2.78 2.75 2.74 2.38 2.36 2.34 0.30 69.12 6.5 76.50 7.0 82.39 7.5 81.10 0.05 129.18 127.96 8.0 126.20 7.49 137.53 0.05 151.98 0.10 7.29 7.27 7.26 7.25 7.20 7.19 7.17 6.70 6.69 6.65 6.63 0.15 172.82 171.09 170.76 168.36 167.61 1.51 Experimenteller Teil Peptid 120 0.55 0.50 0.45 0.40 0.35 0.25 0.00 20.04 7.02 1.5 1.0 0.5 DMSO-d6 0.08 0.06 0.00 -0.01 -0.02 20 10 0.02 0.01 150 0.03 0.05 27.45 27.56 6.5 6.0 5.5 5.0 100 167 4.5 4.0 3.10 3.5 2.54 1.08 3.0 50 2.5 24.04 23.01 21.79 16.80 0.78 1.00 2.08 41.21 37.34 35.34 0.04 7.24 1.85 1.84 1.82 3.04 3.02 2.78 2.75 2.74 2.28 3.41 3.19 4.84 4.83 4.82 4.82 4.55 4.53 4.52 4.26 4.24 4.22 4.21 7.19 7.18 7.17 7.16 0.15 0.10 1.28 0.83 1.26 0.81 0.80 0.78 7.22 3.14 0.25 51.14 51.82 47.61 6.18 59.98 58.63 54.89 7.0 82.23 7.5 80.59 77.26 8.0 129.12 127.98 8.5 126.19 9.0 1.20 137.60 0.77 7.88 7.86 8.31 8.30 0.05 151.92 174.24 172.78 171.47 170.72 169.34 158.05 157.74 1.43 1.34 3.59 Experimenteller Teil Peptid 121 DMSO-d6 0.20 0.00 0.82 1.43 17.23 2.0 1.5 6.10 1.0 DMSO-d6 0.09 0.08 0.07 0.06 0.00 -0.01 -0.02 0 0.5 0.10 0.05 180 170 160 150 140 130 0.30 28.00 1.04 5.0 120 110 2.52 4.5 4.0 100 168 90 27.74 0.84 2.99 2.98 2.97 2.95 2.95 2.92 2.68 2.66 2.11 2.11 2.07 2.07 4.72 4.71 4.70 4.61 4.58 4.50 4.47 4.09 4.05 4.04 3.75 3.51 3.48 5.45 5.45 5.43 5.43 0.10 2.85 2.76 3.5 80 0.67 0.85 3.0 70 2.5 60 0.82 2.0 50 1.5 40 30 0.81 0.79 1.43 1.39 1.38 7.28 7.25 3.30 Chloroform-d 22.99 21.01 17.60 16.88 82.99 75.66 72.44 71.79 67.94 60.70 59.07 54.75 54.33 53.50 52.27 48.30 44.68 39.44 36.45 5.5 83.32 6.0 127.64 11.03 126.20 0.15 129.17 128.46 6.5 138.36 137.49 7.0 152.26 7.5 7.15 0.20 7.13 7.13 7.07 7.05 7.32 7.30 0.05 173.59 173.29 172.87 172.14 171.30 169.87 169.08 3.70 1.48 1.45 Experimenteller Teil Peptid 122 0.30 0.25 0.15 0.00 18.29 6.00 1.0 Chloroform-d 0.40 0.35 0.25 0.20 0.00 20 0.03 0.02 170 0.01 160 150 140 130 120 110 100 169 4.5 90 4.0 80 3.5 70 3.0 60 2.5 50 28.19 5.0 3.14 3.13 3.10 3.09 2.79 2.78 2.05 2.04 2.02 1.51 4.59 4.56 4.46 4.43 4.40 4.23 3.98 3.96 3.90 3.80 7.32 0.20 1.31 1.20 1.29 1.19 0.78 0.77 0.72 7.19 7.18 7.20 3.20 3.59 7.30 1.36 DMSO-d6 0.85 2.0 40 23.78 22.95 21.10 16.70 16.60 0.04 5.5 36.94 0.05 6.0 3.99 3.14 3.04 0.98 43.10 0.06 6.5 51.79 47.78 7.0 52.49 7.5 1.97 65.97 60.99 58.45 8.0 5.32 70.38 1.02 7.16 7.12 7.11 0.10 77.77 75.07 0.07 129.07 128.13 127.36 8.5 7.69 7.68 0.15 126.03 0.88 138.33 138.08 9.0 7.83 7.82 8.56 8.55 8.54 0.05 154.85 172.57 171.57 170.80 169.12 168.75 Experimenteller Teil Peptid 124 0.30 0.25 0.00 9.10 30 3.00 1.5 1.0 0.5 DMSO-d6 0.12 0.11 0.10 0.09 0.08 0.00 -0.01 -0.02 20 Experimenteller Teil 5.3.2. MS/MS-Spektrum von Peptid 117 100 95 90 85 80 75 70 65 60 55 50 45 40 35 30 25 20 15 10 5 0 200 300 465,9588 400 m/z 377,1818 327,1671 299,1720 251,1392 221,1288 164,1072 120,0809 100 600 700 768,3950 637,3419 691,1157 577,2953 723,5968 518,2611 500 170 Lab-pep-1-9_HCD768_Spritze #12-69 RT: 0,70-4,32 AV: 58 NL: 4,96E3 T: FTMS + c ESI Full ms2 768,40@hcd30,00 [50,00-775,00] 490,2665 Relative Abundance Experimenteller Teil 5.3.3. LC-MS-Analytik der Peptide 122, 123 und 124 Peptid 122 171 Experimenteller Teil Peptid 123 172 Experimenteller Teil Peptid 123 173 Experimenteller Teil 5.3.4. Röntgenstrukturdaten von (2R,4S)-5-tert-Butyl-1-methyl-2-azido-4-(bis-Bocamino)-2-(hydroxymethyl)pentandioat Tabelle 5: Kristalldaten und Strukturerläuterung Empirische Formel Molekulargewicht Temperatur Wellenlänge Kristallsystem Raumgruppe Dimensionen der Elementarzelle Volumen Z Dichte (ber.) Absorptionskoeffizient F(000) Kristallgröße Θ-Bereich für die Datensammlung Bereich der Indizes Anzahl der gemessenen Reflexe Anzahl der unabhängigen Reflexe Vollständigkeit von Θ= 25.00° Absorptionskorrektur Max. und min. Transmission Finale R-Werte [I>2σ(I)] R-Werte (alle Daten) C15 H24 N4 O6 356.38 150(2) K 0.71073 Å Orthorhombisch P212121 (Nr. 19) a = 6.21698(14) Å α = 90°. b = 16.9747(5) Å β = 90°. c = 16.9770(4) Å γ = 90°. 1791.60(8) Å3 4 1.321 Mg/m3 0.103 mm-1 760 0.45 x 0.29 x 0.27 mm3 3.39 to 25.00°. -7<=h<=7, -19<=k<=20, -16<=l<=20 7026 2829 [R(int) = 0.0217] 99.7 % Semi-empirisch 0.9727 und 0.9552 R1 = 0.0296, wR2 = 0.0635 R1 = 0.0335, wR2 = 0.0646 174 Experimenteller Teil Tabelle 6: Atomkoordinaten (x 104) und äquivalente isotropen Auslenkungsparameter (Å2 x 103) (Standardabweichung der letzten Stelle in Klammer; U (eq) ist definiert als 1/3 des orthogonalisierten Uij-Tensors ). ___________________________________________________________________________ x y z U(eq) ___________________________________________________________________________ N(1) 3860(2) 2715(1) 5430(1) 24(1) N(2) 3767(2) 2919(1) 4726(1) 24(1) N(3) 3711(3) 3012(1) 4068(1) 39(1) N(4) 5435(2) 3782(1) 7109(1) 15(1) O(1) 6973(2) 3944(1) 5873(1) 26(1) O(2) 1628(2) 4601(1) 6203(1) 23(1) O(3) 2768(2) 2777(1) 8674(1) 27(1) O(4) 5741(2) 2442(1) 7966(1) 21(1) O(5) 8426(2) 4560(1) 7315(1) 27(1) O(6) 6120(2) 4250(1) 8301(1) 20(1) C(1) 3486(2) 3426(1) 7454(1) 16(1) C(2) 2452(3) 2982(1) 6755(1) 19(1) C(3) 3420(2) 3349(1) 6009(1) 17(1) C(4) 5538(3) 3722(1) 6294(1) 17(1) C(5) 2030(3) 4003(1) 5650(1) 19(1) C(6) 3962(2) 2853(1) 8120(1) 18(1) C(7) 6459(3) 1778(1) 8478(1) 22(1) C(8) 4701(3) 1160(1) 8529(1) 33(1) 175 Experimenteller Teil C(9) C(10) C(11) C(12) C(13) C(14) C(15) 7087(3) 8397(3) 6842(2) 7188(3) 6840(3) 5951(3) 9557(3) 2103(1) 1471(1) 4238(1) 4724(1) 5590(1) 4466(1) 4511(1) 9280(1) 8037(1) 7563(1) 8933(1) 8754(1) 9659(1) 9006(1) Tabelle 7: Bindungslängen [Å] and Bindungswinkel [°]. _____________________________________________________ N(1)-N(2) 1.2467(19) N(1)-C(3) 1.483(2) N(2)-N(3) 1.1277(18) N(4)-C(4) 1.3882(18) N(4)-C(11) 1.399(2) N(4)-C(1) 1.4756(19) O(1)-C(4) 1.2038(18) O(2)-C(5) 1.4055(18) O(3)-C(6) 1.2038(18) O(4)-C(6) 1.3329(19) O(4)-C(7) 1.4927(18) O(5)-C(11) 1.2034(19) O(6)-C(11) 1.3311(18) O(6)-C(12) 1.4959(18) C(1)-C(6) 1.521(2) C(1)-C(2) 1.545(2) C(2)-C(3) 1.535(2) C(3)-C(5) 1.533(2) C(3)-C(4) 1.539(2) C(7)-C(10) 1.511(2) C(7)-C(8) 1.517(2) C(7)-C(9) 1.520(2) C(12)-C(13) 1.516(2) C(12)-C(14) 1.518(2) C(12)-C(15) 1.522(2) N(2)-N(1)-C(3) 115.23(14) N(3)-N(2)-N(1) 171.93(18) C(4)-N(4)-C(11) 124.10(13) C(4)-N(4)-C(1) 113.77(13) C(11)-N(4)-C(1) 121.43(12) 176 39(1) 37(1) 18(1) 21(1) 33(1) 28(1) 31(1) Experimenteller Teil C(6)-O(4)-C(7) 121.96(12) C(11)-O(6)-C(12) 122.31(12) N(4)-C(1)-C(6) 113.42(12) N(4)-C(1)-C(2) 103.70(11) C(6)-C(1)-C(2) 109.92(12) C(3)-C(2)-C(1) 105.81(12) N(1)-C(3)-C(5) 111.44(12) N(1)-C(3)-C(2) 108.91(12) C(5)-C(3)-C(2) 113.66(13) N(1)-C(3)-C(4) 110.44(12) C(5)-C(3)-C(4) 108.08(13) C(2)-C(3)-C(4) 104.06(12) O(1)-C(4)-N(4) 127.08(15) O(1)-C(4)-C(3) 125.15(13) N(4)-C(4)-C(3) 107.71(13) O(2)-C(5)-C(3) 110.91(12) O(3)-C(6)-O(4) 127.48(14) O(3)-C(6)-C(1) 121.93(14) O(4)-C(6)-C(1) 110.47(12) O(4)-C(7)-C(10) 102.17(13) O(4)-C(7)-C(8) 109.85(13) C(10)-C(7)-C(8) 111.40(14) O(4)-C(7)-C(9) 108.87(13) C(10)-C(7)-C(9) 111.35(15) C(8)-C(7)-C(9) 112.66(15) O(5)-C(11)-O(6) 126.70(15) O(5)-C(11)-N(4) 124.81(14) O(6)-C(11)-N(4) 108.49(13) O(6)-C(12)-C(13) 108.34(12) O(6)-C(12)-C(14) 101.70(12) C(13)-C(12)-C(14) 111.70(14) O(6)-C(12)-C(15) 111.13(13) C(13)-C(12)-C(15) 112.61(15) C(14)-C(12)-C(15) 110.82(14) _____________________________________________________________ 177 Experimenteller Teil Tabelle 8: Anisotrope Auslenkungsparameter (Å2x 103). ___________________________________________________________________________ U11 U22 U33 U23 U13 U12 ___________________________________________________________________________ N(1) 30(1) 24(1) 18(1) -4(1) -4(1) 4(1) N(2) 19(1) 27(1) 25(1) -6(1) 5(1) 2(1) N(3) 48(1) 49(1) 20(1) -7(1) 7(1) 10(1) N(4) 15(1) 18(1) 14(1) 0(1) 1(1) -1(1) O(1) 20(1) 38(1) 19(1) 0(1) 5(1) -5(1) O(2) 24(1) 20(1) 26(1) -2(1) 6(1) 2(1) O(3) 28(1) 32(1) 21(1) 5(1) 8(1) 4(1) O(4) 19(1) 23(1) 21(1) 6(1) 2(1) 4(1) O(5) 24(1) 34(1) 24(1) -5(1) 5(1) -12(1) O(6) 20(1) 26(1) 16(1) -5(1) 2(1) -5(1) C(1) 13(1) 19(1) 17(1) 2(1) 1(1) 0(1) C(2) 20(1) 19(1) 19(1) 2(1) -2(1) -3(1) C(3) 19(1) 17(1) 15(1) -2(1) -1(1) 0(1) C(4) 18(1) 17(1) 17(1) 2(1) -1(1) 3(1) C(5) 19(1) 21(1) 18(1) -1(1) 1(1) -1(1) C(6) 18(1) 18(1) 17(1) -3(1) -3(1) -1(1) C(7) 23(1) 20(1) 23(1) 9(1) -2(1) 1(1) C(8) 33(1) 24(1) 43(1) 9(1) -4(1) -3(1) C(9) 49(1) 38(1) 30(1) 4(1) -16(1) 5(1) C(10) 30(1) 32(1) 48(1) 15(1) 7(1) 8(1) C(11) 17(1) 17(1) 20(1) -1(1) 0(1) 2(1) C(12) 22(1) 23(1) 17(1) -7(1) -2(1) -3(1) C(13) 42(1) 26(1) 31(1) -6(1) -1(1) -1(1) C(14) 29(1) 34(1) 21(1) -8(1) 1(1) -1(1) C(15) 23(1) 44(1) 28(1) -6(1) -6(1) 1(1) 178 Experimenteller Teil Tabelle 9: Wasserstoffkoordinaten ( x 104) und isotrope Auslenkungsparameter (Å2x 103). ___________________________________________________________________________ x y z U(eq) ___________________________________________________________________________ H(2) 579 4472 6487 35 H(1) 2493 3849 7643 20 H(2A) 2791 2413 6782 23 H(2B) 870 3048 6761 23 H(5A) 2775 4230 5187 23 H(5B) 647 3777 5468 23 H(8A) 4194 1032 7998 50 H(8B) 3502 1366 8842 50 H(8C) 5272 684 8780 50 H(9A) 8165 2519 9213 58 H(9B) 7689 1679 9604 58 H(9C) 5812 2321 9540 58 H(10A) 7959 1299 7510 55 H(10B) 9017 1025 8325 55 H(10C) 9473 1891 7991 55 H(13A) 5309 5686 8655 49 H(13B) 7676 5737 8287 49 H(13C) 7311 5907 9205 49 H(14A) 4414 4568 9581 42 H(14B) 6462 4763 10118 42 H(14C) 6178 3902 9748 42 H(15A) 9722 3938 8980 47 H(15B) 10111 4703 9512 47 H(15C) 10364 4756 8575 47 _________________________________________________________________________ 179 Anhang 6. Anhang 6.1. Literaturverzeichnis [1] [2] [3] [4] [5] [6] [7] [8] [9] [10] [11] [12] [13] [14] [15] [16] [17] [18] [19] [20] [21] [22] [23] [24] [25] [26] [27] [28] [29] [30] [31] [32] T. Wieland, M. Hasan, P. Pfaender, Justus Liebigs Ann. Chem. 1968, 717, 205-214. H.-D. Jakubke, Spektrum, Akad. Verl., Heidelberg; Berlin; Oxford, 1996. R. Halai, D. J. Craik, Nat. Prod. Rep. 2009, 26, 526-536. J. Ekberg, D. J. Craik, D. J. Adams, Int. J. Biochem. Cell Biol. 2008, 40, 2363-2368. H. Terlau, B. M. Olivera, Physiol Rev 2004, 84, 41-68. M. McIntosh, L. J. Cruz, M. W. Hunkapiller, W. R. Gray, B. M. Olivera, Arch. Biochem. Biophys. 1982, 218, 329-334. J. A. Williams, M. Day, J. E. Heavner, Expert Opin. Pharmacother. 2008, 9, 15751583. D. J. Craik, D. J. Adams, ACS Chemical Biology 2007, 2, 457-468. R. W. Jack, G. Jung, Curr Opin Chem Biol 2000, 4, 310-317. M. J. Horn, D. B. Jones, S. J. Ringel, J. Biol. Chem. 1941, 138, 141-149. N. Schnell, K.-D. Entian, U. Schneider, F. Götz, H. Zähner, R. Kellner, G. Jung, Nature 1988, 333, 276-278. C. I. Mortvedt, J. Nissen-Meyer, K. Sletten, I. F. Nes, Appl. Environ. Microbiol. 1991, 57, 1829-1834. F. Castiglione, L. Cavaletti, D. Losi, A. Lazzarini, L. Carrano, M. Feroggio, I. Ciciliato, E. Corti, G. Candiani, F. Marinelli, E. Selva, Biochemistry 2007, 46, 58845895. J. M. Willey, W. A. van der Donk, Annu. Rev. Microbiol. 2007, 61, 477-501. G. Bierbaum, C. Szekat, M. Josten, C. Heidrich, C. Kempter, G. Jung, H. Sahl, Appl. Environ. Microbiol. 1996, 62, 385-392. H. G. Sahl, R. W. Jack, G. Bierbaum, Eur. J. Biochem. 1995, 230, 827-853. Y. Rew, S. Malkmus, C. Svensson, T. L. Yaksh, N. N. Chung, P. W. Schiller, J. A. Cassel, R. N. DeHaven, M. Goodman, J. Med. Chem. 2002, 45, 3746-3754. H. Li, X. Jiang, M. Goodman, J. Pept. Sci. 2001, 7, 82-91. H. Li, X. Jiang, S. B. Howell, M. Goodman, J. Pept. Sci. 2000, 6, 26-35. B. Perichon, P. Courvalin, Antimicrob. Agents Chemother. 2009, 53, 4580-4587. P. D. Cotter, C. Hill, R. P. Ross, Curr. Protein Pept. Sci. 2005, 6, 61-75. H. Brötz, G. Bierbaum, P. E. Reynolds, H. G. Sahl, Eur. J. Biochem. 1997, 246, 193199. S.-T. D. Hsu, E. Breukink, E. Tischenko, M. A. G. Lutters, B. de Kruijff, R. Kaptein, A. M. J. J. Bonvin, N. A. J. van Nuland, Nat. Struct. Mol. Biol. 2004, 11, 963-967. C. Chatterjee, M. Paul, L. Xie, W. A. van der Donk, Chem. Rev. 2005, 105, 633-684. E. Breukink, B. de Kruijff, Nat. Rev. Drug Discov. 2006, 5, 321-323. G. Machaidze, J. Seelig, Biochemistry 2003, 42, 12570-12576. I. F. Nes, J. R. Tagg, Antonie Leeuwenhoek 1996, 69, 89-97. T. Schmiederer, PhD thesis, Technische Universität Berlin (Berlin), 2008. T. Stein, S. Borchert, B. Conrad, J. Feesche, B. Hofemeister, J. Hofemeister, K.-D. Entian, J. Bacteriol. 2002, 184, 1703-1711. C. Meyer, G. Bierbaum, C. Heidrich, M. Reis, J. Süling, M. I. Iglesias-Wind, C. Kempter, E. Molitor, H. G. Sahl, Eur. J. Biochem. 1995, 232, 478-489. G. Jung, Angew. Chem., Int. Ed. 2006, 45, 5919-5921. N. M. Okeley, M. Paul, J. P. Stasser, N. Blackburn, W. A. van der Donk, Biochemistry 2003, 42, 13613-13624. 180 Anhang [33] [34] [35] [36] [37] [38] [39] [40] [41] [42] [43] [44] [45] [46] [47] [48] [49] [50] [51] [52] [53] [54] [55] [56] [57] [58] [59] [60] [61] [62] B. Li, J. P. J. Yu, J. S. Brunzelle, G. N. Moll, W. A. van der Donk, S. K. Nair, Science 2006, 311, 1464-1467. Y. Zhu, M. D. Gieselman, H. Zhou, O. Averin, W. A. v. d. Donk, Org. Biomol. Chem. 2003, 1, 3304-3315. R. J. Siezen, O. P. Kuipers, W. M. Vos, Antonie Leeuwenhoek 1996, 69, 171-184. L. Xie, L. M. Miller, C. Chatterjee, O. Averin, N. L. Kelleher, W. A. van der Donk, Science 2004, 303, 679-681. Y. O. You, W. A. van der Donk, Biochemistry 2007, 46, 5991-6000. G. Jung, Angew. Chem., Int. Ed. 1991, 30, 1051-1068. U. Pag, H. G. Sahl, Curr. Pharm. Des. 2002, 8, 815-833. A. Dufour, T. Hindré, D. Haras, J. P. Le Pennec, FEMS Microbiol. Rev. 2007, 31, 134-167. P. Chen, J. Novak, M. Kirk, S. Barnes, F. X. Qi, P. W. Caufield, Appl. Environ. Microbiol. 1998, 64, 2335-2340. N. I. Martin, T. Sprules, M. R. Carpenter, P. D. Cotter, C. Hill, R. P. Ross, J. C. Vederas, Biochemistry 2004, 43, 3049-3056. I. Wiedemann, T. Bottiger, R. R. Bonelli, A. Wiese, S. O. Hagge, T. Gutsmann, U. Seydel, L. Deegan, C. Hill, P. Ross, H. G. Sahl, Mol. Microbiol. 2006, 61, 285-296. R. D. Tillotson, H. A. B. Wosten, M. Richter, J. M. Willey, Mol. Microbiol. 1998, 30, 595-602. K. Meindl, T. Schmiederer, K. Schneider, A. Reicke, D. Butz, S. Keller, H. Gühring, L. Vértesy, J. Wink, H. Hoffmann, M. Brönstrup, G. Sheldrick, R. Süssmuth, Angew. Chem., Int. Ed. 2010, 49, 1151-1154. S. Kodani, M. A. Lodato, M. C. Durrant, F. Picart, J. M. Willey, Mol. Microbiol. 2005, 58, 1368-1380. J. Wink, R. M. Kroppenstedt, G. Seibert, E. Stackebrandt, Int. J. Syst. Evol. Microbiol. 2003, 53, 721-724. R. Dorenbos, T. Stein, J. Kabel, C. Bruand, A. Bolhuis, S. Bron, W. J. Quax, J. M. van Dijl, J. Biol. Chem. 2002, 277, 16682-16688. C. Kubicek, M. Komoń-Zelazowska, E. Sándor, I. Druzhinina, Chem. Biodiversity 2007, 4, 1068-1082. W. Müller, T. Schmiederer, P. Ensle, R. Süssmuth, Angew. Chem., Int. Ed. 2010, 49, 2436-2440. S. Kodani, M. E. Hudson, M. C. Durrant, M. J. Buttner, J. R. Nodwell, J. M. Willey, Proc. Natl. Acad. Sci. U. S. A. 2004, 101, 11448-11453. I. Decosterd, C. J. Woolf, Pain 2000, 87, 149-158. K. Fukase, M. Kitazawa, A. Sano, K. Shimbo, H. Fujita, S. Horimoto, T. Wakamiya, T. Shiba, Tetrahedron Lett. 1988, 29, 795-798. T. Wakamiya, K. Shimbo, A. Sano, K. Fukase, T. Shiba, Bull. Chem. Soc. Jpn. 1983, 56, 2044-2049. D. N. Harpp, J. G. Gleason, J. Org. Chem. 1971, 36, 73-80. A. K. Galande, J. O. Trent, A. F. Spatola, Peptide Science 2003, 71, 534-551. H. Shao, S. H. H. Wang, C.-W. Lee, G. Oesapay, M. Goodman, J. Org. Chem. 1995, 60, 2956-2957. Y. Hata, M. Watanabe, Tetrahedron 1987, 43, 3881-3888. X. Zhu, Richard R. Schmidt, Eur. J. Org. Chem. 2003, 2003, 4069-4072. V. Swali, M. Matteucci, R. Elliot, M. Bradley, Tetrahedron 2002, 58, 9101-9109. S. Bregant, A. B. Tabor, J. Org. Chem. 2005, 70, 2430-2438. V. R. Pattabiraman, S. M. K. McKinnie, J. C. Vederas, Angew. Chem. 2008, 120, 9614-9617. 181 Anhang [63] A. C. Ross, H. Liu, V. R. Pattabiraman, J. C. Vederas, J. Am. Chem. Soc. 2009, 132, 462-463. [64] Y. Izumi, I. Chibata, T. Itoh, Angew. Chem. 1978, 90, 187-194. [65] A. Strecker, Justus Liebigs Ann. Chem. 1850, 75, 27-45. [66] S. Yamada, C. Hongo, M. Yamamoto, I. Chibata, Agric. Biol. Chem. 1976, 40, 14251427. [67] S. Yamada, M. Yamamoto, I. Chibata, J. Org. Chem. 1973, 38, 4408-4412. [68] U. Schöllkopf, T. Tiller, J. Bardenhagen, Tetrahedron 1988, 44, 5293-5305. [69] D. A. Evans, Aldrichim. Acta 1982, 15, 23-32. [70] T. Oguri, N. Kawai, T. Shioiri, S. Yamada, Chem. Pharm. Bull. 1978, 26, 803-808. [71] A. Solladie-Cavallo, M. C. Simon-Wermeister, J. Schwarz, Organometallics 1993, 12, 3743-3747. [72] L. M. Jackman, B. C. Lange, J. Am. Chem. Soc. 1981, 103, 4494-4499. [73] M. Tabcheh, A. El Achqar, L. Pappalardo, M.-L. Roumestant, P. Viallefont, Tetrahedron 1991, 47, 4611-4618. [74] Klaus W. Laue, S. Kröger, E. Wegelius, G. Haufe, Eur. J. Org. Chem. 2000, 2000, 3737-3743. [75] D. C. Horwell, G. Ratcliffe, E. Roberts, Bioorg. Med. Chem. Lett. 1991, 1, 169-172. [76] J. E. Green, D. M. Bender, S. Jackson, M. J. O`Donnell, J. R. McCarthy, Org. Lett. 2009, 11, 807-810. [77] D. Seebach, J. D. Aebi, M. Gander-Coquoz, R. Naef, Helv. Chim. Acta 1987, 70, 1194-1216. [78] C. Cativiela, M. D. Díaz-de-Villegas, Tetrahedron: Asymmetry 1998, 9, 3517-3599. [79] H.-J. Cristau, X. Marat, J.-P. Vors, J.-L. Pirat, Tetrahedron Lett. 2003, 44, 3179-3181. [80] J. A. Smulik, E. Vedejs, Org. Lett. 2003, 5, 4187-4190. [81] A. Avenoza, C. Cativiela, F. Corzana, J. M. Peregrina, D. Sucunza, M. M. Zurbano, Tetrahedron: Asymmetry 2001, 12, 949-957. [82] A. Avenoza, J. M. Peregrina, E. San MartIn, Tetrahedron Lett. 2003, 44, 6413-6416. [83] H. Shao, J. K. Rueter, M. Goodman, J. Org. Chem. 1998, 63, 5240-5244. [84] H. C. Kolb, M. S. VanNieuwenhze, K. B. Sharpless, Chem. Rev. 1994, 94, 2483-2547. [85] A. Avenoza, J. H. Busto, F. Corzana, J. I. Garcia, J. M. Peregrina, J. Org. Chem. 2003, 68, 4506-4513. [86] S. Saito, N. Takahashi, T. Ishikawa, T. Moriwake, Tetrahedron Lett. 1991, 32, 667670. [87] U. Cramer, A. G. Rehfeldt, F. Spener, Biochemistry 1980, 19, 3074-3080. [88] K. Katagiri, K. Tori, Y. Kimura, T. Yoshida, T. Nagasaki, H. Minato, J. Med. Chem. 1967, 10, 1149-1154. [89] E. C. Roos, H. H. Mooiweer, H. Hiemstra, W. N. Speckamp, B. Kaptein, W. H. J. Boesten, J. Kamphuis, J. Org. Chem. 1992, 57, 6769-6778. [90] B. Kübel, G. Höfle, W. Steglich, Angew. Chem. 1975, 87, 64-66. [91] R. E. Ireland, R. H. Mueller, J. Am. Chem. Soc. 1972, 94, 5897-5898. [92] P. A. Bartlett, J. F. Barstow, J. Org. Chem. 1982, 47, 3933-3941. [93] U. Kazmaier, Liebigs Ann. Chem. 1997, 1997, 285-295. [94] U. Kazmaier, Angew. Chem. 1994, 106, 1046-1047. [95] U. Kazmaier, R. Grandel, Synlett 1995, 1995, 945,946. [96] U. Kazmaier*, Synlett 1995, 1138-1140. [97] U. Kazmaier, Tetrahedron 1994, 50, 12895-12902. [98] U. Kazmaier, S. Maier, Tetrahedron 1996, 52, 941-954. [99] U. Kazmaier, Tetrahedron Lett. 1996, 37, 5351-5354. [100] R. W. Driver, H. N. Hoang, G. Abbenante, D. P. Fairlie, Org. Lett. 2009, 11, 30923095. 182 Anhang [101] N.-H. Nam, G. Ye, G. Sun, K. Parang, J. Med. Chem. 2004, 47, 3131-3141. [102] V. Alezra, M. Bonin, A. Chiaroni, L. Micouin, C. Riche, H.-P. Husson, Tetrahedron Lett. 2000, 41, 1737-1740. [103] A. J. Mancuso, D. Swern, Synthesis 1981, 1981, 165-185. [104] T. Vogler, A. Studer, Synthesis 2008, 2008, 1979-1993. [105] M. Falorni, S. Conti, G. Giacomelli, S. Cossu, F. Soccolini, Tetrahedron: Asymmetry 1995, 6, 287-294. [106] J. Sélambarom, S. Monge, F. Carré, J. P. Roque, A. A. Pavia, Tetrahedron 2002, 58, 9559-9566. [107] A. Ncube, S. B. Park, J. M. Chong, J. Org. Chem. 2002, 67, 3625-3636. [108] H. Takahashi, K. Takahashi, K. Higashiyama, H. Onishi, Chem. Pharm. Bull. 1986, 34, 479-485. [109] A. Alexakis, N. Lensen, J. P. Tranchier, P. Mangeney, J. Org. Chem. 1992, 57, 45634565. [110] Y. Yamashita, S. Kobayashi, J. Am. Chem. Soc. 2004, 126, 11279-11282. [111] A. Alexakis, N. Lensen, P. Mangeney, Synlett 1991, 625,626. [112] P. R. Krishna, E. R. Sekhar, F. Mongin, Tetrahedron Lett. 2008, 49, 6768-6772. [113] K.-D. Gundermann, W. Cohnen, H.-U. Alles, Chem. Ber. 1964, 97, 647-653. [114] J. Wehbe, V. Rolland, A. Fruchier, M.-L. Roumestant, J. Martinez, Tetrahedron: Asymmetry 2004, 15, 851-858. [115] G. Lu, K. Burgess, Bioorg. Med. Chem. Lett. 2006, 16, 3902-3905. [116] B. P. Mowery, V. Prasad, C. S. Kenesky, A. R. Angeles, L. L. Taylor, J.-J. Feng, W.L. Chen, A. Lin, F.-C. Cheng, A. B. Smith, R. Hirschmann, Org. Lett. 2006, 8, 43974400. [117] T. Gagnon, D. Fillion, M.-R. Lefebvre, E. Escher, J. Recept. Signal Transduction 2006, 26, 435-451. [118] B.-X. Zhao, M. Schaudt, S. Blechert, Chin. J. Chem. 2006, 24, 1080-1085. [119] D. J. St-Cyr, A. G. Jamieson, W. D. Lubell, Org. Lett. 2010, 12, 1652-1655. [120] W. Pilgrim, P. V. Murphy, Org. Lett. 2009, 11, 939-942. [121] M. A. Lago, J. Samanen, J. D. Elliott, J. Org. Chem. 1992, 57, 3493-3496. [122] R. B. Nasir Baig, V. Sai Sudhir, C. Srinivasan, Synlett 2008, 2684-2688. [123] R. Rajan, T. Mathew, R. Buffa, F. Bornancin, M. Cavallari, P. Nussbaumer, G. De Libero, A. Vasella, Helv. Chim. Acta 2009, 92, 918-927. [124] N. D. Smith, M. Goodman, Org. Lett. 2003, 5, 1035-1037. [125] N. D. Smith, A. M. Wohlrab, M. Goodman, Org. Lett. 2005, 7, 255-258. [126] L. T. Boulton, H. T. Stock, J. Rarhy, D. C. Horwell, J. Chem. Soc. [Perkin 1] 1999, 1421-1429. [127] P. S. Kutchukian, J. S. Yang, G. L. Verdine, E. I. Shakhnovich, J. Am. Chem. Soc. 2009, 131, 4622-4627. [128] Y.-W. Kim, G. L. Verdine, Bioorg. Med. Chem. Lett. 2009, 19, 2533-2536. [129] C. E. Schafmeister, J. Po, G. L. Verdine, J. Am. Chem. Soc. 2000, 122, 5891-5892. [130] V. R. Pattabiraman, J. L. Stymiest, D. J. Derksen, N. I. Martin, J. C. Vederas, Org. Lett. 2007, 9, 699-702. [131] T. Johnson, M. Quibell, R. C. Sheppard, J. Pept. Sci. 1995, 1, 11-25. [132] T. Johnson, L. C. Packman, C. B. Hyde, D. Owen, M. Quibell, J. Chem. Soc. [Perkin 1] 1996, 719. [133] M. Mergler, F. Dick, B. Sa, C. Stähelin, T. Vorherr, J. Pept. Sci. 2003, 9, 518-526. [134] S. Zahariev, C. Guarnaccia, F. Zanuttin, A. Pintar, G. Esposito, G. Maravi, B. Krust, A. G. Hovanessian, S. Pongor, J. Pept. Sci. 2005, 11, 17-28. [135] K. Wahlström, O. Planstedt, A. Undén, Tetrahedron Lett. 2008, 49, 3921-3924. 183 Anhang [136] O. Demmer, A. O. Frank, H. Kessler, in Peptide and Protein Design for Biopharmaceutical Applications (Ed.: K. J. Jensen), Wiley, 2009, pp. 133 - 176. [137] J. S. Davies, J. Pept. Sci. 2003, 9, 471-501. [138] T. Rückle, P. de Lavallaz, M. Keller, P. Dumy, M. Mutter, Tetrahedron 1999, 55, 11281-11288. [139] H. Kessler, R. Schuck, R. Siegmeier, J. W. Bats, H. Fuess, H. Förster, Liebigs Ann. Chem. 1983, 1983, 231-247. [140] W. D. F. Meutermans, G. T. Bourne, S. W. Golding, D. A. Horton, M. R. Campitelli, D. Craik, M. Scanlon, M. L. Smythe, Org. Lett. 2003, 5, 2711-2714. [141] M. El Haddadi, F. Cavelier, E. Vives, A. Azmani, J. Verducci, J. Martinez, J. Pept. Sci. 2000, 6, 560-570. [142] J. E. Sheppeck, H. Kar, H. Hong, Tetrahedron Lett. 2000, 41, 5329-5333. [143] K. E. Kawulka, T. Sprules, C. M. Diaper, R. M. Whittal, R. T. McKay, P. Mercier, P. Zuber, J. C. Vederas, Biochemistry 2004, 43, 3385-3395. [144] R. Sateesh Chandra Kumar, G. Venkateswar Reddy, G. Shankaraiah, K. Suresh Babu, J. Madhusudana Rao, Tetrahedron Lett. 2010, 51, 1114-1116. [145] J. Jeon, J. H. Lee, J.-W. Kim, Y. G. Kim, Tetrahedron: Asymmetry 2007, 18, 24482453. [146] J. K. Cha, N.-S. Kim, Chem. Rev. 1995, 95, 1761-1795. [147] P. Boersema, S. Mohammed, A. Heck, Anal. Bioanal. Chem. 2008, 391, 151-159. [148] T. Yoshida, J. Biochem. Biophys. Methods 2004, 60, 265-280. [149] H. Hayen, Nachr. Chem. 2010, 58, 461-465. [150] H.-Y. Tang, D. W. Speicher, Anal. Biochem. 2004, 334, 48-61. [151] J. Mack, K. Falk, O. Rötzschke, T. Walk, J. L. Strominger, G. Jung, J. Pept. Sci. 2001, 7, 338-300. [152] V. Wittmann, S. Takayama, K. W. Gong, G. Weitz-Schmidt, C.-H. Wong, J. Org. Chem. 1998, 63, 5137-5143. [153] K. A. McDonnell, S. C. Low, T. Hoehn, R. Donnelly, H. Palmieri, C. Fraley, P. Sakorafas, A. R. Mezo, J. Med. Chem. 2010, 53, 1587-1596. [154] M. Taniguchi, K. Suzumura, K. Nagai, T. Kawasaki, J. Takasaki, M. Sekiguchi, Y. Moritani, T. Saito, K. Hayashi, S. Fujita, S. Tsukamoto, K. Suzuki, Bioorg. Med. Chem. 2004, 12, 3125-3133. [155] M. Takasaki, K. Harada, J. Chem. Soc., Chem. Commun. 1987, 571-573. [156] E. Gross, J. L. Morell, J. Am. Chem. Soc. 1967, 89, 2791-2792. [157] A. Galande, A. Spatola, Lett. Pept. Sci. 2001, 8, 247-251. [158] D. Basavaiah, M. Krishnamacharyulu, A. J. Rao, Synth. Commun. 2000, 30, 2061 2069. [159] C. Grundmann, G. Ottmann, Justus Liebigs Ann. Chem. 1953, 582, 163-177. [160] A. Kendhale, R. Gonnade, P. R. Rajamohanan, G. J. Sanjayan, Chem. Commun. 2006, 2756-2758. [161] J. Kretz, Diplomarbeit Technische Universität (Berlin), 2010. [162] E. D. Goddard-Borger, R. V. Stick, Org. Lett. 2007, 9, 3797-3800. [163] A. Pesic, pers. Mitteilung TU Berlin, Berlin, 2009. 184 Anhang 6.2. Abkürzungsverzeichnis Abu Aminobuttersäure Ac Acetyl ACE Angiotensin converting enzyme AcSH Thioessigsäure AD asymmetrische Dihydroxylierung Ala Alanin All Allyl äq Äquivalent Arg Arginin Asn Asparagin Asp Asparaginsäure ATP Adenosintriphosphat AviCys Aminovinylcystein AviMeCys Aminovinyl-3-Methylcystein Bn Benzyl Boc tert-Butoxycarbonyl Bu Butyl Cbz Benzyloxycarbonyl COSY Correlation spectroscopy; Korrelationspektroskopie Cys Cystein d Duplett DABCO 1,4-Diazabicyclo[2.2.2]octan DNA Deoxyribonucleic acid; Desoxyribonukleinsäure DBU 1,8-Diazabicyclo[5.4.0]undec-7-en DC Dünnschichtchromatographie DCM Dichlormethan dd Duplett von Duplett de diastereomeric excess; Diastereomerenüberschuss DEAD Diazendicarbonsäurediethylester DEPBT 3-(Diethoxyphosphoryloxy)-1,2,3-benzotriazin-4(3H)-on Dha Didehydroalanin 185 Anhang Dhb Didehydrobutyrin DIPEA N,N-Diisopropyl-N-ethylamin DMAP 4-Dimethylaminopyridin DMF N,N-Dimethylformamid DMSO Dimethylsulfoxid Dpm Diphenylmethyl DPPA Diphenylphosphorylazid dt Duplett von Triplett DTT Dithiothreitol (1,4-Dimercapto-2,3-butandiol) 1-Ethyl-3-(3-dimethylaminopropyl)carbodiimid EDAC Hydrochlorid ee enantiomeric excess; Enatiomerenüberschuss EI Elektronenstoßionisation ESI Elektronensprayionisation Et Ethyl EtOAc Ethylacetat Fmoc Fluorenylmethoxycarbonyl GC Gaschromatographie GC-MS Gaschromatographie-Massenspektrometrie Gln Glutamin Glu Glutaminsäure Gly Glycin GTP Guanosintriphosphat HATU O-(7-Azabenzotriazol-1-yl)-N,N,N´,N´tetramethyluroniumhexafluorophosphat Hex Hexan HILIC Hydrophile Interaktionschromatographie His Histidin HOAt 1-Hydroxy-7-azabenzotriazol HOBt N-Hydroxybenzotriazol HOSu N-Hydroxysuccinimid HPLC high-performance liquid chromatography; Hochleistungs-Flüssigkeitschromatographie Ile Isoleucin 186 Anhang IPDMS Isopropyldimethylsilyl J Kopplungskonstante (NMR) kb Kilobasen KHMDS Kaliumhexamethyldisilizan Lab Labyrinthopeptin Lan Lanthionin LC-MS liquid chromatography mass spectrometry Flüssigkeitschromatograhie-Massenspektometrie LDA Lithiumdiisopropylamid Leu Leucin Lys Lysin m Multiplett MAH N-(2-Mercaptoethyl)-aminomethyl-Harz Me Methyl MeCys 3-Methylcystein MeLan β-Methyllanthionin MeOH Methanol Met Methionin MOM Methoxymethyl MOMCl Methoxymethylchlorid MRSA Methicilin-resistenter Staphylococus aureus MS Massenspektrometrie Ms Methylsulfonyl MsCl Methylsulfonylchlorid NMR nuclear magnetic resonance; Kernspinresonanz NTCB 2-Nitro-5-thiocyanatobenzoesäure pb polymer bond; Polymer gebunden PEG Polyethylenglykol Pen Pentan Ph Phenyl Phe Phenylalanin ppm parts per millon Pro Prolin PrOH Propanol 187 Anhang pTos para-Toluolsulfonsäure PWT Paw Withdrawal Threhold q Quartett Rf Retentionsfaktor RT Raumtemperatur s Singulett Ser Serin SNI spared nerve injury; neurophatisches Schmerzmodell SPPS solid phase peptid synthesis; Festphasenpeptidsynthese Su Succinimidyl t Triplett TBAF Tetrabutylammoniumfluorid TBDMS tert-Butyldimethylsilyl TBDMSCl tert-Butyldimethylsilylchlorid tBu tert-Butyl TBTA tert-Butyl-Acetimidat td Triplett von Duptett TEA Triethylamin TEMPO 2,2,6,6-Tetramethyl-piperidin-1-oxyl TES Triethylsilan TFA Trifluoressigsäure THF Tetrahydrofuran THP Tetrahydropyranyl Thr Threonin Tmb Trimethoxybenzyl Trp Tryptophan Tyr Tyrosin UV Ultraviolett Val Valin 188