Übung 101126 Lösung-b
Werbung

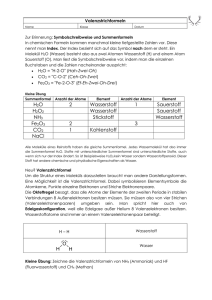
Übungen zur VL Chemie für Biologen und Humanbiologen 26. 11.2010 1. Nennen Sie mindestens 2 Arten der chemischen Bindungen und geben Sie je 2 Beispielverbindungen dafür an (Strukturformel). 1) Ionische Bindung: Man zeichnet hier keine Valenzstrichformel, Bsp.: NaCl, CaCO3 2) Kovalente Bindung: Wasserstoff , Aceton 3) Komplexbindung bzw. koordinative Bindung: Tetrachloronickel-Komplex Hexaaquakupfer-Komplex 4) Metallische Bindung: Hier können auch keine Valenzstrichformeln gezeichnet werden. Die Metallatome sind in einem makroskopisch ausgedehnten Kristallgitter angeordnet. 2. Wodurch wird die Oberflächenspannung von Wasser bedingt? Wie nennt man diese Art der Bindung? Skizieren Sie kurz wie diese Bindungen aussehen. Die hohe Oberflächenspannung von Wasser wird durch die starken Wechselwirkungen zwischen den Wasser Molekülen bedingt. Zum Einen besitzen die polaren Wassermoleküle ein Dipolmoment wodurch sie sich bei entsprechender Ausrichtung anziehen. Zum Anderen können speziell bei Wasser zwischen den Molekülen Wasserstoffbrückenbindungen zwischen den Wasserstoffatomen und den freien Elektronenpaaren des Sauerstoffs gebildet werden. Wasserstoffbrückenbindung: 3. Wieviel bindig sind folgende Elemente in kovalenten Bindungen? Einige Elemente können auch verschiedene Bindigkeiten zeigen Br 1 O 2 Al 3 N 3;5 Na 1 P 3;5 S 2;4;6 C 4 B 3 Ca 2 Mg 2 H1 Kovalente Bindungen zwischen Alkali- und Erdalkalimetallen erfüllen die Oktettregel nicht und sind auch aufgrund der hohen Elektronegativitätsdifferenz sehr instabil/reaktiv. 4. Zeichnen Sie die Struktur der organischen Säure mit folgender Summenformel und benennen Sie die Säure: C2H4O2 Essigsäure: 5. Welche räumliche Struktur hat Methan? Zeichnen Sie die Strukturformel des Moleküls räumlich Die Wasserstoffatome bilden die Ecken eines Tetraeders. Das Zentrum ist das Kohlenstoffatom. H H C H H 7. Zeichnen Sie die Elektronendichteverteilung in den Strukturformeln folgender Moleküle: Diethylether Methanol Natriumbromid ist eine ionische Verbindung keine Valenzstrichformel Ammoniak H N H H Brom Br Br Beide Atome besitzen die gleiche Elektronegativität. Daher ist die Bindung nicht polar. Schwefelsäure O O H S H O O 8. Was wird gebildet wenn man Brommoleküle mit UV Licht bestrahlt? Geben Sie die Reaktionsgleichung an. Es werden 2 Bromradikale pro Brommolekül gebildet. hν 2 Br Br 2 9. Kennzeichnen Sie bei welchen Formelpaaren es sich um identische Verbindungen, mesomere Grenzformen oder andere Strukturen handelt. handelt 1) Es sind Konstitutionsisomere.. Die beiden Verbindungen haben die gleiche Summenformel, aber unterschiedlich verknüpfte Atome. 2) O OH HO HO H O Spiegelebene HO H HO O OH O Gleiche Summenformel, gleiche Atomverküpfung. Atomverküpfung. Die beiden Verbindungen lassen sich jedoch nicht ineinander überführen. Konfigurationsisomer (auch Stereoisomer genannt). genannt) Diese beiden Verbindungen hier verhalten sich speziell wie Bild und Spiegelbild. Enantiomere. 3) Diese beiden Strukturen sind identisch. Sie lassen sich durch Drehung ineinander überführen. 4) Gleiche Summenformel, unterschiedliche Verknüpfung der Atome Konstitutionsisomere. Diese Verbindungen speziell können durch eine intramolekulare Reaktion (hier die Übertragung eines Wasserstoffprotons) ineinander umgewandelt werden. werden. Dieser Prozess heißt Tautomerie, das Isomerenpaar nennt man Tautomere. 5) Diese beidenn Strukturen sind mesomere Grenzstrukturen eines deprotonierten Diketons. 10. Zeichnen Sie mindestens estens je zwei mesomere Grenzformeln folgender Moleküle: 1) Benzol 2) Kohlensäureanion Hier nach zweifacher facher Protonenabgabe. Es entsteht Carbonat. O O O C C C O O O O O 3) O O O O O 11. Welches der beiden Moleküle ist chemisch stabiler. Begründen Sie Ihre Wahl kurz. Das untere Molekül ist stabiler, da das System der konjugierten Doppelbindungen größer ist. Die π-Eletronen Eletronen können sich innerhalb des konjugierten Systems frei bewegen. Sie sind delokalisiert. alisiert. Dies ist ein energetisch günstiger Zustand. 12. Nennen Sie 2 einzähnige, einen zweizähnigen und einen sechszähnigen Liganden (mit Struktur). Einzähnig: Wasser O H H Ammoniak H N H H Zweizähnig: Ethylendiamin H H N N H H Sechszähnig: Ethylendiamintetraessigsäure (EDTA) In der Mitte ist in rot ein potentielles Zentralatom Zentral angedeutet. 13. Beschreiben Sie kurz was ein Komplex ist. Nennen Sie 5 Beispiele, davon mindestens zwei Beispiele natürlicher Komplexe. Ein Komplex oder Koordinationsverbindung ist eine chemische Verbindung, bei der ein Zentralatom (Metall-Ion oder Atom) Lücken in seiner Elektronenkonfiguration aufweist, so dass sich ein oder mehrere Moleküle oder Ionen, die Liganden, anlagern können, die jeweils mindestens ein freies Elektronenpaar für die Bindung zur Verfügung stellen. Beispiele: [Ag(NH3)2]+ [Ag(CN)2][Fe(CN)6]3Hämoglobin, Chlorophyll 14. Was wird gebildet wenn man zu dem Silberammoniak-Komplex [Ag(NH3)2]+ Kaliumcyanat (KCN) zugibt? Begründen Sie Ihre Erklärung mit der Komplexbildungskonstante. [Ag(CN)2]Die Komplexbildungskonstante des Silbercyanokomplexes ist größer als die des Silberaminokomplexes, so dass sich bevorzugt im Gleichgewicht der Cyanokomplex bildet. 15. Nennen Sie die drei Aggregatzustände der stofflichen Materie. Gasförmig, flüssig, fest.