Seite als PDF downloaden - Max-Planck
Werbung

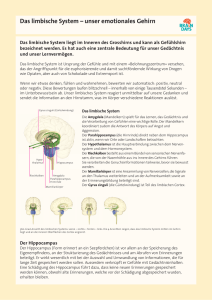
Jahrbuch 2005/2006 | Miquelajauregui, Amaya; Tarabykin, Victor | Der Transkriptionsfaktor SIP1: ein Schlüsselregulator in der Gehirnentw icklung der Maus Der Transkriptionsfaktor SIP1: ein Schlüsselregulator in der Gehirnentwicklung der Maus Sip1 Transcription Factor as a Key Regulator of Hippocampus Development in the Mouse Miquelajauregui, Amaya; Tarabykin, Victor Max-Planck-Institut für experimentelle Medizin, Göttingen Korrespondierender Autor E-Mail: [email protected] Zusammenfassung SIP1 ist ein Transkriptionsfaktor, der an der Entstehung des Mow at-W ilson-Syndroms beteiligt ist – einer Krankheit, bei der die normale Gehirnentw icklung des Menschen gestört ist. Um die molekularen Mechanismen der W irkung des Sip1-Gens aufzudecken, züchteten W issenschaftler am Max-Planck-Institut für experimentelle Medizin in Göttingen eine Mausmutante, die modellhaft für dieses Syndrom ist. In diesen Mäusen w ar das Sip1-Gen nur in der Großhirnrinde ausgeschaltet, w ährend es in anderen Gew ebeteilen unverändert blieb. Summary SIP1 is a transcription factor that has been implicated in the genesis of Mow at-W ilson syndrome – a disease that affects normal brain development in humans. In order to uncover molecular mechanisms of Sip1 gene action scientists of the MPI for experimental medicine created a mutant mouse as a model for the syndrome. In this mouse Sip1 gene w as inactivated in the cerebral cortex only, w hile in other organs it remained intact. The mutant mice show ed loss of the entire hippocampus, w hich w as based on elevated cell death and decreased proliferation during development. SIP1 ist ein Transkriptionsfaktor, der beim Menschen an der Entstehung des Mow at-W ilson-Syndroms (früher auch Hirschsprung-Krankheit oder mental retardation syndrome genannt) beteiligt ist. Patienten des Mow atW ilson-Syndroms haben ein verkleinertes Großhirn und sind geistig stark zurückgeblieben. Die Krankheit zeigt mit 1 in 1000 bis 1500 Neugeborenen eine sehr hohe Verbreitung. Um den Patienten des Mow at-W ilsonSyndroms helfen zu können, müssen die molekularen Grundlagen der Krankheit erkannt w erden. Außer der Tatsache, dass bei diesen Patienten das SIP1-Gen mutiert ist, w ar über den molekularen Entstehungsw eg der Krankheit nichts bekannt. Um diesen Weg aufzuklären, untersuchten Victor Tarabykin und Amaya Mequelajauregui die Funktion von SIP1 im Gehirn von Mäusen. Zuerst analysierten die W issenschaftler die Expression von SIP1 w ährend der embryonalen Entw icklung. Dabei fanden sie SIP1 schon vor der Gastrulation bis zum Erw achsenenstadium und vorw iegend im Gehirn, aber auch in vielen anderen Gew eben. Es w ar deshalb nicht überraschend, dass sich das Ausschalten (knock-out) des SIP1-Gens in Mäusen, die im Labor von Prof. Danny Huylebroeck, Universität Leuven, Belgien, hergestellt © 2006 Max-Planck-Gesellschaft w w w .mpg.de 1/7 Jahrbuch 2005/2006 | Miquelajauregui, Amaya; Tarabykin, Victor | Der Transkriptionsfaktor SIP1: ein Schlüsselregulator in der Gehirnentw icklung der Maus w urden, schon in der Mitte des Embryonalstadiums letal ausw irkt. Um dennoch Jungtiere zur Untersuchung zu erhalten, w urden – in Zusammenarbeit mit Huylebroeck – Mausmutanten mithilfe der so genannten konditionalen Knock-out-Technik hergestellt. Diese Methode ermöglicht das Ausschalten eines Genes in einem bestimmten Zielgew ebe, ohne dass die Expression dieses Gens in anderen Organen beeinträchtigt w ird. Dazu w erden zw ei heterozygote Mauslinien verw endet, w obei eine Linie versteckte Mutationen enthält, die durch eine spezifische Kreuzung aktiviert w erden. Aus de r Kre uzung zwe ie r Ma uslinie n zur Erze ugung k onditiona le r SIP 1-k nock -out-Mä use . Die he te rozygote n Mä use sind una uffä llig, die hom ozygote n Ma usm uta nte n le ide n unte r ä hnliche n De fe k te n wie Mowa t-W ilson-P a tie nte n. © Ma x -P la nck -Institut für Ex pe rim e nte lle Me dizin/Ta ra byk in Da bei Mow at-W ilson-Patienten das Gehirn die Region ist, die am stärksten gestört ist, w urde SIP1 nur in der Großhirnrinde ausgeschaltet, andere Regionen blieben unverändert. Die bei der Kreuzung erzeugten homozygoten Mausmutanten w aren kleiner als ihre heterozygoten Geschw ister und überlebten nur bis zum frühen Erw achsenenalter von drei bis vier W ochen (Abb. 1). Die Mausmutanten zeigten dramatische Veränderungen im strukturellen Aufbau des Gehirns. Es fehlte ihnen die gesamte Hippocampusformation, ein Teil des Großhirns (Cortex cerebri), der für Lernen und Gedächtnis w ichtig ist (Abb. 2). Die Veränderungen w aren denen ähnlich, die in Gehirnen von Mow at-W ilson-Patienten gefunden w urden. Daher können diese homozygoten Mäuse, die aus der Mauskreuzung als stabile Linie hervorgegangen sind, als Tiermodell der Krankheit beim Menschen dienen. Um die Ursachen für die Fehlentw icklung der Hippocampusformation aufzuklären, untersuchten die Forscher die Entw icklung des Großhirns in diesen Mausmutanten. Es zeigte sich, dass in frühen Entw icklungsstadien die Hippocampusformation nicht vollständig fehlt, jedoch ihre Größe dramatisch reduziert ist. Für das Fehlen eines ganzen Gehirnareals kann es verschiedene Ursachen geben, beispielsw eise eine verminderte Zellteilung in der entsprechenden Region. In den Gehirnen der Mutanten w urde ein stark vermindertes Wachstum im Bereich der Hippocampusformation gefunden (Abb. 3). © 2006 Max-Planck-Gesellschaft w w w .mpg.de 2/7 Jahrbuch 2005/2006 | Miquelajauregui, Amaya; Tarabykin, Victor | Der Transkriptionsfaktor SIP1: ein Schlüsselregulator in der Gehirnentw icklung der Maus Nissl-Fä rbung a uf Ge hirnschnitte n dre i W oche n a lte r Kontrollm ä use und Muta nte n. De r Ste rn de ute t a uf die R e gion, in de r die Hippoca m pusform a tion fe hlt. © Ma x -P la nck -Institut für Ex pe rim e nte lle Me dizin/Ta ra byk in Als zw eite Ursache für einen fehlenden Hippocampus kann auch vermehrter Zelltod durch Apoptose (programmierter Zelltod) in Frage kommen. W ährend der Entw icklung reguliert der programmierte Zelltod die Anzahl der Zellen im Körper und die Größe von Organen. Auch in der Hippocampusformation findet Apoptose w ährend der normalen Entw icklungsstadien Hirnentw icklung statt, jedoch ist die Rate relativ niedrig und auf späte beschränkt. Es lag nahe, diese Hirnregion auf eine vermehrte Apoptoserate zu untersuchen. Die Mutanten zeigten im Vergleich zu Kontrolltieren eine stark erhöhte Zahl von Zellen, die an Apoptose starben, außerdem setzte der programmierte Zelltod viel früher ein. Als nächster Schritt sollten die molekularen Ursachen der verminderten Zellteilung und der erhöhten Zelltodrate identifiziert w erden. Es ist bekannt, dass für die Bildung der Hippocampusformation die W ntSignalkaskade sehr w ichtig ist. Mäuse mit Mutationen in den verschiedenen Proteinen des W nt-Signalw eges zeigen einen ähnlichen Phänotyp w ie SIP1-Mutanten. Es lag daher nahe, anzunehmen, dass SIP1 in die Kontrolle des W nt-Signalw eges eingreift. Die W nt-Signalkaskade ist für viele verschiedene Prozesse bedeutend, so für die Embryonalentw icklung, für Zellteilung, Differenzierung und Krebs. © 2006 Max-Planck-Gesellschaft w w w .mpg.de 3/7 Jahrbuch 2005/2006 | Miquelajauregui, Amaya; Tarabykin, Victor | Der Transkriptionsfaktor SIP1: ein Schlüsselregulator in der Gehirnentw icklung der Maus Ve rm inde rte Ze llte ilung (a ,b) und ve rm e hrte Apoptose (c,d) in Hirnschnitte n von Kontrollm ä use n (a ,c) und Muta nte n (b,d). Die P fe ile we ise n a uf die Unte rschie de hin. In de r obe re n R e ihe wurde n sich te ile nde Ze lle n m it e ine m Thym idinAna logon (BrdU) m a rk ie rt und histoche m isch durch e ine Antik örpe rre a k tion sichtba r ge m a cht. In de r unte re n R e ihe wird die e rhöhte Fluore sze nz in a poptotische n Ze lle n ge ze igt. Die dort ge hä uft vork om m e nde n k urze n DNA-Bruchstück e we rde n m it fluore sze nzm a rk ie rte n Nuk le otide n m itte ls Te lom e ra se re a k tion ve rlä nge rt. © Ma x -P la nck -Institut für Ex pe rim e nte lle Me dizin/Ta ra byk in Die W nt-Signale können über einen kanonischen und einen nicht-kanonischen Weg w eitergeleitet w erden. Im ersten Fall ist das am besten beschriebene zytoplasmatische Zielprotein der Aktivierung des W nt-Rezeptors da s β-catenin. In einer nicht aktivierten Zelle w ird die Phosphorylierung von β-catenin nicht aufgehoben und das phosphorylierte Protein w ird abgebaut. In einer aktivierten Zelle ist diese Phosphorylierung durch Bindung des extrazellulären W nt-Signalproteins an seinen Rezeptor Frizzled gehemmt, dies führt zur Stabilisierung von β-catenin und zu seinem Transport in den Zellkern. Dort kann es als Co-Faktor von Transkriptionsfaktoren w irken und die Transkription von nachfolgenden Genen steuern (Abb. 4. Der W nt-Signalw eg kann durch extrazelluläre Inhibitoren w ie Sfrp-Proteine (secreted frizzled related proteins) unterdrückt w erden. Diese Proteine ähneln dem Rezeptorprotein Frizzled in ihrer Fähigkeit, W nt zu binden. Sie führen jedoch zu keiner Aktivierung, sondern zu einer Hemmung des Signalw egs, da die blockierten W ntMoleküle von der Bindung an ihre Rezeptormoleküle abgehalten w erden. © 2006 Max-Planck-Gesellschaft w w w .mpg.de 4/7 Jahrbuch 2005/2006 | Miquelajauregui, Amaya; Tarabykin, Victor | Der Transkriptionsfaktor SIP1: ein Schlüsselregulator in der Gehirnentw icklung der Maus Sche m a de s k a nonische n W nt-Signa lwe ge s. De r R e ze ptor Frizzle d binde t da s e x tra ze llulä re W nt und gibt durch He m m ung de r P hosphorylie rung von β-ca te nin e in Signa l a n de n Ze llk e rn we ite r. Dort binde t β-ca te nin a n Tra nsk riptionsfa k tore n (TF) und löst so die Abschrift von we ite re n Ge ne n a us. Anwe se nde Sfrp-Mole k üle fa nge n a ls Konk urre nte n de s R e ze ptors Frizzle d vie le W nt-Mole k üle we g. Da durch ge ht die P hosphorylie rung von β-ca te nin und se in Abba u we ite r, die Signa lk e tte wird nicht a usge löst. © Ma x -P la nck -Institut für Ex pe rim e nte lle Me dizin/Ta ra byk in Die hier untersuchte Ausschaltung des SIP1-Proteins, das ein bekannter Repressor der Transkription ist, führte zu starken morphologischen und Zellw achstums-Defekten, die vergleichbar sind mit denen, die durch Ausschalten der W nt-Signalkaskaden-Komponenten verursacht w erden. Daher liegt die Schlussfolgerung nahe, dass SIP1 – entw eder direkt oder indirekt – eine negative Steuerung auf bestimmte Inhibitoren des W nt-Signalw eges ausüben kann. Um dieser Frage nachzugehen, untersuchten die W issenschaftler die Aktivität von Sfrp-Genen, die im Großhirn exprimiert w erden. Davon ist Sfrp1 nur in der Großhirnrinde und nicht im Hippocampus exprimiert. In den homozygoten Mausmutanten w ar dieses Genprodukt jedoch im Hippocampus in hoher Konzentration zu finden (Abb. 5). Es w urde nun ein Versuch unternommen, den Verlust der Hippocampusformation in den SIP1-Mausmutanten mit einem genetischen Ansatz zu reparieren. Dazu verw endeten die Forscher Mäuse, bei denen eine stabile Form von β-catenin in den gleichen Zellen aktiviert w erden konnte, in denen das Sip1-Gen ausgelöscht w orden w ar. In diesen Zellen w ar die Stabilisierung von β-catenin nicht mehr von der Interaktion zw ischen W nt und dem Rezeptorprotein Frizzled abhängig. Die Ergebnisse zeigten, dass die Zahl der zur Hippocampusformation gehörenden Zellen deutlich erhöht w erden konnte. So w urde zw ar nicht der ganze Hippocampus, aber der w ährend der Entw icklung zuletzt gebildete Teil des Hippocampus (Gyrus dentata) erhalten. © 2006 Max-Planck-Gesellschaft w w w .mpg.de 5/7 Jahrbuch 2005/2006 | Miquelajauregui, Amaya; Tarabykin, Victor | Der Transkriptionsfaktor SIP1: ein Schlüsselregulator in der Gehirnentw icklung der Maus Autora diogra phie n von e m bryona le n Hirnschnitte n (Ta g 14), die m it e ine r ra dioa k tive n P robe ge ge n Sfrp1-R NA m a rk ie rt wurde n. Die P fe ile ze ige n de n Unte rschie d in de r Ex pre ssion von Sfrp1-R NA in de r Hippoca m pusre gion zwische n Kontrollm ä use n und Muta nte n. Die ge striche lte Linie m a rk ie rt de n Übe rga ng zwische n Ne ocorte x und Hippoca m pus. © Ma x -P la nck -Institut für Ex pe rim e nte lle Me dizin/Ta ra byk in Die Daten w eisen auf eine modellartige Beteiligung von SIP1 an der Bildung der Hippocampusformation hin. Normalerw eise w ird SIP1 im Hippocampus exprimiert und hemmt dort die Expression von Sfrp1. In den SIP1Mausmutanten dagegen w ird, durch das Fehlen von SIP1, die Expression von Sfrp1 nicht unterdrückt, aber als Folge der W nt-Signalw eg gehemmt. Dies führt dann durch verminderte Zellteilung und vermehrten Zelltod zum Verlust des gesamten Hippocampus. Die hier vorgestellten Ergebnisse deuten darauf hin, dass die Hochregulation von SIP1 eine Hauptursache der Degeneration des Hippocampus bei Mow at-W ilson-Patienten ist. Zurzeit w erden Experimente mit den homozygoten SIP1-Mäusen durchgeführt, die die komplette W iederherstellung des Hippocampus durch die Inaktivierung von Sfrp1 zum Ziel haben. Falls es mit diesen Experimenten gelingen sollte, die Degeneration der Hippocampusformation zu verhindern, w äre ein neues Ziel bei der Suche nach Medikamenten für Patienten mit Mow at-W ilson-Syndrom gefunden. Originalveröffentlichungen Nach Erw eiterungen suchenBilderw eiterungChanneltickerDateilisteHTML- Erw eiterungJobtickerKalendererw eiterungLinkerw eiterungMPG.PuRe-ReferenzMitarbeiter (Employee Editor)Personenerw eiterungPublikationserw eiterungTeaser mit BildTextblockerw eiterungVeranstaltungstickererw eiterungVideoerw eiterungVideolistenerw eiterungYouTubeErw eiterung [1] K. Verschueren, J. E. Remacle, C. Collart, H. Kraft, B. S. Baker, P. Tylzanowski, L. Nelles, G. Wuytens, M. T. Su, R. Bodmer et al.: SIP1, a novel zinc finger/homeodomain repressor, interacts with Smad proteins and binds to 5'-CACCT sequences in candidate target genes. Journal of Biological Chemistry 274, 20489-98 (1999). [2] N. Wakamatsu, Y . Y amada, K. Y amada, T. Ono, N. Nomura, H. Taniguchi, H. Kitoh, N. Mutoh, T. Y amanaka, K. Mushiake et al.: Mutations in SIP1, encoding Smad interacting protein-1, cause a form of Hirschsprung disease. Nature Genetics 27, 369-70 (2001). © 2006 Max-Planck-Gesellschaft w w w .mpg.de 6/7 Jahrbuch 2005/2006 | Miquelajauregui, Amaya; Tarabykin, Victor | Der Transkriptionsfaktor SIP1: ein Schlüsselregulator in der Gehirnentw icklung der Maus [3] T. van de Putte, M. Maruhashi, A. Francis, L. Nelles, H. Kondoh, D. Huylebroeck and Y . Higashi: Mice lacking ZFHX1B, the gene that codes for Smad-interacting protein-1, reveal a role for multiple neural crest cell defects in the etiology of Hirschsprung disease-mental retardation syndrome. American Journal of Human Genetics 72, 465-70 (2003). © 2006 Max-Planck-Gesellschaft w w w .mpg.de 7/7