Chemie Semster 3
Werbung

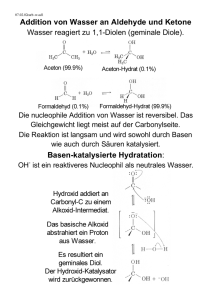
Abiturwiederholung Chemie Thematischer Schwerpunkt 3: Halogenierte Kohlenwasserstoffe als Zwischen- und Endprodukte der chemischen Industrie Stoffklassen (Halogene, Halogenwasserstoffe, homologe Reihen der Alkane, Alkene und Alkanole) sowie halogenierte Kohlenwasserstoffe Chemische und physikalische Eigenschaften (Struktur-Eigenschafts-Beziehungen) Reaktionstypen (Substitution, Addition, Polymerisation und Eliminierung) Reaktionsmechanismen (Radikalische und nucleophile Substitution) Anwendungsbeispiele (Lösemittel, Kühlmittel sowie die Kunststoffe Polyvinylchlorid und Polytetrafluorethen) Auswirkungen auf Umwelt und Gesundheit Chemische und physikalische Eigenschaften a. Bei chemischen und physikalischen Eigenschaften von Halogenierten Kohlenwasserstoffen, muss man die nachfolgenden Effekte beachten. Diese entscheiden darüber, wie und ob ein Stoff löslich ist, wie die Siede-Temperatur ist, wie stark oder schwach eine Säure ist etc. b. Wasserstoff Brückenbindungen Dipol Kräfte ergeben sich aus der Differenz der Elektronegativität, 0,5 ≤ ΔEN ≤ 1,4, gibt den Bereich an, in welchem eine Bindung als polar gilt. Wasserstoff und Sauerstoff haben beispielsweise einen Δen Wert von 1,3, was die starke Polarität von Wasser erklärt. Polare Verbindungen mit Wasserstoff sind immer sehr stark, da Wasserstoff nur 1 Außenelektron besitzt, was bedeutet, wenn dieses in eine Richtung gezogen wird, nur der positiv geladenen Kern zurück bleibt. Besonders stark sind die H-Brücken bei N,O,F und Cl. c. Van der Waals Kräfte Diese Kräfte sind sehr schwach und entstehen quasi durch spontane Dipole. Da diese aber nur spontan sind, sind polare Bindungen wesentlich stärker. (Bedenke bei zunehmender Kettenlänge, steigen aber die zwischenmolekularen Kräfte) d. Induktiver Effekt Durch die Elektronegativität bestimmter Stoffe, werden die Ladungen in einer Bindung beeinflusst, genau wie bei der Induktion in Physik. Es gibt den +I Effekt (Elektronen schiebend) und den –I Effekt (Elektronen ziehend). +I Effekt Die negative Ladung wird quasi in das System geschoben, durch Substituenten mit geringem En Wert. Bsp.: Alkylgruppe, wenn man Brom und 2,3-Dimethylbut-2-en bei einer elektrophilen Addition reagieren lässt, dann ist die Reaktion schneller, als wenn man Brom und Propen reagieren lässt. Dies kann man mit dem +I Effekt begründen, da die Elektronen durch den Alkylteil zur Doppelbindung gedrückt werden, weshalb die Reaktivität zu nimmt. -I Effekt Die negative Ladung wird quasi aus dem System gezogen, dies geschieht durch Substituenten mit hoher Elektronegativität. Besonders dominant sind hierbei: z.B. -NO2, -NH2, -OH -F, -Cl, -Br, -I. e. Substituentenstellung Bei Doppel und Ringbindungen, kann man den Induktiven Effekt besonders gut sehen, das Problem bei Doppelbindungen ist allerdings, dass man die verschiedenen Anordnungen betrachten muss, da man nicht einfach eine Drehung um die „Doppelbindungs-Achse“ machen kann. Sind sich die Substituenten gegenüber von einander, dann heben sich die Effekte zum Teil auf, so heben sich die Dipolmomente von E-Dichlorethen auf, wobei sie sich bei Z-Dichlorethen verdoppeln. E (oder trans) steht dabei für entgegen, Z (oder cis) steht dabei für zusammen. Mark Kremer -1- Abiturwiederholung f. Chemie Allgemeine Struktur Die Allgemeine Struktur ist ebenfalls sehr wichtig, z.B. beim Teflon, welches nur in der Pfanne, hält aufgrund seines gewinkelten Aufbaus. Wichtig ist auch, ob z.B. eine Doppelbindung vorliegt und wie lang das Molekül ist. Reaktionstypen a. Addition Bei der Addition, reagiert oft ein Alkan, Alken, Alkin, Aldehyd oder Keton ohne Abspaltung von irgendwas zu einem neuen Stoff. Es wird nichts ersetzt oder abgespalten, sondern nur etwas angehängt. Da meist C-C Doppelbindungen angegriffen werden, handelt es sich meist um elektrophile Additionen. Es laufen bei einer Addition an eine C-C Doppelbindung folgende Schritte ab: Elektrophile Addition Elektrophiler Angriff und Bildung eines π-Komplexes Hierbei wird beispielsweise ein Brom-Molekül polarisiert, die positive Teilladung nährt sich einem negativem Ladungszentrum an, was man dann als π-Komplex bezeichnet. Es folgt die Ausbildung einer Bindung zwischen dem Molekül mit der Doppelbindung und dem Brommolekül. Dadurch wird das Brommolekül heterolytisch gespalten. Es bildet sich ein Bromoniumion und ein Bromid-Ion. Das Bromid Ion greift nun rückseitig an und die kovalente Bindung wird ausgebildet. Markownikow-Regel Wenn man z.B. die Addition von Propen und HCl betrachtet, dann entsteht bevorzugt, 2-Chlorpropan, und nicht 1-Chlorpropan, dies liegt an den Zwischenprodukten, denn nachdem sich der π-Komplex gebildet hat, lagert sich das H-Atom an, je nachdem wo es sich anlagert, wirken verschieden viele +I Effekte. Wenn es sich „außen“ anlagert, dann liegt die positive Teilladung des Carbenium-Ions in der Mitte des Moleküls und es wirken zwei +I Effekte, die das Carbenium-Ion stabilisieren, wenn sich das Wasserstoff Atom aber „mittig“ anlagern würde, dann liegt die positive Teilladung außen und es wirkt nur ein +I Effekt. Folglich ist die erste Variante stabiler. Daraus lässt sich die Regel ableiten, dass sich bei Halogen-Wasserstoffen, das Halogen, am ehesten dort anlagert, wo die wenigsten H-Atome gebunden sind. (Also meist mehr Alkylreste) Anwendung: Man kann Doppelbindungen durch die Addition nachweisen, indem man den zu überprüfenden Stoff in Bromwasser leitet, wenn es sich entfärbt, passiert die oben geschilderte Reaktion, wenn nicht, dann liegt keine Doppelbindung vor. Nucleophile Addition Wenn man eine Doppelbindung zwischen beispielsweise einem C und einem O Atom betrachtet, dann wird das C-Atom stark polarisiert, somit kann ein nucleophiles Teilchen Angreifen. Bsp.: Carbonyl-Gruppe und Wasser. Bei dieser Reaktion lagert sich zunächst das Wasser an die polarisierte Doppelbindung an, danach geschieht eine intra-molekulare Protolyse, wobei Methanalhydrat entsteht. von http://www.chempage.de/theorie/nucladd.htm Mark Kremer -2- Abiturwiederholung Chemie b. Eliminierung Die Eliminierung ist die Umkehrung der Addition und wird durch Zufuhr von thermischer Energie begünstigt und durch Zugabe eines elektrophilen Teilchens erreicht. Es gibt drei verschiedene Reaktionsmechanismen (E1, E1cb und E2) jedoch laufen die meisten nach dem gleichen Schema ab. Beim E1 Mechanismus zuerst durch eine heterolytische Spaltung die Funktionelle Gruppe abgespalten, es bildet sich meist ein Carbokation, (Carbenium-Ion). Danach wird ein weiteres Atom vom angreifenden nucleophilen Teilchen abstrahiert, dieses ist diesmal jedoch positiv geladen (meist H+). Wenn man diese Reaktion für Alkohol betrachtet, dann spaltet sich zunächst ein OH- Ion ab, danach ein H+, es entsteht also Wasser, deshalb nennt man diesen besonderen Vorgang auf Dehydratisierung. Beim E1cb wird zuerst das später positiv geladene Atom abgespalten, also andersherum, beim E2 Mechanismus bildet das angreifende nucleophile Teilchen eine Verbindung mit einem Proton. Beide Gruppen werden dann abgespalten und die Doppelbindung entsteht. c. Polymerisation Die Polymerisation beschriebt die die Verknüpfung von Molekülen mir Doppelbindung, zu Polymeren. Es gibt im wesentlichen 2 verschiedene Arte. Zum einen die radikalische Polymerisation, zum anderen die ionische Polymerisation, welche sich allerdings in kationische und anionische Polymerisation gliedern lässt. Mark Kremer -3-