Übersicht über die proteinogenen Aminosäuren
Werbung

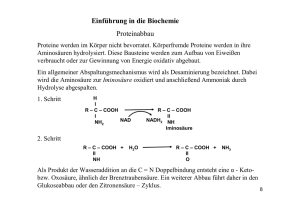
Übersicht über die proteinogenen Aminosäuren 1. Neutrale Aminosäuren (Abkürzungen in Klammern) H2N COOH H2N Glycin (Gly, G) COOH H2N COOH H2N Valin * (Val, V) Alanin (Ala, A) COOH H2N Leucin * (Leu, L) COOH Isoleucin * (Ile, I) CONH2 SH H2N OH H2N COOH Cystein (Cys, C) COOH OH H2N COOH Threonin * (Thr, T) Serin (Ser, S) COOH H2N Phenylalanin * (Phe, F) COOH H2N H2N H2N Asparagin (Asn, N) COOH Glutamin (Gln, Q) H2N N H COOH Methionin * (Met, M) Prolin (Pro, P) 2. Basische Aminosäuren H N NH2 H N NH2 NH H2N COOH Lysin * (Lys, K) H2N COOH N H2N Arginin (Arg, R) COOH COOH COOH Asparaginsäure (Asp, D) COOH Histidin (His, H) 3. Saure Aminosäuren H2N COOH SCH3 Tryptophan * (Trp, W) Thyrosin (Tyr, Y) COOH H N OH H2N CONH2 H2N COOH Glutaminsäure (Glu, E) COOH Peptid-Synthesen 1 R R 1 SG HN 2 + H2N COOH 1 CO SG 2 R − H2O 2 1 SG HN R CO HN CO SG 1. Schutzgruppen für die Carboxylgruppe R H2N R R C OCH3 H2N C O O H2N O O Methylester O C CH3 CH3 CH3 tert.-Butylester Benzylester für die Aminofunktion O O C R N H COOH O CH3 H3C H3C O C R N H COOH tert.-Butyloxycarbonyl(Boc-)-Schutzgruppe Benzyloxycarbonyl(Z-)-Schutzgruppe 2. Peptidknüpfung R2 O 1 RO C N H N COOH + C 1 RO N R2 O 1 C N H C N H C O O C NH N R3 Dicyclohexylcarbodiimid (DCC) RO R2 O 4 H2N COOR R3 CO NH O 4 COOR + N H C N H Dicyclohexylharnstoff (DCH) 2 Struktur der Proteine Primärstruktur: Aminosäuresequenz der Peptidketten Sekundärstruktur: beruht auf den Bindungskräften zwischen den verschiedenen funktionellen Gruppen der Peptide. → α-Helix- und Faltblatt-Struktur. Peptidkette 1 N H O S S + − NH3 OOC Peptidkette 2 H-Brückenbindungen kovalente Disulfidbrücken Ionische Wechselwirkungen hydrophobe Wechselwirkungen Faltblatt-Struktur: intermolekulare H-Brückenbindungen Bsp.: ß-Keratin α-Helix: intramolekulare H-Brückenbindungen und zwar zwischen den N–H-Protonen einer Peptid-Bindung und dem Carbonyl-Sauerstoff der dritten Aminosäure oberhalb dieser Bindung. Alle bisher untersuchten nativen Proteine sind rechtsgängig. Kollagen (Bindegewebe) und α-Keratin der Haare: Drei lange Polypeptid-Ketten aus linksgängigen Helices bilden eine dreifache, rechtsgängige Superhelix. Lingsgängige- rechtsgängige Kollagen-Tripelhelix Helix Tertiärstruktur: räumliche Orientierung des Moleküls. Quartärstruktur: Verschiedene Proteine können sich auch zu einer größeren Einheit zusammenlagern, deren Anordnung genannt wird. Bekanntes Beispiel: Hämoglobin