Chemie 04.10.00 Aminosäuren – Bausteine der Proteine
Werbung

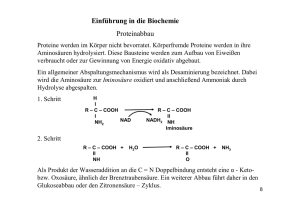
Chemie 04.10.00 Aminosäuren – Bausteine der Proteine Vorkommen: Enzyme, Hormone, Antikörper, Gerüstsubstanzen, Reservestoffe Name „Protein“ stammt aus dem griechischem „proteuo“ = ich nehme den 1. Platz ein. Entdeckt von Berzelius Gewinnung der AS durch Hydrolyse von Proteinen. Protein + HCl ! max. 20 vers. AS Amino = NH2 – Gruppe α - AS, da die NH2 – Gruppe immer am benachbarten (α) C – Atom Säure = COOH – Gruppe einfachste AS: Glycin (α - Amino Essigsäure) H2N – CH2 - COOH Nächst höhere AS: Alanin H3C – CH – COOH NH2 Chirales C – Atom, d.h. es besitzt 4 versch. Substituenten. Die Verbindung ist deshalb optisch aktiv Steht die Aminogruppe in der Fischer – Projektion links, liegt die „L – Form“ vor, steht sie rechts liegt die „D – Form“ z.B.: COOH H2N H „L“ CH3 [α]D20(H2O) [°cm3/ dm • g] D Glucose D Fructose +52,7 – 92,4 Sacharose +66,5 D = D- Linie des Na – Spektrums 20 = Temperatur 20°C H2O = Lösungsmittel Die natürlichen AS kommen nur als L – Form vor. Einteilung der AS unpolar: Protolyseverhalten in H2O neutral, da 1 NH2 und 1 COOH polar: saure: , da 1 NH2 und 2 COOH basische: , da 2 NH2 und 1 COOH AS sind Zwitterione, d.h. sie tragen gleichzeitig entgegengesetzte Ladungen. Das ist auch die Ursache für die hohe Schmelztemperatur der Aminosäuren, denn sie bilden im Festzustand ein Ionengitter, z.B. Glycin 292°C. AS sind Ampholyte, d.h. sie können sowohl als Säure als auch als Base reagieren. Sie haben also Puffereigenschaften: Je nach pH – Wert liegen bestimmte Protolyse GGW vor. z.B.: Gly pH < 2,3 pH > 9,7 Kationen – Form Anionen – Form Der Isoelektrische - Punkt [pH (I)] ist derjenige pH – Wert, bei dem ein Ladungsausgleich vorliegt. Am pH(I) ist die Löslichkeit von AS imWasser am geringsten.