Folgende Inhaltsfelder sind in der Jahrgangsstufe 8 zu thematisieren
Werbung

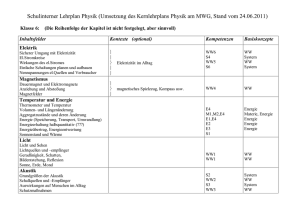
Folgende Inhaltsfelder sind in der Jahrgangsstufe 8 zu thematisieren: 8.1 Elementfamilie, Atombau und Periodensystem 8.2 Ionenbindung und Ionenkristalle 8.3 Freiwillige und erzwungenen Elektronenübertragungen 8.4 Unpolare und polare Elektronenpaarbindungen Kernlehrplan Chemie NRW Inhaltsfeld Fachliche Kontexte Konzeptbezogene Kompetenzen und Hinweise zur Umsetzung des Kernlehrplans Richtlinien zur Sicherheit im Unterricht an allgemeinbildenden Schulen in Nordrhein-Westfalen (RISU-NRW) • • • Grundregeln für das sachgerechte Verhalten und Experimentieren im Chemieunterricht Kennzeichnung von Gefahrstoffen Regeln für das Sachgerechte Experimentieren Die Schülerinnen und Schüler haben das Konzept der chemischen Reaktion/ zur Struktur der Materie/ der Energie so weit entwickelt, dass sie... Prozessbezogene Kompetenzen (K) Kommunikation (E) Erkenntnisgewinnung (B) Bewertung Schülerinnen und Schüler … (K5) (B3) 8.1 Inhaltsfeld: Elementfamilie, Atombau und Periodensystem Fachliche Kontexte: Böden und Gestein – Vielfalt und Ordnung Fachlicher Kontext Gesetz von Aus tiefen Quellen oder natürlichen Baustoffen konstanten Basisinhalte Massenverhältni • Aufgreifen und Vertiefung des Atommodells nach ssen Dalton Chemische • Atome und ihre Massen Formelschreibw • Vom Massenverhältnis zur Verhältnisformel eise und • Reaktionsschemata und –gleichung Reaktionsgleich • Reaktionsgleichungen unter Einbeziehung von ungen Atomen, Molekülen und Elementargruppen Beispiel: • Zersetzung von Wasser zur Bestimmung einer Verhältnisformel (Integrierte Wiederholung der Knallgas- und Glimmspanprobe) • Massenverhältnisse am Bsp. der Umsetzung von Kupfer mit Schwefel Alkali- und Erdalkalimetalle (E) (B) (K) Hinweise zur Umsetzung des Kernlehrplans stöchiometrisc he Berechnungen Konzeptbezogene Kompetenzen Basiskonzepte/Fachwissen • Chemische Reaktionen durch Reaktionsschemata in Worte- und in Symbolen formulieren unter Angabe des Atommassenverhältnisses beschreiben und die Gesetzmäßigkeit der konstanten Atomanzahlverhältnisse erläutern (chR 1.8) • Kenntnisse über Reaktionsabläufe nutzen, um die Gewinnung von Stoffen zu erklären (chR 1.15) • Einfache Atommodelle zur Beschreibung chemischer Reaktionen nutzen (Materie) M1.10 • Den Erhalt der Masse bei chemischen Reaktionen durch Reaktionsschemata in Wortund evt. in Symbolformulierungen unter Angabe des Atomanzahlverhältnisses beschreiben und die Gesetzmäßigkeit der konstanten Atomzahlenverhältnisse erläutern. (chR 1.6) Basisinhalte • Masse, Teilchenzahl und Stoffmenge • Stoffmengenkonzentration Beispiele • Quantitative Neutralisation Fachlicher Kontext Aus tiefen Quellen oder natürlichen Baustoffen Basisinhalte • Alkalimetalle – eine Elementengruppe • Bildung von alkalischen Lösungen (Laugen) • Natronlauge • Ausblick auf Erdalkalimetalle • Verwendung von Calcium und Magnesium als Leichtmetalle Beispiel: • Gruppenpuzzel zum Atombau, Aufbau des PSE (K7) (B5) (E4) (K6) (E7) (K6) • • • saure und alkalische Lösungen mit Hilfe von Indikatoren nachweisen (chR 1.13) Ordnungsprinzipien für Stoffe aufgrund ihrer Eigenschaften und Zusammensetzung nenne, beschreiben und begründen: Elemente. (Materie) M 1.2 Einen Stoffkreislauf als eine Abfolge verschiedener Reaktionen deuten. (chR 2.9) (K8) (E7) (K3) • • • Kern-HülleModell Elementarteilche n Atomsymbole Halogene Nachweisreaktio nen Schalenmodell und Besetzungssche ma PSE Atomare Masse, Isotope Ionenverbindung Nachweis von Alkalimetallen und Erdalkalimetallen in Salzen Wirkung eines Rohrreinigers Basisinhalte Vom Massenmodell zum Kern-Hülle-Modell • Das Dalton´schen Atomvorstellung und der Atomzeichen und Einführung der atomaren Masseneinheit • Einführung des Elektrons, Protons und des Neutrons • Rutherford´scher Streuversuch • Atome mithilfe eines einfachen Kern-HülleModells darstellen und Protonen, Neutronen als Kernbausteine benennen sowie die Unterschiede zwischen Isotopen erklären. (Materie) M1.12 (K4) (B7) Fachlicher Kontext Streusalz und Dünger – Wie viel verträgt der Boden? Basisinhalte • Weitere Elementegruppen • Eigenschaften der Halogene • Halogene als Salzbildner • Alkali- und Erdalkalihalogenide • Nachweis der Halogenide • Einführung der Salzsäure Beispiel • Einfluss von Kochsalz- und Düngesalzlösungen auf das Wachstum von Pflanzen (Kresse) • Ordnungsprinzipien für Stoffe aufgrund ihrer Eigenschaften und Zusammensetzung nenne, beschreiben und begründen (Elemente). (Materien) M1.2 (K10) • Energiestufen- und Schalenmodell der Atomhülle • Mitteilung des Besetzungsschemas • Beleg der Elektronendifferenzierung durch die Ionisierungsenergie • Aufbauprinzipien des PSE, Beschränkung auf die Hauptgruppen • Edelgase Beispiel: • Altersbestimmung mit Hilfe von Isotopen • Einsatz von Isotopen in der Medizin, Radioaktivität • Wann lebte Ötzi Basisinhalte • Einführung der Isotope • Aufbauprinzipien des PSE der Elemente beschreiben und als Ordnungs- und Klassifikationsschema nutzen, Haupt- und Nebengruppen unterscheiden. (Materie) M2.1 erläutern, dass Veränderungen von Elektronenzuständen mit Energieumsätzen verbunden sind. (Energie) E2.2 Atome mithilfe eines einfachen Kern-HülleModells darstellen und Protonen, Neutronen als Kernbausteine benennen sowie die Unterschiede zwischen Isotopen erklären (Materie) M1.12 (K4) (K6) (B7) • • (K10) (B2) 8.2 Inhaltsfeld: Ionenbindung und Ionenkristalle Fachliche Kontexte: Die Welt der Minerale Konzeptbezogene Kompetenzen Basiskonzepte/Fachwissen (E) (B) (K) Hinweise zur Umsetzung des Kernlehrplans Salzkristalle Leitfähigkeit von Salzlösungen Salzkristalle Ionenbildung u. –bindung Chemische Formelschreibw eise und Reaktionsgleich ungen Fachlicher Kontext Salzbergwerke Salze und Gesundheit Basishinhalte • Gewinnung von Salzen in Salzbergwerken (Verknüpfung Technik) • Natriumchloridversorgung für den Menschen • Kaliumjodid für die Schilddrüse • Eigenschaften von Kochsalz Basisinhalte • Salzlösungen leiten den elektrischen Strom • Elektrolyse einer Salzlösung (Zinkjodid/ Kupferbromid) • Salze bestehen aus Ionen (Kationen, Anionen) • Ionenbildung und –bindung am Bsp. Von Natriumchlorid • Edelgasregel • Ionenformel • Aufbau von Ionenkristallen • Deutung der Eigenschaften von Ionenverbindungen mit Hilfe ihres Aufbaus • Metallbindung (Elektronengasmodell; vgl. der Ionenbindung mit der Metallverbindung) Basisinhalte • Aufgreifen des Wissens zur Reaktionsgleichung und Anwendung auf die Salzbildung aus den Elementen und Erweiterung auf die Ionenbildung • Bildung von Natriumchlorid aus den elementaren Stoffen (differenzierte energetische Betrachtungen) • • • • • • • Stoffe aufgrund von Stoffeigenschaften (z.B. Löslichkeit, Dichte, Verhalten als Säure bzw. Lauge) bezüglich ihrer Verwendungsmöglichkeiten bewerten. (Materie) M1.6 Stoffeigenschaften zur Trennung von einfacher Stoffgemische nutzen. (Materie) M1.7 (K3) Stoffe aufgrund ihrer Zusammensetzung und Teilchenstruktur ordnen. (Materie) M1.4 Den Zusammenhang zwischen Stoffeigenschaften und Bindungsverhältnissen (Ionenbindung, Elektronenpaarbindung, Metallbindung) erklären. (Materie) M2.7 Chem. Bindungen (Ionenbindung, Elektronenpaarbindungen) mit Hilfe geeigneter Modelle erklären und Atome mit Hilfen eines differenzierteren Kern-HülleModells beschreiben. (Materie) M 2.8 Erläutern, dass Veränderungen von Elektronenzuständen mit Energieumsätzen verbunden sind. (Energie) E2.2 Stoff- u. Energieumwandlung als Veränderung in der Anordnung von Teilchen und als Umbau chemischer Bindungen erklären (chR 2.1) (K4) 8.3 Inhaltsfeld: Freiwillige und erzwungene Elektronenübertrag ungen Fachliche Kontexte: Metalle schützen und Veredeln Oxidation als Dem Rost auf der Spur Konzeptbezogene Kompetenzen Basiskonzepte/Fachwissen (E) (B) (K) Hinweise zur Umsetzung des Kernlehrplans Fachlicher Kontext • Möglichkeiten der Steuerung chemischer Rkt.en durch Variationen von Reaktionsbedingungen beschreiben (chR 2.3) (E3) Elektrochemische Reaktionen (Elektrolyse und elektrochemische Spannungsquellen) nach dem Donator-Aktzeptor-Prinzip als Aufnahme und Abgabe von Elektronen deuten, bei denen Energie umgesetzt wird. (chR2.5) Elektrochemische Reaktionen (Elektrolyse und elektrochemische Spannungsquellen) nach dem Donator-Aktzeptor-Prinzip als Aufnahme und Abgabe von Elektronen deuten, bei denen Energie umgesetzt wird. (chR2.5) (E8) Elektronenübertra gungsreaktionen Unedel – dennoch stabil Metallüberzüge: nicht nur Schutz vor Korrosion Basisinhalte • Systematisieren der Redoxreaktionen als Elektronenübertragungsreaktionen, Beschränkung auf die Oxidation von Metallen Beispiele • Welche Bedingungen fördern die Bildung von Rost? • Was ist Rost? • Schutz von Eisen und Stahl vor dem Verrosten • Aluminium – Passivierung • Chrom schützt und glänzt Reaktionen zwischen Metallatomen und Metallionen Basisinhalte • „Von der Redoxreihe zur Reihe der Elektronenübertragungsreaktionen“ am Bsp. Ausgewählter Metalle und ihrer Ionen • Bsp. einer einfachen Elektrolyse Basisinhalte Aufgreifen einer bereits durchgeführten Elektrolyse, Betonung der Elektronenabgabe und –aufnahme, Galvanisieren als Anwendungsbeispiel (Verkupfern, Vergolden) Beispiel • vom Malachit zur Münze/ zum Euro, Betonung auf der Gewinnung von Reinstkupfer • (K4) 8.4 Inhaltsfeld: Unpolare und polare Elektronenpaarbin dung Die Atombindung / unpolare Elektronenpaarb indung Wasser-, Ammoniak- und Chlorwasserstoff moleküle als Dipole Wasserstoffbrüc kenbindung Hydratisierung Fachliche Kontexte: Wasser – mehr als ein einfaches Lösungsmittel Konzeptbezogene Kompetenzen Basiskonzepte/Fachwissen (E) (B) (K) Hinweise zur Umsetzung des Kernlehrplans Fachlicher Kontext Wasser und seine besonderen Eigenschaften und Verwendbarkeit Basisinhalte • Einführung der Elektronenpaarbindung • Bindungsenergie • Elektronenstrichschreibweise • Bindende und nichtbindende Elektronenpaare • Mehrfach (Doppel- und Dreifachbindung) • Anwendung der Edelgasregel • Der räumliche Aufbau von Molekülen (Elektronenpaarabstoßungsmodell) Basisinhalte • Polare Atombindung • Elektronegativität • Dipole • Wasserstoffbrückenbindung • Molekülgitter von Eis Beispiele • Ammoniakspringbrunnen Fachlicher Kontext Wasser als Reaktionspartner Basisinhalte • Wasser als Lösungsmittel für polare Stoffe • Wasser als Lösungsmittel für Salze Beispiele • Herstellung eines Wärmebeutels • Herstellung einer Kältemischung • • • • Chem. Bindungen (Ionenbindung, Elektronenpaarbindungen) mit Hilfe geeigneter Modelle erklären und Atome mit Hilfen eines differenzierteren Kern-HülleModells beschreiben. (Materie) M 2.8 Mithilfe eines angemessenen Atommodells und Kenntnissen des Periodensystems erklären, welche Bindungen bei chemischen Reaktionen gelöst werden und welche entstehen. (chR 2.2) Mithilfe eines Elektronenpaarabstoßungsmodells die räumliche Struktur von Molekülen erklären (Materie) M 2.9 Mithilfe eines angemessenen Atommodells und Kenntnissen des Periodensystems erklären, welche Bindungen bei chemischen Reaktionen gelöst werden und welche entstehen. (chR 2.2) (K4) (B8) (K4)