Ferienkurs (5 Tage) mit dem Thema Virologie/Serologie
Werbung

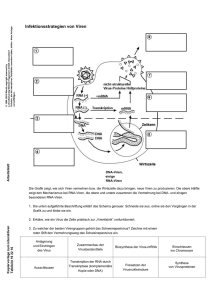
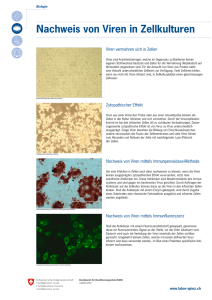
Leitfaden für einen fünftägigen Ferienkurs Thema: Virologie/Serologie INHALT 1 2 Theoretische Grundlagen__________________________________________________ 5 1.1 Viren _______________________________________________________________ 5 1.2 Virusanzucht_________________________________________________________ 8 1.3 Virusnachweis _______________________________________________________ 9 1.4 Antikörper-Antigene-Immunantwort______________________________________ 13 1.5 Bestandteile und Aufgaben des Blutes ___________________________________ 16 1.6 Antikörpertests ______________________________________________________ 18 Protokoll ______________________________________________________________ 21 2.1 Virusanzucht________________________________________________________ 21 2.2 PCR ______________________________________________________________ 22 2.3 ELISA Test _________________________________________________________ 25 2.4 Western Blot________________________________________________________ 28 2.5 Reinigung und Färbung von Blutzellen ___________________________________ 29 3 Glossar _______________________________________________________________ 31 4 Anhang _______________________________________________________________ 33 4.1 Sicherheitslabor Klasse L4 ____________________________________________ 33 4.2 Sicherheitsstufen ____________________________________________________ 34 Überblick über den Kursinhalt (Ferienkurs) Tag 1 Virologie: Zellkulturen und Virusnachweis 9.00 Begrüßung Einführung: Laborregeln (Beauftragter für Arbeitsschutz) Methoden der Virusanzucht Einführung: Virologie & Zellkultur Ansetzen von Medien für die Zellkultur Pipettierübungen Zellen umsetzen Mittagspause 13.00 Zellkulturen mikroskopieren Molekulare Diagnostik: Nachweis des Cytomegalievirus mit Hilfe der Polymerasekettenreaktion (PCR) Einführung Ansetzen der PCR-Reaktion Institutsführung 16.00 Schluss Tag 2 Serologie: Antikörpernachweis 9.00 Auswertung der PCR-Reaktion: Elektrophoreselauf, färben Serologie: Nachweis der Cytomegalievirus-Infektion mit Hilfe eines Antikörpertests (ELISA) Einführung: Antikörper und serologische Testverfahren Blutentnahme für Antikörpertest Mittagspause 13.00 Serumherstellung Durchführung Enzyme-linked immunosorbent assay (ELISA) Vortrag aus der Praxis: z.B. HIV-Forschung Auswertung ELISA 15.00 Schluss Tag 3 Molekularbiologie: Proteinnachweis 9.00 Proteine von Krankheitserregern nachweisen: Western Blot Einführung Elektrophoreselauf Proteintransfer Antikörperreaktion Mittagspause 13.00 Auswertung des Western Blots ZwischenProgramm 15.00 Berufserkundung: Dokoranden und Technische Assistenten stellen sich und ihren Arbeitsplatz vor Schluss Tag 4 Immunologie 9.00 Mittagspause 13.00 ZwischenProgramm 15.00 Abwehrzellen im menschlichen Blut Einführung Reinigen von Lymphozyten aus menschlichem Blut Färbung verschiedener Zelltypen Untersuchung mit Hilfe des Fluoreszenzmikroskops Berufserkundung: Besichtigung der Klinik, Gespräch mit Arzt/Ärztin Schluss Tag 5 Tropische Viren 9.00 Vortrag aus der Praxis: z.B. Lassaviren Besichtigung: Hochsicherheitslabor Führung: Die Technik hinter der Forschung Mittagspause 13.00 Abschlussbesprechung und Picknick 15.00 ENDE Leitfaden für den Ferienkurs – 1 Theoretische Grundlagen Seite 5 1 Theoretische Grundlagen 1.1 Viren Was ist ein Virus? Viren sind die Ursache von ca. 60% aller menschlichen Krankheiten. Sie gehören zu den einfachsten Lebensformen und bestehen entweder aus DNA (Desoxyribonucleinsäure) oder RNA (Ribonucleinsäure) als genetischem Informationsträger, der von einem Proteinmantel umhüllt ist. Sie haben keinen eigenen Stoffwechsel und können sich nicht vermehren, ohne ihr genetisches Material einem anderen Organismus einzuschleusen. Viren müssen sich mit einer Zelle des Wirtsorganismus verbinden und reproduzieren sich dann sehr schnell in dieser Zelle. Während dieser Zeit der sog. "Inkubation" sind sie noch vom Wirtsorganismus getrennt. Sie brechen erst dann in großer Anzahl aus den Wirtszellen aus, wenn sie zu zahlreich geworden sind, um im Inneren zu bleiben. Diese neuen Viren suchen sich dann neue Zellen, die sie wiederum infizieren. Viren haben unterschiedliche Strategien entwickelt, um den Wirtsstoffwechsel zu ihrer Vermehrung auszunutzen und wurden deshalb verschiedenen Gruppen zu geordnet: a) Lytische Viren b) Lysogene (temperente) Viren c) Retroviren a) Lytische Viren Alle Viren tragen auf ihrer Hülle Proteine, die mit Wirtszellrezeptoren in Wechselwirkung treten können. Diese Kontaktaufnahme findet nur mit Zellen statt, die den passenden Rezeptor tragen. Viren sind auf Grund dieser Tatsache sowohl wirts- als auch zellspezifisch. D.h. Viren sind an eine oder nur wenige Wirtsarten angepasst, andere Lebewesen können von diesen Viren nicht infiziert werden. Im Ein typischer lytischer Zyklus verläuft nach folgendem Muster: - - Phase 1: Das Virus wird an dem Rezeptor der Wirtszelle adsorbiert. Phase 2: Das genetische Material des Virus wird in die Wirtszelle injiziert. Phase 3: Die injizierte DNA wird in den Zellkern eingeschleust. Dies ist aus zwei Gründen not wendig: Zum einen wird genetisches Material im Cytoplasma rasch durch Enzyme (die Nucleasen) abgebaut, zum anderen wird aus der Virus-DNA zunächst die entsprechende RNA aufgebaut, um die Proteinbiosynthese zu starten. Phase 4: Die aus der Viren-DNA entstandene Viren-RNA nutzt die Wirtzellenribosomen zur Produktion von neuen Viruspartikeln Phase 5: Die neuen Viruspartikel setzen sich zu neuen Viren zusammen. Phase 6: Das ebenfalls gebaute Enzym Lysozym löst die Zellmembran der Wirtszelle auf und neue Viren werden frei und können anderen Zellen infizieren. Zu den lytischen Viren zählen Krankheitserreger wie Tollwut, Influenza, Kinderlähmung oder Tabakmosaikviren. b) Lysogene (temperente) Viren Die Infektion der Zelle durch das Virus gleicht dem Ablauf der Infektion mit lytischen Viren. Die VirenDNA wird jedoch bei den lysogenen Viren in die DNA der Wirtszelle eingebaut und liegt dann als sogenanntes Provirus vor. Das Provirusstadium kann über mehrere Zellteilungsschritte erhalten bleiben, wobei jede Zellteilung auch einer Virusvermehrung entspricht. Die als Provirus vorliegenden DNAAbschnitte werden dann durch äußere Einflüsse wie UV-Strahlung, chemische Stimulation oder Tem- Leitfaden für den Ferienkurs – 1 Theoretische Grundlagen Seite 6 peraturveränderung virulent und starten die Synthese von Viren-RNA. Es folgen dann - wie oben beschrieben - die Phasen 4 bis 6, was die Zerstörung der Wirtszelle zur Folge hat. Verbreitete Vertreter dieser Virengruppe sind Herpes, Gürtelrose oder Bakteriophagen. c) Retroviren (HIV) Diese Gruppe hat als spezifisches Kennzeichen das Enzym Reverse Transkriptase. Viren dieser Kategorie schleusen die genetische Information immer in Form von RNA in die Wirtszelle ein. Das Enzym Reverse Transkriptase schreibt die Viren-RNA in DNA um. Diese DNA-Kopie wird in das Wirtsgenom integriert und bei den Zellteilungen weitervererbt. Retroviren haben damit Ähnlichkeit mit den lysogenen Viren, die Entstehung der Virulenz folgt jedoch einem komplizierten System. Dieses System ist noch nicht komplett erforscht, es gibt jedoch schon einige bekannte Mechanismen. Das menschliche Immunschwäche-Virus (HIV) ist ein Retrovirus. Sie führen unter Umständen erst Jahre nach einer Infektion zur Krankheit. Retroviren unterscheiden sich von den meisten anderen Viren, Bakterien, tierischen und pflanzlichen Zellen dadurch, dass ihre genetische Information in Form von zwei einzelsträngigen RNA-Molekülen vorliegt. Grundsätzlich können HI-Viren Zellen des Immunsystems befallen. Die CD4-Zellen (die im Thymus reifen) und die Makrophagen (die sogenannten Fresszellen) spielen eine zentrale Rolle bei der Krankheitsabwehr. Während die Viren den Tod der von ihnen selbst infizierten CD4-Zellen und damit ihren eigenen Untergang bewirken, leben die befallenen Makrophagen unbeeinträchtigt weiter. Sie stellen somit ein gefährliches Virusreservoir dar, in dem sich HI-Viren ungehindert vermehren können. Durch den hohen Verlust an funktionstüchtigen Immunzellen verschlechtert sich nach und nach der Immunstatus der Patienten, so dass sich der Infizierte schließlich gegen normalerweise harmlose Infektionen nicht mehr wehren kann und daran stirbt. Die Vermehrung des Virus im menschlichen Körper kann in folgende Schritte unterteilt werden: - Phase 1: HI-Viren „docken“ an Wirtszellen an. Bei der Infektion einer Zelle heften sich HI-Viren an die Membran der Wirtszelle, indem sie an zwei Oberflächenrezeptoren bindet, den CD4-Rezeptor andocken. Normalerweise dienen diese Rezeptoren körpereigenen Molekülen, sie werden aber vom HIV-Erreger als Eintrittspforte in die Zelle missbraucht. - Phase 2: Das HI-Virus entleert sich in die Wirtszelle. Nachdem die Membran von Zelle und Virus miteinander verschmolzen sind, entleert sich das Virus in das Zellinnere. Die wichtigsten Bestandteile sind dabei die viruseigenen Enzyme Reverse Transkriptase und Integrase sowie die virale RNA. - Phase 3: Umschreiben der viralen RNA in einen viralen DNA-(Doppel-)strang Das Enzym Reverse Transkriptase schreibt die genetische Information des Virus (die HIV RNA) in DNA um. Dieser Schritt ist für die Vermehrung des HI-Virus essentiell, denn die Erbsubstanz des Virus kann nur in Form von DNA in das Genom der Wirtszelle eingebaut werden. - Phase 4: Einschleusen des viralen DNA-Stranges in neue Wirtszellen und anschließender Einbau in die Wirts-DNA Der Einbau der viralen DNA in das Wirtsgenom erfolgt durch das viruseigene Enzym Integrase. Bei jeder folgenden Teilung der Wirtszelle verdoppelt sich nun auch die integrierte DNA des dann als Provirus bezeichneten HIV. Werden die infizierten Wirtszellen in ihrer Funktion als Immunzellen durch ein Antigen aktiviert, beispielsweise durch eine andere Infektion, dann werden auch verstärkt HIV-RNA und -Proteine gebildet. Das HIV Enzym Protease schneidet die Virusproteine aus großen Vorläuferproteinen zurecht. Diese werden gemeinsam mit HIV RNA zu neuen Viruspartikeln verpackt, die sich aus der Zelle abschnüren und weitere Zellen befallen können. Damit sind neue Viruspartikel im Umlauf. Die Umsatzrate des HI-Virus ist beeindruckend: ca. 10 Milliarden Vi- Leitfaden für den Ferienkurs – 1 Theoretische Grundlagen Seite 7 ruspartikel werden täglich neu gebildet. Bei dieser Massenproduktion kommt es jedoch zu Fehlern bei der Abschrift der HIV RNA in die DNA-Form. Viele dieser Mutationen sind für das HI-Virus tödlich. Doch einige sind nicht nur ohne negative Folgen für das Virus, sondern von Vorteil, beispielsweise weil sie den Eintritt in die Wirtszelle erleichtern. So entstehen Unterarten des HIV (Quasispezies), die zum Teil vom Immunsystem nicht mehr erkannt werden oder therapieresistent sind. Diese als Variabilität bezeichnete Mutation des HIV ist die Ursache dafür, dass das HIV trotz intensiver Forschungsanstrengungen weltweit medikamentös zwar behandelbar ist, aber nicht komplett besiegt werden kann. Aus dem gleichen Grund gibt es bis heute auch noch keine gegen die verschiedenen HIV Subtypen wirksamen Impfstoff. Abbildung 1 Aufbau des HI-Virus Wie werden Virus-Infektionen übertragen? Grundsätzlich unterscheidet man folgende Übertragungswege: Direkter Kontakt über verunreinigte Nahrung Körperkontakt mit Infizierten (Händeschütteln, Sex) Berührung von kontaminierten Gegenständen - Übertragung durch die Luft (Tröpfcheninfektion) durch Husten oder Niesen Übertragung durch Blut oder Blutprodukte bei Verletzungen, Operationen oder über Mehrfachbenutzen von Spritzbestecken. Wie behandelt man Virusinfektionen? Da Viren keinen eigenen Stoffwechsel haben, sind sie nur schwer zu bekämpfen, ohne dabei die rpereigenen Zellen zu schädigen. Oft behandelt man deshalb nur die Beschwerden wie Fieber, Schmerzen, Schnupfen oder Durchfall und wartet, bis das Immunsystem die Erreger vernichtet hat. Damit das Immunsystems sich voll auf die Viren konzentrieren kann, sollte man sich schonen, viel trinken und eventuell immunstärkende Medikamente einsetzen. Inzwischen lernt die Wissenschaft immer mehr über Viren und entwickelt Virustatika, die gezielt gegen die Viren selbst vorgehen. Sie verhindern z.B. dass Viren in die Wirtszelle eindringen oder stoppen ihre Vermehrung in der Wirtszelle. Es gibt bereits Virustatika speziell gegen Influenza, Herpes und HIV. Das humanpathogene Cytomegalie-Virus (CMV) Die Methoden zum Virusnachweis (PCR) und zum Antikörpernachweis (ELISA) werden wir am Beispiel des Cytomegalie-Virus durchführen. Das CMV wird der Familie der Herpesviridae zugeordnet, welche sich durch ein doppelsträngiges DNA-Genom auszeichnen. Typisch für diese Viren ist, dass sie nach einer Primärinfektion latent im Leitfaden für den Ferienkurs – 1 Theoretische Grundlagen Seite 8 Organismus verbleiben. Das Cytomegalie-Virus kommt auf der ganzen Welt vor. In den Industrienationen sind ca. 50 bis 80 % der Erwachsenen mit dem Erreger infiziert. Die meisten Menschen wissen gar nicht, dass sie das Virus in sich tragen, denn die Erstinfektion verläuft meist ohne Symptome. Menschen mit einem gesunden Immunsystem haben allenfalls Beschwerden wie bei einem grippalen Infekt. Bei Patienten mit Störungen des Immunsystems verläuft die Erstinfektion wesentlich heftiger und dramatischer. Bei Menschen mit gesunden Abwehrkräften bleibt das Virus nach der Infektion im Verborgenen. Zwischen dem Immunsystem des Infizierten und dem Virus stellt sich ein Gleichgewicht ein. Das bedeutet, dass ein Mensch, der einmal infiziert ist, zwar lebenslang infiziert bleibt, die Infektion verursacht allerdings keine Symptome. Wird das Immunsystem durch Erkrankungen oder Medikamente geschwächt, kann es zu einer St rung des Gleichgewichts kommen. Die Viren vermehren sich dann schneller, als das Immunsystem sie vernichten kann, und richten Schaden an. Man spricht in dieser Situation von einer Reaktivierung oder Reinfektion. Bei Menschen mit Störungen des Immunsystems (z.B. Transplantationspatienten, HIVInfizierte, Tumorpatienten, Neugeborene) besteht außerdem die Gefahr, dass sie sich mit einer neuen Variante des Erregers infizieren. Diese erneute Infektion wird als Reinfektion oder Superinfektion bezeichnet. Das Cytomegalie-Virus kann sich in fast allen Köpergeweben vermehren. Entsprechend sind die Symptome, die durch eine Cytomegalie-Infektion entstehen, sehr variabel. Sie sind abhängig davon, ob es sich um eine Erstinfektion, eine Superinfektion oder eine Reaktivierung einer vorhandenen Infektion handelt. 1.2 Virusanzucht Grundsätzlich kann man Viren von zwei Seiten aus betrachten: ♦ Direkt: Isolierung und Darstellung des Virus per se ♦ Indirekt: Reaktion des Wirts auf einen Kontakt mit dem Erreger Viren sind normalerweise zu klein, um sie mit einer anderen Methode als dem Elektronenmikroskop (EM) darzustellen (Ausnahme Pockenviren). Aber selbst für EM Untersuchungen benötigt man größe11 re Mengen Virus (10 Partikel) wenn sie nicht morphologisch ganz spektakulär sind. Das Elektronenmikroskop und auch die Röntgen-Kristallographie haben viel zur Strukturanalyse der Viren beigetragen, sind aber äußerst aufwendige Techniken, die meist auch nur nach einer Multiplikation der Viren in Kultur zum Ziel führen. Daher braucht man Vermehrungsverfahren, die, anders als bei Bakterien, neben dem "Futter" auch noch "Arbeitskraft" zu Verfügung stellten - das Virus braucht eine Wirtszelle. Die Wahl des Kultursystems ist vom Versuchsansatz abhängig (wenn es überhaupt schon ein Kulturverfahren gibt). Viele Viren gelten heute noch als nichtkultivierbar. Molekulare Techniken haben hier eine wesentliche, alternative Rolle übernommen. Eines der ältesten Nachweisverfahren war die Applikation "infektiösen Materials" eines Erkrankten in einen empfänglichen Wirt und die Beobachtung der Entwicklung von Symptomen. Versuchstiersysteme werden auch heute noch in der Virologie eingesetzt um Virus zu vermehren, das auf keinem künstlichen Kultursystem angeht die Pathogenese eines bestimmten Virus klarzustellen Impfstoffe auf Ihre Sicherheit und Verträglichkeit zu testen. Probleme dabei sind der hohe Preis der Versuchstierhaltung komplexe Versuchstiersysteme machen die Forschung ebenfalls schwierig Variationen beim Wirt führen oft zu nichtvorhersehbaren Ergebnissen ethischen Grundsätze Überholtheit mancher Ansätze durch moderne Techniken Heute werden Versuchstiere oft von "in vitro" Zellkulturen abgelöst. Leitfaden für den Ferienkurs – 1 Theoretische Grundlagen Seite 9 Im Fall von Zellen bedeutet das, sie erfolgreich im Labor zu züchten. Dazu werden Zellen aus dem gewünschten Organ isoliert und anschließend in einem Nährmedium vermehrt. Zellkulturen können von Organen oder sonstigen Zellen (Fibroblasten, Lymphozythen) kultiviert werden. Sie sollten von einem empfänglichen Wirtstier stammen und dem Zelltyp entsprechen, der vom Erreger für die Replikation normalerweise benutzt wird. Es gibt aber auch Beispiele heterologer Kulturen, die leicht infizierbar sind (z.B. exembryonierte Hühnereier für Influenza). Häufig wächst ein Virus nur sehr langsam in seiner neuen Umgebung an, bis er sich durch Mutationen der Kultur angepasst hat, und "normal" weiterwächst. Eine solche Primärzellkultur birgt jedoch einige Probleme. Den größten Nachteil stellt die begrenzte Lebensdauer der Körperzellen von wenigen Wochen dar. Für die Mehrzahl der Versuche werden Zellen deshalb bei Zelllinien-Sammlungen eingekauft. Vom Menschen und von gut 150 Tierarten sind insgesamt über 4000 Zelllinien kommerziell erhältlich. Diese Zellen stammen meist von Tumoren ab oder wurden nachträglich so verändert, Monate hinweg ungehemmt wachsen. Im Labor müssen die Zellen einiges aushalten: Gelagert bei -196°C in flüssigem Stickstoff, werden sie ins Labor geliefert, vorsichtig aufgetaut und in speziellen Kulturgefäßen ausgesät. Jeden Tag werden sie unter dem Mikroskop auf ihr Befinden, Aussehen und Wachstum überprüft. Darüber hinaus werden sie alle zwei bis drei Tage geerntet, in neue Kulturgefäße aufgeteilt und gefüttert. zu dicht wachsen, kann das zur Folge haben, dass sie aufhören sich zu teilen. Die Vermehrung der Zellen erfolgt im Inkubator, einem Schrank, der die Bedingungen des Körpers nachahmt. Temperatur und pH-Wert müssen genau auf die jeweilige Zellart abgestimmt sein. Das gleiche gilt für das Zellfutter, Medium genannt: Es enthält als Grundlage unter anderem Zucker, Salze, Spurenelemente, Vitamine und ein Serum, das alle wichtigen Wachstumsfaktoren enthält. Vorbedingung ist, dass man eine Nährflüssigkeit (Medium) für die gewünschte Zellart besitzt, die ein Leben in Kultur ermöglicht und dass das Medium keimfrei aufbewahrt werden kann. Auch Antibiotika fehlen in keinem Zellkulturmedium. Diese sind allerdings nicht für die Zellen bestimmt, sondern gegen Bakterien und Pilze. Denn auch für die Mikroorganismen stellt das fhaltige Medium ein gefundenes Fressen dar. Gelangen nur einige wenige in ein Medium ohne Antibiotika, nehmen deren Nachkommen innerhalb weniger Stunden im Kulturgefäß überhand. Die Folge: die Zellen sterben ab und wichtige Versuche müssen abgebrochen werden. Zellkulturen werden daher unter einer Sterilbank gehandhabt. Hier sorgen Filter für einen schmutz– und keimfreien Luftstrom. Zusätzlich töten Desinfektionsmittel und UV-Licht Mikroben auf den Oberflächen der Sterilbank ab. Alles, was mit den Zellen in Berührung kommt, — Medium, Kulturgefäße, nde des Laboranten — muss keimfrei sein. 1.3 Virusnachweis Der Nachweis geringster Mengen Virusgenoms aus verschiedenstem Probenmaterial ist durch die Polymerase Kettenreaktion, kurz "PCR" (Polymerase Chain Reaction), möglich geworden. Was ist PCR? Die PCR ist eine Methode zur Vervielfältigung kurzer Stücke der Erbinformation (DNA) ohne lebende Organismen, wie z.B. E. coli oder Hefe, zu verwenden. So ist auch der Nachweis geringster Mengen Virusgenoms aus verschiedenstem Probenmaterial möglich geworden. Die PCR wurde Anfang der 1980iger Jahre von Kary Mullis erfunden, wofür er den Chemie-Nobelpreis erhielt. Anwendung findet die PCR fast in jedem Gebiet der Life Sciences. Sie wird gewöhnlich in medizinischen und biologischen Forschungslaboren für eine Vielzahl von Aufgaben eingesetzt, unter anderem zur Erkennung von Erbkrankheiten, zur Identifikation genetischer Fingerabdrücke, zur Erzeugung von genetischen Stammbäumen, zur Klonierung von Genen und für Vaterschaftstests. Sie ist Grundlage der DNAAnalytik in Diagnostik und Grundlagenforschung in Universitäten und Industrie und ist damit eine der Durch die PCR wurde es möglich, ein einzelnes Gen, oder auch nur einen Teil davon zu klonieren. Das sollte nicht mit dem Klonen ganzer Lebewesen verwechselt werden. Für die Klonierung eines Gens muss es zuerst aus einem Organismus entnommen und dann in einen anderen, z.B. ein Bakte- Leitfaden für den Ferienkurs – 1 Theoretische Grundlagen Seite 10 rium, eingebaut werden. Dann kann das klonierte Gen im neuen Organismus detailliert untersucht werden. Die PCR wird häufig verwendet, um das Gen aus dem ersten Organismus durch Vervielfältigung zu isolieren, bevor es in den zweiten transferiert wird. Die PCR wird auch benutzt, um gezielt Mutationen (Veränderungen) in DNA-Strängen hervorzurufen. Ein derart verändertes Gen kann dann auf die Auswirkungen der Veränderung hin untersucht werden. Auch in der Biotechnologie wird die PCR häufig verwendet, z.B. um Bakterien so zu verändern, dass sie bestimmte Wirkstoffe herstellen. Wie funktioniert die PCR? Während der Kettenreaktion wird die DNA durch das Enzym DNA-Polymerase kopiert. Normalerweise wird nur ein kleiner Teil eines langen DNA-Strangs durch eine PCR verdoppelt. Voraussetzung ist, dass man die Basenfolge des Anfangs und des Endes eines gewünschten DNA-Abschnitts kennt. Dieser Teil wird durch die Primer, kurze, künstliche DNA-Stücke (20-40 Basenpaare) festgelegt, welche komplementär zu dem Anfang bzw. dem Ende des zu kopierenden Strangs sind. Die ssen so orientiert sein, dass die Synthesen der DNA-Moleküle aufeinander zulaufen. Die PCR-Maschine (Thermocycler) besteht aus einem computerkontrollierten Ofen, bei dem ein Programm Zeit und Temperatur steuert. Der PCR-Prozess besteht aus mehreren (normalerweise 15-30) Wiederholungen der drei folgenden Schritte (siehe Abbildung 5): 1. 2. 3. Denaturierung (Schmelzen, 96°C, 30-600 Sekunden). Im Denaturierungs-Schritt wird die doppelsträngige DNA wie ein Reißverschluss in ihre beiden Einzelstränge aufgetrennt. Annealing (Anlagerung, 65-80°C, 30-120 Sekunden). Im Annealing-Schritt lagern sich die Primer an die komplementären Stellen der einzelnen DNA-Stränge an. Elongation (Verlängerung, 65-80°C, 30-120 Sekunden). Im Elongation-Schritt läuft eine hitzeresistente DNA-Polymerase (z.B. die Taq-Polymerase) an der einzelsträngigen DNA entlang, wobei sie den fehlenden zweiten Strang erzeugt. Leitfaden für den Ferienkurs – 1 Theoretische Grundlagen Seite 11 Abbildung 2 Schematische Darstellung des PCR-Zyklus Bei jedem Durchlauf der drei Schritte wird der DNA-Abschnitt verdoppelt, die DNA-Menge steigt also 30 exponentiell (mit Basis 2) an. So werden beispielsweise in 30 Durchläufen von einem DNA-Strang 2 = 1 073 741 824 exakte Kopien von dem durch die Primer begrenzten Abschnitt angefertigt. Leitfaden für den Ferienkurs – 1 Theoretische Grundlagen Abbildung 3 Exponentielle Amplifikation (Vermehrung) bei der PCR Abbildung 4 Temperaturprofil einer PCR Der Erfolg einer PCR wird üblicherweise mit einer Agarose Gelelektrophorese überprüft. Seite 12 Leitfaden für den Ferienkurs – 1 Theoretische Grundlagen Seite 13 1.4 Antikörper-Antigene-Immunantwort Um die komplexen Antikörper-basierten Methoden in der medizinischen besser zu verstehen, wird immunbiologische Abwehrreaktionen in unserem Organismus mit Hilfe von Antikörpern ablaufen und was Antikörper überhaupt sind. Antikörper sind große Proteine, die aus langen, gefalteten Ketten von kleineren Molekülen bestehen. Die im Blut am häufigsten vorkommenden Antikörper (Immunglobuline G) haben ein Molekulargewicht von etwa 150.000 Dalton, grob entspricht das etwas mehr als 1.000 Aminosäuren. Nur ein sehr kleiner Teil davon ist die Antigen-Bindungsstelle (s. Abb. 5), also die Struktur, die bei einem anderen Protein (dem Antigen) die zu ihm passende Stelle (das Epitop) erkennt und daran binden kann. Dieses Epitop ist - begrenzt durch die Größe der Antigen-Bindungsstelle des Antikörpers - sehr klein, es besteht aus weniger als 10 Aminosäuren. Ist beispielsweise ein anderer Antikörper das Antigen, macht das Epitop weniger als 1% seiner Aminosäuren - und damit des gesamten Proteins - aus. Das Epitop muss außerdem nicht absolut zur Antigen-Bindungsstelle passen, aber je weniger es passt, desto schwächer wird die Bindung. Da sich Proteine aus den 20 Aminosäuren aufbauen, deren Kombinationsmöglichkeit endlich ist, sind gleiche oder ähnliche Strukturen auf unterschiedlichen Proteinen wahrscheinlich. Ist dies beim Epitop der Fall, kann ein Antikörper an mehrere verschiedene Proteine binden (das wird als Kreuzreaktion bezeichnet). Der Antikörper erkennt nur das Epitop, nicht das Protein selbst. Abbildung 5 Im Sprachgebrauch haben sich einige Redewendungen etabliert, die sehr ungenau sind und Verwirrung stiften: • „Antikörper gegen ein Virus“ gibt es nicht, sondern nur verschiedene Antikörper gegen verschiedene Virusproteine, genauer gesagt Teile davon (Epitope). • Ist die Rede von Antikörpern gegen ein bestimmtes Protein, spiegelt sich darin meist das eigene Forschungsinteresse wider, das sich gerade auf dieses Protein richtet und unerwünschte Bindungen der Antikörper an andere Proteine als Kreuzreaktionen bezeichnet • Der Begriff Antikörper (im Plural verwendet) kann sich einmal auf eine (polyklonale) Mischung unterschiedlicher Antikörper beziehen, wie sie beispielsweise im Blut vorhanden ist oder auch auf viele (monoklonale) Antikörper mit identischen Eigenschaften. 14 Antikörpereinteilung Die Antikörper unterscheiden sich in ihrem Aufbau und in ihrer Funktion voneinander und werden in verschiedene Klassen eingeteilt. Die Immunglobuline bestehen aus einer unterschiedlichen Zusammensetzung von Proteinen. Durch ein spezielles Untersuchungsverfahren, die Elektrophorese, können die verschiedenen Proteine sichtbar gemacht werden. Gleichzeitig ermöglicht die Elektrophorese auch, die Immunglobuline zu "zählen". Die Ergebnisse dieser Untersuchung erlauben dann z. B. Rückschlüsse auf den Krankheitserreger oder auf die bisherige Dauer einer Infektion. Die verschieden Immunglobulinklassen werden mit Buchstaben bezeichnet. Man spricht von der GAMDE-Einteilung, womit folgende Klassen gemeint sind: • • • • Immunglobulin Immunglobulin Immunglobulin Immunglobulin • Immunglobulin E oder IgE G oder IgG A oder IgA M oder IgM D oder IgD Immunglobulin G Die weitaus größte Menge der Antikörper im Körper ist mit ungefähr 75 % das Immunglobulin G (IgG). Das IgG wird bei einer Erstinfektion erst nach ungefähr drei Wochen gebildet. Erst dann mit Hilfe der Elektrophorese nachweisen. Tritt dieselbe Infektion aber noch einmal auf, so werden IgG Antikörper sehr schnell und in sehr großer Menge produziert, um den erneuten Ausbruch einer Erkrankung zu verhindern. Eine weitere Besonderheit von IgG ist, dass sie bei einer Schwangerschaft die schützende Plazenta durchdringen können. So wird auch das Kind vor und auch nach der Geburt vor einer Infektion geschützt. Dieser Schutz Immunglobulin A Das Immunglobulin A (IgA) ist spezialisiert auf Abwehr von Antigenen an den Oberflächen der menschlichen Schleimhäute z.B. in Nase, Rachen und Darm. Ihr Anteil an der gesamten Antikörpermenge beträgt ungefähr 17%. Häufig werden Krankheitserreger und Allergene schon durch die IgA abgefangen und neutralisiert. Dringen die Erreger aber tiefer ein, kommt es zu einer Immunreaktion. IgA gelangt in die Milch einer stillenden Mutter, die so ihrer Abwehrstoffe auf ihren Säugling übertragen kann. Immunglobulin M Wenn ein fremder Erreger in den Organismus gelangt, reagiert der Körper als erstes mit der Produktion von Immunglobulin M (IgM). Weil IgM so schnell zur Verfügung steht, wird er gelegentlich auch als Die Produktion von IgM sinkt einigen Wochen nach Beginn der Infektion ab. Dann sind zum Schutz des Organismus verstärkt die IgG Antikörper gebildet worden, die einen speziellen Schutz bieten. Gerade durch diesen Mechanismus ist eine spezielle Labordiagnostik möglich, die gezielte Fragen eindeutig belegen kann. • Besteht der Verdacht auf eine Infektion durch einen bestimmten Erreger, so müssen sich in der Elektrophorese IgM Antikörper nachweisen lassen. • • • Ist die Infektion eine Erstinfektion, dann steigt die IgM Produktion rasch an. Ist die Infektion eine Zweitinfektion, dann bleibt die IgM Konzentration gering. Ist die akute Phase einer Infektion überwunden, sinkt die Konzentration des IgM wieder. Immunglobulin D Das Immunglobulin D (IgD) ist im Serum nur in sehr geringen Mengen nachweisbar. Über seine genaue Funktion und Bedeutung ist bisher nicht sehr viel bekannt. Es wird aber vermutet, dass es bei Leitfaden für den Ferienkurs – 1 Theoretische Grundlagen Seite 15 der Aktivierung der B-Lymphozyten eine Rolle spielt, denn es "sitzt" auf der Oberfläche der BLymphozyten und kreist mit ihnen im Blutstrom. Immunglobulin E Das Immunglobulin E (IgE) ist ebenfalls stark spezialisiert und spielt bei der Abwehr von Wurminfektionen und bei Allergien eine Rolle. Es stammt aus dem Lymphgewebe, das in der Nähe der Atemwege und des Verdauungstraktes liegt. Von dort aus gelangt es ins Blut. IgE ist nur in winzigen Mengen nachweisbar. Nur 0,001% aller Immunglobuline sind IgE. Trotzdem spielt es bei über 90 Prozent aller allergischen Prozesse eine wichtige Rolle. Die geringe Menge des IgE ist auch dafür verantwortlich, dass es auch mit dem Namen Reagin bezeichnet wird. IgE wurde erst viel später entdeckt, als die anderen Immunglobuline. Man wusste aber schon vorher, dass besonders bei allergischen Reaktionen der Körper mit einem bestimmten Stoff auf das Vorhandensein von Allergenen reagiert. Diesen Stoff nannte man sozusagen unbekannterweise Reagin. IgE ist, wie alle Immunglobuline ein Protein. Er kann sich leicht an alle anderen Körperzellen ankoppeln. IgE ist vor allem in der Haut und in den Schleimhäuten zu finden, die bei allergischen Reaktionen auf Allergene beteiligt sind. Kommen Allergene auf der Haut und den Schleimhäuten mit IgE in Berührung, bewirkt das IgE eine Veränderung in der Funktion verschiedener Zellen. Diese Veränderungen führen zur Ausschüttung von Stoffen aus den Zellen, die eine Entzündungsreaktion hervorrufen. Diese Stoffe werden Mediatoren oder Mittlersubstanzen genannt. Der bekannteste Mediator ist das Histamin. Grundprinzip der Immunabwehr Das Blut spielt eine wichtige Rolle bei der Immunabwehr des Körpers gegen Krankheitserreger. Vor allem die im Blut vorhandenen Leukozyten, die auf dem Blutweg an den Ort der Immunabwehr gebracht werden, übernehmen hier wichtige Aufgaben. In der Umwelt befinden sich viele Krankheitserreger wie Bakterien, Viren, Pilze und Parasiten, die im Körper Erkrankungen hervorrufen können und daher von der Immunabwehr bekämpft werden müssen. Aber auch im Körper entartete Zellen, also Zellen, die einmal ein nützlicher Teil des Körpers waren, aber durch Erreger oder Genveränderungen "krankmachend" geworden sind, müssen von der Körperabwehr erkannt und unschädlich gemacht werden. All diese Substanzen, die vom Körper als "fremd" erkannt werden und eine "Immunantwort" hervorrufen können, nennt man Antigene. Der Körper erkennt sie, weil sie auf ihrer Oberfläche bestimmte Merkmale tragen, die der Körper als "fremd" identifiziert. Welche Oberflächenmerkmale dabei "fremd" sind und welche zum Körper gehören, lernt das Immunsystem bis kurz nach der Geburt. Wurden nun Antigene vom Körper entdeckt, so produzieren die im Blut vorhandenen B-Lymphozyten, eine Unterart der Leukozyten, Antikörper, die zu dem Antigen passen wie "ein Schlüssel zum Schloss" und sich an das Antigen binden. Dadurch entsteht der so genannte Antigen-Antikörper-Komplex. Dieser Komplex wiederum ist für viele andere Zellen des Immunsystems das Zeichen dafür, diesen Komplex mit allen an ihm haftenden Zellen zu zerstören. Die verschiedenen Unterarten der Leukozyten starten dann ein genau vorprogrammiertes Abwehrprogramm, bei dem Botenstoffe bestimmte Zellarten aktivieren und zur Vermehrung anregen. Am sogenannten großen Blutbild kann man daher am Verhältnis der Unterarten der Leukozyten ablesen, ob gerade eine Infektion bekämpft wird bzw. in welchem Stadium (früh, akut oder fast abgeschlossen) der Infektion sich der Mensch befindet. Leitfaden für den Ferienkurs – 1 Theoretische Grundlagen Seite 16 1.5 Bestandteile und Aufgaben des Blutes Betrachtet man frisch aus einer Wunde ausgetretenes Blut unter einem Mikroskop, so erkennt man eine klare Flüssigkeit in der schwach rötlich-gelb gefärbte Gebilde schwimmen. Dazwischen sind auch noch etwas größere anders geformte Körperchen zu erkennen. Das Blut besteht also aus zwei grundsätzlich verschiedenartigen Bestandteilen: dem Blutplasma (Blutflüssigkeit) und den Blutkörperchen (geformte Bestandteile), die sich wiederum aus den roten und weißen Blutkörperchen und den Blutplättchen zusammensetzen. Blut Blutplasma 60% Serum Fibrinogen Blutkörperchen 40 % Rote (Erythrozyten) Weiße (Leukozyten) Blutplättchen (Thrombozyten) Sie bilden die Mehrzahl der festen Bestandteile des Blutes und sind die Träger des Sauerstofftransportes. Der in ihnen erhaltene rote Farbstoff (Hämoglobin) kann den Sauerstoff an sich binden und transportieren. Mangel an Roten Blutkörperchen bedeutet daher in erster Linie Defizite im Sauerstoffund Nährstoffhaushalt des Körpers. Das sauerstoffreiche (im Körper: arterielle) Blut sieht hellrot aus; das Sauerstoff arme Blut der Körpervenen ist dunkelrot und wird über den Lungenkreislauf wieder mit Sauerstoff versehen. Die Erythrozyten werden im Knochenmark gebildet und haben eine Lebensdauer von ca. 120 Tagen. Sie werden in Milz und Leber abgebaut, müssen also laufend nachgebildet werden. Die Gesamtzahl der Erythrozyten beim Erwachsenen beträgt ca. 25- 30 Billionen. Leukozyten (weiße Blutkörperchen) Die etwas größeren unregelmäßig geformten Blutzellen mit Zellkern sind die Leukozyten (leukos, gr. weiß). Diese lassen sich nicht nur mit dem Blutstrom treiben, sondern können sich auch aktiv, z.B. in Richtung eines Entzündungsherdes, fortbewegen. Sie umschließen Krankheitserreger und vernichten diese, gehen dabei häufig selbst zugrunde und bilden dann manchmal mit Geweberesten zusammen den Eiter. Die Anzahl der Leukozyten ist wesentlich geringer als die der Erythrozyten: Auf einen Leukozyten kommen ca. 700-800 Erythrozyten. Monozyten machen zwei bis acht Prozent der Leukozyten aus. Unter diesen stellen sie die größten dar. Außerdem sind sie unter den Leukozyten am besten in der Lage, Bakterien und Gewebetrümmer achen (zu phagozytieren, d.h. wörtlich zu "fressen"). Monozyten bleiben zwei bis drei Tage im Blutkreislauf. Danach wandern sie in das umgebende Gewebe ein, wo sie größer werden und dann als Makrophagen bezeichnet werden. Sie sind vor allem in Lymphknoten, Lunge, Leber, Milz und Knochenmark zu finden. Eine bestimmte Gruppe der Leukozyten, die Lymphozyten, sorgen für die spezifische Abwehr von Krankheitserregern. Sie bilden z.B. spezielle Antikörper gegen Erreger von Infektionskrankheiten. Bei der aktiven Immunisierung (Impfung) werden geringe Mengen abgeschwächter oder abgetöteter Krankheitserreger injiziert und somit die Antikörperproduktion angeregt, damit das Immunsystem auf eine mögliche Infektion vorbereitet ist. Ist eine schwere Infektionskrankheit, mit der der Mensch selbst nicht fertig wird, bereits ausgebrochen, können in manchen Fällen Antikörper direkt gespritzt (passive Immunisierung) werden. Thrombocyten (Blutplättchen) Im Mikroskop kaum zu sehen sind die Blutplättchen oder Thrombozyten (gr. thrombos - Klumpen, kytos - Zelle). Es sind kleine Gebilde (4 µm im Durchmesser), die schnell zerfallen und eine wichtige Funktion bei Wundverschluss und Blutgerinnung spielen: Tritt aus einer Wunde Blut aus, wird dieses Leitfaden für den Ferienkurs – 1 Theoretische Grundlagen Seite 17 schnell fest und bildet einen die Wunde verschließenden Pfropf. Dieser Vorgang wird Blutgerinnung genannt, der Pfropf besteht aus einem Gewirr von Proteinfäden ( Fibrin, sondern eine Vorstufe, das Fibrinogen. Kommt das Blut mit rauhen Oberflächen in Berührung, so zerfallen die Blutplättchen und entlassen ein Protein, das zusammen mit Kalzium zur Gerinnung des Fibrinogens in Fibrin führt. Blutplasma Lässt man frisch entnommenes Blut unter Luftabschluss stehen, so sinken allmählich die geformten Bestandteile zu Boden. Als Überstand wird deutlich das Blutplasma sichtbar. Das Blutplamsa ist der flüssige, gerinnungsfähige Anteil des Blutes ohne Blutzellen. Es ist die Trägersubstanz der Blutkörperchen und besteht zu 90% aus Wasser, 10% sind darin gelöste Bestandteile. Es enthält viel Protein für Wachstum und Baustoffwechsel, Fett, Traubenzucker und Kochsalz in ungefähr gleich bleibenden Fibrinogen, Antikörper, Hormone als Botenstoffe und viele andere lebenswichtige Stoffe mehr sind im Plasma enthalten. Auch unser Wärmehaushalt wird über die Temperatur des Blutes geregelt. Zuwenig an Plasma bedeutet "zu dickes" Blut und in letzter Hinsicht Probleme mit dem Kreislauf, da die feinsten Blutgefäße nicht mehr ordentlich durchflossen werden können. Das Blut mit all seinen darin enthaltenden Bestandteilen wird als Vollblut bezeichnet. Bei Serum handelt es sich um das Vollblut ohne Blutzellen und Gerinnungsfaktoren. Da das Serum nicht mehr gerinnen kann, ist es für viele Untersuchungen wie Blutzucker, Antikörper etc. am besten geeignet. Zur Herstellung des Blutserums lässt man das Blut gerinnen und zentrifugiert es anschließend. Das Serum setzt sich dann als wässrige Flüssigkeit über den festen Bestandteilen ab. Abbildung 8 Mikroskopisches Blutbild. 1 Blutplättchen, 2 Erythrozyten, 3 Leukozyten. Leitfaden für den Ferienkurs – 1 Theoretische Grundlagen Seite 18 Funktionen des Blutes im Überblick Transport Abwehr Wärmeregulation Abdichtung Pufferung Transport von Sauerstoff und Nährstoffen zu den Zellen, gleichzeitig Abfuhr von Kohlendioxid und Stoffwechselendprodukten, Hormon- und Enzymtransport zu den Zielzellen. spezifische Immunabwehr (zellulär: speziell sensibilisierte T-u.B-Lymphozyten; humoral: spezifische Antikörper, Immunglobuline) unspezifische Immunabwehr (zellulär: z.B. Granulozyten, Monozyten; humoral: z.B. Pyrogene, Histamine) Gleichbleibende Körpertemperatur von etwa 36,5°C durch wird durch ständige Blutzirkulation aufrecht erhalten. Abdichtung von Gefäßwanddefekten durch die Fähigkeit der Blutgerinnung (Hämostase). Der pH-Wert muss konstant gehalten werden, da Enzyme sonst nicht mehr wirksam sind (Bikarbonat-, Phosphat-, Proteinpuffer). 1.6 Antikörpertests Die gebräuchlichsten Antikörpertests sind: • der EIA (Enzyme Immuno Assay) oder ELISA (Enzyme-linked Immunosorbent Assay), als Suchtest verwendet, • die Immunfluoreszenz, wird als Bestätigungstest bezeichnet, • der Western Blot oder Immunoblot, gilt ebenfalls als Bestätigungstest. Wir werden als Versuch den ELISA und den Western Blot durchführen. Bei Verdacht auf eine Virusinfektion wird in der Diagnostik zunächst ein Suchtest durchgeführt, wenn dieser positiv ausfällt, soll sich ein sogenannter Bestätigungstest anschließen, der Western Blot oder die Immunfluoreszenz. ELISA, Western Blot und Immunfluoreszenz beruhen auf demselben Prinzip: bestimmte Proteine (eines Virus, eines Bakteriums oder welchen Ursprungs auch immer) sind fest an eine Trägersubstanz gebunden, dazu wird das Blutserum eines Menschen gegeben, der getestet werden soll. Die Antikörper in diesem Serum, die zu einem oder mehreren Proteinen passen, binden daran. Dann werden die ungebundenen Antikörper entfernt und üblicherweise dazugegeben, die von einer anderen Tierart stammen und an menschliche Antikörper binden können. Die Konjugat-Antikörper tragen ein Enzym, das nach Zugabe von bestimmten Substanzen eine Farbreaktion erzeugt, die sichtbar und messbar ist. ELISA (Enzyme-Linked Immunosorbent Assay) Für den ELISA wurden anfangs Viren aus Zellkulturen verwendet, doch seit einigen Jahren benutzen die Herstellerfirmen gentechnisch produzierte Proteine oder Teile davon. Im ELISA sind die Proteine an Plastikplatten oder -kugeln gebunden. Sind menschliche Antikörper im ersten Arbeitsschritt gebunden worden, wird die Reaktion mit Hilfe von Konjugat-Antikörpern sichtbar gemacht. ein Enzym tragen, Western Blot Mit dem Western Blot können einzelne, spezifische Protiene in komplexen Proteingemischen aufgespürt und quantifiziert werden. Dabei können einzelne Proteine aus Virus-Präparationen, Gesamt-ZellProtein oder Gewebe-Lysaten nachgewiesen werden. Zunächst werden die Proteine, abhängig von Leitfaden für den Ferienkurs – 1 Theoretische Grundlagen Seite 19 ihrer Größe, im elektrischen Feld getrennt (Elektrophorese). Die Proteine werden so behandelt, dass sie eine negative Ladung tragen, dann werden sie auf ein Gel aufgetragen. An dieses Gel wird eine Spannung angelegt. Die Proteine, die sich am negativen Pol befinden, wandern wegen ihrer negativen Ladung zum Pluspol. Kleine Proteine wandern schnell durch das Gel, große langsam, und Proteine mit gleichem Molekulargewicht lagern sich zusammen und bilden eine sogenannte Bande. Waren in der Probe viele Proteine mit unterschiedlichem Molekulargewicht, bilden sich viele Banden, die angefärbt werden müssen, um sichtbar zu sein. Anschließend werden die Proteinbanden von dem Gel auf eine Membran transferiert und dadurch immobilisiert. Dieser Schritt wird als Blotten bezeichnet. Der Begriff Western Blot bezeichnet die Übertragung von Proteinen auf eine Membran (im Gegensatz zum Southern und Northern Blot, bei denen Nucleinsäuren übertragen werden). Auf die Membran wird das Blutserum eines Menschen gegeben, der getestet werden soll. Auf der Membran erfolgt der Nachweis des Proteins mittels eines spezifischen Antikörpers. Der gebundene erste Antikörper wird durch einen zweiten Antikörper detektiert, der entweder radioaktiv markiert oder an ein Enzym (Peroxidase, Phosphatase etc.) gekoppelt ist, und durch eine Farbreaktion sichtbar gemacht. Wenn Antikörper aus dem Serum mit Proteinen auf der Membran reagiert haben, wird so die entsprechende Proteinbande sichtbar. Die Banden im Western Blot werden nach ihrem Molekulargewicht benannt. Abbildung 6 Blot-Transfer Abbildung 7 Banden eines Western Blots Leitfaden für den Ferienkurs – 1 Theoretische Grundlagen Seite 20 Übersicht über die Prinzipien der Virusdiagnostik Direkter Nachweis des Virus oder von Virusbestandteilen • Virusisolierung: Zellkultur • Direkte Visualisierung: Elektronenmikroskopie • Nachweis der Auswirkungen einer Virusinfektion: Lichtmikroskopie von infiziertem Gewebe oder Zellen • Nachweis viraler Antigene: z.B. mittels Immunfluoreszenz • Nachweis von viralem Genom (viraler Nukleinsäure): mittels PolymeraseKettenreaktion (PCR) Indirekter Nachweis der antiviralen Immunantwort • humoral: Antikörper verschiedener Klassen (IgG, IgM, IgA) und Subklassen: z.B. mittels Enzyme-linked Immunosorbent Assay (ELISA, EIA), Immunfluoreszenztest (IFT), Western blot • zellulär: zytotoxische T-Zellen • unspezifisch: Interferone etc. Leitfaden für den Ferienkurs – 2 Protokoll Seite 21 2 Protokoll 2.1 Virusanzucht Voraussetzung für die Virusanzucht ist das sterile Arbeiten. Normalerweise wird an rbeitet, deshalb ist die Anleitung dafür hier mit aufgeführt. Wir werden allerdings ohne Sterilbank versuchen steril zu arbeiten, da uns in unserem Labor keine Sterilbank zur Verfügung steht. Vorbereitung (Sterilbank) ♦ ♦ Hood einschalten (Anleitung des jeweiligen Modells beachten) ggf. UV-Lampe entfernen/Fenster auf Arbeitshöhe bringen ♦ ♦ ♦ ♦ auf Betriebsbereitschaft warten (Warnton erlöscht) Arbeitsfläche mit Desinfektionsmittel aussprühen/abwischen Autoklavierbeutel (Abfall) und Gefäß für Flüssigabfall (in der Bank) bereitstellen alle Utensilien, die während der Arbeit benötigt werden, mit Desinfektionsmittel gründlich einsprühen und in die Bank stellen zuletzt Handschuhe desinfizieren – Hände unter der Hood lassen benötigte Gefäße aufschrauben, aber Deckel auf dem Verschluss lassen ♦ ♦ ♦ ♦ steril bleibt steril – semisteril gibt es nicht darauf achten, dass mit Pipettenspitzen keine Gegenstände (und Gefäße) berührt werden, ansonsten Spitze verwerfen Zellen splitten (Anzucht einer neuen Passage) Eine Passage bedeutet, dass Zellen von einem Zellkulturgefäß in ein anderes zum Zwecke der Vermehrung der Zellen umgesetzt werden. Wir werden Nieren-Tumor-Zellen der grünen Meerkatze 2 7 (Verozellen) umsetzen. Eine dichtbewachsene Flasche (25ml Inhalt – 75cm Fläche) enthält ca. 10 6 Zellen, ein definierter Ansatz enthält meist 10 Zellen pro Flasche. Vorgehensweise ♦ verbrauchtes Medium mit 10er Pipette abnehmen und verwerfen, dabei die Zellen, die am Flaschenboden haften nicht beschädigen ♦ 10ml PBS (min. RT) zum Waschen mit einer Pipette in die Flasche geben, leicht schwenken und wieder abnehmen, Flüssigkeit verwerfen ♦ ♦ ♦ ♦ ♦ 1ml Trypsin auftragen, leicht schwenken und ggf. klopfen bis die Zellen vom Flaschenboden gelöst sind (trübe Lösung). Achtung: Trypsin lysiert Zellen, wenn es zu lange inkubiert. 8ml DMEM-Medium zugeben, um die Proteolyse (Aufspaltung von Proteinen durch Enzyme) zu stoppen. Neubauerkammer vorbereiten: Die saubere Kammer anhauchen, das Deckgläschen auflegen und durch leichte Schiebebewegung festdrücken bis „Newton’sche Ringe zu sehen sind 20µl der Zellsuspension abnehmen und an den Rand den Deckgläschens träufeln Mikroskop einstellen, Zellen auszählen: Leitfaden für den Ferienkurs – 2 Protokoll Zählkammer Seite zu zählende Zellen 22 Zählreihenfolge Ein Großquadrat besteht aus 16 Kleinquadraten. Es werden vier Großquadrate ausgezählt. Jedes Großquadrat hat eine Fläche von 1 mm2, dieses ergibt bei einer Tiefe von 0,1 mm ein Volumen von 4 Zellzahl mit 10 (10.000) multipliziert werden. Bsp.: Zählung 1: 163 Zellen Zählung 2: 144 Zellen 4 = 307 Zellen à ∅ 153 (Zellen) x 10 (Neubauerfaktor) 6 6 = 1,53 x 10 /ml à wenn 10 Zellen/Flasche gewünscht, dann 660µl einsetzen (1/1,53) und auf 25ml auffüllen ♦ ♦ ♦ 6 entsprechende Menge für gewünschte Zellzahl (z.B. 660µl für 1,0x10 Zellen) in neue Flasche überführen entsprechende Differenz bis 10 ml mit Medium auffüllen restliche Zelllösung verwerfen / alte Flasche verwerfen Nachbereitung (Sterilbank) ♦ ♦ ♦ Zellkulturen inkubieren (Brutschrank: auf CO2-Fluss und Temperatur achten) Arbeitsmaterialien aus der Hood entfernen Autoklavierbeutel entfernen, mit Autoklavierband verschließen und zum Autoklavenabfall geben ♦ ♦ ♦ Flüssigmüllbehälter verschließen (verbleibt in Hood bis er voll ist) Hood mit Desinfektionsmittel aussprühen / auswischen als letzter Benutzer am Tag, die Hood ausschalten und die UV-Lampe einsetzen und einschalten Nach ein paar Tagen werden wir uns die Kulturen erneut ansehen, und nach Bakterien Ausschau halten. Je weniger Bakterien ihr findet, desto sauberer habt ihr gearbeitet! 2.2 PCR Nachweis des Cytomegalievirus mittels PCR Gewinnung der CMV-DNA Zunächst muss die Erreger-DNA aus dem Serum (Blutprobe des Patienten) gewonnen werden. Hierfür wird das Serum zunächst mit einem Lysis-Puffer versetzt, der die Blutzellen zerstört und dann mit Ethanol, um die Gesamt-DNA auszufällen. Es schließen sich nach Zugabe von Puffern mehrere Zentrifugationsschritte an bis man die aufgereinigte DNA für die Weiterverarbeitung in der PCR erhält. Diese Schritte werden jedoch von euch nicht durchgeführt. Die gereinigte doppelsträngige Virus-DNA ist das Ausgangsmaterial (template) für die Polymerase Kettenreaktion. Leitfaden für den Ferienkurs – 2 Protokoll Seite 23 Design von Oligonukleotiden für die Polymerase Kettenreaktion (PCR) Um ein Teilstück der CMV-DNA mit Hilfe einer PCR amplifizieren (vervielfältigen) zu können, brauchen wir eine thermostabile DNA-Polymerase und zwei passende Oligonukeotidprimer. Diese Oligonukleotide werden speziell für die gewünschte Amplifikation maßgeschneidert. Die Primer haben folgende Sequenzen: Primer CMS („sense“) 5‘ –GCACCATCCTCCTCTTCC-3‘ (19-mer) antisense“) 5‘ –GGCCTCTGATAACCAAGCC-3‘ (19-mer) PCR Alles was man für eine PCR braucht sind eine thermostabile DNA-Polymerase, ein wenig DNA („template“), zwei passende Oligonukleotidprimer, entsprechende Puffer und Nukleotide. Wir werden ein typisches PCR-Programm durchführen. Die PCR Maschine (Thermozykler) ist folgendermaßen programmiert: Aktivierung des Enzyms: Denaturierung: 95°C 95°C 15 min 10 sec Annealing/Elongation: 58°C 30 sec 45 Zyklen Folgender 50 µl Reaktionsansatz wird in kleinen dünnwandigen 1,7 ml zusammenpipettiert. Wichtig ist bei der PCR, dass man für jeden Schritt eine neue Pipettenspitze nimmt (Kontaminationsgefahr!): Der Supermix muss nicht mehr extra von euch angesetzt werden. ♦ ♦ ♦ 44,8 µl „Supermix“ (Puffer, Nukleotide, Magnesium, Primer) 0,2 µl AmpliTaq Gold (DNA-Plymerase) 5 µl template Analyse der PCR-Produkte mittels Agarose Gelelektrophorese Um DNA-Fragmente sichtbar zu machen bedient man sich einer Gelelektrophorese, mit der man Fragmente ihrer Größe nach auftrennen kann. Das Prinzip: Man löst Agarose in Elektrophorese-Puffer durch Erhitzen. Nach Zufügen eines Farbstoffes (Ethidiumbromid) gießt man das Gel in eine Kammer. Mit Hilfe eines Kammes, der in das noch flüssige Gel gehängt wird, formt man mit Erkalten des Gels Vertiefungen (Taschen). Nach ca. 30 min wird das kalte Gel in eine Elektrophorese-Kammer gelegt, 15 µl PCR-Produkt mit 5 µl Puffer in eine Taschen pipettiert und Spannung angelegt. Nach einer Laufzeit von ca. 30 min bei 120V betrachtet man das Gel unter UV-Licht. Große DNA-Fragmente durchlaufen Agarosegele langsamer als kleine. Der Grund liegt in der Siebstruktur der Agarose, deren Poren kleineren Fragmenten bei der Wanderung zum anderen Pol weniger Widerstand bietet. Gleichzeitig wird ein „Standard“ mit DNAFragmenten bekannter Länge aufgetragen, mit deren Hilfe die Länge eines Fragmentes bestimmt werden kann. Verwendeter Puffer: TBE-Puffer (Tris-Borat-EDTA-Puffer) Vorgehensweise ♦ ♦ 1 g Agarose in 100 ml TBE-Puffer in Erlenmeyerkolben suspendieren Agarose schmelzen und die Lösung bei Raumtemperatur abkühlen lassen, 2,5 µl Ethidiumbromid hinzufügen ♦ ♦ Gelkammer mit Leukosilk abkleben Agarose-Lösung blasenfrei in die Gelkammer gießen Leitfaden für den Ferienkurs – 2 Protokoll ♦ ♦ Seite 24 Taschenschablone (10er Kamm) in die noch warme Agarose-Lösung einsetzen und event. Luftblasen dort entfernen Gel erkalten lassen ♦ Leukosilk entfernen und den Gelträger in die vorbereitete Gelkammer (gefüllt mit TBE-Puffer) überführen, sodass die Taschen auf der Kathodenseite (-) sind. ♦ 15 µl PCR-Produkt mit 5 µl Auftragspuffer in einem Eppendorf-Gefäß vermischen und mit der Pipette in die Probentasche einbringen. Dabei die Pipette schräg über die Tasche halten und beim Pipette die Probelösung langsam in die Taschen absinken lassen. Als nmarker wird eine sog. 1-kb-Leiter verwendet. Nach dem Beladen, eine Spannung von 120 V anlegen und das Gel ca. 30 min laufen lassen. Die Färbung erfolgt mit Ethidiumbromid (mutagen und toxisch, wird daher von uns durchgeführt). Das Gel kann anschließend mit einer Polaroid Kamera unter UV-Licht aufgenommen werden und jeder enthält eine entsprechende Aufnahme. ♦ Leitfaden für den Ferienkurs – 2 Protokoll Seite 25 2.3 ELISA Test Enzymimmunoassay mit Pipettier-Kontroll-System (PKS) zur Bestimmung von IgG-Antikörpern gegen das Cytomegalie-Virus(CMV) Je nach geographischer Region und Durchseuchung sind bei 50 - 100 % der Erwachsenen IgGAntikörper gegen CMV nachweisbar. Da CMV latent im Körper verbleiben kann, kann es zu einer Reaktivierung des Virus kommen. Eine akute CMV-Infektion kann durch den Nachweis von IgMAntikörpern diagnostiziert werden. Wir werden jedoch nur auf IgG-Antikörper testen. Wer möchte kann sich Blut entnehmen lassen und sein eigenes Blut auf die Antikörper testen. Testprinzip Mit humanem IgM-Rheumafaktor beschichtete Mikrotiterplatte. Zwischen den Antikörpern gegen CMV aus der Patientenprobe und dem gleichzeitig auf die Mikrotiterplatte gegebenen CMV-IgG-ELA (Enzyme Labelled Antigen) bilden sich während der Inkubation Immun-komplexe (AG = Antigen, P = Peroxidase). Nur die IgG-Immunkomplexe werden selektiv an den IgM-Rheumafaktor gebunden. Nach dem Waschen zum Entfernen des ungebundenen Materials wird TMB-Substrat hinzugegeben. Die Reaktion wird durch die Zugabe von Schwefelsäure gestoppt. Die Auswertung erfolgt photometrisch bei einer Wellenlänge von 450 nm. Leitfaden für den Ferienkurs – 2 Protokoll Seite 26 Durchführung Zunächst müssen Serumverdünnungen hergestellt werden. Die Verdünnungen werden mit 20µl Serum des entsprechenden „Patienten“ und dem Probenverdünnungspuffer in einer Mikrotiterplatte hergestellt. Hinweis: Da zu den Serumverdünnungen noch das Antigen dazugegeben wird, entspricht die angesetzte Serumverdünnung noch nicht der Endkonzentration. Verdünnung 1:10 (V 1): Verdünnung 1:100 (V 2): Verdünnung 1:1000 (V 3 ): 20µl Serum + 180 µl Verdünnungspuffer 20µl der 1:10er Verdünnung + 180 µl Verdünnungspuffer 20 µl der 1:100er Verdünnung + 180 µl Verdünnungspuffer Mikrotiterplatte 1 2 3 4 A LW P2V1 P2V2 P2V3 B NK P3V3 P3V3 P3V3 C NK D PK E PK F P1V1 G P1V2 5 6 7 8 9 10 11 12 etc. H P1V3 LW = Leerwert; P1, P2, P3 = Patient 1, 2, 3; V1 = Verdünnung 1:10; V2 = Verdünnung 1:100; V3 = Verdünnung 1:1000; NK = Negativkontrolle; PK = Positivkontrolle Anschließend wird nach folgenden Arbeitsschritten vorgegangen: ♦ ♦ ♦ Die Verpackung einer neuen Mikrotiterplatte wird am ZIP-Verschluss geöffnet und die erforderliche Anzahl Mikrotitervertiefungen entnommen. Die Vertiefung A1 bleibt frei für die Ermittlung des Leerwertes (LW). Probenverdünnungen sowie in Doppelbestimmung Negative Kontrolle (NK) und Positive Kontrolle (PK) in die Vertiefungen der Platte pipettieren. Nach dem Pipettieren der Proben (pH-neutrale bzw. basische Flüssigkeiten) kommt es zu einer Blaufärbung. Erfolgt in einer Vertiefung kein Farbumschlag, so ist dies ein Hinweis darauf, dass keine Probe bzw. keine Kontrolle pipettiert wurde. ♦ Jeweils 50 µl CMV-IgG-ELA (rot gefärbt) in alle Vertiefungen (außer A1) pipettieren. Die Endver♦ ♦ ♦ ♦ dünnungen des Serums sind nun 1:50 (V1), 1:500 (V2) und 1:5000 (V3). Die Mikrotitervertiefungen 60 min (± 2 min) bei 20°C (± 1 °C) inkubieren (feuchte Kammer). Waschpuffer ansetzen: 1 Teil Waschpuffer (10 x) wird mit 9 Teilen Aqua dest. (destilliertem Wasser) angesetzt (z. B. 50 ml Waschpuffer (10 x) mit 450 ml Aqua dest. Für acht Vertiefungen werden 5 ml Waschpuffer benötigt. Evtl. im Waschpuffer (10 x) vorhandene Kristalle sind vor dem Ansetzen durch Erwärmen (max. 37 °C) und/oder Rühren bei RT in Lösung zu bringen. Nach Inkubation die Mikrotitervertiefungen dreimal mit jeweils 200 µl Waschpuffer waschen. Darauf achten, dass alle Vertiefungen beim Waschen gefüllt werden. Nach Beendigung des Waschvorganges Mikrotitervertiefungen auf Filterpapier ausklopfen. Nicht austrocknen lassen! Umgehend weiterverwenden! 50 µl TMB-Substrat in jede Vertiefung (auch A1) pipettieren und 10 min (±2 min) bei 20 °C (±1 °C) im Dunkeln inkubieren (feuchte Kammer). Positive Proben erscheinen blau gefärbt. Leitfaden für den Ferienkurs – 2 Protokoll ♦ ♦ ♦ Seite 27 In alle Vertiefungen (auch A1) 100 µl Stopplösung pipettieren. Es erfolgt ein Farbumschlag von blau nach gelb. Mikrotitervertiefungen vor photometrischer Messung von unten abwischen und darauf achten, dass keine Luftblasen in den Vertiefungen vorhanden sind! Photometermessung bei 450 nm (Referenzwellenlänge 620 - 650 nm) innerhalb von 15 min nach dem Stoppen Tabelle zur Arbeitsvorschrift (IgG) Leerwert (A1) Negative Kontrolle Positive Kontrolle Probe Negative Kontrolle 10 µl Positive Kontrolle 10 µl Probe 10 µl CMV-IgG-ELA 50 µl 50 µl 50 µl 60 min. bei 18 – 28 °C inkubieren, 3x mit 200 µl Waschpuffer waschen TMB-Substrat 50 µl 50 µl 50 µl 50 µl 10 min bei 18 – 28 °C im Dunkeln inkubieren Stopplösung 100 µl 100 µl 100 µl 100 µl Photometrische Auswertung bei 450 nm (Ref. 620 – 650 nm) Testbeurteilung (Validität) ♦ Die OD (Optische Dichte) des Leerwertes (Vertiefung A1) wird von allen OD-Werten subtrahiert. ♦ Der OD-Mittelwert der Negativkontrolle muß < 0,100 betragen. Der OD-Mittelwert der Positivk ontrolle muss > 1,000 (IgG) betragen. Cut-off = OD-Mittelwert der Negativkontrolle + 0,140 Grenzbereich = Cut-off ± 10 % ♦ ♦ Interpretation der Ergebnisse ♦ ♦ ♦ Proben mit OD-Werten unterhalb des Grenzbereiches werden als NEGATIV bewertet. Proben mit OD-Werten innerhalb des Grenzbereiches werden als GRENZWERTIG bewertet. Werte im Grenzbereich sollten kontrolliert werden, indem nach 14 Tagen eine zusätzliche Patientenprobe entnommen wird, die zusammen mit der ersten Probe auf eine Titerbewegung untersucht wird. Proben mit OD-Werten oberhalb des Grenzbereiches werden als POSITIV bewertet. Leitfaden für den Ferienkurs – 2 Protokoll Seite 28 2.4 Western Blot Nachweis von spezifischen Antikörpern gegen Parasitenantigene am Beispiel des Wurms Onchocerca volvulus. Gegen fremde Proteine bildet das Immunsystem des Wirts (z.B. Mensch) Antikörper, hauptsächlich IgG-Antikörper, die spezifisch mit den Antigenen des Parasiten reagieren. Mit Antikörper komplexierte lösliche Antigene werden von Leukozyten aufgenommen und abgebaut. Antikörper, die an Oberflächen-assoziierte Antigene (partikuläre Antigene) des Parasiten anhaften, können sekundär eine Bindung von Leukozyten an die Parasiten auslösen. Die Leukoyten „umzingeln“ den Wurm und schädigen ihn. In unserem Versuch wird ein Extrakt von Proteinen des parasitischen Wurms Onchocerca volvulus auf Antikörper untersucht. Vorgehensweise ♦ SDS-Page-Gelelektrophorese (siehe auch S. 17) durchführen. Gel anschließend in Petrischale in Bjerrum - Schäfer-Nielsen (BSN) Puffer geben ♦ Nitrocellulose-Membran auf Gelgrösse schneiden. Unten in ca. 0,5 cm Abstand Markierungsstrich mit Kugelschreiber ziehen. Membran in BSN-Puffer geben. ♦ 6 Whatman - Papier auf Gelgrösse schneiden (nicht grösser, da sonst Strom nicht durch die NCMembran fliesst) und in BSN-Puffer geben ♦ ♦ ♦ ♦ In Transferkammer (Elektroblotting) in folgender Reihenfolge einlegen: 3x Filterpapier Gel Nitrocellulose-Membran 3x Filterpapier Blottingbedingungen. 50 min / 80mA / 25V / 65W (0,8mA/cm2) Nitrocellulose-Membran in Petrischale geben und mit Farbstoff Ponceau S (0,5%) färben (Blotkontrolle) mit H2O entfärben Nitrocellulose-Membran in ca. 3mm Streifen (lanes) schneiden und beschriften Einzelne lanes in Färbebox legen (Marker sofort trocknen) Pro lane 1ml 5% Magermilchpulver (MG) in PBS geben 30 bis 60 min. schütteln/blockieren ♦ Abgießen und pro lane 1ml Serum/3%MG/PBS zugeben 1. Antikörper (z.B. Patientenserum) über Nacht im Kühlschrank (4°C) schütteln oder 3h bei Raumtemperatur, verdünnte Seren sind wiederverwendbar ♦ ♦ ♦ 3 x 5 min. mit PBS + 0,1% Triton X waschen Protein G – POD (Peroxidase) markiert (Verd.: 1:1000 ) mit 3% MG/PBS zugeben, 1h inkubieren 3 x 5 min. mit PBS + 0,1% Triton X waschen ♦ Entwicklung : 15 mg Chloronaphthol 5 ml Methanol ad 50 ml PBS 50 µl H2O2 pro lane 1,5 ml zugeben, solange warten bis Banden sichtbar sind mit Aqua dest. (destilliertem Wasser) stoppen Leitfaden für den Ferienkurs – 2 Protokoll Seite 29 2.5 Reinigung und Färbung von Blutzellen Reinigung einkerniger (mononukleärer) Zellen aus dem menschlichen Blut Einkernige Zellen (Lymphozyten und Makrophagen) werden aus einem Teil der Blutkonserve, der den größten Teil der kernhaltigen Zellen enthält (Buffycoat) über einen Dichtegradienten von den Erythrozyten und Granulozyten (gehören auch zu den Leukozyten) getrennt. Vorgehensweise ♦ Auslaufschlauch des Buffycoates desinfizieren ♦ ♦ ♦ Schlauch aufschneiden und Inhalt des Beutels in einen 200ml Erlenmeyer-Kolben laufen lassen Blut mit gleichem Volumen PBS-Puffer verdünnen (ca. 50ml) Vier 50ml-Röhrchen mit je 15 ml Ficoll (das ist ein Zuckermolekül, mit dessen Hilfe sich die Dichte ♦ ♦ 25ml des verdünnten Blutes vorsichtigt überschichten 20 min zentrifugieren, Bremse ausschalten ♦ Nach der Zentrifugation erkennt man unten das Pellet (fester Teil), das Erythrozyten und Granulozyten enthält, auf dem Ficoll liegen Lymphozyten und Monozyten als weißliche Schicht, darüber befindet sich das Blutplasma ♦ Die Schicht auf dem Ficoll vorsichtig abnehmen, dabei versuchen nicht zu viel Ficoll mitzunehmen. Zellen in ein frisches 50ml Falcon geben und mindestens 1:10 mit PBS verdünnen. 10min bei 1200 rpm (Umdrehungen pro Minute) zentrifugieren. ♦ ♦ ♦ ♦ ♦ ♦ Überstand verwerfen Pellets zusammengeben und mit 50ml PBS-FCS waschen Die letzten zwei Schritte noch 3x wiederholen Zellen zählen. Dazu die Zellsuspension in 10ml PBS-FCS aufnehmen, gut mischen, 10µl entnehmen und mit 90µl Trypanblau verdünnen. Diese Zellsuspension in eine Neubauer Zählkammer füllen und zwei Eckquadrate auszählen. Die Konzentration der Zellen errechnet sich nach folgender Formel Zellzahl/Eckquadrat x Verdünnung x 10000 = Zellzahl/ml Ausgangszellsuspension 6 Zellen auf 10 Zellen/ml mit PBS-FCS einstellen Färbung der einkernigen Zellen aus dem Blut mit Antikörpern Antikörper, die mit verschiedenen fluoreszierenden Farbstoffen gekoppelt sind, binden an die Oberfl chenmoleküle der Zellen. Dadurch können diese in funktionell unterscheidbare Gruppen eingeteilt werden. Die Eigenschaften der Zellen können nun mit Hilfe der Durchflusszytometrie auf Einzellebene dokumentiert werden. Die Durchflusszytometrie (FACS steht für Fluorescence Activated Cell Sorting) ermöglicht das Zählen und die Analyse von physikalischen und molekularen Eigenschaften von Partikeln (Zellen, Kunststoffkügelchen usw.) in einem Flüssigkeitsstrom. Grundlage ist die Antigen-Antikörper-Reaktion, die mit Fluoreszenzfarbstoff-markierten Antikörpern durchgeführt wird. Zur Analyse werden die Zellen einer Einzelzellsuspension wie an einer Perlenkette an einem gebündelten Laserstrahl geeigneter Wellenlänge vorbeigeleitet. Bei exakter Anregung der Elektronen des Fluoreszenzfarbstoffes durch den Laserstrahl werden diese auf ein höheres Energieniveau gehoben. Nach dem Laserpuls fallen die Elektronen unter Abgabe von Energie (in Form von Photonen) auf ihr Ursprungsniveau zurück. Die ausstrahlene Photonenkonzentration, die durch einen Photodetektor registriert wird, verhält sich proportional zur Menge an gebundenen Zusätzlich werden durch die Lichtbeugung und -streuung Informationen über die Binnenstruktur (Granularität des Zytoplasmas, Größe des Zellkerns usw.) der Zellen gewonnen. Leitfaden für den Ferienkurs – 2 Protokoll Seite 30 Außerdem werden wir die Zellen noch unter dem Fluoreszenzmikroskop betrachten. Die Fluoreszenzmikroskopie beruht auf der Tatsache, dass Moleküle einen Teil des von ihnen absorbierten Lichts in Form einer langwelligeren (energieärmeren) Strahlung wieder abgeben. Vorgehensweise ♦ Je 106 Zellen in drei FACS-Röhrchen füllen ♦ 5 min bei 1200 rpm zentrifugieren ♦ ♦ Überstand abkippen Auf dem Rücklauf 10µl CohnII 10mg/l (humane Immunglobuline zum Blockieren der FcRezeptoren) ♦ ♦ 100µl Antikörper-Lösung zugeben: a) CD3/CD19 b) CD4PerCP/CD8APC c) CD3FITC/CD16+CD56PE 30 min auf Eis inkubieren ♦ ♦ ♦ mit 2ml PBS-FCS auffüllen 5 min bei 1200 rpm zentrifugieren in 300 µl Paraformaldehyd 1% aufnehmen Leitfaden für den Ferienkurs – 3 Glossar Seite 31 3 Glossar DNA/Desoxyribonukleinsäure (DNS) - Bildet bei den meisten Lebewesen das genetische Material Durchflusszytometrie - Methode zur Analyse von Zellen nach Färbung mit markierten rpern Enzyme - Proteine, die als Katalysatoren Reaktionen ohne Beeinflussung ihres Gleichgewichts beschleunigen Expression - Produktion eines gen-kodierten Proteins Fibrin - Nicht wasserlöslicher Bestandteil des Blutes, der bei der Blutgerinnung entsteht Gelelektrophorese – Biomoleküle werden nach Größe im elektrischen Feld getrennt Gen - Grundeinheit der Erbinformation, die für eine Struktur oder Funktion kodiert Genom - Gesamtheit der Erbinformationen Gentherapie - Heilung von Krankheiten durch das Einbringen intakter Gene in "kranke" Körperzellen. Die veränderte Information der Körperzellen wird nur dann nicht an die Nachkommen weitergegeben, wenn sie nicht in Keimzellen eingebracht wurde Immunologie - Lehre von den Erkennungs- und Abwehrmechanismen eines Organismus für fremde Substanzen und Gewebe r- in vitro - Lat. "im Reagenzglas". Prozesse, die außerhalb des Organismus ablaufen in vivo - Lat. „im Lebewesen“. Prozesse, die im lebenden Organismus ablaufen Lymphozyten - Für die Immunabwehr verantwortliche Zellen Matrix - Von Zellen abgesonderte Schicht unterschiedlicher Stoffklassen Passage - hier: Das Umsetzen von Zellen von einem Kulturgefäß in ein anderes zum Zwecke der Vermehrung der Zellen PCR - Engl. „Polymerase Chain Reaction“, Methode zur Amplifikation (Verfielfältigung) bestimmter DNA- oder RNA-Bereiche mittels hitzeresistenter Enzyme Primer - kurze, synthetisch herstellte einzelsträngige DNA-Moleküle von ca. 17-30 Oligonukleotide); die beiden Primer eines PCR-Systems flankieren jeweils einen definierten DNAAbschnitt (Zielsequenz=Template), so dass nur dieser Abschnitt in der PCR amplifiziert (verfielfältigt) wird. Protein - aus Aminosäuren aufgebautes Eiweißmolekül (Genprodukt). Proteolyse - Aufspaltung von Proteinen durch proteolytische Enzyme Sterilität - Abwesenheit von Keimen und Mikroorganismen Leitfaden für den Ferienkurs – 3 Glossar Seite 32 T-Lymphozyten - Thymus-abgeleitete immunkompetente Zellen T-Zelle - Kurzbezeichnung für T-Lymphozyten Virologie - Lehre von den Viren Zellkulturassays – experimentelle Ansätze zum Nachweis bestimmter Zellfunktionen Zelllinie - Aus einer Zellkultur hervorgegangene Nachkommen, die identisch sind und stets unter definierten Bedingungen weitergezüchtet werden Zentrifugieren - Stofftrennung durch die entstehende Fliehkraft auf Grund einer schnellen Drehbewegung Leitfaden für den Ferienkurs – 4 Anhang Seite 33 4 Anhang 4.1 Sicherheitslabor Klasse L4 Ausführung: Größe ca. 35 m2 mit separatem Raum, speziell für Tierversuche. Höchste biologische Sicherheitsstufe (L4). Das Labor ist durch ein spezielles Schleusensystem zu betreten. Die drei Zugangstüren verriegeln sich wechselseitig. Im Inneren herrscht ein Unterdruck von -50 Pascal, so dass keine Luft nach draußen gelangen kann. Der Unterdruck wird durch vier unabhängig voneinander arbeitende erzeugt und durch ein drehzahlabhängiges Zuluftgebläse reguliert. Zuluft und Abluft werden durch doppelte Hochleistungsschwebefilter steril gehalten. Bei Stromausfall sorgt ein Notstromaggregat für die Aufrechterhaltung des Unterdrucks. Materialien werden durch einen Doppeltür-Autoklaven (120° C Lösungsmittelprogramm) entsorgt, dessen Türen sich wechselseitig nur jeweils nach einem Autoklavierungsvorgang öffnen lassen. Es befinden sich keine Abflüsse im Labor. Die gesamte Inneneinrichtung hat abgerundete Kanten, der Fußboden besteht aus versiegeltem Beton, die Fenster sind aus Panzerglas. Die Anschlüsse für die Luftzufuhr der arbeitenden Personen befinden sich im Abstand von 1,5 m voneinander. Insgesamt sind 3 Notfallalarmknöpfe vorhanden. Die Alarmanlage außerhalb des L4-Labors gibt einen nicht überhörbaren Signalton im gleichen Geschoss sowie in der virologischen Abteilung von sich. Der Alarm läuft ebenfalls beim Pförtner auf. Im Inneren des Labors befindet sich eine Überwachungskamera, die eine direkte Überwachung der arbeitenden Personen auf zwei, in verschiedenen Labors angebrachten Monitore ermöglicht. Im hinteren Bereich gibt es eine Durchreiche, die Türen können nur wechselseitig nach einer Sterilisationszeit von 3 Minuten geöffnet werden. Alle Kühltruhen, Zu- und Abluftmechanismen sind über eine Alarmanlage gesichert. Zugangsregelung zum Labor: Das Betreten des Labors ist grundsätzlich nur nach einer bestimmten Einweisung und Ausbildung der erfogt über einen Schlüssel, der in einem Tresor liegt. Die Kombination des Tresors ist nur zugangsberechtigten Personen bekannt. Das Labor darf nur in einem luftdicht abgeschlossenen Anzug (Material: PVC) betreten werden. Dieser Anzug wird im ersten Schleusenraum angezogen und mit Atmungsluft über ein Schlauchsystem aufgeblasen. Die einzuatmende Luft läuft über ein Entfeuchtungsgerät, das die Atmungsluft gleichzeitig temperiert und gelangt dann über vier Kohlefilter in den Anzug. Die überschüssige Luft entweicht über ein Ventil. Die Luftzufuhr kann von der arbeitenden Person über einen Hahn selbst reguliert werden. Das Labor kann nur über eine Säuredusche verlassen werden. Die Dusche arbeitet mit 1,5% Peressigsäure über 3 Minuten. Anschließend wird 5 Minuten mit Wasser nachgewaschen. Das Duschwasser (Essigsäure) wird mit Natronlauge neutralisiert. Bundesweiter Notdienst Wenn in Deutschland und Europa Verdachtsfälle von hämorrhagischem Fieber oder anderen exotischen, hochansteckenden Erkrankungen auftreten, so ist die Belastung für die Betroffenen und das öffentliche Gesundheitssystem enorm. Eine schnelle und zuverlässige Diagnostik sorgt im günstigsten dass der Verdacht ausgeschlossen und die aufwendigen Quarantänemaßnahmen für Patient und Kontaktpersonen aufgehoben werden können. Daher ist der virologische Bereitschaftsdienst am Bernhard-Nocht-Institut unter der zentralen Rufnummer 040/4 28 18-0 rund um die Uhr zu erreichen. Durch die Rufbereitschaft vergingen im Durchschnitt nur 6 Stunden vom Eintreffen der Probe bis zur Diagnose. Dies bedeutet aber auch, dass notfalls in der Nacht oder am Wochenende im Hochsicherheitslabor gearbeitet werden muß. In den letzten drei Jahren wurde der virologische Bereitschaftsdienst durch das Auftreten mehrerer Verdachstfälle von viralem hämorrhagischen Fieber innerhalb Europas und nicht zuletzt durch die asiatische Lungenentzündung SARS im Schnitt ca. 30 Mal pro Jahr in Anspruch genommen. Leitfaden für den Ferienkurs – 4 Anhang Seite 34 4.2 Sicherheitsstufen Gruppe 1 Biostoffe, bei denen es unwahrscheinlich ist, dass sie beim Menschen eine Krankheit verursachen. Beispiele: Erreger von Pflanzenkrankheiten (Pflanzenviren, Rhizobien) Erreger von Krankheiten, die auf Tiere beschränkt sind (Bacillus thuringiensis) Milchsäurebakterien Bäckerhefe Gruppe 2 Biostoffe, die eine Krankheit beim Menschen hervorrufen können und eine Gefahr darstellen können. Eine Verbreitung des Stoffes in der Bevölkerung ist unwahrscheinlich. Eine wirksame Vorbeugung Beispiele: Legionellen Salmonellen Masernvirus Influenzavirus Gruppe 3 Biostoffe, die schwere Krankheit beim Menschen hervorrufen und eine ernste Gefahr darstellen können. Die Gefahr einer Verbreitung in der Bevölkerung kann bestehen, doch ist normalerweise eine wirksame Vorbeugung oder Behandlung möglich. Beispiele: Pest (Yessina pestis) Tuberculose (Mycobact. tuberculosis) Anthrax (Bacillus anthracis) HIV BSE (Bovine Spongiforme Encephalopathie, Rinderwahn) FSME (Frühsommer-Meningo-Enzephalitis, Gehirnhautentzündung) Malaria (Plasmodium falciparum) Gruppe 4 Biostoffe, die eine schwere Krankheit beim Menschen hervorrufen und eine ernste Gefahr darstellen. Die Gefahr einer Verbreitung in der Bevölkerung ist u.U. groß, normalerweise ist eine wirksame Vorbeugung oder Behandlung nicht möglich. Beispiele: Lassavirus Pockenvirus Ebolavirus