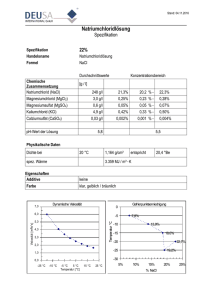
Korrektur der Formel auf S. 227 im Skriptum
Werbung

Skriptum Chemie I, 2016/2017 Seite 227 Kapitel 10, Flüssigkeiten und Feststoffe W. Wegscheider Verwendung der Einheitszellen. Wenn wir die Struktur der Einheitszelle einer Verbindung kennen, können wir diese verwenden, um andere Eigenschaften des Festkörpers abzuleiten. Eine besonders chemisch wichtige Anwendung ist die Bestimmung der Avogadrozahl aus der Messung der Dichte eines Feststoffes. Beispiel. Bestimmung der Avogadrozahl aus der Kristallstruktur Die Dichte von Natriumchlorid ist 2.163 g/cm3 und die Kantenlänge der Einheitszelle in Steinsalz ist 564.1 pm. Verwenden Sie diese Information um die Avogadrozahl auszurechnen. Anleitung. Die Avogadrozahl, NA, ist die Zahl der Einheiten pro Mol, in diesem Fall die Zahl der NaCl-Formeleinheiten pro Mol NaCl. Da wir von vorhin wissen, dass wir 4 NaCl-Formeleinheiten pro Einheitszelle haben, können wir die Anzahl der Formeleinheiten pro m3 berechnen. Als nächstes können wir mit der Dichte die Zahl der Formeleinheiten pro Gramm rechnen. Unter Verwendung der Molmasse können wir schließlich die Zahl der Formeleinheiten pro Mol Natriumchlorid berechnen. Lösung: Die Umrechnungen, die wir brauchen, werden aus dem Volumen der Einheitszelle abgeleitet: 1 Einheitszelle = (564.1 pm)3 Der Umrechnungsfaktor von Volumen auf Masse unter Verwendung der Dichte ist 1 cm3 NaCl = 2.163 g NaCl und die Umrechnung von Masse auf Mole mit der Molmasse von NaCl ist 58.44 g NaCl = 1 Mol NaCl. Die Gesamtumrechnung ist daher: Zahl der Formeleinheiten/Mol = 4 NaCl 1 Einheitsze lle 1 pm 3 10 2 m 3 1 cm 3 NaCl 58.44 g NaCl ) * * * * ( ) *( Einheitsze lle (564.1 pm) 3 1 cm 2.163 g NaCl 1 mol NaCl 10 12 m = 6.021 * 1023 NaCl pro Mol Übung. Wiederholen Sie die Bestimmung der Avogadrozahl mit den Angaben, dass die Dichte von Cäsiumchlorid 3.988 g/cm3 beträgt und die Einheitszelle ein Würfel mit der Kantenlänge von 411 pm ist. (Antwort: 6.08 * 1023 Cäsiumchlorid/mol) Andere Arten von Festkörpern Kleine synthetische Diamanten mit ca. 350 µm Durchmesser. Die Atome in netzartigen Festkörpern sind mit ihren Nachbarn durch kovalente Bindungen, die sich auf den gesamten Kristall erstrecken, verbunden. Vernetzte Verbindungen haben die Stärke von kovalenten Bindungen, die sie verknüpfen und sind daher sehr harte steife Materialien mit hohen Schmelz- und Siedetemperaturen. Im Gegensatz dazu haben molekulare Feststoffe - Feststoffe, die aus einzelnen Molekülen bestehen - oft niedrige Schmelzpunkte, da nur wenig thermische Bewegung vonnöten ist, um die relativ schwachen intermolekularen Kräfte aufzubrechen, die diese Moleküle fixieren. Titantetrachlorid (TiCl4) z.B. ist eine Flüssigkeit, die bei 136°C siedet und bei –25°C zu einem molekularen Festkörper friert. Der Festkörper besteht aus tetraedrischen TiCl4-Einheiten, die weitgehend durch Londonkräfte zwischen den elektronenreichen Chloratomen zusammengehalten werden. Nicht alle molekularen Festkörper sind weich: Saccharose, eine spröder Festkörper, ist ein molekularer Festkörper, bei dem die C12H22O11 Moleküle durch Wasserstoffbrücken-