Übungsblatt 4
Werbung

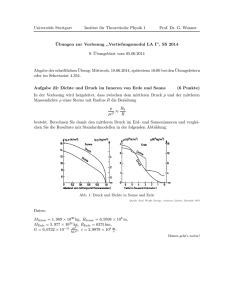
Übungen zur ”Physik der kondensierten Materie I” Prof. D. Grundler WS11/12 Blatt 4 Abgabe bis Donnerstag, 17.11.2011. Besprechung der Aufgaben von 21.11.11 - 25.11.2011. Aufgabe 4.1 Edelgaskristalle besitzen eine fcc-Struktur. Die Bindung wird durch ein Lennard-Jones Potential verursacht: σ 12 σ 6 U (r) = 4ε , − r r dabei ist r der Abstand zwischen zwei Atomen. (a) Geben Sie die Gesamtenergie Utot eines Edelgaskristalls aus N Atomen an. (b) In einem Experiment an Ne-Kristallen wurden ein Gleichgewichtsabstand zwischen nächsten Nachbarn r0 = 3.13 Å und eine Bindungsenergie von 20 meV pro Atom gemessen. Bestimmen Sie ε und σ, d.h. die Muldentiefe bzw. den Nulldurchgang der Funktion U (r) (c) Berechnen Sie für Neon das Kompressionsmodul K = −V ∂p . ∂V Hilfe: Die benötigten Gittersummen der fcc-Struktur sind A12 = 12, 131 und A6 = 14, 454. Aufgabe 4.2 Ein Ionenkristall (z. Bsp. NaCl) wird häufig durch Evjen-Zellen beschrieben. Dabei wird der Kristall gedanklich in Zellen zerlegt, die nach außen hin keine Ladung tragen, aber die ursprüngliche Kristallstruktur besitzen. Ionen an den Ecken, Kanten und Außenflächen des Gitters werden „zerschnitten“, werden also nur als Bruchteile von Ladungen gesehen (siehe Bild). Die Gesamtenergie der Bindung wird oftmals in guter Näherung geschrieben als: 1 αe2 A E(r) = −N − n (1) 4π0 r r wobei α die Madelungskonstante darstellt, die die CoulombWechselwirkung zwischen den geladenen Ionen beschreibt. Der zweite Term beschreibt die abstoßende Wechselwirkung. N ist die Anzahl der Ionenverbindungen und r ist der Abstand nächster Nachbarn. (a) Bestimmen Sie den Exponenten n. Benutzen Sie dazu das Kompressionsmodul (Definition in Aufgabe 1) K = 24.42 GPa, die Madelungskonstante α = 1.75 und den Abstand nächster Nachbarn in NaCl r0 = 2.81Å. Hilfe: Im thermodynamischen Gleichgewicht kann die Relation dE = −pdV verwendet werden, mit E als Energie des Systems. Benutzen dE Sie die Gleichgewichtsbedingung dr = 0. 0 (b) Bestimmen Sie unter Zuhilfenahme von Aufgabe 4.2a die Bindungsenergie pro Ionenbindung. Vergleichen Sie mit Literaturwerten.