Word Pro - Mathieu Hauck
Werbung

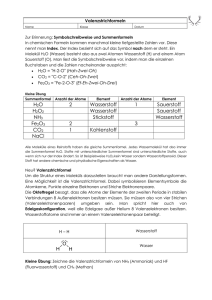
Prüfungsvorbereitung CHemie 1. Teil der organischen Chemie 1. Wie viele Verbindungen kennt man in der anorganischen Chemie und in der organischen ? _______________ ________________ Beispiel: 2. Warum gibt es so viele organische Moleküle, obwohl nur recht wenige Atome sich verknüpfen? Welche Atome kommen überwiegend (nach der Häufigkeit geordnet!) in organ.Verbindungen vor ? 3. Was ist der Grund dafür, dass aus diesem recht geringen Atomvorrat so viele verschiedene Moleküle entstehen können? Das immer in organischen Molekülen vorkommende Atom ______________ hat einige herausragende Eigenschaften, die diese Fülle an organischen Molekülen ermöglicht: a) es ist ____________wertig, das heißt, es kann vier Bindungen zu vier einwertigen Atomen knüpfen (z.B. CH4 ) oder zwei Bindungen zu zwei zweiwertigen Atomen z.B. CO2 - dies ist aber kein organisches Molekül !) b) es kann sich mit anderen Atomen entsprechend der Wertigkeit verknüpfen : CH3 Cl ( das ist das ____________________________________________), CH2 O (das ist das _____________________________________________), CH3OH (das ist das _____________________________________________). c) es kann mit anderen ___ - Atomen sich zu einer langen Kette, Ringen oder verzweigten Molekülstrukturen verknüpfen . Beispiel : ein Kohlenwasserstoff mit sechs C-Atomen Länge: C C -C-C-C-C-C-C- C C C C -C-C-C-CC C Name: __________________________ Name:____________________ Name:_________________ _________________________ Summenformel:____________ Summenformel: __________________ Summenformel: __________ Prüfungsvorbereitung CHemie 1. Teil der organischen Chemie 4. Wie kann man die organische Chemie von der anorganischen Chemie unterscheiden ? Alte Definition, die vor der synthetischen Herstellung des Harnstoffs galt: Moderne Definition (allgemein gültig): 5. Da ursprünglich die organischen Verbindungen tatsächlich nur in Lebewesen vorkamen, findet man in Umbauprodukten von Lebewesen auch eine Vielzahl organischer Moleküle. So findet man vor allem im eine unvorstellbare Vielfalt organischer Verbindungen. Man schätzt, dass nahezu alle organischen Verbindungen darin vorkommen, die meisten sind nachgewiesen, jährlich kommen viele neuentdeckte hinzu. Es ist daher ein wichtiges Argument gegen den blinden, verschwenderischen Verbrauch von Erdöl als Rohstoff, dass darin viele Stoffe enthalten sind, die einfach zu schade zum Verbrennen (Autofahren, Kunststoffherstellen...) sind und uns anderweitig wichtiger sein könnten ! 6. Wie trennt man nun diese unvorstellbare Vielfalt von Stoffen im Erdöl , um ein halbwegs einheitliches (immer noch unüberschaubares ! ) Stoffgemisch ähnlicher Eigenschaften zu erhalten. Eine Möglichkeit ist die Destillation - Stoffe mit ähnlichen Siedepunkten haben meist auch ähnliche Eigenschaften. max. Vakuumdestillation Atmosphärische (oder fraktionierte) Destillation ( bei normalen Druckverhältnissen) 400° ( unter reduziertem Druck) C geringster Siedepunkt : Gase < 30° Benzine um 100° Mitteldestillate: Kerosin, Peroleum 200° Heizöl 300° höchster Siedepkt: schweres Heizöl >400° Trennung des Schweren Heizöls in Schmieröle und Rückstand Bitumen Bei Druckverminderung wird * der Siedepunkt bis zu 150 ° herabgesetzt ! * Auf dem Mount Everest (wo der Luftdruck geringer ist als bei Normalnull oder auch bei uns im Schwarzwald siedet Wasser deutlich unter 100 ° C, da die Wassermoleküle weniger stark zurückgehalten werden ! 7. Warum erhitzt man zur weiteren Trennung das Schwere Heizöl nicht über 400° C ? Die im schweren Heizöl enthaltenen Moleküle sind lange Kohlenstoffverbindungen. Diese langen Ketten würden bei einer Erwärmung auf über 400 ° so sehr in Bewegung geraten, dass sie unkontrolliert in kürzere Moleküle ___________________________. 8. Aufbau eines Destillationsturmes mit Glockenböden, wo die entsprechenden Stoffe der dort unterschrittenen Siedetemperatur wieder flüssig werden und sich ansammeln. Prüfungsvorbereitung CHemie 1. Teil der organischen Chemie Umweltaspekt: Hoher Energieverbrauch bei der Destillation ! Häufig wird das in großen Mengen entstehende Gas (ungenutzt) abgefackelt anstatt es aufzufangen. 9. Cracken - Benzingewinnung aus langkettigen Alkanen (von geringem Bedarfswert; z.B. Schweres Heizöl oder Bitumen) Das Argument aus Frage 7 wird nun in kontrollierter Weise genutzt: Erhitzt man langkettige Kohlenwasserstoffe ( z.B. Schweres Heizöl) zerbrechen die langen Ketten in kürzere unter anderem auch in die Alkane der Benzine ( Hauptbestandteil z.B. Heptan !) Thermisches Cracken bei rund 600° C Nachteil: Hoher Energieverbrauch, geringe Ausbeute Katalytisches Cracken (Katalysator) <600° Vorteil: Größere Ausbeute und geringerer Nebenaspekt: Unter den Crackprodukten befinden sich sowohl Alkane als auch Alkene! w Welche Crackprodukte könnten aus diesem Molekül entstehen ? -C-C-C-C- 10. Die homologe Reihe der ALKANE Alkane bestehen nur aus ________________ und ____________________ - es gibt nur _____________________bindungen ! w Zähle die homologe Reihe auf ! Zustandsform Gas a) __________________ ( Summenformel:_____________________) b)__________________ ( Summenformel:_____________________) c)__________________ ( Summenformel:_____________________) d)__________________ ( Summenformel:_____________________) e)__________________ ( Summenformel:_____________________) f)__________________ ( Summenformel:_____________________) g)__________________ ( Summenformel:_____________________) h)__________________ ( Summenformel:_____________________) i)__________________ ( Summenformel:_____________________) j)__________________ ( Summenformel:_____________________) Flüssigkeit Prüfungsvorbereitung CHemie 1. Teil der organischen Chemie Ab Heptadecan (C17 H36) sind die Alkane fest ! Sogenannte Paraffine (Stoffgemische!) 11. Alkaneigenschaften : w Dichte _________________ als Wasser-----> schwimmen ______ Fett ! w Alle Alkane sind brennbar ----> doch je länger die Kette desto mehr ___________________ bei der Verbrennung ! w Sie sind in Wasser nicht löslich (da unpolar! oder hydrophob) 12. Allgemeine Bildungs- C formel ALKANE: H 13. Isomerie bei ALKANEN - gleiche ______________________ aber unterschiedliche _____________________ : Längerkettige Alkane können verschiedene Strukturen einnehmen, obwohl sie dieselbe Summenformel haben (doch leicht veränderten physikalischen Eigenschaften)! C6H14 kann folgende Strukturen haben - es sind die Isomeren des n-Hexans (bitte die exakte Benennung verwenden !) C - C - C - C- C- C- - C - C - C- C- C C C - C - C - C- C- C- - C - C - C- C- C C 14. Wie heißen diese möglichen "Abzweige" ( ALKYL"GRUPPEN")von einer Grundkette ? C ___________________ C C C C C __________________ __________________ C C C _____________ C Prüfungsvorbereitung CHemie 1. Teil der organischen Chemie H CH H H H C-C-C-C-C-C HH H H H H H H H H ___________________________ H c -c - c - c - c- c - c c c 1 2 3 4 5 6 c -c - c - c - c- c - c c c 1 2 3 4 5 6 __________________________ C7 __________________________ c c c c - c - c - c- c - c - c c c 1 2 3 4 5 c c - c - c - c- c - c c c c c8 4 3 2 1 6 7 ____________________________ 5 6 7 __________________________ Prüfungsvorbereitung CHemie 1. Teil der organischen Chemie 17. Molekulargewichtsberechnungen bei Alkanen - Alkenen - Alkinen oder bei ALKANOLEN bzw. Alkansäuren : C= 12 u H= 1 u O = 16 u ! 18 ALKENE - ein oder mehrere Doppelbindungen im Kohlenwasserstoffmolekül -------------- > größere Reaktionsbereitschaft ---------------> Nachweis über die Brom - Addition ------ > Dibrom -ALKAN C-C-C C-C-C Br Br Br Br _________________________ + Br2 --------------------->_____________________________ Brom ist ein farbiger Stoff, nach der Addition an das Alken zum Alkan ist diese Färbung verschwunden! Nachweis einer vormals vorhandenen Doppelbindung (Additionsmöglichkeit) am Molekül. 19 ALKENE mit mehreren Doppelbindungen im Molekül : - C - C - C- C- C- C C C - C- C- C- C C dien dien 19. AlkineEigenschaften: Sehr reaktionsfreudige Verbindungen ! - C - C- C- C- C C in - C - C- C- C- C C in 20 . Halogenalkane: Ausgehend von dem Grundalkan (z.B. Methan ) wird durch Substitution (Ersetzung eines Wasserstoffatoms durch ein Halogen z.B. Chlor) eine Molekülveränderung herbeigeführt. Prüfungsvorbereitung CHemie 1. Teil der organischen Chemie H H H Energie C H + Cl2 ----------> H Methan + Chlor (molekular) -------> C Cl Cl C Cl H ( Mono)Chlor-Methan H Cl + + Chlorwasserstoff (Gas) H H H H Cl Cl C Cl Cl C Cl Cl Cl 21. Wie heißt dieser Stoff mit dem Handelsnamen (eingetragenes Warenzeichen der Bayer ? AG) ? F Cl C Cl F 22. Von den ALKANEN führt der Weg über eine OXIDATION weiter zu den Alkoholen (ALKANOLEN) H H C H + H H 1/2 02 -----------> H − + C O H H unpolare Alkylgruppe polare Hydroxylgruppe Methan + Sauerstoff (atom)-----> Methanol Alkoholeigenschaften: Obwohl von der Masse her recht kleine Moleküle, haben sie doch einen hohen Siedepunkt. Warum ? ____________________________________________ _________________________________________________________________________ Prüfungsvorbereitung CHemie 1. Teil der organischen Chemie 22. Alkohole sind in Benzin löslich (unpolares Lösungsmittel). Diese Lösung vermitteln sie mit ihrem unpolaren Alkylrest, die kurzen Alkohole sind bis Butanol (einschließlich) in Wasser löslich (polares Lösungsmittel), dies vermittelt die polare OH-Gruppe ! + H 23. Das Wassermolekül und seine Polarität. Beschreibe: ____________________________________ + H ____________________________________ ____________________________________ 24. Warum ist ein so kleines und massearmes Molekül wie Wasser flüssig und nicht gasförmig ? Die Molekülmasse des Wassers beträgt __________ u . + H + H + H + H + H + H + H + H + H + H + H + H Auch das Ethanmolekül hat die gleiche polare Gruppe wie das Wassermolekül , es ist an dieser Stelle der OH- Gruppe polar (hydrophil = wasserfreundlich oder auch lipophob= fettunfreundlich/fettunlöslich). Zusätzlich besitzt das Ethanolmolekül noch eine unpolare (hydrophobe =wasserfeindliche oder auch lipophile= fettfreundliche) ALKYL-Gruppe. Hier ist die Elektronenverteilung völlig gleichmäßig. Bei den längerkettigen AlkohoH H len ab Pentanol überwiegt die polare Gruppe: Sie sind nicht H C C O H mehr wasserlöslich, nur noch fettH H löslich (hydrophob) ! 24. Isomerie bei Alkoholen (ALKANOLEN): Die Lage der OH-Gruppe und unverzweigtes oder Verzweigtes ! - C - C - C- C- C- - C - C - C- C- C- - C - C - C- C- CO-H C O-H C O-H C Prüfungsvorbereitung CHemie 1. Teil der organischen Chemie 25. Mehrwertige Alkohole - Alkohole mit mehreren OH-Gruppen Das 1,2 Ethandiol (Glykol) ist ein solcher mehrwertiger Alkohol (ein süßlich schmeckender Stoff zum Panschen von Wein schon oft verwandt ! + als Frostschutzmittel !) Das 1,2,3 Propantriol (Glyzerin) ist ein solcher mehrwertiger Alkohol ( Verwendung in Kosmetika und zum Geschmeidighalten von Kunststoffdichtungen) Sorbit ist ein zahnfreundlicher Süßstoff, der aber leicht abführend wirkt. Sein Name ist Hexanhexol: Alkohole wirken reduzierend - das heißt, sie entnehmen einem anderen Stoff__________________________________ und werden dabei _____________________________________. Ag NO3 + Alkohol ------------------------------> _______________+ __________________ 26. Die funktionelle Gruppe der Alkohole ist die _______________________gruppe. 27. Was bedeutet die funktionelle Gruppe ? _______________________________________ __________________________________________________________________________ 28. Die weitere Oxidation der ALKANOLE führt zu : _______________________________ H H H C O H Methanol H + 1/2 O2 ------> H C O H O H Methandiol = instabiles Zwischenprodukt (Regel: nicht mehr als eine OH-Gruppe an einem C - Atom ! Bitte wenden !! Prüfungsvorbereitung CHemie 1. Teil der organischen Chemie H H H C O H Wasserabspaltung -----------------------> H C O freie Bindung ! O H H H H Methanal C oder O C Fromaldehyd ( ein gutes Desinfektionsmittel) O funktionelle Gruppe der ALKANALE 30 Eine weitere OXIDATION der ALKANALE führt zu den Alkansäuren / Carbonsäuren H + 1/2 O2 C ------> R O HO-H C O R= Rest (z.B. H bei Methansäure; CH3 bei Ethansäure..) 31. Warum sind Alkansäuren "Säuren" im klassischen Sinne ? a) Sie bilden in wässriger Lösung ________________ und ___________________________ b) pH-Wert ________________________________ 7. c) Sie reagieren mit ___________________________ zu _____________ und ___________. Prüfungsvorbereitung CHemie 1. Teil der organischen Chemie 32. Dissoziationsgleichung von _________________________ in Hydro(xo)nium-Ionen und neg. Säurerest (___________________) O C-C-C-C − + O - H+ H O 2 ---------> H3O + + neg. Säurerest-Ion 33. Langkettige Alkansäuren nennt man ______________________________________. Sie sind auch zunehmend (je nach Kettenlänge) fest. 34. Bei den C18 -langen Carbonsäuren gibt es mehrere Carbonsäuren - mit unterschiedlicher Summenformel und unterschiedlichen physikalischen Eigenschaften: Stearinsäure (_C___H___COOH_) , Ölsäure (_C__H__COOH_) , Linolsäure(_C___H___COOH_) und der Linolensäure (_C___H___COOH_) 35. Was versteht man unter gesättigten Fettsäuren, was unter ungesättigten Fettsäuren ? 36. Ich gebe zu einer Alkansäure eine Lauge. Was passiert ? Es entsteht ein __________ und __________ bildet sich (Neutralisationsgleichung). 37 . Fülle die Reaktionsgleichungen vollständig aus ! ____ CH3 COOH + ____ Mg --------------> _____________ + Magnesium -------------> _____ ___________________ + ______ Magnesium-______________ + ________ ____ C2H5COOH + ___ NaOH -------------> ______ _________________ + _______ _____________ + ____________---------> ______ C17 H33 COOH + Na _____________ + Natrium ________________________ + ________ --------> ____ ____________________ + ________ -------------> Natrium-______________ + ________ Ich werfe Natriumbutanoat (Natriumsalz der Butansäure) in Wasser. Ich sehe die vormals feststellbaren Körnchen nicht mehr. Warum ?