erhötes Anforderungsniveau 11/I
Werbung

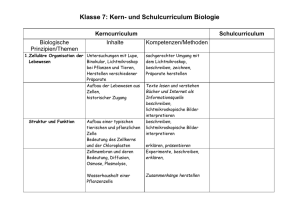
Schulcurriculum CBG Chemie 11/I erhöhtes Anforderungsniveau Zeit Thema Inhalt Prozess- und inhaltsbezogene Kompetenzen Vernetzungen Experimente/Bemerkungen Energetik und Gleichgewichtsreaktionen in Natur und Technik 22 ThermoBedeutung energetische erklären makroskopische Erscheinungen der • Bio P2 7/8 Fette, Kohlen- Internetrecherche dynamik Vorgänge in Natur und chemischen Reaktion mithilfe der submikroshydrate, Eiweiße Gesellschaft kopischen Betrachtungsweise (Merkmale einer - Energiegehalt von Lebens- Experimente • Erster Hauptsatz der Thermo- chemischen Reaktion), beurteilen chemische mitteln (kalorimetrische endo- und exotherme dynamik (EnergieerhaltungsReaktionen energetisch unter Nutzung des Ersten Bestimmung durch einfache Lösungsvorgänge von Salzen satz) Hauptsatzes der Thermodynamik, Experimente) oder besser und 1 • Enthalpie als Reaktionswärme definieren Enthalpie als Reaktionswärme bei • PH P3 7/8: Temperatur, Neutralisationsreaktion im bei konstantem Druck (Lösungs- konstantem Druck, thermische Energie und Kalorimeter enthalpie,Neutralisationsenthalp unterscheiden Enthalpiearten (Reaktions-, Wärme ie, Verbrennungsenthalpie, Bildungs-, Verbrennungs- und Lösungsenthalpie) Bildungsenthalpie) sowie molarer und nichtmolarer Größen, • Ermitteln der Reaktionswärme wenden die Kalorimetrie als Methode zur durch Kalorimetrie Bestimmung von Reaktionsenthalpien an und • Berechnung der Enthalpie planen die entsprechenden Experimente, nach dem Satz von Hess nutzen tabellierte Daten zur Berechnung von • Entropie, freie Enthalpie Standardreaktionsenthalpien aus (Berechnung mit GibbsStandardbildungsenthalpien bewerten die Helmholtz -Gleichung), gesellschaftliche Relevanz verschiedener Ableitung von Aussagen zum Energieträger freiwilligen Ablauf chemischer berechnen Reaktionsentropien und leiten Reaktionen Aussagen aus den Werten ab, leiten Voraussagen über den freiwilligen Verlauf chemischer Reaktionen ab und bestimmen den Wahrheitsgehalt dieser Aussagen mittels der GIBBS-HELMHOLTZ-Gleichung 1 Festigung und Lernerfolgskontrolle Schulcurriculum CBG Chemie 11/I erhöhtes Anforderungsniveau Zeit Thema Inhalt 22 Kinetik • Reaktionsgeschwindigkeit und deren Beeinflussung • Merkmale des chemischen Gleichgewichtes • Massenwirkungsgesetz • Berechnungen von Kc bzw. der Konzentrationen der Stoffe im Gleichgewicht für Δv = 0 • Anwendung des Prinzips von LeChatelier) 1 Prozess- und inhaltsbezogene Kompetenzen • vergleichen den Geschwindigkeitsbegriff in Alltags- und Fachsprache, • erkennen und beschreiben die Bedeutung unterschiedlicher Reaktionsgeschwindigkeiten alltäglicher Prozesse, • Einflüsse verschiedener Faktoren auf die Geschwindigkeit chemischer Reaktionen • Katalysatoren und beurteilen deren Einsatz in technischen Prozessen, • Merkmale des chemischen Gleichgewichtes, • chemische GG auf Stoff-und Teilchenebene, • Lage des chemischen Gleichgewichtes anhand • Wirtschaftlichkeit der GG-Konstante, (einschließlich technologischer • berechnen Kc bzw. die Konzentrationen der Prinzipien: Gegenstromprinzip, Stoffe im Gleichgewicht und nutzen das MWG kontinuierliche und unter anderem zur Diskussion der diskontinuierliche ArbeitsReaktionsführung technischer Synthesen weisen, Kreislaufprinzip) und • formulieren Voraussagen über die Änderung ökologische Folgen einer der Gleichgewichtslage durch Druck-, Temausgewählten technischen peratur- und Konzentrationsänderung (Prinzip Synthese von LE CHATELIER), Möglichkeiten der Steuerung chemischer Reaktionen durch Variation von Reaktionsbedingungen, Bedeutung der Beeinflussung von Gleichgewichten in der chemischen Industrie und in der Natur Durchführung und technische Prinzipien einer ausgewählten technischen Synthese (HABER-BOSCH-Verfahren), incl Diskussion Wirtschaftlichkeit und ökologische Folgen Festigung und Lernerfolgskontrolle Vernetzungen Experimente/Bemerkungen Enzyme als Biokatalysatoren im menschlichen Organismus (z. B. Katalase) (Bio Klasse 9, RLP4.1 und 4.5) • PHP6 7/8: Gleichförmige Bewegungen Planung und Durchführung von Experimenten zum Einfluss von Faktoren auf die Reaktionsgeschwindigkeit Geschichte, WAT Internetrecherche -Katalysatoren SE Hebermodell Experiment zur Verschiebung der Lage des chemischen Gleichgewichtes (Iodstärke) Stickoxidampulle DE Chromat-DichromatGleichgewicht, Kohlensäure-Gleichgewicht am Beispiel Ammoniaksynthese Film zum Haber-BoschVerfahren und seiner Bedeutung für die Landwirtschaft „Dünger aus der Luft“ (→ Uwe) Schulcurriculum CBG Chemie 11/I erhöhtes Anforderungsniveau Zeit 25 Thema Inhalt Prozess- und inhaltsbezogene Kompetenzen Vernetzungen Experimente/Bemerkungen SäureBaseGleichgewichte • Säure-Base-Theorie nach BRØNSTEDals DonatorAkzeptor-Reaktion • Ionenprodukt des Wassers • pH-Wert und Indikatoren • Berechnungen von pHWerten sehr starker, starker und schwacher Protolyte sowie von Salz-Lösungen • Puffersysteme (qualitative Betrachtungen) • Säure-Base-Titrationen, einschließlich Auswertung von Titrationskurven (starke und schwache einprotonige / einwertige Protolyte) • recherchieren zu Säuren und Basen in AlltagsTechnik- und Umweltbereichen und präsentieren ihre Ergebnisse, • beschreiben die Säure-Base-Theorie nach BRØNSTED als Donator-Akzeptor-Reaktion, • leiten das Ionenprodukt des Wassers aus der Autoprotolyse des Wassers her, • definieren den Begriff pH-Wert und erläutern den Zusammenhang zum Ionenprodukt des Wassers, • berechnen pH-Werte sehr starker, starker und schwacher Protolyte sowie pH-Werte von SalzLösungen und ermitteln diese experimentell unter Verwendung geeigneter Indikatoren, • reflektieren die Bedeutung von pH-WertAngaben in ihrem Alltag, • recherchieren exemplarisch zu Puffergleichgewichten in Umwelt und biologischen Systemen und präsentieren ihre Ergebnisse, • führen Säure-Base-Titrationen durch und berechnen Konzentrationen, Massen und Stoffmengen der Titranden, • werten Titrationskurven aus. • Bio P4 7/8 Säure-BaseHaushalt des Blutes (Puffersysteme) Bio P3 7/8//PI 9/10 Zellatmung und Kohlenstoffdioxid SE Ermitteln von pHWerten mit Methylorange, Methylrot, Bromthymolblau, (Phenolphthalein ?) 4 Analytik Ionen-Nachweise: Wesen Fällungsreaktionen Wesen Farbreaktionen 1 Festigung und Lernerfolgskontrolle 3 Klausur DE Wirkung einer Pufferlösung HCOOH oder CH3COOH + NaOH, • Titration einprotoniger Säuren und einwertiger Basen SE HCl, HNO3 + NaOH, KOH Ionen-Nachweise: Halogenid-, Sulfat-, Carbonat-, Hydronium-, Hydroxid- und AmmoniumIonen Schulcurriculum CBG Chemie 11/II erhöhtes Anforderungsniveau Zeit Thema Inhalt Prozess- und inhaltsbezogene Kompetenzen Vernetzungen Experimente/Bemerkungen PH Sek.II RLP 4.3: Quantenobjekte und atomare Systeme DE Reaktivität der Elemente (Na, Li, K, Mg, Ca + H2O) Elektrochemie in Alltag und Technik 8 Atombau /PSE Elektronenkonfiguration der Haupt- und Nebengruppenelemente beschreiben und erläutern den Bau der Atome unter Angabe von Elektronenkonfigurationen, 12 Redoxreaktionen Redoxreaktionen als Donator-Akzeptor-Reaktionen, Vergleich mit Säure-BaseReaktionen pH-abhängige Redoxreaktionen entwickeln Teil- und Gesamtgleichungen für Redoxreaktionen (auch pH-abhängig), wenden Fachbegriffe zur Redoxreaktion an vergleichen Redox- mit Säure-Base-Reaktionen und interpretieren diese als Donator-AkzeptorReaktionen, Experimente: Nachweisreaktionen: Fe3+/Fe2+/Cu2+-Ionen pH-abhängige Redoxr. mit KMnO4; thermisches Zersetzen von KMnO4; (Na2S2O3 + AgNO3, Br2, I2) 1 Festigung und Lernerfolgskontrolle 40 Elektrochemie erläutern chemische und technische Grundlagen der Umwandlung von chemischer in elektrische Energie und umgekehrt, planen Experimente zur Aufstellung der Redoxreihe der Metalle und führen diese durch leiten aus der elektrochemischen Spannungsreihe begründete Voraussagen über den Verlauf von Redoxreaktionen ab und überprüfen diese experimentell, beschreiben den Bau und erklären die Arbeitsweise einer galvanischen Zelle, einer Brennstoffzelle und eines Akkumulators, bestimmen und berechnen die Zellspannung einer galvanischen Zelle auch unter Verwendung der NERNSTschen Gleichung, erläutern die Vorgänge bei der elektrochemischen Korrosion unter Verwendung geeigneter Experimente (Ionennachweise, Lokalelement) und leiten geeignete Experimente: Zementation SE Spannungsreihe mit Haargel Bau eines galvanischen Elementes und Messung der Zellspannung SE "Obstbatterien" SE Schwefelsäureakku Elektrochemische Spannungsreihe prinzipieller Bau und Arbeitsweise einer galvanischen Zelle und deren Anwendung bei einem Primär- und Sekundärelement sowie bei einer Brennstoffzelle Berechnung der Zellspannung Anwendung der NERNSTschen Gleichung für Metallsalzlösungen der Konzentrationen c < 1 mol · L-1 Elektrochemische Korrosion, Lokalelement, Korrosionsschutz (aktiv und passiv) Theoretische Grundlagen der Elektrolyse und Lokalelement (Korrosion) (Fe, Cu, Zn in Lösung mit Nachweis der Reaktionsprodukte) DE aktive, passive Korrosion FE, Mg Anwendung an einem ausgewählten Beispiel Vergleich Elektrolysezelle und galvanische Zelle 2 Festigung und Lernerfolgskontrolle 3 Klausur Korrosionsschutzmaßnahmen ab, bewerten wirtschaftliche und ökologische Folgen der Korrosion unter dem Aspekt der Nachhaltigkeit, erörtern und bewerten Methoden des passiven und aktiven Korrosionsschutzes, beurteilen die Elektrolyse als Verfahren zur Gewinnung wichtiger Rohstoffe vor dem Hintergrund knapper werdender Ressourcen, planen und führen selbstständig die Elektrolyse einer Salz-Lösung durch und werten diese aus, beurteilen und bewerten den Einsatz elektrochemischer Energiequellen. SV „KorrosionKorrosinsschutz“ Film „Elektrolyse“ „Akte Alu“ SE Elektrolyse (NaI, Na2SO4) Schulcurriculum CBG Chemie 12/I erhöhtes Anforderungsniveau Zeit Thema Inhalt Prozess- und inhaltsbezogene Kompetenzen Vernetzungen Experimente/Bemerkungen erklären Stoffeigenschaften anhand ihrer Kenntnisse über intra- und intermolekulare Wechselwirkungen diskutieren Reaktionsmöglichkeiten funktioneller Gruppen erkennen und beschreiben die Bedeutung von Kohlenhydraten und Proteinen in ihrer Lebenswelt erörtern und bewerten die Nutzung nachwachsende Rohstoffe vor dem Hintergrund knapper werdender Ressourcen beschreiben die Chiralität als Ursache für die optische Aktivität, begründen die Zuordnung und die Einteilung der Kohlenhydrate auf der Grundlage von Strukturmerkmalen, geben die Strukturformeln der Monosaccharide Glucose und Fructose als Grundbausteine biologisch wichtiger Makromoleküle in der FISCHER- und HARWORTH-Projektion an, untersuchen die chemischen Eigenschaften von Kohlenhydrate, Prinzip der Kondensationsreaktion an und erläutern die glykosidische Bindung unter Verwendung von HARWORTHProjektionsformeln, Vorkommen und die Bedeutung von Stärke und Cellulose und untersuchen deren Eigenschaften, führen experimentell eine Hydrolyse durch und weisen die Spaltprodukte nach, Bio P2 7/8 Ernährung und Verdauung Bio P2 7/8 // P1 9/10 Nährstoffnachweise Bio P1 7/8// P2 9/10 Bau von Samenpflanzen Bio P1 9/10 Glucose als Reaktionsprodukt der Fotosynthese Bio P 2 7/8 Aufbau von Makromolekülen aus Monomeren in pflanzlichen und tierischen Organismen Bio P3 7/8 Biologische Oxidation Experimente: Nachweisreaktionen: FEHLING-, TOLLENS-, SELIWANOW-Reaktion Natürliche Makromolekulare Stoffe I 40 2 Kohlenhydrate FISCHER -Projektion am Beispiel von Glucose, Fructose Chiralität und optische Aktivität Beschreibung der Umwandlung von Kettenform in Ringform (HARWORTH -Formel) anhand gegebener Strukturen Einteilung und Bedeutung von Kohlenhydraten Struktur, Eigenschaften und Nachweisreaktionen von Monosacchariden (Glucose, Fructose), Disacchariden (Saccharose, Maltose), Polysacchariden (Stärke, Cellulose) Festigung und Lernerfolgskontrolle (Achtung: immer frische Kolenhydrat-Lösungen verwenden!!) DE Polarimeter und seine Funktionsweise Hydrolyse eines Kohlenhydrats mit Nachweis der Spaltprodukte Schulcurriculum CBG Chemie 12/I erhöhtes Anforderungsniveau Zeit Thema Inhalt Prozess- und inhaltsbezogene Kompetenzen Vernetzungen Experimente/Bemerkungen leiten die Eigenschaften ausgewählter biogener Aminosäuren ab (optische Aktivität, Schmelztemperatur, Löslichkeit, Säure-BaseEigenschaften, Pufferwirkung, NinhydrinReaktion), stellen die Primärstruktur eines Peptids aus vorgegebenen Aminosäuren dar (Wdh. Substitution, Kondensation) und erläutern die Sekundär-, Tertiär- und Quartärstruktur von Proteinen, führen Nachweisreaktionen für Proteine durch, erklären Denaturierungsvorgänge und deren Bedeutung aufgrund experimenteller Untersuchungen, (Bezug zu Bindungsarten) begründen die Funktion biologisch wichtiger Stoffe aus dem räumlichen Bau ihrer Moleküle (Stärke, Cellulose, Enzyme) kennzeichnen Polymere als makromolekulare Stoffe, die aus gleichen oder verschiedenen Monomeren bestehen können, Bio P1 9/10// Bio, Sek. II, RLP 4.1 und 4.5: Enzyme als Biokatalysatoren im menschlichen Organismus Bio P3 9/10 // Bio, Sek. II, RLP 4.1 und 4.7: Proteinbiosynthese Bio P6 7/8 Immunabwehr Bio P4 7/8 Blutgruppeneigenschaften Experimente: Nachweisreaktionen: Aminosäuren: Ninhydrin-Reaktion Protein: Biuret- und XanthoproteinReaktion Natürliche Makromolekulare Stoffe II 32 Proteine Aminosäuren: Einteilung, Struktur, Eigenschaften (einschließlich Bildung von Zwitter-Ionen, Pufferwirkung und Peptidbildung) und Nachweis Proteine: Einteilung, Struktur, Denaturierung und Nachweisreaktionen Kondensation und Hydrolyse 2 Festigung und Lernerfolgskontrolle 5 Klausur unter Abiturbedingungen Ch 11/1 Säure/Base (Wdh. Brönstedt, Titration) Ausgewählte Experimente zur Denaturierung von Eiweißen (Temperatur, Schwermetalle, Säuren, Basen, Alkohole) evtl. Wdh. SE „Katalase in Kartoffel“ (mit Centstück) Schulcurriculum CBG Chemie 12/II erhöhtes Anforderungsniveau Zeit Thema Inhalt Prozess- und inhaltsbezogene Kompetenzen Vernetzungen Experimente/Bemerkungen wenden geeignete Modelle zum Beschreiben und Erklären der Zusammenhänge zwischen Licht und Farbe an und diskutieren die Grenzen der Anwendbarkeit von Modellen, leiten begründete Voraussagen über die Farbigkeit der Stoffe auf der Grundlage ihrer Struktur ab, erläutern mithilfe des Chromophor- und Mesomeriemodells Beziehungen zwischen chemischer Struktur und Farbigkeit anhand gegebener Strukturen, PH Sek.II RLP 4.3: Quantenobjekte und atomare Systeme 4.6: Elektromagnetische Induktion, Schwingungen und Wellen 4.7: Quantenobjekte und atomare Systeme Flammfärbung beschreiben Indikatoren als schwache Säuren und Basen beschreiben Funktion von Säure-BaseIndikatoren nutzen Tabellen zur Auswahl eines geeigneten Indikators für Titration führen qualitative Untersuchungen mit Indikatorfarbstoffen durch, begründen die Farbänderungen von Indikatorfarbstoffen bei Donator-AkzeptorReaktionen. Ch 11/1 Experimente: Einfluss von Säuren und Basen auf Indikatorfarbstoffe Ch 11/1 Blue-Bottle-Experiment Indikatorfarbstoffe 12 Licht und Farbe Licht und Farbe (elektromagnetisches Spektrum, Komplementärfarbe, additive und subtraktive Farbmischung) Zusammenhang zwischen Struktur und Farbe (Theorie nach WITT) 18 Säure-Base- Anwendung der Farbtheorie Indikatoren auf Indikatoren Säure-BaseIndikatoren: Phenolphthalein und Methylorange Redoxindikator: Methylenblau 2 Festigung und Lernerfolgskontrolle 3 Klausur