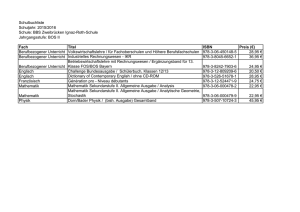
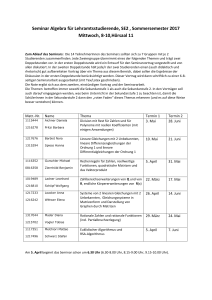
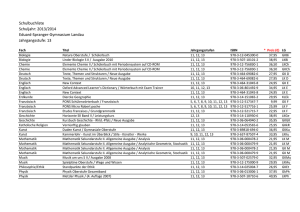
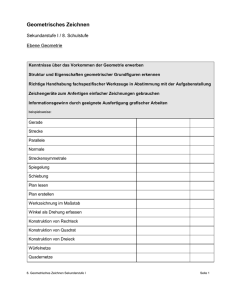
Die Inhalte werden im Unterricht zur Einübung der entsprechenden
Werbung

Städtisches Mädchengymnasium Essen-Borbeck Schulinterne Absprachen Sekundarstufe II CHEMIE Jahrgangsstufe EF In der Einführungsphase der gymnasialen Oberstufe soll in besonderer Weise einerseits die Arbeit der Sekundarstufe I fortgeführt werden, andererseits sollen wichtige grundlegende Basiskonzepte im Mittelpunkt stehen (vgl. Aufgaben und Ziele des Fachs). Dazu gehören neben dem Energiekonzept insbesondere das Stoff-Teilchen-, Struktur-Eigenschaft-, das Donator-Akzeptor- sowie das Gleichgewichtskonzept. In der ersten Stunde erfolgt neben einem Überblick über Inhalte und Bewertungsgrundlagen (s.u.) wie in jeder Jahrgangsstufe die obligatorische Sicherheitsbelehrung, mit Eintrag in die Kursmappe und Einholen der Schülerunterschrift. Durch die Zusammenlegung der Schülerinnen verschiedener Klassen und neuer Schülerinnen von Real- oder anderen Schulen in Kurse, wird zur Angleichung des Basiswissens ein Stationenlernen zur Wiederholung für die Oberstufe relevanter Inhalte aus der Sekundarstufe I (Atombau, Periodensystem, Bindungsarten, zwischenmolekulare Kräfte) durchgeführt. Intensiver als in der Sekundarstufe I soll im Anschluss tiefergehendes chemisches Grundlagenwissen und ein naturwissenschaftlich fundiertes Weltverständnis durch Verknüpfung mit interessanten Kontexten erworben werden. Daraus folgt, dass die Erarbeitung von Sachkenntnissen mit der Vermittlung von Fachmethoden wie dem naturwissenschaftlichen Erkenntnisweg und experimentellen Techniken verknüpft werden soll (wissenschaftspropädeutische Ausrichtung). Diese verstärkte Zielsetzung soll in der Eingangsphase schrittweise in den Blick genommen werden. Das soll dadurch erfolgen, dass an verschiedenen Stellen nicht nur das Wissen, sondern auch die Verfahren, wie man zu dem Wissen gekommen ist, thematisiert werden. Das eingeführte Lehrbuch Elemente Chemie für die Einführungsphase bietet dazu Hilfen. Inhaltlich ergeben sich folgende Inhaltsfelder (gemäß den Vorgaben aus dem Kernlehrplan für die SEKII Gymnasium/Gesamtschule in NRW): Inhaltsfeld 1: Kohlenstoffverbindungen und Gleichgewichtsreaktionen Dick gedruckt sind die obligatorischen Inhalte und Methoden Vorgaben Organische Stoffklassen Inhalte (mit notwendigen Grundlagen und Methoden) Homologe Reihen, IUPAC-Regeln, Strukturisomerien (Gerüst- und Positionsisomerie) Anwendung der Atom- und Bindungsmodelle auf organische Moleküle Eigenschaften der Alkohole (Siedetemperaturen, Schmelztemperaturen, Polarität, Löslichkeit) und deren Begründung (zwischenmolekulare Kräfte) Oxidation von primären u. sekundären Alkoholen Alkanale, Alkanone Nachweisreaktionen für die Stoffgruppen (u.a. GC) Oxidationszahlen bei organischen Verbindungen und Redoxreaktionen Alkansäuren, Eigenschaften und Bedeutung Möglicher Freiraum zu Alkansäuren: Integrierte Wdh.: Säuren/Laugen, einfache Titrationen Veresterung als Kondensationsreaktion und Ester als Aromastoffe, Eigenschaften, Bedeutung Herstellung verschiedener Düfte Trennverfahren: Extraktion, Wasserdampfdestillation Möglicher Freiraum: Gemeinsamer Gäransatz zur Weinherstellung aus Obst Fächerübergreifende Ansätze: z.B. Deutsch: Das Parfüm von P. Süßkind, Biologie: Gärung, Enzyme oder Sozialwissenschaften: Alkoholismus und Gesellschaft, Berechnung des Blutalkoholgehalts und Wirkung des Alkohols, Entstehung des „Katers“ Städtisches Mädchengymnasium Essen-Borbeck Schulinterne Absprachen Sekundarstufe II CHEMIE Gleichgewichtsreaktionen Anorganische Kohlenstoffverbindungen Ansatz einer Veresterung und einer Esterhydrolyse Integrierte Wdh.: stöchiometrisches Rechnen: Mol, molare Masse, Stoffmenge, Stoffmengenkonzentration Bestimmung der Gleichgewichtskonzentrationen Gesetzmäßigkeiten des chemischen Gleichgewichts Experimentell erarbeitete Definition der Reaktionsgeschwindigkeit als Differenzquotient (c/ t), Einfluss von verschiedenen Parametern: u.a. Katalysatoren (Auswertung von Graphen, Energie-ReaktionswegDiagramm), Oberfläche, Konzentration, Temperatur Abhängigkeit des chemischen Gleichgewichts v. Druck, Temperatur, Konzentration und Katalyse Untersuchung verschiedener Gleichgewichte Nanochemie des Kohlenstoffs: Struktur, Eigenschaften und Vergleich von Graphit, Diamant und Fullerenen Chancen und Risiken der Nanotechnologie Der Kohlenstoffdioxid-Carbonat-Kreislauf ausgewählte Säuren und Basen, anorganische Verbindungen Kohlensäure, Carbonate, Abläufe in Tropfsteinhöhlen Möglicher Freiraum: Selbstlern-Flashanimationen zum Kalkkreislauf, Entstehung einer Tropfsteinhöhle unter: http://www.chemie-interaktiv.net/flashfilme.htm#tropfstein Versauerung von Ozeanen durch steigende CO2-Konzentration im Rahmen der globalen Erwärmung, Versuche, Film „Quarks & Co Auf Tauchfahrt: Wie gesund sind unsere Meere?“ Unterrichtsziele: 1. Sicheres, verantwortungsvolles Arbeiten beim Experimentieren 2. Vertiefung und Anwendung experimenteller Nachweismethoden 3. Problemorientiertes Lernen – eigenständige Entwicklung von Fragestellungen und Problemlösungen (naturwissenschaftlicher Erkenntnisweg) 4. Teamarbeit/ Projektarbeit, aber auch selbständiges Lernen und Arbeiten (Recherche, Präsentationen) 5. Verbesserung der selbstständigen Analyse (Beobachtung und Deutung von Versuchen) sowie der Protokollführung 6. Anwendung von chemischen Fachbegriffen und Arbeitsweisen (z.B. Verwendung der IUPACNomenklatur, Benennung von Oxidationszahlen, Ableitung und Berechnung der Gleichgewichtskonstanten) Konkretisierte Kompetenzerwartungen: Nicht nur Graphit und Diamant – Erscheinungsformen des Kohlenstoffs nutzen bekannte Atom- und Bindungsmodelle zur Beschreibung organischer Moleküle und Kohlenstoffmodifikationen (E6). stellen anhand von Strukturformeln Vermutungen zu Eigenschaften ausgewählter Stoffe auf und schlagen geeignete Experimente zur Überprüfung vor (E3). erläutern Grenzen der ihnen bekannten Bindungsmodelle (E7). beschreiben die Strukturen von Diamant und Graphit und vergleichen diese mit neuen Materialien aus Kohlenstoff (u.a. Fullerene) (UF4). Städtisches Mädchengymnasium Essen-Borbeck Schulinterne Absprachen Sekundarstufe II CHEMIE recherchieren angeleitet und unter vorgegebenen Fragestellungen Eigenschaften und Verwendungen ausgewählter Stoffe und präsentieren die Rechercheergebnisse adressatengerecht (K2, K3). stellen neue Materialien aus Kohlenstoff vor und beschreiben deren Eigenschaften (K3). bewerten an einem Beispiel Chancen und Risiken der Nanotechnologie (B4). Kohlenstoffdioxid und das Klima – Die Bedeutung der Ozeane unterscheiden zwischen dem natürlichen und dem anthropogen erzeugten Treibhauseffekt und beschreiben ausgewählte Ursachen und ihre Folgen (E1). führen qualitative Versuche unter vorgegebener Fragestellung durch und protokollieren die Beobachtungen (u.a. zur Untersuchung der Eigenschaften organischer Verbindungen) (E2, E4). dokumentieren Experimente in angemessener Fachsprache (u.a. zur Untersuchung der Eigenschaften organischer Verbindungen, zur Einstellung einer Gleichgewichtsreaktion, zu Stoffen und Reaktionen eines natürlichen Kreislaufes) (K1). nutzen angeleitet und selbstständig chemiespezifische Tabellen und Nachschlagewerke zur Planung und Auswertung von Experimenten und zur Ermittlung von Stoffeigenschaften (K2). erläutern die Merkmale eines chemischen Gleichgewichtszustands an ausgewählten Beispielen (UF1). beschreiben und erläutern das chemische Gleichgewicht mithilfe von Modellen (E6). formulieren Hypothesen zur Beeinflussung natürlicher Stoffkreisläufe (u.a. KohlenstoffdioxidCarbonat-Kreislauf) (E3). erläutern an ausgewählten Reaktionen die Beeinflussung der Gleichgewichtslage durch eine Konzentrationsänderung (bzw. Stoffmengenänderung), Temperaturänderung (bzw. Zufuhr oder Entzug von Wärme) und Druckänderung (bzw. Volumenänderung) (UF3). formulieren Fragestellungen zum Problem des Verbleibs und des Einflusses anthropogen erzeugten Kohlenstoffdioxids (u.a. im Meer) unter Einbezug von Gleichgewichten (E1). veranschaulichen chemische Reaktionen zum Kohlenstoffdioxid-Carbonat-Kreislauf grafisch oder durch Symbole (K3). recherchieren Informationen (u.a. zum Kohlenstoffdioxid-Carbonat-Kreislauf) aus unterschiedlichen Quellen und strukturieren und hinterfragen die Aussagen der Informationen (K2, K4). beschreiben die Vorläufigkeit der Aussagen von Prognosen zum Klimawandel (E7). beschreiben und bewerten die gesellschaftliche Relevanz prognostizierter Folgen des anthropogenen Treibhauseffektes (B3). zeigen Möglichkeiten und Chancen der Verminderung des Kohlenstoffdioxidausstoßes und der Speicherung des Kohlenstoffdioxids auf und beziehen politische und gesellschaftliche Argumente und ethische Maßstäbe in ihre Bewertung ein (B3, B4). Leistungsbewertung: 1. Mitarbeit im Unterricht (mündliche Beteiligung) 2. Praktisches Arbeiten: Fähigkeiten im sachgerechten Umgang mit den Geräten, mitdenkende Vorgehensweise bei den Versuchsdurchführungen, Beachtung von Sicherheitsaspekten 3. Eigenständiges Organisieren und späteres Aufräumen der benötigten Versuchsmaterialien bzw. – geräte (ggf. nach Absprache) 4. Qualität von Hausaufgaben und Präsentationen 5. Klausurschreiber: 50% 1-4, 50 % Klausurergebnisse (eine Klausur pro Halbjahr) Benötigte Materialien: Schnellhefter/Ordner, Schreibzeug, Folienstift (wasserlöslich), Overhead-Folie, Edding, weitere benötigte Materialien wie Taschenrechner oder Speichermedien werden vorher angekündigt.