Bildverarbeitung im Fliegenhirn Image processing in the fly brain
Werbung

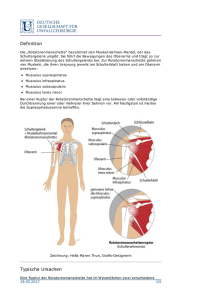
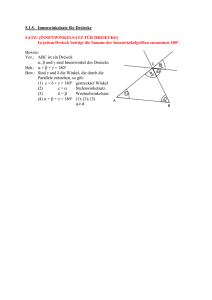
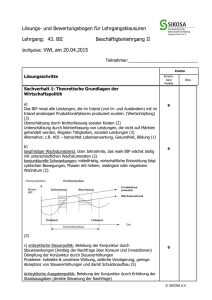
Jahrbuch 2014/2015 | Borst, Alexander | Bildverarbeitung im Fliegenhirn Bildverarbeitung im Fliegenhirn Image processing in the fly brain Borst, Alexander Max-Planck-Institut für Neurobiologie, Martinsried Korrespondierender Autor E-Mail: [email protected] Zusammenfassung Fliegen vollführen in Sekundenbruchteilen die unglaublichsten Flugmanöver – und verlassen sich dabei zum Großteil auf ihre Augen. Im Fliegenkopf sind mehr als die Hälfte der Nervenzellen mit dem Ausw erten und Verarbeiten der gesehenen Bilder beschäftigt. Mithilfe moderner genetischer Methoden gelang es in den letzten Jahren, die entsprechenden Schaltkreise bei der Fruchtfliege Drosophila in w ichtigen Teilen aufzuklären. Dabei ergaben sich erstaunliche Parallelen zu den neuronalen Verschaltungen, w ie man sie in der Netzhaut von W irbeltieren findet. Summary W hen flies perform their incredible aerobatic maneuvers, they rely, to a large extent, on visual cues. Accordingly, flies dedicate more than 50% of all their nerve cells to process the images coming from their large facet eyes. Thanks to the advent of sophisticated genetic methods available in the fruit fly Drosophila allow ing for targeting and manipulating individual nerve cells, recent years have seen much progress in our understanding of the neural circuits involved. The results reveal astonishing parallels to the ones found in the mammalian retina. Was wir "sehen", ist errechnet Wenn w ir die Augen öffnen und umherblicken, erkennen w ir in Sekundenbruchteilen, w o w ir uns befinden, und w issen, w elche Gegenstände uns umgeben. W ir erkennen ein Buch, sehen seine Farbe, w ir w issen, w ie w eit entfernt von uns das Buch steht. Alle diese Informationen sind zw ar in den Bildern vorhanden, die unser Gehirn von der Netzhaut empfängt, aber nicht explizit: Um diese Informationen zu erhalten, muss unser Gehirn rechnen. Dies w urde in vollem Umfang deutlich, als man das erste Mal versuchte, Computer so zu programmieren, dass sie, mit einer Kamera verbunden, die gleichen Informationen ausgeben, die w ir Menschen so leicht aus den Bildern lesen. W ie aber errechnet das Nervensystem die Informationen aus den Bildern, die von den Augen geliefert w erden? Diese Frage untersuchen die W issenschaftler in der Abteilung Schaltkreise – Information – Modelle am MPI für Neurobiologie am Beispiel des Bew egungssehens. Neben dem Erkennen von Gegenständen, der Tiefe im Raum und seiner Farbe ist Bew egung eine der w ichtigsten Bildinformationen: W ir benutzen Bew egungsinformation, um unseren Weg zu steuern, w ir benutzen sie, um © 2015 Max-Planck-Gesellschaft w w w .mpg.de 1/8 Jahrbuch 2014/2015 | Borst, Alexander | Bildverarbeitung im Fliegenhirn uns schnell auf den Gehsteig zu retten, w enn w ir beim Überqueren der Straße ein herannahendes Auto sehen, oder w ir benutzen sie, w enn w ir einen Ball fangen w ollen, der uns zugew orfen w ird. Warum die Fliege? Die Martinsrieder Forscher untersuchen dieses Problem aus mehreren Gründen am Sehsystem der Fliege: Zum einen ist die Fliege als schnell fliegendes Insekt auf Sehen und dabei speziell auf das Sehen von Bew egungen spezialisiert. Mehr als 50 Prozent aller Nervenzellen im Fliegengehirn sind einzig der Bildverarbeitung gew idmet. Zum anderen besteht das Gehirn der Fliegen aus nur w enigen 100 000 Nervenzellen. Dies ist im Vergleich zu den circa 100 Milliarden Nervenzellen des menschlichen Gehirns eine nahezu bescheidene Anzahl, w as die Analyse entscheidend erleichtert. Darüber hinaus steht der Forschung bei der Fruchtfliege Drosophila eine große Menge genetischer Methoden zur Verfügung, um Nervenzellen gezielt zu manipulieren: Dabei legt ein Gen fest, w elches Protein in der Zelle erzeugt w ird, ein anderer Genabschnitt legt die Adresse fest, also in w elcher Zelle dies geschehen soll. Die Möglichkeiten sind schier unerschöpflich: (i) Es gibt Proteine, w elche die Nervenzellen blockieren. Ist in Tieren, bei denen zum Beispiel Zelle A blockiert ist, die Reaktion auf Bew egungsreize deutlich gestört, w eiß man, das Zelle A am Bew egungssehen beteiligt ist. (ii) Andere Proteine erhöhen ihre Fluoreszenz, w enn die Nervenzelle aktiv ist. Damit lassen sich die Antw orten der Nervenzellen auf Bew egungsreize mit dem Mikroskop optisch messen. (iii) Schließlich können auch Proteine in die Zellen eingebracht w erden, w elche bei Belichtung die Zelle aktivieren. Diese ‚optogenetische‘ Methode erlaubt es, die Verschaltung zw ischen einzelnen Nervenzellen nachzuw eisen, indem man eine Zelle anregt und die Aktivität in der nachgeschalteten Zelle misst. Das Sehsystem der Fliege © 2015 Max-Planck-Gesellschaft w w w .mpg.de 2/8 Jahrbuch 2014/2015 | Borst, Alexander | Bildverarbeitung im Fliegenhirn A bb. 1: a .) Aufba u de s Se hsyste m s de r Flie ge (link s). Auf Be we gung e ine s Stre ife ns re a gie re n die Lichtsinne sze lle n una bhä ngig von de r R ichtung (obe n re chts); Ze lle n de r Lobula pla tte hinge ge n ze ige n richtungsse le k tive Signa le (unte n re chts). b.) Da s Ha sse nste in-R e icha rdt-Mode ll e ine s Be we gungsde te k tors be schre ibt de n Me cha nism us de s Be we gungsse he ns a uf e ine r a bstra k te n, m a the m a tische n Ebe ne . M=Multiplik a tor. c.) Die wichtigste n Ne rve nze lle n, die a n de r Ve ra rbe itung von Be we gungsinform a tion be te iligt sind. © Ma x -P la nck -Institut für Ne urobiologie / Borst, Schorne r Das Sehsystem der Fliege beginnt mit den großen Facettenaugen. In jeder Facette liegen acht Lichtsinneszellen. Anders als oft angenommen sieht dabei jede einzelne Facette nur einen kleinen Bildpunkt, liefert also zum Gesamtbild im Gehirn nur einen einzelnen Pixel. Der hinter den Augen liegende ‚optische Lobus‘ besteht aus vier Schichten von Nervenzellen, w elche sich in einzelne Kolumnen (Säulen) gliedern (Abb. 1a). Diese Kolumnen entsprechen in Anzahl und Anordnung genau den Facetten des Auges und enthalten ungefähr je 100 Nervenzellen. In der Fruchtfliege Drosophila gibt es ca. 750 Facetten pro Auge und entsprechend nur 750 solcher Kolumnen. Das Bild w ird also in lediglich 750 Pixeln im Gehirn repräsentiert. Bew egt sich nun ein Objekt von links nach rechts und w ieder zurück, antw ortet eine einzelne Lichtsinneszelle beide Male gleich (Abb. 1a). Offensichtlich ist die Information über die Bew egungsrichtung also nicht aus den Signalen einer einzelnen Lichtsinneszelle ablesbar. Geht man aber stattdessen zu einer der großen Tangentialzellen, die sich in der 4. Schicht, der sogenannten ‚Lobulaplatte‘ befinden, erhält man ein anderes Bild: Hier reagieren die Zellen auf Bew egung in eine Richtung mit einer elektrischen Erregung, auf Bew egung in die andere Richtung Verknüpfungsstellen mit w ird einer also Hemmung. aus den Die Signale sind richtungsunspezifischen richtungsselektiv. Signalen der Innerhalb w eniger Lichtsinneszellen ein richtungsselektives Signal errechnet. W ie kann das sein? Der Hassenstein-Reichardt-Detektor Schon vor mehr als 50 Jahren schlugen Bernhardt Hassenstein und Werner Reichardt ein Modell vor, w elches © 2015 Max-Planck-Gesellschaft w w w .mpg.de 3/8 Jahrbuch 2014/2015 | Borst, Alexander | Bildverarbeitung im Fliegenhirn genau dieses Phänomen erklärt (Abb. 1b). Um die zeitliche Abfolge der Signale in zw ei benachbarten Sinneszellen und damit die Bew egungsrichtung zu erkennen, w ird das Signal einer Lichtsinneszelle durch einen sog. Tiefpass-Filter zeitlich verzögert und anschließend mit dem nicht-verzögerten Signal der Nachbarzelle multipliziert. W ird diese Operation in zw ei zueinander spiegelbildlichen Einheiten durchgeführt und deren Signale anschließend voneinander subtrahiert, erhält man am Ausgang eine richtungsselektive Antw ort: Bew egt sich das Objekt von links nach rechts, ist die Antw ort positiv, bew egt sich das Objekt von rechts nach links, ist die Antw ort negativ, genau w ie das elektrische Signal der oben beschriebenen Zelle in der Lobulaplatte der Fruchtfliege. Das Modell beschreibt den Mechanismus des Bew egungssehens auf einer abstrakten, mathematischen Ebene. Dies ist ein großer Vorteil, w eil man mithilfe von Computersimulationen präzise Vorhersagen machen kann, w as man in den bew egungsempfindlichen Zellen der Lobulaplatte zu erw arten hat. Tatsächlich w urden auf diese Weise eine Vielzahl von Simulationen und Experimenten gemacht, w elche das Modell in allen Punkten bestätigten. Das Modell beschreibt also die Verschaltung zw ischen den Facettenaugen und der Lobulaplatte sehr exakt. Es sagt aber überhaupt nichts darüber aus, w elche Nervenzellen des optischen Lobus an dieser Verschaltung beteiligt sind. Die entsprechenden Schaltkreise blieben lange Jahre im Dunkeln. Erst in den letzten Jahren gelang es mithilfe der oben beschriebenen genetischen Methoden, die Nervenzellen zu identifizieren, die den verschiedenen Elementen des Hassenstein-Reichardt-Modells entsprechen und die Information über die Bew egungsrichtung aus den Bildern extrahieren (Abb. 1c). ON- und OFF-Kanäle © 2015 Max-Planck-Gesellschaft w w w .mpg.de 4/8 Jahrbuch 2014/2015 | Borst, Alexander | Bildverarbeitung im Fliegenhirn A bb. 2: Aufspa ltung de r prim ä re n Lichtinform a tion in O N- und O FF-Ka nä le . Be we gungsinform a tion wird in be ide n Ka nä le n se pa ra t be re chne t: Die La m ina ze lle L1 bilde t de n Einga ng zum O N-Ka na l, de r die Be we gungsrichtung von He ll-Ka nte n e rre chne t, die La m ina ze lle L2 bilde t de n Einga ng zum O FFKa na l, de r die Be we gungsrichtung von Dunk e l-Ka nte n e rre chne t. © Ma x -P la nck -Institut für Ne urobiologie / Borst, Schorne r In der ersten Schicht des optischen Lobus, der sogenannten ‚Lamina‘, kontaktieren die Lichtsinneszellen des Facettenauges in jeder Kolumne fünf verschiedene Lamina-Zellen, die w iederum mit unterschiedlichen Nervenzellen in der nächsten Schicht verbunden sind. Offensichtlich w ird die primäre Bildinformation also in verschiedene, parallele Kanäle geleitet und dort spezifisch w eiter verarbeitet. Welcher dieser Kanäle bildet den Eingang zum Bew egungs-Detektor? Diese Frage konnte durch gezielte Blockierung der verschiedenen Lamina-Zellen beantw ortet w erden [1]. W urde die Zelle L1 blockiert, w ar die Bew egungsantw ort auf ca. 50 Prozent reduziert, w urde die Zelle L2 blockiert, ebenfalls. W urden beide Zellen – L1 und L2 – blockiert, konnte keine Bew egungsantw ort mehr beobachtet w erden. Daraus konnte geschlossen w erden, dass L1 und L2 die Haupteingänge zum Bew egungsdetektor darstellen. Was aber w ar der Unterschied zw ischen den beiden Kanälen? Dies w urde deutlich, als die W issenschaftler statt regelmäßiger Muster Hell- und Dunkel-Kanten als Bew egungsreize verw endeten: Bei Blockierung von L1 w ar die Antw ort auf Hell-Kanten verschw unden, w ährend die Antw ort auf Dunkel-Kanten intakt w ar. Das umgekehrte w urde bei Blockierung von L2 beobachtet: Hier w ar die Antw ort auf Hell-Kanten intakt, w ährend die Antw ort auf Dunkel-Kanten gleich Null w ar. Diese und w eitere Experimente belegten, dass im Fliegengehirn die primäre Information über Helligkeit, je nach ihrer zeitlichen HelligkeitsÄnderung aufgespalten und in zw ei parallelen Kanälen analysiert w ird (Abb. 2): Die Laminazelle L1 bildet den Eingang zum ON-Kanal, der die Bew egungsrichtung von Hell-Kanten errechnet, die Laminazelle L2 bildet den Eingang zum OFF-Kanal, der die Bew egungsrichtung von DunkelKanten errechnet. T4- und T5-Zellen © 2015 Max-Planck-Gesellschaft w w w .mpg.de 5/8 Jahrbuch 2014/2015 | Borst, Alexander | Bildverarbeitung im Fliegenhirn A bb. 3: Signa le de r T4- (a ,a) und T5-Ze lle n (b,b). a ,b) T4Ze lle n re a gie re n spe zifisch nur a uf die Be we gung von He llKa nte n, T5-Ze lle n nur a uf die Be we gung von Dunk e l-Ka nte n. a,b) T4- und T5-Ze lle n glie de rn sich in vie r Unte rgruppe n. Je de die se r Gruppe n re a gie rt spe zifisch a uf e ine de r vie r Ha uptrichtunge n (re chts, link s, obe n, unte n) und projizie rt de m e ntspre che nd in e ine de r vie r Schichte n de r Lobula pla tte . © Ma x -P la nck -Institut für Ne urobiologie / Borst Bereits seit längerer Zeit legten anatomische Befunde zw ei Bahnen durch den optischen Lobus nahe: eine L1Bahn, w elche über sogenannte T4-Zellen in die Lobulaplatte geht, und eine L2-Bahn, die über sogenannte T5Zellen in das gleiche Zielgebiet führt. Daher w ar es naheliegend, im nächsten Schritt die Signale von T4- und T5-Zellen auf bew egte ON- und OFF-Kanten zu untersuchen. Dies gelang den W issenschaftlern im vergangenen Jahr [2] und belegte die oben beschriebene Aufspaltung in ON- und OFF-Kanäle eindrucksvoll (Abb. 3 a,b): W ährend T4-Zellen selektiv auf die Bew egung von ON-Kanten reagieren, sprechen T5-Zellen selektiv auf die Bew egung von OFF-Kanten an. Weiterhin zeigten die Untersuchungen, dass sich beide Zelltypen in je vier funktionelle Untergruppen aufteilen (Abb. 3 a,b): Eine Gruppe von T4/T5-Zellen reagiert maximal auf Bew egung von vorne nach hinten vor dem Fliegenauge und projiziert in die vorderste Schicht 1 der Lobulaplatte. Eine andere Gruppe reagiert maximal auf Bew egung von hinten nach vorne und projiziert in Schicht 2. Eine dritte Gruppe reagiert maximal auf Aufw ärtsbew egung und projiziert in Schicht 3, eine vierte Gruppe reagiert maximal auf Abw ärtsbew egung und projiziert in Schicht 4. In der Lobulaplatte läuft die Information der ON- und OFF-Kanäle w ieder zusammen: T4- und T5-Zellen kontaktieren gemeinsam in der entsprechenden Schicht die großen Tangentialzellen. Bei Blockierung von T4- oder T5-Zellen reagieren die Tangentialzellen spezifisch auf Hell- bzw . Dunkel-Kanten nicht mehr, genau so, als hätte man die Laminazellen L1 oder L2 blockiert. Diese Befunde sind in vielfacher Hinsicht erstaunlich. Zum einen gleicht der Aufbau des Bew egungsSehsystems bei der Fliege in mehreren Punkten der Informationsverarbeitung in der Netzhaut der W irbeltiere: Auch dort w erden die Signale der Lichtsinneszellen zunächst in parallele ON- und OFF-Kanäle aufgespalten und Bew egungsinformation in beiden Bahnen separat berechnet. Im nächsten Schritt w ird diese Information von ON- und OFF-Kanälen auf der Ebene von richtungsspezifischen Ganglion-Zellen zusammengebracht. W ie bei der Fliege existieren davon vier Untergruppen für die vier orthogonalen Hauptrichtungen. Dies ist umso erstaunlicher, als bei der Fliege die visuelle Umw elt zunächst in einem hexagonalen Raster vorliegt. Dennoch w ird an einer Stelle der Informationsverarbeitung von dem hexagonalen in ein orthogonales Koordinatensystem umgerechnet. Für all die genannten Gemeinsamkeiten scheint in der Evolution ein großer Selektionsdruck am W erke gew esen zu sein. © 2015 Max-Planck-Gesellschaft w w w .mpg.de 6/8 Jahrbuch 2014/2015 | Borst, Alexander | Bildverarbeitung im Fliegenhirn Zusammenfassung und Ausblick A bbildung 4: Ze llulä re r Scha ltpla n de s e le m e nta re n Be we gungsde te k tors be i de r Flie ge . TP = Tie fpa ss-Filte r. © Ma x -P la nck -Institut für Ne urobiologie / Borst Die Erforschung des Bew egungssehens bei der Fliege hat dank des Einsatzes genetischer Methoden erstaunliche Fortschritte gemacht. Heute ist bekannt, dass die Bew egungsrichtung in separaten ON- und OFFKanälen errechnet w ird und durch die T4- und T5-Zellen, sortiert nach den vier orthogonalen Hauptrichtungen, in der Lobulaplatte vorliegt (Abb. 4). Eine naheliegende Frage ist, ob T4- und T5-Zellen die einzigen bew egungsempfindlichen Zellen im Fliegengehirn sind. Oder gibt es dazu parallel noch andere Verarbeitungsbahnen, die auf visuelle Bew egung reagieren? Die klare Antw ort lautet: Nein. Werden beide Gruppen von Neuronen blockiert, sind die Fliegen absolut bew egungsblind. Sie reagieren w eder auf die Bew egungsrichtung großflächiger Muster, noch auf die Bew egungsrichtung kleiner Objekte. Eine große W issenslücke existiert aber immer noch: Was passiert zw ischen den Lamina-Zellen L1 und L2 und © 2015 Max-Planck-Gesellschaft w w w .mpg.de 7/8 Jahrbuch 2014/2015 | Borst, Alexander | Bildverarbeitung im Fliegenhirn den bew egungsempfindlichen T4- und T5-Zellen? Jüngste Untersuchungen haben eine Reihe von Neuronen identifiziert, w elche die L1-Zellen mit den T4-Zellen verbinden, ebenso diejenigen, w elche die L2-Zellen mit den T5-Zellen verbinden [3, 4]. Keine dieser Zellen zeigte aber eine spezifische Präferenz für eine bestimmte Bew egungsrichtung. T4- und T5-Zellen sind also die ersten Zellen in der Verarbeitungsbahn, w elche richtungsselektive Antw orten zeigen. Sie sollten somit dem Ausgang des Multiplikators des Modells entsprechen. Der entscheidende Schritt muss daher in der Verbindung zw ischen diesen Zellen und den T4bzw . T5-Zellen passieren. Momentan laufende Untersuchungen beschäftigen sich mit der Frage, w elche dieser Zellen dem verzögerten und w elche dem nicht-verzögerten Arm des Hassenstein-Reichardt-Detektors entsprechen. Die nächste, ebenso w ichtige Frage ist die nach dem biophysikalischen Mechanismus, der diese Signale miteinander multipliziert. Hier w erden zur Zeit zw ei Möglichkeiten diskutiert: Zum einen könnten die Signale sich multiplikativ verstärken, w enn die Bew egung entlang der Vorzugsrichtung der Zelle läuft (‚Vorzugsrichtungs-Verstärkung‘). Zum anderen könnten sich die Signale spezifisch auslöschen, w enn die Bew egung in die Gegenrichtung läuft (‚Nullrichtungs-Unterdrückung‘). Beide Mechanismen könnten formal w ie eine Multiplikation der Signale aussehen. Die Antw orten auf diese Fragen w erden in naher Zukunft dazu führen, dass w ir an einem einfachen Beispiel verstehen, w ie das Nervensystem auf der Ebene einzelner Nervenzellen und ihren präzisen Verknüpfungen eine neuronale Berechnung durchführt, die für das Überleben des Individuums von entscheidender Bedeutung ist. Literaturhinweise [1] Joesch, M.; Schnell, B.; Raghu, S.; Reiff, D. F.; Borst, A. ON and OFF pathways in Drosophila motion vision Nature 468, 300–304 (2010) [2] Maisak, M. S.; Haag, J.; Ammer, G.; Serbe, E.; Meier, M.; Leonhardt, A.; Schilling, T.; Bahl, A.; Rubin, G. M.; Nern, A.; Dickson, B. J.; Reiff, D. F.; Hopp, E.; Borst, A. A directional tuning map of Drosophila elementary motion detectors Nature 500, 212–216 (2013) [3] Shinomiya, K.; Karuppudurai, T.; Lin, T.-Y .; Lu, Z.; Lee, C.-H.; Meinertzhagen, I. A. Candidate neural substrates of Off-edge motion detection in Drosophila Current Biology 24, 1062–1070 (2014) [4] Takemura S.; Bharioke A.; Lu Z.; Nern A.; Vitaladevuni S.; Rivlin P. K.; Katz W. T.; Olbris D. J.; Plaza S. M.; Winston P.; Zhao T.; Horne J. A.; Fetter, R. D.; Takemura S.; Blazek, K.; Chang L.-A.; Ogundeyi O.; Saunders M. A.; Shapiro V.; Sigmund C.; Rubin G. M.; Scheffer L. K.; Meinertzhagen, I. A.; Chklovskii, D. B. A visual motion detection circuit suggested by Drosophila connectomics Nature 500, 175–181 (2014) © 2015 Max-Planck-Gesellschaft w w w .mpg.de 8/8