Chemie für Studierende mit Nebenfach Chemie
Werbung

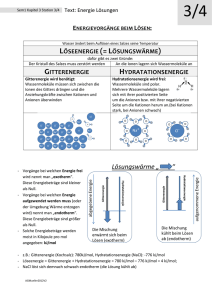
Allgemeine und Anorganische Chemie ___________________________________________________________________ 6. Übung zur Vorlesung Allgemeine Chemie Bachelor Plus MINT / Juniorstudium ______________________ Aufgabe 1: Airbags in Kraftfahrzeugen werden durch die Zerfallsreaktion von Natriumazid NaN 3 in seine elementaren Bestandteile gezündet: 2 NaN3(s) 2 Na(s) + 3 N2(g) a) Wie viel Liter Distickstoff N2 werden beim Zerfall von 5 g NaN3 gebildet? b) Wie viel Gramm NaN3 werden benötigt, um 10,0 g Stickstoff zu erzeugen? (relat. Atommassen [g/mol]: Na = 23,9898; N = 14,0067) _________________________________________________________________ Aufgabe 2: a) Erklären Sie die Oktettregel. b) Kann man die Oktettregel sowohl auf Ionen- als auch auf kovalente Verbindungen anwenden? Erklären Sie warum und zeigen Sie es an dem Beispiel MgO. ___________________________________________________________________ Aufgabe 3: Ordnen Sie die folgenden Bindungspaare nach zunehmender Polarität der Bindung an: a) C-F, O-F, Be-F b) O-Cl, S-Br, C-P c) C-S, B-F, N-O ___________________________________________________________________ Aufgabe 4: a) Definieren Sie den Begriff Gitterenergie. b) Welche Faktoren bestimmen die Größe der Gitterenergie einer Ionenverbindung? ___________________________________________________________________ Aufgabe 5: Warum bilden sich bei der Ionenverbindung keine Moleküle aus, sondern dreidimensionale Festkörperstrukturen? __________________________________________________________________________________ Aufgabe 6: Für welche Verbindung erwarten Sie die höhere Schmelztemperatur, für a) NaCl oder NaI, b) NaCl oder KCl? Begründen Sie Ihre Entscheidung. ___________________________________________________________________ Aufgabe 7: Warum zerspringt ein Salzkristall leicht bei einem Schlag mit dem Hammer, während Metall sich nur verformen? ___________________________________________________________________________ Aufgabe 8: Geben Sie die mögliche Anzahl von gebundenen und einsamen Elektronenpaaren um ein Zentralatom an, wenn die folgenden Winkel zwischen ihnen gegeben sind (Winkel sind idealisiert): a) 120° b) 180° c) 109,5° d) 90° und 120° __________________________________________________________________ Aufgabe 9: Welche dreidimensionalen Lewis-Formeln kommen den folgenden Verbindungen zu: a) BeCl2 c) SiF62d) SF4 e) PCl3 f) PH5 g) BF3 h) BrF3 i) AsCl4+ j) SbCl6___________________________________________________________________ Aufgabe 10: Erklären Sie, warum BrF4- quadratisch planar ist, während BF4- tetraedrisch ist. ___________________________________________________________________ Aufgabe 11: Zeigen Sie anhand der MO-Schemata, dass die Verbindungen NO und O2+ isoelektronisch zueinander sind.