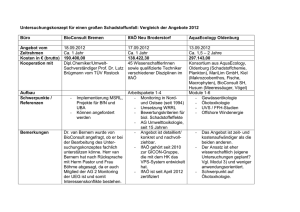
Wasserrechtliches Erlaubnisverfahren Kraftwerk
Werbung

Wasserrechtliches Erlaubnisverfahren Kraftwerk Herrenhausen und Heizkraftwerk Linden Teil C: Artenschutzrechtlicher Fachbeitrag März 2016 erstellt im Auftrag der Stadtwerke Hannover AG ARSU GmbH Escherweg 1 ▪ 26121 Oldenburg Auftraggeber: Stadtwerke Hannover AG Ihmeplatz 2 30449 Hannover Projekt: Wasserrechtliches Erlaubnisverfahren Kraftwerk Herrenhausen und Heizkraftwerk Linden Artenschutzrechtlicher Fachbeitrag zum Erlaubnisantrag Stand: 22.03.2016 Auftragnehmer: ARSU GmbH Arbeitsgruppe für regionale Struktur- und Umweltforschung Escherweg 1, D-26121 Oldenburg Tel.: 0441 / 971 74-97 Fax: 0441 / 971 74-73 Internet: www.arsu.de E-Mail: [email protected] Bearbeiter: Projektleitung Dipl.-Biologin Elith Wittrock Dipl.-Biologin Annette Lienemann Wasserrechtliches Erlaubnisverfahren für die Kraftwerke Herrenhausen und Linden I Inhaltsverzeichnis 0. Zusammenfassung ........................................................................................................3 1. Einleitung .......................................................................................................................6 2. Rechtliche und fachliche Grundlagen ..........................................................................7 3. 4. 2.1 Artenschutzrechtliche Verbote........................................................................................... 7 2.2 Anwendungsbereich .......................................................................................................... 8 2.3 Ausnahmemöglichkeiten ................................................................................................... 8 2.4 Kriterien und Beurteilungsmaßstäbe für die Bewertung der Verbotstatbestände............. 9 Artenschutzrechtliche Relevanz der Wirkfaktoren ....................................................10 3.1 Änderung der Strömungsverhältnisse/Wasserführung ................................................... 10 3.2 Entnahme von Organismen ............................................................................................. 11 3.3 Einleitung von Nähr- und Schadstoffen ........................................................................... 13 3.4 Einleitung von Wärme und Änderung des Sauerstoffgehalts ......................................... 18 3.5 Zusammenfassung der artenschutzrechtlich relevanten Wirkfaktoren ........................... 21 Bestandsbeschreibung ...............................................................................................22 4.1 Gewässersystem von Leine und Ihme ............................................................................ 22 4.2 Aktuelle Bestandserfassungen ........................................................................................ 24 4.2.1 Makrophyten in Leine und Ihme .................................................................................... 25 4.2.2 Makrozoobenthos in Leine und Ihme............................................................................. 25 4.2.3 Fische und Rundmäuler in Leine und Ihme ................................................................... 27 5. Relevanzprüfung .........................................................................................................29 6. Prüfung des Eintretens von Verbotstatbeständen ....................................................33 6.1 Prognose und Bewertung der Schädigung von besonders geschützten Fischen und Rundmäulern nach § 44 BNatSchG ......................................................................... 33 6.1.1 Werden wildlebende Tiere gefangen, verletzt, getötet oder ihre Entwicklungsformen aus der Natur entnommen, beschädigt oder zerstört? ................... 34 6.1.2 Fazit ............................................................................................................................. 36 6.2 Prognose und Bewertung der Schädigung von besonders bzw. streng geschützten Libellen nach § 44 BNatSchG ..................................................................... 36 6.2.1 Werden wildlebende Tiere gefangen, verletzt, getötet oder ihre Entwicklungsformen aus der Natur entnommen, beschädigt oder zerstört? ................... 36 6.2.2 Fazit ............................................................................................................................. 41 ARSU GmbH, Oldenburg 22.03.2016 II Artenschutzrechtlicher Fachbeitrag 6.3 Prognose und Bewertung der Schädigung von besonders bzw. streng geschützten Weichtieren nach § 44 BNatSchG .............................................................. 41 6.3.1 Werden wildlebende Tiere gefangen, verletzt, getötet oder ihre Entwicklungsformen aus der Natur entnommen, beschädigt oder zerstört? ................... 41 6.3.2 Fazit ............................................................................................................................. 43 7. Artenschutzrechtliches Fazit ......................................................................................44 8. Literaturverzeichnis.....................................................................................................45 Anhang 1: Ergänzende Angaben zur Relevanzprüfung Anhang 2: Beschreibung der relevanten Fische und Rundmäuler Anhang 3: Beschreibung der relevanten Libellen Anhang 4: Beschreibung der relevanten Weichtiere Verzeichnis der Abbildungen Abb. 1: Sauerstoffgehalt im Kühlwasserauslauf Herrenhausen .................................................... 20 Abb. 2: Bestandsuntersuchungen in Ihme und Leine im Raum Hannover .................................... 23 Verzeichnis der Tabellen Tab. 1: Stoffeinträge und –austräge durch die beantragte Wasserentnahme und –einleitung ....... 14 Tab. 2: Abschätzung der maximalen Konzentrationsänderungen in Gewässersystem von Ihme und Leine infolge der Stoffeinträge durch die beantragte Einleitung von Abwassernebenströmen in Linden und Herrenhausen ..................................................... 15 Tab. 3: Szenarien zur Untersuchungen der Wärme-Einleitung ..................................................... 19 Tab. 4: In Leine und Ihme nachgewiesene besonders und streng geschützte Muscheln und Libellen ........................................................................................................................... 27 Tab. 5: 22.03.2016 In Leine und Ihme nachgewiesene besonders und streng geschützten Fische und Rundmäuler .................................................................................................................... 28 ARSU GmbH, Oldenburg Wasserrechtliches Erlaubnisverfahren für die Kraftwerke Herrenhausen und Linden 0. 3 Zusammenfassung Der vorliegende artenschutzrechtliche Fachbeitrag für die beantragte Wasserentnahme und –einleitung für das Heizkraftwerk Linden, das Kraftwerk Herrenhausen und das Gemeinschaftskraftwerk Hannover der Stadtwerke Hannover AG basiert auf der Beschreibung der bestehenden und der beantragten Gewässerbenutzung sowie der Maßnahmen zur Vermeidung und Minimierung von Beeinträchtigungen im Teil A der naturschutzfachlichen Unterlagen. Der artenschutzrechtlichen Prognose liegt die Realisierung und Einhaltung dieser Vermeidungs- und Minimierungsmaßnahmen zugrunde. Artenschutzrechtliche Relevanz der Wirkfaktoren Als mögliche Wirkungen der beantragten Wasserentnahme und –einleitung in Linden und Herrenhausen werden identifiziert: Änderung der Strömungsverhältnisse/Wasserführung, Entnahme von Organismen, Einleitung von Nähr- und Schadstoffen, Einleitung von Wärme und Änderung des Sauerstoffgehalts. Die Analyse dieser Wirkfaktoren zeigt, dass die nutzungsbedingten Strömungsänderungen und die Einleitung von Nähr- und Schadstoffen unter Berücksichtigung der Vermeidungsmaßnahmen so gering sind, dass artenschutzrechtlich relevante Auswirkungen auf geschützte Organismen nicht zu besorgen sind. Auch die Einleitung von Wärme sowie die damit verbundene Minderung des Sauerstoffgehalts werden soweit begrenzt, dass artenschutzrechtlich relevante Wirkungen nicht zu erwarten sind. Als einziger artenschutzrechtlich relevanter Wirkfaktor der beantragten Gewässerbenutzung in Linden und in Herrenhausen wurde die mögliche Entnahme von Organismen mit dem Kühlwasser identifiziert. Sofern davon Individuen besonders geschützter Arten betroffen sind, würde dies den Verbotstatbestand nach § 44 Abs. 1 Nr. 1 bzw. Nr. 4 BNatSchG erfüllen und könnte außerdem den Zielen der Europäischen Aalverordnung bzw. des Aalbewirtschaftungsplans entgegenstehen. Das Eintreten anderer Verbotstatbestände kann bereits auf der Basis der Analyse der benutzungsbedingten Wirkfaktoren ausgeschlossen werden. Relevante Arten und Prognose Die Ermittlung der relevanten Arten erfolgte unter Berücksichtigung der vom Niedersächsischen Landesbetrieb für Wasserwirtschaft, Küsten- und Naturschutz (NLWKN) veröffentlichten Verzeichnisse der in Niedersachsen besonders oder streng geschützten Arten (THEUNERT 2008a, b) und der vorliegenden Bestandsinformationen, insbesondere der aktuellen Untersuchungen zur ökologischen Situation von Ihme und Leine (BIOCONSULT 2014, 2016b). Als relevante Artengruppen wurden die Fische und Rundmäuler sowie die Libellen und die Weichtiere identifiziert. Arten dieser Tiergruppen verbringen ihr gesamtes Leben oder einen wesentlichen Teil ihres Lebenszyklus im Gewässer und wurden im Wirkraum der beantragten Gewässerbenutzung nachgewiesen oder können dort nicht ausgeschlossen werden. ARSU GmbH, Oldenburg 22.03.2016 4 Artenschutzrechtlicher Fachbeitrag Fische und Rundmäuler Relevante Arten sind der Aal, das Bach- und das Flussneunauge, die im Wirkraum der Gewässerbenutzung nachgewiesen wurden, sowie das seltene Meerneunauge, dessen Vorkommen nicht ausgeschlossen werden kann. Sie sind jeweils besonders geschützt. Sowohl in Linden als auch in Herrenhausen werden voraussichtlich Larven (Querder) der Neunaugen mit dem Kühlwasser entnommen. Die Entnahme von adulten Aalen und Neunaugen kann ebenfalls nicht ganz ausgeschlossen werden. Unter der Voraussetzung, dass die Fischrückführung in Linden realisiert und die in Herrenhausen weiter betrieben wird, werden die entnommenen Individuen jedoch überwiegend vital in die Ihme bzw. Leine zurückgeführt, so dass sich kein signifikant erhöhtes Tötungs- oder Verletzungsrisiko ergibt. Auch für Neunaugen-Laich besteht kein signifikant erhöhtes Tötungsrisiko durch die beantragte Gewässerbenutzung, da Neunaugen-Eier, die nicht in den Sedimenten der Laichgruben verbleiben, ohnehin nicht überlebensfähig sind. Das Vorkommen von Laich oder Larven des Aals im Wirkraum ist auszuschließen. Da das Eintreten anderer Verbotstatbestände bereits auf der Basis der Analyse der benutzungsbedingten Wirkfaktoren ausgeschlossen wurde, werden durch die beantragte Gewässerbenutzung für Fische und Rundmäuler insgesamt keine Verbotstatbestände nach § 44 Abs. 1 BNatSchG erfüllt. Libellen Relevant sind insgesamt 13 besonders geschützte Libellen-Arten, darunter die Gebänderte Prachtlibelle, die Gewöhnliche Federlibelle und die Gewöhnliche Keiljungfer, deren Larven im Wirkraum der beantragten Gewässerbenutzung nachgewiesen wurden. Das Vorkommen der übrigen zehn Arten, darunter auch die streng geschützte Grüne Flussjungfer, kann nicht ausgeschlossen werden. Imagines der Libellen halten sich zwar häufig am Wasser, aber in der Regel nicht im Wasser auf, daher besteht für sie weder in Linden noch in Herrenhausen ein signifikant erhöhtes Risiko mit dem Kühlwasser eingesogen zu werden. Die Entnahme von Libellen-Eiern und –Larven mit dem Kühlwasser ist dagegen möglich. Unter der Voraussetzung, dass die Fischrückführung in Linden realisiert und die in Herrenhausen weiter betrieben wird, werden sie jedoch überwiegend vital in die Gewässer zurückgeführt. Berücksichtigt man ferner die eingeschränkte Habitateignung von Ihme und Leine im Bereich der Entnahmestellen für die möglicherweise betroffenen Libellen-Arten, dann ergibt sich insgesamt kein signifikant erhöhtes Tötungs- oder Verletzungsrisiko. Da das Eintreten anderer Verbotstatbestände bereits auf der Basis der Analyse der benutzungsbedingten Wirkfaktoren ausgeschlossen werden kann, werden durch die beantragte Gewässerbenutzung für Libellen insgesamt keine Verbotstatbestände nach § 44 Abs. 1 BNatSchG erfüllt. Weichtiere Relevant sind insgesamt fünf besonders geschützte Fluss- und Teichmuschel-Arten, darunter die im Wirkraum der beantragten Gewässerbenutzung nachgewiesene Malermuschel. Das Vorkommen der übrigen vier Arten, einschließlich der streng geschützten Abgeplatteten Teichmuschel, kann nicht ausgeschlossen werden. 22.03.2016 ARSU GmbH, Oldenburg Wasserrechtliches Erlaubnisverfahren für die Kraftwerke Herrenhausen und Linden 5 Die Entnahme von Larven (Glochidien) oder sehr kleinen Jungmuscheln dieser Arten ist nicht ausgeschlossen. Sie können aufgrund ihrer geringen Größe nicht zurückgehalten und in die Gewässer zurückgeführt werden. Erst wenn die Jungmuscheln eine Größe erreicht haben, die von den Siebbandanlagen zurückgehalten wird, können sie in Herrenhausen ebenso wie die adulten Muscheln (einschließlich von möglicherweise im Kiemenraum befindlichem Laich) über die Fischrückführung vital in die Leine zurückgeführt werden. In Linden können sie hingegen trotz der geplanten Rückführleitung voraussichtlich nur zu einem geringen Teil in die Ihme zurückgeführt werden. Unter Berücksichtigung der untergeordneten Bedeutung von Ihme und Leine als Habitat dieser Arten, der hohen natürlichen Mortalität der frühen Entwicklungsstadien und der sedimentgebundenen Lebensweise der Muscheln ist jedoch nicht von einem signifikant erhöhten Tötungsrisiko für die relevanten Arten auszugehen. Da das Eintreten anderer Verbotstatbestände bereits auf der Basis der Analyse der benutzungsbedingten Wirkfaktoren ausgeschlossen werden kann, werden durch die beantragte Gewässerbenutzung für Weichtiere insgesamt keine Verbotstatbestände nach § 44 Abs. 1 BNatSchG erfüllt. Artenschutzrechtliches Fazit Weder in Linden noch in Herrenhausen kann eine nutzungsbedingte Schädigung oder Tötung einzelner Individuen der relevanten Arten bzw. ihrer Entwicklungsformen durch das Einsaugen mit dem Flusswasser ganz ausgeschlossen werden. Ein signifikant erhöhtes Tötungs- oder Verletzungsrisiko ist jedoch insbesondere unter Berücksichtigung der geplanten oder bereits bestehenden schonenden Fischrückführung und der deutlich eingeschränkten Eignung der betroffenen Gewässerabschnitte für die relevanten Arten nicht zu erwarten. Verbotstatbestände nach § 44 Abs. 1 BNatSchG werden somit insgesamt nicht erfüllt und die beantragte Gewässerbenutzung steht auch den Zielen der Europäischen AalVerordnung und des Aalbewirtschaftungsplanes nicht entgegen. ARSU GmbH, Oldenburg 22.03.2016 6 Artenschutzrechtlicher Fachbeitrag 1. Einleitung Die Stadtwerke Hannover AG betreibt im Stadtgebiet das Heizkraftwerk Linden, das Kraftwerk Herrenhausen und das Gemeinschaftskraftwerk Hannover in Stöcken. Nach dem Prinzip der Kraft-Wärme-Kopplung erzeugen sie für die öffentliche Versorgung Strom- und Fernwärme, benötigen aber eine Kühlung. Die Stadtwerke Hannover AG besitzt daher für die Kühl- und Brauchwasserversorgung dieser Kraftwerke zwei eigenständige gehobene wasserrechtliche Erlaubnisse nach § 11 des Niedersächsischen Wassergesetzes (NWG): Die Änderung und Neufassung der wasserrechtlichen Erlaubnis zur Nutzung der Ihme für die Kühl- und Brauchwasserversorgung des Heizkraftwerks Hannover-Linden (HKW Linden) vom 16.01.2004. Diese ist bis zum 28.02.2022 befristet. Die Änderung und Neufassung der wasserrechtlichen Erlaubnis zur Nutzung der Leine für die Kühl- und Brauchwasserversorgung des Kraftwerks Herrenhausen (KWH Herrenhausen) und des Gemeinschaftskraftwerks Hannover (GKH Stöcken) vom 01.03.2004. Diese ist bis zum 31.12.2016 befristet. Da die Befristungen auslaufen, steht eine Neubeantragung an. Gegenstand der bestehenden Erlaubnisse ist die Entnahme von Kühlwasser aus dem Fluss für die Durchlaufkühlung der Kraftwerke in Linden und Herrenhausen sowie für die Kühlturm-Zusatzwasserversorgung des Gemeinschaftskraftwerks in Stöcken, die Einleitung des erwärmten Kühlwassers und des Abflutwassers vom Kühlturm in den Fluss, die Einleitung von Abwassernebenströmen aus dem Kraftwerksbetrieb in den Fluss. Beide Erlaubnisse sind über gemeinsame Auflagen zum Monitoring und zur Begrenzung der mit der Kühlwassernutzung verbundenen Wärmeeinleitung in die Ihme bzw. Leine gekoppelt. Daher und zur Reduzierung des Aufwandes für zwei zeitlich aufeinanderfolgende Verfahren wird in Abstimmung mit dem Niedersächsischen Landesbetrieb für Wasserwirtschaft, Küsten- und Naturschutz (NLWKN) als Genehmigungsbehörde angestrebt, eine gemeinsame gehobene wasserrechtliche Erlaubnis für die Kühlwasserversorgung der drei Kraftwerke zu erhalten. Für die Erlangung dieser wasserrechtlichen Erlaubnis sind Prüfungen der Verträglichkeit der Wasserentnahmen und –einleitungen mit dem Europäischen Naturschutznetz Natura 2000 (FFH-Verträglichkeitsprüfung), mit dem Artenschutzrecht (spezielle Artenschutzrechtliche Prüfung) und mit den Zielen der Europäischen Wasserrahmenrichtlinie (WRRL) erforderlich. Gegenstand der vorliegenden Unterlage ist die Prüfung, ob die beantragte Benutzung mit den Anforderungen des besonderen Artenschutzes vereinbar ist. Eine Beschreibung der bestehenden und der beantragten Benutzung sowie der Maßnahmen zur Vermeidung und Minimierung von Beeinträchtigungen ist dem Teil A der naturschutzfachlichen Unterlagen zu entnehmen. Der vorliegenden artenschutzrechtlichen Prognose liegt die Realisierung und Einhaltung dieser Vermeidungs- und Minimierungsmaßnahmen zugrunde. 22.03.2016 ARSU GmbH, Oldenburg Wasserrechtliches Erlaubnisverfahren für die Kraftwerke Herrenhausen und Linden 2. Rechtliche und fachliche Grundlagen 2.1 Artenschutzrechtliche Verbote 7 Die relevanten besonderen artenschutzrechtlichen Verbote der nationalen Gesetzgebung sind in § 44 Abs. 1 BNatSchG formuliert. Danach ist es verboten, 1. wild lebenden Tieren der besonders geschützten Arten nachzustellen, sie zu fangen, zu verletzen, zu töten oder ihre Entwicklungsformen aus der Natur zu entnehmen, zu beschädigen oder zu zerstören, 2. wild lebende Tiere der streng geschützten Arten und der europäischen Vogelarten während der Fortpflanzungs-, Aufzucht-, Mauser-, Überwinterungs- und Wanderungszeiten erheblich zu stören; eine erhebliche Störung liegt vor, wenn sich durch die Störung der Erhaltungszustand der lokalen Population einer Art verschlechtert, 3. Fortpflanzungs- oder Ruhestätten der wild lebenden Tiere der besonders geschützten Arten der Natur zu entnehmen, zu beschädigen oder zu zerstören, 4. wild lebende Pflanzen der besonders geschützten Arten oder ihre Entwicklungsformen aus der Natur zu entnehmen, sie oder ihre Standorte zu beschädigen oder zu zerstören. Nach § 44 Abs. 5 BNatSchG gelten unter bestimmten Voraussetzungen Einschränkungen der speziellen artenschutzrechtlichen Verbote: Für nach § 15 BNatSchG zulässige Eingriffe in Natur und Landschaft sowie für Vorhaben im Sinne des § 18 Abs. 2 Satz 1, die nach den Vorschriften des Baugesetzbuches zulässig sind, gelten für die Zugriffs-, Besitz- und Vermarktungsverbote folgende Maßgaben: Sind in Anhang IVa der Richtlinie 92/43/EWG aufgeführte Tierarten, europäische Vogelarten oder solche Arten betroffen, die in einer Rechtsverordnung nach § 54 Abs. 1 Nr. 2 aufgeführt sind, liegt ein Verstoß gegen das Verbot des Absatzes 1 Nr. 3 und im Hinblick auf damit verbundene unvermeidbare Beeinträchtigungen wild lebender Tiere auch gegen das Verbot des Absatzes 1 Nr. 1 nicht vor, soweit die ökologische Funktion der von dem Eingriff oder Vorhaben betroffenen Fortpflanzungs- oder Ruhestätten im räumlichen Zusammenhang weiterhin erfüllt wird. Soweit erforderlich, können auch vorgezogene Ausgleichsmaßnahmen festgesetzt werden. Für Standorte wild lebender Pflanzen der in Anhang IVb der Richtlinie 92/43/EWG aufgeführten Arten gelten diese Maßgaben entsprechend. Sind andere besonders geschützte Arten betroffen, liegt bei Handlungen zur Durchführung eines Eingriffs oder Vorhabens kein Verstoß gegen die Zugriffs-, Besitz- oder Vermarktungsverbote vor. Dem besonderen Schutz des Europäischen Aales (Anguilla anguilla) dient darüber hinaus die Verordnung Nr. 1100/2007 der Europäischen Union. Sie verpflichtet die Mitgliedsstaaten zur Aufstellung von einzugsgebietsspezifischen Aalbewirtschaftungsplänen mit dem Ziel, die Bestände wieder zu erhöhen und die anthropogene Mortalität zu verringern. Ein solcher Aalbewirtschaftungsplan (vom Dezember 2008) liegt auch für das Flusseinzugsgebiet der Weser vor. Er sieht vor allem eine Aufrechterhaltung und Steigerung der Besatzmaßnahmen sowie eine Reduzierung der Mortalität durch Wasserkraftanlagen vor (LAVES et al. 2008). Hinsichtlich der beantragten ARSU GmbH, Oldenburg 22.03.2016 8 Artenschutzrechtlicher Fachbeitrag Gewässerbenutzungen ergeben sich aus der Verordnung und dem Bewirtschaftungsplan keine Anforderung an den Schutz des Aals, die über die in § 44 Abs. 1 BNatSchG formulierten artenschutzrechtlichen Verbote hinausgehen. 2.2 Anwendungsbereich Die Regelungen des Bundesnaturschutzgesetzes zum speziellen Artenschutz unterscheiden zwischen besonders geschützten Arten und streng geschützten Arten, wobei alle streng geschützten Arten zugleich zu den besonders geschützten Arten zählen (d. h. die streng geschützten Arten sind eine Teilmenge der besonders geschützten Arten). Welche Arten zu den besonders geschützten Arten bzw. den streng geschützten Arten zu rechnen sind, ist in § 7 Abs. 2 Nrn. 13 und 14 BNatSchG geregelt: streng geschützte Arten: die Arten aus Anhang A der EU-Verordnung über den Schutz von Exemplaren wild lebender Tier- und Pflanzenarten durch Überwachung des Handels (EG Nr. 338/97), die Arten aus Anhang IV der FFH-Richtlinie (Fauna-FloraHabitat-Richtlinie 92/43/EWG) sowie die Arten nach Anlage 1, Spalte 3 der Bundesartenschutzverordnung; besonders geschützte Arten: die Arten aus Anhang B der EU-Verordnung über den Schutz von Exemplaren wild lebender Tier- und Pflanzenarten durch Überwachung des Handels, die europäischen Vogelarten, die Arten nach Anlage 1, Spalte 2 der Bundesartenschutzverordnung sowie die streng geschützten Arten (s. o.). Den europäischen Vogelarten – das sind alle einheimischen Vogelarten – kommt im Schutzregime des § 44 Abs. 1 BNatSchG eine Sonderstellung zu: Gemäß den Begriffsbestimmungen zählen sie zu den besonders geschützten Arten, hinsichtlich der Verbotstatbestände sind sie jedoch den streng geschützten Arten gleichgestellt. Weiterhin sind einzelne europäische Vogelarten über die Bundesartenschutzverordnung oder Anhang A der EU-Verordnung 338/97 als streng geschützte Arten definiert. 2.3 Ausnahmemöglichkeiten Gemäß § 45 Abs. 7 BNatSchG können im Einzelfall von den nach Landesrecht zuständigen Behörden weitere Ausnahmen von den Verboten des § 44 Abs. 1 BNatSchG zugelassen werden. Dies ist u. a. aus zwingenden Gründen des überwiegenden öffentlichen Interesses einschließlich solcher sozialer und wirtschaftlicher Art möglich. Eine Ausnahme darf jedoch nur zugelassen werden, wenn zumutbare Alternativen nicht gegeben sind und sich der Erhaltungszustand der Populationen einer Art nicht verschlechtert, soweit nicht Artikel 16 Abs. 1 der Richtlinie 92/43/EWG weitergehende Anforderungen enthält. 22.03.2016 ARSU GmbH, Oldenburg Wasserrechtliches Erlaubnisverfahren für die Kraftwerke Herrenhausen und Linden 2.4 9 Kriterien und Beurteilungsmaßstäbe für die Bewertung der Verbotstatbestände Das Tötungsverbot des § 44 Abs. 1 Nr. 1 BNatSchG ist nach der Rechtsprechung des Bundesverwaltungsgerichts individuenbezogen zu verstehen. Der Verbotstatbestand tritt bereits ein, wenn die Tötung eines Exemplars der besonders geschützten Arten nicht im engeren Sinn absichtlich erfolgt, sondern sich als unausweichliche Konsequenz eines im Übrigen rechtmäßigen Verwaltungshandelns erweist. Der Tötungstatbestand ist jedoch nur erfüllt, wenn sich das Tötungsrisiko für die betroffenen Tierarten in signifikanter Weise erhöht (BVERWG 2008b, a, 2009, 2011). Ob eine signifikante Erhöhung des Tötungsrisikos für eine bestimmte Art vorliegt, hängt im Wesentlichen von zwei Faktoren ab. Es muss sich erstens um eine Tierart handeln, die aufgrund ihrer artspezifischen Verhaltensweisen gerade im Bereich des Vorhabens ungewöhnlich stark von dessen Risiken einer möglichen Tötung betroffen ist. Zweitens muss sich die Tierart häufig im Gefährdungsbereich des Vorhabens aufhalten (BVERWG 2009, 2011). Für Verletzungen dürften dieselben Kriterien angewendet werden können. Der Verbotstatbestand der Störung des § 44 Abs. 1 Nr. 2 BNatSchG ist erfüllt, wenn sich der Erhaltungszustand der lokalen Population verschlechtert. Als Störungen werden direkt auf ein Tier einwirkende Beunruhigungen oder Scheuchwirkungen bewertet, die insbesondere durch Lärm, Erschütterungen, Licht oder sonstige optische Störreize hervorgerufen werden können. Erhebliche Störungen sind während der Fortpflanzungs-, Aufzucht-, Mauser-, Überwinterungs- und Wanderungszeiten von Relevanz und damit fast während des gesamten Lebenszykluses der Tiere. Im artenschutzrechtlichen Kontext ist eine Störung als erheblich zu bewerten, wenn sie zu einer Verschlechterung des Erhaltungszustandes einer lokalen Population führt. Davon ist auszugehen, wenn sich die Größe der Population und/oder ihr Fortpflanzungserfolg signifikant und nachhaltig verringern. Negative Auswirkungen auf den Erhaltungszustand einer lokalen Population sind insbesondere dann anzunehmen, wenn Tiere störungsbedingt den Wirkraum verlassen bzw. zukünftig meiden oder wenn sich ihre Überlebenschancen, ihre Reproduktionsfähigkeit oder ihr Reproduktionserfolg im gestörten Bereich verschlechtern. Die Möglichkeit des Ausweichens von Individuen auf benachbarte Lebensräume ohne negative Auswirkungen auf die lokale Population kann grundsätzlich in die Bewertung der Erheblichkeit von Störungen einbezogen werden (LBV-SH 2013). Eine Fortpflanzungs- und Ruhestätte gilt als beschädigt oder zerstört, wenn ihre Funktion dauerhaft verloren geht. "Die Fortpflanzungs- und Ruhestätte besteht aus einem Mittelpunkt (z. B. Nest, Wochenstube, Schlafplatz) und einem Verbund aus weiteren Elementen, die aufgrund ihrer Lage oder Qualität in mehr oder weniger privilegierter räumlicher Wechselbeziehung mit diesem Mittelpunkt stehen. Aus artenschutzrechtlicher Sicht sind nur die Verbundbestandteile von Relevanz, die für den Fortpflanzungserfolg und die Nutzung als Ruhestätte entscheidend sind." (LBV-SH 2013) ARSU GmbH, Oldenburg 22.03.2016 10 Artenschutzrechtlicher Fachbeitrag 3. Artenschutzrechtliche Relevanz der Wirkfaktoren Im Teil A der naturschutzfachlichen Unterlagen werden auf der Basis einer Beschreibung der bestehenden und der beantragten Gewässerbenutzung insgesamt die folgenden Wirkfaktoren der geplanten Entnahme von Kühlwasser und Einleitung von Abwasser identifiziert (vgl. Teil A, Kap. 3.6): Änderungen der Strömungsverhältnisse und Wasserführung, Entnahme von lebenden Organismen durch Einsaugen mit dem Flusswasser, Einleitung von Nähr- und Schadstoffen, Einleitung von Wärme und Änderung des Sauerstoffgehalts. Entsprechend der Art der beantragten Benutzung – Entnahme von Wasser aus Ihme und Leine sowie Einleitung von energetisch und stofflich verändertem Wasser in diese Gewässer über die bereits bestehenden Anlagen – kommt es nicht zu einer Inanspruchnahme von Flächen oder eines Raumvolumens inner- oder außerhalb der Gewässer. Auch relevante Störwirkungen durch optische oder akustische Emissionen sind infolge der beantragten Benutzung vor dem Hintergrund der bereits bestehenden Anlagen, geringer betriebsbedingter Wartungs- und Überwachungsaktivitäten und der bestehenden erheblichen Vorbelastung durch Straßenverkehr, Bebauung und Freizeitnutzung nicht zu besorgen. Die Intensität der identifizierten Wirkungen und die Größe ihrer jeweiligen Wirkräume sind sehr unterschiedlich, ebenso ihre Relevanz für die artenschutzrechtlichen Betrachtungen. 3.1 Änderung der Strömungsverhältnisse/Wasserführung An den Entnahmestellen in Linden und Herrenhausen erfolgt die Kühlwasserentnahme quer zur Strömungsrichtung der Ihme bzw. der Leine, was bei der Wasserentnahme jeweils zu lokalen Veränderungen der Fließrichtung und –geschwindigkeit und möglicherweise auch zu Turbulenzen führt. Das Kühlwasser wird nach Gebrauch zusammen mit den Abwassernebenströmen stromabwärts der Entnahmestellen wieder in die Ihme bzw. Leine eingeleitet. Die Einleitung erfolgt zwar nicht rechtwinklig, sondern in einem flacheren Winkel zur Hauptströmung des Flusses, aber auch sie trägt zu den lokalen Strömungsänderungen bei. Das Ausmaß und die räumliche Ausdehnung der Veränderungen im Gewässer hängen einerseits vom Entnahmevolumen und der Einstromgeschwindigkeit (siehe Kap. 3.3 in Teil A der naturschutzfachlichen Unterlagen) ab und andererseits von den zum gegebenen Zeitpunkt herrschenden hydrologischen Bedingungen wie Wasserstand und Abfluss. Zur Beurteilung der möglichen Auswirkungen wird ein dreidimensionales Modell des Fließgewässers herangezogen, welches insbesondere zur Simulation der Wärmeausbreitung durch GOLDER ASSOCIATES (2016) erstellt wurde, mit dem aber auch Wasserstände und Strömungsgeschwindigkeiten abgebildet werden können. Die Modellierungen von GOLDER ASSOCIATES (2016) zeigen, dass es im Worst Case (bei einem geringen Abfluss von 14,4 m³/s und einer Wasserentnahme von 6 m³/s in Linden bzw. von 5 m³/s in Herrenhausen) 22.03.2016 insbesondere im Abschnitt zwischen der Entnahme und der Wiedereinleitung jeweils lokal begrenzt zu einer Verringerung der Fließgeschwindigkeit um bis zu ca. 0,1 m/s kommt, ARSU GmbH, Oldenburg Wasserrechtliches Erlaubnisverfahren für die Kraftwerke Herrenhausen und Linden 11 oberhalb der Entnahme und unterhalb der Einleitung lokal auf wenige hundert Meter begrenzt zu geringfügigen Veränderungen der Fließgeschwindigkeiten von deutlich weniger als +/ 0,1 m/s kommt, allenfalls zu geringfügigen Wasserspiegelveränderungen in der Leine zwischen der Entnahme- und der Einleitstelle in Herrenhausen kommt, aber – aufgrund der Stauhaltung – nicht zu Auswirkungen auf den Wasserstand der Ihme in Linden kommt. Insgesamt sind auf der Basis der vorliegenden Modellierungen also nur geringfügige, räumlich eng begrenzte nutzungsbedingte Veränderungen der Strömungen in Ihme und Leine zu prognostizieren. Daher geht von ihnen kein signifikant erhöhtes Risiko der Schädigung oder Tötung von Organismen aus. Strömungsänderungen können außerdem direkt oder indirekt (durch morphologische Veränderungen infolge von Erosion und Sedimentation) Auswirkungen auf die Habitateigenschaften von Gewässern haben. Aufgrund der geringen Intensität der benutzungsbedingten Strömungsänderungen sind jedoch allenfalls geringfügige Folgewirkungen zu prognostizieren. Wesentliche Habitateigenschaften der Gewässer, die deren mögliche Eignung oder Funktion als Fortpflanzungsoder Ruhestätte (etwa als Laich-, Ruhe- oder Schlafgewässer) beschädigen oder zerstören könnten, sind daher nicht zu erwarten. Eine Verschlechterung der ökologischen Gesamtsituation im nutzungsbedingten Wirkraum im Hinblick auf seine Funktion als Fortpflanzungs- oder Ruhestätte ist durch diesen Wirkfaktor also ebenfalls nicht zu besorgen. Der nutzungsbedingte Wirkfaktor Strömungsänderungen ist daher aufgrund seiner geringen Intensität und kleinräumigen Wirkung für die artenschutzrechtliche Prüfung nicht relevant und wird nachfolgend nicht weiter berücksichtigt. 3.2 Entnahme von Organismen Organismen, die sich im Wasser aufhalten, sich mit der Strömung treiben lassen oder eine geringe Schwimmstärke aufweisen, können bei der Kühlwasserentnahme mit dem Flusswasser eingesogen werden. Sie können durch die Rechen, die Korbsiebbandanlagen oder die Passage der Kühlanlagen geschädigt bzw. getötet werden. Dieser nutzungsbedingte Wirkfaktor ist also artenschutzrechtlich relevant, da er direkt zu einer Tötung oder Schädigung von besonders geschützten Arten führen kann. Wie in Kapitel 3.1 erläutert, beschränken sich die benutzungsbedingten Strömungsänderungen im Bereich der Entnahmebauwerke auf die unmittelbare Umgebung. Eine Sogwirkung auf Organismen entsteht entsprechend nur im unmittelbaren Umfeld der Entnahmestellen. Zu berücksichtigen ist außerdem, dass nicht alle Organismen, die eingesogen werden, von einer Tötung oder Schädigung betroffen sind: In Linden wird alles, was vom Feinrechen oder den Korbsiebbandanlagen zurückgehalten wird, über Bodenrinnen in ein Sammelbecken geleitet. Von diesem Sammelbecken wird das Abspritz- und Spülwasser mit den darin enthaltenen Organismen gegenwärtig noch mit Hilfe von Tauchpumpen in die Ihme zurückgeführt. Geplant ist jedoch, das Sammelbecken zukünftig über eine Freigefälleleitung mit der Ihme zu verbinden, um die Schädigung und Tötung von Organismen zu minimieren. Die vorhandenen Bodenrinnen, die geplante Rückführleitung und der Betrieb der Siebbandanlage werden ARSU GmbH, Oldenburg 22.03.2016 12 Artenschutzrechtlicher Fachbeitrag organismenschonend optimiert und mit Wirksamwerden der beantragten Erlaubnis in Betrieb genommen (vgl. Teil A der naturschutzfachlichen Unterlagen). Bei Betrieb dieser geplanten Rückführleitung wird das Abspritzwasser von den Korbsiebbandanlagen und der Rechenabwurf vom Feinrechen also im Freigefälle in die Ihme abgeleitet. Mit dem Wasser wird voraussichtlich auch der überwiegende Teil der darin enthaltenen Organismen schonend in die Ihme zurückgeführt. Organismen, die von den Anlagen zurückgehalten werden, danach noch vital sind und über die Rückführleitung in die Ihme gelangen, können auf diese Weise überleben. Der Sachverständige für Fischerei und Gewässerökologie (SPÄH 2015) erwartet, dass aufgrund der Strömungsverhältnisse im Sammelbecken der überwiegende Teil der Fische entweder direkt mit der Strömung in die Rückführleitung gelangt oder sich innerhalb des Sammelbeckens aktiv zum Ablauf der Rückführleitung orientiert. Auch bei den mobilen Benthos-Organismen wie beispielsweise den Insektenlarven oder den Flohkrebsen ist zu erwarten, dass sie überwiegend mit der Strömung in die Rückführleitung gelangen und auf diese Weise in die Ihme zurückgeführt werden. Hingegen wird wahrscheinlich der überwiegende Teil der weniger mobilen Arten wie Schnecken oder Muscheln zu Boden sinken und nicht wieder in die Ihme gelangen (vgl. SPÄH 2015). Individuenverluste sind also auch bei Nutzung der geplanten Rückführleitung vor allem bei den weniger mobilen Arten zu erwarten, aber auch bei den mobileren nicht auszuschließen. Werden bei Verstopfungen der Rückführleitung oder zu deren Vermeidung vorübergehend wieder Tauchpumpen (oder ein Zerhäcksler) eingesetzt, ist davon auszugehen, dass während dieser Betriebszeit alle Organismen die vom Feinrechen oder der Siebbandanlage ins Sammelbecken gelangen, getötet werden. Bei der Prognose der Wirkungen der beantragten Gewässerbenutzung wird vorausgesetzt, dass die schonende Fischrückführung in Linden realisiert und der Betrieb der Tauchpumpen auf wenige Tage im Jahr (max. rund 10 Tage/Saison) beschränkt wird. In Herrenhausen werden große Organismen vom Feinrechen des normalerweise betriebenen Entnahmebauwerks I zurückgehalten, der ihnen einen ausreichenden Schutz gegen das Eindringen in das Kühlwassersystem bietet. Das am Rechen anfallende Treibgut wird in einem Container gesammelt und entsorgt. Das gilt auch für kleinere Organismen, die an größeren Pflanzenteilen, Hölzern etc. angeheftet sind. Diese Organismen werden also getötet. Im Abspritzwasser der Korbsiebbandanlage von Entnahmebauwerk I enthaltene Organismen werden dagegen über eine schon bestehende Rückführungsrinne wieder in die Leine gegeben und überleben, wenn sie nach dem Abspritzen noch vital sind. Das Entnahmebauwerk II in Herrenhausen verfügt nicht über eine Korbsiebbandlange, sondern nur über Rechen. Das Rechengut wird entsorgt und auch alle Organismen, die den Rechen passieren, werden getötet. Diese Entnahmelinie wird jedoch nur eingesetzt, wenn das Entnahmebauwerk I aufgrund von Wartungs- oder Revisionsarbeiten außer Betrieb ist und dient dann ausschließlich zur Versorgung der Kühlturmzusatzwasseraufbereitungsanlage für das GKH Stöcken. Bei der Prognose wird vorausgesetzt, dass die Entnahmelinie II tatsächlich nur an wenigen Tagen im Jahr mit geringen Entnahmemengen (maximal 16.800 m³/d) betrieben wird. 22.03.2016 ARSU GmbH, Oldenburg Wasserrechtliches Erlaubnisverfahren für die Kraftwerke Herrenhausen und Linden 13 Denkbar ist darüber hinaus eine indirekte Wirkung auf besonders geschützte Tiere über die Nahrungskette, sofern ihnen durch das Einsaugen anderer Organismen die Nahrungsgrundlage entzogen wird. Nach den vorliegenden Erkenntnissen und Erfahrungen gibt es jedoch keine Hinweise darauf, dass es bedingt durch die beantragte Benutzung zu einer erheblichen Veränderung des Artenspektrums bzw. des Nahrungsangebotes kommen könnte, die zu einer signifikanten Erhöhung des Tötungs- und Schädigungsrisikos oder einem Verlust von Nahrungsräumen mit essentieller Bedeutung für Fortpflanzungs- oder Ruhestätten führen könnte. 3.3 Einleitung von Nähr- und Schadstoffen Das Kühlwasser für die Kraftwerke Linden und Herrenhausen wird chemisch nicht verändert, seine Nähr- und Schadstofffracht durch den Kühlprozess nicht beeinflusst, so dass sich daraus für die Gewässer kein Einfluss auf die Nähr- und Schadstoffe im Wasser ergibt. Anders verhält es sich mit dem Zusatzwasser für den Kühlturm des GKH Stöcken, dem Abflutwasser aus dem Kühlkreislauf des GKH Stöcken und den verworfenen Kesselkondensaten des HKW Linden und des KWH Herrenhausen sowie dem Abwasser aus der Wasseraufbereitung in Herrenhausen. Sie werden durch Zusätze, Eindickung und Austrag in die Atmosphäre verändert (vgl. Kap. 2.4 in Teil A der naturschutzfachlichen Unterlagen). Durch die Einleitung dieser Abwassernebenströme kommt es in Linden zu Nährstoffeinträgen und in Herrenhausen zu einem Eintrag von Nährstoffen und Salzen, aber durch die Wasserentnahme für das Zusatzwasser auch zu einem Austrag. Zur Bilanzierung der Ein- und Austräge wurden daher in Tab. 1 die nutzungsbedingten Frachten für die Nährstoffe und Salze auf der Basis der Angaben zur bisherigen Qualität der Abwassernebenströme (vgl. Kap. 2.4 von Teil A) abgeschätzt. Da zur Vermeidung von Beeinträchtigungen der Einsatz von Betriebs- und Hilfsstoffen im Kraftwerksbetrieb – wie bisher – auf das absolut notwendige Maß beschränkt wird (vgl. Kap. 4.1.5 von Teil A), bieten die vorhandenen Daten aus der betrieblichen Eigenüberwachung der Jahre 2010–2014 eine gute Grundlage für eine Abschätzung der benutzungsbedingt zu erwartenden Frachten. Für die Konzentrationen im Kühlturmzusatzwasser aus der Leine, im Abflutwasser und dem Abwasser aus der Aufbereitung standen keine Mittelwerte, sondern die Bandbreite der Konzentrationen zur Verfügung (vgl. Tab. 4 und Tab. 5 in Teil A). Daher wurden der Abschätzung Werte im Mittel der Bandbreite zugrunde gelegt. Für die verworfenen Kondensate wurde zur Berechnung der Stickstoff-Frachten jeweils der maximale Zusatz von 1 mg/l einer 25 %igen NH3-Lösung1 angenommen. 1 1 mg einer 25 %igen NH3-Lösung entspricht rund 0,21 mg N, der pro Liter Kondensat zugesetzt wird (25 mg NH3/100 mg entsprechen 20,56 mg N/100 g, also rund 0,21 mg N/mg, das ergibt sich aus den Molmassen von Stickstoff (14,0067 g/Mol), Wasserstoff (1,0079 g/Mol) und NH3 (17,0304 g/Mol), woraus folgt, das Stickstoff rund 82,25 % der Gesamtmasse des NH3 ausmacht) ARSU GmbH, Oldenburg 22.03.2016 14 Tab. 1: Artenschutzrechtlicher Fachbeitrag Stoffeinträge und –austräge durch die beantragte Wasserentnahme und –einleitung errechnet auf der Basis der maximal beantragten Entnahme- und Einleitwassermengen und einer Stoffkonzentration in der Mitte der Angaben der Antragstellerin zur Bandbreite dieser Konzentrationen (vgl. Tab. 4 und Tab. 5 in Teil A der naturschutzfachlichen Unterlagen) bzw. bei den Kesselkondensaten auf der Basis der maximal zugesetzten Menge max. Menge [m³/a] Konzentrationen Nährstoff-Frachten Salzfrachten NH4-N [mg/l] Phosphor [mg P/l] Chlorid [mg/l] Sulfat [mg/l] Ammonium [kg N/a] Phosphor [kg P/a] Chlorid [kg/a] Sulfat [kg/a] 3.000.000 0,1 – 0,2 0,1 – 0,2 130 – 160 150 – 190 450,0 450 435.000 510.000 450.000 0,02 – 0,05 0,6 – 1,0 500 – 800 500 – 800 15,8 360 292.500 292.500 Kesselkondensate HKW Linden 15.000 max. 0,21 - - - 3,2 - - - Kesselkondensat KWH Herrenhausen 10.000 max. 0,21 - - - 2,1 - - - Abwasser Wasseraufbereitung Herrenhausen 40.000 0,2 – 5 3.000 – 10.000 300 – 1.000 104,0 24 260.000 26.000 125,0 384 552.500 318.500 Austrag Zusatzwasser für den Kühlturm GKH Stöcken Eintrag Abflutwasser Kühlturm GKH Stöcken Summe Eintrag 22.03.2016 0,2 – 1 ARSU GmbH, Oldenburg Wasserrechtliches Erlaubnisverfahren für die Kraftwerke Herrenhausen und Linden Tab. 2: 15 Abschätzung der maximalen Konzentrationsänderungen in Gewässersystem von Ihme und Leine infolge der Stoffeinträge durch die beantragte Einleitung von Abwassernebenströmen in Linden und Herrenhausen errechnet auf der Basis der gemäß Antrag maximal möglichen Abwassereinleitung pro Stunde, des Maximalwertes der Bandbreite der Konzentration der Stoffe (gemäß betrieblicher Eigenüberwachung 2010–2014, vgl. Tab. 4 und Tab. 5 in Teil A der naturschutzfachlichen Unterlagen) bzw. bei den Kesselkondensaten auf der Basis der maximal zugesetzten Menge sowie eines niedrigen Abflusses in Höhe des mittleren Niedrigwasserabflusses (MNQ) von 16,0 m³/s bzw. 57.600 m³/h; dargestellt im Vergleich zum jeweiligen Mittelwert der Vorbelastung an der Messstelle Bordenau für die Jahre 2008–2014 und zum Orientierungswert nach LAWA-AO (2015) maximale Abwassereinleitung [m³/h] maximale Konzentration [mg/l] maximale Fracht [g/h] maximale Konzentrationserhöhung bei MNQ [mg/l] Mittelwert der Vorbelastung [mg/l] Orientierungswert [mg/l] Ammoniumstickstoff Kesselkondensat HKW Linden 75 0,21 15,75 0,000 27 Kesselkondensat KWH Herrenhausen 25 0,21 5,25 0,000 09 5 5,0 25,0 0,000 43 0,05 11,5 0,000 20 57,5 0,000 99 Abwasser Wasseraufbereitung Herrenhausen Abflutwasser Kühlturm GKH Stöcken 230 Summe Ammoniumstickstoff Ammonium-N: 0,072 Gesamt-N: Ammonium-N: 0,2 4,3 Gesamt-Phosphor Abwasser Wasseraufbereitung Herrenhausen Abflutwasser Kühlturm GKH Stöcken Summe Gesamt-Phosphor ARSU GmbH, Oldenburg 5 1,0 5 0,000 09 230 1,0 230 0,003 99 235 0,004 08 0,13 0,1 22.03.2016 16 Artenschutzrechtlicher Fachbeitrag maximale Abwassereinleitung [m³/h] maximale Konzentration [mg/l] maximale Fracht [g/h] maximale Konzentrationserhöhung bei MNQ [mg/l] Mittelwert der Vorbelastung [mg/l] Orientierungswert [mg/l] Chlorid Abwasser Wasseraufbereitung Herrenhausen Abflutwasser Kühlturm GKH Stöcken 5 10.000 50.000 0,868 230 800 184.000 3,194 234.000 4,062 Summe Chlorid 118,29 200 139,35 200 Sulfat Abwasser Wasseraufbereitung Herrenhausen Abflutwasser Kühlturm GKH Stöcken Summe Sulfat 22.03.2016 5 1.000 5.000 0,087 230 800 184.000 3,194 189.000 3,281 ARSU GmbH, Oldenburg Wasserrechtliches Erlaubnisverfahren für die Kraftwerke Herrenhausen und Linden 17 Wie die Abschätzung in Tab. 1 zeigt, steht den stofflichen Einträgen mit dem Abflutwasser des Kühlturms jeweils ein größerer Austrag mit dem Zusatzwasser für den Kühlturm gegenüber. Der Betrieb des Kühlturms führt also nicht zu einem Netto-Eintrag2 von Ammonium, Phosphor, Chlorid oder Sulfat. Vielmehr ist auch bei einer Bilanzierung aller durch die beantragte Benutzung bedingten Ein- und Austräge mit Ausnahme von Chlorid insgesamt nicht von einem Netto-Eintrag auszugehen. Beim Chlorid ergibt sich zwar ein Netto-Eintrag, der jedoch im Vergleich zum betroffenen Abflussvolumen vernachlässigbar gering ist.3 Da die Abwassernebenströme aus den Kesselkondensaten und der Wasseraufbereitung diskontinuierlich anfallen und das Abflutwasser infolge der Eindickung durch den Kühlturm des GKH Stöcken erhöhte Konzentrationen aufweist, ist zusätzlich zur Bilanzierung der Jahresfrachten zu prüfen, ob es zu relevanten Erhöhungen der Nährstoff- oder Salzkonzentrationen kommt. Auf der Basis der maximal pro Stunde möglichen Einleitmenge4 der verschiedenen Abwasserströme und der maximalen Konzentration der Nährstoffe und Salze wurden daher für einen Abfluss in Höhe eines mittleren Niedrigwasserabflusses (MNQ) von 16 m³/s bzw. 57.600 m³/h in Tab. 2 die jeweils maximal zu erwartenden Konzentrationserhöhungen für die verschiedenen Stoffe im Gewässersystem von Ihme und Leine ermittelt. Sie sind bezogen auf die verschiedenen Abwassernebenströme sowohl im Vergleich zur Vorbelastung als auch im Vergleich zum Orientierungswert der LAWA-AO (2015) jeweils vernachlässigbar gering. Die Ableitung der Kesselkondensate und des Abwassers aus der Wasseraufbereitung erfolgt diskontinuierlich und unabhängig voneinander jeweils nur für wenige Stunden. Dennoch ist nicht auszuschließen, dass alle Einleitungen zeitgleich vorgenommen werden. Aber auch in der Summe ergeben sich für die verschiedenen Stoffe nur sehr geringe Konzentrationserhöhungen. Mit dem Abwasser wird auch in geringen Mengen Ammonium eingeleitet, das im Gewässer in Abhängigkeit von der Wassertemperatur und dem pH-Wert in das fischgiftige Ammoniak umgewandelt wird. Die für Fische letalen Konzentrationen liegen bei 0,6–1,2 mg/l, die für Fischbrut bei 0,2–0,4 mg/l. Andere Wassertiere wie Insekten, deren Larven oder Krebse sind weniger empfindlich (FREIE UND HANSESTADT HAMBURG 2001). Vitalitätsbeeinträchtigungen der Fische können jedoch bereits bei geringeren Konzentrationen auftreten. Die niedersächsische Verordnung über Qualitätsanforderungen an Fischgewässer und Muschelgewässer (FischMuGewQualV ND) sieht daher einen Grenzwert von ≤ 0,025 mg/l Ammoniak vor. Wie Tab. 2 zeigt, ist jedoch allenfalls eine sehr geringe benutzungsbedingte Erhöhung der Ammonium-Konzentration in Ihme und Leine zu prognostizieren, die auch nur eine vernachlässigbar geringe zusätzliche Ammoniak-Bildung zur Folge hat. Allerdings kann auch die benutzungsbedingte Erhöhung der Wassertemperatur (siehe Kap. 3.4) einen lokalen Anstieg der AmmoniakKonzentration im Wasser unterhalb der Einleitungsstellen verursachen. Ausgehend von den in der Leine zwischen 2008 und 2014 beobachteten Ammonium-Konzentrationen sind jedoch auch unter Berücksichtigung einer benutzungsbedingten Temperaturerhöhung um 3 K nur Konzentrationen deutlich unter dem Grenzwert von ≤ 0,025 mg/l Ammoniak (bzw. ≤ 0,0206 mg/l Ammoniakstick- 2 3 4 Ein Netto-Eintrag ist nur dann gegeben, wenn mit den Abwässern insgesamt eine größere Menge eines Stoffes eingetragen wird, als mit dem entnommenen Flusswasser entnommen wird. Einem rechnerischen Netto-Eintrag von117.500 kg/a steht bei einem mittleren Abfluss von rund 50 m³/s (vgl. Kap. 4.1) ein betroffenes Wasservolumen von 1.576.800.000 m³/a gegenüber, so dass sich im Mittel eine nutzungsbedingte Konzentrationserhöhung von nur rund 0,07 mg/l Chlorid im Gewässer ergibt. Bei der Ermittlung der Abwassermenge pro Stunde wurde berücksichtigt, dass die Pumpe für die Einleitung des Abwasser aus der Wasseraufbereitung mit maximal 5 m³/h arbeitet und dass die pro Tag beantragte Kesselkondensat-Einleitmenge im Extremfall jeweils innerhalb von zwei Stunden abgeleitet werden kann (vgl. Kap. 4.2 und Kap. 4.3 des Antrags) ARSU GmbH, Oldenburg 22.03.2016 18 Artenschutzrechtlicher Fachbeitrag stoff) zu erwarten (vgl. Gewässerökologisches Gutachten in Teil B der naturschutzfachlichen Unterlagen). Auswirkungen auf Leben und Gesundheit der Gewässerorganismen sind daher nicht zu besorgen. Artenschutzrechtlich relevante Auswirkungen auf besonders geschützte Arten durch die mit der beantragten Benutzung verbundenen Veränderungen von Nährstoffen und Schadstoffen in Ihme und Leine sind nicht zu erwarten. Sie sind weder geeignet die Vitalität von geschützten Organismen zu beeinträchtigen noch eine Verschlechterung der ökologischen Gesamtsituation des Wirkraums unterhalb der Einleitungsstellen im Hinblick auf seine mögliche Funktion als Fortpflanzungs- oder Ruhestätte zu verursachen. Der Wirkfaktor Nähr- und Schadstoffe ist daher für die artenschutzrechtliche Prüfung nicht relevant und wird nachfolgend nicht weiter berücksichtigt. 3.4 Einleitung von Wärme und Änderung des Sauerstoffgehalts Der Wärmehaushalt eines Fließgewässers wird von einer Vielzahl von Parametern beeinflusst, dabei bilden sich in Abhängigkeit von den meteorologischen Verhältnissen Tages- und Jahresgänge aus. Mit dem eingeleiteten Kühlwasser wird Energie in Form von Wärme in Ihme und Leine eingetragen, was sich direkt auf deren Wassertemperatur auswirkt und auch zu Veränderungen des Sauerstoffgehalts führen kann. Grundsätzlich können anthropogen stark erhöhte oder verringerte Wassertemperaturen bzw. extreme Temperaturwechsel zu Stressreaktionen, zu Schädigungen oder sogar zum Tod von Organismen führen. Durch die beantragte Kühlwassereinleitung mit einer Beschränkung der Einleittemperatur auf max. 30 °C bzw. 32 °C sowie die Einhaltung der Grenzwerte der niedersächsischen Verordnung über Qualitätsanforderungen an Fischgewässer und Muschelgewässer, also einer maximalen Wassertemperatur von 28 °C und einer maximalen Aufwärmspanne von 3 K am Rand der Durchmischungszone, werden artenschutzrechtlich relevante Auswirkungen jedoch vermieden. Der für den guten ökologischen Zustand von Gewässern des Epipotamals relevante Orientierungswert der Oberflächengewässerverordnung (OGewV, Anlage 6 Nr. 2) von < 25 °C zielt darauf ab, die Funktionsfähigkeit des Ökosystems des betroffenen Gewässertyps und die biologischen Qualitätskomponenten der Gewässerflora und –fauna (wie Makrophyten, benthische Wirbellose oder Fische) in einem anthropogen nur in geringem Maße veränderten Zustand zu erhalten. Auch im Arbeitspapier der LAWA (LAWA-AO 2015) ist für diesen Gewässertyp eine sommerliche Maximaltemperatur von 25 °C genannt, darüber hinaus wird dort für den Winter (Dezember bis März) eine maximale Wassertemperatur von 10 °C gefordert. GOLDER ASSOCIATES (2016) haben die nutzungsbedingten Temperaturveränderungen in Ihme und Leine anhand eines dreidimensionalen Modells und verschiedener Szenarien (vgl. Tab. 3) untersucht, die auf den Angaben zum voraussichtlichen Betrieb (vgl. Kap. 3.2 in Teil A der naturschutzfachlichen Unterlagen) basieren. Dabei haben sie für alle simulierten Lastfälle Randbedingungen zugrunde gelegt, die einen in Gänze betrachtet konservativen Parametersatz nachbilden. Anhand dieser in Teil B der naturschutzfachlichen Unterlagen genauer erläuterten Szenarien, die einen realistischen Worst Case sowohl für den Sommer- wie auch für den Winterbetrieb darstellen und daher geeignet sind, den Antragsgegenstand abzubilden, können die voraussichtlichen Auswirkungen auf die Gewässertemperatur prognostiziert werden. 22.03.2016 ARSU GmbH, Oldenburg Wasserrechtliches Erlaubnisverfahren für die Kraftwerke Herrenhausen und Linden Tab. 3: 19 Szenarien zur Untersuchungen der Wärme-Einleitung zu den Betriebsszenarien vgl. auch Kapitel 3.2 in Teil A der naturschutzfachlichen Unterlagen, die maximale Kühlwasseraufwärmspanne beträgt 10 K, d. h. die Einleittemperatur des Kühlwassers liegt maximal 10 K über der Ausgangstemperatur; unter Volllast wird der Betrieb der Kraftwerke mit der beantragten maximalen Kühlwassereinleitmenge und –temperatur verstanden; da die Einhaltung der Grenzwerte der niedersächsischen Verordnung über Qualitätsanforderungen an Fischgewässer und Muschelgewässer im Sommer bei einem Leine-Abfluss von < 28 m³/s nur bei einem reduzierten Wärmeeintrag eingehalten werden kann, wurde auch ein entsprechend reduzierter Sommerlastfall bei einem niedrigen Leine-Abfluss von 14,4 m³/s untersucht Szenarien Kühlwassereinleitung [m³/s] Ihme Leine LeineAbfluss [m³/s] Randbedingungen Sommer Lastfall 1 – Volllast Betrachtung der Wärmeeinleitung beider Kraftwerke 6 2 28 Teilbetrachtung der Wärmeeinleitung HKW Linden 6 0 28 Betrachtung der Wärmeeinleitung beider Kraftwerke 3 5 28 Teilbetrachtung der Wärmeeinleitung KWH Herrenhausen 0 5 28 Betrachtung der Wärmeeinleitung HKW Linden 3,9 0 14,4 Betrachtung der Wärmeeinleitung KWH Herrenhausen 0 3,9 14,4 Betrachtung der Wärmeeinleitung beider Kraftwerke 2 2 30,2 Teilbetrachtung der Wärmeeinleitung HKW Linden 2 0 30,2 Teilbetrachtung der Wärmeeinleitung KWH Herrenhausen 0 2 30,2 Ausgangs-Wassertemperatur: 21 °C Lufttemperatur: max. 28 °C Luftfeuchtigkeit: max. 80 % Windgeschwindigkeit: 0,5 m/s Bewölkungsgrad: 1 Sonneneinstrahlung: Anfang Juli Lastfall 2 – Volllast reduzierter Sommerlastfall Winter Ausgangs-Wassertemperatur: 4 °C Lufttemperatur: max. 9,4 °C Luftfeuchtigkeit: max. 80 % Windgeschwindigkeit: 1,7 m/s Bewölkungsgrad: 7 Sonneneinstrahlung: Ende Februar Benutzungsbedingte Veränderungen der Wassertemperatur und damit verbundene Wirkungen auf den Sauerstoffgehalt des Wassers entstehen jeweils an den Einleitungsstellen und wirken sich stromabwärts davon aus. Zunächst (in der Durchmischungszone) bleibt die eingeleitete Wärme jeweils als Wärmefahne auf einen Teil des Gewässerquerschnitts begrenzt (nach den vorliegenden Modellierungen in Herrenhausen ufernah, in Linden im Winter ebenfalls ufernah, im Sommer oberflächennah). Mit zunehmender Fließstrecke wird eine immer stärkere Durchmischung erreicht. Am Rand der Durchmischungszone ist die in Linden und Herrenhausen eingeleitete Wärme gleichmäßig über den Gewässerquerschnitt verteilt. Bei den von GOLDER ASSOCIATES (2016) untersuchten Szenarien war insgesamt spätestens rund 1.200 m unterhalb der Einleitung in Herrenhausen eine vollständige Durchmischung erreicht. In der sich flussabwärts anschließenden durchmischten Zone ist das Wasser aber weiterhin wärmer als ohne die beantragten Kühlwassereinleitungen. Da die Wärmeabgabe aus dem Gewässer an die Luft insbesondere im Sommer nur gering ist, bleibt die eingeleitete Wärme weitgehend im ARSU GmbH, Oldenburg 22.03.2016 20 Artenschutzrechtlicher Fachbeitrag Wasser und eine Verringerung der Temperatur erfolgt nur durch Verdünnung über kühlere Zuflüsse. Dabei wird die Wärmeeinleitung aber in jedem Fall so begrenzt, dass in der durchmischten Zone keine nutzungsbedingte Erwärmung um mehr als 3 K und keine Überschreitung von 28 °C Wassertemperatur erfolgen (vgl. Kap. 3.1 und Kap. 4 in Teil A). Nach den Untersuchungen von GOLDER ASSOCIATES (2016) ergeben sich bei den gewählten konservativen aber realistischen Parametersätzen Temperaturen im durchmischten Wasserkörper von < 25 °C bei einer Aufwärmspanne von maximal 3 K. Die Ergebnisse der Simulationen von GOLDER ASSOCIATES (2016) zeigen außerdem, dass es zwar innerhalb der Wärmefahnen zu einer lokalen Überschreitung der für Gewässer des Epipotamals relevanten Orientierungswerte nach OGewV und LAWA-AO (2015) für den guten ökologischen Zustand von < 25 °C im Sommer bzw. 10 °C im Winter kommt, dass die Temperaturen ansonsten aber bei den gewählten konservativen Randbedingungen (s. o.) innerhalb der Durchmischungszone unter diesen Werten bleiben. Den aquatischen Organismen verbleiben somit ausreichend Ausweichmöglichkeiten. Da die Orientierungswerte für den guten ökologischen Zustand durch die beantragte Gewässerbenutzung allenfalls lokal eng begrenzt oder selten und kurzzeitig überschritten werden, geht von der Temperaturerhöhung in Ihme und Leine weder ein signifikant erhöhtes Tötungs- oder Schädigungsrisiko noch eine Gefährdung von möglichen Fortpflanzungs- oder Ruhestätten aus. Abb. 1: Sauerstoffgehalt im Kühlwasserauslauf Herrenhausen Ergebnisse der täglichen Messungen durch die Stadtwerke Hannover AG in den Jahren 2013 und 2014; die Ablaufwerte berücksichtigen die Einleitung des Abflutwassers des GKH, der Block B war 2013/14 nur phasenweise in Betrieb; MIN = Jahresminimalwert Die Löslichkeit von Sauerstoff in Wasser ist temperaturabhängig, daher kann es bei sauerstoffgesättigtem Wasser durch eine Temperaturerhöhung zu einer Verringerung des absoluten Sauerstoffgehaltes kommen. Messungen der Antragstellerin in Herrenhausen zeigen jedoch, dass die Sauerstoffkonzentration im auslaufenden Kühlwasser (bei einer Aufwärmspanne von 10 K) 2013 und 2014 im Mittel bei 9 mg/l lag und 5,7 mg/l nicht unterschritten wurden (vgl. Abb. 1). Für das Überleben von Fischen kritische Werte von ≤ 4 mg/l wurden nicht beobachtet. Der Orientierungswert der LAWA-AO (2015) von 7 mg/l für Bäche, Flüsse und Ströme des norddeutschen 22.03.2016 ARSU GmbH, Oldenburg Wasserrechtliches Erlaubnisverfahren für die Kraftwerke Herrenhausen und Linden 21 Tieflands wird selbst im Auslauf mit der lokal besonders starken Temperaturerhöhung überwiegend eingehalten. Die Einleitung von zusätzlichen Nährstoffen mit dem Abwasser, die zu einer erhöhten Sauerstoffzehrung führen könnten, ist vernachlässigbar gering (vgl. Kap. 3.3). Da Leine und Ihme keine planktondominierten Gewässer sind, ist auch die durch die beantragte Gewässerbenutzung bedingte Sauerstoffzehrung durch Organismen, die im Kühlkreislauf getötet und wieder eingeleitet werden, gering. Insgesamt ist daher ein signifikant erhöhtes Tötungs- und Schädigungsrisiko durch nutzungsbedingte Veränderungen des Sauerstoffhaushalts von Ihme und Leine nicht zu besorgen. Der Wirkfaktor Einleitung von Wärme und Änderung des Sauerstoffgehalts ist daher insgesamt für die artenschutzrechtliche Prüfung nicht relevant und wird nachfolgend nicht weiter berücksichtigt. 3.5 Zusammenfassung der artenschutzrechtlich relevanten Wirkfaktoren Insgesamt ist in den vorangegangenen Kapiteln nur ein Wirkfaktor als relevant für die Prüfung des Eintretens von Verbotstatbeständen identifiziert worden: das Einsaugen von Organismen mit dem Flusswasser. Dieser könnte bei besonders geschützten Individuen zu deren Schädigung oder Tötung führen, was den Verbotstatbestand nach § 44 Abs. 1 Nr. 1 (Tiere) oder Nr. 4 (Pflanzen) BNatSchG erfüllen würde. Das Eintreten von Verbotstatbeständen nach § 44 Abs. 1 Nr. 2 (Störung) oder Nr. 3 (Schädigung von Fortpflanzungs- oder Ruhestätten) BNatSchG ist auf der Basis der Analyse der Wirkfaktoren nicht zu besorgen. ARSU GmbH, Oldenburg 22.03.2016 22 4. Artenschutzrechtlicher Fachbeitrag Bestandsbeschreibung Aufgrund der Art der beantragten Gewässerbenutzung, die sich auf die Entnahme von Kühlwasser aus Ihme und Leine sowie die Einleitung des energetisch und stofflich veränderten Wassers in diese Gewässer über die bereits bestehenden Anlagen beschränkt, sind ihre Auswirkungen auf das Gewässersystem von Ihme und Leine begrenzt. Betroffen sind im Wesentlichen der eigentliche Wasserkörper und der damit in Wechselwirkung stehende Gewässergrund sowie die dort vorkommenden Organismen. Die Reichweite der Wirkfaktoren innerhalb der Gewässer ist unterschiedlich und wird von den wechselnden hydrologischen Randbedingungen beeinflusst. Unter Berücksichtigung der Lage des Randes der Durchmischungszone nahe der Querung durch die Bahntrasse und der vorliegenden 'Untersuchungen der ökologischen und chemischen Situation an Leine und Ihme' (BIOCONSULT 2016b) wurde als Betrachtungsraum ein Abschnitt von Ihme und Leine gewählt, der sich vom Wehr Schneller Graben bis über die Bahntrasse hinaus erstreckt und die ober- und unterhalb der Entnahme- und Einleitstellen in Linden und Herrenhausen beprobten Abschnitte (S-5 bis S-7, vgl. Kap. 4.2) umfasst. Entsprechend konzentrieren sich auch die Bestandsbeschreibungen auf diese Gewässer. 4.1 Gewässersystem von Leine und Ihme Die Leine durchquert von Thüringen kommend in Niedersachsen zunächst die naturräumliche Region des Weser-Leineberglandes und südlich von Hannover dann den Westteil der Börden, bevor sie im Bereich der Stadt Hannover das Weser-Aller-Flachland erreicht. Am Nordrand dieser Region mündet sie in die Aller, die am Westrand des Weser-Aller-Flachlandes in die Weser fließt. In Höhe des Maschsees (Leine-km 16,75) wird die Leine durch den Leineabzweig am Wasserkraftwerk und Wehr Schneller Graben aufgeteilt. Eine kleinere Wassermenge fließt als Leine, auch Mühlen-Leine genannt, durch die Innenstadt von Hannover. Der Hauptabfluss fließt in den Schnellen Graben, der sich nach einer Strecke von ca. 500 m mit dem aus Richtung des Deisters kommenden Ihme-Bach vereinigt und zum Ihme-Fluss wird (vgl. Abb. 1 in Kap. 2 von Teil A der naturschutzfachlichen Unterlagen). Im Folgenden ist mit der Bezeichnung Ihme der Ihme-Fluss (einschließlich des Schnellen Grabens) gemeint. Nördlich von Hannover-Mitte werden Ihme und Leine bei Leine-km 21,0 wieder vereinigt. Flussabwärts davon liegen bei Leine-km 22,78 das Wasserkraftwerk und Wehr Herrenhausen sowie der Abzweig des Leineabstiegskanals. Im Bereich zwischen dem Wehr Schneller Graben und dem Wehr Herrenhausen ist der Abfluss von Ihme und Leine staureguliert und entsprechend verlangsamt. Auch oberhalb von Hannover ist die Leine durch zahlreiche Stauanlagen reguliert, unterhalb der Stadt ist sie dagegen ökologisch durchgängig (NLWKN 2012). Während Leine und Ihme oberhalb des Wehres Herrenhausen einen gestreckten Verlauf zeigen, ist die weitere Fließstrecke bis zur Mündung in die Aller deutlich gewunden. Dennoch ist auch dieser Abschnitt der Leine "geprägt durch ihren immer wieder begradigten und durchgehend stark bis sehr stark tiefenerodierten Verlauf" (NLWKN 2012). Die ökologisch durchgängige Leine unterhalb von Hannover im Übergangsbereich der Börden zur Geest ist auf weiten Strecken ein- oder beidseitig von Gehölzstreifen begleitet, die teilweise strukturbildende Funktion sowie vereinzelt und sehr kleinräumig sogar noch einen Auwald-ähnlichen Charakter haben. Daneben gibt es einzelne Kiesbänke und Uferabbrüche, die zum Teil mit Totholzablagerungen verbunden sind. Insgesamt sind aber strukturbildende Elemente im Verhältnis 22.03.2016 ARSU GmbH, Oldenburg Wasserrechtliches Erlaubnisverfahren für die Kraftwerke Herrenhausen und Linden 23 zur Größe des Gewässers nach Angaben des NLWKN (2012) nur in relativ geringer Anzahl ausgebildet. Gefährdete Uferabschnitte sind zum großen Teil befestigt und die eigendynamische Entwicklung der Leine entsprechend meist unterbunden. Die Breiten-, Tiefen-, Strömungs- und Substratvarianz ist nicht besonders ausgeprägt. Kiese scheinen aufgrund des Geschiebetransportes aus den oberhalb liegenden Mittelgebirgsabschnitten und der erhöhten Fließgeschwindigkeit zu dominieren. Über weite Strecken erfolgt in der Aue eine Nutzung als Acker oder Grünland bis an den Gewässerrand, im Stadtbereich von Hannover ist – unterhalb der Einmündung der Ihme und über das Wehr Herrenhausen hinaus – neben einem verstärkten Ausbau auch eine intensive Freizeitnutzung kennzeichnend (NLWKN 2012). BIOCONSULT (2016b) hat Ihme und Leine im Gewässerabschnitt vom Wehr Schneller Graben bis einschließlich Luthe (vgl. Abb. 2) untersucht. Sie stufen sowohl den Ihme-Fluss als auch die Leine in Abstimmung mit den Fachbehörden (NLWKN und LAVES) als große sand- und lehmgeprägte Tieflandflüsse (Fließgewässertyp 15g) ein. Infolge der Lage am Übergang vom Hügelland ins Flachland sowie durch anthropogene Laufverengungen und Eintiefung des Profils weist die Leine für ein Fließgewässer dieses Typs noch eine relativ starke Strömung auf (BIOCONSULT 2016b). Abb. 2: Bestandsuntersuchungen in Ihme und Leine im Raum Hannover (Quelle: BIOCONSULT 2016b) Die vom NLWKN (2012) angeführte Begradigung der Leine prägt nach Angaben von BIOCONSULT (2016b) nicht das Gesamtbild. Daneben sind auch Abschnitte mit relativ naturnahem Krümmungsverlauf nicht selten. Im von BioConsult untersuchten Abschnitt von Ihme und Leine dominieren Kiese nur in stärker überströmten Sohlbereichen. Lehmige und schluffige Auensedimente prägen hier die Gewässersubstrate, so dass sie den Flüssen mit höherem Lehmanteil zugeordnet ARSU GmbH, Oldenburg 22.03.2016 24 Artenschutzrechtlicher Fachbeitrag werden können. Die Ufergehölze setzten sich im untersuchten Abschnitt aus wenigen Weidenarten und deren Hybriden zusammen. Weitere gewässertypische Arten wie Schwarzerle sind nicht oder nur vereinzelt anzutreffen. Eine Hartholzaue ist nahezu nicht vorhanden. Insgesamt besteht nach Einschätzung von BIOCONSULT (2016b) das größte strukturelle Defizit des untersuchten Abschnitts in dem stark eingetieften und teilweise eingeengten Verlauf, den fehlenden Retentionsflächen in der Aue und den daraus resultierenden sehr starken hydrologischen Belastungen des Gewässerprofils sowie der Flora und Fauna bei Hochwasserereignissen. Im Bereich des HKW Linden ist die Ihme etwa 40 m breit und insbesondere bei Niedrig- bis Mittelabfluss sind dort aufgrund des Rückstaus nach GOLDER ASSOCIATES (2016) geringe Fließgeschwindigkeiten zu erwarten. Nach Angaben von BIOCONSULT (2016b) ist die Leine in den meisten untersuchten Abschnitten (vgl. Abb. 2) durch eine gegenüber dem Leitbild eines 'großen sandund lehmgeprägten Tieflandflusses' stark erhöhte Fließgeschwindigkeit gekennzeichnet. Im Bereich der Wasserentnahme bei Herrenhausen hat die etwa 30 m breite Leine aber nach GOLDER ASSOCIATES (2016) ein geringes Sohlgefälle, so dass sie dort bei einem niedrigen Abfluss auch nur geringe Fließgeschwindigkeiten erwarten. In den unterhalb des Wehres Herrenhausen gelegenen Untersuchungsabschnitten S-5 und S-6 ist die Leine nach BIOCONSULT (2016b) häufig durch steile Ufer und Uferverbau gekennzeichnet. Der mittlere Abfluss (MQ) der Leine für den Zeitraum von 1941–2012 liegt am Pegel Herrenhausen bei 50 m³/s, der mittlere Niedrigwasserabfluss (MNQ) beträgt 16 m³/s. Es wurden aber auch schon deutlich niedrigere Abflüsse von 13,4 m³/s (Oktober 2012) oder 8,9 m³/s (Oktober 1947) registriert (NLWKN 2014). Neben September und Oktober zeigen die Monate August und Juli am häufigsten einen niedrigen Monatsabfluss. In der Ihme werden im Februar durchschnittlich Wassertemperaturen von 1–6 °C und im August von 15–23,5 °C beobachtet (GOLDER ASSOCIATES 2016). Die Wassertemperatur in der Leine bei Bordenau schwankte im Zeitraum von 2008 bis 2014 im Jahresverlauf zwischen etwa 1–4 °C im Winter und 20–24 °C im Sommer (vgl. Gewässerökologisches Gutachten in Teil B der naturschutzfachlichen Unterlagen). 4.2 Aktuelle Bestandserfassungen Im Rahmen der Untersuchung der ökologischen und chemischen Situation an Leine und Ihme erfolgte 2013 durch BIOCONSULT (2016b) auch eine Erfassung der Makrophytenbestände, des Makrozoobenthos und der Fische in insgesamt sieben Abschnitten (S-1 bis S-7, vgl. Abb. 2) zwischen dem Wehr Schneller Graben und Luthe. Die Untersuchungsabschnitte lagen jeweils in einem gewissen Abstand ober- und unterhalb der verschiedenen Einleiter (Kraftwerke und Kläranlagen, vgl. Abb. 2), um einen großräumigen Vergleich des ökologischen Zustands der Gewässer vor und hinter den Einleitungen, aber möglichst unabhängig von kleinräumigen und womöglich stärkeren Effekten der Einleitungen zu gewährleisten (BIOCONSULT 2016a). Die Untersuchungen von BIOCONSULT (2016b) hatten eine Erfassung und Bewertung des aktuellen Zustands der biologischen Qualitätskomponenten von Ihme und Leine nach den Verfahren der Wasserrahmenrichtlinie zum Ziel. Die Ergebnisse sind daher vor allem geeignet, den Bestand der Gewässer grundsätzlich zu charakterisieren. Dem entsprechend handelt es sich zwar um repräsentative Stichproben, aber nicht um Erfassungen der vollständigen Artenspektren. Aufgrund der räumlichen Variabilität der hydromorphologischen Bedingungen erlauben die Ergebnisse daher insbesondere für Makrophyten und Makrozoobenthos zwar Rückschlüsse auf die Biozönose des Gewässers, aber keine konkreten Aussagen über Vorkommen besonders geschützter Arten in der 22.03.2016 ARSU GmbH, Oldenburg Wasserrechtliches Erlaubnisverfahren für die Kraftwerke Herrenhausen und Linden 25 unmittelbaren Umgebung der Entnahme- und Einleitbauwerke in Linden und Herrenhausen. Aus diesem Grund werden bei der Relevanzprüfung (in Kap. 5) nicht nur die besonders geschützten Arten berücksichtigt, die von BIOCONSULT (2016b) in Ihme und Leine nachgewiesen wurden, sondern auch die, deren Vorkommen im Wirkraum der beantragten Gewässerbenutzung aufgrund der vorliegenden Kenntnisse über die Gewässer nicht ausgeschlossen werden kann. 4.2.1 Makrophyten in Leine und Ihme Die Erfassung der Makrophyten im Gewässer erfolgte entsprechend der Phylib-Verfahrensanleitung (SCHAUMBURG et al. 2012) Anfang September 2013. Kartiert wurden insgesamt neun Probenahmestellen (P0 – P5 und P9 – P11, siehe Abb. 2) in den sieben ausgewählten Gewässerabschnitten. Die Makrophyten wurden vor Ort bestimmt und ihr jeweiliger Bedeckungsgrad aufgenommen. Darüber hinaus wurden weitere Parameter erfasst wie das besiedelte Substrat, die mittlere Tiefe und die Gewässertrübung (BIOCONSULT 2016b). Aufgrund der in den meisten von BIOCONSULT (2016b) untersuchten Gewässerabschnitten stark erhöhten Fließgeschwindigkeit, der häufig starken Uferbefestigung mit Steinschüttungen und dem weitgehenden Fehlen von gewässertypischen Strukturen wie Uferbänke, Totholz, strömungsberuhigter Bereiche etc. sind die Ansiedlungsmöglichkeiten für höhere Pflanzen deutlich eingeschränkt. Auch die relativ starke Trübung und Schluff bzw. Detritus-Depositionen sowie wiederkehrende hohe Abflussspitzen und starke Wasserstandsschwankungen schränken deren Ansiedlung ein (BIOCONSULT 2016b). BIOCONSULT (2016b) charakterisiert das Arteninventar als sehr einheitlich. Insgesamt wurden an den Probenahmestellen in Leine und Ihme nur sieben verschiedene submers wachsende Arten nachgewiesen, darunter sechs Gefäßpflanzen und ein Wassermoos. Als vorherrschend wurden der Störungszeiger Kamm-Laichkraut (Potamogeton pectinatus) und das Gewöhnliche Quellmoos (Fontinalis antipyretica), das Steinschüttungen besiedelt, identifiziert. Keine der von BIOCONSULT (2016b) nachgewiesenen Pflanzenarten ist besonders oder streng geschützt. 4.2.2 Makrozoobenthos in Leine und Ihme Zur Erfassung der Makrozoobenthos-Vorkommen wurden von BIOCONSULT (2016b) insgesamt neun repräsentative Probenahmestellen (P0 – P5 und P9 – P11, siehe Abb. 2) in den sieben Gewässerabschnitten ausgewählt, die jeweils Ende April bzw. Anfang Mai 2013 und im Oktober 2013 beprobt wurden. Die Untersuchungen erfolgte entsprechend der Vorgaben des 'Methodischen Handbuches Fließgewässerbewertung' (MEIER et al. 2006). Soweit möglich, fand die Probenahme vom Ufer aus bzw. watend im Gewässer statt, zum Teil musste die Beprobung aber auch vom Boot aus vorgenommen werden. Es wurde eine quantitative Untersuchungen mittels MultiHabitat-Sampling (MHS) mit anschließender Lebendsortierung unter Angabe der Häufigkeitsklassen vorgenommen. Zusätzlich wurde an jeder Probenahmestelle eine 21. Teilprobe von besonders besiedlungsträchtigen Habitaten genommen, die durch die MHS-Methode aufgrund eines zu geringen Deckungsgrades nicht ausreichend erfasst wurde (BIOCONSULT 2016b). Nach BIOCONSULT (2016b) waren die Probenahmestellen vorwiegend durch Lehm mit Feinsandund teilweise auch geringen Kiesanteilen charakterisiert. Die Uferbereiche waren überwiegend ARSU GmbH, Oldenburg 22.03.2016 26 Artenschutzrechtlicher Fachbeitrag sehr steil und teilweise auch befestigt. Für den Fließgewässertyp eigentlich charakteristische, strukturgebende Elemente in Form von natürlichen Sekundärsubstraten, wie Totholz und Wasserpflanzen, fehlten häufig. Die Funktion der untersuchten Abschnitte von Ihme und Leine als Lebensraum für das Makrozoobenthos ist eingeschränkt, denn nach BIOCONSULT (2016b) ergibt sich (in Übereinstimmung mit der offiziellen behördlichen Bewertung) nur ein mäßiger bis unbefriedigender ökologischer Zustand, der aus der allgemeinen Degradation des Gewässers, seiner Strukturarmut und der hohen Anzahl von Neozoen resultiert. Insgesamt wurden bei den Untersuchungen Taxa aus 17 Ordnungen nachgewiesen, darunter auch 16 Neozoen. Artenreichste Gruppen waren die Dipteren (Zweiflügler), die Trichopteren (Köcherfliegen) und die Crustaceen (Krebstiere). Aus den artenschutzrechtlich relevanten Gruppen (Bivalvia, Gastropoda, Odonata und Coleoptera) wurden insgesamt 31 Taxa nachgewiesen, darunter acht besonders geschützte Taxa (vgl. Tab. 4). Da die Frühjahrs-Beprobung 2013 vergleichsweise früh erfolgte und das Frühjahr zudem kalt war, wurden im Juni 2014 insgesamt elf Probenahmestellen (P0 – P7 und P9 – P11, siehe Abb. 2) erneut untersucht (BIOCONSULT 2014). Dabei wurde im Wesentlichen die Bewertung der Untersuchung von 2013 bestätigt, jedoch gibt es hinsichtlich der nachgewiesenen Arten Unterschiede. Bei den Untersuchungen von 2013 (BIOCONSULT 2016b) war unter den sieben festgestellten Muschel-Arten mit der Malermuschel (Unio pictorum) nur eine besonders geschützt Art. Sie wurde in geringer Dichte (0,4 Individuen/m²) im Bereich der Probenahmestelle P2 oberhalb der Wasserentnahme für das Kraftwerk Herrenhausen angetroffen. An allen anderen Probenahmestellen wurde sie nicht nachgewiesen. Dieses Vorkommen der Malermuschel wurde bei den Untersuchungen im Frühjahr 2014 (BIOCONSULT 2014) nicht bestätigt, jedoch wurde eine nicht näher bestimmte Unio-Art weiter flussabwärts (P7 und P10) in etwa größerer Dichte (1,3 bzw. 1,0 Ind./m²) nachgewiesen. Außerdem wurde 2014 eine ebenfalls nicht näher bestimmte Art der Teichmuscheln (Anodonta sp.) in der Ihme (P0) sowie in der Leine unterhalb von Herrenhausen (P5) festgestellt (ebenfalls mit 1,3 bzw. 1,0 Ind./m²). Alle heimischen Libellen-Arten sind nach der Bundesartenschutzverordnung (BArtSchV) besonders geschützt, einige Arten sind darüber hinaus nach Anhang IV der FFH-Richtlinie bzw. der BArtSchV auch streng geschützt. Von den Larven der sieben 2013 nachgewiesenen Libellen-Taxa hat BIOCONSULT (2016b) nur drei bis zur Art bestimmt. Es handelt sich um Larven der Gebänderten Prachtlibelle (Calopteryx splendens), der Gewöhnlichen Keiljungfer (Gomphus vulgatissimus) und der Gewöhnlichen Federlibelle (Platycnemis pennipes). Alle drei Arten sind besonders geschützt. Sie wurden in unterschiedlicher Dichte (0,4–6,9 Individuen/m²) an verschiedenen Probenahmestellen nachgewiesen. Die anderen vier Odonata-Taxa wurden nur bis zur Gattung, bis zur Familie oder sogar nur bis zur Unterordnung bestimmt. Diese umfassen neben besonders auch streng geschützte Arten. Fünf der Taxa, darunter die drei bis zur Art bestimmten, wurden auch an den Probenahmestellen in der Ihme (S-7) bzw. der Leine (S-6, S-5) ober- und unterhalb der Wasserentnahmen für die Kraftwerke festgestellt. Bei den ergänzenden Untersuchungen im Frühjahr 2014 wurden erneut Larven der Gewöhnlichen Keiljungfer nachgewiesen und die der Gebänderten Prachtlibelle traten an nahezu allen Probenahmestellen auf, dabei erreichten sie mit 10 Individuen/m² in der Ihme die höchste Dichte (BIOCONSULT 2014). 22.03.2016 ARSU GmbH, Oldenburg Wasserrechtliches Erlaubnisverfahren für die Kraftwerke Herrenhausen und Linden Tab. 4: 27 In Leine und Ihme nachgewiesene besonders und streng geschützte Muscheln und Libellen Angaben zum Vorkommen auf der Basis der Untersuchungen von BIOCONSULT (2014, 2016b), zur Lage der untersuchten Gewässerabschnitte (S-1 bis S-7) und der Probenahmepunkte (P1 – P5, P9 – P11) im Bereich Hannover unterhalb des Wehres Schneller Graben und stromabwärts bis Luthe vgl. Abb. 2, X = bei den Untersuchungen nachgewiesen; Angaben zum Schutzstatus auf der Basis von THEUNERT (2008b), bei den nicht bis zur Art bestimmten Libellen-Larven ist mindestens von einem besonderen Schutz auszugehen (min. besond.), einige Arten dieser Taxa sind darüber hinaus streng geschützt Taxon Schutzstatus Vorkommen in den Abschnitten (S) an den Probenahmestellen (P) S-7 P0 S-6 P1 P2 S-5 S-4 S-3 P3 P4 P5 S-2 P6 P7 P9 S-1 P10 P11 Bivalvia (Muscheln) Unio pictorum ssp. besonders Unio sp. besonders Anodonta sp. besonders X X X X X Odonata (Libellen-Larven) Aeshnidae Gen. sp. min. besond. Calopteryx sp. min. besond. X besonders X Coenagrionidae Gen. sp. min. besond. X Gomphus vulgatissimus besonders X Platycnemis pennipes besonders X Calopteryx splendens Zygoptera Gen. sp. X X X X X X X X X X X X X X X X X min. besond. X X X Unter den nachgewiesenen Schnecken-Arten und den festgestellten Käfer-Taxa waren keine besonders oder streng geschützten Arten. 4.2.3 Fische und Rundmäuler in Leine und Ihme Zur Erfassung der Fischfauna in den Gewässern und zur Ermittlung der mit dem Kühlwasser an den Kraftwerken eingesogenen Fischfauna wurden zwei Untersuchungen durchgeführt (BIOCONSULT 2015, 2016b). Für die Erfassung der Fischfauna in Leine und Ihme zwischen Schnellem Graben und Luthe wurden von BIOCONSULT (2016b) in jedem der sieben Gewässerabschnitten (S-1 bis S-7, vgl. Abb. 2) je zwei repräsentative Befischungsstrecken einmal im Sommer und einmal im Herbst in Orientierung am DIN-Entwurf EN 14011 'Probenahme von Fisch mittels Elektrizität' und an den Empfehlungen zur Anwendung des fischbasierten Bewertungssystems für Fließgewässer (DUßLING 2009) sowie den Vorgaben des Niedersächsischen Landesamtes für Verbraucherschutz und Lebensmittelsicherheit (LAVES), Dezernat Binnenfischerei untersucht. Zusätzlich wurden von BIOCONSULT (2016b) zur repräsentativen Erfassung der Rundmäuler Feinsedimentbänke im Bereich dieser Streckenbefischungen untersucht, in dem der Anodenkescher für mindestens 10 Sekunden unter Stromgabe auf das Sediment gelegt und die aus dem Sediment dringenden Querder mit einem feinmaschigen Zusatzkescher gefangen wurden. Im untersuchten Bereich vom Wehr Schneller Graben bis Luthe ergibt sich nach BIOCONSULT (2016b) für Leine und Ihme ein guter ökologischer Zustand der Fischfauna. Es wurden insgesamt 28 Arten der Fische und Rundmäuler festgestellt. Die häufigeren Arten wurden in allen UnterARSU GmbH, Oldenburg 22.03.2016 28 Artenschutzrechtlicher Fachbeitrag suchungsabschnitten nachgewiesen, bei selteneren Arten spielt aufgrund der generell geringeren Erfassungswahrscheinlichkeit auch der Zufall eine erhebliche Rolle. Hinzu kommt, dass lokal nicht alle vorhandenen Habitatelemente repräsentativ ausgebildet sind. Dies führt dazu, dass bei Betrachtungen auf kleinräumiger Ebene (also für einzelne Untersuchungsabschnitte) nicht unbedingt das gesamte Artenspektrum des Gewässers erfasst wird. Im Hinblick auf die zum Teil sehr großen Aktionsräume der Arten ist bei der Ermittlung der artenschutzrechtlich relevanten Arten (in Kap. 5) das gesamte Spektrum der von BIOCONSULT (2016b) festgestellten besonders geschützten Arten zu berücksichtigen. Nachgewiesen wurden der Aal und in allen 18 beprobten Querder-Habitaten auch Larven der Neunaugen. Überwiegend handelte es sich um Bachneunaugen. Flussneunaugen wurden deutlich seltener erfasst und Meerneunaugen gar nicht angetroffen. Da diese Art sehr selten ist, kann ihr gelegentliches Vorkommen aber dennoch nicht ausgeschlossen werden. Darüber hinaus erfolgte durch BIOCONSULT (2015) eine Untersuchung der mit dem Kühlwasser eingesogenen Fischfauna von März bis November 2014. An beiden Kraftwerken wurden an jeweils 18 Terminen insgesamt 28 Untersuchungsdurchgänge von je 4–5 Stunden Dauer durchgeführt. Dabei lag der Fokus zunächst auf der Tageserfassung, aber an jeweils 10 Terminen erfolgten die Untersuchungen zusätzlich auch in der Nacht. Erfasst wurde sowohl der Rechenabwurf als auch das Siebbandabspritzwasser. Zusätzlich hat BIOCONSULT (2015) bei diesen Untersuchungen im April und Mai 2014 mittels Ringnetzbefischung Vergleichsproben aus der Leine und der Ihme im Bereich der Kühlwasserentnahme untersucht (vgl. BIOCONSULT 2015). Dabei wurden an beiden Kraftwerken je vier Gewässerabschnitte beprobt. Drei lagen jeweils an dem Ufer, an dem sich auch das Entnahmebauwerk befindet. Bei diesen Untersuchungen wurden am KWH Herrenhausen im Abspritzwasser der Korbsiebbandanlage insgesamt 18 Fischarten festgestellt. Im Abspritzwasser der Siebbandanlage des HKW Linden fanden sich insgesamt 19 Fischarten, darunter auch drei Arten, die BIOCONSULT (2016b) bei den Gewässeruntersuchungen im Vorjahr nicht festgestellt hatte. Vier weitere Arten wurden jeweils in den Vergleichsproben aus der Leine und der Ihme nachgewiesen. Insgesamt ergibt sich aus den aktuellen Untersuchungen (BIOCONSULT 2015, 2016b) für Leine und Ihme im Einflussbereich der Kraftwerke ein Artenspektrum von 31 nachgewiesenen Fischarten und Rundmäulern, darunter mit Aal, Bachneunauge und Flussneunauge drei besonders geschützte Arten (vgl. Tab. 5). Tab. 5: In Leine und Ihme nachgewiesene besonders und streng geschützten Fische und Rundmäuler Angaben zum Vorkommen auf Basis der Untersuchungen von BIOCONSULT (2016b) und BIOCONSULT (2015), X = bei den Untersuchungen in Leine und Ihme nachgewiesen, H = Vorkommen am KWH Herrenhausen, L = Vorkommen am HKW Linden; Angaben zum Schutzstatus auf der Basis von THEUNERT (2008a) deutsche Name wissenschaftliche Name Schutzstatus BIOCONSULT (2016b) BIOCONSULT (2015) Aal Anguilla anguilla besonders X H, L Bauchneunauge Lampetra planeri besonders X H Flussneunauge Lampetra fluviatilis besonders X H, L 22.03.2016 ARSU GmbH, Oldenburg Wasserrechtliches Erlaubnisverfahren für die Kraftwerke Herrenhausen und Linden 5. 29 Relevanzprüfung Geplant ist die Fortsetzung der Wasserentnahme und -einleitung von Durchlaufkühlwasser für die Kraftwerke in Linden und Herrenhausen einschließlich des Kühlturmzusatzwassers für das Gemeinschaftskraftwerk Hannover. Diese Gewässerbenutzungen werden jeweils mit einer bestandskräftigen Anlagengenehmigung betrieben. Damit ist die beantragte Gewässerbenutzung – auch wenn diese in Form der neu beantragten Wasserentnahme und einleitung für sich genommen keinen Eingriff im Sinne von § 14 Abs. 1 BNatSchG darstellt – nach der vom NLWKN vertretenen Rechtsauffassung, der sich die Antragstellerin anschließt, dennoch am Maßstab der privilegierenden Bestimmungen des § 44 Abs. 5 Satz 2–5 BNatSchG zu messen. Dahinter steht die Überlegung, dass es sich bei dem fortgesetzten Betrieb eines zugelassenen Kraftwerkes dem Grunde nach und vor allem unter Berücksichtigung des der Antragstellerin zustehenden eigentumsgleichen Rechts am eingerichteten und ausgeübten Gewerbebetrieb in der Gesamtbetrachtung um ein Projekt handelt, auf das die Vorgabe des § 44 Abs. 5 Satz 1 BNatSchG sinngemäß anzuwenden ist. Dieser Rechtsauffassung folgend könnte sich die Befassung auf in Anhang IV Buchstabe a der Richtlinie 92/43 EWG aufgeführte Tierarten, europäische Vogelarten sowie solche Arten, die in einer Rechtsverordnung nach § 54 Abs. 1 Nr. 2 BNatSchG aufgeführt sind, beschränken. Da soweit ersichtlich noch keine höchstrichterlichen Entscheidungen über die Fortsetzung einer zugelassenen Gewässerbenutzung unter dem Gesichtspunkt des Artenschutzes vorliegen, werden ergänzend Betrachtungen durchgeführt, die eine Nichtanwendbarkeit der privilegierenden Bestimmungen des § 44 Abs. 5 Satz 2–5 BNatSchG unterstellen und damit das gesamte Spektrum der besonders geschützten Arten in den Blick nehmen. Im Folgenden werden daher alle im Einflussbereich der beantragten Gewässerbenutzung tatsächlich oder möglicherweise vorkommenden besonders und streng geschützten Arten ermittelt und eine Einschätzung ihrer potenziellen Betroffenheit durch die beantragte Nutzung gegeben. Der Niedersächsische Landesbetrieb für Wasserwirtschaft, Küsten- und Naturschutz (NLWKN) hat Verzeichnisse der in Niedersachsen besonders oder streng geschützten Arten veröffentlicht (THEUNERT 2008a, b), in denen insgesamt 19 Artengruppen unterschieden werden. Für sieben dieser Artengruppen sind Fließgewässer nicht von Bedeutung, da sie nicht zu den typischen Habitaten der Arten dieser Gruppen gehören. Aus diesem Grund müssen die Gruppen Flechten (Lichenes), Pilze (Fungi), Schmetterlinge (Lepidoptera), Hautflügler (Hymenoptera), Netzflügler (Neuroptera), Springschrecken (Saltatoria) und Stachelhäuter (Echinodermata) nicht weiter berücksichtigt werden. Für alle übrigen Gruppen wurde geprüft, ob die genannten Arten möglicherweise durch die beantragte Benutzung in artenschutzrechtlich relevanter Weise berührt werden oder ob Verbotstatbestände ohne vertiefende Betrachtung ausgeschlossen werden können. Dabei wurde berücksichtigt, dass in Kapitel 3 als artenschutzrechtlich relevanter Wirkfaktor nur die Entnahme von Organismen durch Einsaugen mit dem Flusswasser identifiziert wurde. Das Einsaugen von besonders geschützten Organismen könnte zu deren Schädigung oder Tötung führen, was den Verbotstatbestand nach § 44 Abs. 1 Nr. 1 (Tiere) bzw. Nr. 4 (Pflanzen) BNatSchG erfüllen würde. Das Eintreten anderer Verbotstatbestände kann, auf der Basis der Analyse der mit der beantragten Gewässerbenutzung verbundenen Wirkfaktoren in Kapitel 3, ausgeschlossen werden. ARSU GmbH, Oldenburg 22.03.2016 30 Artenschutzrechtlicher Fachbeitrag Für folgende Artengruppen kann das Eintreten von Verbotstatbeständen ausgeschlossen werden: Farn- und Blütenpflanzen (Pterido- und Spermatophyta) bei den Untersuchungen von BIOCONSULT (2016b) wurden keine besonders oder streng geschützten Arten nachgewiesen und ein Vorkommen der beiden von THEUNERT (2008a) genannten Arten ist aufgrund ihrer Verbreitung und Lebensraumansprüche nicht zu erwarten Moose (Bryophyta) bei den Untersuchungen von BIOCONSULT (2016b) wurden keine besonders oder streng geschützten Arten nachgewiesen und ein Vorkommen der einzigen von THEUNERT (2008a) genannten Art ist aufgrund ihrer Lebensraumansprüche nicht zu erwarten Säugetiere (Mammalia) einige der von THEUNERT (2008a) genannten 17 Arten sind ausgestorben, andere aufgrund ihrer Verbreitung im Untersuchungsraum nicht zu erwarten, darüber hinaus ist das Einsaugen möglicherweise vorkommender Säugetiere unter Berücksichtigung ihrer Lebensweise, ihrer Größe und ihres Schwimmvermögens ausgeschlossen Vögel (Aves) einige der von THEUNERT (2008a) genannten 47 Arten kommen gemäß Atlas der Brutvögel in Niedersachsen und Bremen 2005–2008 (KRÜGER et al. 2014) im Gebiet als Brutvögel vor, darüber hinaus können weitere als Durchzügler oder Wintergäste auftreten, aber das Einsaugen vorkommender Vögel ist unter Berücksichtigung ihrer Lebensweise, ihrer Größe und ihres Schwimmvermögens nicht zu besorgen Reptilien (Reptilia) ein Vorkommen der einzigen von THEUNERT (2008a) genannten Art ist aufgrund ihrer Lebensraumansprüche wenig wahrscheinlich und ein Einsaugen auch unter Berücksichtigung der vorwiegend landgebundenen Lebensweise, Größe und Schwimmfähigkeit der Art nicht zu erwarten Amphibien (Amphibia) ein Vorkommen von drei der fünf von THEUNERT (2008a) genannten Art in Ihme und Leine ist aufgrund ihrer Lebensraumansprüche nicht zu erwarten; das Vorkommen der beiden übrigen Arten ist nicht ganz ausgeschlossen, aber eine Gefährdung adulter Tiere durch Einsaugen besteht aufgrund ihrer Schwimmfähigkeit nicht und das Vorkommen von Laich und Larven im Umfeld der Entnahmestellen ist aufgrund der dort vorhandenen Uferstruktur und dem Fehlen einer ausreichenden Wasservegetation nicht zu erwarten Käfer (Coleoptera) die einzige von THEUNERT (2008b) genannte Art ist ausgestorben Webspinnen (Araneae) die einzige von THEUNERT (2008b) genannte Art ist ausgestorben 22.03.2016 ARSU GmbH, Oldenburg Wasserrechtliches Erlaubnisverfahren für die Kraftwerke Herrenhausen und Linden 31 Krebse (Crustacea) die einzige von THEUNERT (2008b) genannte Art ist im Wirkraum der beantragten Benutzungen nicht zu erwarten, da sie nur noch mit wenigen Populationen in isolierten Fließgewässerabschnitten und Stillgewässern vorkommt. Weitergehende Angaben zur Relevanzprüfung für diese Tiergruppen finden sich in Anhang 1 dieser Unterlage. Hingegen ist für verschiedene Arten der folgenden Gruppen eine genauere Prüfung des Eintretens von Verbotstatbeständen erforderlich, die in Kapitel 6 erfolgt: Fische und Rundmäuler (Pisces und Cyclostoma) Zwei der fünf von THEUNERT (2008a) genannten Arten sind ausgestorben und daher nicht relevant. Das Vorkommen der besonders geschützten Arten Aal (Anguilla anguilla), Bachneunauge (Lampetra planeri), Flussneunauge (Lampetra fluviatilis), Meerneunauge (Petromyzon marinus) bzw. ihrer Larven ist jedoch nachgewiesen oder zu erwarten (vgl. auch Anhang 1). Sie könnten daher vom Einsaugen mit dem Kühlwasser in artenschutzrechtlich relevantem Maße betroffen sein. Libellen (Odonata) Alle heimischen Libellen-Arten sind besonders, einige darüber hinaus auch streng geschützt. THEUNERT (2008b) nennt insgesamt elf Klein- und 15 Großlibellen-Arten, für die Fließgewässer von Bedeutung sind (vgl. Anhang 1). Drei dieser Arten wurden von BIOCONSULT (2014, 2016b) bei den Makrozoobenthos-Untersuchungen als Larven in Ihme und Leine nachgewiesen. Es ist jedoch davon auszugehen, dass weitere Arten vorkommen, da weitere Libellen-Larven nachgewiesen, aber nicht bis zur Art bestimmt wurden. Insgesamt dreizehn der von THEUNERT (2008b) genannten Arten sind aufgrund ihrer Lebensraumansprüche im Untersuchungsbereich von Ihme und Leine nicht zu erwarten, bei den übrigen Arten kann ein Vorkommen jedoch nicht ausgeschlossen werden. Die folgenden besonders geschützten Libellen-Arten könnten daher aufgrund ihres nachgewiesenen oder potenziell möglichen Vorkommens in artenschutzrechtlich relevantem Maße betroffen sein: Gebänderte Prachtlibelle (Calopteryx splendens), Blauflügel-Prachtlibelle (Calopteryx virgo), Hufeisen-Azurjungfer (Coenagrion puella), Gewöhnliche Pechlibelle (Ischnura elegans), Frühe Adonislibelle (Pyrrhosoma nymphula), Weidenjungfer (Lestes viridis), Gewöhnliche Winterlibelle (Sympecma fusca), ARSU GmbH, Oldenburg 22.03.2016 32 Artenschutzrechtlicher Fachbeitrag Gewöhnliche Federlibelle (Platycnemis pennipes) Braune Mosaikjungfer (Aeshna grandis), Früher Schilfjäger (Brachytron pratense), Gewöhnliche Keiljungfer (Gomphus vulgatissimus), Grüne Flussjungfer (Ophiogomphus cecilia), Spitzenfleck (Libellula fulva). Von diesen als relevant eingestuften 13 Arten ist nur die Grüne Flussjungfer streng geschützt. Weichtiere (Mollusca) THEUNERT (2008b) nennt insgesamt sieben besonders geschützte Muschel-Arten, für die Fließgewässer bedeutende Habitate sind (vgl. Anhang 1). Mit der Malermuschel (Unio pictorum) wurde eine dieser Arten 2013 von BIOCONSULT (2016b) nachgewiesen. Das Vorkommen von vier weiteren Arten ist möglich, zumal 2014 von BIOCONSULT (2014) Larven von Anodonta und Unio festgestellt wurden, die jedoch nicht bis zur Art bestimmt wurden. Das Vorkommen der übrigen beiden Arten kann jedoch ausgeschlossen werden. Als relevant wurden die folgenden besonders geschützten Muschel-Arten identifiziert: Flache Teichmuscheln (Anodonta anatina), Gewöhnliche Teichmuschel (Anodonta cygnea), Abgeplattete Teichmuschel (Pseudanodonta complanata), Malermuschel (Unio pictorum), Große Flussmuschel (Unio tumidus). Von diesen fünf Arten ist nur die Abgeplattete Teichmuschel streng geschützt. 22.03.2016 ARSU GmbH, Oldenburg Wasserrechtliches Erlaubnisverfahren für die Kraftwerke Herrenhausen und Linden 6. 33 Prüfung des Eintretens von Verbotstatbeständen Entsprechend der Art des Projekts kommt es weder zu einer Inanspruchnahme von Flächen oder eines Raumvolumens inner- oder außerhalb der Gewässer noch zu relevanten Störwirkungen durch optische oder akustische Emissionen. Als einziger für die Prüfung des Eintretens von Verbotstatbeständen relevanter Wirkfaktor wurde in Kapitel 3 das Einsaugen von Organismen mit dem Flusswasser identifiziert. Es kann bei besonders geschützten Individuen zu deren Schädigung oder Tötung führen, was den Verbotstatbestand nach § 44 Abs. 1 Nr. 1 BNatSchG erfüllen würde. Für die in Kapitel 5 als relevant ermittelten Tierarten aus den Gruppen Fische und Rundmäuler Libellen Weichtiere wird daher nachfolgend geprüft, ob das Eintreten dieses Verbotstatbestandes durch die beantragte Benutzung zu erwarten ist, dabei werden die Arten einer Tiergruppe soweit möglich und sinnvoll zusammengefasst, um Wiederholungen zu minimieren. Relevante Pflanzenarten sind im Wirkraum nicht zu erwarten (vgl. Kap. 8), ein Verbotstatbestand nach § 44 Abs. 1 Nr. 4 BNatSchG kann somit ausgeschlossen werden. Auch das Eintreten eines Verbotstatbestandes nach § 44 Abs. 1 Nr. 2 oder Nr. 3 BNatSchG ist auf der Basis der Analyse der Wirkfaktoren nicht zu besorgen (vgl. Kap. 3). Grundlagen der Prognose sind unter anderem Angaben zu den einzelnen Arten, ihrem Schutzund Gefährdungsstatus, ihrer Verbreitung, ihren Lebensraumansprüchen und Verhaltensweisen sowie ihrem Vorkommen im Einflussbereich der beantragten Benutzung, die in Anhang 2 bis Anhang 4 dieser Unterlage zusammengestellt sind. 6.1 Prognose und Bewertung der Schädigung von besonders geschützten Fischen und Rundmäulern nach § 44 BNatSchG Relevante Arten dieser Tiergruppe sind nach Kapitel 5 der Aal (Anguilla anguilla) sowie das Bach⁻, das Fluss- und das Meerneunauge (Lampetra planeri, L. fluviatilis und Petromyzon marinus). Beschreibungen dieser besonders geschützten Arten befinden sich in Anhang 2. Zur Feststellung und Beurteilung von möglichen Fischschädigungen durch den Betrieb der Kühlwasserentnahmebauwerke in Herrenhausen und Linden hat BIOCONSULT (2015) von März bis November 2014 Untersuchungen durchgeführt, bei denen an jeweils 18 Terminen pro Entnahmebauwerk sowohl tagsüber als auch nachts das Rechenabwurfmaterial und das Abspritzwasser der Korbsiebbandanlagen auf eingesogene Fische und Rundmäuler untersucht wurde. Dabei wurde auch die Vitalität bzw. Mortalität der eingesogenen Fische und Rundmäuler ermittelt. Diese Untersuchungen sind Grundlage der nachfolgenden Prognose. ARSU GmbH, Oldenburg 22.03.2016 34 6.1.1 Artenschutzrechtlicher Fachbeitrag Werden wildlebende Tiere gefangen, verletzt, getötet oder ihre Entwicklungsformen aus der Natur entnommen, beschädigt oder zerstört? Einsaugen mit dem Kühlwasser in Linden Aale pflanzen sich im Sargassomeer fort, ihre Weidenblattlarven entwickeln sich noch im marinen Bereich zu Glasaalen, die in den Mündungsbereichen und Unterläufen der großen Ströme zu juvenilen Gelbaalen heranwachsen. Eine nutzungsbedingte Schädigung von Laich oder Larven der Aale ist daher ausgeschlossen. Ein Tötungs- oder Verletzungsrisiko durch das Einsaugen von Neunaugen-Laich besteht ebenfalls nicht. Zwar wird wahrscheinlich ein großer Teil der Eier mit der Strömung aus den Laichgruben verdriftet und könnte eingesogen werden, aber nach den vorliegenden Kenntnissen (KRAPPE et al. 2012) entwickeln sich ohnehin nur die Neunaugen-Eier, die in der Laichgrube verbleiben. Ein signifikant erhöhtes Tötungs- oder Verletzungsrisikos für Neunaugen-Laich infolge der Kühlwasserentnahme in Linden ist daher auszuschließen. Neunaugen-Larven, (Querder) können jedoch trotz ihrer Lebensweise im Sediment eingesogen werden, wie die Untersuchungen von BIOCONSULT (2015) gezeigt haben. In Linden wurden bei einer untersuchten Kühlwassermenge von ca. 381.390 m³ insgesamt acht Lampetra-Querder (Bach- und Flussneunaugen) im Abspritzwasser der Korbsiebbandanlage festgestellt. Sie wurden aber durch das Einsaugen und das Abspritzen an der Siebbandanlage nicht sichtbar geschädigt und zeigten auch keine Folgemortalität (vgl. BIOCONSULT 2015). Es ist daher davon auszugehen, dass eingesogene Neunaugen-Querder mit dem Spülwasser vital in das vorhandene Sammelbecken des HKW Linden gelangen. Juvenile oder adulte Aale oder Neunaugen werden am Entnahmebauwerk in Linden nach den Untersuchungen von BIOCONSULT (2015) nicht eingesogen. Sie sind ausreichend groß und schwimmstark, um dem Sog der Kühlwasserentnahme zu entgehen. Sollten dennoch einzelne Individuen eingesogen werden, gelangen sie ebenfalls in das vorhandene Sammelbecken. Da es sich um robuste Arten handelt, ist davon auszugehen, dass sie – wie die Neunaugen-Querder – nach der Siebbandpassage in der Regel noch vital sind (vgl. SPÄH 2015). Bei Betrieb der in Linden zur Minimierung der nutzungsbedingten Beeinträchtigungen geplanten schonenden Fischrückführung für die im Rechenabwurf und Abspritzwasser der Korbsiebbandanlage enthaltenen Organismen (vgl. Teil A der naturschutzfachlichen Unterlagen) können die eingesogenen und ins Sammelbecken abgeleiteten Neunaugen-Querder über die geplante Rückführleitung im Freigefälle vital in die Ihme zurückgelangen. Entsprechendes gilt gegebenenfalls auch für möglicherweise eingesogene juvenile oder adulte Aale oder Neunaugen. Zu erwarten ist, dass die mobilen, schwimmfähigen Tiere aufgrund der Strömungsverhältnisse im Sammelbecken überwiegend entweder direkt mit der Strömung in die Rückführleitung gelangen oder sich innerhalb des Sammelbeckens aktiv zum Ablauf der Rückführleitung orientieren (vgl. Kap. 3.2 und (SPÄH 2015)). Das gilt auch für die Querder, die sich gern mit der Strömung verdriften lassen, aber auch aktiv schwimmen und deren Wanderungen meist stromabwärts gerichtet sind (vgl. KRAPPE et al. 2012). Nach Beobachtungen von SPÄH (2015) orientierten sich Querder bei Hälterungsversuchen zunächst schwimmend und dringen nicht sofort in das Sediment ein. Daher erwartet er im Sammelbecken ein ähnliches Verhalten und dass die Querder weitgehend in die Ihme zurückgeführt werden. 22.03.2016 ARSU GmbH, Oldenburg Wasserrechtliches Erlaubnisverfahren für die Kraftwerke Herrenhausen und Linden 35 Zu erwarten ist daher, dass am HKW Linden eingesogene Querder, Neunaugen und Aale bei Betrieb der geplanten Rückführleitung überwiegend unbeschadet in die Ihme zurückgeleitet werden. Schädigungen oder auch Verluste einzelnen Individuen können jedoch nicht ganz ausgeschlossen werden. Bei Rückführung des Spülwassers aus dem Sammelbecken mittels Tauchpumpen oder unter Einsatz eines Zerhäckslers zur Behebung oder Vermeidung von Verstopfungen der geplanten Rückführleitung ist jedoch von der Tötung aller ins Sammelbecken gelangenden Individuen auszugehen. Da diese Art der Rückführung jedoch zukünftig zur Minimierung der Beeinträchtigungen auf wenige Tage im Jahr beschränkt ist (vgl. Kap. 4.2.3 von Teil A der naturschutzfachlichen Unterlagen), sind davon gegebenenfalls allenfalls wenige Individuen der Querder, Neunaugen und Aale betroffen. Insgesamt ist daher eine Schädigung oder Tötung einzelner Individuen nicht auszuschließen, ein signifikant erhöhtes Tötungs- oder Verletzungsrisikos für Aale und Neunaugen einschließlich ihrer Entwicklungsformen durch die beantragte Kühlwasserentnahme in Linden ist jedoch nicht zu prognostizieren. Einsaugen mit dem Kühlwasser in Herrenhausen Aus den oben bereits genannten Gründen ergibt sich auch durch die Kühlwasserentnahme in Herrenhausen kein signifikant erhöhtes Tötungs- oder Verletzungsrisikos für Neunaugen-Laich sowie für Glasaale, Weidblattlarven und Laich der Aale. Die Untersuchungen von BIOCONSULT (2015) haben aber gezeigt, dass in Herrenhausen Neunaugen-Querder trotz ihrer Lebensweise im Sediment in bedeutender Anzahl eingesogen werden. Bei einer untersuchten Kühlwassermenge von ca. 188.840 m³ wurden insgesamt 71 Lampetra-Querder im Abspritzwasser der Korbsiebbandanlage von Entnahmebauwerk I festgestellt. Mehr als 85 % der Querder wurde nachts eingesogen, was der vorherrschenden Nachtaktivität der Neunaugen entspricht. Und rund 70 % der Querder wurden an drei Spitzentagen zwischen April und Juni eingesogen, was sich mit der Angabe von KRAPPE et al. (2012) deckt, dass Neunaugen-Querder im Frühjahr eine Tendenz zur Ausbreitung haben. Dazu verlassen sie das Sediment und lassen sich mit der Strömung verdriften, um neue Sedimentbänke zu besiedeln. Juvenile oder adulte Aale und Neunaugen wurden bei den Untersuchungen (BIOCONSULT 2015) auch in Herrenhausen nicht eingesogen. Dennoch kann auch hier nicht ganz ausgeschlossen werden, dass einzelne Individuen die Rechen passieren und eingesogen werden. Bei Betrieb von Entnahmebauwerk I werden in Herrenhausen eingesogene Querder, Neunaugen und Aale jedoch durch die Korbsiebbandanlage zurückgehalten und von dort mit dem Abspritzwasser über die bestehende Freigefälleleitung schonend in die Leine zurückgeführt. Wie in Linden ist dabei nach den vorliegenden Untersuchungen und Erfahrungen davon auszugehen, dass die betroffenen Individuen die Siebbandpassage und Rückführung weitestgehend unbeschadet und vital überstehen. Entnahmebauwerk II in Herrenhausen ist jedoch nicht mit einer Siebbandanlage ausgerüstet, so dass bei dessen Betrieb von einer Tötung aller eingesogenen Individuen auszugehen ist. Da die Nutzung dieser Entnahmelinie jedoch auf wenige Tage im Jahr mit geringen Entnahmemengen (maximal 16.800 m³/d) beschränkt ist (vgl. Kap. 4.1.3 von Teil A der naturschutzfachlichen ARSU GmbH, Oldenburg 22.03.2016 36 Artenschutzrechtlicher Fachbeitrag Unterlagen), sind aufgrund des geringen Umfangs der Wasserentnahme allenfalls wenige Individuen der Querder, Neunaugen und Aale betroffen. Insgesamt ist daher auch in Herrenhausen eine Schädigung oder Tötung einzelner Individuen durch die beantragte Kühlwasserentnahme nicht auszuschließen, ein signifikant erhöhtes Tötungs- oder Verletzungsrisikos für Aale und Neunaugen einschließlich ihrer Entwicklungsformen jedoch nicht zu erwarten. 6.1.2 Fazit Weder in Linden noch in Herrenhausen ergibt sich ein signifikant erhöhtes Tötungs- und Verletzungsrisiko für Aale und Neunaugen einschließlich ihrer Entwicklungsformen. Das Eintreten anderer Verbotstatbestände für diese Arten kann aufgrund der Analyse der Wirkfaktoren der beantragten Gewässerbenutzung (vgl. Kap. 3) ebenfalls ausgeschlossen werden. Somit wird durch die beantragte Gewässerbenutzung für die besonders geschützten Arten Aal, Bach-, Fluss- und Meerneunauge kein artenschutzrechtlicher Verbotstatbestand erfüllt. 6.2 Prognose und Bewertung der Schädigung von besonders bzw. streng geschützten Libellen nach § 44 BNatSchG In der Ihme und Leine zwischen dem Wehr Schneller Graben und der Kreuzung mit dem Mittellandkanal wurden bei den Untersuchungen des Makrozoobenthos (BIOCONSULT 2014, 2016b) Larven der Libellen-Arten Gebänderte Prachtlibelle (Calopteryx splendens), Gewöhnliche Federlibelle (Platycnemis pennipes), Gewöhnliche Keiljungfer (Gomphus vulgatissimus) sowie einer weiteren Calopteryx- und einer Schlanklibellen-Art nachgewiesen. Da keine Untersuchungen zur Libellenfauna im Untersuchungsraum vorliegen, wurden anhand einer Potentialanalyse in Kapitel 5 insgesamt 13 besonders geschützte Libellen-Arten ermittelt, die Leine und Ihme tatsächlich oder möglicherweise zur Fortpflanzung nutzen. Darunter ist mit der Grünen Flussjungfer (Ophiogomphus cecilia) auch eine streng geschützte Art. Beschreibungen der Arten befinden sich in Anhang 3. 6.2.1 Werden wildlebende Tiere gefangen, verletzt, getötet oder ihre Entwicklungsformen aus der Natur entnommen, beschädigt oder zerstört? Einsaugen mit dem Kühlwasser in Linden Hinsichtlich der möglichen Schädigung oder Tötung durch Einsaugen ist zwischen den adulten Libellen sowie den Eiern und Larven zu unterscheiden. Die Imagines halten sich zwar häufig am Wasser, in der Regel aber nicht im Wasser auf. Während die Weidenjunger (Lestes viridis) auch bei der Eiablage in die Ufergehölze nicht direkt mit dem Wasser in Berührung kommt, tippen andere Arten bei der exophytischen Eiablage ihren Hinterleib ins Wasser ein (Gewöhnliche Keiljungfer, grüne Flussjungfer und Spitzenfleck) oder gehen bei der endophytischen Eiablage mit dem Hinterleib oder (wie die Gebänderte Prachtlibelle, die Blauflügel-Prachtlibelle, die Gewöhnliche Federlibelle und die Gewöhnliche Pechlibelle) sogar ganz unter Wasser. Dabei halten sie sich 22.03.2016 ARSU GmbH, Oldenburg Wasserrechtliches Erlaubnisverfahren für die Kraftwerke Herrenhausen und Linden 37 aber an den Pflanzen fest. Ein signifikant erhöhtes Risiko, dass Imagines von Libellen mit dem Flusswasser der Ihme eingesogen werden, besteht daher nicht. Einen großen Teil ihres Lebens verbringen Libellen als Larven im Gewässer, unterscheiden sich dabei aber in ihrer Lebensweise und ihrer Gefährdung durch Einsaugen: Die Larven der Gewöhnlichen Keiljungfer und der Grünen Flussjungfer leben im Sediment und sind so vor Verdriftung geschützt. Sie können aber, beispielsweise wenn sie das Sediment zum Häuten verlassen, verdriftet werden und zeigen zum Teil saisonale Wanderungen. Die Larven der übrigen elf tatsächlich oder potenziell vorkommenden Arten leben entweder frei auf dem Gewässergrund, zwischen Wasser- bzw. Uferpflanzen oder an den Pflanzen. Allerdings graben sich ältere Larven des Spitzenflecks (Libellula fulva) zum Teil ebenfalls im Sediment ein. Die Larven der Gewöhnliche Winterlibelle (Sympecma fusca) gelten dabei als flinke Schwimmer, sind aber nur bei kaum wahrnehmbarer Strömung anzutreffen, während die der Hufeisen-Azurjungfer (Coenagrion puella) nur selten schwimmen. Die Larven der Frühen Adonislibelle ( Pyrrhosoma nymphula) lassen sich auch mit der Strömung treiben. Die Larven der Prachtlibellen (Calopteryx splendens, C. virgo) leben zwar sehr stationär vorwiegend an Pflanzen und gelangen bei Verdriftung normalerweise bereits nach wenigen Metern auf den Gewässerboden und von dort wieder auf geeignetes Pflanzensubstrat, aber dennoch hat SPÄH (2008) häufig Larven von Calopteryx virgo im Abspritzwasser der Siebbänder von Wasserentnahmen aus der Else und der Werre gefunden. Trotz der unterschiedlichen Lebensweisen ist bei allen 13 Libellen-Arten also ein Einsaugen ihrer Larven durch die beantragte Benutzung denkbar. Geschieht dies, gelangen sie mit dem Rechenabwurf und dem Abspritzwasser der Korbsiebbandanlage in das vorhandene Sammelbecken des HKW Linden. SPÄH (2008) hat festgestellt, dass auch sehr empfindliche Formen, wie zum Beispiel große Larven von Calopteryx virgo von bis zu 40 mm Körperlänge im abgespülten Getreibsel oft völlig unverletzt sind. Er kommt zu dem Schluss, dass sie bei der Siebbandpassage nur in relativ geringem Umfang geschädigt werden und zu einem hohen Prozentsatz gänzlich unbeschädigt bleiben. Auch bezüglich der Gefährdung von Libellen-Eiern durch Einsaugen gibt es aufgrund der verschiedenen Eiablagestrategien Unterschiede zwischen den Arten: Die Gewöhnliche Keiljungfer, die Grüne Flussjungfer und der Spitzenfleck geben ihre Eier ins Wasser ab, wo sie entweder zu Boden sinken oder im Wasser treiben. Gelangen Eier bzw. Eiballen dieser Arten in den Sog des Entnahmebauwerks, werden sie wahrscheinlich geschädigt bzw. getötet. Dies kann auch nicht durch zusätzliche Vermeidungsmaßnahmen verhindert werden. In Linden ist eine Betroffenheit von Eiern des Spitzenflecks jedoch als unwahrscheinlich einzustufen, da die Eiablage dieser Art in seichtem Wasser im Bereich bzw. in der Nähe von Carex-Horsten oder Röhrichtsäumen erfolgt, die im betreffenden Abschnitt der Ihme nicht ausgebildet sind. Die Eier der Gewöhnlichen Keiljungfer verdriften nur einige Meter bevor sie zu Boden sinken und benötigen nur wenige Wochen für die Embryonalentwicklung, dennoch kann nicht ganz ausgeschlossen werden, dass es in Linden zum Einsaugen von Eiern dieser Art kommen kann. ARSU GmbH, Oldenburg 22.03.2016 38 Artenschutzrechtlicher Fachbeitrag Während der NLWKN (2011d) davon ausgeht, dass die Grüne Flussjungfer ihre Eier meist im Schutz dichter Vegetation ablegt, die im Einwirkungsbereich der Entnahme in Linden nicht zu erwarten ist, berichten PETERSEN et al. (2003), dass die Eiablage in der Gewässermitte erfolgt. Da die Eiballen mit der Strömung verdriften, kann nicht ausgeschlossen werden, dass es in Linden zum Einsaugen von Eiern dieser Art kommt. Somit kann bei den Arten Gewöhnliche Keiljungfer und Grüne Flussjungfer eine durch die beantragte Benutzung bedingte Schädigung bzw. Tötung von Eiern in Linden nicht ausgeschlossen werden. Für die Gewöhnliche Keiljungfer liegt jedoch für die Ihme nur ein Nachweis von Larven in geringer Dichte (0,4 Ind./m²) in mehr als 2 km Entfernung zur Entnahmestelle vor. Nachweise für die Grüne Flussjungfer liegen nicht vor, aber ein Vorkommen kann nicht ausgeschlossen werden, da sie bisweilen auch in technisch ausgebauten Fließgewässern vorkommt. Als typischer Lebensraum werden jedoch Bäche und Flüsse mit geringer Wassertiefe und einem feinsandig-kiesigen Gewässergrund mit Flachwasserbereichen genannt, so dass die Ihme im Bereich der Wasserentnahme als suboptimales Habitat für die Flussjungfer einzustufen ist. Daher ist für die Eier dieser beiden Arten nicht von einem signifikant erhöhten Tötungsrisiko auszugehen. Eier, die wie die der Weidenjungfer in Ufergehölze oder die der Prachtlibellen und der Frühen Adonislibelle in lebende Wasserpflanzen gelegt werden, sind nicht durch Einsaugen gefährdet. Die Arten Hufeisen-Azurjungfer, Gewöhnliche Pechlibelle, Gewöhnliche Winterlibelle, Gewöhnliche Federlibelle, Braune Mosaikjungfer und Früher Schilfjäger legen ihre Eier ebenfalls endophytisch ab, nutzen dabei aber auch oder sogar bevorzugt abgestorbene und schwimmende Pflanzenteile oder Hölzer. Sie können daher grundsätzlich mit dem Treibsel eingesogen werden und gelangen dann (wie eingesogene Larven) mit dem Rechenabwurf und dem Abspritzwasser der Korbsiebbandanlagen in das vorhandene Sammelbecken des HKW Linden. Da sie von den Pflanzenteilen, in denen sie sich befinden, geschützt werden, ist dabei das Risiko einer Beschädigung der Eier gering. Bei Betrieb der in Linden zur Minimierung der nutzungsbedingten Beeinträchtigungen geplanten schonenden Rückführung des Spülwassers von der Rechen- und Korbsiebbandanlage und der darin enthaltenen Organismen (vgl. Teil A der naturschutzfachlichen Unterlagen) können auch die betroffenen und ins Sammelbecken abgeleiteten Entwicklungsformen der Libellen zum größten Teil vital in die Ihme zurückgelangen. Zu erwarten ist, dass im pflanzlichen Treibsel enthaltene Libellen-Eier aufgrund der Strömungsverhältnisse im Sammelbecken überwiegend mit der Strömung direkt in die Rückführleitung gelangen, weil das Treibsel auf oder im Wasser schwimmt. Nach Beobachtungen von Späh5 haften Libellen-Larven im Abspritzwasser ebenfalls vorwiegend am Treibsel und werden mit diesem aus dem Sammelbecken in die Rückführleitung geschwemmt. Aber auch frei schwimmende Libellen-Larven werden voraussichtlich überwiegend in die Rückführleitung gelangen. Es ist jedoch nicht auszuschließen, dass sich einzelne Individuen am Grund oder an den Wänden des Sammelbeckens anheften und daher nicht oder nur verzögert in die Ihme zurückgeführt werden. Auch wenn zu erwarten ist, dass am HKW Linden eingesogene Libellen-Eier und –Larven bei Betrieb der geplanten Rückführleitung zu einem hohen Prozentsatz weitgehend unbeschadet in 5 fernmündliche Mitteilung vom 24.11.2015 22.03.2016 ARSU GmbH, Oldenburg Wasserrechtliches Erlaubnisverfahren für die Kraftwerke Herrenhausen und Linden 39 die Ihme zurückgeleitet werden, sind Schädigungen oder auch Verluste einzelner Individuen möglich. Bei Rückführung des Spülwassers aus dem Sammelbecken mittels Tauchpumpen oder unter Einsatz eines Zerhäckslers ist dagegen von der Tötung aller ins Sammelbecken gelangenden Individuen auszugehen. Da diese Art der Rückführung jedoch zukünftig auf wenige Tage im Jahr beschränkt ist (vgl. Kap. 4.2.3 von Teil A), sind davon gegebenenfalls nur wenige Individuen der Entwicklungsformen von Libellen betroffen. Bei der Bewertung der Tötungsrisiken für Libellen-Eier und –Larven ist auch die Habitatqualität der Ihme im Wirkraum der beantragten Wasserentnahme zu berücksichtigen. Diese ist aufgrund der anthropogenen Überformung des Gewässers erheblich eingeschränkt, insbesondere durch die verbauten Ufer sowie durch das Fehlen von Flachwasserzonen, geschützten Buchten und einer ausgeprägten Unterwasser-, Schwimmblatt- oder gewässertypischen Ufervegetation. Auch die Qualität der angrenzenden Landhabitate für adulte Libellen, die die Ihme zur Fortpflanzung nutzen könnten, ist durch die innerstädtische Lage und die starke anthropogene Überformung der vorhandenen Grünflächen gering. Daher ist davon auszugehen, dass die Ihme im Bereich der beantragten Wasserentnahme für das HKW Linden für Libellen von geringer Bedeutung ist. Insgesamt ist daher trotz der geplanten Rückführung eine Schädigung und Tötung von einzelnen Libellen-Eiern oder –Larven durch die beantragte Wasserentnahme in Linden nicht ausgeschlossen, aber unter Berücksichtigung der eingeschränkten Habitatqualität der Ihme ist nicht von einem signifikant erhöhtem Tötungsrisiko auszugehen. Einsaugen mit dem Kühlwasser in Herrenhausen Aufgrund der Verhaltensweise der Imagines (vgl. oben) kann ein signifikant erhöhtes Risiko, dass Imagines von Libellen mit dem Flusswasser der Leine in Herrenhausen eingesogen werden, ausgeschlossen werden. Auch für Eier, die wie die der Weidenjungfer in Ufergehölze oder die der Prachtlibellen und der Frühen Adonislibelle in lebende Wasserpflanzen gelegt werden, besteht in Herrenhausen keine Gefährdung durch Einsaugen. Eier der Gewöhnliche Keiljungfer, der Grüne Flussjungfer und des Spitzenflecks können dagegen grundsätzlich auch in Herrenhausen durch Einsaugen geschädigt und getötet werden. Das kann hier ebenfalls nicht durch zusätzliche Vermeidungsmaßnahmen verhindert werden. Wie in Linden ist jedoch auch in Herrenhausen eine Betroffenheit von Eiern des Spitzenflecks als unwahrscheinlich einzustufen, da seichtes Wasser, Carex-Horste und Röhrichtsäume im betreffenden Abschnitt der Leine nicht ausgebildet sind. Für die Arten Gewöhnliche Keiljungfer und Grüne Flussjungfer kann auch in Herrenhausen eine Schädigung bzw. Tötung von Eiern durch die beantragte Benutzung nicht ausgeschlossen werden, aber aus den schon für Linden angeführten Gründen ist auch infolge der Wasserentnahme in Herrenhausen nicht von einem signifikant erhöhten Tötungsrisiko für Eier dieser Arten auszugehen. Auch Eier der übrigen Arten sowie Libellen-Larven können in Herrenhausen eingesogen werden. Bei Betrieb des Entnahmebauwerks I in Herrenhausen gelangen eingesogene Libellen-Larven mit dem Abspritzwasser der Siebbandanlage über die bereits bestehende Fischrückführung wieder in die Leine und bleiben dabei überwiegend unbeschädigt (vgl. SPÄH 2008). ARSU GmbH, Oldenburg 22.03.2016 40 Artenschutzrechtlicher Fachbeitrag können Larven der Winterlibelle (Sympecma fusca), der Federlibelle und des Spitzenflecks, die sich auch auf oder unter abgestorbenen Pflanzenteilen, Treibholz etc. aufhalten, mit größerem Getreibsel auch vom Feinrechen zurückgehalten und mit dem Rechenabwurf entsorgt, also aus dem Gewässer entnommen und getötet werden. Allerdings bevorzugen die Larven aller drei Arten strömungsberuhigte Bereiche, die der Winterlibelle tolerieren sogar maximal eine kaum wahrnehmbare Strömung. Unter Berücksichtigung der eingeschränkten Eignung der Leine im Bereich der Wasserentnahme für diese Arten und der Tatsache, dass die Anheftung von Larven an Treibselbestandteile nur einer von verschiedenen möglichen Aufenthaltsorten ihrer Larven ist, kann eine Tötung zwar nicht ganz ausgeschlossen werden, aber es ist nicht von einem signifikant erhöhten Risiko auszugehen. können Eier der Arten Hufeisen-Azurjungfer, Gewöhnliche Pechlibelle, Gewöhnliche Winterlibelle, Gewöhnliche Federlibelle, Braune Mosaikjungfer und Früher Schilfjäger mit dem Getreibsel eingesogen werden. Passiert dieses den Feinrechen, wird es mit dem Abspritzwasser der Korbsiebbandanlage über die bereits vorhandene Fischrückführungsrinne in die Leine zurückgegeben, wobei das Risiko einer Beschädigung von Libellen-Eiern auch hier gering ist. wird aber größeres Getreibsel, das durch den Feinrechen zurückgehalten wird, in einen Container abgeworfen und entsorgt. Sofern daran Libellen-Eier gebunden sind, werden diese aus dem Gewässer entnommen und getötet. Die möglicherweise betroffenen Arten bevorzugen allerdings überwiegend stehende bis langsam fließende Gewässer und strömungsberuhigte sowie struktur- und pflanzenreiche Bereiche und benötigen zum Teil gut entwickelte Verlandungszonen, Schwimmblatt-, Röhricht- oder Seggenvegetation. Diese Habitatelemente können zwar in der Leine nicht ausgeschlossen werden, sind aber im Einwirkungsbereich des am Prallhang liegenden Entnahmebauwerks in Herrenhausen nicht oder nur eingeschränkt ausgebildet. Die relativ geringe Dichte von 0,4–2,5 Ind./m², in der die Larven der nachgewiesenen Arten festgestellt wurden, deutet ebenfalls auf eine eingeschränkte Eignung als Libellengewässer hin. Auch wenn nicht ausgeschlossen werden kann, dass mit dem Rechenabwurf von Entnahmebauwerk I in Herrenhausen Libellen-Eier aus dem Gewässer entnommen werden, ist daher nicht von einem signifikant erhöhten Tötungsrisiko auszugehen. Bei Betrieb des Entnahmebauwerks II in Herrenhausen werden hingegen alle eingesogenen Libellen-Eier und -Larven getötet, weil das Rechengut entsorgt wird und keine Siebbandanlage vorhanden ist, die kleineres Treibsel zurückhalten könnte. Zwar kann nicht ausgeschlossen werden, dass davon auch besonders geschützte Libellen-Larven betroffen sind, aber unter der Voraussetzung, dass die Entnahmelinie II tatsächlich nur an wenigen Tagen im Jahr mit geringen Entnahmemengen (maximal 16.800 m³/d) betrieben wird, ist aufgrund des geringen Umfangs der Wasserentnahme sowie der bereits beschriebenen eingeschränkten Eignung des betroffenen Leine-Abschnitts als Libellengewässer nicht von einem signifikant erhöhten Risiko auszugehen. Insgesamt ist zwar – wie in Linden – die Entnahme von Eiern oder Larven von besonders oder streng geschützten Libellen-Arten in Herrenhausen nicht ausgeschlossen, unter Berücksichtigung der bestehenden bzw. geplanten Vermeidungsmaßnahmen und der eingeschränkten Habitatqualität ist jedoch nicht von einem signifikant erhöhten Schädigungs- oder Tötungsrisiko durch die geplante Wasserentnahme auszugehen. 22.03.2016 ARSU GmbH, Oldenburg Wasserrechtliches Erlaubnisverfahren für die Kraftwerke Herrenhausen und Linden 6.2.2 41 Fazit Sowohl in Linden als auch in Herrenhausen kann trotz der bestehenden bzw. geplanten Vermeidungsmaßnahmen (schonende Rückführung von Organismen) eine Schädigung und Tötung insbesondere von Eiern oder Larven verschiedener Libellen-Arten durch Einsaugen nicht ganz ausgeschlossen werden. Unter Berücksichtigung der erheblich eingeschränkten Habitatqualität der Gewässer im Umkreis der Entnahmestellen ist jedoch nicht von einem signifikant erhöhten Tötungsrisiko für die betroffenen Arten durch die beantragte Nutzung auszugehen. Das Eintreten anderer Verbotstatbestände für Libellen-Arten kann aufgrund der Analyse der Wirkfaktoren der beantragten Gewässerbenutzung (vgl. Kap. 3) ebenfalls ausgeschlossen werden. Somit wird durch die beantragte Gewässerbenutzung weder für die streng geschützte Grüne Flussjungfer (Ophiogomphus cecilia) noch für weitere zwölf tatsächlich bzw. möglicherweise vorkommende besonders geschützte Libellen-Arten ein artenschutzrechtlicher Verbotstatbestand erfüllt. 6.3 Prognose und Bewertung der Schädigung von besonders bzw. streng geschützten Weichtieren nach § 44 BNatSchG Relevante Arten dieser Tiergruppe sind nach Kapitel 5 die in der Leine nachgewiesene Malermuschel (Unio pictorum) sowie die möglicherweise ebenfalls vorkommenden Teich- und Flussmuscheln (Anodonta anatina, A. cygnea, Pseudanodonta complanata, Unio tumidus). Sie sind besonders geschützt, die Abgeplattete Teichmuschel ist darüber hinaus streng geschützt. Beschreibungen der einzelnen Arten befinden sich in Anhang 4. 6.3.1 Werden wildlebende Tiere gefangen, verletzt, getötet oder ihre Entwicklungsformen aus der Natur entnommen, beschädigt oder zerstört? Einsaugen mit dem Kühlwasser in Linden Besonders geschützte Süßwassermuscheln und ihre Entwicklungsformen sind grundsätzlich in unterschiedlichem Maße durch Einsaugen mit dem Kühlwasser gefährdet: Die Eier der besonders geschützten Süßwassermuscheln wachsen im Kiemenraum der adulten Tiere zu Larven heran. Daher sind sie nicht durch Einsaugen gefährdet. Die nur etwa 0,2–0,4 mm großen Muschellarven (Glochidien) werden jedoch ins Wasser abgegeben und können grundsätzlich eingesogen werden, solange sie sich noch nicht an Wirtsfische angeheftet haben. Aufgrund ihrer geringen Größe können sie auch nicht von der Siebbandanlage zurückgehalten werden. Glochidien, die sich in einem Wirtsfisch eingenistet haben, können auch mit diesem Wirtsfisch eingesogen werden. Die winzigen Jungmuscheln, die sich später wieder von den Wirtsfischen lösen, sind ebenfalls durch Einsaugen gefährdet, solange sie sich noch nicht im Sediment verankert bzw. eingegraben haben. ARSU GmbH, Oldenburg 22.03.2016 42 Artenschutzrechtlicher Fachbeitrag Danach sind die juvenilen und adulten Tiere durch ihre bodenbewohnende Lebensweise nur wenig durch Entnahme mit dem Kühlwasser gefährdet. Nur wenn sie durch andere Ereignisse aus dem Sediment ausgespült werden, können sie auch mit dem Kühlwasser eingesogen werden. Glochidien und die winzigen Jungmuscheln, die sich gerade von ihren Wirtsfischen gelöst haben, können, wenn sie mit dem Flusswasser eingesogen werden, aufgrund ihrer geringen Größe nicht von den Siebbandanlagen zurückgehalten werden. Sie können entsprechend auch nicht in die Ihme zurückgeführt werden. An Wirtsfische gebundene Glochidien können dagegen mit der geplanten Fischrückführung in die Ihme zurückgelangen. Allerdings können Jungfische einiger Wirtsfische nach den Untersuchungen von BIOCONSULT (2015) durch die Siebbandpassage von einer unmittelbaren Mortalität oder Folgemortalität betroffen sein, was auch zum Tot der betroffenen Glochidien führen könnte. Auch durch den zeitweiligen Betrieb der Tauchpumpen statt der geplanten Rückführleitung könnten an Wirtsfische gebundene Glochidien getötet werden. Heranwachsende Muscheln ausreichender Größe und adulte Muscheln würden durch die Siebbandanlage zurückgehalten und in das Sammelbecken der Rückführung abgeleitet. Aufgrund ihrer geringen Mobilität und ihres Eigengewichtes würden sie aber auch bei Betrieb der geplanten Rückführung voraussichtlich nur zu einem geringen Anteil vom Sammelbecken in die Rückführleitung und letztlich wieder in die Ihme gelangen. Vermutlich würde ein größerer Anteil im Sammelbecken des HKW Linden zurückbleiben und letztlich getötet. Eine Tötung besonders geschützter Süßwassermuscheln bzw. ihrer Entwicklungsformen durch die Wasserentnahme in Linden ist also nicht auszuschließen. Zu berücksichtigen ist jedoch, dass sich die Glochidien und die winzigen Jungmuscheln nur sehr kurzzeitig im freien Wasserkörper aufhalten und zudem auch natürlicherweise eine sehr hohe Mortalität aufweisen. Außerdem ist es wenig wahrscheinlich, dass sich größere Jungmuscheln oder adulte Muscheln im freien Wasser befinden und eingesogen werden. Zudem konnten geschützte Muscheln bei den Stichproben in der Ihme 2013 nicht und 2014 nur in geringer Dichte nachgewiesen werden (BIOCONSULT 2014, 2016b), so dass die Ihme als Muschelgewässer von entsprechend geringer Bedeutung ist. Darüber hinaus sind Muscheln auch bei der Probenahme zur Untersuchung der Fischschäden (BIOCONSULT 2015) nach Angaben von BioConsult6 nicht aufgefallen. Allerdings wurden die Proben auch nicht gezielt auf Muschelvorkommen im Abspritzwasser untersucht. Insgesamt ist daher ein signifikant erhöhtes Tötungsrisiko für Weichtiere durch die Wasserentnahme in Linden nicht zu erwarten. Einsaugen mit dem Kühlwasser in Herrenhausen Wie in Linden ist auch in Herrenhausen aus den oben gennannten Gründen eine durch die beantragte Gewässerbenutzung bedingte Tötung von Glochidien oder Jungmuscheln infolge der Wasserentnahme nicht auszuschließen. Sollten in Herrenhausen größere Muscheln eingesogen werden, würden sie bei Betrieb des Entnahmebauwerks I von der Siebbandanlage abgeschieden und über die bestehende Fischrückführung in die Leine zurückgeführt. Nur bei dem kurzzeitigen und mit reduzierter Wassermenge möglichen Betrieb von Entnahmebauwerk II würden gegebenenfalls auch eingesogene größere Muscheln getötet. 6 E-Mail von BioConsult vom 24.11.2015 22.03.2016 ARSU GmbH, Oldenburg Wasserrechtliches Erlaubnisverfahren für die Kraftwerke Herrenhausen und Linden 43 Zwar wurde die Malermuschel von BIOCONSULT (2014, 2016b) in der Leine oberhalb der Wasserentnahme nachgewiesen, aber nur in einer geringen Dichte (0,4 Ind./m³) und auch nur bei den Untersuchungen 2013, nicht jedoch 2014. Daher ist davon auszugehen, dass die Leine in diesem Bereich nur eine untergeordnete Bedeutung als Muschelgewässer hat. Berücksichtigt man dazu die hohe natürliche Mortalität und die nur kurze Anwesenheit der jungen Entwicklungsstadien der besonders geschützten Muscheln im freien Wasser sowie die geringe Wahrscheinlichkeit des Einsaugens von größeren Muscheln aufgrund ihrer sedimentgebundenen Lebensweise, dann ist nicht von einem signifikant erhöhtem Tötungsrisiko durch die Wasserentnahme in Herrenhausen auszugehen. 6.3.2 Fazit Sowohl in Linden als auch in Herrenhausen kann trotz der bestehenden bzw. geplanten Vermeidungsmaßnahmen (schonende Rückführung von Organismen) eine Schädigung und Tötung von Larven und winzigen Jungmuscheln der verschiedenen Arten durch Einsaugen nicht ganz ausgeschlossen werden. Unter Berücksichtigung der untergeordneten Bedeutung von Ihme und Leine als Habitat dieser Arten, der hohen natürlichen Mortalität und kurzem Anwesenheit der jungen Entwicklungsstadien im Wasser sowie der geringen Wahrscheinlichkeit des Einsaugens von größeren Muscheln aufgrund ihrer sedimentgebundenen Lebensweise ist jedoch nicht von einem signifikant erhöhten Tötungsrisiko durch die beantragte Benutzung auszugehen. Das Eintreten anderer Verbotstatbestände für Muschel-Arten kann aufgrund der Analyse der Wirkfaktoren der beantragten Gewässerbenutzung (vgl. Kap. 3) ebenfalls ausgeschlossen werden. Somit wird durch die beantragte Gewässerbenutzung weder für die streng geschützte Abgeplattete Teichmuschel noch für die besonders geschützten Arten Flache und Gewöhnliche Teichmuschel, Große Flussmuschel und Malermuschel ein artenschutzrechtlicher Verbotstatbestand erfüllt. ARSU GmbH, Oldenburg 22.03.2016 44 Artenschutzrechtlicher Fachbeitrag 7. Artenschutzrechtliches Fazit Die beantragte Gewässerbenutzung in Linden und Herrenhausen hat verschiedene Wirkungen auf Ihme und Leine. Die nutzungsbedingten Strömungsänderungen sowie die Einleitung von Nährund Schadstoffen sind so gering, dass artenschutzrechtlich relevante Auswirkungen auf geschützte Organismen nicht zu besorgen sind. Auch die Einleitung von Wärme sowie die damit verbundene Minderung des Sauerstoffgehalts werden soweit begrenzt das artenschutzrechtlich relevante Wirkungen nicht zu erwarten sind. Als einziger artenschutzrechtlich relevanter Wirkfaktor wurde die Entnahme von Organismen mit dem Kühlwasser identifiziert. Sie kann bei besonders geschützten Individuen zu deren Schädigung oder Tötung führen, was den Verbotstatbestand nach § 44 Abs. 1 Nr. 1 BNatSchG erfüllen würde und auch den Zielen der Europäischen Aalverordnung bzw. des Aalbewirtschaftungsplan entgegenstehen könnte. Das Eintreten anderer Verbotstatbestände kann bereits auf der Basis der Analyse der nutzungsbedingten Wirkfaktoren ausgeschlossen werden. Betroffen sein könnten Arten der Tiergruppen Fische und Rundmäuler, der Libellen und der Weichtiere, die im Wirkraum der beantragten Gewässerbenutzung nachgewiesen wurden oder potenziell vorkommen können und entsprechend empfindlich gegenüber dem Wirkfaktor Einsaugen sind. Als relevante Arten identifiziert wurden der Aal (Anguilla anguilla) sowie die Bach-, Fluss- und Meerneunaugen (Lampetra planeri, L. fluviatilis und Petromyzon marinus), die mit Ausnahme des Meerneunauges im Wirkraum der beantragten Benutzung nachgewiesen wurden und besonders geschützt sind, insgesamt dreizehn besonders geschützte Libellen-Arten, von denen mit der Gebänderte Prachtlibelle (Calopteryx splendens), der Gewöhnlichen Federlibelle (Platycnemis pennipes) und der Gewöhnlichen Keiljungfer (Gomphus vulgatissimus) drei im Betrachtungsraum als Larven nachgewiesen wurden und eine potenziell vorkommende Art (die Grüne Flussjungfer Ophiogomphus cecilia) nach Anhang IV der FFH-Richtlinie streng geschützt ist, insgesamt fünf besonders geschützte Muschel-Arten, darunter die im Betrachtungsraum nachgewiesene Malermuschel (Unio pictorum) und eine potenziell vorkommende Art (die Abgeplattete Teichmuschel Pseudanodonta complanata), die nach der BArtSchV streng geschützt ist. Weder in Linden noch in Herrenhausen kann eine nutzungsbedingte Schädigung oder Tötung einzelner Individuen dieser Arten bzw. ihrer Entwicklungsformen durch das Einsaugen mit dem Flusswasser ganz ausgeschlossen werden. Unter Berücksichtigung der Vermeidungsmaßnahmen, insbesondere der geplanten oder bereits bestehenden schonenden Rückführung in Linden und Herrenhausen sowie der geringen entnommenen Wassermengen am Entnahmebauwerk II in Herrenhausen und des nur kurzzeitigen Einsatzes der Tauchpumpen zur Rückführung in Linden und vor dem Hintergrund der deutlich eingeschränkten Habitateignung der betroffenen Gewässerabschnitte für diese Arten ist jedoch ein signifikant erhöhtes Tötungs- oder Verletzungsrisiko nicht zu erwarten. Verbotstatbestände nach § 44 Abs. 1 BNatSchG werden mit der beantragten Benutzung insgesamt nicht erfüllt und sie steht auch den Zielen der Europäischen Aal-Verordnung und des Aalbewirtschaftungsplanes nicht entgegen. 22.03.2016 ARSU GmbH, Oldenburg Wasserrechtliches Erlaubnisverfahren für die Kraftwerke Herrenhausen und Linden 8. 45 Literaturverzeichnis ALTMÜLLER, R., M. BREUER & M. RASPER (1989): Zur Verbreitung und Situation der Fließgewässerlibellen in Niedersachsen. Informationsdienst Naturschutz Niedersachsen 8/89: 137-176. ALTMÜLLER, R. & H.-J. CLAUSNITZER (2010): Rote Liste der Libellen Niedersachsens und Bremens, 2. Fassung, Stand 2007. Informationsdienst Naturschutz Niedersachsen 4/2010: 211-238. BAUMGÄRTNER, D. & S. HEITZ (1995): Großmuscheln, Lebensweise, Gefährdung und Schutz. Arbeitsblätter zum Naturschutz 21, Landesanstalt für Umweltschutz Baden-Württemberg, Karlsruhe, 39 Seiten. http://www.fachdokumente.lubw.baden-wuerttemberg.de/servlet/is/50090/ grossmuscheln.pdf?command=downloadContent&filename=grossmuscheln.pdf&FIS=200. BAYERISCHES LANDESAMT FÜR UMWELT (2012a): Artensteckbrief Abgeplattete Teichmuschel (Pseudoanodonta complanata) 2 Seiten. http://fisch.wzw.tum.de/uploads/media/Merkblatt_ Abgeplattete_Teichmuschel.pdf. BAYERISCHES LANDESAMT FÜR UMWELT (2012b): Artensteckbrief Aufgeblasene/Große Flussmuschel (Unio tumidus). 2 Seiten. http://fisch.wzw.tum.de/uploads/media/Merkblatt_Aufgeblasene_ Flussmuschel.pdf. BAYERISCHES LANDESAMT FÜR UMWELT (2012c): Artensteckbrief Gemeine Teichmuschel (Anodonta anatina) (auch Kleine Teichmuschel oder Entenmuschel). 3 Seiten. http://fisch.wzw.tum.de/ uploads/media/Merkblatt_Gemeine_Teichmuschel.pdf. BAYERISCHES LANDESAMT FÜR UMWELT (2012d): Artensteckbrief Große Teichmuschel (Anodonta cygnea) 2 Seiten. http://fisch.wzw.tum.de/uploads/media/Merkblatt_Grosse_Teichmuschel.pdf. BAYERISCHES LANDESAMT FÜR UMWELT (2012e): Artensteckbrief Malermuschel (Unio pictorum) 3 Seiten. http://fisch.wzw.tum.de/uploads/media/Merkblatt_Malermuschel.pdf. BELANYECZ, H. & U. BRÄMICK (2009): Fisch des Jahres 2009 - Der Aal (Anguilla anguilla), Verband Deutscher Sportfischer e. V. (VDSF) und Österreichisches Kuratorium für Fischerei und Gewässerschutz, Offenbach am Main. BIOCONSULT (BioConsult Schuchardt & Scholle GbR) (2014): Makrozoobenthosuntersuchung in der Leine im Juni 2014 - Ergänzung im Rahmen der Erlaubnisverfahren. 25 S. BIOCONSULT (BioConsult Schuchardt & Scholle GbR) (2015): Gutachten zur Feststellung und Beurteilung von Fischschädigungen durch Betrieb der Kühlwasserentnahmebauwerke der Kraftwerke Herrenhausen und Linden. Gutachten im Auftrag der Stadtwerke Hannover AG, Bremen, März 2015, 110 Seiten. BIOCONSULT (BioConsult Schuchardt & Scholle GbR) (2016a): Antworten auf die Stellungnahme des Gewässerkundlichen Landesdienstes vom 24.02.2016. März 2016, 7 Seiten. BIOCONSULT (BioConsult Schuchardt & Scholle GbR) (2016b): Untersuchungen der ökologischen und chemischen Situation an Leine und Ihme. Teil 1: Gesamtbetrachtung; Ergebnisse und Bewertung nach den nationalen WRRL-Verfahren. Teil 2: Auswertung der Untersuchungsergebnisse für die Untersuchungsräume ober- und unterhalb der Kraftwerke Linden und Herrenhausen, Stadtwerke Hannover AG. März 2016. BLOHM, H.-P., D. GAUMERT & M. KÄMMEREIT (1994): Leitfaden für die Wieder- und Neuansiedlung von Fischarten. Binnenfischerei in Niedersachsen Heft 3, Niedersächsisches Landesamt für Ökologie (NLÖ), Hildesheim, 90 Seiten. http://www.laves.niedersachsen.de/portal/ live.php?navigation_id=27438&article_id=93498&_psmand=23. BVERWG (Bundesverwaltungsgericht) (2008a): Urteil vom 09.07.2008 - 9 A 14.07 - Nordumfahrung Bad Oeynhausen. BVERWG (Bundesverwaltungsgericht) (2008b): Urteil vom 12.03.2008 - 9 A 3.06 - A 44 VKE 20 Hessisch-Lichtenau II. BVERWG (Bundesverwaltungsgericht) (2009): Urteil vom 18.03.2009 - 9 A 31.07 - A 44 Ratingen Velbert. ARSU GmbH, Oldenburg 22.03.2016 46 Artenschutzrechtlicher Fachbeitrag BVERWG (Bundesverwaltungsgericht) (2011): Urteil vom 14.07.2011 - 9 A 12.10 - Ortsumgehung Freiberg. DGHT E. V. (Deutsche Gesellschaft für Herpetologie und Terrarienkunde e. V.) (2014): Verbreitungsatlas der Amphibien und Reptilien Deutschlands, auf Grundlage der Daten der Länderfachbehörden, Facharbeitskreise und NABU Landesfachausschüsse der Bundesländer sowie des Bundesamtes für Naturschutz. www.feldherpetologie.de/atlas. DREHWALD, U., D. TEUBER & T. WOLF (2010): Artensteckbrief Sphagnum denticulatum Brid. var. denticulatum Gezähntes Torfmoos. 7 Seiten. DUßLING, U. (2009): Handbuch zu fiBS. Hilfestellungen und Hinweise zur sachgerechten Anwendung des fischbasierten Bewertungsverfahrens fiBS. Schriftenreihe des Verbandes Deutscher Fischereiverwaltungsbeamter und Fischereiwissenschaftler e. V.: 72 Seiten. FGG WESER (Flussgebietsgemeinschaft Weser) (o. J.): Die Fisch- und Rundmaularten in der Flussgebietseinheit Weser - eine Übersicht. 13 Seiten. http://www.fgg-weser.de/DownloadDateien/broschuere_fischarten.pdf. FREIE UND HANSESTADT HAMBURG (2001): Stickstoff in Oberflächengewässern - Nitrat, Nitrit, Ammoium, Ammoniak. Behörde für Stadtenwicklung und Umwelt, Hamburg, 8 Seiten. FREYHOF, J. (2009): Rote Liste der im Süßwasser reproduzierenden Neunaugen und Fische (Cyclostomata & Pisces). Naturschutz und Biologische Vielfalt 70 (1): 291-316. GERSTMEIER, R. & T. ROMIG (2003): Süßwasserfische Europas, Stuttgart. GLÖER, P. & R. DIERCKING (2010): Atlas der Süßwassermollusken. Rote Liste, Verbreitung, Ökologie, Bestand und Schutz, Freie und Hansestadt Hamburg, Behörde für Natur- und Ressourcenschutz, Hambrug. GOLDER ASSOCIATES (2016): Hydronumerische Modellierung. Abschlussbericht Wärmefahnenberechnungen für die Kraftwerke Herrenhausen und Linden der Stadtwerke Hannover AG. 86 S. GÜNTHER, R., (Editor), (1996): Die Amphibien und Reptilien Deutschlands. Gustav Fischer Verlag, Jena. JUNGBLUTH, J., H., & D. V. KNORRE (2011): Rote Liste und Gesamtartenliste der Binnenmollusken (Schnecken und Muscheln; Gastropoda et Bivalvia) Deutschlands, 6., überarbeitete Fassung, Stand Februar 2010. In: BFN: Rote Liste gefährdeter Tiere, Pflanzen und Pilze Deutschlands, Band 3: Wirbellose Tiere (Teil 1), Bundesamt für Naturschutz, Bonn - Bad Godesberg, 647708. KOTTELAT, M. & J. FREYHOF (2007): Handbook of European Freshwater Fishes, Kottelat, Cornol, Switzerland and Freyhof, Berlin, Germany. KRAPPE, M., R. LEMCKE, L. MEYER & M. SCHUBERT (2012): Fisch des Jahres 2012 - Die Neunaugen, Verband Deutscher Sportfischer e. V. (VDSF), Offenbach am Main. KRÜGER, T., J. LUDWIG, S. PFÜTZKE & H. ZANG (2014): Atlas der Brutvögel in Niedersachsen und Bremen 2005-2008. Naturschutz Landschaftspfl. Niedersachsen. LAVES (Niedersächsisches Landesamt für Verbraucherschutz und Lebensmittelsicherheit - Dezernat Binnenfischerei) (2008): Vorläufige Rote Liste der Süßwasserfische, Rundmäuler und Krebse in Niedersachsen (unveröffentlicht). 1 Seite. LAVES (Niedersächsisches Landesamt für Verbraucherschutz und Lebensmittelsicherheit) (2011a): Vollzugshinweise zum Schutz von Fischarten in Niedersachsen. – Fischarten des Anhangs II der FFH-Richtlinie und weitere Fischarten mit höchster Priorität für Erhaltungs- und Entwicklungsmaßnahmen – Europäischer Aal (Anguilla anguilla). Niedersächsische Strategie zum Arten- und Biotopschutz, Hannover, 13 Seiten. LAVES (Niedersächsisches Landesamt für Verbraucherschutz und Lebensmittelsicherheit) (2011b): Vollzugshinweise zum Schutz von Fischarten in Niedersachsen. – Fischarten des Anhangs II der FFH-Richtlinie und weitere Fischarten mit höchster Priorität für Erhaltungs- und Entwicklungsmaßnahmen – Flussneunauge (Lampetra fluviatilis). Niedersächsische Strategie zum Arten- und Biotopschutz, Hannover, 12 S. 22.03.2016 ARSU GmbH, Oldenburg Wasserrechtliches Erlaubnisverfahren für die Kraftwerke Herrenhausen und Linden 47 LAVES (Niedersächsisches Landesamt für Verbraucherschutz und Lebensmittelsicherheit) (2011c): Vollzugshinweise zum Schutz von Fischarten in Niedersachsen. – Fischarten des Anhangs II der FFH-Richtlinie und weitere Fischarten mit höchster Priorität für Erhaltungs- und Entwicklungsmaßnahmen – Meerneunauge (Petromyzon marinus). Niedersächsische Strategie zum Arten- und Biotopschutz, Hannover, 13 S. LAVES (Niedersächsisches Landesamt für Verbraucherschutz und Lebensmittelsicherheit) (2011d): Vollzugshinweise zum Schutz von Fischarten in Niedersachsen. – Fischarten des Anhangs II der FFH-Richtlinie und weitere Fischarten mit Priorität für Erhaltungs- und Entwicklungsmaßnahmen – Bachneunauge (Lampetra planeri). – Niedersächsische Strategie zum Arten- und Biotopschutz. Hannover, 12 S. LAVES (Niedersächsisches Landesamt für Verbraucherschutz und Lebensmittelsicherheit, Dez. Binnenfischerei - Fischereikundlicher Dienst) (2011e): Vollzugshinweise zum Schutz von Wirbellosenarten in Niedersachsen. - Wirbellosenarten des Anhangs V der FFH-Richtlinie mit Priorität für Erhaltungs- und Entwicklungsmaßnahmen - Edelkrebs (Astacus astacus). Niedersächsische Strategie zum Arten- und Biotopschutz, Hannover, 12 Seiten. LAVES, SENATOR FÜR WIRTSCHAFT UND HÄFEN BREMEN, REGIERUNGSPRÄSIDIUM KASSEL, BEZIRKSREGIERUNG DETMOLD, THÜRINGER LANDESANSTALT FÜR WALD JAGD UND FISCHEREI & LANDESVERWALTUNGSAMT SACHSEN-ANHALT (2008): Aalbewirtschaftungsplan für das Flusseinzugsgebiet der Weser. 28 Seiten. http://www.portal-fischerei.de/fileadmin/redaktion/dokumente/fischerei/Bund/ Bestandsmanagement/FlusseinzugsgebietWeser.pdf. LAWA-AO (Bund/Länderarbeitsgemeinschaft Wasser, ständiger Ausschuss „Oberirdische Gewässer und Küstengewässer“) (2015): Rahmenkonzeption Monitoring Teil B - Bewertungsgrundlagen und Methodenbeschreibungen. Arbeitspapier II Hintergrund- und Orientierungswerte für physikalisch-chemische Qualitätskomponenten zur unterstützenden Bewertung von Wasserkörpern entsprechend EG-WRRL. Stand 09.01.2015. 32 S. LBV-SH (Landesbetrieb Straßenbau und Verkehr Schleswig-Holstein) (2013): Beachtung des Artenschutzrechtes bei der Planfeststellung. Neufassung nach der Novellierung des Bundesnaturschutzgesetzes vom 29. Juli 2009 mit Erläuterungen und Beispielen in Zusammenarbeit mit dem Kieler Institut für Landschaftsökologie und dem Landesamt für Landwirtschaft, Umwelt und ländliche Räume des Landes Schleswig-Holstein. 78 S. MEIER, C., P. HAASE, P. ROLAUFFS, K. SCHINDEHÜTTE, F. SCHÖLL, A. SUNDERMANN & D. HERING (2006): Methodisches Handbuch Fließgewässerbewertung. Handbuch zur Untersuchung und Bewertung von Fließgewässern auf der Basis des Makrozoobenthos vor dem Hintergrund der EGWasserrahmenrichtlinie - Stand Mai 2006. Anhang IX zu: Weiterentwicklung und Anpassung des nationalen Bewertungssystems für Makrozoobenthos an neue internationale Vorgaben. Im Auftrag des Umweltbundesamtes (UFOPLAN 2002 24 223), 110 Seiten. http://www.fliessgewaesserbewertung.de NLWKN (Niedersächsischer Landesbetrieb für Wasserwirtschaft, Küsten- und Naturschutz) (2011a): Vollzugshinweise zum Schutz von Pflanzenarten in Niedersachsen. Pflanzenarten des Anhangs II der FFH-Richtlinie mit höchster Priorität für Erhaltungs- und Entwicklungsmaßnahmen - Froschkraut (Luronium natans). Niedersächsische Strategie zum Arten- und Biotopschutz, Hannover, 15 Seiten. NLWKN (Niedersächsischer Landesbetrieb für Wasserwirtschaft, Küsten- und Naturschutz) (2011b): Vollzugshinweise zum Schutz von Wirbellosenarten in Niedersachsen. – Wirbellosenarten des Anhangs II der FFH-Richtlinie mit höchster Priorität für Erhaltungs- und Entwicklungsmaßnahmen – Bachmuschel (Unio crassus). Niedersächsische Strategie zum Arten- und Biotopschutz, Hannover, 11 Seiten. NLWKN (Niedersächsischer Landesbetrieb für Wasserwirtschaft, Küsten- und Naturschutz) (2011c): Vollzugshinweise zum Schutz von Wirbellosenarten in Niedersachsen. – Wirbellosenarten des Anhangs II der FFH-Richtlinie mit höchster Priorität für Erhaltungs- und Entwicklungsmaßnahmen – Flussperlmuschel (Margaritifera margaritifera). Niedersächsische Strategie zum Arten- und Biotopschutz, Hannover, 10 S. ARSU GmbH, Oldenburg 22.03.2016 48 Artenschutzrechtlicher Fachbeitrag NLWKN (Niedersächsischer Landesbetrieb für Wasserwirtschaft, Küsten- und Naturschutz) (2011d): Vollzugshinweise zum Schutz von Wirbellosenarten in Niedersachsen. – Wirbellosenarten des Anhangs II der FFH-Richtlinie mit höchster Priorität für Erhaltungs- und Entwicklungsmaßnahmen – Grüne Flussjungfer (Ophiogomphus cecilia). Niedersächsische Strategie zum Arten- und Biotopschutz, Hannover, 10 Seiten. NLWKN (Niedersächsischer Landesbetrieb für Wasserwirtschaft, Küsten- und Naturschutz) (2012): Wasserkörperdatenblatt 21019 Leine, Ihme-Westaue, Stand September 2012. 5 Seiten. http://www.google.de/url?sa=t&rct=j&q=&esrc=s&source=web&cd=3&cad=rja&uact=8&ve d=0CCsQFjAC&url=http%3A%2F%2Fwww.nlwkn.niedersachsen.de%2Fdownload%2F71737 %2FWK21019_Leine_Ihme-Westaue_.pdf&ei=WOs0VazJJ4yxsAHmpIDgBg&usg= AFQjCNG9BQPPVpnWSgGF0kuk9KUxrAREBw&bvm=bv.91071109,d.bGg. NLWKN (Niedersächsischer Landesbetrieb für Wasserwirtschaft, Küsten- und Naturschutz) (2014): Deutsches Gewässerkundliches Jahrbuch Weser- und Emsgebiet 2012. Norden, 293 S. OBERDORFER, E. (1990): Pflanzensoziologische Exkursionsflora, Eugen Ulmer Verlag, Stuttgart. OTT, J. & W. PIPER (1998): Rote Liste der Libellen (Odonata). In: BINOT, M., R. BLESS, P. BOYE, H. GRUTTKE & P. PRETSCHER: Rote Liste gefährdeter Tiere Deutschlands, Bundesamt für Naturschutz: Schriftenreihe für Landschaftspflege und Naturschutz, Heft 55, Bonn - Bad Godesberg, Seiten 260-263. PETERSEN, B., G. ELLWANGER, G. BIEWALD, U. HAUKE, G. LUDWIG, P. PRETSCHER, E. SCHRÖDER & A. SSYMANK (2003): Das europäische Schutzgebietssystem Natura 2000. Ökologie und Verbreitung von Arten der FFH-Richtlinie in Deutschland. Band 1: Pflanzen und Wirbellose. Schriftenreihe für Landschaftspflege und Naturschutz, Bonn-Bad Godesberg. PETERSEN, B., G. ELLWANGER, R. BLESS, P. BOYE, E. SCHRÖDER & A. SSYMANK (2004): Das europäische Schutzgebietssystem Natura 2000. Ökologie und Verbreitung von Arten der FFH-Richtlinie in Deutschland. Band 2: Wirbeltiere. Schriftenreihe für Landschaftspflege und Naturschutz, Bonn-Bad Godesberg. SCHAUMBURG, J., CHRISTINE SCHRANZ, D. STELZER, A. VOGEL & A. GUTOWSKI (2012): Verfahrensanleitung für die ökologische Bewertung von Fließgewässern zur Umsetzung der EG-Wasserrahmenrichtlinie: Makrophyten und Phytobenthos - Phylib, Stand Januar 2012. Bayerisches Landesamt für Umwelt, 191 Seiten. SCHNITTER, P., C. EICHEN, G. ELLWANGER, M. NEUKIRCHEN & E. SCHRÖDER (2006): Empfehlungen für die Erfassung und Bewertung von Arten als Basis für das Monitoring nach Artikel 11 und 17 der FFH-Richtlinie in Deutschland. Berichte des Landesamtes für Umweltschutz Sachsen-Anhalt (Halle), Halle. SCHORR, M. (1990): Grundlagen zu einem Artenhilfsprogramm Libellen der Bundesrepublik Deutschland, Ursus Scientific Publishers, Bilthoven - Niederlande. SPÄH, H. (2008): Vermeidung von Fischschäden im Bereich Kühlwasserentnahmen Kraftwerk Kirchlengern. Fischereibiologisches Gutachten im Auftrag der E.ON Westfalen Weser EnergieService GmbH (EWAES). 22 Seiten. SPÄH, H. (2015): Gutachterliche Beratungen Fischrückführung HKW Linden. Fischereifachliche Anmerkungen zur Machbarkeitsstudie der Ingenieurgesellschaft Heidt & Peters von Oktober 2015. Im Auftrag der Stadtwerke Hannover AG (unveröffentlichtes Schreiben vom 26.11.2015), 6 Seiten. STERNBERG, K. & R. BUCHWALD (1999a): Die Libellen Baden-Württembergs. Band 1: Allgemeiner Teil, Kleinlibellen (Zygoptera), Stuttgart. STERNBERG, K. & R. BUCHWALD (1999b): Die Libellen Baden-Württembergs. Band 2: Großlibellen (Anisoptera), Literatur, Stuttgart. THEUNERT, R. (2008a): Verzeichnis der in Niedersachsen besonders oder streng geschützen Arten Schutz, Gefährdung, Lebensräume, Bestand, Verbreitung - Teil A: Wirbeltiere, Pflanzen, Pilze (Stand: 1. November 2008) (Korrigierte Fassung 1. Januar 2015). Informationsdienst Naturschutz Niedersachsen 3/2008: 69-141. 22.03.2016 ARSU GmbH, Oldenburg Wasserrechtliches Erlaubnisverfahren für die Kraftwerke Herrenhausen und Linden 49 THEUNERT, R. (2008b): Verzeichnis der in Niedersachsen besonders oder streng geschützten Arten Schutz, Gefährdung, Lebensräume, Bestand, Verbreitung - Teil B: Wirbellose Tiere (Stand 1. November 2008) (Korrigierte Fassung 1. Januar 2015). Informationsdienst Naturschutz Niedersachsen 4/2008: 153-210. THIEL, R., H. WINKLER, U. BÖTTCHER, R. FRICKE, M. GEORGE, M. KLOPPMANN, T. SCHAARSCHMIDTH, C. UBL & R. VORBERG (2013): Rote Liste der Meeresfische und Neunaugen. In: Rote Liste gefährdeter Tiere, Pflanzen und Pilze Deutschlands, Band 2: Meeresorganismen, Bundesamt für Naturschutz, Bonn - Bad Godesberg, 70 (2). ARSU GmbH, Oldenburg 22.03.2016 Wasserrechtliches Erlaubnisverfahren für die Kraftwerke Herrenhausen und Linden Anhang 1: Anhang 1 – Seite 1 Ergänzende Angaben zur Relevanzprüfung Der Niedersächsische Landesbetrieb für Wasserwirtschaft, Küsten- und Naturschutz (NLWKN) hat Verzeichnisse der in Niedersachsen besonders oder streng geschützten Arten veröffentlicht (THEUNERT 2008a, b), in denen insgesamt 19 Artengruppen unterschieden werden. Für sieben dieser Artengruppen sind Fließgewässer nicht von Bedeutung, da sie nicht zu den typischen Habitaten der Arten dieser Gruppen gehören. Aus diesem Grund müssen die Gruppen Flechten (Lichenes), Pilze (Fungi), Schmetterlinge (Lepidoptera), Hautflügler (Hymenoptera), Netzflügler (Neuroptera), Springschrecken (Saltatoria) und Stachelhäuter (Echinodermata) nicht weiter berücksichtigt werden. Alle übrigen Artengruppen werden nachfolgend näher betrachtet, um möglicherweise relevante Arten zu ermitteln. Dabei wird berücksichtigt, dass als artenschutzrechtlich relevanter Wirkfaktor nur die Entnahme von Organismen durch Einsaugen mit dem Flusswasser identifiziert wurde. Farn- und Blütenpflanzen (Pterido- und Spermatophyta) Bei der Kartierung der Makrophyten nach Phylib wurden zwischen Wehr Schneller Graben und Luthe in Ihme und Leine nur sieben Arten nachgewiesen, sechs Blütenpflanzen und ein Moos. Darunter war keine besonders oder streng geschützte Art. Da die Kartierung nach Phylib auf die Erfassung der repräsentativen Pflanzenausstattung und nicht auf vollständige Artenlisten abzielt, wird nachfolgend geprüft, ob möglicherweise dennoch besonders geschützte Pflanzen im Einflussbereich der beantragten Gewässerbenutzung zu erwarten sind. (THEUNERT 2008a) nennt nur zwei besonders geschützte Farn- und Blütenpflanzen, für die Fließgewässer als Habitate von Bedeutung sind: das streng geschützte Froschkraut (Luronium natans) ist gefährdet (Kat. 2 der Roten Listen von Niedersachsen und Deutschland). Es kommt in Niedersachsen zerstreut im Weser-Ems-Gebiet vor. Einzelne Vorkommen gibt es auch im östlichen Tiefland bei Celle, Wolfsburg und am Rand der Ostheide bei Bodenteich. Es handelt sich um eine konkurrenzschwache Pionierart, die vorwiegend zeitweilig an flach überschwemmten Ufersäumen von basenarmen, oligo- bis mesotrophen Seen, Heideweihern und Teichen sowie in den Uferbereichen von Fließgewässern – insbesondere Gräben – mit mäßig schnell fließendem Wasser vorkommt. Im Bereich von Ihme und Leine sind nach den Vollzugshinweisen zum Schutz von Pflanzenarten in Niedersachsen (NLWKN 2011a) keine Vorkommen bekannt. die besonders geschützte Wasserfeder (Hottonia palustris) steht in Niedersachsen auf der Vorwarnliste und ist deutschlandweit gefährdet (Kat. 3). Sie kommt hier zerstreut bis verbreitet in zum Teil größerer Anzahl im Tiefland vor, in Schwimmblatt-Gesellschaften stehender, mäßig nährstoffreicher, oft kalkarmer, mesotropher Gewässer über torfigen Schlammböden, in Altwässern, Gräben und Moorseen (OBERDORFER 1990). Im Bereich der Flüsse Ihme und Leine ist ihr Vorkommen daher nicht zu erwarten. Besonders oder streng geschützte Farn- und Blütenpflanzen kommen im Einwirkungsbereich der beantragten Gewässerbenutzung somit nicht vor. Eine artenschutzrechtlich relevante BetroffenARSU GmbH, Oldenburg 22.03.2016 Anhang 1 – Seite 2 Artenschutzrechtlicher Fachbeitrag heit von Farn- und Blütenpflanzen durch die beantragte Gewässerbenutzung kann also ausgeschlossen werden. Moose (Bryophyta) Bei der Kartierung der Makrophyten wurde in Ihme und Leine zwischen dem Wehr Schneller Graben und Luthe nur eine Moos-Art nachgewiesen, das Ährige Tausendblatt (Myriophyllum spicatum), das weder streng noch besonders geschützt ist (vgl. Kap. 4.2.1). Da die Kartierung nach Phylib auf die Erfassung der repräsentativen Pflanzenausstattung und nicht auf vollständige Artenlisten abzielt, wird nachfolgend zusätzlich geprüft, ob möglicherweise dennoch besonders geschützte Moose im Einflussbereich der beantragten Benutzung zu erwarten sind. THEUNERT (2008a) weist nur eine besonders geschützte Moos-Art aus, zu deren typischen Habitaten Fließgewässer gehören: das Gezähneltes Torfmoos (Sphagnum denticulatum), das in zwei Varianten (var. denticulatum und var. inundatum) verbreitet im Tiefland sowie im Weserbergland und im Harz vorkommt. Beide Varianten dieses Torfmooses nutzen vorwiegend saure, nährstoffarme, huminsäurereiche und kalkfreie Gewässer, aber es gibt auch Hinweise auf Vorkommen in basenreicheren, mäßig nährstoffreichen Biotopen. Als Habitate werden vor allem entsprechende Niedermoore, Quellsümpfe, nasse Borstgrasrasen, Erlenbrüche, moorige Tümpel und Teichränder sowie Bäche genannt, als Sekundärbiotope auch Gräben, nasse Wegfurchen und Steine (PETERSEN et al. 2003; DREHWALD et al. 2010)7. Flüsse wie Leine und Ihme gehören also nicht zu den Habitaten dieses besonders geschützten Mooses. Es ist dort entsprechend nicht zu erwarten. Eine artenschutzrechtlich relevante Betroffenheit von Moosen durch die beantragte Gewässerbenutzung kann daher ausgeschlossen werden. Säugetiere (Mammalia) Kartierungen zu den im Bereich der Flüsse Ihme und Leine unterhalb des Wehres Schneller Graben vorkommenden Säugetieren liegen nicht vor. THEUNERT (2008a) nennt jedoch eine Reihe von besonders geschützten Säuger-Arten, für die Fließgewässer zu den bedeutenden Habitaten zählen (vgl. A 1 - Tab. 1). Überwiegend sind diese Arten darüber hinaus streng geschützt. 7 außerdem: www.artensteckbrief.de und http://www.bbsfieldguide.org.uk/sites/default/files/pdfs/mosses/Sphagnum_denticulatum.pdf, jeweils besucht am 27.04.2015 22.03.2016 ARSU GmbH, Oldenburg Wasserrechtliches Erlaubnisverfahren für die Kraftwerke Herrenhausen und Linden Anhang 1 – Seite 3 A 1 - Tab. 1: Besonders geschützte Säuger-Arten, für die Fließgewässer von Bedeutung sind Zusammenstellung und Angaben zur Verbreitung der Arten vorwiegend nach THEUNERT (2008a),Ergänzungen sind mit gesonderten Quellenangaben versehen Art Schutzstatus RL Nds. Verbreitung 1856 ausgestorben, seit 1990 wiederangesiedelt, Vorkommen an der Hase, der Ems und der Elbe einschließlich der Unteren Seege-Niederung, vereinzelt auch in der oberen Allerniederung ist inzwischen auch in der Region Hannover wieder heimisch, bei der Winterkartierung 2014 wurden mindestens 15 Reviere an der Leine und ihren Zuflüssen 8 zwischen Schulenburg und Neustadt dokumentiert Hauptvorkommen zwischen der Aller und der Elbe, festgestellt auch zwischen Wilhelmshaven und Emden sowie im Bergland östlich der Leine, vereinzelt auch in der Region Cloppenburg zerstreut bis verbreitet, aber im Westen nicht vorhanden semiaquatische Säuger Biber Castor fiber streng 0 Fischotter Lutra lutra streng 1 besonders 3 Breitflügelfledermaus Eptesicus serotinus streng 2 verbreitet, aber von den Ostfriesischen Inseln nur auf Norderney bekannt Große Bartfledermaus Myotis brandtii streng 2 zerstreut im Bergland, deutlich spärlicher im Tiefland, besonders in Küstennähe, keine Funde im Ems- und Elbegebiet Teichfledermaus Myotis dasycneme streng Wasserfledermaus Myotis baubentonii streng 3 Kleine Bartfledermaus Myotis mystacinus streng 2 im Bergland zerstreut bis verbreitet, ansonsten eher mäßig vorhanden; in Küstennähe und entlang der Ems nicht nachgewiesen Fransenfledermaus Myotis nattereri streng 2 Zwergfledermaus Pipistrellus pipistrellus streng 3 zerstreut bis verbreitet, regional nicht nachgewiesen aber wohl vorhanden, keine Funde auf den Ostfriesischen Inseln wohl mehr oder weniger verbreitet Mückenfledermaus Pipistrellus pygmaeus streng N unzureichend bekannt, einige Nachweise im Harz, bei Springe im Deister, im Südwestteil des Tieflandes sowie in der Lüneburger und in der Ostheide Braunbär Ursus arctos streng 0 im 17. Jahrhundert ausgestorben Europäischer Nerz Mustela lutreola streng 0 Luchs Lynx lynx streng 0 wahrscheinlich schon vor dem 1. Weltkrieg ausgestorben, Wiederansiedlungsprojekt im Raum Osnabrück, einzelne Funde im östlichen Tiefland im 19. Jahrhundert ausgestorben, seit 1999 im Harz wieder angesiedelt und inzwischen bis an den Nordrand des Ostbraunschweigischen Hügellandes, bis Hildesheim und über den Göttinger Raum hinaus bis in den Solling abgewandert Wasserspitzmaus Neomys fodiens Fledermäuse nur regional nachgewiesen: im Harz, im Ith, zwischen Rinteln und Hannover, im Osnabrücker Land, an der Aller, im Nordosten des Tieflandes und im unteren Weser- und Emsgebiet wohl mehr oder weniger landesweit verbreitet, auch auf Norderney vorkommend andere Säuger 8 vgl. https://niedersachsen.nabu.de/tiere-und-pflanzen/saeugetiere/biber/, besucht am 29.04.2015 ARSU GmbH, Oldenburg 22.03.2016 Anhang 1 – Seite 4 Art Artenschutzrechtlicher Fachbeitrag Schutzstatus RL Nds. Wildkatze Felis silvestris streng 2 Wisent Bison bonsus streng 0 Wolf Canis lupus streng 0 Verbreitung besonders im Harz und Solling sowie im dazwischen liegenden Bereich, nach Norden bis an die Mittelgebirgsschwelle nachgewiesen (Deister, Raum Hildesheim, Elm) seit dem 16. Jahrhundert ausgestorben verschwand im 18. und 19. Jahrhundert, seither zunächst vereinzelt inzwischen häufiger aus dem Osten wieder zugewandert wurde in Niedersachsen zunächst auf Truppenübungsplätzen in der Heide beobachtet, taucht inzwischen aber in verschiedenen Landesteilen auf, auch aus der Region 9 nördlich von Hannover liegen Hinweise vor Die Säugetiere haben eine unterschiedlich starke Bindung an Gewässer, während manche Arten die Fließgewässer nur zur Nahrungssuche nutzen, halten sich die semiaquatischen Arten überwiegend im Bereich der Gewässer auf und haben auch ihre Fortpflanzungsstätten in Gewässernähe. Eine Tötung oder Verletzung durch Einsaugen möglicherweise vorkommender Säugetiere ist aber unter Berücksichtigung ihrer Lebensweise, ihrer Größe und ihres Schwimmvermögens ausgeschlossen. Eine artenschutzrechtlich relevante Betroffenheit von Säugetieren durch die beantragte Gewässerbenutzung kann daher ausgeschlossen werden. Vögel (Aves) Kartierungen zu den im Bereich der Flüsse Ihme und Leine unterhalb des Wehres Schneller Graben vorkommenden Vogelarten liegen nicht vor. THEUNERT (2008a) nennt aber eine Reihe von streng und besonders geschützten Arten, für die Fließgewässer von Bedeutung sind (vgl. A 1 Tab. 2). Darunter sowohl Brutvögel, als auch Durchzügler und Überwinterer. A 1 - Tab. 2: Geschützte Vogel-Arten, für die Fließgewässer von Bedeutung sind Zusammenstellung und Angaben zur Verbreitung der Arten nach THEUNERT (2008a) Art Schutzstatus RL Nds. Verbreitung Brutvogel, zum Teil auch durchziehend oder überwinternd Blässhuhn Fulica atra Blaukehlchen Luscinia svecica 9 besonders - regelmäßiger und weit verbreiteter Brutvogel; nur in Teilen des Berglandes nicht vorhanden o. selten im Winter mitunter in großen Beständen auftretend streng V als Brutvogel in der ssp. cyanecula verbreitet im Bereich der Watten und Marschen; im mittleren, östlichen und südlichen Landesteil nur hier und da, südwärts bis in den Landkreis Göttingen in der ssp. svecica regelmäßiger Durchzügler vgl. http://www.haz.de/Nachrichten/Der-Norden/Uebersicht/Woelfe-Luxe-und-Biber-in-Niedersachsen-sorgen-fuerDiskussionen, . http://www.wildtiermanagement.com/wildtiere/haarwild/wolf/wolfsnachweise_in_niedersachsen, http://www.haz.de/Hannover/Aus-der-Stadt/Uebersicht/Wolf-beisst-Hund-einer-Radfahrerin-in-der-Region-Hannover und http://www.haz.de/Hannover/Aus-der-Region/Wedemark/Nachrichten/Der-Wedemaerker-Wolf-ist-ueberfahren-worden, besucht am 29.04.2015 22.03.2016 ARSU GmbH, Oldenburg Wasserrechtliches Erlaubnisverfahren für die Kraftwerke Herrenhausen und Linden Art Anhang 1 – Seite 5 Schutzstatus RL Nds. Verbreitung Brandgans Tadorna tadorna besonders - regelmäßiger Brutvogel im Küstenraum und auf den Inseln; vielerorts auch an der Unterläufen von Ems, Weser und Elbe, an der unteren Mittelelbe und in der Diepholzer Moorniederung sowie vereinzelt im südöstlichen Niedersachsen in vielen Wintern im Küstengebiet verbleibend Eiderente Somateria mollissima besonders - regelmäßiger Brutvogel auf den Ostfriesischen Inseln, außer Wangerooge im Winterhalbjahr in größerer Anzahl im Wattenmeer rastend; bisweilen Gastvogel in Niederungen im Binnenland Eisvogel Alcedo atthis streng 3 regelmäßiger Brutvogel, nahezu landesweit verbreitet, mit Schwerpunkten im Osnabrücker Raum, im Weser-Leinebergland, der nördlichen Lüneburger Heide und im Wendland Fischadler Pandion haliaetus streng 1 regelmäßiger Brutvogel erst wieder seit Mitte der 1990er Jahre, besonders nördlich der Aller bis in der Südteil der Lüneburger Heide regelmäßiger Durchzügler Flussregenpfeifer Charadrius dubius streng 3 zerstreut auftretender Brutvogel, mit Ausnahme der Küstenregion, einem Gürtel zwischen Lingen und Vechta und den waldreichen Bereichen des Berglandes Flussseeschwalbe Sterna hirundo streng 2 regelmäßiger Brutvogel und dabei häufigste Art innerhalb der Gattung; fast nur auf den Inseln im Wattenmeer und am Küstensaum des Festlandes, z. B. Leybucht, Jadebusen; sporadisch auch weiter landeinwärts auf künstlichen Brutplätzen Flussuferläufer Actitis hypoleucos streng 1 insgesamt nur noch wenigen Brutvorkommen, vor allem an der unteren Mittelelbe, mehrere Paare am Unterlauf der Oker im östlichen Tiefland, sonst nur vereinzelt und unregelmäßig auftretend auf dem Zug insgesamt mehr oder weniger zahlreich, aber an der Küste nur in verhältnismäßig geringer Anzahl Gänsesäger Mergus merganser besonders - extrem seltener Brutvogel an der unteren Mittelelbe regelmäßiger Durchzügler und Gast im Winterhalbjahr auf Elbe, Ems, Hase, Weser und Aller, im Elbegebiet bisweilen auch im Sommer Gebirgsstelze Motacilla cinerea besonders - im Bergland zerstreuter bis verbreiteter Brutvogel; im Tiefland etwas weniger, aber in den südlichen und mittleren Teilen regelmäßig brütend; in Küstennähe nur ausnahmsweise; größte Dichte im Harz Graugans Anser anser besonders - regelmäßiger und weit verbreiteter Brutvogel, jedoch regional kaum oder gar nicht brütend zur Mauserzeit 2014 an der Küste örtlich sehr große Ansammlungen Graureiher Ardea cinerea besonders - als Brutvogel mittlerweile wieder in weiten Teilen Niedersachsens vorhandener aber ungleichmäßig verteilt Heringsmöwe Larus fuscus besonders - regelmäßiger Brutvogel auf einigen der Ostfriesischen Inseln; im Binnenland nur einzelne kleine Brutvorkommen z. B. nahe der Unterelbe ARSU GmbH, Oldenburg 22.03.2016 Anhang 1 – Seite 6 Art Artenschutzrechtlicher Fachbeitrag Schutzstatus RL Nds. Kanadagans Branta canadensis besonders - regelmäßiger Brutvogel, mit Schwerpunkten im Südteil der Stader Geest und östlich davon bei Lüneburg; im Westen vor allem in der Ostfriesischen Geest und im Osnabrücker Hügelland Wintergast, insbesondere in Küstennähe, in kalten Wintern mitunter in größerer Anzahl. Kormoran Phalacrocorax carbo besonders - ausgehend von kleinen Brutvorkommen auf Leuchttürmen nunmehr wieder Bruten im Binnenland in fast allen Regionen außerhalb der Brutzeit weit umherziehend. Mantelmöwe Larus marinus besonders R vereinzelt und unregelmäßiger Brutvogel auf den Ostfriesischen Inseln Wintergast in größerer Anzahl in Küstennähe, selten im Binnenland, sporadisch in den südlichen Landesteilen nachgewiesen Mehlschwalbe Delichon urbicum besonders V flächendeckend vorhandener Brutvogel, größere Dichten im Süden und Nordosten Mittelsäger Mergus serrator besonders 1 regelmäßiger Brutvogel im nördlichen Harzvorland, und auf Mellum außerhalb der Brutzeit hier und da vorhanden Rauchschwalbe Hirundo rustica besonders 3 als Brutvogel nahezu flächendeckend vorhanden; größere Dichten westlich der Weser, in der Lüneburger Heide und im Wendland streng 2 regelmäßiger Brutvogel, östlich einer Linie von der mittleren Elbe bis zum Zusammenfluss von Aller und Weser nahezu flächendeckend; größte Dichte im Harzvorland; im westlichen Tiefland und in Küstennähe fehlend Schellente Bucephala clangula besonders - Regelmäßiger Brutvogel im Tiefland im Umfeld einzelner alter Fischteichanlagen außerhalb der Brutzeit mitunter in größerer Anzahl Schwarzkopfmöwe Larus melanocephalus besonders - regelmäßiger Brutvogel seit wenigen Jahrzehnten; größtes Vorkommen auf Insel in der Unterelbe; daneben westlich der Weser einschließlich der Ostfriesischen Inseln in geringer Zahl außerdem Durchzügler Schwarzmilan Milvus migrans streng - regelmäßiger Brutvogel, zerstreut im mittleren Elbtal und südlich der Aller; westlich der Weser nur sporadisch Schwarzstorch Ciconia nigra streng 2 regelmäßig, aber ziemlich seltener Brutvogel nördlich der Aller, im Weser-Leinebergland und Harz; westlich der Weser nur im Wiehengebirge Seeadler Haliaeetus albicilla streng 2 regelmäßiger Brutvogel mit Hauptvorkommen in den Urstromtälern von Elbe und Aller; vereinzelte Bruten in Küstennähe, z. B. nahe der Emsmündung im Winterhalbjahr an großen Stillgewässern auftretend, vorwiegend nördlich des Mittellandkanals Silbermöwe Larus argentatus besonders - Brutvogel in teils großen Kolonien auf allen Ostfriesischen Inseln; kleine Brutvorkommen an der Unterelbe und anderenorts im Binnenland Stockente Anas platyrhynchos besonders - flächendeckend als Brutvogel vorhanden, mit Schwerpunkt im Nordwesten zu anderen Jahreszeit mitunter in größerer Anzahl Rotmilan Milvus milvus 22.03.2016 Verbreitung ARSU GmbH, Oldenburg Wasserrechtliches Erlaubnisverfahren für die Kraftwerke Herrenhausen und Linden Art Anhang 1 – Seite 7 Schutzstatus RL Nds. Verbreitung besonders - regelmäßiger aber ungleichmäßig über weite Teile Niedersachsens verteilter Brutvogel; im Bergland, außer im nördlichen Harzvorland, selten brütend im Winterhalbjahr mancherorts in größerer Anzahl Teichhuhn Gallinula chloropus streng V verbreitet vorhandener Brutvogel, mit Schwerpunkt im Nordwesten und Lücken im Osten und Süden außerhalb der Brutzeit am Rand weiterer Gewässer zu beobachten Uferschwalbe Riparia riparia streng V Brutvogel zerstreut bis verbreitet im Tiefland und im nördlichen Teil des Berglandes, fehlt im Bereich der Watten und Marschen, im Harz und in weiten Teilen des Weser-Leine-Berglandes Waldwasserläufer Tringa ochropus streng - regelmäßiger Brutvogel im Aller-Urstromtal und nördlich darüber hinaus, u. a. auf Truppenübungsplätzen mitunter überwinternd Wasseramsel Cinclus cinclus besonders - regelmäßiger Brutvogel, aber fast nur im Bergland außerhalb der Brutzeit etwas nach Norden vordringend und Zuzug nordischer Tiere Wiesenschafstelze Motacilla flava besonders - als Brutvogel zerstreut bis verbreitet vorhanden; aber weitgehend fehlend auf den Ostfriesischen Inseln, in der Ostfriesisch-Oldenburgischen Geest, im Harz und außerhalb der Tallagen im Weser-Leinebergland Tafelente Aythya ferina Durchzügler und Wintergäste Blässgans Anser albifrons besonders - Durchzügler und Wintergast alljährlich im Rheiderland, auf dem Dollart, in der Elbmündung, in der Elbtalaue bei Hitzacker und Schnackenburg sowie immer wieder auf dem Steinhuder Meer Bergpieper Anthos spinoletta besonders - regelmäßiger Durchzügler und Wintergast im gesamten Gebiet Grünschenkel Tringa nebularia besonders - alljährlich durchziehend, mehr an der Küste als im Binnenland Präriemöwe Larus pipixcan besonders - Irrgast, 2003 auf der Elbe bei Winsen streng - regelmäßiger Durchzügler im Küstengebiet und im Binnenland Rötelschwalbe Cecropis daurica besonders - umherstreifend mancherorts nachgewiesen, von der Küste bis ins Bergland Saatgans Anser fabalis besonders - Durchzügler und Wintergast besonders in der Elbniederung im Bereich Amt Neuhaus und Wendland, in der Elbmündung und im Rheiderland. Strandpieper Anthus petrosus besonders - Durchzügler und Wintergast regelmäßig im Küstenraum, eher seltener aber wohl gleichfalls regelmäßig im Binnenland Terekwasserläufer Xenus cinereus besonders - zur Zugzeit vereinzelt in verschiedene Regionen nördlich der Mittelgebirgsschwelle, 2004 auch im Landkreis Göttingen Weißkopf-Ruderente Oxyura leucocephala streng - seltener Wintergast in Binnenland und Küstennähe Zwergmöwe Hydrocoloeus minutus besonders R regelmäßig durchziehend an der Küste und besonders an der Unterelbe Zwergsäger Mergellus albellus besonders - Durchzügler und Wintergast fast alljährlicher in Küstennähe, seltener im Binnenland Raubseeschwalbe Hydroprogne caspia ARSU GmbH, Oldenburg 22.03.2016 Anhang 1 – Seite 8 Artenschutzrechtlicher Fachbeitrag Gemäß Atlas der Brutvögel in Niedersachsen und Bremen 2005–2008 (KRÜGER et al. 2014) kommen davon Eisvogel, Blässhuhn, Teichhuhn, Mehl- und Rauchschwalbe als Brutvögel im Umfeld der Kühlwasserentnahmen vor. Weitere Arten sind südlich bzw. nördlich davon als Brutvögel nachgewiesen, so Flussregenpfeifer, Graugans, Graureiher, Kormoran, Rot- und Schwarzmilan, Tafelente, Uferschwalbe, Waldwasserläufer, Wasseramsel und Wiesenschafstelze. Weitere Arten können außerhalb der Brutzeit, im Winter oder auf dem Durchzug im Gebiet auftreten. Auch die Vögel haben wie die Säugetiere eine unterschiedlich starke Bindung an die Gewässer, während manche Arten die Fließgewässer nur zur Nahrungssuche nutzen, halten sich andere überwiegend im Bereich der Gewässer auf und brüten auch in Gewässernähe. Für alle im Einwirkungsbereich der beantragten Gewässerbenutzung vorkommenden Vögel gilt jedoch analog zu den Säugetieren, dass unter Berücksichtigung ihrer Lebensweise, ihrer Größe und ihres Schwimmvermögens eine nutzungsbedingte Tötung oder Verletzung von Individuen durch Einsaugen nicht zu besorgen ist. Eine artenschutzrechtlich relevante Betroffenheit von Vögeln durch die beantragte Gewässerbenutzung kann daher ausgeschlossen werden. Reptilien (Reptilia) Als einzige besonders geschützte Reptilienart, für die Fließgewässer bedeutende Habitate sind, nennt THEUNERT (2008a) die in Niedersachsen als gefährdet eingestufte Ringelnatter ( Natrix natrix). Sie ist besonders geschützt, kommt verbreitet im östlichen Tiefland vor und hat im Weser-Aller-Flachland einen Schwerpunkt ihres Vorkommens. Ringelnattern nutzen offene und halboffene Lebensräume mit heterogenen Vegetationsstrukturen und einem Mosaik unterschiedlicher Biotoptypen, die ihnen geeignete Jagdreviere, Überwinterungsmöglichkeiten (wie feuchte Hohlräume, Eiablageplätze, Sonnenplätze und Tagesverstecke (wie Stein- und Holzhaufen) bieten. Vor allem nutzen sie Feuchtgebiete und deren Umgebung. Sie leben sowohl an eher langsam fließenden Gewässern wie auch an Seen und Teichen sowie in Sümpfen und Feuchtwiesen oder anderen Gebieten mit gutem Nahrungsangebot. Ein Vorkommen der Ringelnatter im Einwirkungsbereich des Vorkommens ist vor allem aufgrund der eingeschränkten Eignung der angrenzenden Biotope wenig wahrscheinlich. Nachweise für den Bereich Hannover liegen nach dem Verbreitungsatlas der Amphibien und Reptilien Deutschlands (DGHT E. V. 2014) für den Zeitraum 1990–2014 nicht vor. Außerdem wäre unter Berücksichtigung der vorwiegend landgebundenen Lebensweise, Größe und Schwimmfähigkeit der Art eine Tötung oder Verletzung von Individuen durch Einsaugen nicht zu prognostizieren. Eine artenschutzrechtlich relevante Betroffenheit von Reptilien durch die beantragte Gewässerbenutzung kann daher ausgeschlossen werden. Amphibien (Amphibia) THEUNERT (2008a) weist fünf besonders geschützte Amphibien-Arten aus, für die Fließgewässer als Habitate von Bedeutung sind. Wie A 1 - Tab. 3 zeigt, nutzen Salamander und Bergmolch kleinere Fließgewässer und der Teichfrosch benötigt eine reiche Wasservegetation. Diese Arten sind daher in Ihme und Leine im Einwirkungsbereich der beantragten Wasserentnahme nicht zu erwarten. 22.03.2016 ARSU GmbH, Oldenburg Wasserrechtliches Erlaubnisverfahren für die Kraftwerke Herrenhausen und Linden Anhang 1 – Seite 9 A 1 - Tab. 3: Besonders geschützte Amphibien-Arten, für die Fließgewässer von Bedeutung sind Zusammenstellung der Arten nach THEUNERT (2008a), Angaben zur Verbreitung und zu den Lebensraumansprüchen nach THEUNERT (2008a) und GÜNTHER (1996) Amphibien-Art Schutzstatus RL Nds. Verbreitung und Lebensraumansprüche Ichthyosaura alpestris Bergmolch besonders 3 verbreitet im Bergland, regional zerstreut im Tiefland; z. T. selten oder nicht vorhanden so in Küstennähe, im Emsland, Oldenburger Münsterland, nordwestlichen Elbe-Weser-Dreieck und Wendland nutzt als Laichgewässer neben verschiedenen stehenden Gewässern auch Quelltöpfe, Gräben und Bäche, optimal sind kleinere bis mittelgroße, waldnahe Gewässer mit ausgeprägter Flachwasserzone und nicht zu dichter Unterwasservegetation Pelophylax kl. esculentus Teichfrosch besonders - außer im Nordwesten allgemein verbreitet, aber in Küstennähe meist nicht vorhanden erreicht die größten Bestandsdichten in permanenten Gewässern (Weihern) bis 1 ha Größe mit lichten Gehölzbeständen, nutzt aber u. a. auch Niederungsbäche und –gräben, Flüsse und Kanäle im Flach- und Hügelland, benötigt Laichgewässer mit reicher Unterwasser- bzw. Schwimmblattvegetation Pelophylax ridibundus Seefrosch besonders 3 ist entlang der Elbe überall, entlang der Weser nördlich der Mittelgebirgsschwelle und an der Ems nur am Unterlauf verbreitet; ansonsten zerstreut vorkommend so auch an der Leine und am Südharzrand; regional fehlend so auf den Ostfriesischen Inseln, im Harz und im Südwesten bevorzugt größere, eutrophe Gewässer in Flussauen wie Seen, Altarme, Buchten und andere ruhige Streckenabschnitte der Flüsse, Kanäle und breitere Gräben; nutzt vor allem vegetationsreiche Stillgewässer, aber auch pflanzenreiche Kanäle und Stillwasserbuchten von Flüssen zum Laichen Rana temporaria Grasfrosch besonders - flächendeckend vorhanden, auch auf den meisten Ostfriesischen Inseln nutzt verkrautete Flachwasserzonen, aber auch schwimmende Pflanzenteppiche in einem breiten Spektrum stehender und fließender Gewässer zum Laichen, bevorzugt bei Fließgewässern langsam fließende Gräben und Niederungsbäche, in Bergbachtypen werden Buchten und andere langsam durchströmte Bereiche genutzt Salamandra salamandra Feuersalamander besonders 3 verbreitet im Osnabrücker Hügelland, im WeserLeinebergland und im Harz, außerdem einige isolierte Vorkommen im Braunschweiger Raum und im östlichen Tiefland; westlich der Weser nur in wenigen Gebieten zwischen Delmenhorst und Bad Bentheim; fehlt im Nordwesen Larven nutzen nährstoffarme (oligotrophe), kühle und sauerstoffreiche Gewässer, vor allem Quellbäche und -tümpel, Bäche, Bachstaue, Teich und Gräben sowie Kleingewässer Ihme und Leine gehören auch nicht zu den bevorzugten Lebensräumen von Seefrosch ( Pelophylax ridibundus) und Grasfrosch (Rana temporaria), ihr Vorkommen in ruhigen, vegetationsreicheren Bereichen dieser Gewässer kann aber nicht ganz ausgeschlossen werden. Jedoch ist eine Nutzung als Laichhabitat im Bereich der Wasserentnahmestellen in Linden und Herrenhausen aufgrund der dort vorhandenen Uferstruktur und fehlender Wasservegetation nicht zu erwarten. Eine durch die beantragte Benutzung bedingte Tötung oder Verletzung durch Einsaugen von ARSU GmbH, Oldenburg 22.03.2016 Anhang 1 – Seite 10 Artenschutzrechtlicher Fachbeitrag Laich oder Larven ist daher nicht zu besorgen. Adulte Tiere sind auch aufgrund ihrer Schwimmstärke nicht gefährdet. Eine artenschutzrechtlich relevante Betroffenheit von Amphibien durch die beantragte Gewässerbenutzung kann daher ausgeschlossen werden. Fische und Rundmäuler (Pisces und Cyclostoma) THEUNERT (2008a) nennt für Niedersachsen zwei streng geschützte Fischarten, den Atlantischen Stör (Acipenser sturio) und den Nordseeschnäpel (Coregonus maraena), die beide als ausgestorben gelten und entsprechend im Wirkraum der beantragten Gewässerbenutzung nicht vorkommen. Darüber hinaus nennt er den besonders geschützten Aal ( Anguilla anguilla) und drei besonders geschützte Rundmäuler, das Bachneunauge (Lampetra planeri) und das Flussneunauge (Lampetra fluviatilis) sowie das Meerneunauge (Petromyzon marinus). Aal, Bach- und Flussneunauge wurden 2013 bei den Untersuchungen von BIOCONSULT (2016b) in Leine und Ihme nachgewiesen. Darüber hinaus ist von einem Vorkommen des Meerneunauges auszugehen. Es gehört nach Angaben der FGG WESER (o. J.) zur Fischfauna der Leine. Auch in den Vollzugshinweisen zum Schutz dieser Art (LAVES 2011c) wird auf einen Nachweis im Bereich nördlich von Hannover verwiesen. Fische und Rundmäuler verbringen ihr gesamtes Leben im Wasserkörper und reproduzieren sich auch dort. Sie könnten daher vom Einsaugen mit dem Kühlwasser in artenschutzrechtlich relevantem Maße betroffen sein. Sowohl die nachgewiesenen als auch die potenziell vorkommenden Arten Aal, Bach-, Fluss- und Meerneunauge sind daher einer genaueren Prüfung des Eintretens von Verbotstatbeständen zu unterziehen. Käfer (Coleoptera) Als einzige besonders geschützte Käfer-Art Niedersachsens, für die Fließgewässer bedeutende Habitate sind, nennt THEUNERT (2008b) den streng geschützten Grubenlaufkäfer (Carabus variolosus), der aber wohl bereits um 1950 ausgestorben ist. Sein Vorkommen im Einflussbereich der beantragten Gewässerbenutzung ist somit auszuschließen. Eine artenschutzrechtlich relevante Betroffenheit von Käfern durch die beantragte Gewässerbenutzung kann daher ausgeschlossen werden. Libellen (Odonata) Alle heimischen Libellen-Arten sind besonders, einige darüber hinaus streng geschützt. THEUNERT (2008b) nennt insgesamt elf Klein- und 15 Großlibellen-Arten, für die Fließgewässer von Bedeutung sind (vgl. A 1 - Tab. 4). 22.03.2016 ARSU GmbH, Oldenburg Wasserrechtliches Erlaubnisverfahren für die Kraftwerke Herrenhausen und Linden Anhang 1 – Seite 11 A 1 - Tab. 4: Besonders geschützte Libellen-Arten, für die Fließgewässer von Bedeutung sind Zusammenstellung der Arten und Angaben zur Verbreitung nach THEUNERT (2008b), Angaben zum Rote-Liste-Status (RL Nds.) angegeben für Niedersachsen und Bremen / Region östliches Tiefland nach ALTMÜLLER & CLAUSNITZER (2010) und zu den Ansprüchen an die besiedelten Gewässer nach ALTMÜLLER & CLAUSNITZER (2010), ALTMÜLLER et al. (1989), den Artensteckbriefen der AG Libellen in 10 Niedersachsen und Bremen sowie ergänzend nach STERNBERG & BUCHWALD (1999a, b), Angaben zum möglichen Vorkommen im Einflussbereich der beantragten Gewässerbenutzung auf der Basis von BIOCONSULT (2014, 2016b) sowie der gutachtlichen Bewertung des Lebensraumpotentials für die Art, in der Tabelle farbig hinterlegte Arten wurde im Wirkraum der beantragten Gewässerbenutzung nachgewiesen (orange) oder können dort nicht ausgeschlossen werden (gelb) 1 = vom Aussterben bedroht, 2 = stark gefährdet, 3 = gefährdet, G = Gefährdung unbekannten Ausmaßes, R = extrem selten, V = Vorwarnliste, * = ungefährdet, - = kein Vorkommen in der Region Libellen-Art Schutzstatus RL Nds. Verbreitung und Ansprüche an die Gewässer Vorkommen Kleinlibellen (Zygoptera) Prachtlibellen (Calopterygidae) Calopteryx splendens Gebänderte Prachtlibelle besonders */* im Tiefland zerstreut bis verbreitet, nach Nordwesten abnehmend, küstennah vereinzelt, im Bergland nur hier und da Fließgewässerart: Bäche, kleine Flüsse besiedelt Mittel- und Unterläufe, Leitart des Epi- und Metapotamals Larven nachgewiesen (S-1 bis S-7) Calopteryx virgo Blauflügel-Prachtlibelle besonders 3/V zerstreut im östlichen Tiefland nördlich der Aller, hier und da im südlichen Teil des westlichen Tieflandes, im Bergland nur ausnahmsweise vorwiegend Bäche, Flussoberläufe, mit guter Wasserqualität, natürlicher Uferstruktur, Pflanzen im Gewässer, bevorzugt kühleres, sauerstoffreicheres Wasser als C. splendens potenziell Schlanklibellen (Coenagrionidae) Ceriagrion tenellum Scharlachlibelle streng G/V Tieflandart, zerstreut vorkommend zwischen Ems und Allergebiet, nordwärts einzelne Nachweise in Ostfriesland und Lüneburger Heide im östlichen Tiefland in Heidemooren, vermoorten Quellbereichen und Bachoberläufen sowie Stillgewässer nein Coenagrion mercuriale Helm-Azurjunger streng 1/1 im Übergangsbereich der südlichen Dümmer-Niederung zum Osnabrücker Land, bei Sulingen und bei Stolzenau an der Weser, im Süden und Osten des östlichen Tieflandes, am Südrand des Ostbraunschweigischen Hügellandes Kalkquellmoore, Flussauen, langsam fließende kalkhaltige Wiesenbäche und Entwässerungsgräben mit Grundwassereinfluss, winterwarm nein 10 http://www.ag-libellen-nds-hb.de/libellen/artensteckbriefe/, besucht am 18.06.2015 ARSU GmbH, Oldenburg 22.03.2016 Anhang 1 – Seite 12 Libellen-Art Artenschutzrechtlicher Fachbeitrag Schutzstatus RL Nds. Verbreitung und Ansprüche an die Gewässer Vorkommen Coenagrion ornatum Vogel-Azurjungfer streng 1/1 In neuerer Zeit im südlichen Wendland, im Raum Bodenteich-Wittingen und bei Braunschweig nachgewiesen; verschollen im Übergangsbereich der südlichen Dümmer-Niederung zum Osnabrücker Land, am Steinhuder Meer und bei Hildesheim winterwarme Grund- oder Quellwasser beeinflusste langsam fließende, Gräben und Bäche nein Coenagrion puella Hufeisen-Azurjungfer besonders */* landesweit verbreitet Charakterart eu- bis oligotropher Kleingewässer, auch an Altwässern, Sümpfen und mesotrophen Mooren, seltener an größeren Weihern und Seen, überwachsenen Wiesengräben und in strömungsberuhigten Bereichen von Flüssen und Kanälen potenziell Ischnura elegans Gewöhnliche Pechlibelle besonders */* praktisch überall verbreitet oft in größerer Anzahl Gewässer aller Art, auch stark beeinträchtigte, vor allem stehende und langsam fließende Gewässern, aber auch in lenitischen Zonen mäßig schnell strömender Wiesengräben und –bäche, in ruhig fließenden breiten Flüssen und sogar in kleinen Flüssen mit turbulenter Strömung potenziell Pyrrhosoma nymphula Frühe Adonislibelle besonders */* verbreitet im gesamten Tiefland, regional auch im Bergland besiedelt breites Spektrum, stehender und fließender Gewässer, kleine Bäche, Kanäle und Gräben sowie pflanzenreiche Tümpel, Mooraugen, Wagenspuren, Teiche und Weiher; fehlt weitgehend an größeren Seen und Flüssen hat ihr Optimum an ± nährstoffreichen, verwachsenen Kleingewässern, träge fließenden sauberen (Quell-)Gräben, Oberläufen von (Quell-)Bächen und kleinen Flüssen, insbesondere wenn ruhige, krautreiche Buchten ausgebildet und die Ufer bewaldet sind. potenziell besonders */* zerstreut bis verbreitet im Tiefland und Bergland kleine Tümpel bis größere Seen sowie langsam strömende Gewässer, auch anthropogene, naturferne oder weitestgehend vegetationslose Gewässer, gelegentlich auch an ruhigen Uferbuchten schnell strömender Bäche und Flüsse, braucht Ufergehölze mit überhängenden Zweigen potenziell Teichjungfern (Lestidae) Lestes viridis Weidenjungfer 22.03.2016 ARSU GmbH, Oldenburg Wasserrechtliches Erlaubnisverfahren für die Kraftwerke Herrenhausen und Linden Libellen-Art Sympecma fusca Gewöhnliche Winterlibelle Schutzstatus besonders Anhang 1 – Seite 13 RL Nds. Verbreitung und Ansprüche an die Gewässer Vorkommen */* Zerstreut, vornehmlich im östlichen Tiefland, Einzelnachweise im Bergland und westlichen Tiefland Weser-Aller-Flachland ein Vorkommensschwerpunkt in Niedersachsen vor allem naturnahe Stillgewässer, aber auch strömungsberuhigte Abschnitte von Fließgewässern, mit Verlandungsvegetation (Seggenriede, Röhrichte) bzw. vorjährigem, flutenden Pflanzenmaterial potenziell */* zerstreut im Tiefland, im Nordwesten nur einzelne Funde, im Bergland spärlich, vornehmlich an Innerste und im Ostbraunschweigischen Hügelland Charakterart der Auen größerer Flusssysteme, besiedelt breites Spektrum schnell fließender bis stehender, mehr oder weniger nährstoffreicher Gewässer Larven nachgewiesen (S-7) Federlibellen (Platycnemididae) Platycnemis pennipes Gewöhnliche Federlibelle besonders Großlibellen (Anisoptera) Edellibellen (Aeshnidae) Aeshna grandis Braune Mosaikjungfer besonders Boyeria irene Westliche Geisterlibelle besonders ARSU GmbH, Oldenburg */V zerstreut bis verbreitet in den Marschen und im Tiefland, Schwerpunkte: unterer Weserraum, Jadebusen; im Bergland vor allem in tieferen Lagen, so im Ostbraunschweigischen Hügelland Stillgewässer, langsam strömende Fließgewässer widersprüchliche Angaben: Teiche, Weiher, Seen, Altwasser, Sumpf- und Moorgewässer, Gräben, Kanäle, Bäche, keine oder langsame Strömung in Larvenhabitaten 2007 erstmals im Tiefland nachgewiesen Funde an der Örtze in der südlichen Lüneburger Heide einziges bekanntes bodenständiges Vorkommen in Deutschland nutzt dort Abschnitte mit naturnahen Sohl- und Uferstrukturen und sandigem bis feinkiesigem Sediment, gesäumt von locker bis mäßig dichten Erlen, mit kleinräumigem Wechsel zwischen sonnigen und schattigen Bereichen potenziell nein 22.03.2016 Anhang 1 – Seite 14 Libellen-Art Brachytron pratense Früher Schilfjäger Artenschutzrechtlicher Fachbeitrag Schutzstatus besonders RL Nds. Verbreitung und Ansprüche an die Gewässer Vorkommen 3/3 sehr zerstreut bis zerstreut im Tiefland, selten im Bergland, vielerorts im Wendland und in Ostfriesland, am zahlreichsten wohl in Wesermarsch bevorzugt Stillgewässer mit Röhrichten und Hochstauden, auch Altwässer und bewachsene Gräben Auenart, Stillgewässer aber auch schnell fließende Flüsse, Kanäle, Bäche und Gräben häufig zusammen mit Platycnemis pennipes potenziell Quelljungfern (Cordulegastridae) Cordulegaster bidentata Gestreifte Quelljungfer besonders */- wenige Vorkommen im Weserbergland von Hann. Münden bis zum Deister, einzelne Funde im Harz; Vorkommen im Osnabrücker Land fraglich strenger Spezialist schwach und mäßig schüttender Hangquellen nein Cordulegaster boltonii Zweigestreifte Quelljungfer besonders 3/3 nördlich der Aller bis Lüneburger Heide, im südlichen Bergland, im Harzvorland, am Nordrand des Osnabrücker Landes und im Raum Cloppenburg/ Oldenburg sand- und/oder lehmgeprägter Bäche mit naturnaher Struktur und wenig bewachsenen Mikrostandorten nein Falkenlibellen (Corduliidae) Somatochlora flavomaculata Gefleckte Smaragdlibelle besonders 3/V einige aktuelle Funde im östlichen Tiefland, vereinzelt westlich der Weser, auch im Harzvorland breites Gewässerspektrum, aber Reproduktionsgewässer meistens flach, ihr Untergrund bestehend aus einer mächtigen organischen Schicht, in dystrophem Milieu aus Torf nein Somatochlora metallica Glänzende Smaragdlibelle besonders */* zerstreut bis verbreitet im Tiefland bis in Marschen, sehr zerstreut im Bergland bevorzugte Reproduktionsgewässer sind Seen, Altwässer, Weiher und größere Moorgewässer, oft mit Ufergehölzen bzw. in Waldnähe, auch an Bächen, Flüssen oder Entwässerungskanälen zu beobachten, wo sie aber wohl nur selten reproduzieren nein 2/3 jahrzehntelang verschollen, in den letzten Jahren in der unteren Mittelelbe, in der unteren Aller und folgend in der Weser strömungsberuhigte Bereiche großer Fließgewässer, Zwischenbuhnenfelder großer Ströme nein Flussjungfern (Gomphidae) Gomphus flavipes Asiatische Keiljungfer 22.03.2016 streng ARSU GmbH, Oldenburg Wasserrechtliches Erlaubnisverfahren für die Kraftwerke Herrenhausen und Linden Libellen-Art Schutzstatus Gomphus vulgatissimus Gewöhnliche Keiljungfer besonders Onychogompus forcipatus Kleine Zangenlibelle besonders Ophiogomphus cecilia Grüne Flussjungfer streng Anhang 1 – Seite 15 RL Nds. Verbreitung und Ansprüche an die Gewässer Vorkommen V/* nur im Tiefland zwischen Grafschaft Bentheim und Elbe, so in Ems, Hunte und Weser, bei Braunschweig Schwelle zum Bergland erreichend, fehlt im Nordwesten Aller und Nebenflüsse Verbreitungsschwerpunkt in Niedersachsen Gewässer von Bächen bis zu großen Strömen Larven nachgewiesen (S-1, S-3, S-6, S-7) ausgestorben, um 1950/60 noch bei Hannover, Bremen und Hamburg schnell fließende Bäche und Flüsse mit sandigem, kiesigem Grund und guter Wasserqualität, Ufer größerer Seen nein 3/V zwischen Aller und Elbe vielerorts, südwärts etwa bis Hannover und Braunschweig; im Westen vereinzelt bis zur Hunte Weser-Aller-Flachland einer der Verbreitungsschwerpunkte Sand- und lehmgeprägte sowie kiesgeprägte Tieflandflüsse, auch bebaute Innenstadtbereiche potenziell Segellibellen (Libellulidae) Libellula fulva Spitzenfleck besonders 2/2 sporadisch in einigen Tieflandregionen, von der Ems bis zur Elbe langsam strömende, nicht zu stark verschmutzte Flüsse, Kanäle und Altwässer der Tieflandauen mit reicher Ufervegetation, gut ausgeprägten Röhrichten und Großseggenrieden potenziell Orthetrum brunneum Südlicher Blaupfeil besonders R/R tritt regelmäßig in Lüneburger Heide, bei Celle, Braunschweig und Helmstedt sowie im Eichsfeld auf Quellrinnsale, kleinflächige, grundwasserbeeinflusste Stillgewässer, flach, offene Wiesenbäche und –gräben nein Orthetrum coerulescens Kleiner Blaupfeil besonders 2/2 sehr zerstreut im östlichen, selten im westlichen Tiefland sowie am nördlichen Harzrand und im Vorland bis Großer Bruch und Salzgitter grundwasserbeeinflusste oder quellnahe Bäche und Gräben, auch Quellmoore und –sümpfe, seltener andere Lebensräume mit geringer oder mittlerer Fließgeschwindigkeit nein Sympetrum vulgatum Gewöhnliche Heidelibelle besonders */* allgemein verbreitet, im Nordwesten etwas weniger, auf allen Inseln nutzt breites Spektrum von Still- und langsamen Fließgewässern, besonders regelmäßig und häufig an mäßig nährstoffreichen Weihern und Tümpeln mit starker Verlandungsvegetation nein ARSU GmbH, Oldenburg 22.03.2016 Anhang 1 – Seite 16 Artenschutzrechtlicher Fachbeitrag Drei dieser Arten – zwei Klein- und eine Großlibelle – wurden von BIOCONSULT (2014, 2016b) bei den Makrozoobenthos-Untersuchungen als Larven in Ihme und Leine nachgewiesen: Die besonders geschützte Gebänderte Prachtlibelle (Calopteryx splendens) wurde 2013 sowohl unterhalb des Wehres Herrenhausen, oberhalb der Wasserentnahme am KWH Herrenhausen (Abschnitt S-6) als auch in den Abschnitten unterhalb der Kläranlage Herrenhausen (Abschnitte S-1 bis S-4) nachgewiesen. Im Frühjahr 2014 trat sie an nahezu allen untersuchten Probenahmestellen in Ihme und Leine auf. Die besonders geschützte Gewöhnliche Federlibelle (Platycnemis pennipes) wurde ausschließlich 2013 im Bereich der Ihme (Abschnitt S-7) festgestellt. Die ebenfalls besonders geschützte Gewöhnliche Keiljungfer ( Gomphus vulgatissimus) wurde 2013 sowohl in der Ihme (Abschnitt S-7) als auch in verschiedenen Bereichen der Leine angetroffen, so unterhalb des Wehres Herrenhausen (Abschnitt S-6), unterhalb der Wasserentnahme am KWH Herrenhausen (S-5) und bei Luthe (S-1). Im Frühjahr 2014 wurde sie dagegen nur unterhalb des Wehres Herrenhausen (S-6) und bei Luthe (S-1) nachgewiesen. Darüber hinaus hat BIOCONSULT (2016b) im Jahr 2013 Larven einer weiteren Calopteryx-, einer Schlanklibellen- und einer weiteren Kleinlibellen- sowie einer Edellibellen-Art in Ihme und Leine zwischen dem Wehr Schneller Graben und der Leine bei Luthe festgestellt. Es kommen also weitere besonders geschützte Arten vor. Unter Berücksichtigung der Lebensraumansprüche der von THEUNERT (2008b) genannten Arten (vgl. A 1 - Tab. 4) sind im Wirkungsbereich der beantragten Gewässerbenutzung neben den drei nachgewiesenen Libellen auch die folgenden Arten zu erwarten oder zumindest nicht auszuschließen: die streng geschützte Grüne Flussjungfer (Ophiogomphus cecilia), die gemäß der Vollzugshinweise zum Schutz dieser Art (NLWKN 2011d) in diesem Bereich vorkommt, die besonders geschützte Blauflügel-Prachtlibelle (Calopteryx virgo), die besonders geschützte Hufeisen-Azurjungfer (Coenagrion puella), die besonders geschützte Gewöhnliche Pechlibelle (Ischnura elegans), die besonders geschützte Frühe Adonislibelle (Pyrrhosoma nymphula), die besonders geschützte Weidenjungfer (Lestes viridis), die besonders geschützte Gewöhnliche Winterlibelle (Sympecma fusca), die besonders geschützte Braune Mosaikjungfer (Aeshna grandis), der besonders geschützte Frühe Schilfjäger (Brachytron pratense), der besonders geschützte Spitzenfleck (Libellula fulva). Zwar leben die Imagines der Libellen außerhalb des Wassers, nutzen aber zur Reproduktion das Gewässer. Ihre Larven wachsen im Wasserkörper heran und verlassen diesen erst zur Metamorphose. Sie könnten daher vom Einsaugen mit dem Kühlwasser in artenschutzrechtlich relevantem Maße betroffen sein. Sowohl die nachgewiesenen als auch die potenziell vorkommenden Libellen-Arten sind daher einer genaueren Prüfung des Eintretens von Verbotstatbeständen zu unterziehen. 22.03.2016 ARSU GmbH, Oldenburg Wasserrechtliches Erlaubnisverfahren für die Kraftwerke Herrenhausen und Linden Anhang 1 – Seite 17 Webspinnen (Araneae) Als einzige besonders geschützte Webspinnen-Art Niedersachsens, für die Fließgewässer möglicherweise eine Bedeutung haben, nennt THEUNERT (2008b) die streng geschützte Sand-Wolfsspinne (Arctosa cinerea), die aber als ausgestorben bzw. verschollen gilt und zuletzt vor 1990 auf den Ostfriesischen Inseln nachgewiesen wurde. Ihr Vorkommen im Einflussbereich der beantragten Benutzung ist daher auszuschließen. Eine artenschutzrechtlich relevante Betroffenheit von Webspinnen durch die beantragte Gewässerbenutzung besteht daher nicht. Krebse (Crustacea) Als einzige besonders geschützte Krebs-Art Niedersachsens, für die Fließgewässer von Bedeutung sind, nennt THEUNERT (2008b) den streng geschützten Edelkrebs (Astacus astacus). Die bis Anfang des 19. Jahrhunderts verbreitete Art kommt aktuell nur noch mit wenigen Populationen in isolierten Fließgewässerabschnitten und Stillgewässern vor, die sich vorwiegend aus Wiederansiedlungsprojekten rekrutieren. Zwar gibt es auch in der Region Hannover Vorkommen in isolierten Gewässerabschnitten, die sich aber in kleinen Nebenbächen der Leine, in Teichen und Baggerseen befinden (LAVES 2011e). Das Vorkommen des streng geschützten Edelkrebses im Einflussbereich der beantragten Benutzung in Ihme und Leine ist daher nicht zu erwarten. Eine artenschutzrechtlich relevante Betroffenheit von Krebsen durch die beantragte Gewässerbenutzung kann daher ausgeschlossen werden. Weichtiere (Mollusca) BIOCONSULT (2016b) hat 2013 mit der Malermuschel (Unio pictorum) im Bereich der Leine zwischen dem HKW Linden und dem KWH Herrenhausen eine besonders geschützte Muschel-Art nachgewiesen. Sie wurde in geringer Dichte (0,4 Individuen/m²) im Bereich einer Probenahmestelle oberhalb der Wasserentnahme für das Kraftwerk Herrenhausen festgestellt. Bei ergänzenden Untersuchungen im Frühjahr 2014 wurden mit Anodonta sp. und Unio sp. weitere nicht bis zur Art bestimmte besonders geschützte Süßwassermuscheln in Ihme und Leine nachgewiesen (BIOCONSULT 2014). THEUNERT (2008b) nennt für Niedersachsen insgesamt sieben besonders geschützte MuschelArten, für die Fließgewässer bedeutende Habitate sind (vgl. A 1 - Tab. 1). Das Vorkommen von zwei dieser Arten, der Flussperlmuschel ( Margaritifera margaritifea) und der Bachmuschel (Unio crassus) im Wirkungsbereich der beantragten Benutzung kann jedoch ausgeschlossen werden, da sie im Einzugsgebiet der Weser nur noch im Landkreis Celle bzw. in der Delme vorkommen (vgl. auch NLWKN 2011c, b). Das Vorkommen von Teichmuscheln (Anodonta anatina, A. cygnea und Pseudanodonta complanata) und der großen Flussmuschel (Unio tumidus) ist hingegen möglich. ARSU GmbH, Oldenburg 22.03.2016 Anhang 1 – Seite 18 Artenschutzrechtlicher Fachbeitrag A 1 - Tab. 5: Besonders geschützte Weichtier-Arten, für die Fließgewässer von Bedeutung sind Zusammenstellung der Arten nach THEUNERT (2008b), in der Tabelle farbig hinterlegte Arten wurde im Wirkraum der beantragten Gewässerbenutzung nachgewiesen (orange) oder können nicht ausgeschlossen werden (gelb) Mollusken-Art Schutzstatus Verbreitung und Lebensraumansprüche Anodonta anatina Flache Teichmuschel besonders mehr oder weniger verbreitet kommt in stehenden bis langsam fließenden, kleineren und größeren Gewässern vor, Untergrund kann grob sandig bis schlammig sein, besiedelt alle Gewässerbereiche Anodonta cygnea Gewöhnliche Teichmuschel besonders mehr oder weniger verbreitet kommt vorwiegend in Stillgewässern oder langsam fließenden, gestauten Bereichen sommerwarmer Bäche und Flüsse vor und bevorzugt schlammigen bis feinsandigen Untergrund Margaritifera margaritifera Flussperlmuschel streng Vorkommen nur noch im Lutter-Lachte-System (Landkreis Celle) und in Restbeständen im Ilmenau-System (Landkreis Uelzen) Pseudanodonta complanata Abgeplattete Teichmuschel streng sehr zerstreut im südlichen und mittleren Abschnitt des Tieflandes von der Aller bis zur Ems, bis an die Schwelle zu den Mittelgebirgen, fehlt im Nordwesten, in der Zevener Geest, in der Wümme-Niederung und in weiteren Regionen des Tieflands lebt in wenig bewegten Bereichen mittlerer und größerer Flüsse, strömungsberuhigten Buchten sowie am Rand größerer Seen, auf feinsandigen bis schlammigen Grund, gräbt sich oft tief ein, Bestände schwer zu erfassen Unio crassus Bachmuschel streng zerstreut im Bergland und im Tiefland östlich einer Linie Peine – Lüneburg, im Einzugsgebiet der Weser einzelne neuere Nachweise aus der Delme bei Bremen. Aus der Weser und Leine weitgehend und aus der Ems anscheinend vollständig verschwunden Unio pictorum Malermuschel besonders im Tiefland zerstreut bis verbreitet, im Bergland eher selten, kommt auch in der Leine bei Nörten-Hardenberg vor bevorzugt langsam fließende, mittlere bis größere meso- bis eutrophe Gewässer und besiedelt typischerweise sandige bis schlammige Substrate, lebt aber auch in feinkiesigen Bereichen ist in der Leine unterhalb des Wehres Herrenhausen nachgewiesen worden Unio tumidus Große Flussmuschel besonders im Tiefland zerstreut bis verbreitet, im Bergland eher selten, keine Nachweise im südlichen und mittleren Abschnitt der Leine und den Heidebächen lebt in der Uferzone von Seen, Flüssen und kleineren Fließgewässern mit geringer bis mittlerer Strömung und bevorzugt sandige Substrate kommt häufig in gemischten Beständen mit Maler- und Teichmuscheln vor Da Muscheln ihr gesamtes Leben innerhalb des Gewässers verbringen, könnten sie vom Einsaugen mit dem Kühlwasser in artenschutzrechtlich relevantem Maße betroffen sein. Sowohl die nachgewiesene Art als auch die potenziell vorkommenden Muschel-Arten sind daher einer genaueren Prüfung des Eintretens von Verbotstatbeständen zu unterziehen 22.03.2016 ARSU GmbH, Oldenburg Wasserrechtliches Erlaubnisverfahren für die Kraftwerke Herrenhausen und Linden Anhang 2: Anhang 2 – Seite 1 Beschreibung der relevanten Fische und Rundmäuler Relevante Arten dieser Tiergruppe sind der Aal (Anguilla anguilla) sowie das Bach⁻, das Flussund das Meerneunauge (Lampetra planeri, L. fluviatilis und Petromyzon marinus). Aal (Anguilla anguilla) Schutz- und Gefährdungsstatus Der Aal ist eine nach der EG-Artenschutzverordnung besonders geschützte Art11; ist in der aktuellen Roten Liste der Süßwasserfische in Deutschland (FREYHOF 2009) nicht gelistet, da er sich im Meer reproduziert, nach der Roten Liste der Meeresfische und Neunaugen ist er stark gefährdet (Kat. 2) und Deutschland ist für diese Art in besonderem Maße verantwortlich (THIEL et al. 2013); ist nach der Roten Liste der International Union for Conservation of Nature (IUCN) 12 aufgrund der starken Bestandsrückgänge 'critically endangered', d. h. es besteht ein sehr hohes Risiko, dass die Art in freier Wildbahn ausstirbt13; ist auch in Niedersachsen nach Angabe des LAVES (2011a) stark gefährdet (Kat. 2), hat in Niedersachsen aufgrund des europaweiten Rückgangs von Glas- und Gelbaalen sowie der in Niedersachsen als unzureichend eingestuften Habitatausstattung der Gewässer einen schlechten Erhaltungszustand (LAVES 2011a). Verbreitung Der Europäische Aal kommt von Nordafrika bis zum Eismeer vor (BELANYECZ & BRÄMICK 2009) und ist in ganz Deutschland verbreitet. Er besiedelt sowohl die Meeresküsten von Nord- und Ostsee und die Ästuare, als auch die Binnengewässer. Natürlicherweise kommen Aale nicht nur in den Fließgewässern sondern auch in damit verbundenen Altwässern und –armen sowie in Seen vor. Heute ist der Aal in nahezu allen Binnen- und Küstengewässern, einschließlich der Schifffahrtskanäle und Seen verbreitet. In den Fließgewässern besiedeln Aale alle Abschnitte mit Ausnahme sommerkalter Forellenbäche mit vergleichsweise hohen Strömungsgeschwindigkeiten (LAVES 2011a). Auch in Niedersachsen kommt der Aal in nahezu allen Binnen- und Küstengewässern vor, meist durch Besatz gestützt. Insbesondere die größeren Flüsse und Ströme Leda, Hase, Ems, Hunte, Große Aue, Wümme, Aller, Leine, Weser, Oste, Ilmenau, Jeetzel und Elbe haben eine hohe Bedeutung für den Schutz des Aals (LAVES 2011a). Die Bestände des Aals sind in den letzten Jahrzehnten in Niedersachsen, Deutschland und Europa rückläufig. In Deutschland erfolgen bereits seit über 100 Jahren Besatzmaßnahmen in den Fließ- 11 12 13 vgl. http://www.wisia.de/FsetWisia1.de.html, besucht am 25.06.2015 The IUCN Red List of Threatened Species, Version 2015.2 (http://www.iucnredlist.org), Download vom 29.06.2015 vgl. http://www.iucnredlist.org/static/categories_criteria_3_1, zuletzt besucht am 29.06.2015 ARSU GmbH, Oldenburg 22.03.2016 Anhang 2 – Seite 2 Artenschutzrechtlicher Fachbeitrag gewässern, um den negativen Einfluss der Wanderungshindernisse auszugleichen (LAVES 2011a). Lebensraumansprüche und Verhaltensweisen Der Aal gehört zu den katadromen Wanderfischen, d. h. er wandert zur Eiablage aus den Binnengewässern ins Meer. Er hat einen komplexen Lebenszyklus mit verschiedenen Entwicklungsstadien, der noch nicht vollständig aufgeklärt ist. Die Laichgebiete des Europäischen Aals liegen nach heutigem Kenntnisstand im Sargassomeer vor der amerikanischen Ostküste. Von dort gelangen die unpigmentierten so genannten Weidenblatt- oder Leptocephalus-Larven des Aals wieder an die Küsten Europas. Wohl spätestens am Rand des Kontinentalhangs nehmen die Larven dann eine unpigmentierte aalförmige Gestalt an (GERSTMEIER & ROMIG 2003; KOTTELAT & FREYHOF 2007; BELANYECZ & BRÄMICK 2009). Diese so genannten Glasaale sind aktive Schwimmer und steuern die Küsten- und Brackwasserbereiche an (GERSTMEIER & ROMIG 2003). Sie erreichen die deutsche Nordseeküste im Februar (GERSTMEIER & ROMIG 2003; BELANYECZ & BRÄMICK 2009). Während ein Teil der Population im Bereich der Ästuare und Flussunterläufe verbleibt, wandert der andere Teil stromauf, teilweise bis weit in die Flussläufe des Binnenlandes (BELANYECZ & BRÄMICK 2009; LAVES 2011a). Die kleineren Männchen verbleiben eher in der Nähe der Unterläufe, die größeren Weibchen wandern bis zu 1.000 km flussaufwärts (GERSTMEIER & ROMIG 2003). Während der Wanderung erfolgt im Bereich der Flussmündungen und –unterläufe die Pigmentierung der Tiere zum so genannten Gelbaal (LAVES 2011a). Die pigmentierten Gelbaale siedeln sich letztlich in einer Vielzahl von Gewässertypen an (s. o.) und sind dann sehr standorttreu. Nach GERSTMEIER & ROMIG (2003) bewegen sie sich meist nur innerhalb eines Radius von wenigen hundert Metern. Allerdings kommt es vor allem in Fließgewässern auch zu saisonalen bis zu ca. 60 km langen Wanderungen der Aale zwischen Sommerund Winterquartieren (GERSTMEIER & ROMIG 2003; LAVES 2011a). Die Aktivität der Aale geht mit sinkenden Wassertemperaturen deutlich zurück. In der kalten Jahreszeit suchen sie tiefe, frostfreie Stellen im Gewässer auf (LAVES 2011a). Die Abwanderung in die Winterquartiere und die Rückwanderung erfolgen meistens Ende September und Anfang Mai und erstrecken sich jeweils über ca. drei Wochen (BELANYECZ & BRÄMICK 2009). Die Angaben zur Aufenthaltszeit der Aale im Süßwasser variieren erheblich und liegen zwischen fünf und 20 Jahren (KOTTELAT & FREYHOF 2007; BELANYECZ & BRÄMICK 2009; LAVES 2011a). Mit Erreichen der Geschlechtsreife beginnen die adulten Aale wieder flussabwärts zu wandern und nehmen eine silbergraue Färbung an. Diese Blankaale wandern über 4.000–6.000 km zurück ins Sargassomeer und sterben nach dem Ablaichen (LAVES 2011a). In den Flüssen wandern sie dabei in der stärksten Strömung, mit einer von der Strömung unabhängigen Geschwindigkeit von durchschnittlich ca. 3,3 km/h. Nach KOTTELAT & FREYHOF (2007) beginnt die Abwanderung im Spätsommer oder Herbst. Sie scheint temperaturabhängig zu sein, wobei die untere Grenze anscheinend bei ca. 4–6 °C liegt. Darunter sind die Tiere weitgehend inaktiv, aber auch zu hohe Temperaturen reduzieren den Anteil der abwandernden Aale (BELANYECZ & BRÄMICK 2009). In den Binnengewässern gilt der Aal als Bewohner der Gewässersohle. Hier hält er sich tagsüber in geeigneten Verstecken aus Steinen, Baumwurzeln, Totholz oder dichten Pflanzenbeständen verborgen. In ausgebauten Fließgewässern werden die Ufersicherungen aus Blocksteinen als Sekundärhabitat genutzt. Aale sind nachtaktive mit dem Geruchssinn jagende Bodenfische. In 22.03.2016 ARSU GmbH, Oldenburg Wasserrechtliches Erlaubnisverfahren für die Kraftwerke Herrenhausen und Linden Anhang 2 – Seite 3 den Flussgebieten ernähren sich die Jungaale von Kleintieren. Sie fressen vor allem Schnecken, Muscheln, Kleinkrebse und Würmer, die größeren Aale vermehrt auch Fische (LAVES 2011a). Nach BELANYECZ & BRÄMICK (2009) kann die Ernährungsweise von Gewässer zu Gewässer sehr unterschiedlich sein und auch mit den Jahreszeiten variieren. Vorkommen im Einflussbereich der beantragten Benutzung Der Europäische Aal kommt in allen Abschnitten der niedersächsischen Leine vor und die Region Hannover gehört zu den Gebieten mit höchster Priorität für die Umsetzung von Maßnahmen zum Schutz und zur Entwicklung des Aals (vgl. LAVES 2011a). BIOCONSULT (2016b) hat den Aal auch bei den 2013 durchgeführten Untersuchungen zur ökologischen Situation von Leine und Ihme im Abschnitt vom Wehr Schneller Graben bis Luthe nachgewiesen. Er trat in allen drei Untersuchungsabschnitten ober- und unterhalb der Kühlwasserentnahme- und Einleitungsbauwerke (S-5 bis S-7) auf. Dabei war die relative Abundanz im Bereich des Ihme-Flusses (S-7) größer als in den Abschnitten unterhalb des Wehres Herrenhausen (S-5, S-6). Bachneunauge (Lampetra planeri) Schutz- und Gefährdungsstatus Das Bachneunauge ist eine nach der BArtSchV besonders geschützte Art14, ist nach der Roten Liste Deutschland (FREYHOF 2009) ungefährdet, ist in Niedersachsen nach THEUNERT (2008a) und LAVES (2008, 2011d) gefährdet (Kat. 3) hat in Deutschland nach dem aktuellen Nationalen Bericht 2013 gemäß FFH-Richtlinie sowohl in der atlantischen als auch in der kontinentalen Region einen günstigen Erhaltungszustand.15 Verbreitung Die Hauptvorkommen des Bauneunauges liegen in Deutschland in den Einzugsgebieten der Ströme Elbe, Weser und Rhein. Besiedlungsschwerpunkte finden sich in der Lüneburger Heide, im Pfälzer Wald, Schwarzwald, Hunsrück, Taunus, Erzgebirge und im nordhessischen Bergland (LAVES 2011d). Insbesondere im norddeutschen Tiefland überschneidet sich sein Verbreitungsgebiet mit dem des Flussneunauges, aber Bachneunaugen besiedeln auch Gewässerabschnitte oberhalb der von den Flussneunaugen bevorzugten Bereiche und kommen noch deutlich weiter im Binnenland vor (GERSTMEIER & ROMIG 2003; KRAPPE et al. 2012). 14 15 vgl. http://www.wisia.de/FsetWisia1.de.html, besucht am 25.06.2015 vgl. Ergebnisübersicht – Nationale Bericht 2013 (https://www.bfn.de/0316_nat-bericht_ergebnisse2013.html), Einzelbewertungen Arten atlantische bzw. kontinentale biogeografische Region https://www.bfn.de/fileadmin/MDB/documents/themen/ natura2000/Nat_Bericht_2013/arten_atl.pdf bzw. https://www.bfn.de/fileadmin/MDB/documents/themen/natura2000/Nat_ Bericht_2013/arten_kon.pdf, zuletzt abgerufen am 25.06.2015 ARSU GmbH, Oldenburg 22.03.2016 Anhang 2 – Seite 4 Artenschutzrechtlicher Fachbeitrag In Niedersachsen war das Bachneunauge ursprünglich in den Einzugsgebieten von Elbe, Weser und Ems weit verbreitet, fehlte aber in den Marschgewässern und den höher gelegenen Harzbächen. Aktuell werden überwiegend Einzelvorkommen in den Einzugsgebieten der drei großen Flüsse nachgewiesen. Es gibt aber noch größere zusammenhängende Areale (LAVES 2011d). Als Vorkommensschwerpunkte innerhalb des Weser-Einzugsgebiets werden genannt (LAVES 2011d): die linken Weserzuflüsse Lethe, Delme, Hache und die nördlichen Zuflüsse der Großen Aue im Weserbergland die Schwülme und die Ilme mit Nebengewässern im Leinebergland Oker, Sieber und Nebengewässer in der Heide Örtze, Lachte und Böhme im Bereich der Stader Geest die Fließgewässersysteme von Lehrde und Wümme. Die Leine gehört also nicht zu den Verbreitungsschwerpunkten, aber sowohl oberhalb als auch unterhalb von Hannover werden aktuelle Vorkommen verzeichnet (vgl. LAVES 2011d), wie auch die aktuelle vom LAVES zur Verfügung gestellte Karte in A 2 - Abb. 1zeigt. A 2 - Abb. 1: Bachneunaugen-Nachweise im Rahmen des fischereilichen Monitorings 2001–2013 Quelle: Niedersächsisches Landesamt für Verbraucherschutz und Lebensmittelsicherheit (LAVES), Dezernat Binnenfischerei (E-Mail vom 12.06.2015), ergänzt um einen pinkfarbenen Kreis zur Markierung der Lage des Projekts im Bereich Hannover 22.03.2016 ARSU GmbH, Oldenburg Wasserrechtliches Erlaubnisverfahren für die Kraftwerke Herrenhausen und Linden Anhang 2 – Seite 5 Lebensraumansprüche und Verhaltensweisen Bachneunaugen leben stationär in sauerstoffreichen Bächen und kleinen Flüssen (GERSTMEIER & ROMIG 2003; KOTTELAT & FREYHOF 2007; LAVES 2011d). Sie besiedeln bevorzugt sommerkühle Bäche und kleine Flüsse, deren sommerliche Höchsttemperaturen in der Regel unter 20 °C liegen und die eine gute bis sehr gute Wasserqualität (Güteklasse II oder besser) aufweisen. Aber auch tendenziell sommerwarme Gewässerabschnitte werden genutzt, sofern sie hinreichende Laichmöglichkeiten bieten (PETERSEN et al. 2004; LAVES 2011d). Der Lebenszyklus der Bachneunaugen umfasst eine mehrjährige larvale und eine kurze adulte Phase, die auf einige Monate beschränkt ist (BLOHM et al. 1994). Als Grenztemperatur für den Beginn der Laichzeit werden Werte von ca. 9–11 °C genannt (BLOHM et al. 1994; PETERSEN et al. 2004; KOTTELAT & FREYHOF 2007; KRAPPE et al. 2012), möglicherweise ist aber eine sprunghafte Temperaturerhöhung um mehrere Grad der auslösende Faktor für die Laichaktivitäten (BLOHM et al. 1994; PETERSEN et al. 2004). In Abhängigkeit von der geografischen Lage erstreckt sich die Laichzeit über die Zeit von März bis Juli (GERSTMEIER & ROMIG 2003; PETERSEN et al. 2004; KRAPPE et al. 2012). Das LAVES (2011d) gibt für Niedersachsen einen Zeitraum von Mitte April bis Juni an, im norddeutschen Flachland liegt die Laichzeit häufig im Mai und das Ablaichen kann sich innerhalb eines Bestandes über 1–3 Wochen hinziehen (BLOHM et al. 1994; LAVES 2011d), konzentriert sich aber meist auf wenige Tage (KRAPPE et al. 2012). Als Laichhabitate werden flach überströmte, kiesig-sandige Substrate (LAVES 2011d) in Bereichen mit moderater Strömung (KOTTELAT & FREYHOF 2007) genutzt. Meist liegt die Strömungsgeschwindigkeit bei ca. 0,2–0,5 m/s und die Wassertiefe ist in der Regel geringer als 40 cm, in größeren Gewässern kann sie aber bis 60 cm betragen. Bevorzugt werden Korngrößen von 0,2–20 mm (Mittelsand bis Mittelkies) (BLOHM et al. 1994; PETERSEN et al. 2004; KRAPPE et al. 2012). Während die Bachneunaugen sonst das Tageslicht meiden, sind sie während des Laichzeit tagaktiv (BLOHM et al. 1994; KOTTELAT & FREYHOF 2007; KRAPPE et al. 2012). Sie legen flache Laichgruben an und das Ablaichen erfolgt in Gruppen. Danach sterben die adulten Tiere innerhalb weniger Wochen (GERSTMEIER & ROMIG 2003; PETERSEN et al. 2004; KRAPPE et al. 2012). Die Weibchen produzieren durchschnittlich jeweils ca. 500–2.000 Eier (PETERSEN et al. 2004; KRAPPE et al. 2012), die sich im Lückensystem des stromab liegenden Randes der Laichgrube ablagern. Die Larven schlüpfen nach ca. 11–14 Tagen und verbleiben noch etwa zehn Tage im Bereich der Laichgrube bis der Dottersack aufgezehrt ist (LAVES 2011d; KRAPPE et al. 2012). Nur ca. 5 % der Eier siedeln sich als Junglarven an und während der nachfolgenden Aufwuchsphase wird die jährliche Sterblichkeitsrate nach KRAPPE et al. (2012) auf 20–40 % und nach PETERSEN et al. (2004) auf 30–40 % geschätzt. Die als Querder bezeichneten Larven (Ammocoetes-Larven) verdriften von der Laichgrube mit ca. 8 mm Länge (BLOHM et al. 1994) bachabwärts und besiedeln meist unmittelbar stromab der Laichplätze liegende Habitate mit strömungsberuhigten Abschnitten und Ablagerungen von Feinsedimenten. Die Querder sind auf sehr feinkörniges, weiches Substrat angewiesen, in dem sie graben, Nahrung finden und sich bei Gefahr in tiefere Schichten zurückziehen können. Genutzt werden Bereiche mit ganz schwacher bis mittlerer Strömung (ca. 0,03–0,5 m/s) aber die höchsten Querder-Dichten werden bei schwacher Strömung (ca. 0,1 m/s) beobachtet. Bereiche mit hoher Sedimentumlagerung werden gemieden (BLOHM et al. 1994). Aufgrund ihres langsamen Stoffwechsels können die Larven offenbar relativ lange Phasen mit extremem Sauerstoffmangel überdauern (KRAPPE et al. 2012). ARSU GmbH, Oldenburg 22.03.2016 Anhang 2 – Seite 6 Artenschutzrechtlicher Fachbeitrag Die Querder halten sich vorwiegend im Feinsediment der stabilen Sandbänke verborgen und ernähren sich als Filtrierer von kleinen organischen Partikeln wie Kieselalgen, Einzellern, tierischen Kleinlebewesen und Detritus (LAVES 2011d), die sie aus dem grundnahen Wasser und aus den obersten Sedimentschichten aufnehmen (BLOHM et al. 1994). Sie verlassen das Sediment nur ungern, aber im Frühjahr gibt es eine Phase, in der sie eine Tendenz zur Ausbreitung zeigen (KRAPPE et al. 2012). Im Verlauf der mehrjährigen Larvalzeit breiten sich die Querder so stromabwärts aus, auch in der Folge von Hochwasser-Ereignissen. Ältere Querder besiedeln häufig dicke Detritus-Ablagerungen aus sich zersetzendem Pflanzenmaterial (LAVES 2011d). Nach KRAPPE et al. (2012) breiten sie sich im norddeutschen Tiefland durchschnittlich um ca. 230–320 m/Jahr aus, aber bei ungünstigen Rahmenbedingungen dürfte die Ausbreitung noch größer sein. Mit zunehmender Entfernung vom Laichplatz nimmt die Querdichte ab, so dass in 1,5–2 km Entfernung stromabwärts eine starke Ausdünnung zu verzeichnen ist und der Bestand sich überwiegend aus älteren Jahrgängen zusammensetzt. Die Bachneunaugen haben im Vergleich zu den Fluss- und Meerneunaugen eine längere Larvalphase, die nach den älteren Schätzungen etwa 3–5 Jahre oder 6–8 Jahre dauern soll (GERSTMEIER & ROMIG 2003; KOTTELAT & FREYHOF 2007; LAVES 2011d). Nach neueren Untersuchungen aus dem norddeutschen Tiefland ist aber vermutlich von mindestens 10 Jahren, durchschnittlich sogar 14–18 Jahren auszugehen, wobei sie bei den Weibchen vermutlich länger dauert als bei den Männchen (KRAPPE et al. 2012). Auch bezüglich des Beginns der Metamorphose der Querder zu den adulten Bachneunaugen werden unterschiedliche Angaben gemacht. Sie erfolgt nach LAVES (2011d) bei einer Länge der Querder von etwa 10–15 cm, nach GERSTMEIER & ROMIG (2003) bei ca. 15–20 cm. Nach KOTTELAT & FREYHOF (2007) sowie BLOHM et al. (1994) beginnt sie im Juni, Juli oder August und vollständig transformierte Adulte werden ca. sechs Wochen später gewöhnlich im August und September gefunden. Nach KRAPPE et al. (2012) ist sie in den Beständen stark synchronisiert, beginnt gewöhnlich gegen Ende Juli und vollzieht sich in den nächsten Wochen recht rasch, so dass die Tiere ab Ende September den Adulten schon ähneln. Die weitere Umwandlung verläuft dann deutlich langsamer, so dass man vollentwickelte Laichtiere erst im März findet. Während und nach der Metamorphose graben sich die Tiere weiterhin wie die Querder ein (BLOHM et al. 1994). Die metamorphosierten Bachneunaugen nehmen keine Nahrung mehr zu sich, sammeln sich in kleinen Gruppen und überwintern, bevor sie im nächsten Frühjahr laichen (GERSTMEIER & ROMIG 2003; KOTTELAT & FREYHOF 2007). Um geeignete Laichareale zu finden, führen sie kurze Laichwanderungen durch. Nach BLOHM et al. (1994) liegen die Laichplätze in der Regel nahe an den Querder-Habitaten, manchmal aber auch einige hundert Meter oder selten auch wenige Kilometer bachaufwärts. KRAPPE et al. (2012) gehen jedoch davon aus, dass auch Distanzen von mehreren Kilometern zwischen Winterquartier und Laichplatz überwunden werden. Die Laichwanderungen erfolgen fast ausschließlich nachts, erst etwa zwei Wochen vor der Laichzeit und werden vermutlich durch einen Anstieg der Wassertemperatur auf 7–10 °C ausgelöst (BLOHM et al. 1994). Vorkommen im Einflussbereich der beantragten Benutzung Bei den 2013 durchgeführten Untersuchungen zur ökologischen Situation von Leine und Ihme im Abschnitt vom Wehr Schneller Graben bis Luthe hat BIOCONSULT (2016b) bei den Befischungen zwar keine adulten Bachneunaugen wohl aber deren Querder nachgewiesen (vgl. Kap. 4.2.3). Nach Angaben des LAVES wurden zwischen 2001 und 2013 Bachneunaugen im Rahmen des 22.03.2016 ARSU GmbH, Oldenburg Wasserrechtliches Erlaubnisverfahren für die Kraftwerke Herrenhausen und Linden Anhang 2 – Seite 7 fischereilichen Monitorings zur Umsetzung der Wasserrahmen- und der Fauna-Flora-HabitatRichtlinie ober- und unterhalb von Hannover nachgewiesen. Im Bereich Hannover wurden Querder der Lampetra-Arten nachgewiesen, dabei wurde allerdings nicht zwischen Bach- und Flussneunaugen unterschieden (vgl. A 2 - Abb. 1). Für Querder geeignete Habitate befinden sich nach Angaben von BIOCONSULT (2016b) im gesamten Untersuchungsbereich zwischen dem Wehr Schneller Graben und der Leine bei Luthe. Diese weisen jedoch aufgrund der Unterschiede in der Gewässerstruktur, dem Uferverbau und dem Strömungsgeschehen eine unterschiedliche Qualität auf. Bevorzugt werden locker gelagerte Feinsedimentbänke in relativ flachen zumindest teilweise besonnten Uferbereichen (BIOCONSULT 2016b). In allen sieben untersuchten Abschnitten (vgl. S-1 bis S-7 in Abb. 2 auf Seite 23) wurden in den beprobten potenziellen Querderhabitaten Bachneunaugen-Querder nachgewiesen. Die Dichte der Querder war mit 2–42 Individuen pro Probenahmestelle sehr unterschiedlich. Auch innerhalb eines Untersuchungsabschnittes gab es deutliche Unterschiede zwischen den einzelnen Probenahmestellen, daher macht BIOCONSULT (2016b) keine Aussagen zu einem Trend entlang der untersuchten Strecke. Die in der Leine bei Herrenhausen beprobten Querderhabitate (Q3–Q6) wiesen bezogen auf den gesamten Untersuchungsbereich eine überdurchschnittliche Besiedlungsdichte auf (vgl. A 2 - Abb. 2). Die am Übergang vom Schnellen Graben zum Ihme-Fluss untersuchten Habitate (Q1 und Q2) hatten trotz potenziell gut geeigneter Habitatstrukturen nur eine vergleichsweise geringe Besiedlungsdichte. A 2 - Abb. 2: Neunaugen-Querder je Probenahmestelle in Ihme und Leine dargestellt ist die Anzahl der Querder je Probenahmestelle (Q1-Q10, Q15-Q17) in den Untersuchungsabschnitten (S) 1–7, rot umrandet sind die Probenahmestellen Q1–Q6 in den Untersuchungsabschnitten S-7 bis S-5 ober- und unterhalb der Wasserentnahmestellen für die Kraftwerke in Hannover (Quelle: BIOCONSULT 2016b) ARSU GmbH, Oldenburg 22.03.2016 Anhang 2 – Seite 8 Artenschutzrechtlicher Fachbeitrag Nach Angaben des LAVES16 wurde aus den Fängen des Monitorings zur Wasserrahmenrichtlinie (WRRL) und der Fauna-Flora-Habitat-Richtlinie (FFH-RL) seit 2001 für ganz Niedersachsen ein Mittelwert der Dichte von Bach- und Flussneunaugen-Querdern von 0,056 Individuen/m² ermittelt17. In der Leine lag die Dichte mit im Mittel 0,008 Ind./m² deutlich niedriger.18 Nach den 'Empfehlungen für die Erfassung und Bewertung von Arten als Basis für das Monitoring nach Artikel 11 und 17 der FFH-Richtlinie in Deutschland' (SCHNITTER et al. 2006) entspricht eine Querderdichte von < 0,5 Ind./m² einem schlechten, eine von 0,5–5 Ind./m² einem guten und von > 5 Ind./m² einem hervorragenden Erhaltungszustand einer Neunaugen-Population. Nach Auffassung von BIOCONSULT (2016b) ist es nicht unwahrscheinlich, dass im Bereich der Ihme aufgrund der Stauwirkung oder der Barrierewirkung des Wehres Herrenhausen weniger Neunaugen ablaichen und somit auch weniger Querder anzutreffen sind. Eine vom LAVES zur Verfügung gestellte Abbildung zeigt jedoch, dass sich in einem Seitenarm von Schnellem Graben/ Ihme zahlreiche Laichplätze der Neunaugen befinden. Auch in der Leine oberhalb des Wehres Schneller Graben im Stadtteil Döhren, in der Mühlenleine im Zentrum von Hannover sowie in der Leine kurz unterhalb des Wehres Herrenhausen sind Laichplätze bekannt (vgl. A 2 - Abb. 3). Da es aber für den Bereich der Leine keine systematische Kartierung der Laichplätze gibt, sind sie auch in anderen Gewässerabschnitten nicht auszuschließen. A 2 - Abb. 3: Laichhabitate der Neunaugen in der Leine in Hannover Quelle: Niedersächsisches Landesamt für Verbraucherschutz und Lebensmittelsicherheit (LAVES), Dezernat Binnenfischerei (E-Mail vom 12.06.2015), die Laichplätze sind durch schwarze Punkte markiert 16 17 18 Niedersächsisches Landesamt für Verbraucherschutz und Lebensmittelsicherheit (LAVES), Dezernat Binnenfischerei, E-Mail vom 12.06.2015 bei einem Minimalwert von 0,0002 Ind./m² und einem Maximalwert von 3,81 Ind./m² bei minimal 0,003 Ind./m² und maximal 0,006 Ind./m². Da die Querder der Fluss- und der Bachneunaugen in den frühen Lebensstadien häufig vergesellschaftet sind, sich aber im Feld nicht unterscheiden lassen, werden die Lampetra-Querder zusammen erfasst und zur Einschätzung des Erhaltungszustandes zu je 50 % auf die beiden Arten verteilt. Anzahl der Proben: für Niedersachsen n = 1.461, für die Leine N = 37. 22.03.2016 ARSU GmbH, Oldenburg Wasserrechtliches Erlaubnisverfahren für die Kraftwerke Herrenhausen und Linden Anhang 2 – Seite 9 Flussneunauge (Lampetra fluviatilis) Schutz- und Gefährdungsstatus Das Flussneunauge ist eine nach der BArtSchV besonders geschützte Art19, ist nach der Roten Liste Deutschland (FREYHOF 2009) gefährdet (Kat. 3), ist in Niedersachsen nach Angabe von THEUNERT (2008a) und LAVES (2008, 2011b) stark gefährdet (Kat. 2), hat in Deutschland nach dem aktuellen Nationalen Bericht 2013 gemäß FFH-Richtlinie in der atlantischen Region einen ungünstig-unzureichenden und in der kontinentalen Region einen ungünstig-schlechten Erhaltungszustand.20 Verbreitung Flussneunaugen nutzen je nach Lebensphase sowohl marine Küstengewässer als auch Fließgewässer. Verbreitungsschwerpunkte in den Binnengewässern Deutschlands sind die Flüsse Rhein, Elbe, Weser, Ems und Oder sowie deren Nebengewässer (LAVES 2011b). Niedersachsen hat aufgrund der Verbreitungsschwerpunkte in den niedersächsischen Strömen Elbe, Weser und Ems, deren Ästuaren und im Wattenmeer eine besondere Verantwortung für den Erhalt dieser Art. Zudem sind die niedersächsischen Flussunterläufe ein wichtiger Wanderkorridor für die stromauf liegenden Lebensräume in anderen Bundesländer (LAVES 2011b). Im Wesereinzugsgebiet stammen die meisten Nachweise aus den Einzugsgebieten von Wümme. Geeste und Hunte sowie aus dem Flussgebiet der unteren Aller einschließlich der Leine bis Hannover. Eine aktuelle vom LAVES zur Verfügung gestellte Karte zeigt Nachweise des Flussneunauges in und unterhalb von Hannover (vgl. A 2 - Abb. 4). 19 20 vgl. http://www.wisia.de/FsetWisia1.de.html, besucht am 25.06.2015 vgl. Ergebnisübersicht – Nationale Bericht 2013 (https://www.bfn.de/0316_nat-bericht_ergebnisse2013.html), Einzelbewertungen Arten atlantische bzw. kontinentale biogeografische Region https://www.bfn.de/fileadmin/MDB/documents/themen/ natura2000/Nat_Bericht_2013/arten_atl.pdf bzw. https://www.bfn.de/fileadmin/MDB/documents/themen/natura2000/Nat_ Bericht_2013/arten_kon.pdf, zuletzt abgerufen am 25.06.2015 ARSU GmbH, Oldenburg 22.03.2016 Anhang 2 – Seite 10 Artenschutzrechtlicher Fachbeitrag A 2 - Abb. 4: Flussneunaugen-Nachweise im Rahmen des fischereilichen Monitorings 2001–2013 Quelle: Niedersächsisches Landesamt für Verbraucherschutz und Lebensmittelsicherheit (LAVES), Dezernat Binnenfischerei (E-Mail vom 12.06.2015), ergänzt um einen pinkfarbenen Kreis zur Markierung der Lage des Projekts im Bereich Hannover Lebensraumansprüche und Verhaltensweisen Im Gegensatz zum stationären Bachneunauge handelt es sich beim Flussneunauge um eine anadrome Wanderart. Sie nutzt die Fließgewässer als Laich- und Larvalhabitat, wandert für eine Aufwuchsphase in die küstennahen marinen Bereiche ab und kehrt dann zur Reproduktion in die Binnengewässer zurück. Dort benötigt das Flussneunauge durchgängige, sauerstoffreiche Fließgewässer mit mäßig bis stark überströmten Kiesbänken als Laichareal und Feinsedimentbänke als Larvalhabitat. Entsprechende Abschnitte finden sich vor allem im oberen Potatmal (Barbenregion) und besonders im Rhithral (Äschen- und zum Teil auch Forellenregion) der Fließgewässer (LAVES 2011b). Der Lebenszyklus der Flussneunaugen umfasst eine mehrjährige larvale Phase und eine kürzere Aufwuchsphase, in der die Tiere parasitisch bis räuberisch leben. Dabei heften sie sich an Wirtsfische und raspeln Gewebe ab, dass sie mit ihrem Saugmaul aufnehmen. Mit Beginn der Laichwanderung stellen sie die Nahrungsaufnahme ein und bilden den Verdauungstrakt zurück. Nach dem Laichen sterben die adulten Tiere innerhalb weniger Tage (LAVES 2011b). 22.03.2016 ARSU GmbH, Oldenburg Wasserrechtliches Erlaubnisverfahren für die Kraftwerke Herrenhausen und Linden Anhang 2 – Seite 11 Das Flussneunauge zieht zum Laichen weit in die Flusssysteme hinein. Erste Tiere wandern ab dem Spätsommer aus den Küstengewässern kommend in die Brackwasserbereiche der Ästuare von Elbe, Weser und Ems, die eigentliche Laichwanderung in den Binnengewässern erfolgt aber erst vom Herbst (Oktober) bis zum Frühjahr (April) des nächsten Jahres, wird jedoch bei niedrigen Temperaturen unterbrochen. Dabei steigen im Herbst in der Regel mehr Neunaugen auf als im Frühjahr. Die im Herbst aufsteigenden Tiere überwintern im Süßwasser stromabwärts der späteren Laichplätze ohne Nahrung aufzunehmen und sind meist größer als die im Frühjahr wandernden (GERSTMEIER & ROMIG 2003; KOTTELAT & FREYHOF 2007; LAVES 2011b; KRAPPE et al. 2012). Die Laichzeit des Flussneunauges ist im Frühjahr zwischen März und Mai, wenn eine kritische Wassertemperatur von ca. 9–10 °C erreicht wird, aber auch bei 6 °C wurden schon Laichaktivitäten beobachtet. Entgegen der sonst das Tageslicht meidenden Verhaltensweise, laichen die Tiere an sonnenexponierten Stellen. Meist sind die Laichhabitate des Flussneunauges durch kiesiges Substrat, eine rasche Strömung (ca. 0,20–0,95 m/s) und eine Wassertiefe von mindestens 20 cm gekennzeichnet. Sie liegen oft am Anfang und Ende von Gleithängen. In ausgebauten Gewässern werden außerdem technische Steinschüttungen genutzt (GERSTMEIER & ROMIG 2003; PETERSEN et al. 2004; KOTTELAT & FREYHOF 2007; LAVES 2011b; KRAPPE et al. 2012). Wie die Bachneunaugen legen auch die Flussneunaugen Laichgruben an und laichen gruppenweise. Zum Teil nutzen beide Arten zeitgleich dieselben Laichgruben (KRAPPE et al. 2012). Ihre Eier lagern sich im Kieslückensystem der Laichgrube ab (LAVES 2011b). Die Zahl der Eier pro Weibchen variiert mit der Größe der Tiere zwischen 5.000 und 42.500 Stück, durchschnittlich kann von etwa 25.000–30.000 Eiern/Weibchen ausgegangen werden. Die Larven schlüpfen nach ca. 14 Tagen und verbleiben noch etwa 4–5 Tage im Bereich der Laichgrube bevor sie in die Querderhabitate abwandern (KRAPPE et al. 2012). Auch die Larven der Flussneunaugen leben vorwiegend im Gewässergrund eingegraben und ernähren sich vor allem von organischen Partikeln, Algen, Diatomeen und anderen Kleinstorganismen. Sie bevorzugen Feinsedimentbänke mit Detritusauflage (GERSTMEIER & ROMIG 2003; PETERSEN et al. 2004; KOTTELAT & FREYHOF 2007; LAVES 2011b; KRAPPE et al. 2012). Zwar verlassen sie das Sediment nur ungern, zeigen aber im Frühjahr eine Tendenz zur Ausbreitung. Meist gelangen sie in dieser Phase in stromabwärts gelegene Bereiche, stromaufwärts gerichtete Bewegungen sind vergleichsweise selten. Obwohl die Querder gelegentlich von Fischen gefressen werden, wird ihre Mortalitätsrate während dieser Lebensphase als relativ gering eingestuft (KRAPPE et al. 2012). Die Larvalphase dauert vermutlich etwa 3–5 Jahre. Die Metamorphose erfolgt im Spätsommer und Herbst, wenn die Querder etwa eine Länge von 10–15 cm erreicht haben. Die juvenilen Flussneunaugen überwintern dann noch im Süßwasser, bevor sie im Frühling mit den Hochwässern zwischen März und Mai in die Ästuare und marinen Aufwuchsgebiete wandern (GERSTMEIER & ROMIG 2003; PETERSEN et al. 2004; KOTTELAT & FREYHOF 2007; LAVES 2011b; KRAPPE et al. 2012). Die marine Aufwuchsphase dauert 1–3 Jahre. Vermutlich halten sich die Tiere vorwiegend in den äußeren Ästuaren und Küstengewässern auf, wo sie insbesondere an Stinten, Herings- und Dorschfischen parasitieren. Die ausgewachsenen Flussneunaugen kehren nicht unbedingt in ihre Geburtsgewässer zurück, sondern folgen chemotaktisch den von Querdern abgesonderten Pheromonen (KOTTELAT & FREYHOF 2007; LAVES 2011b; KRAPPE et al. 2012). ARSU GmbH, Oldenburg 22.03.2016 Anhang 2 – Seite 12 Artenschutzrechtlicher Fachbeitrag Vorkommen im Einflussbereich der beantragten Benutzung Bei den 2013 durchgeführten Untersuchungen von Leine und Ihme im Abschnitt vom Wehr Schneller Graben bis Luthe hat BIOCONSULT (2016b) keine adulten Flussneunaugen aber deren Querder nachgewiesen (vgl. Kap. 4.2.3). Nach Angaben des LAVES wurden zwischen 2001 und 2013 Flussneunaugen im Rahmen des fischereilichen Monitorings inner- und unterhalb von Hannover nachgewiesen (vgl. A 2 - Abb. 4). Nach den zur Verfügung gestellten Daten21 wurden am Wehr Herrenhausen zwischen 2000 und 2015 wiederholt Flussneunaugen beobachtet. Auch Querder der Lampetra-Arten wurden im Bereich Hannover festgestellt, jedoch nicht nach Bach- und Flussneunaugen unterschieden (vgl. A 2 - Abb. 1 und A 2 - Abb. 4). Für Querder geeignete Habitate mit locker gelagerten Feinsedimenten befinden sich nach Angaben von BIOCONSULT (2016b) im gesamten Untersuchungsbereich zwischen dem Wehr Schneller Graben und der Leine bei Luthe. Diese weisen jedoch aufgrund der Unterschiede in der Gewässerstruktur, dem Uferverbau und dem Strömungsgeschehen eine unterschiedliche Qualität auf. In allen sieben untersuchten Abschnitten (vgl. S-1 bis S-7 in Abb. 2 auf Seite 23) wurden in den beprobten potenziellen Habitaten Lampetra-Querder nachgewiesen, jedoch nur an sechs der insgesamt 15 Probenahmestellen wurden neben Bachneunaugen auch Flussneunaugen-Querder festgestellt. Darunter war eine Probenahmestelle ober- und eine unterhalb der Wasserentnahme in Herrenhausen (vgl. A 2 - Abb. 2). Die Dichte der Flussneunaugen-Querder war gering (max. 2 Individuen pro Probenahmestelle). Wie bei den Bachneunaugen bereits erläutert, sind verschiedene Laichplätze der Lampetra-Arten in Leine und Ihme bekannt (vgl. A 2 - Abb. 3). Zwar liegen zahlreiche dieser Laichplätze in einem Nebengewässer von Schnellem Graben und Ihme, aber BIOCONSULT (2016b) hat in der Ihme nur Querder des Bachneunauges und keine des Flussneunauges nachgewiesen. Meerneunauge (Petromyzon marinus) Schutz- und Gefährdungsstatus Das Meerneunauge 21 22 23 ist eine nach der BArtSchV besonders geschützte Art22, steht nach der Roten Liste Deutschland (FREYHOF 2009) auf der Vorwarnliste (Kat. V), ist in Niedersachsen nach Angabe von THEUNERT (2008a) und LAVES (2008, 2011c) stark gefährdet (Kat. 2), hat in Deutschland nach dem aktuellen Nationalen Bericht 2013 gemäß FFH-Richtlinie in der atlantischen Region einen ungünstig-unzureichenden und in der kontinentalen Region einen ungünstig-schlechten Erhaltungszustand.23 Niedersächsisches Landesamt für Verbraucherschutz und Lebensmittelsicherheit (LAVES), Dezernat Binnenfischerei (06.09.2015): Zusammenfassung der Ergebnisse zum Neunaugenaufstieg in Niedersachsen, übermittelt per E-Mail vom 12.06.2015 vgl. http://www.wisia.de/FsetWisia1.de.html, besucht am 25.06.2015 vgl. Ergebnisübersicht – Nationale Bericht 2013 (https://www.bfn.de/0316_nat-bericht_ergebnisse2013.html), Einzelbewertungen Arten atlantische bzw. kontinentale biogeografische Region https://www.bfn.de/fileadmin/MDB/documents/themen/ natura2000/Nat_Bericht_2013/arten_atl.pdf bzw. https://www.bfn.de/fileadmin/MDB/documents/themen/natura2000/Nat_ Bericht_2013/arten_kon.pdf, zuletzt abgerufen am 25.06.2015 22.03.2016 ARSU GmbH, Oldenburg Wasserrechtliches Erlaubnisverfahren für die Kraftwerke Herrenhausen und Linden Anhang 2 – Seite 13 Verbreitung Meerneunaugen nutzen je nach Lebensphase sowohl marine Küstengewässer als auch Fließgewässer. Im Binnenland von Deutschland kommt die Art vor allem in den Flüssen Rhein, Elbe und Weser sowie deren Nebengewässern vor (LAVES 2011c). Früher war das Meerneunauge in Niedersachsen als durchwandernde Art in Elbe, Weser und Ems vertreten und nutzte zahlreiche ihrer Nebengewässer zum Laichen. Aus den Jahren 1994 bis 2009 liegen Nachweise von stromauf wandernden Meerneunaugen vor allem aus der Elbe und den Unterläufen der Nebenflüsse Este, Luhe, Seeve und Ilmenau vor. Auch aus dem Emsästuar und aus dem Einzugsgebiet der Weser gibt es einzelne Nachweise (LAVES 2011c). Eine aktuellere vom LAVES zur Verfügung gestellte Karte zeigt nur wenige Nachweise von Meerneunaugen in Nebengewässern von Ems, Weser und Elbe, darunter auch ein Nachweis aus der Leine deutlich nördlich von Hannover (vgl. A 2 - Abb. 5). A 2 - Abb. 5: Meerneunaugen-Nachweise im Rahmen des fischereilichen Monitorings 2001–2013 Quelle: Niedersächsisches Landesamt für Verbraucherschutz und Lebensmittelsicherheit (LAVES), Dezernat Binnenfischerei (E-Mail vom 12.06.2015), ergänzt um einen pinkfarbenen Kreis zur Markierung der Lage des Projekts im Bereich Hannover ARSU GmbH, Oldenburg 22.03.2016 Anhang 2 – Seite 14 Artenschutzrechtlicher Fachbeitrag Lebensraumansprüche und Verhaltensweisen Im Gegensatz zum stationären Bachneunauge handelt es sich beim Flussneunauge um eine anadrome Wanderart. Sie nutzt die Fließgewässer als Laich- und Larvalhabitat, wandert für eine Aufwuchsphase in die küstennahen marinen Bereiche ab und kehrt dann zur Reproduktion in die Binnengewässer zurück. Dort benötigt das Flussneunauge durchgängige, sauerstoffreiche Fließgewässer mit mäßig bis stark überströmten Kiesbänken als Laichareal und Feinsedimentbänke als Larvalhabitat. Entsprechende Abschnitte finden sich vor allem im oberen Potatmal (Barbenregion) und besonders im Rhithral (Äschen- und zum Teil auch Forellenregion) der Fließgewässer (LAVES 2011b). Der Lebenszyklus der Flussneunaugen umfasst eine mehrjährige larvale Phase und eine kürzere Aufwuchsphase, in der die Tiere parasitisch bis räuberisch leben. Dabei heften sie sich an Wirtsfische und raspeln Gewebe ab, dass sie mit ihrem Saugmaul aufnehmen. Mit Beginn der Laichwanderung stellen sie die Nahrungsaufnahme ein und bilden den Verdauungstrakt zurück. Nach dem Laichen sterben die adulten Tiere innerhalb weniger Tage (LAVES 2011b). Das Flussneunauge zieht zum Laichen weit in die Flusssysteme hinein. Erste Tiere wandern ab dem Spätsommer aus den Küstengewässern kommend in die Brackwasserbereiche der Ästuare von Elbe, Weser und Ems, die eigentliche Laichwanderung in den Binnengewässern erfolgt aber erst vom Herbst (Oktober) bis zum Frühjahr (April) des nächsten Jahres, wird jedoch bei niedrigen Temperaturen unterbrochen. Dabei steigen im Herbst in der Regel mehr Neunaugen auf als im Frühjahr. Die im Herbst aufsteigenden Tiere überwintern im Süßwasser stromabwärts der späteren Laichplätze ohne Nahrung aufzunehmen und sind meist größer als die im Frühjahr wandernden (GERSTMEIER & ROMIG 2003; KOTTELAT & FREYHOF 2007; LAVES 2011b; KRAPPE et al. 2012). Die Laichzeit des Flussneunauges ist im Frühjahr zwischen März und Mai, wenn eine kritische Wassertemperatur von ca. 9–10 °C erreicht wird, aber auch bei 6 °C wurden schon Laichaktivitäten beobachtet. Entgegen der sonst das Tageslicht meidenden Verhaltensweise, laichen die Tiere an sonnenexponierten Stellen. Meist sind die Laichhabitate des Flussneunauges durch kiesiges Substrat, eine rasche Strömung (ca. 0,20–0,95 m/s) und eine Wassertiefe von mindestens 20 cm gekennzeichnet. Sie liegen oft am Anfang und Ende von Gleithängen. In ausgebauten Gewässern werden außerdem technische Steinschüttungen genutzt (GERSTMEIER & ROMIG 2003; PETERSEN et al. 2004; KOTTELAT & FREYHOF 2007; LAVES 2011b; KRAPPE et al. 2012). Wie die Bachneunaugen legen auch die Flussneunaugen Laichgruben an und laichen gruppenweise. Zum Teil nutzen beide Arten zeitgleich dieselben Laichgruben (KRAPPE et al. 2012). Ihre Eier lagern sich im Kieslückensystem der Laichgrube ab (LAVES 2011b). Die Zahl der Eier pro Weibchen variiert mit der Größe der Tiere zwischen 5.000 und 42.500 Stück, durchschnittlich kann von etwa 25.000–30.000 Eiern/Weibchen ausgegangen werden. Die Larven schlüpfen nach ca. 14 Tagen und verbleiben noch etwa 4–5 Tage im Bereich der Laichgrube bevor sie in die Querderhabitate abwandern (KRAPPE et al. 2012). Auch die Larven der Flussneunaugen leben vorwiegend im Gewässergrund eingegraben und ernähren sich vor allem von organischen Partikeln, Algen, Diatomeen und anderen Kleinstorganismen. Sie bevorzugen Feinsedimentbänke mit Detritusauflage (GERSTMEIER & ROMIG 2003; PETERSEN et al. 2004; KOTTELAT & FREYHOF 2007; LAVES 2011b; KRAPPE et al. 2012). Zwar verlassen sie das Sediment nur ungern, zeigen aber im Frühjahr eine Tendenz zur Ausbreitung. Meist gelangen sie in dieser Phase in stromabwärts gelegene Bereiche, stromaufwärts gerichtete 22.03.2016 ARSU GmbH, Oldenburg Wasserrechtliches Erlaubnisverfahren für die Kraftwerke Herrenhausen und Linden Anhang 2 – Seite 15 Bewegungen sind vergleichsweise selten. Obwohl die Querder gelegentlich von Fischen gefressen werden, wird ihre Mortalitätsrate während dieser Lebensphase als relativ gering eingestuft (KRAPPE et al. 2012). Die Larvalphase dauert vermutlich etwa 3–5 Jahre. Die Metamorphose erfolgt im Spätsommer und Herbst, wenn die Querder etwa eine Länge von 10–15 cm erreicht haben. Die juvenilen Flussneunaugen überwintern dann noch im Süßwasser, bevor sie im Frühling mit den Hochwässern zwischen März und Mai in die Ästuare und marinen Aufwuchsgebiete wandern (GERSTMEIER & ROMIG 2003; PETERSEN et al. 2004; KOTTELAT & FREYHOF 2007; LAVES 2011b; KRAPPE et al. 2012). Die marine Aufwuchsphase dauert 1–3 Jahre. Vermutlich halten sich die Tiere vorwiegend in den äußeren Ästuaren und Küstengewässern auf, wo sie insbesondere an Stinten, Herings- und Dorschfischen parasitieren. Die ausgewachsenen Flussneunaugen kehren nicht unbedingt in ihre Geburtsgewässer zurück, sondern folgen chemotaktisch den von Querdern abgesonderten Pheromonen (KOTTELAT & FREYHOF 2007; LAVES 2011b; KRAPPE et al. 2012). Vorkommen im Einflussbereich der beantragten Benutzung Bei den 2013 durchgeführten Untersuchungen zur ökologischen Situation von Leine und Ihme im Abschnitt vom Wehr Schneller Graben bis Luthe hat BIOCONSULT (2016b) weder Meerneunaugen noch deren Querder nachgewiesen. Meerneunaugen gehören nach Angaben der FGG WESER (o. J.) zur Fischfauna der Leine, sind dort aber selten. Im Rahmen des fischereilichen Monitorings wurde das Meerneunauge zwischen 2001 und 2013 in der Leine nachgewiesen, jedoch nur deutlich nördlich von Hannover. Querder wurden im Bereich der Leine nicht festgestellt (vgl. A 2 - Abb. 5). Nach den vom LAVES darüber hinaus zur Verfügung gestellten Daten24 wurden in der Leine am Wehr Herrenhausen zwischen 2000 und 2015 keine Meerneunaugen beobachtet. Das gelegentliche Vorkommen von besonders geschützten Meerneunaugen im Einflussbereich der beantragten Gewässerbenutzung kann nach den vorliegenden Erkenntnissen jedoch nicht ausgeschlossen werden. 24 Niedersächsisches Landesamt für Verbraucherschutz und Lebensmittelsicherheit (LAVES), Dezernat Binnenfischerei (06.09.2015): Zusammenfassung der Ergebnisse zum Neunaugenaufstieg in Niedersachsen, übermittelt per E-Mail vom 12.06.2015 ARSU GmbH, Oldenburg 22.03.2016 Wasserrechtliches Erlaubnisverfahren für die Kraftwerke Herrenhausen und Linden Anhang 3: Anhang 3 – Seite 1 Beschreibung der relevanten Libellen Als relevant wurden insgesamt dreizehn Libellen-Arten ermittelt: Gebänderte Prachtlibelle (Calopteryx splendens) Blauflügel-Prachtlibelle (Calopteryx virgo), Gewöhnliche Federlibelle (Platycnemis pennipes), Gewöhnliche Keiljungfer (Gomphus vulgatissimus) Grüne Flussjungfer (Ophiogomphus cecilia), Hufeisen-Azurjungfer (Coenagrion puella), Gewöhnliche Pechlibelle (Ischnura elegans), Frühe Adonislibelle (Pyrrhosoma nymphula), Gemeine Weidenjungfer (Lestes viridis), Gewöhnliche Winterlibelle (Sympecma fusca), Braune Mosaikjungfer (Aeshna grandis), Früher Schilfjäger (Brachytron pratense), Spitzfleck (Libellula fulva). Gebänderte Prachtlibelle (Calopteryx splendens) Schutz- und Gefährdungsstatus Die Gebänderte Prachtlibelle (Calopteryx splendens) ist eine nach der BArtSchV besonders geschützte Kleinlibellen-Art25, steht nach der Roten Liste Deutschland (OTT & PIPER 1998) auf der Vorwarnliste (Kat. V), ist in Niedersachsen nicht gefährdet (ALTMÜLLER & CLAUSNITZER 2010). Verbreitung Die Gebänderte Prachtlibelle ist in Deutschland weit verbreitet, ist jedoch nach Norden spärlicher vertreten als im Süden. Dabei sind die Populationsdichten heute geringer als früher. Als Verbreitungsschwerpunkte werden genannt: der gesamte Oberrheingraben von Basel bis Mainz mit dem Hardt-Gebirge, der Eifelsüdrand und das Moseltal, Mittelfranken und in Niedersachsen das AllerWeser-Tiefland (SCHORR 1990; STERNBERG & BUCHWALD 1999a). Nach dem Artensteckbrief der 'Arbeitsgemeinschaft Libellen Niedersachsen und Bremen' zeigt die Art in Niedersachsen in allen Naturräumen eine dichte Besiedlung, jedoch in der Marsch und in den küstennahen Geestbereich deutliche Lücken.26 25 26 vgl. http://www.wisia.de/FsetWisia1.de.html, besucht am 25.06.2015 Artensteckbrief unter http://www.ag-libellen-nds-hb.de/libellen/artensteckbriefe/calopteryx-splendens-gebaenderteprachtlibelle/, besucht am 06.07.2015 ARSU GmbH, Oldenburg 22.03.2016 Anhang 3 – Seite 2 Artenschutzrechtlicher Fachbeitrag Lebensraumansprüche und Verhaltensweisen Calopteryx splendens besiedelt den Mittel- und Unterlauf von Fließgewässern vom Metarhithral bis zum Metapotamal und ist Leitform des Epi- und Metapotamals (Barben- bzw. Brachsenregion) träge strömender Flüsse der Ebene (STERNBERG & BUCHWALD 1999a). Die Imagines schlüpfen von Ende April/Anfang Mai bis in die zweite Julihälfte hinein, vor allem aber zwischen Ende Mai und Mitte/Ende Juni, die Hauptflugzeit ist von Mitte Juni bis Mitte August (STERNBERG & BUCHWALD 1999a)27. Geschlechtsreife Tiere findet man von Mitte Mai bis Ende September (SCHORR 1990). Die Eiablage erfolgt in der Regel in Fließgewässerabschnitten mit strömendem Wasser aber gelegentlich werden auch Abschnitte ohne erkennbare Strömung genutzt. Die Weibchen legen die Eier endophytisch meist unmittelbar unterhalb der Wasserlinie ab, können aber auch vollständig unter Wasser tauchen und die Eier bis in eine Tiefe von über 30 cm in die Pflanzen einstechen. Genutzt werden recht unspezifisch von Wasser umströmte Sprossteile und Wurzeln von verschiedenen Wasserpflanzen, teilweise auch von Röhrichten und überhängenden Uferstauden (STERNBERG & BUCHWALD 1999a). Die Embryonalentwicklung dauert ca. 6–9 Wochen, die Gesamtdauer der Larvalentwicklung variiert in Abhängigkeit von den Temperaturverhältnissen zwischen einem und zwei Jahren. Die mittlere Sommertemperatur des Larvalgewässers muss mindestens 16 °C betragen, optimal sind Werte von 18–24 °C und auch bei Werten von 28 C können sich die Larven noch entwickeln (SCHORR 1990; STERNBERG & BUCHWALD 1999a). In thermisch belasteten Fließgewässern wirkt sich vor allem die Verkürzung der winterlichen Entwicklungsruhe, insbesondere bei den spät im Jahr aus dem Ei schlüpfenden Larven, beschleunigend auf die Entwicklung aus (STERNBERG & BUCHWALD 1999a). Die Larven meiden normalerweise den Gewässerboden und bevorzugen mehr oder weniger gleichgerichtete, gleichmäßige Strömungen von 3 cm/s bis 30 cm/s, werden aber auch bei Strömungsgeschwindigkeiten von bis zu 70 oder 80 cm/s angetroffen. Sie sitzen vorwiegend auf stabilem, in die Strömung ragendem Substrat, das ein gutes Anklammern gestattet und in der Strömung festen Halt bietet. Häufig leben sie an frei flutenden Wurzeln von Bäumen, Sträucher und Gräsern, sowie an Wurzel- und Sprossteilen verschiedener Wasserpflanzen. Sie nutzen aber auch Spalten an durch Erosion unterhöhlten Abbruchkanten und Steilufern, ruhigere Buchten und angeschwemmtes Falllaub sowie Vegetationsbestände in der Hauptströmung des Gewässers (SCHORR 1990; STERNBERG & BUCHWALD 1999a). Die Larven legen nur unbedeutende Wanderstrecken zurück. Bei Verdriftung gelangen sie normalerweise durch spezifische Verhaltensweisen bereits nach wenigen Metern auf den Gewässerboden und von dort wieder auf geeignetes Pflanzensubstrat. Sie bleiben daher in der Regel in unmittelbarer Nähe der Eiablagestellen und Schlüpfen dort auch. Dazu klettern sie an vertikalen Strukturelementen (meist der Emersvegetation) des Ufers in der Regel bis in ca. 5–40 cm Höhe über dem Wasser (STERNBERG & BUCHWALD 1999a). An die Gewässergüte werden von den Larven keine allzu großen Anforderungen gestellt, jedoch fehlt die Art in Gewässern, deren absoluter Sauerstoffgehalt ständig 6–7 mg/l unterschreitet (SCHORR 1990; STERNBERG & BUCHWALD 1999a). Bei Sauerstoffmangel versuchen sie die Sauerstoffaufnahme durch Vergrößerung der atmungsaktiven Körperoberfläche und Bewegungen von 27 vgl. auch Artensteckbrief ebenda 22.03.2016 ARSU GmbH, Oldenburg Wasserrechtliches Erlaubnisverfahren für die Kraftwerke Herrenhausen und Linden Anhang 3 – Seite 3 Thorax und Abdomen zu vergrößern oder klettern unter Umständen auch für kurze Zeit aus dem Wasser. Anhaltender akuter Sauerstoffmangel führt bei jungen Larven zu Häutungsproblemen, oder sie fallen in eine Starre und Sterben. Larven im letzten Stadium häuten sich vorzeitig, allerdings mit hohen Verlusten durch Häutungsprobleme während der Metamorphose (STERNBERG & BUCHWALD 1999a). Vorkommen im Einflussbereich der beantragten Benutzung Die Larven der Gebänderter Prachtlibelle (Calopteryx splendens) wurden 2013 von BIOCONSULT (2016b) bei den Untersuchungen des Makrozoobenthos von Leine und Ihme sowohl unterhalb des Wehres Herrenhausen, oberhalb der Wasserentnahme am KWH Herrenhausen (Abschnitt S6, vgl. Abb. 2 auf Seite 23) als auch in den Abschnitten unterhalb der Kläranlage Herrenhausen (Abschnitte S-1 bis S-4) nachgewiesen. An der Probenahmestelle oberhalb der Wasserentnahme in Herrenhausen war die mittlere Abundanz der Larven dieser Art mit 0,4 Ind./m² deutlich geringer als an den weiter flussabwärts gelegenen Probenahmestellen mit Abundanzen zwischen 0,8 Ind/² und 6,9 Ind./m². Im Bereich der Ihme sowie an den Probenahmestellen unterhalb der Wasserentnahme in Herrenhausen hat BIOCONSULT (2016b) 2013 keine Larven von Calopteryx splendens nachgewiesen. Bei ergänzenden Untersuchungen im Frühjahr 2014 hat BIOCONSULT (2014) Larven der Gebänderten Prachtlibelle in allen sieben Abschnitten und an nahezu allen Probenahmepunkten festgestellt. Die Individuendichte lag dabei in der Leine zwischen 1,0 und 2,5 Individuen/m² und in der Ihme bei 10 Individuen/m². Blauflügel-Prachtlibelle (Calopteryx virgo) Schutz- und Gefährdungsstatus Die Blauflügel-Prachtlibelle (Calopteryx virgo) ist eine nach der BArtSchV besonders geschützte Kleinlibellen-Art28, ist nach der Roten Liste Deutschland (OTT & PIPER 1998) gefährdet (Kat. 3), ist auch in Niedersachsen gefährdet (Kat. 3), und steht in der Region östliches Tiefland auf der Vorwarnliste (Kat. V) der Roten Liste (ALTMÜLLER & CLAUSNITZER 2010). Verbreitung Die Blauflügel-Prachtlibelle ist nahezu in ganz Deutschland verbreitet, ist aber im Norden seltener oder fehlt ganz. Vorkommensschwerpunkt sind die Mittelgebirgsbäche, insbesondere die naturräumlichen Haupteinheiten Bergisch-Sauerländisches Gebirge, Schwäbisches Keuper-Lias-Land und Mittleres Oberrheintiefland (SCHORR 1990). In Niedersachsen gibt es nach Angaben der AG Libellen in Niedersachsen und Bremen29 ein deutliches Häufigkeitsgefälle von Ost nach West, mit einem eindeutigen Dichtezentrum östlich der 28 29 vgl. http://www.wisia.de/FsetWisia1.de.html, besucht am 06.07.2015 http://www.ag-libellen-nds-hb.de/libellen/artensteckbriefe/calopteryx-virgo-blaufluegel-prachtlibelle/, besucht am 07.07.2015 ARSU GmbH, Oldenburg 22.03.2016 Anhang 3 – Seite 4 Artenschutzrechtlicher Fachbeitrag Aller-Weser-Linie. Die Börden und das nordwestliche Weser- und Leineberg scheinen dünn oder gar nicht besiedelt zu sein und in Westniedersachsen sind nur wenige nennenswerte Vorkommen im Raum Osnabrück bekannt. Nachweise aus den Marschen und küstennahen Gebieten liegen nicht vor. Lebensraumansprüche und Verhaltensweisen Calopteryx virgo besiedelt Bäche, Gräben, Kanäle und Flüsse. Sie gilt als Leitart kleinerer, oligostenothermer Flüsse planarer und montaner Gebiete und ist vor allem im Meta- bis Hyporhithral der schnell fließenden Bäche anzutreffen, kann aber auch das Epipotamal (Barbenregion) besiedeln. C. virgo kommt in den gleichen Gewässern vor wie C. splendens, jedoch mehr in den oberen kühleren und beschatteteren Bereichen und ist in den sommerwärmeren Gewässern seltener. Aber die beiden Calopteryx-Arten kommen auch neben einander vor (SCHORR 1990; STERNBERG & BUCHWALD 1999a; ALTMÜLLER & CLAUSNITZER 2010). Die Schlüpfhabitat von C. virgo entsprechen denen von C. splendens. Die Imagines schlüpfen in der Regel von Anfang Mai bis Mitte Juli. Die Hauptflugzeit liegt zwischen Ende Mai und Anfang August (STERNBERG & BUCHWALD 1999a). Die höchste Aktivität ist im Juni und Juli zu beobachten.30 Die Eiablagehabitate und –substrate entsprechen ebenfalls denen von C. splendens. Fortpflanzungshabitate von C. virgo sind im Allgemeinen kühle, saubere, mit Uferröhricht und lockerer Submersvegetation bewachsene, mehr oder weniger beschattete Gewässer mit besonnten Abschnitten, mehr oder weniger schnell fließendem Wasser und naturnaher Uferstruktur (STERNBERG & BUCHWALD 1999a). Die Strömungsgeschwindigkeit muss mindestens 2 cm/s betragen und überschreitet in der Regel 60–70 cm/s nicht (SCHORR 1990). Die Larven von C. virgo meiden ebenso wie die von C. splendens normalerweise den Gewässerboden (STERNBERG & BUCHWALD 1999a). Die Embryonal- und Larvalentwicklung gleicht ebenfalls im Wesentlichen der von C. splendens. Bei gemeinsamem Vorkommen beider Arten in einem Gewässer dauert die Embryonalentwicklung wahrscheinlich ebenfalls ca. 6–9 Wochen. Die Blauflügel-Prachtlibelle besiedelt jedoch in der Regel kühlere Gewässer, daher gehen STERNBERG & BUCHWALD (1999a) davon aus, dass die Larvalentwicklung im Mittel insgesamt etwas länger dauert als bei der Gebänderten Prachtlibelle. Die Optimaltemperatur der Larvalgewässer von C. virgo liegt bei 13–18 °C, also um ca. 5-6 °C unter der von C. splendens. Bei einem längerfristigen Anstieg der Wassertemperatur auf Werte > 22 °C wird ein Schädigung der Larven (vor allem Schlüpfdefekte) und eine erhöhte Mortalität festgestellt. Verantwortlich dafür ist wahrscheinlich nicht die Temperatur selbst, sondern ein durch die Erwärmung sinkender Sauerstoffgehalt des Wassers. So wurden auch schon Populationen nachgewiesen in deren Brutgewässern regelmäßig sommerliche Maximaltemperaturen von 22–25 °C herrschen (STERNBERG & BUCHWALD 1999a). Die Larven von C. virgo können Sauerstoff weniger gut aus dem Wasser aufnehmen und sind daher gegenüber Sauerstoffmangel sensibler als C. splendens. Bereits nach ca. vier Tagen kommt es zu nachhaltigen Schädigungen und höheren Mortalitätsraten (STERNBERG & BUCHWALD 1999a). Die höhere Sensibilität gegenüber Sauerstoffmangel ist wahrscheinlich ein wesentlicher 30 Artensteckbrief der AG Libellen in Niedersachsen und Bremen, http://www.ag-libellen-nds-hb.de/libellen/artensteckbriefe/ calopteryx-virgo-blaufluegel-prachtlibelle/, besucht am 07.07.2015 22.03.2016 ARSU GmbH, Oldenburg Wasserrechtliches Erlaubnisverfahren für die Kraftwerke Herrenhausen und Linden Anhang 3 – Seite 5 Grund für die Bevorzugung von eher sommerkühlen Gewässern mit eher geringer bis mäßiger Belastung. Insgesamt haben die Larven von C. virgo trotz der sehr ähnlichen Habitatansprüche und Lebensweise eine kleinere ökologische Amplitude und stellen höhere ökologischen Ansprüche an ihren Lebensraum als C. splendens (STERNBERG & BUCHWALD 1999a). Vorkommen im Einflussbereich der beantragten Benutzung Aktuelle Nachweise der Larven der Blauflügel-Prachtlibelle (Calopteryx virgo) liegen nicht vor, ihr Vorkommen ist jedoch möglich. BIOCONSULT (2016b) gibt für das Makrozoobenthos von Leine und Ihme neben Calopteryx splendens auch das Vorkommen von Larven einer weiteren Calopteryx-Art an. Die Nachweise von Calopteryx sp. erfolgten für Probenahmestellen in der Ihme (Abschnitt S-7), in der Leine unterhalb des Wehres Herrenhausen (S-6) sowie nahe der Autobahn 2 und unterhalb davon (S-2, S-1, vgl. Abb. 2 auf Seite 23) nachgewiesen. Die Abundanz lag zwischen 12,6 Ind./m² in der Ihme und 0,4 Ind./m² unterhalb des Wehres Herrenhausen. Sofern es sich dabei nicht auch um C. splendens handelt, kommt nur C. virgo in Frage. Gewöhnliche Federlibelle (Platycnemis pennipes) Schutz- und Gefährdungsstatus Die Gewöhnliche Federlibelle (Platycnemis pennipes) ist eine nach der BArtSchV besonders geschützte Kleinlibellen-Art31, ist nach der Roten Liste Deutschland (OTT & PIPER 1998) ungefährdet, und ist auch in Niedersachsen nicht gefährdet (ALTMÜLLER & CLAUSNITZER 2010). Verbreitung Die Gewöhnliche Federlibelle hat in Deutschland ihre Verbreitungsschwerpunkte im Südwesten im Bereich des gesamten Oberrheintieflandes und westlich davon bis ins Saar-Nahe-Bergland und im Süden des Alpenvorlandes. Sie erreicht etwa in Schleswig-Holstein ihre nördliche Verbreitungsgrenze. Die Art ist vor allem im thermisch begünstigtem Flachland zu finden, kommt aber auch bis in Höhen von 400 m oder sogar 700 m über Normalnull vor (SCHORR 1990; STERNBERG & BUCHWALD 1999a). In Niedersachsen ist sie nur spärlich vorhanden und fehlt im Nordwesten weitgehend. Etwa 50 % aller Fundorte liegen in Flussniederungen. Lebensraumansprüche und Verhaltensweisen Platycnemis pennipes ist eine Charakterart der Auen größerer Flusssysteme und besiedelt ein breites Spektrum fließender bis stehender, mehr oder weniger nährstoffreicher Gewässer. An 31 vgl. http://www.wisia.de/FsetWisia1.de.htmlin , besucht am 06.07.2015 ARSU GmbH, Oldenburg 22.03.2016 Anhang 3 – Seite 6 Artenschutzrechtlicher Fachbeitrag Flüssen, Bächen, Kanälen und Gräben nutzt sie überwiegend die Bereiche mit langsamer Strömung. Außerdem nutzt sie auch größere Stillgewässer, wie Altwässer, Seen und Kiesgruben, meidet aber auch kleinere, tiefere Gewässer nicht. Auffällig oft kommt sie an fischreichen Gewässern wie Fischzucht- und Angelteichen vor. Ihr Optimum hat sie in wenig belasteten Gewässern (SCHORR 1990; STERNBERG & BUCHWALD 1999a). Die Imagines schlüpfen in der Regel von Anfang Mai bis Anfang August. Die Flugzeit der Adulten reicht von Mitte Mai bis Ende September, seltener bis Mitte Oktober und hat im Juni und Juli ihr Maximum. Sie treten häufig mit der Gebänderten Prachtlibelle ( Calopteryx splendens), der Großen Pechlibelle (Ischnura elegans) und der Frühen Adonislibelle (Pyrrhosoma nymphula) vergesellschaftet auf (STERNBERG & BUCHWALD 1999a). Für die endophytische Eiablage nutzt die Federlibelle die Stiele und Stängel von Schwimm- und Röhrichtpflanzen, aber auch Wurzeln und Holz werden verwendet. In der Regel werden die submersen Pflanzenteile nur soweit genutzt, wie das weibliche Abdomen reicht, aber es wurden auch schon vollständig untergetauchte Weibchen beobachtet (SCHORR 1990; STERNBERG & BUCHWALD 1999a). Die Dauer der Eientwicklung ist stark von der Wassertemperatur abhängig bei 12 °C beträgt sie mehr als 60 Tage, bei etwa 28 °C nur etwa 12 Tage. Die größte Überlebensrate (55 %) wurde bei Wassertemperaturen von 19–21 °C festgestellt. Viele Larven sind bereits vor dem Winter mehr oder weniger ausgewachsen, überwintern als Larve und schlüpfen bereits im Sommer nach der Eiablage. Larven von spät im Jahr gelegten Eiern benötigen zum Teil wahrscheinlich ein weiteres Jahr bis zur Metamorphose (STERNBERG & BUCHWALD 1999a). Die Larven der Federlibelle sind im Vergleich zu anderen Arten wenig aktiv, langsam und träge. In Stillgewässern leben sie gern auf dem Bodenschlamm, häufig auch auf und zwischen Falllaub. Sie halten sich aber auch an den submersen Teilen von Emerspflanzen und seltener an flutenden Wasserpflanzen oder an Wurzeln unterspülter Uferbäume auf. In Fließgewässern findet man die Larven vorwiegend in den strömungsberuhigten Uferzonen, aber sie halten sich auch im Bereich der stärkeren Strömung im submersen Pflanzengewirr oder im Wurzelwerk von Ufersträuchern verborgen. Die Habitatwahl der Larven hängt offenbar von verschiedenen Faktoren ab, insbesondere auch vom Feinddruck (STERNBERG & BUCHWALD 1999a). Der Gewässergrund der Larvenhabitate ist meist sandig bis schlammig und häufig mit Falllaub stark durchsetzt oder vollständig davon bedeckt. Die Larven scheinen langsam und gleichmäßig fließendes Wasser turbulenter Strömung vorzuziehen, können aber auch starker Strömung widerstehen. Sie bevorzugen offenbar struktur- und pflanzenreiche Habitate, können sich aber auch in sehr vegetationsarmen Gewässern entwickeln. Zum Schlüpfen nutzen sie meist mehr oder weniger senkrechte Substrate, an denen sie sich in der Regel nur weniger Zentimeter über dem Wasser aufhalten. Gelegentlich werden auch fast waagerechte Substrate wie Seerosenblätter, Erdklumpen oder Blätter von Uferstauden genutzt (STERNBERG & BUCHWALD 1999a). Platycnemis pennipes gilt als Indikator für oligo- bis β-mesosaprobe Gewässer (Güteklasse I–II), wird aber auch noch in stark belasteten Gewässern (Güteklasse III) gefunden. Hohe LarvenAbundanzen werden nur in Gewässern gefunden, deren absoluter Sauerstoffgehalt höchstens für kurze Zeit auf Werte < 5,5 mg/l sinkt. Aus der Verbreitung der Art kann eine gewisse Thermophilie der Larven abgeleitet werden, dabei scheinen mäßig sommerwarme Gewässer mit eher gleichmäßigen Temperaturen bevorzugt zu werden – möglicherweise infolge ihres Sauerstoffbedarfes. In wärmegetönten Gewässern meiden sie die ausgesprochen warmen Flachwasser22.03.2016 ARSU GmbH, Oldenburg Wasserrechtliches Erlaubnisverfahren für die Kraftwerke Herrenhausen und Linden Anhang 3 – Seite 7 zonen und sind vorwiegend in Tiefen von 0,5–1 m zu finden, in kühleren Gewässer bevorzugen sie die oberflächennahen Schichten bis etwa 30 cm. Im Winter ziehen sie sich in größere Tiefen (> 1,5 m) zurück (STERNBERG & BUCHWALD 1999a). Vorkommen im Einflussbereich der beantragten Benutzung Die Larven der Gewöhnlichen Federlibelle (Platycnemis pennipes) wurden 2013 von BIOCONSULT (2016b) bei den Untersuchungen des Makrozoobenthos im Bereich Schneller Graben/Ihme (Abschnitt S-7, vgl. Abb. 2 auf Seite 23) festgestellt. Ihre mittlere Abundanz war mit 0,4 Ind./m² gering. In den sechs Untersuchungsabschnitten (S-6 bis S-1) der Leine zwischen dem Wehr Herrenhausen und Wunstorf Luthe wurde die Art nicht nachgewiesen, ihr Vorkommen ist aber potenziell möglich. Gewöhnliche Keiljungfer (Gomphus vulgatissimus) Schutz- und Gefährdungsstatus Die Gewöhnliche Keiljungfer (Gomphus vulgatissimus) ist eine nach der BArtSchV besonders geschützte Großlibellen-Art32, ist nach der Roten Liste Deutschland (OTT & PIPER 1998) stark gefährdet (Kat. 2), steht in Niedersachsen auf der Vorwarnliste (Kat. V) der Roten Liste (ALTMÜLLER & CLAUSNITZER 2010), ist aber in der Region östliches Tiefland nicht gefährdet. Verbreitung Stabile Vorkommen der Gewöhnlichen Keiljungfer (Gomphus vulgatissimus) waren in Deutschland bis vor Kurzem nur wenige bekannt, beispielsweise in der Lüneburger Heide und in der Mittleren und Südlichen Oberrheinebene (STERNBERG & BUCHWALD 1999b). SCHORR (1990) gibt nur wenige naturräumliche Haupteinheiten mit einem spärlichen Vorkommen an, das Schleswig-Holsteinische Hügelland, die Stader Geest und das nördliche Harzvorland. Darüber hinaus verweist er auf Einzelfunde in weiteren Haupteinheiten. In Niedersachsen liegt der Verbreitungsschwerpunkt im Einzugsgebiet der Aller und ihrer Nebenflüsse. Außerdem sind Teile der Einzugsgebiete von Ems und Hunte sowie Teile der Weser und das Wendland recht gut besiedelt.33 Lebensraumansprüche und Verhaltensweisen Gomphus vulgatissimus besiedelt ein breites Spektrum von Fließgewässern, das von Buchten und Buhnenfeldern großer Ströme, über Altwässer, kleinere Flüsse, Bäche und Gräben bis zu Stillgewässern reicht. An träge fließenden Flachlandflüssen kann die Gewöhnliche Keiljungfer zusam- 32 33 vgl. http://www.wisia.de/FsetWisia1.de.html, besucht am 06.07.2015 Artensteckbrief der AG Libellen in Niedersachsen und Bremen (http://www.ag-libellen-nds-hb.de/libellen/artensteckbriefe/ gomphus-vulgatissimus-gemeine-keiljungfer/), besucht am 08.07.2015 ARSU GmbH, Oldenburg 22.03.2016 Anhang 3 – Seite 8 Artenschutzrechtlicher Fachbeitrag men mit der Gebänderten Prachtlibelle (Calopteryx splendens) und der Gemeinen Federlibelle (Platycnemis pennipes) die häufigste Art sein (SCHORR 1990; STERNBERG & BUCHWALD 1999b). Die Imagines schlüpfen nach STERNBERG & BUCHWALD (1999b) in der Regel ab Anfang bis Mitte Mai und die Flugzeit endet meist Mitte Juli. In Norddeutschland hat sich der Beginn der Flugperiode in den letzten Jahrzehnten um mehr als einen halben Monat auf Mitte April vorverlagert und es werden auch immer häufiger spät fliegende Individuen noch bis Anfang Oktober beobachtet, die Hauptflugzeit ist aber Anfang Mai bis Juli.34 Die Eier werden bei den Gomphiden über dem Wasser abgeworfen oder durch Eintippen des Hinterleibsendes an der Wasseroberfläche abgestreift. Die Eiablage von Gomphus vulgatissimus wurde bisher nur selten beobachtet und erfolgte vorwiegend in stark strömenden Bereichen an die sich ruhigere Bereiche anschlossen (STERNBERG & BUCHWALD 1999b). Die Eier werden einige Meter weit verdriftet, bevor sie zum Grund sinken (SCHORR 1990; STERNBERG & BUCHWALD 1999b). Die Embryonalentwicklung dauert bei 20 °C etwa 14–18 Tage, die Gesamtentwicklung erfordert in der Regel zwei, sonst drei und selten vier Jahre (STERNBERG & BUCHWALD 1999b). Die Larven der Gemeinen Keiljungfer leben ca. 7 mm tief im Sediment vergraben, nur ihre Analpyramide ragt aus dem Grund hervor. So sind sie vor Verdriftung geschützt. Sie sind überwiegend nachts aktiv, schaufeln sich auf der Suche nach Beute durch das Sediment. Nur nachts kommen sie gelegentlich an die Sedimentoberfläche (STERNBERG & BUCHWALD 1999b). In Fließgewässern nutzen sie oft nur die Feinsedimente der Gleithänge und anderer strömungsberuhigter Bereiche, können aber bei sehr schwacher Strömung auch die gesamte Gewässersohle besiedeln, sofern sie nicht zu kiesig ist oder zu stark umgelagert wird. Häufig zeichnet sich der von den Larven besiedelte Gewässergrund durch eine hohe Strukturvielfalt und sandig-schlammige Mischsubstrate mit wechselnden Mischungsverhältnissen und Korngrößenverteilungen aus, das meist mit Grobdetritus durchsetzt ist. Möglicherweise werden je nach Alter der Larven unterschiedliche Mikrohabitate genutzt. In manchen größeren Gewässern führen die Larven offenbar saisonale Wanderungen durch, vor Winterbeginn suchen sie tiefere Regionen auf und kehren im Frühjahr langsam wieder zum Ufer zurück (STERNBERG & BUCHWALD 1999b). Überwiegend halten sich die Larven in der Grenzzone zwischen schnellfließendem und nahezu stehendem Wasser auf oder bevorzugen Gewässerbereiche mit mäßiger Strömung und leben in makrophytenfreien oder -armen Gewässerbereichen. Bei Fehlen geeigneter Freiflächen mit Sand und Schlamm besiedeln sie auch lichtere Röhrichtbestände und strömungsberuhigtere Bereiche in der Nähe von freigespülten Wurzeln der Ufergehölze oder dichter Pflanzenbestände in der Strömung. Nur bei extremem Niedrigwasser werden sie überwiegend unter Pflanzenbeständen gefunden. Stärkere Strömung gefährdet die Larven vor allem, wenn sie zum Schlüpfen das Sediment verlassen. Gelegentlich findet man verdriftete Larven gehäuft vor Strömungsbarrieren (STERNBERG & BUCHWALD 1999b). Die Larven-Gewässer sollten sommerliche Temperaturen von 16–17 °C erreichen. Im Jahresverlauf können die Temperaturen zwischen 4,5 und 27 °C schwanken. Die besten Vorkommen finden sich in Fließgewässern der Güteklasse II (mäßig belastet), aber auch stark belastete Gewässer (Güteklasse III) werden noch genutzt. Die Larven sind gegenüber starken Schwankungen des Sauerstoffgehalts im Wasser wenig empfindlich. Dabei werden in Fließgewässern offenbar geringere Sauerstoffkonzentrationen toleriert als in Seen (STERNBERG & BUCHWALD 1999b). Nach 34 Artensteckbrief der AG Libellen in Niedersachsen und Bremen 22.03.2016 ARSU GmbH, Oldenburg Wasserrechtliches Erlaubnisverfahren für die Kraftwerke Herrenhausen und Linden Anhang 3 – Seite 9 SCHORR (1990) schwankten die Werte an Larvenfundorten in Rumänien zwischen 5,5 mg/l und 14,5 mg/l. Die Libellen schlüpfen am Prall- und Gleithang auf vertikalen und horizontalen Substraten jeglicher Art, meist auf Uferpflanzen, aber auch auf Steinen, Baumstämmen, Mauerwerk und gelegentlich auch auf Sand- und Schlickflächen (STERNBERG & BUCHWALD 1999b). Vorkommen im Einflussbereich der beantragten Benutzung Die Larven der Gewöhnlichen Keiljungfer (Gomphus vulgatissimus) wurden 2013 von BIOCONSULT (2016b) bei den Untersuchungen des Makrozoobenthos von Leine und Ihme in mehreren Abschnitten nachgewiesen in der Ihme (S-7), in der Leine unterhalb des Wehres Herrenhausen (S-6), sowie in den Bereichen Seelze (Abschnitt S-3) und Wunstorf-Luthe (S-1, vgl. Abb. 2 auf Seite 23). Die mittlere Abundanz der Larven dieser Art war mit Werten zwischen 0,4 Ind./m² und 1,5 Ind./m² gering. Auch bei ergänzenden Untersuchungen im Frühjahr 2014 hat BIOCONSULT (2014) Larven der Gewöhnlichen Keiljungfer festgestellt, wiederum in der Leine unterhalb des Wehres Herrenhausen (S-6) sowie bei Wunstorf-Luthe (S-1). Die Individuendichte lag zwischen 1,3 und 2,0 Individuen/m². Grüne Flussjungfer (Ophiogomphus cecilia) Schutz- und Gefährdungsstatus Die Grüne Flussjungfer (Ophiogomphus cecilia) ist eine nach Anhang IV der FFH-Richtlinie streng geschützte Großlibellen-Art35, ist nach der Roten Liste Deutschland (OTT & PIPER 1998) stark gefährdet (Kat. 2), ist in der Roten Liste Niedersachsen (ALTMÜLLER & CLAUSNITZER 2010) als gefährdet (Kat. 3) eingestuft, in der Region östliches Tiefland steht sie auf der Vorwarnliste (Kat. V). hat in Deutschland nach dem aktuellen Nationalen Bericht 2013 gemäß FFH-Richtlinie in der atlantischen Region einen ungünstig-unzureichenden Erhaltungszustand, in der kontinentalen Region hingegen einen günstigen.36 Verbreitung Die Grüne Flussjungfer (Ophiogomphus cecilia) ist in Deutschland vor allem in den östlichen Landesteilen verbreitet. Die Hauptvorkommen liegen im Bereich der Lüneburger Heide und des Einzugsgebiet der Aller und mittleren Weser, im Bereich von Oder, Neiße und Spree. Diese sind offenbar über einen Verbreitungsschwerpunkt entlang der mittleren Elbe verbunden. Weitere 35 36 vgl. http://www.wisia.de/FsetWisia1.de.html, besucht am 06.07.2015 vgl. Ergebnisübersicht – Nationale Bericht 2013 (https://www.bfn.de/0316_nat-bericht_ergebnisse2013.html), Einzelbewertungen Arten atlantische bzw. kontinentale biogeografische Region https://www.bfn.de/fileadmin/MDB/documents/themen/ natura2000/Nat_Bericht_2013/arten_atl.pdf bzw. https://www.bfn.de/fileadmin/MDB/documents/themen/natura2000/Nat_ Bericht_2013/arten_kon.pdf, zuletzt abgerufen am 13.07.2015 ARSU GmbH, Oldenburg 22.03.2016 Anhang 3 – Seite 10 Artenschutzrechtlicher Fachbeitrag Vorkommensschwerpunkt befinden sich im bayerische Alpenvorland, in Mittelfranken und in der Oberpfalz (SCHORR 1990; STERNBERG & BUCHWALD 1999b; PETERSEN et al. 2003; NLWKN 2011d). In Niedersachsen hat die Grüne Flussjungfer (Ophiogomphus cecilia) einen deutlichen Schwerpunkt im Bereich zwischen der Aller und der Ilmenau, einschließlich des Einzugsgebietes der Oste im Nordwesten. Zu den besiedelten Naturräumen gehören neben der Lüneburger Heide vor allem der südliche Teil der Stader Geest und das Weser-Aller-Flachland. Das FFH-Gebiet (Nr. 090) 'Aller (mit Barnbruch), untere Leine, untere Oker' hat eine besondere Bedeutung für diese Art. Aus den Bereichen westlich der Weser liegen dagegen nur wenige Nachweise vor (SCHORR 1990; STERNBERG & BUCHWALD 1999b; NLWKN 2011d). Lebensraumansprüche und Verhaltensweisen Nach STERNBERG & BUCHWALD (1999b) kommt die Grüne Flussjungfer (Ophiogomphus cecilia) typischerweise in großen bis mittelgroßen, gut strukturierten Wasserläufen (Hyporhithral bis Epipotamal, Äschen- bis Barbenregion) der Ebene und der Vorgebirge vor. Gemäß NLWKN (2011d) werden vor allem Bäche und Flüsse mit mäßiger Fließgeschwindigkeit und geringer Wassertiefe genutzt. Auch wenn die Art als Indikator für naturnahe Verhältnisse an Fließgewässern angesehen wird und gering verschmutzte Gewässer (Güteklasse II) bevorzugt, wird sie auch in technisch ausgebauten Fließgewässern angetroffen (STERNBERG & BUCHWALD 1999b; NLWKN 2011d)37. Die Grüne Keiljungfer ist oft mit der Gemeinen Flussjungfer ( Gomphus vulgatissimus) und der Gebänderten Prachtlibelle (Calopteryx splendens) vergesellschaftet (NLWKN 2011d). Zur charakteristischen rheotypischen Begleitfauna gehören auch Maler- und Flache Teichmuschel, Bachneunaugen und deren Querder (STERNBERG & BUCHWALD 1999b). Ihre Imagines schlüpfen meist in der Zeit zwischen Anfang Juni und Ende Juli. Die Flugzeit reicht entsprechend in der Regel von Juni bis Ende September, mit einem Maximum der Flugaktivität in der ersten Augusthälfte (STERNBERG & BUCHWALD 1999b; PETERSEN et al. 2003; NLWKN 2011d)38. Die Eier dieser Gomphiden-Art werden in kurzer Zeit durch mehrmaliges Eintauchen des Hinterleibs ins Wasser abgelegt, meist im Schutz dichter Vegetation (NLWKN 2011d). Nach STERNBERG & BUCHWALD (1999b) werden sowohl Bereiche mit geringer wie auch solche mit stärkerer Strömung genutzt. Nach PETERSEN et al. (2003) erfolgt die Eibablage in der Gewässermitte und es werden pro Ablage mindestens 260 wahrscheinlich bis 500 Eier in Form von Eiballen abgelegt, die dann frei im Wasser verdriften. Die Eiablagehabitate können mehrere hundert Meter oberhalb der Schlüpfhabitate liegen. Zur Dauer der Eientwicklung werden sehr unterschiedliche Angaben gemacht, die von 3–4 Wochen bis 3–8 Monate reichen. Die Gesamtentwicklungsdauer der Larven ist ebenfalls sehr vielfältig und variiert zwischen zwei und maximal vier Jahren (vgl. STERNBERG & BUCHWALD 1999b; PETERSEN et al. 2003). Als Larvalhabitate werden meist vegetationsarme, sandig-kiesige Bereiche der Gewässersohle genannt (vgl. z. B. NLWKN 2011d). Nach STERNBERG & BUCHWALD (1999b) gibt es aber auch Nachweise aus grobkörnigeren Lückensystemen oder Schlammsedimenten. Auch hinsichtlich der Fließgeschwindigkeit sind die Larven offenbar anpassungsfähig. Nach Angaben des NLWKN (2011d) findet man sie in strömungsberuhigten Bereichen. Nach PETERSEN et al. (2003) und STERNBERG & BUCHWALD (1999b) besiedeln sie eher die Zonen höherer Fließgeschwindigkeiten und 37 38 sowie: Artensteckbrief der AG Libellen in Niedersachsen und Bremen (http://www.ag-libellen-nds-hb.de/libellen/artensteckbriefe/ophiogomphus-cecilia-gruene-flussjungfer/), besucht am 13.07.2015 sowie: Artensteckbrief der AG Libellen in Niedersachsen und Bremen 22.03.2016 ARSU GmbH, Oldenburg Wasserrechtliches Erlaubnisverfahren für die Kraftwerke Herrenhausen und Linden Anhang 3 – Seite 11 können hohe Strömungen tolerieren, suchen aber andererseits auch aktiv strömungsberuhigtere Sohlenbereiche z. B. hinter Steinen oder Pflanzenpolstern auf. In etwa 10–120 cm Wassertiefe lauern sie oberflächlich im Substrat vergraben oder in gröberen Sedimenten in Mulden geduckt auf Beute (STERNBERG & BUCHWALD 1999b; NLWKN 2011d) oder suchen grabend nach Nahrung (PETERSEN et al. 2003). Sie erreichen Populationsdichten von 10 Larven/m² in günstigen Gewässern auch bis zu 50 Larven/m² (PETERSEN et al. 2003). Insgesamt sind die Larven wenig aktiv, verharren viele Tage an der derselben Stelle und vermindern so die Gefahr der Verdriftung. Auch zum Häuten verlassen sie anscheinend das Sediment nur kurzzeitig (STERNBERG & BUCHWALD 1999b). Dennoch können sie vor allem bei Hochwasserereignissen verdriftet werden (NLWKN 2011d). Bei Verdriftung zeigen die Larven unterschiedliches Verhalten, während sich einige mit angezogenen Beinen treiben lassen, versuchen andere durch Schwimmbewegungen möglichst bald wieder Substratkontakt zu bekommen (STERNBERG & BUCHWALD 1999b). Welche Rolle die Ausbreitung über driftende Larven spielt ist nicht bekannt, aber in der Oder wurden in Driftfängen regelmäßig junge Larvenstadien in geringer Anzahl nachgewiesen. In Laboruntersuchungen waren die Larven überwiegend nachtaktiv und legten durchschnittlich Strecken von nur 2 cm pro Nacht zurück (PETERSEN et al. 2003). Die Wassertemperatur der Larvengewässer ist meist im Jahres- und Tagesverlauf recht ausgeglichen. Als Sommertemperatur werden nach STERNBERG & BUCHWALD (1999b) in der Regel Werte von 18–20 °C angegeben. Die Wasserqualität ist meist gut bis sehr gut, aber auch in kritisch belasteten Gewässern (Güteklasse II–III) kommt die Art vor. Hinsichtlich der Ansprüche an den Sauerstoffgehalt des Wassers liegen keine Daten vor, jedoch besteht die Vermutung, dass die Larven empfindlich auf geringe Sauerstoffgehalte reagieren und daher in der Regel schlammige Sedimente und belastete Gewässer meiden, diese aber nutzen können, wenn durch höhere Fließgeschwindigkeiten eine bessere Sauerstoffversorgung gegeben ist (STERNBERG & BUCHWALD 1999b). Die Schlüpfhabitate der Grünen Flussjungfer liegen in unmittelbarer Nachbarschaft zu den bevorzugten Larvenhabitaten, häufig im Bereich stärkster Strömung (z. B. Prallhänge). Genutzt werden horizontale und vertikale Positionen in bis zu ca. 1 m Entfernung von der Wasserlinie auf Sand, Steinen und Uferbefestigungen, an Wurzeln, Gebüschen und anderer Vegetation (STERNBERG & BUCHWALD 1999b) Vorkommen im Einflussbereich der beantragten Benutzung Aktuelle Nachweise für Grüne Flussjungfer ( Ophiogomphus cecilia) aus dem Einwirkungsbereich der beantragten Benutzung liegen nicht vor. BIOCONSULT (2014, 2016b) hat bei den Untersuchungen des Makrozoobenthos von Leine und Ihme keine Larven dieser Art nachgewiesen. Aufgrund ihrer Verbreitung, ihrer Lebensraumansprüche und der häufig beobachteten Vergesellschaftung mit im Untersuchungsraum nachgewiesener Arten ist ihr Vorkommen aber möglich. Gemäß der Vollzugshinweise für diese Art (NLWKN 2011d) wurde sie in diesem Bereich Hannovers auch schon nachgewiesen. ARSU GmbH, Oldenburg 22.03.2016 Anhang 3 – Seite 12 Artenschutzrechtlicher Fachbeitrag Hufeisen-Azurjungfer (Coenagrion puella) Schutz- und Gefährdungsstatus Die Hufeisen-Azurjungfer (Coenagrion puella) ist eine nach der BArtSchV besonders geschützte Kleinlibellen-Art39, ist nach der Roten Liste Deutschland (OTT & PIPER 1998) nicht gefährdet, ist in Niedersachsen ebenfalls nicht gefährdet (ALTMÜLLER & CLAUSNITZER 2010). Verbreitung Die Hufeisen-Azurjungfer gehört in Deutschland zu den häufigsten Libellen-Arten und kommt in allen naturräumlichen Haupteinheiten mit hoher Stetigkeit vor (SCHORR 1990). In Niedersachsen ist sie im Bereich der Marschen, im östlichen Flachland und im Weser-Leinebergland häufig, im Bereich der Börden und der westlichen Geestflächen dagegen spärlicher vertreten (SCHORR 1990). Lebensraumansprüche und Verhaltensweisen Coenagrion puella ist einer Charakterart stehender eutropher bis oligotropher Kleingewässer. Fließgewässer, wie überwachsene Wiesengräben und strömungsberuhigte Bereiche von Flüssen und Kanälen, werden dagegen nur spärlich besiedelt (SCHORR 1990; STERNBERG & BUCHWALD 1999a). Die Imagines schlüpfen an senkrechten Substraten aller Arte in einer Höhe von 3–50 cm (maximal 100 cm) über dem Wasserspiegel. In der Regel schlüpfen sie ab Anfang Mai, in warmen Jahren auch bereits Ende April, in einen Zeitraum von 6–10 Wochen. Die Hauptflugzeit ist dann von Juni bis Juli (STERNBERG & BUCHWALD 1999a). Zur Eiablage sitzen die Paare vorzugsweise auf schwimmenden Pflanzenteilen oder bis an die Wasseroberfläche reichenden Submerspflanzen wie beispielsweise Laichkraut ( Potamogeton spp.) oder Tausendblatt (Myriophyllum spp.), die auch im Untersuchungsraum nachgewiesen wurden. Zur Eiablage werden in der Regel zarte Pflanzen bzw. weiche Pflanzenteile, auch halb verfaulte aus dem Vorjahr genutzt. Meist handelt es sich dabei um Stängel oder Halme. Im Freiland entwickeln sich die Eier in 3–5 Wochen, im Labor bei 22 °C in 18–21 Tagen. Die Larvalentwicklung dauert ½–2 Jahre (STERNBERG & BUCHWALD 1999a). Die jungen, frisch geschlüpften Larven halten sich auf der Unterseite der Blätter auf, verteilen sich jedoch im Laufe der Entwicklung auf die umliegende Unterwasser-Vegetation oder auf dem Grund seichter Bereiche. Sie schwimmen nur selten und sind dabei nicht sehr ausdauernd und schnell. Zur Nahrungsaufnahme laufen sie frei herum, halten sich aber bei hoher Fischdichte eher zwischen Pflanzen versteckt (STERNBERG & BUCHWALD 1999a). Optimal für die Larven sind Stillgewässer, langsam fließende Gräben, Fluss- oder Kanalbereiche sind dagegen suboptimal. An die Wasserqualität werden keine besonderen Ansprüche gestellt, die Larven sind auch in stark belasteten Gewässern (Gütestufe III) noch zu finden. Über die Temperaturansprüche der Larven ist nichts bekannt (STERNBERG & BUCHWALD 1999a). Gegenüber 39 vgl. http://www.wisia.de/FsetWisia1.de.html, besucht am 06.07.2015 22.03.2016 ARSU GmbH, Oldenburg Wasserrechtliches Erlaubnisverfahren für die Kraftwerke Herrenhausen und Linden Anhang 3 – Seite 13 Sauerstoffmangel sind sie vergleichsweise wenig empfindlich, jedoch darf der Sauerstoffgehalt nicht unter 4–5 mg/l absinken (SCHORR 1990; STERNBERG & BUCHWALD 1999a). Vorkommen im Einflussbereich der beantragten Benutzung Aktuelle Nachweise von Larven der Hufeisen-Azurjungfer (Coenagrion puella) im Untersuchungsraum liegen nicht vor, ihr Vorkommen ist jedoch in strömungsberuhigten Bereichen von Ihme und Leine möglich. BIOCONSULT (2016b) gibt für das Makrozoobenthos des Untersuchungsgebietes das Vorkommen von Larven einer Coenagrionidae-Art an. Diese wurde in der Ihme (Abschnitt S-7, vgl. Abb. 2 auf Seite 23) in hoher Abundanz (ca. 76 Ind./m²) und in der Leine unterhalb des Wehres Herrenhausen (S-6) in geringer Abundanz (0,4 Ind./m²) festgestellt. Dabei könnte es sich um Coenagrion puella handeln. Gewöhnliche Pechlibelle (Ischnura elegans) Schutz- und Gefährdungsstatus Die Gewöhnliche Pechlibelle (Ischnura elegans) ist eine nach der BArtSchV besonders geschützte Kleinlibellen-Art40, ist nach der Roten Liste Deutschland (OTT & PIPER 1998) nicht gefährdet, ist in Niedersachsen ebenfalls nicht gefährdet (ALTMÜLLER & CLAUSNITZER 2010). Verbreitung Die Gewöhnliche Pechlibelle ist nicht nur in ganz Deutschland, sondern in ganz Mitteleuropa sehr verbreitet und wahrscheinlich die häufigste Kleinlibellen-Art. Auch in Niedersachsen dürfte sie flächendeckend und in allen Naturräumen vorkommen.41 Nach SCHORR (1990) ist sie in den östlichen Naturräumen häufig, nur im Weser-Leine-Bergland ist sie spärlich vertreten. Lebensraumansprüche und Verhaltensweisen Die Gewöhnliche Pechlibelle nutzt ein breites Spektrum unterschiedlicher Gewässer, insbesondere stehende, aber auch langsam fließende (SCHORR 1990). Auch in ruhigeren Zonen schnell strömender Wiesengräben und –bäche, an ruhig fließenden Flüssen und sogar an kleinen Flüssen mit turbulenter Strömung ist sie anzutreffen (STERNBERG & BUCHWALD 1999a). Die Flugzeit von Ischnura elegans reicht insgesamt von Mitte April bis Ende September bzw. Anfang Oktober. Die Hauptflugzeit ist in der Regel im Juli und August (STERNBERG & BUCHWALD 1999a). 40 41 vgl. http://www.wisia.de/FsetWisia1.de.html, besucht am 06.07.2015 Artensteckbrief der AG Libellen in Niedersachsen und Bremen (http://www.ag-libellen-nds-hb.de/libellen/artensteckbriefe/ ischnura-elegans-grosse-pechlibelle/), besucht am 14.07.2015 ARSU GmbH, Oldenburg 22.03.2016 Anhang 3 – Seite 14 Artenschutzrechtlicher Fachbeitrag Die Eiablage erfolgt häufig in halbverfaulte Halme und Blätter von Binsen, Schilf oder Rohrkolben, die auf dem Wasser treiben. Aber auch senkrechte Halme, Blütenstände und andere Teile diverser Wasserpflanzen werden genutzt. Dabei tauchen die Weibchen auch vollständig unter Wasser (SCHORR 1990; STERNBERG & BUCHWALD 1999a). Meist liegen die Eiablagestellen innerhalb der Röhrichtzone oder unmittelbar davor, aber in spärlich bewachsenen Gewässern erfolgt sie auch auf der freien Wasserfläche (STERNBERG & BUCHWALD 1999a). Bei 10–27 °C Wassertemperatur benötigen die Eier 10–20 Tage zur Entwicklung. Auch die Larvalentwicklung der Pechlibelle hängt stark von der klimatischen Situation ab. So können sich zwei (oder sogar drei) Generationen pro Jahr entwickeln, aber auch zwei Jahre für die vollständige Entwicklung erforderlich sein (STERNBERG & BUCHWALD 1999a). Die Larven halten sich häufig zwischen auf dem Wasser schwimmenden Pflanzenteilen, submersen Pflanzen oder untergetauchten Teilen der emersen Vegetation auf. Sie bewegen sich aber auch nicht selten völlig frei auf dem Grund und suchen im Verlauf des Jahres unterschiedliche Gewässerbereiche wie die Gewässermitte oder die ufernahen Zonen auf (SCHORR 1990; STERNBERG & BUCHWALD 1999a). In der Regel beträgt die Fließgeschwindigkeit in der unmittelbaren Umgebung der Larven bis zu etwa 10 cm/s, kann aber auch noch erheblich höher sein. Die Larven suchen aktiv die Habitate kleinster Strömung auf, wie etwa den Strömungsschatten von Pflanzen. Sie sind sehr gefräßig, fallen aber auch selbst besonders leicht Fischen zum Opfer (STERNBERG & BUCHWALD 1999a). Die Larven halten sich bevorzugt in den warmen Flachwasserzonen auf und sind nicht auf eine bestimmte Vegetation angewiesen. Auch bezüglich der Gewässergüte sind sie offenbar sehr tolerant und werden sogar in stark verschmutzten Gewässern (Güteklasse III) gefunden (SCHORR 1990; STERNBERG & BUCHWALD 1999a). Zur Metamorphose nutzen sie meist senkrechte Halme und Blätter der emersen Vegetation, schlüpfen aber auch auf waagerechten Substraten – in der Regel maximal ca. 1 cm über der Wasseroberfläche (STERNBERG & BUCHWALD 1999a). Vorkommen im Einflussbereich der beantragten Benutzung Aktuelle Nachweise von Larven der Gewöhnlichen Pechlibelle ( Ischnura elegans) im Untersuchungsraum liegen nicht vor, ihr Vorkommen ist jedoch insbesondere in strömungsberuhigten Bereichen von Ihme und Leine möglich. BIOCONSULT (2016b) gibt für das Makrozoobenthos des Untersuchungsgebietes das Vorkommen von Larven einer Coenagrionidae-Art an. Diese wurde in der Ihme (Abschnitt S-7, vgl. Abb. 2 auf Seite 23) in hoher Abundanz (ca. 76 Ind./m²) und in der Leine unterhalb des Wehres Herrenhausen (S-6) in geringer Abundanz (0,4 Ind./m²) festgestellt. Dabei könnte es sich um Ischnura elegans handeln. 22.03.2016 ARSU GmbH, Oldenburg Wasserrechtliches Erlaubnisverfahren für die Kraftwerke Herrenhausen und Linden Anhang 3 – Seite 15 Frühe Adonislibelle (Pyrrhosoma nymphula) Schutz- und Gefährdungsstatus Die Frühe Adonislibelle (Pyrrhosoma nymphula) ist eine nach der BArtSchV besonders geschützte Kleinlibellen-Art42, ist nach der Roten Liste Deutschland (OTT & PIPER 1998) nicht gefährdet, ist in Niedersachsen ebenfalls nicht gefährdet (ALTMÜLLER & CLAUSNITZER 2010). Verbreitung Die Frühe Adonislibelle ist in Deutschland weit verbreitet und gehört in ihrem mitteleuropäischen Verbreitungsgebiet zu den häufigsten Arten (SCHORR 1990). In Niedersachsen kommt sie in allen Naturräumen vor.43 Nach SCHORR (1990) ist sie im östlichen Tiefland häufig, im Westen, auf den Börden und im Bergland spärlicher. Lebensraumansprüche und Verhaltensweisen Auch die Frühe Adonislibelle nutzt ein breites Spektrum verschiedener Gewässer, hat ihr Optimum aber an mehr oder weniger nährstoffreichen, verwachsenen Kleingewässern (Weiher, Teiche), träge fließenden sauberen (Quell-)Gräben, Oberläufen von (Quell-)Bächen und kleinen Flüssen, insbesondere wenn ruhige, krautreiche Buchten und bewaldete Ufer ausgebildet sind (STERNBERG & BUCHWALD 1999a). An größeren Seen und (Tiefland-)Flüssen fehlt sie weitgehend (STERNBERG & BUCHWALD 1999a)44. Die Imagines schlüpfen meist nur wenige Zentimeter über der Wasseroberfläche und in der Regel innerhalb weniger Tage Ende April oder Anfang Mai, in warmen Jahren auch schon Anfang April und Nachzügler in kalten Sommern noch bis Ende Juli. Die Hauptflugzeit ist nach STERNBERG & BUCHWALD (1999a) im Tiefland von Ende Mai bis Mitte Juni. Nach dem Artensteckbrief der AG Libellen reicht die Flugzeit in Niedersachsen und Bremen bis Anfang August. Zur Eiablage werden offenbar verschiedenste Pflanzen genutzt (SCHORR 1990; STERNBERG & BUCHWALD 1999a). Die Embryonalentwicklung dauert 2–6 Wochen, die Gesamtentwicklung im Flachland vermutlich (1–)2 Jahre, in den Hochlagen 2–3 Jahre (STERNBERG & BUCHWALD 1999a). Die jungen Larven leben am Ort der Eiablage zwischen den Pflanzen (SCHORR 1990; STERNBERG & BUCHWALD 1999a), lassen sich anscheinend aber auch mit der Strömung treiben und verteilen sich so im Gewässer (STERNBERG & BUCHWALD 1999a). Sie unterliegen einer sehr hohen Mortalität. Da sie ihr Futter von der Submersvegetation aus jagen und die Halmdichte die Futterverfügbarkeit beeinflusst, darf in den Larvenhabitaten eine bestimmte Dichte der Unterwasservegetation nicht unterschritten werden. Mit ca. 10 mm Länge wechseln die Larven auf den Gewässergrund und bevorzugen dunkle Mikrostandorte wie überhängende Ufer, faulende Blätter oder Löcher (STERNBERG & BUCHWALD 1999a). 42 43 44 vgl. http://www.wisia.de/FsetWisia1.de.html, besucht am 06.07.2015 Artensteckbrief der AG Libellen in Niedersachsen und Bremen (http://www.ag-libellen-nds-hb.de/libellen/artensteckbriefe/ pyrrhosoma-nymphula-fruehe-adonislibelle/), besucht am 14.07.2015 sowie Artensteckbrief (ebenda) ARSU GmbH, Oldenburg 22.03.2016 Anhang 3 – Seite 16 Artenschutzrechtlicher Fachbeitrag In Fließgewässern halten sich die Larven ausnahmslos an Stellen mit geringer Strömung oder in Bereichen mit ruhig und gleichmäßig fließendem Wasser von Buchten oder dichten Pflanzenbeständen auf. Turbulent fließendes Wasser wird gemieden. Hinsichtlich der Gewässergüte werden oligotrophe und leicht meso- bis eutrophe Gewässer besiedelt. Die Art kann jedoch auch in stark belasteten Gewässern (Güteklasse III) gefunden werden (STERNBERG & BUCHWALD 1999a). Bei Fließgeschwindigkeiten von 3–4 cm/s wird eine Mindestsauerstoffkonzentration von 5,5 mg/l genannt, aber es wird auch von Vorkommen bei geringeren Konzentrationen von 3,2 mg/l, 2 mg/l oder sogar 0,6 mg/l berichtet. Die Larvenhabitate weisen insgesamt ein ganzjährig kühles Mikroklima und einigermaßen ausgeglichene Tages- und Jahresverläufe auf, die sommerlichen Mitteltemperaturen liegen anscheinend in der Größenordnung von 14–17 °C (STERNBERG & BUCHWALD 1999a). Vorkommen im Einflussbereich der beantragten Benutzung Aktuelle Nachweise von Larven der Frühen Adonislibelle ( Pyrrhosoma nymphula) im Untersuchungsraum liegen nicht vor, ihr Vorkommen ist jedoch in strömungsberuhigten Bereichen von Ihme und Leine möglich. BIOCONSULT (2016b) gibt für das Makrozoobenthos des Untersuchungsgebietes das Vorkommen von Larven einer Coenagrionidae-Art an. Diese wurde in der Ihme (Abschnitt S-7, vgl. Abb. 2 auf Seite 23) in hoher Abundanz (ca. 76 Ind./m²) und in der Leine unterhalb des Wehres Herrenhausen (S-6) in geringer Abundanz (0,4 Ind./m²) festgestellt. Dabei könnte es sich um Pyrrhosoma nymphula handeln. Gemeine Weidenjungfer (Lestes viridis) Schutz- und Gefährdungsstatus Die Gemeine Weidenjungfer (Lestes viridis) ist eine nach der BArtSchV besonders geschützte Kleinlibellen-Art45, ist nach der Roten Liste Deutschland (OTT & PIPER 1998) nicht gefährdet, ist in Niedersachsen ebenfalls nicht gefährdet (ALTMÜLLER & CLAUSNITZER 2010). Verbreitung Die Gemeine Weidenjungfer ist in Deutschland weit verbreitet, nimmt aber in Norddeutschland ab und erreicht in Schleswig-Holstein bzw. Dänemark ihre nördliche Verbreitungsgrenze (SCHORR 1990; STERNBERG & BUCHWALD 1999a)46. Sie ist auch in Niedersachsen weit verbreitet, tritt aber im Westen spärlicher auf als im Osten. Hauptsächlich wird das wärmebegünstigte Tiefland besiedelt, aber die Gemeine Weidenjungfer ist 45 46 vgl. http://www.wisia.de/FsetWisia1.de.html, besucht am 06.07.2015 sowie Artensteckbrief der AG Libellen in Niedersachsen und Bremen (http://www.ag-libellen-nds-hb.de/libellen/artensteckbriefe/lestes-viridis-westliche-weidenjungfer/), besucht am 14.07.2015 22.03.2016 ARSU GmbH, Oldenburg Wasserrechtliches Erlaubnisverfahren für die Kraftwerke Herrenhausen und Linden Anhang 3 – Seite 17 auch im Harzvorland noch vertreten. Die Besiedlung ist jedoch in den Bereichen südlich des Mittellandkanals lückiger (SCHORR 1990)47. Lebensraumansprüche und Verhaltensweisen Lestes viridis besiedelt stehende und langsam fließende Gewässer aller Art, benötigt aber Ufergehölze mit überhängenden Ästen. Es gibt auch Nachweise von kleinen ruhigen Uferbuchten schnell strömender Bäche und Flüsse sowie von strukturreichen, schnell fließenden Gewässerabschnitten (SCHORR 1990; STERNBERG & BUCHWALD 1999a). Die Imagines der Weidenjungfer schlüpfen ab Ende Juni. Ihre Hauptflugzeit beginnt gemäß Artensteckbrief der AG Libellen in Niedersachsen im Juli, erreicht ihren Höhepunkt im August und September und endet im Oktober. Einzelne Tiere werden auch im Juni oder November beobachtet. Die Eiablage erfolgt in glattrindige Uferbäume und –büsche deren Zweige zumindest im Frühjahr, wenn die Larven schlüpfen, über dem Wasser hängen. Genutzt werden verschiedene Laubholzarten bis in 3 m oder maximal 6 m Höhe, aber auch verholzte Uferstauden und krautige Pflanzen werden gelegentlich verwendet, insbesondere in der Nachbarschaft von Eiablagegehölzen (SCHORR 1990; STERNBERG & BUCHWALD 1999a). Die Embryonen überdauern den Winter und je nach Regionalklima und Frühjahrswetter schlüpfen die Larven Ende März bis Mitte April aus den Eiern und fallen normalerweise direkt auf die Wasseroberfläche und lassen sich zu Boden sinken. Erst dort sind sie relativ sicher vor Jungfischen. Fallen die Larven auf festen Boden, versuchen sie durch bis zu 3 cm weite Sprünge das Wasser zu erreichen (STERNBERG & BUCHWALD 1999a). In Gewässern mit Wellenschlag und bei Anwesenheit von Fischen halten sich die Larven in den ruhigen Zonen bzw. im Bereich der Ufervegetation auf, ansonsten bewegen sie sich aber auch frei auf dem Gewässergrund. In schnell fließenden Gewässern nutzen sie strömungsberuhigte Uferzonen. Die Larven bevorzugen warmes Wasser, entwickeln sich aber, wenn auch deutlich verlangsamt, auch in kühleren Gewässern. An dem Gewässergrund und die Wasservegetation stellen sie keine besonderen Anforderungen, bevorzugen aber Pflanzen in unmittelbarer Ufernähe. Im Flachwasser tolerieren sie offenbar auch stark eutrophierte Verhältnisse, werden aber in tieferen Gewässern nur selten unter stark eutrophen Bedingungen mit hoher Sauerstoffzehrung gefunden (STERNBERG & BUCHWALD 1999a). Vorkommen im Einflussbereich der beantragten Benutzung Aktuelle Nachweise von Larven der Gemeinen Weidenjungfer ( Lestes viridis) im Untersuchungsraum liegen nicht vor, ihr Vorkommen in strömungsberuhigten Bereichen von Ihme und Leine mit geeigneten überhängenden Ufergehölzen kann jedoch nicht ausgeschlossen werden. Gewöhnliche Winterlibelle (Sympecma fusca) Schutz- und Gefährdungsstatus Die Gewöhnliche Winterlibelle (Sympecma fusca) 47 sowie Artensteckbrief (ebenda) ARSU GmbH, Oldenburg 22.03.2016 Anhang 3 – Seite 18 Artenschutzrechtlicher Fachbeitrag ist eine nach der BArtSchV besonders geschützte Kleinlibellen-Art48, ist nach der Roten Liste Deutschland (OTT & PIPER 1998) gefährdet (Kat. 3), ist in Niedersachsen und in der Region östliches Tiefland ungefährdet (ALTMÜLLER & CLAUSNITZER 2010). Verbreitung Die Gewöhnliche Winterlibelle kommt in Deutschland zwar in allen naturräumlichen Haupteinheiten vor, ist aber wahrscheinlich regional nirgendwo häufig. Im norddeutschen Tiefland ist die Art nur zerstreut bis spärlich vertreten und erreicht in Schleswig-Holstein ihre nördliche Verbreitungsgrenze (SCHORR 1990; STERNBERG & BUCHWALD 1999a). Nach SCHORR (1990) ist sie in Niedersachsen im östlichen Tiefland spärlich vertreten, in den übrigen Regionen kaum. Zu den Bereichen, in denen die Winterlibelle häufiger festgestellt wurde, gehören neben der Stader Geest, Teilen der Lüneburger Heide und dem Wendland mit Elbtalaue auch das Weser-Aller-Flachland.49 Lebensraumansprüche und Verhaltensweisen Da die Winterlibelle im Gegensatz zu den übrigen Libellen als Imago überwintert, benötigt sie entsprechende Überwinterungsplätze. Hinsichtlich der Reproduktionsgewässer bevorzugt sie naturnahe Stillgewässer oder sonnige und strömungsberuhigte Fließgewässerabschnitte. Sie besiedelt entsprechend Seeufer, Weiher und Teiche, Altwässer und strömungsberuhigte Flussbuchten mit sonnenbeschienener, nicht zu dichter Röhricht- oder Seggenvegetation (STERNBERG & BUCHWALD 1999a)50. Die Imagines schlüpfen vorwiegend von Ende Juli bis Mitte August, manchmal auch bis Anfang September. Sie fliegen bis zum Kaltwerden Ende Oktober/Anfang November. Gewöhnlich sind sie frühestens im März oder im April wieder aktiv, verlassen ihr Winterquartier aber in wärmeren Phasen auch zwischendurch (STERNBERG & BUCHWALD 1999a). Die Eiablage erfolgt im Frühjahr und kann sich je nach Witterung bis Juni oder Juli verzögern. Sie erfolgt nur an besonnten, im Vergleich zum freien Wasser thermisch begünstigten Habitaten. Genutzt werden verschiedene meist horizontale, schwimmende und nur selten aufrechte Substrate, in der Regel abgestorbene Pflanzenteile wie Seggen-, Binsen- oder Typha-Halme. Die Embryonalentwicklung dauert wahrscheinlich ca. 3–6 Wochen. Die Gesamtentwicklung ist in etwa 10–12 Wochen, in warmen Gewässern auch schon nach 8 Wochen abgeschlossen. Als Schlüpfhabitate dienen meist mehr oder weniger senkrechte Substrate in einer Höhe von ca. 5–35 cm über der Wasserfläche (SCHORR 1990; STERNBERG & BUCHWALD 1999a). Die Lebensweise der Larven ist weitgehend unbekannt, sie sind anscheinend sehr agil und gefräßig und außerdem flinke Schwimmer. Entsprechend ihrer kurzen Entwicklungszeit sind sie vermutlich recht wärmbedürftig und auf ein gutes Nahrungsangebot angewiesen. Sie bevorzugen wahrscheinlich auch deshalb meso- bis eutrophe Gewässer (STERNBERG & BUCHWALD 1999a). 48 49 50 vgl. http://www.wisia.de/FsetWisia1.de.html, besucht am 06.07.2015 Artensteckbrief der AG Libellen in Niedersachsen und Bremen (http://www.ag-libellen-nds-hb.de/libellen/artensteckbriefe/ sympecma-fusca-gemeine-winterlibelle/), besucht am 15.07.2015 sowie Artensteckbrief (ebenda) 22.03.2016 ARSU GmbH, Oldenburg Wasserrechtliches Erlaubnisverfahren für die Kraftwerke Herrenhausen und Linden Anhang 3 – Seite 19 Die Larven der Winterlibelle halten sich bevorzugt zwischen den submersen Teilen der Ufervegetation, auf der Tauchblattvegetation oder auf Algenwatten dicht unter der Wasseroberfläche auf. Auch die Unterseite von schwimmenden Pflanzenteilen, Treibholz etc. wird genutzt. Sie beschränken sich auf Gewässerbereiche, in denen höchstens eine kaum wahrnehmbare Wasserströmung festzustellen ist, überleben aber auch reißende Hochwässer. In der Regel beträgt die Wassertiefe in den Larvenhabitaten maximal 30 cm, seltener bis 50 cm. Sauerstoffgehalte von < 8,75 % bei 20 °C, von < 15,45 % bei 25 °C bzw. von < 22,63 % bei 30 C sind für die Larven lethal (STERNBERG & BUCHWALD 1999a). Vorkommen im Einflussbereich der beantragten Benutzung Aktuelle Nachweise von Larven der Gewöhnlichen Winterlibelle (Sympecma fusca) im Untersuchungsraum liegen nicht vor, ihr Vorkommen in strömungsberuhigten Bereichen von Ihme und Leine kann jedoch nicht ausgeschlossen werden. Braune Mosaikjungfer (Aeshna grandis) Schutz- und Gefährdungsstatus Die Braune Mosaikjungfer (Aeshna grandis) ist eine nach der BArtSchV besonders geschützte Großlibellen--Art51, steht nach der Roten Liste Deutschland (OTT & PIPER 1998) auf der Vorwarnliste (Kat. V), ist in Niedersachsen nicht gefährdet (ALTMÜLLER & CLAUSNITZER 2010), steht aber in der Region östliches Tiefland auf der Vorwarnliste (Kat. V). Verbreitung Die Braune Mosaikjungfer (Aeshna grandis) ist nach SCHORR (1990) in Deutschland sehr unregelmäßig verbreitet. Die Schwerpunkte ihres Vorkommens liegen in Schleswig-Holstein und südlich der Donau. In den übrigen Landesteilen kommt sie eher spärlich oder kaum vor. Nach Angaben der AG Libellen52 ist die Art in Niedersachsen in großen Teilen des Tieflands verbreitet und häufig. Lücken finden sich vor allem in den westlichen Landesteilen (küstennahe Marschen, Diepholzer Moorniederung, südliches Emsland) und im Übergangsbereich zum Berg- und Hügelland. Im südlichen Berg- und Hügelland ist sie selten und weitgehend auf die Flusstäler beschränkt und im Harz fehlt sie nahezu vollständig. Lebensraumansprüche und Verhaltensweisen Die Braune Mosaikjungfer besiedelt sowohl ein breites Spektrum von Stillgewässern als auch langsam strömende Fließgewässer. Sie kommt auch in Städten vor und nutzt Parkteiche und 51 52 vgl. http://www.wisia.de/FsetWisia1.de.html, besucht am 06.07.2015 Artensteckbrief der AG Libellen in Niedersachsen und Bremen (http://www.ag-libellen-nds-hb.de/libellen/artensteckbriefe/ aeshna-grandis-braune-mosaikjungfer/), besucht am 15.07.2015 ARSU GmbH, Oldenburg 22.03.2016 Anhang 3 – Seite 20 Artenschutzrechtlicher Fachbeitrag -seen. Die höchsten Individuenzahlen werden in Niedersachsen an vegetationsreichen Marschgewässern, Teichen und Altwässern der Flusstäler festgestellt. Die besiedelten Gewässer haben meist eine gut entwickelte Verlandungszone, vor allem mit Schwimmblattvegetation, und befinden sich in Waldnähe. Nur selten kommt Aeshna grandis als alleinige Aeshnide vor. Der Frühe Schilfjäger (Brachytron pratense) gehört zu den Arten, die häufig gemeinsam mit der Braunen Mosaikjungfer anzutreffen sind (SCHORR 1990; STERNBERG & BUCHWALD 1999b)53. Die Imagines der Braune Mosaikjungfer schlüpfen meist zwischen Mitte Juni und Ende Juli bzw. Anfang August an senkrechten Halmen und Stängeln der Ufervegetation in 10–40 cm Höhe, an Totholz bis in 2 m Höhe oder an im Wasser treibendem Astwerk. Ihre Flugzeit reicht von Anfang Juni bis in den Oktober mit einem Schwerpunkt im Juli und August (STERNBERG & BUCHWALD 1999b)54. Für die endophytische Eiablage werden verschiedene, meist besonnte Substrate genutzt, dabei scheinen abgestorbene auf dem Wasser treibende Pflanzenteile (Stängel, Rhizome, Sprossteile) bevorzugt zu werden. Aber auch Tot- und Treibholz, Pfähle, ins Wasser hängende Zweige und verschiedenste Pflanzenarten werden genutzt. Die Eier überwintern und erst im Mai des nächsten Jahres schlüpfen die Larven und wachsen je nach klimatischen Bedingungen innerhalb von zwei bis drei oder sogar vier Jahren heran. Aus einem Gewässer schlüpfen dabei nach den bisherigen Beobachtungen nie mehr als hundert Individuen (STERNBERG & BUCHWALD 1999b). In der warmen Jahreszeit halten sich die Larven im Bereich der submersen und emersen Vegetation auf. Dabei haben sie anscheinend keine Bindung an bestimmte Pflanzenarten oder –gesellschaften. Die Larven sind vergleichsweise träge und halten sich vorwiegend an versteckten, dunklen Orten auf. Im Herbst und Winter sind sie auf dem Gewässergrund oder an Torfwänden zu finden. Dabei stellen sie an den Gewässergrund keine besonderen Anforderungen. Ihre Habitate weisen jedoch keine nennenswerte Strömung auf oder werden nur langsam durchströmt mit Fließgeschwindigkeiten bis 1 m/s. Die Larven nutzen Wassertiefen von 0,1–1,5 m und suchen vor allem im Winter die tieferen Schichten auf. Genutzt werden Gewässer aller Trophiestufen, am häufigsten jedoch meso- und eutrophe Gewässer. Es wird vermutet, dass die Larven eher gemäßigt kühles Mikroklima bevorzugen, bei Temperaturen < 12 °C werden sie aber noch lethargischer (STERNBERG & BUCHWALD 1999b). Vorkommen im Einflussbereich der beantragten Benutzung Aktuelle Nachweise von Larven der Braunen Mosaikjungfer ( Aeshna grandis) im Untersuchungsraum liegen nicht vor, ihr Vorkommen ist jedoch in strömungsberuhigten Bereichen von Ihme und Leine möglich. BIOCONSULT (2016b) gibt für das Makrozoobenthos der untersuchten Gewässerabschnitte das Vorkommen von Larven einer Aeshnidae-Art an. Diese wurde unterhalb des Untersuchungsraumes in der Leine zwischen Mittellandkanal und Autobahn A 2 (Abschnitt S-2, vgl. Abb. 2 auf Seite 23) in geringer Abundanz (0,4 Ind./m²) festgestellt. Dabei könnte es sich um Aeshna grandis handeln. 53 54 sowie Artensteckbrief (ebenda) sowie Artensteckbrief (ebenda) 22.03.2016 ARSU GmbH, Oldenburg Wasserrechtliches Erlaubnisverfahren für die Kraftwerke Herrenhausen und Linden Anhang 3 – Seite 21 Früher Schilfjäger (Brachytron pratense) Schutz- und Gefährdungsstatus Der Frühe Schilfjäger (Brachytron pratense) ist eine nach der BArtSchV besonders geschützte Großlibellen-Art55, ist nach der Roten Liste Deutschland (OTT & PIPER 1998) gefährdet (Kat. 3), ist auch in Niedersachsen und in der Region östliches Tiefland gefährdet (ALTMÜLLER & CLAUSNITZER 2010). Verbreitung Auch der Frühe Schilfjäger ist nach SCHORR (1990) in Deutschland sehr unregelmäßig verbreitet und bevorzugt tendenziell das Tiefland und die Flussniederungen gegenüber den Mittelgebirgen. Nur im östlichen Schleswig-Holstein ist er häufig, in den übrigen naturräumlichen Regionen aber nur spärlich, vereinzelt oder gar nicht nachgewiesen. Für Niedersachsen gibt die AG Libellen56 als Verbreitungsschwerpunkte die wärmebegünstigten Niederungen von Ems, Weser, Aller und deren Nebenflüssen sowie der Elbe an. Die höchsten Dichten werden demnach an der Unterweser bei Bremen, in der südlichen Lüneburger Heide und im Wendland beobachtet. Zusammenhängende Vorkommen gibt es aber auch an der unteren Ems, in der nördlichen Stader Geest und im nördlichen Harzvorland. Im Bergland sind die Vorkommen auf die Flusstäler beschränkt. Lebensraumansprüche und Verhaltensweisen Der Frühe Schilfjäger ist eine Art der Aue. Er besiedelt vorzugsweise Stillgewässer unterschiedlicher Größe, deren Ufer dichte Röhricht- und Hochstaudenbestände aufweisen. Aber offenbar werden gelegentlich auch langsam und sogar schnell fließende Gewässer wie Bäche, Gräben, Flüsse und Kanäle genutzt. Häufige Begleiter sind beispielsweise Spitzenfleck (Libellula fulva), Federlibelle (Platycnemis pennipes), Frühe Adonislibelle (Pyrrhosoma nymphula), Große Pechlibelle (Ischnura elegans) und Hufeisen-Azurjungfer (Coenagrion puella) (STERNBERG & BUCHWALD 1999b)57. Die Imagines von Brachytron pratense schlüpfen im Röhricht versteckt im zeitigen Frühjahr etwa von Mitte April bis Mitte Mai. Die Hauptflugzeit liegt in Niedersachsen im Mai und bereits ab Mitte Juni wird die Art nur noch vereinzelt beobachtet (STERNBERG & BUCHWALD 1999b)58. Die Eiablage erfolgt vorwiegend in abgestorbene, halbverfaulte Wurzelbereiche, Rhizomballen, Strünke und anderer Pflanzenteile von Schilf, Rohrkolben, Seebinse, Simsen oder Seggen, die im Bereich der Röhrichte bzw. unmittelbar davor schwimmen (SCHORR 1990; STERNBERG & BUCHWALD 1999b). Die Angaben zu Dauer der Embryonalentwicklung schwanken zwischen drei und sieben 55 56 57 58 vgl. http://www.wisia.de/FsetWisia1.de.html, besucht am 06.07.2015 vgl. Artensteckbrief der AG Libellen in Niedersachsen und Bremen (http://www.ag-libellen-nds-hb.de/libellen/artensteckbriefe/brachytron-pratense-frueher-schilfjaeger/, besucht am 15.07.2015 sowie Artensteckbrief (ebenda) sowie Artensteckbrief (ebenda) ARSU GmbH, Oldenburg 22.03.2016 Anhang 3 – Seite 22 Artenschutzrechtlicher Fachbeitrag Wochen. Die Larven wachsen nur langsam heran und überwintern zwei- oder dreimal (STERNBERG & BUCHWALD 1999b). Die Laven halten sich bevorzugt im Bereich der Rhizome des Uferröhrichts, des Wurzelgeflechts von Uferbäumen oder unterseits von verfaulten schwimmenden Pflanzenteilen auf. In Fließgewässern werden auch strömungsberuhigte Zonen zwischen Schwaden, Rohrglanzgras, Brunnenkresse und Minze besiedelt. Die Larven tolerieren zeitweises oder permanentes Durchströmen ihrer Habitate, werden auch in permanent schnell fließenden Gewässern gefunden und ertragen Fließgeschwindigkeiten von mindestens 8–10 cm/s. Die Larvalgewässer sind in der Regel mesobis eutroph und aufgrund der Beschattung recht kühl mit einem ausgeglichenen Mikroklima. Der für Larven letale Sauerstoffgehalt liegt bei 30 °C bei ca. 26 % (STERNBERG & BUCHWALD 1999b). Vorkommen im Einflussbereich der beantragten Benutzung Aktuelle Nachweise von Larven des Frühen Schilfjägers ( Brachytron pratense) im Untersuchungsraum liegen nicht vor, ihr Vorkommen ist jedoch nicht ausgeschlossen. BIOCONSULT (2016b) gibt für das Makrozoobenthos der untersuchten Gewässerabschnitte das Vorkommen von Larven einer Aeshnidae-Art an. Diese wurde in geringer Abundanz (0,4 Ind./m²) in der Leine unterhalb des Untersuchungsraumes zwischen Mittellandkanal und Autobahn A 2 (Abschnitt S-2, vgl. Abb. 2 auf Seite 23) festgestellt. Dabei könnte es sich um Brachytron pratense handeln. Spitzenfleck (Libellula fulva) Schutz- und Gefährdungsstatus Der Spitzenfleck (Libellula fulva) ist eine nach der BArtSchV besonders geschützte Großlibellen-Art59, ist nach der Roten Liste Deutschland (OTT & PIPER 1998) stark gefährdet (Kat. 2), ist auch nach der Roten Liste Niedersachsen (ALTMÜLLER & CLAUSNITZER 2010) und in der Region östliches Tiefland stark gefährdet (Kat. 2). Verbreitung Der Spitzenfleck ist in Mitteleuropa zwar weit aber meist nur zerstreut verbreitet. Nach SCHORR (1990) liegen Verbreitungsschwerpunkte in Deutschland im Norddeutschen Tiefland, insbesondere dem östlichen Schleswig-Holstein, im Rheintal, im voralpinen Hügel- und Moorland und im Berliner Raum. In Niedersachsen ist der Spitzenfleck nur sehr lückenhaft verbreitet. Zwar gelten die größeren Stromtäler des Tieflandes als primäres Areal der Art, sind aber nur lückig besiedelt. Häufiger ist die Art entlang der Weser zwischen Nienburg und Bremen sowie in der Jeetzel-Niederung in 59 vgl. http://www.wisia.de/FsetWisia1.de.html, besucht am 06.07.2015 22.03.2016 ARSU GmbH, Oldenburg Wasserrechtliches Erlaubnisverfahren für die Kraftwerke Herrenhausen und Linden Anhang 3 – Seite 23 Lüchow-Dannenberg. Einzelne ergänzende Vorkommen werden am ehesten in den Urstromtälern von Weser, Aller und Elbe erwartet.60 Lebensraumansprüche und Verhaltensweisen Der Spitzenfleck ist eine Charakterart der Auen von Tieflandflüssen, die stehende und mehr oder weniger langsam fließende Gewässer besiedelt (STERNBERG & BUCHWALD 1999b). In Niedersachsen werden vor allem langsam strömende, nicht zu stark verschmutzte Flüsse, Kanäle und Altwässer genutzt, die eine reiche Ufervegetation aufweisen und besonnt sind. Gut ausgeprägte Uferröhrichte und Großseggenriede aber auch Bereiche mit offenen Wasserflächen und Gehölze in der Umgebung sind wichtige Habitatelemente für Libellula fulva (SCHORR 1990; STERNBERG & BUCHWALD 1999b)61. Die Imagines schlüpfen versteckt an vertikalen Strukturen der Verlandungs- und Ufervegetation, in der Regel im Mai. Ihre Hauptflugzeit erstreckt sich bis Ende Juni, je nach Witterung können sie aber auch noch im Juli oder August gesichtet werden (STERNBERG & BUCHWALD 1999b)62. In Fließgewässern kommt der Spitzenfleck oft gemeinsam mit der Gebänderten Prachtlibelle ( Calopteryx splendens) oder auch mit der Gewöhnlichen Keiljungfer (Gomphus vulgatissimus) vor (STERNBERG & BUCHWALD 1999b). Die Eier werden exophytisch an seichten Wasserstellen (4–50 cm) an Strünken von Carex-Horsten und Ähnlichem oder über der freien Wasserfläche in der Nähe des Röhrichtsaumes abgestreift oder abgeworfen (STERNBERG & BUCHWALD 1999b). Die Angaben zur Dauer der Embryonalentwicklung variieren zwischen elf Tagen und sieben Wochen, die Larven benötigen vermutlich zwei Jahre bis sie an den einzelnen Gewässern weitgehend synchron schlüpfen (SCHORR 1990; STERNBERG & BUCHWALD 1999b). Die jungen Larven von Libellula fulva halten sich zunächst auf dem Grund des Gewässers auf und verstecken sich erst nach der dritten Häutung unter abgestorbenen Pflanzenteilen oder graben sich ins Sediment ein, dass schlammig bis kiesig sein kann (SCHORR 1990; STERNBERG & BUCHWALD 1999b). Es wird davon ausgegangen, dass die Larven zumindest leichte Strömungen tolerieren. Zwar ist der Spitzenfleck charakteristisch für saubere, meist oligo- bis mesotrophe Gewässer und man nimmt an, dass eutrophe Gewässer nur dann besiedelt werden, wenn sie eine durchgehend hohe Sauerstoffsättigung aufweisen, aber es gibt auch Hinweise, dass die Larven eine hohe Toleranz gegenüber hypertrophen Verhältnissen haben. Da sie tiefere Gewässer mit Grundwasseranbindung bevorzugen, wird angenommen, dass sie sich möglicherweise nur bei einem recht kühlen Mikroklima mit gleichmäßigem Temperaturgang optimal entwickeln können (STERNBERG & BUCHWALD 1999b). Vorkommen im Einflussbereich der beantragten Benutzung Aktuelle Nachweise von Larven des Spitzenflecks (Libellula fulva) im Untersuchungsraum liegen nicht vor, ihr Vorkommen ist jedoch nicht ausgeschlossen. 60 61 62 vgl. Artensteckbrief der AG Libellen in Niedersachsen und Bremen (http://www.ag-libellen-nds-hb.de/libellen/artensteckbriefe/libellula-fulva-spitzenfleck/), besucht am16.07.2015 sowie Artensteckbrief (ebenda) sowie Artensteckbrief (ebenda) ARSU GmbH, Oldenburg 22.03.2016 Wasserrechtliches Erlaubnisverfahren für die Kraftwerke Herrenhausen und Linden Anhang 4: Anhang 4 – Seite 1 Beschreibung der relevanten Weichtiere Fünf Arten der Mollusken wurden als relevant identifiziert: Malermuschel (Unio pictorum) Große Flussmuschel (Unio tumidus) Flache Teichmuschel (Anodonta anatina) Gewöhnliche Teichmuschel (Anodonta cygnea) Abgeplattete Teichmuschel (Pseudanodonta complanata) Malermuschel (Unio pictorum) Schutz- und Gefährdungsstatus Die Malermuschel (Unio pictorum) ist eine nach der BArtSchV besonders geschützte Muschel-Art63, steht nach der Roten Liste Deutschland (JUNGBLUTH & KNORRE 2011) auf der Vorwarnliste (Kat. V), ist in Niedersachsen gefährdet (Kat. 3 der Roten Liste)64. Verbreitung Sie war früher in Deutschland weit verbreitet, ist jedoch heute in vielen ursprünglich besiedelten Gebieten nicht mehr anzutreffen (BAYERISCHES LANDESAMT FÜR UMWELT 2012e). Lebensraumansprüche und Verhaltensweisen Die Malermuschel ist bis zu ca. 9 cm lang und eine typische Tieflandart. Sie kommt in den Unterläufen von Bächen, Flüssen und Altwässern sowie in einigen Seen (an den bewegten Seerändern) im Litoral, Potamal und Rhithral vor. In der Regel besiedelt sie sandige bis schlammige Abschnitte, kommt aber auch in feinkiesigen Bereichen vor. Sie nutzt meso- bis eutrophe Gewässer, toleriert Wassertemperaturen bis über 25 °C und kann ein Alter von etwa 10–15 Jahren erreichen (BAUMGÄRTNER & HEITZ 1995; GLÖER & DIERCKING 2010; BAYERISCHES LANDESAMT FÜR UMWELT 2012e). Die adulten Muscheln vermehren sich im Frühsommer durch Eier, die jedoch im Brutraum der Muschel verbleiben und durch mit dem Atemwasser eingesogene Spermien befruchtet werden. Pro Gelege entwickeln sich 100.000–400.000 Eier im Kiemenraum der weiblichen Malermuschel zu etwa 0,2 mm großen Muschellarven (Glochidien), was je nach Temperatur bis zu sechs Wochen dauert. Die Muschellarven werden dann zwischen März und Juli mit dem Atemwasserstrom ins Wasser abgegeben und sinken zu Boden. Wenn Fische nach den Larven schnappen, 63 64 vgl. http://www.wisia.de/FsetWisia1.de.html, besucht am 25.06.2015 nach den Angaben im Meldebogen 'Mollusken – Limnische Arten' der Erfassung von Tierarten in Niedersachsen, Stand 11/2014 (www.nlwkn.niedersachsen.de/download/21944/Suesswasserschnecken_und_-muscheln.pdf, Download vom 16.07.2015), der sich bezieht auf Jungbluth, J. H. (1990): Vorläufige 'Rote Liste' der bestandsbedrohten und gefährdeten Binnenmollusken (Weichtiere: Schnecken und Muscheln) in Niedersachsen, unveröffentlicht ARSU GmbH, Oldenburg 22.03.2016 Anhang 4 – Seite 2 Artenschutzrechtlicher Fachbeitrag haken diese sich an deren Kiemen fest und werden nachfolgend von den Kiemenblättern umwachsen. Die Larven verbleiben über einige Wochen in den Fischkiemen und ernähren sich von Nahrungspartikeln, die die Fische mit ihrem Atemwasser den Kiemen zuführen. Wenn die Metamorphose zur Muschel abgeschlossen ist, platzt die Zyste auf, die Jungmuschel fällt vom Wirtsfisch ab und sinkt auf den Gewässergrund (BAUMGÄRTNER & HEITZ 1995) 65. Aber nur einem sehr kleinen Prozentsatz der Glochidien gelingt es, sich an einem geeigneten Wirtsfisch festzusetzen, die meisten gehen zugrunde oder werden gefressen. Als Wirtsfische genannt werden Flussbarsch (Perca fluviatilis), Kaulbarsch (Gymnocephalus cerna), Rotfeder (Scardinius erythrophthalmus), Rotauge/Plötze (Rutilus rutilus), Döbel/Aitel (Squalius cephalus), Gründling (Gobio gobio), Schleie (Tinca tinca) und Dreistachliger Stichling (Gasterosteus aculeatus) (BAUMGÄRTNER & HEITZ 1995; GLÖER & DIERCKING 2010; BAYERISCHES LANDESAMT FÜR UMWELT 2012e). Die jungen Muscheln leben die ersten Jahre im Gewässergrund eingegraben. Anscheinend werden sie dennoch von Wasservögel und anderen Räubern gefressen. Mit etwa drei bis vier Jahren werden sie geschlechtsreif. Und auch die ausgewachsenen Muscheln lieben tief im Sediment eingegraben, so dass oft nur ihr Hinterende herausragt. Sie ernähren sich von planktischen Organismen und organischen Partikel (Detritus), sind sehr ortstreu und neigen kaum zu ausgedehnten Wanderungen. Ihre Ausbreitung erfolgt im Wesentlichen über die Wirtsfische im GlochidienStadium (BAUMGÄRTNER & HEITZ 1995). In Fließgewässern sind größere Muschelbestände vor allem an Stellen mit geringer Fließgeschwindigkeit (wie Auskolkungen, Gumpen etc.), zwischen Erlenwurzeln, an Bachbiegungen und in Röhrichtbeständen zu finden (BAUMGÄRTNER & HEITZ 1995). Vorkommen im Einflussbereich der beantragten Benutzung Die Malermuschel (Unio pictorum) wurde 2013 von BIOCONSULT (2016b) unterhalb des Wehres Herrenhausen (Abschnitt S-6, vgl. Abb. 2 auf Seite 23) in der Leine nachgewiesen, jedoch nur an einer Probenahmestelle und nur in geringer Dichte (0,4 Ind./m²). Dieser Nachweis konnte bei den ergänzenden Untersuchungen im Frühjahr 2014 nicht bestätigt werden (BIOCONSULT 2014). Große Flussmuschel (Unio tumidus) Schutz- und Gefährdungsstatus Die Große Flussmuschel (Unio tumidus) 65 66 67 ist eine nach der BArtSchV besonders geschützte Muschel-Art66, ist nach der Roten Liste Deutschland (JUNGBLUTH & KNORRE 2011) stark gefährdet (Kat. 2), ist in Niedersachsen gefährdet (Kat. 3 der Roten Liste)67. sowie http://www.wirbellosen-aquarium.de/schnecken/muscheln/malermuschel.html, besucht am 16.07.2015 vgl. http://www.wisia.de/FsetWisia1.de.html, besucht am 25.06.2015 nach den Angaben im Meldebogen 'Mollusken – Limnische Arten' der Erfassung von Tierarten in Niedersachsen, Stand 11/2014 (www.nlwkn.niedersachsen.de/download/21944/Suesswasserschnecken_und_-muscheln.pdf, Download vom 22.03.2016 ARSU GmbH, Oldenburg Wasserrechtliches Erlaubnisverfahren für die Kraftwerke Herrenhausen und Linden Anhang 4 – Seite 3 Verbreitung Die Große Flussmuschel trat früher in Massen in Bächen auf, ist heute aber sehr selten. Größere Vorkommen gibt es in Deutschland noch in Schleswig-Holstein und Mecklenburg-Vorpommern (BAYERISCHES LANDESAMT FÜR UMWELT 2012b). Lebensraumansprüche und Verhaltensweisen Im Allgemeinen wird die Große Flussmuschel ca. 7–10 cm lang, selten bis zu 12 cm. Sie ist eine noch extremere Tieflandart als die Malermuschel und lebt im Litoral und Potamal träge fließender oder leicht bewegter Gewässer, beispielsweise in Altwässern, Baggerseen, Fischteichen und in größeren Bächen und Flüssen. Sie bevorzugt sandige Substrate bis in mehrere Meter Wassertiefe (BAUMGÄRTNER & HEITZ 1995; GLÖER & DIERCKING 2010; BAYERISCHES LANDESAMT FÜR UMWELT 2012b). Gewässerbereiche mit submerser Vegetation werden weitgehend gemieden (GLÖER & DIERCKING 2010). Die Große Flussmuschel ist häufig mit der Maler-, Bach- oder Teichmuscheln vergesellschaftet (BAYERISCHES LANDESAMT FÜR UMWELT 2012b). Die Entwicklung gleicht der der Malermuschel. Dabei entwickeln sich ca. 200.000 Glochidien pro Weibchen (BAYERISCHES LANDESAMT FÜR UMWELT 2012b). Als Wirtsfische genannt werden Flussbarsch (Perca fluviatilis), Kaulbarsch (Gymnocephalus cerna), Rotfeder (Scardinius erythrophthalmus), Rotauge/Plötze (Rutilus rutilus), Güster (Blicca bjoerkna), Schleie (Tinca tinca) und Dreistachliger Stichling (Gasterosteus aculeatus) (BAUMGÄRTNER & HEITZ 1995; GLÖER & DIERCKING 2010; BAYERISCHES LANDESAMT FÜR UMWELT 2012b) Vorkommen im Einflussbereich der beantragten Benutzung Bei den Untersuchungen von BIOCONSULT (2016b) wurde die Große Flussmuschel (Unio tumidus) 2013 weder in der Leine noch in der Ihme nachgewiesen, ihr Vorkommen kann jedoch nicht ausgeschlossen werden, zumal bei den ergänzenden Untersuchungen im Frühjahr 2014 eine Unio-Art an zwei Probenahmestellen in der Leine unterhalb der Bahnstrecke Richtung Seelze mit 1,0 bzw. 1,3 Individuen/m² nachgewiesen wurde (BIOCONSULT 2014). Dabei könnte es sich um Unio tumidus aber auch um Unio pictorum handeln. Flache Teichmuschel (Anodonta anatina) Schutz- und Gefährdungsstatus Die Flache Teichmuschel (Anodonta anatina) ist eine nach der BArtSchV besonders geschützte Muschel-Art68, steht nach der Roten Liste Deutschland (JUNGBLUTH & KNORRE 2011) auf der Vorwarnliste (Kat. V), ist in Niedersachsen gefährdet (Kat. 3 der Roten Liste)69. 16.07.2015), der sich bezieht auf Jungbluth, J. H. (1990): Vorläufige 'Rote Liste' der bestandsbedrohten und gefährdeten Binnenmollusken (Weichtiere: Schnecken und Muscheln) in Niedersachsen, unveröffentlicht 68 vgl. http://www.wisia.de/FsetWisia1.de.html, besucht am 25.06.2015 ARSU GmbH, Oldenburg 22.03.2016 Anhang 4 – Seite 4 Artenschutzrechtlicher Fachbeitrag Verbreitung Die Flache Teichmuschel war früher sehr weit verbreitet. Ihre Bestände sind zurückgegangen aber sie zählt in Deutschland auch heute noch zu den weniger stark gefährdeten GroßmuschelArten (BAYERISCHES LANDESAMT FÜR UMWELT 2012c). Lebensraumansprüche und Verhaltensweisen Nach GLÖER & DIERCKING (2010) kommt die Flache Teichmuschel (Anodonta anatina) im Litoral ebenso vor wie im Potamal und Rhithral. Gemäß Artensteckbrief des BAYERISCHEN LANDESAMTES FÜR UMWELT (2012c) bewohnt sie das breiteste Spektrum an Gewässertypen und kommt in stehenden bis langsam fließenden, kleineren und größeren Gewässern mit sandigem bis schlammigem Untergrund vor. Vereinzelt wird sie auch auf Kiesgrund gefunden und besiedelt etwas schnellfließendere Bereiche als Anodonta cygnea (BAUMGÄRTNER & HEITZ 1995). Die Flache Teichmuschel wird ausgewachsen rund 8–10 cm (BAUMGÄRTNER & HEITZ 1995) oder sogar bis ca. 15 cm (BAYERISCHES LANDESAMT FÜR UMWELT 2012c) lang. Sie nutzt alle Gewässerbereiche, wird jedoch selten tiefer als acht Meter beobachtet. BAUMGÄRTNER & HEITZ (1995) berichten, dass sie neben der ruhigen Strömung von Bächen und Flüssen sowie durchströmten Teichen und Baggerseen auch Altwässer nutzt, die oft einen reichen Pflanzenwuchs aufweisen. In Hamburg bevorzugt sie aber Gewässer ohne submerse Vegetation (GLÖER & DIERCKING 2010). Der Entwicklungszyklus der Teichmuschel ähnelt dem der Malermuschel, die Fortpflanzung erfolgt jedoch im Herbst und die ca. 300.000–400.000 Glochidien werden erst im folgenden Jahr zwischen Januar und April ins Wasser abgegeben. Sie sind etwa 0,35 mm groß und können sich an Flossen oder Kiemen von Wirtsfischen anheften. Ihre parasitäre Phase dauert ca. zehn Tage bis vier Wochen. Nach ca. 2–4 Jahren sind die Jungmuscheln geschlechtsreif. Insgesamt kann die Flache Teichmuschel bis zu 15 Jahre alt werden. Als Wirtsfische von Anodonta anatina werden Bachforelle (Salmo trutta), Regenbogenforelle (Oncorhynchus mykiss), Flussbarsch (Perca fluviatilis), Rotfeder (Scardinius erythrophthalmus), Rotauge/Plötze (Rutilus rutilus), Döbel/Aitel (Squalius cephalus), Gründling (Gobio gobio), Güster (Blicca bjoerkna), Schleie (Tinca tinca), Hasel (Leuciscus leuciscus), Moderlieschen (Leucaspius delineatus), Aland/Nerfling (Leuciscus idus), Zander (Sander lucioperca), (Mühl-)Koppe/Groppe (Cottus gobio) und Dreistachliger Stichling (Gasterosteus aculeatus) genannt (GLÖER & DIERCKING 2010; BAYERISCHES LANDESAMT FÜR UMWELT 2012c). Vorkommen im Einflussbereich der beantragten Benutzung Bei den Untersuchungen von BIOCONSULT (2016b) wurde die Flache Teichmuschel (Anodonta anatina) 2013 weder in der Leine noch in der Ihme nachgewiesen, ihr Vorkommen kann jedoch nicht ausgeschlossen werden, zumal bei den ergänzenden Untersuchungen im Frühjahr 2014 eine Anodonta-Art in der Ihme (S-7) und in der Leine unterhalb von Herrenhausen bei Seelze (S3) mit 1,3 bzw. 1,0 Individuen/m² nachgewiesen wurde (BIOCONSULT 2014). Dabei könnte es sich um Anodonta anatina aber auch um Anodonta cygnea handeln. 69 nach den Angaben im Meldebogen 'Mollusken – Limnische Arten' der Erfassung von Tierarten in Niedersachsen, Stand 11/2014 (www.nlwkn.niedersachsen.de/download/21944/Suesswasserschnecken_und_-muscheln.pdf, Download vom 16.07.2015), der sich bezieht auf Jungbluth, J. H. (1990): Vorläufige 'Rote Liste' der bestandsbedrohten und gefährdeten Binnenmollusken (Weichtiere: Schnecken und Muscheln) in Niedersachsen, unveröffentlicht 22.03.2016 ARSU GmbH, Oldenburg Wasserrechtliches Erlaubnisverfahren für die Kraftwerke Herrenhausen und Linden Anhang 4 – Seite 5 Gewöhnliche Teichmuschel (Anodonta cygnea) Schutz- und Gefährdungsstatus Die Gewöhnliche Teichmuschel (Anodonta cygnea) ist eine nach der BArtSchV besonders geschützte Muschel-Art70, ist nach der Roten Liste Deutschland (JUNGBLUTH & KNORRE 2011) gefährdet (Kat. 3), ist in Niedersachsen gefährdet (Kat. 3 der Roten Liste)71. Verbreitung Angaben zur Verbreitung in Deutschland liegen nicht vor. Lebensraumansprüche und Verhaltensweisen Die Gewöhnliche Teichmuschel kann eine Länge von bis zu 20–25 cm und ein Alter von bis zu 30 Jahren erreichen. Sie ist limnophil und kommt vorwiegend im Litoral und Potamal von Seen, Altwässern, Baggerseen oder langsam fließenden, häufig auch gestauten Bereichen sommerwarmer Bäche und Flüsse vor. Ihre höchsten Bestandsdichten erreicht sie auf schlammig-feinsandigem Untergrund. Hinsichtlich der Wasservegetation zeigt sie keine Präferenz (BAUMGÄRTNER & HEITZ 1995; GLÖER & DIERCKING 2010; BAYERISCHES LANDESAMT FÜR UMWELT 2012d). Der Entwicklungszyklus von Anodonta cygnea gleicht dem der Flachen Teichmuschel. Im Gegensatz zu dieser ist die Gewöhnliche Teichmuschel aber zwittrig und die Befruchtung erfolgt bereits im Sommer. Im Frühjahr werden dann zwischen Februar und April etwa 200.000– 600.000 Glochidien ins Wasser abgegeben. Als Wirtsfische werden Bachforelle (Salmo trutta), Regenbogenforelle (Oncorhynchus mykiss), Flussbarsch (Perca fluviatilis), Brachse/Brasse/Blei (Abramis brama), Elritze (Phoxinus phoxinus), Laube/Ukelei (Alburnus alburnus), Hecht (Esox lucius), Rotfeder (Scardinius erythrophthalmus), Güster (Blicca bjoerkna), Hasel (Leuciscus leuciscus), Aland/Nerfling (Leuciscus idus), Zander (Sander lucioperca), (Mühl-) Koppe/Groppe (Cottus gobio) und Dreistachliger Stichling (Gasterosteus aculeatus) genannt (BAUMGÄRTNER & HEITZ 1995; GLÖER & DIERCKING 2010; BAYERISCHES LANDESAMT FÜR UMWELT 2012d). Vorkommen im Einflussbereich der beantragten Benutzung Bei den Untersuchungen von BIOCONSULT (2016b) wurde 2013 die Gewöhnliche Teichmuschel (Anodonta cygnea) weder in der Leine noch in der Ihme nachgewiesen, ihr Vorkommen kann jedoch – vor allem im gestauten Bereich der Ihme – nicht ausgeschlossen werden, zumal bei den ergänzenden Untersuchungen im Frühjahr 2014 eine Anodonta-Art in der Ihme (S-7) und in der Leine unterhalb von Herrenhausen bei Seelze (S-3) mit 1,3 bzw. 1,0 Individuen/m² nachgewiesen wurde (BIOCONSULT 2014). Dabei könnte es sich um Anodonta cygnea aber auch um Anodonta anatina handeln. 70 71 vgl. http://www.wisia.de/FsetWisia1.de.html, besucht am 25.06.2015 nach den Angaben im Meldebogen 'Mollusken – Limnische Arten' der Erfassung von Tierarten in Niedersachsen, Stand 11/2014 (www.nlwkn.niedersachsen.de/download/21944/Suesswasserschnecken_und_-muscheln.pdf, Download vom 16.07.2015), der sich bezieht auf Jungbluth, J. H. (1990): Vorläufige 'Rote Liste' der bestandsbedrohten und gefährdeten Binnenmollusken (Weichtiere: Schnecken und Muscheln) in Niedersachsen, unveröffentlicht ARSU GmbH, Oldenburg 22.03.2016 Anhang 4 – Seite 6 Artenschutzrechtlicher Fachbeitrag Abgeplattete Teichmuschel (Pseudanodonta complanata) Schutz- und Gefährdungsstatus Die Abgeplattete Teichmuschel (Pseudanodonta complanata) ist eine nach der BArtSchV streng geschützte Muschel-Art72, ist nach der Roten Liste Deutschland (JUNGBLUTH & KNORRE 2011) extrem selten und vom Aussterben bedroht (Kat. 1), ist auch in Niedersachsen vom Aussterben bedroht (Kat. 1 der Roten Liste)73. Verbreitung Der Hauptverbreitungsschwerpunkt der Abgeplatteten Teichmuschel ist Mitteleuropa und Deutschland trägt eine besondere Verantwortung für den Schutz und Erhalt dieser Art (BAYERISCHES LANDESAMT FÜR UMWELT 2012a). Lebensraumansprüche und Verhaltensweisen Die Abgeplattete Teichmuschel wird selten mehr als 8 cm lang und bis zu 20 Jahre alt. Sie ist rheo- bis limnophil und lebt in den wenig bewegten Bereichen mittlerer und größerer Flüsse (Strombuchten) und am Rand größerer Seen im Litoral und Potamal. Sie besiedelt vorzugsweise den feinsandigen bis schlammigen Gewässergrund in bis zu elf Metern Tiefe. Dort gräbt sie sich oft tief ins Substrat ein. Bereiche mit submerser Vegetation werden gemieden (BAUMGÄRTNER & HEITZ 1995; GLÖER & DIERCKING 2010; BAYERISCHES LANDESAMT FÜR UMWELT 2012a). Über Verbreitung, Ökologie und Entwicklungszyklus von Pseudanodonta complanata ist noch wenig bekannt. Die Art ist getrenntgeschlechtlich und die Befruchtung der Eier erfolgt von August bis Oktober. Sie produziert nur etwa 5.000–50.000 Glochidien, die zwischen Januar und April ins Wasser abgegeben werden. Als Wirtsfische werden Bachforelle (Salmo trutta), Regenbogenforelle (Oncorhynchus mykiss), Fluss- und Kaulbarschbarsch (Perca fluviatilis, Gymnocephalus cerna), Zander (Sander lucioperca) sowie Drei- und Neunstachliger Stichling (Gasterosteus aculeatus, Pungitius pungitius) genannt (BAUMGÄRTNER & HEITZ 1995; GLÖER & DIERCKING 2010). Die Jungmuscheln der Abgeplatteten Teichmuschel (Pseudanodonta complanata) sind besonders empfindlich gegenüber Eutrophierung (BAUMGÄRTNER & HEITZ 1995; BAYERISCHES LANDESAMT FÜR UMWELT 2012a). Vorkommen im Einflussbereich der beantragten Benutzung Bei den Untersuchungen von BIOCONSULT (2014, 2016b) wurde die Abgeplattete Teichmuschel (Pseudanodonta complanata) weder in der Leine noch in der Ihme nachgewiesen, ihr Vorkommen in strömungsberuhigten Bereichen kann jedoch nicht ausgeschlossen werden. 72 73 vgl. http://www.wisia.de/FsetWisia1.de.html, besucht am 25.06.2015 nach den Angaben im Meldebogen 'Mollusken – Limnische Arten' der Erfassung von Tierarten in Niedersachsen, Stand 11/2014 (www.nlwkn.niedersachsen.de/download/21944/Suesswasserschnecken_und_-muscheln.pdf, Download vom 16.07.2015), der sich bezieht auf Jungbluth, J. H. (1990): Vorläufige 'Rote Liste' der bestandsbedrohten und gefährdeten Binnenmollusken (Weichtiere: Schnecken und Muscheln) in Niedersachsen, unveröffentlicht 22.03.2016 ARSU GmbH, Oldenburg