Hinweis
Werbung

Hinweis
Bei dieser Datei handelt es sich um ein Protokoll, das einen Vortrag im Rahmen
des Chemielehramtsstudiums an der Uni Marburg referiert. Zur besseren
Durchsuchbarkeit wurde zudem eine Texterkennung durchgeführt und hinter das
eingescannte Bild gelegt, so dass Copy & Paste möglich ist – aber Vorsicht, die
Texterkennung wurde nicht korrigiert und ist gerade bei schlecht leserlichen
Dateien mit Fehlern behaftet.
Alle mehr als 700 Protokolle (Anfang 2007) können auf der Seite
http://www.chids.de/veranstaltungen/uebungen_experimentalvortrag.html
eingesehen und heruntergeladen werden.
Zudem stehen auf der Seite www.chids.de weitere Versuche, Lernzirkel und
Staatsexamensarbeiten bereit.
Dr. Ph. Reiß, im Juli 2007
o
. <).
Inhalt:
Philipps-Universität Marburg
Fachbereich Chemie
Ausarbeitung
zum chemischen Experimentalvortrag
gehalten am 13. Mai 1998
Thema:
OZON
(Sommersemester 1998)
1. Einleitung I Motivation
2. Zur Geschichte des Ozons I Entdeckung des Ozonlochs
3. Darstellung, Eigenschaften, Verwendung von Ozon
3.1. Darstellung
3.1.1. Thermische Erzeugung von atomarem Sauerstoff
3.1.2. Photochemische Erzeugung von atomarem Sauerstoff
3.1.3. Chemische Erzeugung von atomarem Sauerstoff
3.1.4. Elektrische Erzeugung von atomarem Sauerstoff
3.1.4.1. Ozonisator
3.1.4.2. Elektrolyse
3.2. Eigenschaften
3.3. Verwendung
4. Umweltaspekte der Ozonchemie
4.1. Ozon in der Stratosphäre
4.1.1. Die Atmosphäre der Erde
4.1.2. UV-Strahlung
4.1.2.1. Biologische Wirksamkeit von UV-Strahlung
4.1.2.2. Erhöhte UV-Strahlung
4.1.3. Bildung und Abbau von Ozon in der Stratosphäre
4.1.3.1. Chapman-Zyklus
4.1.3.2. (Natürlicher) katalytischer Abbau von Ozon
4.1.3.3 . Anthropogener katalyt ischer Abbau von Ozon
4.1.3.4. FCKW
4.1.4. Ozon-Loch"
4.2. Ozon in der Troposphäre - Sommersmogproblematik
4.2.1. Problemstellung: Photosmog - Los Angeles-Smog
4.2.2. Chemische Grundlagen
4.2.3. Gefährdung durch boden nahes Ozon
4.2.3.1. Übliche Konzentrationen I Geruch
4.2.3.2. Gesundheitliche Wirkungen
4.2.3.3. Richtwerte
5. Literatur
3
3
6
6
6
6
6
7
7
7
10
13
14
14
14
15
15
15
17
17
18
19
21
22
23
23
23
27
27
27
28
29
Verzeichnis der Versuche:
vorgelegt von
Gunter Kretschmann
Am Zuckerberg 13
35043 Marburg
Chemie in der Schule: www.chids.de
Versuch 1: Ozon durch Elektrolyse von wässriger Schwefelsäure
Versuch 2: Oxidative Eigenschaften des Ozons
Versuch 3: Entmangan isierung von Trinkwasser
Versuch 4: Absorpt ion von UV-Strahlung durch Ozon
Versuch 5: Zerstörung von Ozon durch halogenierte KW
Versuch 6: Abbau von Ozon durch Benzinbestandteile
Versuch 7: Wirkung von Ozon auf Pflanzen
2
8
11
13
16
19
25
28
1. Einleitung I Motivation
Die chemische Verbindung Ozon ist einer breiten Öffentlichkeit erst ungefähr in den
letzten 15 Jahren durch einschlägige Presseberichte bekannt geworden. Auch 1998
wird man wieder in Tageszeitungen oder Journalen folgende Schlagzeilen und
Fragen lesen können:
~
~
~
>
~
~
~
Sommersmog - Panikmache ist unverantwortlich
Konzepte zur Minderung bodennahen Ozons
Internationaler Tag zum Schutzder Ozonschicht...
Ozonloch 1998 noch grOßer
WelcheRolle spielt das Ozonbeim Smog?
Wird das Ozonaus den Auspuffrohrender Autos ausgestoßen?
Wie schadlich ist Ozon?
Doch bevor in der vorliegenden Arbeit versucht wird. eine Antwort auf die Aussagen
und Fragen zu geben, wird ein kurzer Blick auf die Geschichte der Ozonchemie
geworfen.
2. Zur Geschichte des Ozons I Entdeckung des Ozonlochs
Ozon wurde bewußt erstmals 1839 durch den Chemiker Christian Friedrich
Schönbein beschrieben, der beobachtet hatte, wie sich bei der Elektrolyse von
Wasser an der positiven Platin-Elektrode neben Sauerstoff ein weiterer, stechend
riechender Stoff bildete. Er gab ihm den Namen Ozon (gr. ozein = riechen).
1845 schloß Schönbein Ober das Auftreten des gleichen Geruches bei
Blitzeinschlägen auf das Vorhandensein von Ozon in der Atmosphäre,
Bei der Untersuchung des Sonnenspektrums, also des von der Sonne in den
verschiedenen Wellenlängenbereichen (Farben) ausgesendeten Lichtes, entdeckte
Alfred Comu 1878, daß Sonnenlicht einer Wellenlange von unter 300 nm am
Erdboden nicht registriert werden kann. Es war aber klar, daß die Sonne
ultraviolettes Licht ausstrahlt. Irgendeine Substanz, die in der Atmosphäre vorhanden
sein muß, ist also für die Absorption des Lichtes in diesem Wellenlängenbereich
verantwortlich. Dieser Stoff schirmt regelrecht den Erdboden gegen die solare UVStrahlung ab.
1880 berichtete der irische Chemiker Walter N. Hartley darüber. welche
Wellenlängen des eingestrahlten Lichtes durch ein Ozonmolekül aufgenommen
(absorbiert) werden können (er maß das sogenannte Absorptionsspektrum des
Ozons). Er fand heraus, daß Ozon schwerpunktmäßig Licht einer Farbe absorbiert,
die einer Wellenlänge von 265 nm entspricht. Damit war der irdische UV..
Schutzschirm identifiziert. Das atrnosphärlsche Ozon ist für die Absorption des
Sonnenlichtes im ultravioletten Bereich verantwortlich.
In den zwanziger und dreißiger Jahren des 20. Jahrhunderts wurde U.8. durch
Messungen von Gordon Oobson festgestellt, daß in der Atmosphäre eine Schicht von
Ozonmolekülen vorhanden ist, in der in einer HOhe von ca. 22 km die größte Anzahl
an Ozonmolekülen, das Maximum der Ozonschicht, zu finden ist.
1926 wurde in Arosa (Schweiz), mit Messungen der Ozondichte begonnen,
die bis heute fortgesetzt werden. Diese Daten sind die langste existierende Meßreihe
der stratosphärischen Ozondichte. Ironischerweise wurden diese Messungen
begonnen, um nachzuweisen, daß in den Bergen um Arosa besonders viel UVChemie in der Schule: www.chids.de
3
Strahlung vorhanden sei. In den zwanziger Jahren galten nämlich fast alle "Strahlen"
als der Gesundheit förderlich.
Sydney Chapman konnte 1930 mit seiner Arbeit "On Ozone and Atomic Oxygen in
the Upper Atmosphere" als Erster eine einfache Theorie vorlegen, wie es in einer
reinen Sauerstoffatmosphare zur Bildung von Ozon in der StratosphAre kommen
kann. Die wesentlichen Änderungen dieser Theorie in den nAchsten Jahrzehnten, die
durch die BerQcksichtigung von Wechselwirkungen zwischen Sauerstoff, Stickstoff,
Wasserstoff und letztlich Chlor und anderen Ozon-Killersubstanzen erfolgte, ändert
nichts an der prinzipiellen Gültigkeit des Verständnis von Chapman über die OzonBildung. Dieser Prozess wird in dem Kap. 4.1.3.1. Chapman-Zyklus
beschrieben.
P.J. Crutzen und H.S. Johnston führten 1971 die Chemie der Stickoxide in die
Theorie der Ozonschichtbildung ein. Stickstoffoxide sind natOrlich in der Atmosphäre
vorhanden und sind in der Lage. Ozon zu zerstören. Diese Form der natürlichen
Ozonzerstörung
steht
aber
im
Gleichgewicht
mit
natürlichen
Ozonproduktionsmechanismen, so daß die natür1ichen Stickoxide für die
Ozonschicht keine Gefahr darstellen. Ein künstlicher zusätzlicher Eintrag von
Stickoxiden kann aber das Ozongleichgewicht durch zu große einseitige
Ozonverluste durch die Stickstoffoxide erheblich gefährden.
1974 wiesen Mario Molina und Sherwood Rowtand in einem Artikel in der
Zeitschrift Nature erstmals auf die Zerstörung der Ozonmoleküle in der Atmosphäre
durch Chlor-Atome hin. Das Chlor entsteht danach als Abbauprodukt aus künstlichen
Treibgasen und anderen chemischen Stoffen aus menschlichen Quellen direkt in der
Ozonschicht und kann dort sofort die OzonmolekOle angreifen und zerstören.
Die Entdeckung des Ozonloches über dem Südpol
Ab November 1978 wurde an Bord des Wettersatelliten Nimbus 7 das
Ozonmeßgerät TOMS (Total Ozone Mapping Spectrometer) eingesetzt. Es lieferte
erstmals globale und fast tagliche Meßdaten über den ZUstand der Ozonschicht vom
Weltraum aus. Trotz der globalen Überwachung seit 1978 ergab die Auswertung der
rOMS-Daten jedoch bis in das Jahr 1985 hinein keinertei Anzeichen eines
eventuellen Ozonloches. Wie aber heute bekannt ist, trat das Ozonloch mindestens
seit Ende der siebziger Jahre regelmaßig auf. Warum wurde es von TOMS also
zunächst nicht registriert?
Nun, eigentlich waren die Informationen in den TOMS-Meßdaten tatsächlich
vorhanden. Sie wurden jedoch schlicht nicht bemerkt, da die riesigen Datenmengen,
bevor sie irgendein Mensch zu Gesicht bekam, von einem Computer automatisch
vorausgewertet werden mußten. Bei dieser automatischen Datenauswertung wurden
durch den Computer bis 1985 extrem niedrige Werte als angebliche Meßfehler
ausgesondert. Durch die Computer-Routine sollte vermieden werden, daß
''fehlerhafte'' Ergebnisse des TOMS-Gerates die Meßreihen ungeWOnscht
verfälschen. Niemand hatte in der Atmosphäre solch niedrige Werte. wie sie in einem
Ozonloch auftreten können. real erwartet, und entsprechend hoch war die untere
Grenze für "korrekte" Meßwerte in dem Computerprogramm gesetzt worden. Ware
diese Grenze niedriger angesetzt worden. hAtte das Ozonloch mittels rOMS bereits
Anfang der achtziger Jahre entdeckt werden können. Aber es kam anders. Die
NASA-Wissenschaftler überprüften erst ihre Daten. nachdem 1985 von anderer Seite
Belege für ein Ozonloch vorgelegt wurden.
."
Erst im Winter 1981 fiel dann dem britischen Wissenschaftler Joseph Farman bei
seinen Messungen über der britischen Antarktisstation Halley Bay das Ozondefizit
dieses Jahres auf. Als er daraufhin nochmals diese Beobachtungen mit "seinen
4
Aufzeichnungen der früheren Jahre verglichen hatte. erkannte er, daß sich das
stratosphärische Ozon bereits seit mehreren Jahren ausdünnte, und zwar verstärkt
immer in den Frühjahrsmonaten des Südpols. Von Frühjahr zu Frühjahr waren in der
Regel zunehmend größere Ozonverluste zu bemerken.
Da jedoch Anfang der achtziger Jahre in der wissenschaftlichen Literatur nicht von
Ahnlichen Beobachtungen berichtet wurde, u.a. auch nicht von der NASA, deren
TOMS-Gerät eigentlich eine hervorragende Beobachterposition hatte. traute Farman
seinen Messungen und deren Interpretation zunächst noch nicht. Sie schienen ihm
für eine wissenschaftliche Veröffentlichung noch nicht gesichert genug zu sein.
Im Frühjahr 1984 ergaben dann die Messungen von einer zweiten britischen
Forschungsstation aus, daß die Ozondichten über der Südspitze von Argentinien
ebenfalls ungewöhnlich niedrig waren. Das Ozonloch hatte nun solche
geometrischen Ausmaße angenommen, daß es sich erstmals in diesem Frühjahr
zeitweise bis hin nach Feuerland erstreckte.
1985 teilte daraufhin Joseph C. Farman in der Fachzeitung Nature die Entdeckung
des Ozonloches über der Antarktis mit. Diese Mitteilung erreichte zwar später den
Rang einer wissenschaftlichen Sensation, wurde aber nicht sofort von der
wissenschaftlichen Öffentlichkeit bemerkt.
Erst 1985 und nicht schon 1981 oder 1982 erfuhren die TOMS-Wissenschaftler
der NASA also von Farmans Entdeckung und sahen sich daraufhin noch einmal die
Meßdaten von TOMS an. Sie erkannten, daß die automatische Routine zur
Aussortierung von "Meßfehlem" (s.o.) die Entdeckung des Ozonloches verhindert
hatte. Nach ihrer Beseitigung zeigten auch die TOMS-Daten deutlich das Ozonloch
am Südpol. Damit wurde 1985 endlich klar: der Abbau der Ozonschicht hatte das
Maß eines planetarischen Problems erreicht.
Für die Untersuchung
der
chemischen
Mechanismen,
welche
die
Ozonschichtbildung und -zerstörung bedingen, wurde 1995 Crutzen, Molina und
Rowtand der Chemie-Nobelpreis mit der Rechtfertigung verliehen, daß die
Zerstörung der Ozonschicht ein globales Umweltproblem darstellt, welches
katastrophale ökologische Konsequenzen zur Folge haben kann.
3. Darstellung, Eigenschaften, Verwendung von Ozon
3.1. Darstellung
Ozon wird ganz allgemein durch die Einwirkung von atomaren Sauerstoff auf
molekularen Sauerstoff dargestellt.
o
%02(g)
o
(g)
+
02(g)
(g)
+ 249,3 kJ/moi
03 (0)
•
106,5 kJ/mol
03(g)
+
142.8 kJ/mol
Die verschiedenen Bildungsweisen unterscheiden sich dabei in der Art und Weise
der Erzeugung von Sauerstoffatomen. Die Spaltung der Sauerstoffmoleküle kann
z.B. durch Zufuhr a.) thermischer b.) photochemischer c.) chemischer oder d.)
elektrischer Energie erzwungen werden.
3.1.1. Thermische Erzeugung von atomarem Sauerstoff
A
02
---+
2 0 + 498,6 kJ/mol
Die thermische Methode führt nur zu sehr geringen Ozonausbeuten, da eine
erhOhte Temperatur gleichzeitig den endothermen Zerfall begünstigt. Demgemäß
bilden sich beim Erhitzen von Sauerstoff auf hohe Temperaturen praktisch nur
Sauerstoffatome.
3.1.2. Photochemische Erzeugung von atomarem Sauerstoff
hv
02
---+
2 0 + 498.6 kJ/mol
Ä < 242nm
Tab.:
1839
1845
1878
1880
I
1920
1930
1971
1974
ab
1978
1995
Übersicht zur Geschichte des Ozons
Christian Friedrich Schönbein
Elektrolyse von Wasser => Stechend riechender Stoff; gr. ozein
Blitzeinschläqe, gleicher Geruch => Ozon in der Atmosphäre
Alfred Comu; Untersuchung des Sonnenspektrums
Substanz in Atmosphäre ee Absorption von Ar < 300nm
Identifikation des Ozons als irdischer UV-Schutzschirrn
Gordon Dobson; Messungen des Ozongehalts in Atmosphäre
Sydney Chapman "On Ozone and atomic oxygen in the upper atmosphere"
Paul Crutzen: Einfluß der Stickstoffoxide zum Ozonhaushalt
Mario MoHna I Sherwood Rowland: Zerstörung von Ozon durch Chloratome
Bei Zufuhr von Lichtenergie ist die Spaltung des Sauerstoffmoleküls über
photochemische Reaktionen nur mit kurzweiligem Ultraviolett der Wellenlänge
<242nm (Energiewert des Lichtäquivalents: >499 kJ) möglich. Vgl. alltägliches
Prinzip: Höhensonne im Solarium.
3.1.3. Chemische Erzeugung von atomarem Sauerstoff
Außer dem molekularen Sauerstoff kOnnen auch andere sauerstoffhaltige Stoffe
zur Gewinnung der für die Ozonbildung notwendigen Sauerstoffatome benutzt
werden.
Entdeckung des anthropogenen Ozonlochs durch Wettersatelliten
Chemie-Nobelpreis für Crutzen I MoHna I Rowland
laßt man Fluor auf Wasser einwirken,
·1
2 HF
Chemie in der Schule: www.chids.de
5
6
0
(aq)
+ 0
)
so bildet sich auch atomarer Sauerstoff. Daher ist der so entwickelte Sauerstoff - bei
Abwesenheit oxidierbarer Substanzen - stets ozonhallig. Gleiches gilt von dem bei
der Zersetzung leicht zerfallender Sauerstoffverbindungen entstehendem Sauerstoff:
Bsp.: Zersetzung von Peroxiden
·1
Ba02 (s) + H2S04 (I)
-+
·2
0
BaSO.. (s) + H20 (I) + 0
3.1.4. Elektrische Erzeugung von atomarem Sauerstoff
Versuch 1: Ozon durch Elektrolyse von wassriger Schwefelsäure
Gerate (vgl. Abb.):
Hofmannscher
Wasser-Zersetzungsapparat
mit
möglichst
großfli~chigen
Platinelektroden, Spannungsquelle, Voltmeter, 4 Strippen, PVC-Schläuche (besser:
Silikonschlauche), Kolbenprober mit Dreiwegehahn, Pasteurpipette aus Glas oder
ausgezogenes Glasrohr.
Chemikalien:
Schwefelsaure (c = 5 moll1) (Xi).
3.1.4.1. Ozonisator
Die Zufuhr von elektrischer Energie erfolgt besonders bequem im ,Siemens'schen
Ozonisator" (vgl. folgende Abb.). Dieser besteht im Prinzip aus zwei ineinander
gestellten (koaxialen), metallbeschichteten Glasrohren, deren Außen- bzw.
Innenwand mit Wasser gekühlt und mit den Enden mit Hochspannungsklemmen
eines Transformators leitend verbunden ist. In dem engen Ringraum zwischen den
Glasrohren treten bei Anlegen einer niederfrequenten Spannung (5D-SOOHz; 1020kV) ,stille' elektrische Entladungen auf, durch welche ein trockener Sauerstoffoder Luftstrom (1-2bar) geleitet wird. Das den Ozonisator verlassende Gasgemisch
besteht, wenn von reinem Sauerstoff ausgegangen wird. im besten Falle zu 15% aus
Ozon. Für Ozon-Untersuchungen gereinigtes Ozon in Stickstoff erhält man, indem
man das aus der elektrischen Entladung stammende Roh-Ozon bei -78°C an
grobem Kieselgel adsorbiert (Blaufärbung) und dann mit Stickstoff unter
Erwärmenlassen wieder austreibt.
Dieses hergestellte Ozon wird in den Versuchen V2 bis V7 verwendet.
a a
Abb. Siemens'scher Ozonisator
Abb.: Apparatur zur Ozongewinnung
Durchführung:
Man elektrolysiert die SchwefelsAure in der Apparatur, bei ca. 10-15 Volt
Gleichspannung. Während der Elektrolyse muß ab und zu der Wasserstoff
abgelassen werden, deshalb sollte ständig die Gasentwicklung beobachtet werden.
Die ozonhallige Gasmischung wird mit einem Kolbenprober entnommen oder über
den Dreiwegehahn direkt in die Reaktionsgefäße eingeleitet.
Anmerkung:
a.) Das Ozon kann nicht bis zum nächsten Tag aufbewahrt werden, da es nicht allzu
lange stabil ist.
b.) Bei höheren Spannungen wird die Schwefelsaure zu heiß, die Ausbeute an Ozon
nimmt wieder ab.
Nachweise:
Für jeden Nachweis sind mindestens 10-20 ml ozonhaltiges Gas erforderlich, die
man langsam in die Gefäße oder Lösungen einleitet. Die Versuche werden so
durchgeführt, daß ein Vergleichsansatz ohne Ozon die Reaktion erkennen hilft.
(1) Kathode
3.1.4.2. Elektrolyse
Zunächst soll jedoch mit der Methode der Elektrolyse beschrieben werden. wie Ozon
auch ohne Hochspannung (bspw. für die Schulchemie) hergestellt werden kann.
Chemie in der Schule: www.chids.de
7
Man füllt das an der Kathode entstandene Gas in ein Reagenzglas (1=10cm) und
entzündet mit einem Feuerzeug. => ,Knallgasprobe' positiv.
8
)
(2) Anode
3.2. Eigenschaften
ANODENGAS
a.) Man mischt 5 ml Kaliumiodidlösung (w=O,01) mit 1 ml Stärkelösung (w=O,05,
durch Aufkochen von löslicher Stärke mit dest. Wasser hergestellt) in einem
Reagenzglas und leitet das Anodengas ein. ::::) Die Lösung färbt sich je nach
Ozongehalt sofort blau bis tiefdunkelblau.
ß.) Man pustet einen Luftballon auf. Anschließend leitet man etwas Anodengas auf
die Ballonhülle. => An der Stelle, wo das Gas auftrifft, trübt sich der Ballon
augenblicklich und färbt sich weiß. Dann platzt der Luftballon. (Vorsicht: KnaUl)
FLÜSSIGKEIT AUS DEMANODENRAUM
Man entnimmt aus dem Anodenraum etwa 2ml (farblose) Flüssigkeit in ein
Reagenzglas und fügt eine (farblose) Titanoxidsulfatlösung (w=O,025) hinzu. =:> Ein
gelber Farbumschlag ist zu beobachten.
Erklärung:
Reaktionen an der
Kathode (-)
Ozon wird auch als Trisauerstoff, Trioxygen oder auch in der Summenformel als
03 bezeichnet. Es ist die allotrope Modifikation des Sauerstoffs (Allotropie =
Auftreten eines Elements in verschiedenen Formen im gleichen Aggregatzustand.)
Physikalische Eigenschaften:
M(03)= 48,00 glmol. Farbloses, außerst giftiges Gas, Dichte 1,65 (Luft
Litergewicht2,143g. Dunkelblaue Flüssigkeit (Dichte 1,571 ; -183°C),
Siedepunkt -111 ,9°C oder schwarzblaue Kristalle Schmelzpunkt -192,5°C.
100ml Wasser lösen bei O°C 49,4ml Ozon.
=
+
Ö
~,
10
-
H20
(g)
"KnallgasprobelI, stark exotherm
02
(ads)
+
r(aq)
b (aq)
+ 2 H30+(aq) + 2 e·
+ 4 H30 +(aq) + 4 e-l
02 (ads)
Nachweis:
2
(ads)
+ 0 3 (g) + H20(l)
+ Stärke
..
..
sp2-hybridisiert
ist
und
annähernd
ein
Achtung! Achtung! Achtung! Achtung! Achtung! Achtung! Achtung! Achtung! Achtung!
lod-Stärke-Komplex (aq)
(blau-schwarz)
(aq)
(Q
0
Die oxidativen Eigenschaften sollen in Versuch 2 gezeigt werden. Das Ozon wird wie
in Kap. 3.1.4. 1. hergestellt.
(bzw, Polyiodide)
Nachweis:
H2 S20 a(aq) + 2 H20
jedes
Ozon zerfällt spontan nach 03 --+ 02 + %02
Ozon ist neben Fluor das stärkste bekannte Oxidans.
03 bildet mit einigen Metallen Ozonide, oxidiert fast alle Metalle zu ihrer höchsten
Oxidationsstufe (Ausnahme Au, Pt, Ir), Sulfide zu Sulfaten und Ammoniak zu
Salpetersaure etc.
Viele organische Farbstoffe werden durch 03 gebleicht, GummischlAuche zerstört,
Ether, Alkohol, Schliff-Fette ggf. entflammt.
Bildungvon a.) Ozon und b.) PeroxodischwefelsSure
o (ads)
...-.
0'~~
Daraus ergibt sich, daß
Bindungswinkel von 120°.
Anode (+)
o
1) und
Der Geruch des Ozons (Name von griech.: ozein
nach etwas riechen) wird je
nach Konzentration als Nelken-, Heu-, Chlor-ähnlich oder als nach Stickoxiden
riechend beschrieben und ist etwa ab O,01ppm wahrnehmbar. Eine irrige Annahme
ist, daß Waldluft besonders ozonhaltig sei - dort ist der Gehalt an Ozon nicht, wohl
aber derjenige an (oxidierten) Terpenen höher als in anderer Freilandluft.
03 kann in mehreren Resonanzstrukturen vorliegen:
Bildungvon Wasserstoff
Nachweis:
H2(g} + % 02(9)
=
Für die Herstellung von Ozon mittels Ozonisator ist eine besondere
Betriebsanweisung (Gerät und Kältemittel) erforderlich. Ozon wird an grobem
Kieselgel in einem U-Rohr bei -78°e adsorbiert. Dazu wird das Kältemittel in einem
entsprechend großem Dewar (Mischung CCI4 : CHCI3 = 1 : 3) mit flüssigem Stickstoff
heruntergekühlt und die Temperatur durch Trockeneis gehalten. Das Ozon kann für
die Versuche 012 bis V7) unter ErwArmenlassen mit gasförmigen Stickstoff (Bombe)
zum Reaktionsort (=Gaswaschflasche) ausgetrieben werden.
H20 2 (aq) + 2 H2S0 4(aq) Hydrolysereaktion
-1
-1
-2
+ S04 2-(aq) + H202(aq)---I·~Ti(02)2+(aq) (gelb) + S04 2-(aq) + H20 (I)
Chemie in der Schule: www.chids.de
9
10
)
Versuch 2: Oxidative Eigenschaften des Ozons
Mechanismus fOr b.)
Geräte:
.Ozonapperatur" bestehend aus:
N2-Bombe mit Druckminderer
U-Rohr mit an Kieselgel adsorbierten Ozonin Dewar (Käitemittel)
Gaswaschflaschen
PVC-Schlauchsystem, Rückleitung in Abzug
Stativmaterial
o
H
R
N
'c=C\
R
N
H
o
INDIGOCARMIN
blau
H
Chemikalien:
a.) SOml ~[Fe{CN)6]-Lsg. w=O,05
farblos-gelb
b.) SOml Indigocarmin-Lsg. w=O,OO5 tiefblau
0
R
N
Durchführung:
Man leitet das Ozon durch das PVC-Schlauchsystem in die Gaswaschflaschen mit
den Lösungen a. und b. =:> Beobachtung: a. färbt sich intensiv gelb/rot und b. wird
farblos.
'c\
R
o
..
c
/\
~
0-0-0
Erklärung:
H
N
a.)
+2
'c/
0
2 [Fe(CN)s]4- (aq) + 03 (9) + H20
+3
""'r-c
0--0
R
+ 2 OH- (aq)
(g)
\
o
(I)
-2
2 [Fe(CN)s]3- (aq) + 02
0
0
R
+HOH
•
N
H
(gelb)
R
b.)
+2HOH
..
0
H
N
'c=C\
R
R
N
+03.+H20~
----.... 2
C=O
-H20 2
INDIGOCARMIN
blau
R
~
H
0
- HOOH
H
0
ISATIN
farblos-gelb
..
2
R
o
2
R
o
ISATIN
gelb
Chemie in der Schule: www.chids.de
11
12
)
3.3. Verwendung
4. Umweltaspekte der OzonchemIe
Techn isch erzeugtes Ozon wird z.B. verwendet fClr:
4.1. Ozon In der Stratosphäre
~ Chemische Synthesen (Ozonolyse, wie in Versuch 2b)
4.1.1. Die Atmosphäre der Erde
~
für Bleichprozesse
~ Luftverbesserung
Abbau von Geruchsstoffen in der Abluft (Kläranlagen)
~ Entkeimen der Luft
~ Desinfektion
Theater , Schulen, Krankenhäuser, KühlrAume, Brauereien ...
~ Behandlung von Schwimmbadwasser
~ Trinkwasseraufbereitung (siehe Versuch 3)
Die stockwerkartige Struktur der Atmosphäre ist in der folgenden Abb ildung
schematisch dargestellt. Sie ist unterte ilt in die Troposphäre (0 bis ca. zwischen 12
und 18 km), die Stratosphäre in einer Höhe zwischen ca. 15 und 50 km, die
Mesosphare (50 bis 100 km), die Thermosphäre (100 bis wenige hundert km) und
darüber die Exosphäre.
km
Polarlicht
EXOSPHÄRE
Versuch 3: Entmanganisierung von Trinkwasser
800
600
~~~
~ ~~~
Ionosphäre
400
Geräte :
siehe Versuch 2
Chemikalien :
50ml MnS04-Lsg . w=O,05 farblos
THERMOSPHÄRE
Mesopause
Durchführung: siehe Versuch 2
MESOSPHÄRE
Beobachtung :
Die LOsung färbt sich braun. Nach etwa 10min setzt sich ein brauner Niederschlag an
den Wänden der Gaswaschflasche ab.
Erklärung :
+2
STRATOSPHÄRE
Tropopause
+4
0
2
Stratopause
Mn + (aq) + 03
farblos
(g)
+ 3 H20
(I)
Mn02 (s) + 02 (g)
braun
TROPOSPHÄRE
200
100
80
60
40
-----
leuchtende
Nachtwolken
....::;;
10
8
6
4
J.
---.....
' \------~ ------Meteor
~
Ozonschicht
20
~
Polarlicht I ~
Ozonosphäre
Perlmutter-Wolken
----- - - - - -.--------
2
1
Meereshöhe
0 ~=:::~~~:E~=:-""""'----=~~~-
Jeder dieser Atmosphärenbereiche zeichnet sich durch spezifische Eigenschaften
aus, auf die hier nicht weiter eingegangen werden kann . Beispiele mögen genügen:
Die Exosphäre ist der unscharfe Übergangsbereich zwischen Atmosphäre und
Weltraum, fClr den sich eine eindeutige obere Grenze nicht angeben läßt. In der
Thermosphäre - und etwas tiefer - treten u.a. die Polarlichter auf. Die Mesosphäre
enthalt etwa eine Schicht von Natrium-Atomen, die durch hier verglühende
Meteoriten dort deponiert werden . An der oberen Grenze der Mesosphäre beginnt für
Raumschiffe die Rückkehr in die dichtere Atmosphäre. In der Stratosphäre befindet
sich die Ozonschicht. Und in der Troposphäre schließlich läuft das den Menschen
bewußt werdende Wettergeschehen ab. Die Dienste der Bereiche oberhalb der
Troposph äre werden den meisten Menschen nicht offenkundig. Die Bedeutung der
Chemie in der Schule: www.chids.de
13
14
)
Ozonschicht in der Stratosphäre ist aber in den letzten Jahren vermehrt ins
Bewußtsein der Öffentlichkeit gelangt.
(C02) verbraucht. Massive Störungen der Planktonmengen kOnnten Auswirkungen
auf den COz-Haushalt der AtmosphAre haben und den Treibhauseffekt verstärken.
4.1.2. UV-Strahlung
... Pflanzen. Einfluß auf die Landwirtschaft:
4.1.2.1. Biologische Wirksamkeit von UV-Strahlung
Pflanzenuntersuchungen
Abhängigkeiten:
Die solare UV-Strahlung ist ein Teil des solaren Spektrums, also der Strahlung,
die die Sonne aussendet. Der UV-Bereich wird nach seiner biologischen Wirksamkeit
in drei Bereiche eingeteilt:
UV-A
UV-B
UV-C
320 - 400 nm (biologisch relativ unkritisch)
290 - 320 nm (biologisch kritisch)
< 290 nm
(biologisch extrem kritisch)
Über einen Wellenlängenbereich im solaren UV-Spektrum, der von etwa 200 bis zu
325 nm reicht. ist Ozon der wesentliche UV-Fitter der Erde. Interessanterweise ist die
DNA, das genetische Ertmaterial aller Lebewesen, gerade gegenüber Strahlung
dieser Wellenlangen am empfindlichsten!
Die sogenannten DNA-Moleküle (Desoxyribonukleinsäure), die die genetischen
Erbinformationen in jeder Zelle eines jeden Lebewesens enthalten, sind völlig auf
den UV-Schutz durch die Ozonschicht angewiesen. Denn gerade in dem
Wellenlängenbereich der solaren UV-Strahlung, die durch das Ozon herausgefiltert
wird, besitzen die DNA-Moleküle eine stark erhöhte Empfindlichkeit gegen diese
Strahlung. Nur durch den Schutz der Ozonschicht ist sichergestellt, daß die DNA
nicht zerstört wird.
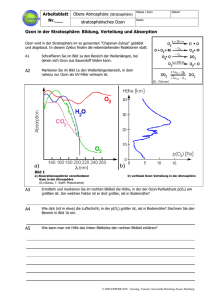
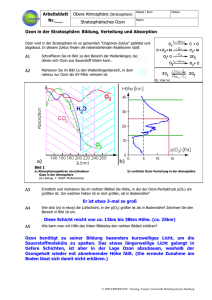
Versuch 4: Absorption von UV-Strahlung durch Ozon
Geräte: siehe Versuch 2 ohne Gaswaschflasche. Zusätzlich
Abzug, UV-Handlampe (Wellenlänge 254 nrn), weißes Papier (oder mit optischen
Aufhellem gewaschene, weiße Textilie) als Fluoreszenzschirm, Glastrichter (0
-15cm) mit PVC-Schlauch als Ableitung in Abzug
--.
Ozon
Eine erhöhte UV-Strahlung, bedingt durch Ozonreduzierung in der Stratosphäre,
hätte folgende Konsequenzen auf
>
~
>
>
Hautkrebs (Melanome)
Gutartige Geschwülste (Nicht-Melanome)
Vorzeitige Alterung der Haut
Katarakte und andere Augenkrankheiten
A:
\"j:Pier
Abzug
t
UV-Lampe
Durchführung:
Man beleuchtet im dunklen Raum mit einer UV-Lampe (Wellenlänge 254 nm) ein
weißes Schreibmaschinenpapier. Dieses dient als Fluoreszenzschirm. Man bläst
direkt vor das Blatt in den Strahlengang Ozon.
würden zunehmen.
Beobachtung/Erklärung:
.
Ozon läßt kaum UV-Strahlung durch, so daß das Ozon (weil keine Fluoreszenz mehr
angeregt wird) einen Schatten in Form von "rosa Wölkchen" wirft.
... das maritime Leben:
Das maritime Leben nahe der Oberfläche der Ozeane ist sehr empfanglich für UVSchädigung. Das Plankton - einzellige Organismen, die frei an der Meeresoberfläche
schweben - ist besonders sensitiv. Klein-Lebewesen. wie Jungfische, Krebse und
Shrimps, die an der Oberfläche und in flachen Küstengebieten leben sind ebenfalls
verletzlich. Diese Organismen bilden die Basis der ozeanischen Nahrungskette.
Daher können erhöhte Intensitäten des UV-B das gesamte ozeanische Ökosystem
stören. Dies wiederum kann die Verfügbarkeit von Fisch und anderen Nahrungsmittel
aus den Ozeanen für den Menschen beeinflussen.
Plankton ist daneben eine der bedeutendsten Quellen des atmosphärischen
Sauerstoffes. Zur Produktion des Sauerstoffes wird atmophärisches Kohlendioxid
Chemie in der Schule: www.chids.de
prinzipiell folgende
1. Die ErtrAge werden zunächst bis zu Ozonverlusten von etwa -3 0A, besser, da die
Pflanzen mehr Energie in Form von UV-Licht erhalten.
2. Der Ertrag nimmt bei Ozonverlusten von -40% drastisch ab.
3. Der Proteingehalt erhöht sich mit zunehmender UV-Belastung.
4. Die Kohlenhydratgehalte nehmen mit zunehmender UV-Belastung ab.
5. Die Reaktionen verschiedener Pflanzen sind unterschiedlich.
6. Die allgemeine Widerstandskraft gegen Krankheiten erhöht sich mit
zunehmender Belastung.
4.1 ~2.2. Erhöhte UV-Strahlung
... den Menschen:
nach UV-Bestrahlung lieferten
15
16
)
4.1.3. Bildung und Abbau von Ozon in der Stratosphäre
4.1.3.2. (Natllrllcher) katalytischer Abbau von Ozon
4.1.3.1. Chapman-Zyklus
.Zunächs t: N2, C02 und H 20 sowie die Spurengase CH 4 und N20 reagieren nicht
mit Ozon, kommen also direkt als Senken nicht in Frage.
Man weiß aber, daß u.a. CI, NO und OH, auch H oder Sr - diese Atome und
Moleküle sind alle in der Stratosphäre nachgewiesen worden - mit 0 3 in einer Weise
reagieren, daß sie selbst unverändert nach der Umwandlung von 03 in O2
zurückb leiben, also als Katalysatoren wirken, und dann erneut für weitere Reaktionen
zur Verfügung stehen.
In den 30er Jahren postulierte Sidney Chapman, daß in der höheren Atmosphäre
ein dauernder Ab- und Abbau von Ozon stattfinden müßte.
A. < 242nm
Ozon-
1---=----
Bildung
~
A. > 242nm
Ozon-
Abbau
Äl < 242nm
02
~
0+0
0 + 02
~
03
SENKEN für Ozon:
x·=
Ä2 > 242nm
03
0 3+ 0
302
~
O2+0
~
2 O2
+hv, - dH
4
~
+ hV2
.OH
CI.
XO· =
HO~
CIO·
Herkunft: .Lachqas''
von X
Wasserdampf
Chlormethan
hv
CH3CI - .
.NO
203
2.NO
2.0H
,
03 wird also ständig aus 02-molekülen aufgebaut und zu Oz-Molekülen abgebaut .
Der Ozon-Gehalt wird also in einem dynamischen Gleichgewicht gehalten.
Aufgrund der bekannten Reaktionen des Chapman-Zyklus laßt sich mit Kenntnis der
Geschwindigkeiten der Reaktionen die Lage des Gleichgewichtes und damit der zu
erwartende Ozongehalt berechnen. Qualitativ stimmen die Rechenergebnisse recht
gut mit den Befunden überein: Es gibt ein Maximum bei ungefähr 30km Höhe über
dem Erdboden. Aber quantitativ liegen die tatsächlich gemessenen Ozon-Geha lte
um ca. eine Zehnerpotenz niedriger als die Werte, die sich nach dem ChapmanMechanismus errechnen lassen . Als Erklärung bleiben weitere chemische
Reaktionen aus Atmosphärengasen , die für den Ozon-Vertust verantwortlich sein
müssen.
Chemie in der Schule: www.chids.de
17
Distickstoffmonoxid, .Lachqas":
N20 entsteht überall dort, wo in einem feuchten Milieu Bakterien Biomasse
zersetzen . Diese langlebige Stickstoffverbindung (Lebensdauer ca. 1508) wird im
wesentlichen durch die Aktivitäten von nitrifizierenden und denitrifizierenden
Mikroorganismen in Böden sowie im Meerwasser und in Seen auf den Kontinenten
gebildet. N20 ist in der erdnahen Lufthülle chemisch inert. Es gibt in der Troposphäre
praktisch keine chemische Reaktionen , durch die N2Ü abgebaut wird . Deshalb
kommt als einzige Senke die Stratosphäre in Frage. Im Prinzip sind folgende
Abbaureaktionen bekannt: N20 reagiert mit atomaren Sauerstoff 0, oder es wird
durch Photolyse direkt zersetzt.
18
)
Wasserdampf:
Der in der Stratosphäre vorkommende Wasserdampf reagiert mit atomaren
Sauerstoff 0 zu Hydroxylradikalen OH, die Ozon katalytisch abbauen können.
Chlormethan:
Im Prinzip müssen als CI-Quellen alle Chlorverbindungen mit ausreichend langer
atmosphärischer lebensdauer in Betracht gezogen werden. Die wichtigste CI-Quelle
ist Chlormethan (CH3CI, lebensdauer 1a), das aus biologischen Prozessen im
Ozean stammt und bei der Verbrennung von Biomasse entsteht.
Für X=CI liefert das o.a. Schema den erstmals 1974 von Molina und Rowland
beschriebenen CIOeZyklus.
Die wichtigsten anthropogenen CI-Quellen sind die Fluorchlorkohlenwasserstoffe
(FCKW), für die keine bedeutenden natürlichen Quellen bekannt sind.
Versuch S soll zeigen, wie am Beispiel Chloroform die FCKW Ozon abbauen und
dadurch das Ozonloch (siehe unten) entsteht. Die Ozonzerstörung basiert auf dem
Mechanismus, der in Kap. 4.1.3.2. beschrieben ist.
~
CI.
+
03
-+
0
-+
Chlor-Katalyse-Zyklus
Entstehung von Säuren und Säurebildnern:
HCI + HO.
CI.
Geräte:
siehe Versuch 2. Zusatz/ich
Schliffstopfen NS29 für Gaswaschflasche, pH-Elektrode mit Anzeigegerät, Pipetten,
Reagenzglas, Reagenzglasgestell mit schwarzem Hintergrund, im Abzug
Chemikalien:
Denkbare Reaktionen sind:
[CIO.+
4.1.3.3. Anthropogener katalytischer Abbau von Ozon
Versuch 5: Zerstörung von Ozon durch halogenierte
Entstehung von Chlor- und Chloroxoradikalen wie CI. oder CIO.
+ CI.
-+
Disproportionierung von Chlor:
o
SOml CHCI3, AgN0 3 w=O,01, HN03 w=O,3
Nachweis:
CI2
+ H20
-=-
·1
>
pH-Änderung
>
Ag·
(aq)
+
cr (aq)
-=- AgCI-I..(s) weißer Nd.
+1
HCI + HCIO
Durchführung:
Man mißt den pH-Wert der Chloroform-lOsung, leitet anschließend Ozon ein,
schüttelt und mißt erneut den pH-Wert. Danach macht man die Lösung salpetersauer
und gibt 3 Tropfen SilbernitratiOsung hinzu und schüttelt um. Man führt eine mit Ozon
unbehandelte Blindprobe nur mit Chloroform zum Vergle ich durch.
CIKatalyse..zytdua
Anmerkung:
Den pH-Wert von Chloroform kann man natürlich nicht messen. Vielmehr wird die
Tendenz angezeigt, wie sich das Verhältnis von Hydrogeniumionen vor und nach
Ozoneinleitung ändert.
Beobachtung:
Der pH-Wert ändert sich (fällt ab). Nach Zugabe von AgN0 3 bildet sich ein weißer
Niederschlag in der wässrigen Phase.
Erklärung I Auswertung:
Chloroform-lösung
................. ............................ ...................Stratosphare
. . ......................-
pH (vor Ozoneinleitung) = 4,1
e =~-,
Trelbgas....
I FCKWs I
pH (nach Ozoneinleitung) = .{J,7
KOhimIttel
Chemie in der Schule: www.chids.de
19
20
Troposphare
.
J
4.1.3.4. FCKW
Globaler Ozonabbau und Reaktionen der politischen Öffentlichkeit
Fluor-Chlor-Kohlenstoffe sind die chemische Stoffklasse, die chemische
Verbindungen von Atomen des Kohlenstoff (C), Fluor (F) und Chlor (CI) enthält.
Im deutschen Sprachgebrauch werden sie auch als FCKW bezeichnet, also als
Fluor-Chlor-Kohlen~stoffe,
obwohl
die Stoffe dieser Klasse keine
Wasserstoffatome enthalten (sie werden aber aus Kohlenwasserstoffen hergestellt) .
Sie gehören mit den Halonen und den weniger kritischen teilhalogenierten FCKW zu
den Stoffen, die in der Stratosphäre die Quellen der ozonzerstörenden Radikale sind.
Wegen der hohen Stabilität können die FCKW die Stratosphäre erreichen, bevor sie
zersetzt werden. Erst in der Stratosphäre werden sie durch solares UV-Licht
aufgebrochen, wobei das ozonzerstOrende CI freigesetzt wird.
Die FCKW sind zwar schwerer als Luft, können die Stratosphäre aber wegen
turbulenter Windstromungen in der Troposphäre und über Diffusionsvorgänge
dennoch erreichen. Dort halten sie und ihre Abbauprodukte sich über mehrere Jahre
auf (!), bevor sie durch natürliche Reinigungsprozesse wieder aus der Stratosphäre
entfemt werden.
Dieser langfristige Aufenthalt dieser Stoffe in der Atmosphäre bedeutet, daß jede
Maßnahme, die heute zur Reduktion der FCKW (und der Halone) führt, sich erst in
größenordnungsmäßig 30 Jahren merkbar auswirkt .
Anders gesagt: würde heute schlagartig jeder Eintrag dieser Stoffe in die Atmosphäre
unterbunden, würde es noch einige Jahrzehnte dauem, bis die Stratosphäre von
ihnen befreit wäre. Eine solcher schlagartiger Stopp ist aber unmöglich, da
beispielsweise ja bereits viele Tonnen dieser Produkte in Klimaanlagen und
Kühlschränken enthalten sind und in den nächsten ca. 10 bis 20 Jahren in die
Atmosphäre freigesetzt werden.
FCKW und Halone sind äußerst stabile und langlebige synthetische
Verbindungen. Sie sind chemisch extrem neutral, reagieren nicht mit anderen Stoffen
und sind gesundheitlich in den meisten Fällen für den Menschen unbedenklich . Ihre
ökotoxische, ozonzerstörende Wirkung bezieht sich lediglich auf das in FCKW
enthaltene Chlor, daß zu einer Zerstörung des Ozons führt. FCKW werden zum
Beispiel aus Kälteanlagen oder Spraydosen freigesetzt und steigen langsam in die
höheren Schichten der Atmosphäre auf, wo sie durch nergiereiches UV-Licht in
Radikale gespalten werden, wobei Chlor und Brom freigesetzt werden .
Verwendung von FCKW und Halonen
}>
~
~
~
}>
Treibmittel in Spraydosen
Kältemittel in Klimaanlagen
Feuerlöschmittel
Lösungsmittel
Verschäumung von Kunststoffen
R 11
R 12
SummenFormel
CFCI3
CF2CI2
ebensdauer
Atmosphäre
pO Jahre
102 Jahre
R 113
R 114
C2F3C I3
C2F4CI 2
~5 Jahre
~OO Jahre
FCKW
in
Chemie in der Schule: www.chids.de
Halon
1301
1211
SummenFormel
!CF3Br
!CF2CIBr
Lebensdauer
65 Jahre
20 Jahre
21
Die eindeutigen wissenschaftlichen Ergebnisse in den Jahren bis 1985 riefen
letztlich auch die Politiker auf den Plan. Nach mehreren Diskussionsrunden wurde
1987 im Montrealer Protokol für die Signatarstaaten bindend festgelegt, die FCKW
bis 1999 um 50% zu reduzieren. 1990 wurde in London eine Verscharfung
vereinbart, wonach bis zum Jahr 2000 die Produktion der FCKW vollständig
eingestellt werden soll.
Die weiter eintreffenden alarmierenden Informationen aber den Zustand der
Ozonschicht führten 1992 auf der Nachfolgekonferenz in Kopenhagen zu der
Vereinbarung, die FCKW-Produktion bis 1994 um 75% zu vermindem und bereits im
Januar 1996 auf die CFC ganz zu verzichten . Allerdings wurde ein
Übergangsperiode bis zum Jahr 2006 beschlossen, wahrend der für essentielle Fälle
und für den Bedarf in Entwicklungsländem FCKW erzeugt werden dürfen.
1995 wurden in der Wiener Nachfolgekonferenz weitere Anderungen und
Anpassungen des Montrealer Protokolles vorgenommen. Danach ist in den
Industrieländem bis zum Jahre 2010 Produktion und Verwendung von Methylbromid
(Fungizid) einzustellen. Der Export von Brommethan in Staaten, die dem Montrealer
Protokoll nicht beigetreten sind, wird verboten . In Entwicklungsländem wird ab 2002
die Produktion und der Verbrauch des Methylbromid auf den DlXChschnitt der Jahre
1995 bis 1998 eingefroren.
4.1.4.0zon-"Loch"
In der breiten Öffentlichkeit ist die Rede vom sogenannten Ozon-Loch". Doch dieser
Begriff ist irreführend und falsch, denn es handelt sich nicht um ein . Loch· im
eigentlichen Sinne. Vielmehr sollte über einen .Ozonschwund" gesprochen werden.
Die genaue Definition des Begriffes Ozonloch lautet wie folgt:
.Ein Ozonabbau wird dann als Ozonloch bezeichnet, wenn für ein
größeres Gebiet über die Höhe hinweg gemittelt das Ozon zu 50 Prozent
zerstört ist und der Schwund über mehrere Wochen anhält."
Allgemein bekamt wurde das Problem der Zerstörung des Ozons in der Atmosphäre
vor allem durch Berichte über das Ozonloch . Dieses Ozonloch von ca. 22 Millionen
Quadratkilometem GrOße (1995 und 1996) beschrankt sich jedoch auf die
antarkt ischen Gebiete der Erde. Auf die gründe soll jedoch hier nicht näher
eingegangen werden .
Weniger bekannt ist, daß auch über allen anderen Punkten der Erdoberfläche ein
Ozonabbau stattfindet. Dieser hat jedoch nicht einen so spektakulären Anschein, wie
das Ozonloch. Tatsächlich ist dieser Abbau aber ebenfalls sehr problematisch: er
findet direkt über den Pflanzen, Tieren und Menschen statt und übt seinen
schädlichen Einfluß auf sie ebenso direkt aus .
22
4.2. Ozon in der Troposphäre - Sommersmogproblematik
Gegebenheiten aber verschiedener - Wert für die Ozonkonzentration ergibt. Damit ist
der Befund, die konstante Ozonkonzentration in unbelasteten Atmosphären, erklärt.
4.2.1. Problemstellung: Photosmog - Los Angeles-Smog
Photosmog - auch Sommersmog genannt - wurde in den vierziger Jahren zuerst in
los Angeles beobachtet. In der Region leben etwa 7,5 Millionen Menschen - mit
etwa gleich großer Autozahl. Stadt und Umland liegen in einem Becken, in dem es im
Sommer häufig zu stabilen Inversionswetterlagen kommt. Bei dieser Wetterlage ist
die normale Zirkulation der luft nicht mOgIich, da wärmere Luftschichten in der Höhe
tieferliegende kalte überdecken. Alle Abgase der Stadt - die wichtigsten sind hier
angesichts des alles beherrschenden Autoverkehrs die Autoabgase - sammeln sich
wie unter einer riesigen Glocke. Durch die intensive Sonneneinstrahlung werden wie
in einem "Reaktor" eine Vielzahl von chemischen Reaktionen in Gang gesetzt. Aus
diesem Produktgemisch hebt sich ein Produkt wegen seiner besonders hohen
Menge heraus: Ozon.
Sichtbar in Erscheinung tritt der Photosmog als ein mehr oder weniger dichter Dunst.
Schlimmer als dieser sind die Wirkungen des brisanten Reaktionsgemisches: in
leichten Fällen kommt es zu einer Reizung der Schleimhäute, besonders der Augen.
Doch auch Lungenerkrankungen wie z. B. eine Bronchitis (im Sommer) oder die
Zunahme von allergischen Erkrankungen werden mit einiger Berechtigung auf den
Sommersmog zurückgeführt. Er sorgt auch dafür, daß Farben rascher ausbleichen,
und Leder, Gummi und Textilien rascher brüchig werden.
Ozon in der belasteten Atmosphäre
Wie sind nun die Verhältnisse in belasteten Atmosphären zu beschreiben. weshalb
sind hier die Ozonkonzentrationen hoch. wie kommt es zu einem Tagesgang, wie zu
unterschiedlichen Konzentrationen in den verschiedenen geographischen Räumen?
Die Erklarung hierfür liegt in der unterschiedlichen Zusammensetzung von belasteter
und unbelasteter Atmosphäre. Hier sind vor allem zwei Punkte zu beachten:
1. In stark verschmutzten Atmosphären findet ma StickstoffmonooxidKonzentrationen, die 1.000 bis 100.000 mal so hoch sind wie in natürlichen.
2. Es liegen erhebliche Mengen an Kohlenwassfioffverbindungen (KW) vor.
die aus dem Kraftfahrzeugverkehr stammen.
CO2 + H 20 + N2 + O 2
Kraftstoff
(KW)
+
Luft
(80°A. N2
20 % 02)
4.2.2. Chemische Grundlagen
Für das Verständnis dieser Phänomene ist es notwendig, die Behandlung der
belasteten Atmosphäre von der der unbelasteten abzukoppeln und diese zuerst zu
betrachten.
99
%
+
Verbrennung
Hauptschadstoffe:
~
~
~
0,85 0",
0.08%
0,05 0/0
K'N:
>
Ozon in der unbelasteten Atmosphäre
Als Bildungsreaktion für Ozon ist nur eine Reaktion von Bedeutung, die Photolyse
von Stickstoffdioxid N02 und die anschließende Reaktion des gebildeten atomaren
Sauerstoffs mit 02 zu Ozon:
>
Methan
Ethan. Ethen. Ethin
Propen
Butan. 1-Buten
Pentan. Isopentan
Benzol
Xylole
Toluol
Dabei kommt es zur Bildung von Photooxidantien. Photooxidantien sind oxidierende
Verbindungen. die auf photochemischem Wege (Sonnenlichteinfluß) entstehen.
In diesem Zusammenhang ist die Reaktion von photolytisch aus Ozon erzeugtem
Sauerstoff mit Wasser Wichtig.
Für den Ozonabbau (der sogenannten "Senke") ist vor allem die Reaktion mit
Stickstoffmonooxid NO von Bedeutung: Wenn die UV-Strahlung (nachts) wegfällt,
drehen sich die Pfeife um und es wird N02 und 02 gebildet.
Bildung und Abbau von Ozon halten sich im Sinne eines dynamischen
Gleichgewichtes die Waage, so daß sich ein konstanter - je nach geographischen
Chemie in der Schule: www.chids.de
23
HO-Radikale geben ihr Sauerstoffatom an Kohlenmonoxid bzw. Kohlenwasserstoffen
ab, wobei ein Wasserstoffradikal H· zurückbleibt. Mit Sauerstoffmolekülen bilden sich
Hydroperoxidradikale HO~. die NO zu N02 oxidieren. Unter Einwirkung von
kurzweiligerem licht (Wellenlängen <420 nm) oder bei hohen Sommertemperaturen
reagiert N02 mit weiteren Sauerstoffmolekülen zu Ozon, das nun in Bodennähe
seine umweltschadigenden Wirkungen ausüben kann.
24
Erklärung (vereinfacht):
+0
CO
Ph-CH 3
t<JN
H
• 2
Ph-CH
2
__
Ph-C-O-O-
NO
H
2
Man kann die bodennahe Ozonbildung somit durch die Minderung der
Schadstoffemission (etwa durch großräumiges, langfristiges Autofahrverbot)
drastisch einschränken. Hinzu kommt daß die bodennahe Ozonbildung durch die
Ausdünnung der Ozonosphäre verstärkt wird. Die Ozonanreicherung hat aber auch
schon die Alpen und andere Reinluftgebiete erreicht.
~O
,,-
Ph-C~
~o
2 Ph-C(_
siehe Versuch 2. Zusätzlich pH-Elektrode mit Anzeigegerät, Abzug.
QH
50ml Toluol
Benzoesäure
Durchführung:
Man mißt den pH-Wert des Toluols in der Gaswaschflasche, leitet vorsichtig(!) Ozon
ein (Achtung: Entzündungsgefahr) und mißt erneut den pH-Wert.
Anmerkung:
Den pH-Wert von Toluol kann man natürlich nicht messen. Vielmehr wird die
Tendenz angezeigt, wie sich das Verhältnis von Hydrogeniumionen vor und nach
Ozoneinleitung ändert.
Beobachtung:
Der pH-Wert erreicht einen tieferen Wert.
pH (vor Ozoneinleitung)
=4,7
pH (nach Ozoneinleitung)
= 2,4
Chemie in der Schule: www.chids.de
25
+ Ph-CH3
-
Q-O.
Versuch 6: Abbau von Ozon durch Benzinbestandteile
Chemikalien:
__
Ph-C-O-OH
Der Grund ist, daß sich in der Nacht wegen des Fehlens von UV-Strahlung die
umgekehrten Reaktionen bemerkbar machen:
NOx und Kohlenwasserstoffe (siehe Versuch 6) bauen die Ozonmoleküle ab und
machen sie unschädlich. Da aber in Reinluftgebieten, anders als in Ballungszentren,
der verkehrsbedingte NOx- sowie Kohlenwasserstoff-Ausstoß abends zum Erliegen
kommt, entfällt die Entgiftung, so daß die Ozonkonzentration konstant hoch bleibt.
26
....
- Ph-CH 2
-OH
Toluol
+ Ph-CH3
~
•
- Ph-CH2
)
4.2.3. Gefährdung durch bodennahes Ozon
Versuch 7: Wirkung von Ozon auf Pflanzen
4.2.3.1. Übliche Konzentrationen I Geruch
Geräte:
siehe Versuch 2, Abzug.
Chemikalien:
Herstellung eines Chlorophyll-Extrakt von Weißklee in Chloroform.
=
Die Ozonkonzentration wird häufig in der Einheit 'Mikrogramm pro Kubikmeter' (
IJg/mS ) angegeben (11Jg 1 Mikrogramm 1 Millionstel Gramm). Die Grundbelastung
liegt heute bei 40 - 80 J,Jg/w; sie ist etwa doppelt bis dreifach so hoch wie zu Beginn
des Jahrhunderts.
Ozonwerte über 180 IJg/mS (Stundenmittelwerte) treten fast ausschließlich im
Sommer bei Temperaturen über 20°C auf. Konzentrationen über 240 IJg/mS wurden
in der BRD bisher selten gemessen.
Die Geruchsschwelle für Ozon liegt bei 40 - 50 lJ9/m 3 , die Stärke der
Geruchsempfindung läßt aber innerhalb von wenigen Minuten nach. Wegen dieser
raschen Gewöhnung wird im Alltag Ozon kaum je durch Riechen wahrgenommen.
=
=
4.2.3.2. Gesundheitliche Wirkungen
Ozon ist einer der am stärksten oxidierenden Stoffe. Die komplexen Schäden. die
es auf zellulärer Ebene anrichtet. können sich u.a. in Entzündungen des Atemtrakts
oder Verminderung der Widerstandsfähigkeit gegenüber Infektionen äußern. Ozon
kann zu Schäden an der Erbsubstanz führen; eine krebsauslösende oder -fördemde
Wirkung kann nicht ausgeschlossen werden.
Ozon dringt bis tief in die feinsten Verästelungen der Lunge ein. Es reizt die
Schleimhäute und das Lungengewebe. Die Atmung kann behindert werden;
Atemwegserkrankungen können die Folge sein. Eine Verschlechterung von
Lungenfunktionen und entzündliche Reaktionen des Lungengewebes wurden schon
bei mehrstündigen Konzentrationen von 160 ~glw beobachtet. Besonders schwere
Schädigungen der Bronchialschleimhaut werden durch die Kombination von Ozon
und Tabakrauch verursacht.
Neben der Beeinträchtigung der Atemwege werden ab Konzentrationen von rund
200 J.Jg/m3 eine Vielzahl verschiedener Beschwerden wie Augenreizungen,
Kopfschmerz, Husten. Brustschmerzen, Müdigkeit und Atemnot genannt. Ein
Vergleich aller vorliegenden Daten ist schwierig, da es offensichtlich große
individuelle Unterschiede in der Ozon-Empfindlichkeit gibt. Außerdem darf man nicht
außer acht lassen, daß gleichzeitig andere Luftschadstoffe auf den Organismus
einwirken.
Über
Langzeitwirkungen und Spätschäden
durch
Ozon
sind
kaum
Untersuchungsergebnisse verfügbar; eine gesundheitlichen Gefährdung kann
deshalb auch dann nicht mit Sicherheit ausgeschlossen werden. wenn keine akuten
Beschwerden vorliegen.
Durchführung:
Man leitet Ozon in die Gaschwaschflasche mit dem Chlorophyll-Extrakt.
Beobachtung: Der Chlorophyll-Extrakt (grün) entfärbt sich (farblos).
Erklärung:
4.2.3.3. Richtwerte
Nur am Arbeitsplatz gibt es in der BRD einen verpflichtenden Grenzwert. den
sogenannten MAK-Wert von 200 IJg/mS (MAK= maximale ArbeitsplatzKonzentration). Er ist als Mittelwert über acht Stunden definiert, wobei kurzzeitig
Konzentrationsspitzen bis zu 400 J.J9/mJ erlaubt sind.
Die Bundesrepublik Deutschland hat 1994 eine Richtlinie der EG übernommen.
nach der folgende Stundenmittelwerte als Schwellenwerte festgelegt sind:
• 180 IJglm3 : "Schwellenwert für die Unterrichtung der Bevölkerung"; bei
Überschreitung könne es bei besonders empfindlichen Gruppen der Bevölkerung
im Fall einer kurzen Exposition begrenzte und vorübergehende gesundheitliche
Auswirkungen geben.
• 360 J.jg/ms : "Schwellenwert für die AuslOsung des Alarmsystems"; bei
Überschreitung bestehe auch im Fall einer kurzen Exposition eine Gefahr für die
menschliche Gesundheit.
Die Angabe von Schwellen- und Grenzwerten bedeutet nicht, daß für geringere
Konzentrationen Gesundheitsschädigungen mit Sicherheit ausgeschlossen werden
können. Es handelt sich vielmehr um Festlegungen politischer Natur, die eine
gewisse Beliebigkeit aufweisen. So gilt in der Schweiz ein maximaler
Stundenmittelwert von 120 J.,Jg/mJ als akzeptabel. wenn er höchstens einmal pro Jahr
überschritten wird; in den Niederlanden dagegen darf der maximale
Stundenmittelwert von 240 J...Iglm3 an bis zu 5 Tagen im Jahr Qberschritten werden.
In Versuch 7 soll stellvertretend die schädigende Wirkung des Ozons auf Pflanzen
gezeigt werden.
Chemie in der Schule: www.chids.de
27
Chlorophyll wird oxidativ zerstört.
28
)
5. Literatur
•
•
•
•
•
•
•
•
•
•
•
•
•
•
•
•
•
•
•
•
•
•
•
•
•
Bliefert, Claus: Umweltchemie. Weinheim - New York 21997.
Blume, Rüdiger I Bader, Hans Joachim: Umweltchemie im Experiment. Frankfurt
1989.
Blume, Rüdiger I Wiechoczek, Dagmar I Hildebrand, Achim I Hilgers. Uwe: Ozon
aus der Elektrolyse von Schwefelsäure - eine Basis für Experimente von Ozon,
in: PdN-Ch. 2 (1996) 8.20-28.
Blume, Rüdiger I Wiechoczek, Dagmar: Unterrichtsexperiment: Nachweis von
Ozon. Anmerkungen zum Schönbein-Verfahren, in: PdN-Ch. 4 (1994) 8.17-19.
Crutzen, Paul: Mein Leben mit 03, NO x und anderen YlOx-Verbindungen (NobelVortrag), in: Angewandte Chemie 1996, 108, 1878-1898.
Fabian, Peter: Kohlenstoffdioxid und andere Treibhausgase: Luftverschmutzung
und ihre Klimawirksamkeit, in: PdN-Ch. 2 (1996) 8.2-13.
Falbe, Jürgen I Regitz, Manfred: Rörnpp Chemie Lexikon. Stuttgart 91992.
Grünhage, Ludger I Jäger, Hans-Jürgen I Dämmgen, Ulrich: Beurteilung von
Ozon-Immissionen, in: PdN-Ch. 4 (1994) S.14ff.
Grünhage, Ludger I Jager. Hans-Jürgen I Dämmgen, Ulrich: Ozon-Dynamik der
bodennahen Atmosphäre, in: PdN-Ch. 4 (1994) 8.4-8.
Grünhage, Ludger I Jäger, Hans-Jürgen I Dämmgen, Ulrich: Schädigungen von
Pflanzen durch Ozon, in: PdN-Ch. 2 (1996) S.20-28.
Grunhage, Ludger I Jäger, Hans-Jürgen I Dämmgen, Ulrich: Schichtung und
Transporteigenschaften der Atmosphäre, in: PdN-Ch. 4 (1994) S.2ft.
Habitz, Peter I Puff, Heinrich I Schmitz-DuMont, OUo: Chemische
Unterrichtsversuche, Darmstadt 61979.
Heydtmann, Horst I Kusch, Anja I Rasing, Stefanie: Passiv-Sammler-Verfahren
zur Messung von Ozon und Stickstoffdioxid in Luft, in: CHEMKON 1 (1998) 8.1923.
Hollemann, Arnold I Wiberg, Egon: Lehrbuch der Anorganischen Chemie, Berlin NewYork 101 1995.
Horlacher, Bernhard I Urban, Alexander: Ozonentstehung und Ozonabbau in
einem einfachen Demonstrationsversuch, in: PdN-Ch. 3 (1992) 8.18-20.
Kaminski, Bettina: Ozon durch Elektrolyse von Schwefelsäure, in: CHEMKON 2
(1996) S.8Sf.
Kober, Friedhelm: Chlorophyll, eine schulgeeignete Verbindung?, in: PdN ..Ch. 3
(1994), 8.81-85.
Lüdtke, Norbert: Chemie in Pressetexten Teil 1: Halonentsorgung geht an den
Start, in: PdN-Ch. 2 (1995) S.32ff.
Malina. Mario: Die Abnahme des Ozongehaltes in der Polaratmosphäre (NobelVortrag). in: Angewandte Chemie 1996, 108, 1900-1907.
Pfeifer, Peter I Pfeifer, Gustav: Luft (= Schmidkunz, Heinz I Häusler, Karl (Hrsg.):
Unterricht Chemie: Stundenbilder, Experimente, Medien Bd. 6 (bisher 8 Bde.)),
Köln 1995.
Rowland, 8herwood: Der Abbau des stratosphärischen Ozons durch
Fluorchlorkohlenwasserstoffe (Nobel-Vortrag), in: Angewandte Chemie 1996,
108. 1908-1921.
Rumpel, Karl-Josef I Schäfer, Stefan I Schmidt, Karf-Dtto: Ozon-Meßverfahren,
in: PdN-Ch. 2 (1996) 8.14-19.
Tausch, Michael: Ozon. Unterrichtsmaterialien für die Sekundarstufe 11, in: PdNeh. 4 (1994) 8.27-34.
Chemie in der Schule: www.chids.de
29
•
Tausch. Michael I Kolkowski) Matthias I Weilert. Kai: Ozon - der andere
Sauerstoff) in: PdN-Ch. 1 (1993) 8.26-34.
Thomas, Eberhard: Ozon - Schutzschild oder Umweltgift? Eine Unterrichtsreihe
in der Jahrgangsstufe 10. in: PdN-Ch. 4 (1994) 8.19-27.
Wirth, Christian: Ozon aus dem Handgelenk. in: MNU 47 (1994) 8.367.
~Q~Q~YOg~o;.
Chemie Konkret
CHEMKDN
Mathematisch-naturwissenschaftlicher Unterricht
MNU
PdN-eh.
Praxis der Naturwissenschaften Chemie
30