WÄRME I
Werbung

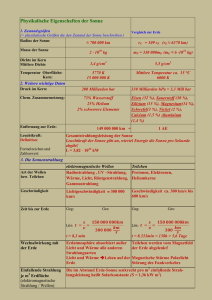
Physik für Pharmazeuten Physik für Pharmazeuten WÄRME I Wärmeenergie und Temperatur Beschreibung des Zustands von Gasen Wärmekapazität Wärme Wä • wozu Wärmelehre ? wozu Wärmelehre ? Temperatur bin ich mittags größer als am morgen ? bin ich mittags größer als am morgen ? wieso wird Sodaflasche kalt, wenn Gas einströmt ? und warum ist der Kühlschrank kalt ? wie baue ich ein perpetuum mobile ? wieso wird Fleisch im Druckkochtopf schneller gar? Reaktionskinetik ........ 2 Wä Wärme 3 1 Wärme und Temperatur 3.1 Wärme und Temperatur • Was ist Wärme ? Was ist Wärme ? bis ~1800 Vorstellung eines "Wärmestoff" Thompson, Joule: ungeordnete Bewegung! z.B.: Gasmoleküle mit unterschiedlicher Einzelenergie Mechanisches Wärmeäquivalent (Versuch von Joule) 3 Wä Wärme 3 1 1 Temperaturskala 3.1.1 • Einheit der Temperatur: 1K (Kelvin) Einheit der Temperatur: 1K (Kelvin) ( Temperaturänderung von 1°C) 1/100 der Temperaturdifferenz zwischen Gefrier‐ und Siedepunkt von Wasser bei 1,013 bar. Gefrierpunkt liegt dann bei 273,2 K Fixpunkt T in K definiere Fixpunkte definiere Fixpunkte Tripelpunkt von Wasserstoff 13,81 zur Übertragung Siedepunkt von Wasserstoff 20,28 zwischen Tripelpunkt von Wasser 273,16 Meßbereichen Siedepunkt von Wasser 373,15 • Temperaturskalen Erstarrungspunkt von Gold 1337,58 Celsius: Celsius: 0 0°C C ... Gefrierpunkt des Wassers Gefrierpunkt des Wassers 100°C ... Siedepunkt des Wassers Fahrenheit: über Schmelzpunkt einer S l i h Salzmischung und, früher, Körpertemperatur d f üh Kö 4 Wä Wärme 3 1 2 Thermische Ausdehnung 3.1.2 Thermische Ausdehnung • lineare Ausdehnung lineare Ausdehnung Länge eines Festkörpers l l0 1 T (für kleine Temperaturänderungen d denn auch temperaturabhängig!) ht t bhä i !) Eisenbahnschiene: 30 m TWinter-Sommer ~ 50 K l=1.8 cm früher Schienenstoß, heute verschweiste Schienen u. fixe Montage – hoher Druck 5 Wärme Wä • lineare Ausdehnung lineare Ausdehnung Länge eines Festkörpers l l0 1 T (für kleine Temperaturänderungen d denn auch temperaturabhängig!) ht t bhä i !) • Raumausdehnung: bei Festkörper durch Längenausdehnung in 3 Raumrichtungen, Längenausdehnung in 3 Raumrichtungen, =3 , bei Flüssigkeiten wesentlich stärker Temperaturabhängigkeit der Dichte m V 0 1 T empirische Beobachtungen: Volumenausdehnung bei Gasen linear mit Volumenausdehnung bei Gasen linear mit Temperatur (bei konstantem Druck), bzw. umgekehrt prop. Druck p0V0 p1V1 ... const. T const (Gesetz von Boyle Mariotte) (Gesetz von Boyle Mariotte) V V0 1 T p const (Gesetz von Gay‐Lussac) 6 Wä Wärme 3 1 3 Thermometer 3.1.3 verwende verwende Temperatureffekte zu deren Messung Temperatureffekte zu deren Messung Längenausdehnung, Volumenausdehnung: Flüssigkeitsthermometer Gasthermomter Bimetallthermometer (Stab aus 2 verbundenen Metallen mit unterschiedlichem verbiegt sich) elektrische Effekte: Änderung des Widerstands Änderung der Kontaktspanung zwischen unter‐ schiedlichen metallischen Leitern schiedlichen metallischen Leitern Wärmestrahlung: Köper geben Energie an Umgebung in Form von Wärmestrahlung ab ( (Wärmebildkamera) ) 7 3.2 Wä Wärme Mikroskopische Beschreibung und Zustandsgleichung und Zustandsgleichung • 3.2.1 Zustandsgrößen 3 2 1 Zustandsgrößen werden zur Beschreibung der makroskopischen Eigenschaften verwendet Zustandsgröße Art Druck p intensiv Temperatur T intensiv Volumen V extensiv Entropie S extensiv Teilchenzahl n extensiv innere Energie U extensiv extensive Größen addieren sich beim Zusammenfügen (z.B.: V, S, N, U) intensive Größen bleiben gleich (P, T) sind nur für Gleichgewicht definiert d f l h h d f 8 Wä Wärme Zustandsgleichung empirische Beobachtungen: empirische Beobachtungen: Volumenausdehnung bei Gasen linear mit Temperatur (bei konstantem Druck), bzw. umgekehrt prop. Druck (Gesetz von Boyle Mariotte) p0V0 p1V1 ... const. T const (Gesetz von Gay‐Lussac) (Gesetz von Gay Lussac) V V0 1 T p const bei konstantem Druck ist V proportinal zu T (Gay‐Lussac) b bzw. pT T bei b i V=const V t isotherme : Linien bei konst. Temperatur p isobare: Linien bei gleichem Druck isochore Linien bei gleichem Volumen 9 Wä Wärme 3 2 2 kinetische Beschreibung 3.2.2 kinetische Beschreibung • mikroskopische Deutung der makroskopischen Eigenschaften mikroskopische Deutung der makroskopischen Eigenschaften große Zahl von Teilchen Mittelungen z.B.: Druck durch Stöße der Teilchen mit Wand: z.B.: Druck durch Stöße der Teilchen mit Wand: Teilchen i erfährt bei Stoß Impulsänderung, bzw. Kraft. Nach Reaktionsprinzip wirkt gleiche Kraft auf Wand. Fi p i dpi dt 10 Wä Wärme Wärmeenergie Temperatur Wärmeenergie • Was Was ist Wärme ? ist Wärme ? mikroskopische Beschreibung Thompson, Joule: ungeordnete Bewegung! p , g g g z.B.: Gasmoleküle mit unterschiedlicher Einzelenergie • in idealem Gas: Temperatur ist Maß für mittlere kinetische Energie i id l G T t i t M ß fü ittl ki ti h E i Etrans 12 mv 2 23 kBT Achtung! Mittelung über Quadrate Quadrat des Mittelwerts m...Masse eines Gasmoleküls v 2...quadratisch gemittelte Geschwindigkeit der Moleküle q g g kB=1,38110‐23 JK‐1 ... Boltzmann‐Konstante in Festkörper: Bewegung um Ruhelage des Atoms, unabhängig von p g g g gg anderen Atomen. • Absoluter Nullpunkt der Temperatur, wenn alle Moleküle v=0 11 Wärme Wä • Längenausdehnung: Atome in Kristallgitter angeordnet Bewegung: Schwingung um Ruhelage asymmetrisch Längenänderung Dehnung g durch Zugkraft Gasmoleküle Bewegung: Gasteilchen bewegen sich Bewegung: Gasteilchen bewegen sich, mittlere Geschwindigkeit ändert sich mit Temperatur. zu berücksichtigen: Behälter des Gases zu berücksichtigen: Behälter des Gases, Annahmen über Verhalten der Teilchen temperaturabh. Ausdehnung 12 Wärme Wä • Bewegung der Gasteilchen – Bewegung der Gasteilchen Annahmen: Annahmen: freie Bewegung, nur elastische Stöße zick‐zack‐Bahnen Brownsche Bewegung ; keine inneren Anregungen, Abstand der Teilchen groß relativ zur Größe der Teilchen (Punktteilchen) Menge eines Gases gegeben durch: molare Masse z B : M(H)=1,008 molare Masse z.B.: (H)=1 00810‐3 kg/mol = 1,008 g/mol = 1 008 g/mol M(H2O)=18,01 g/mol, M(N2)=28,013 g/mol Masse M aus Zahl der Teilchen (N) und m: M=Nm Avogadro: unter Normalbedingungen ist molares Volumen Vm,0=22,413996 m3/kmol ~ 22,41 l/mol NA=6,021023 mol‐1 Avogadro (Loschmidt‐) Zahl, Zahl der Teilchen pro mol 13 Wärme Wä • Druck eines Gases: Druck eines Gases: in Würfel fliegen n/6 Teilchen in Richtung einer Wand, innerhalb einer Zeit t erreichen diejenigen Teilchen die Wand, die maximal N V N v t entfernt sind, das sind N Avt V 6 V F Npimp / t pimp 2mv Kraft: Impulsänderung/Zeit , f l d / Druck: Kraft/Fläche, Mittelung über alle Teilchen p 13 nmv 2 nkBT n=N/V 14 Wärme Wä • Druck eines Gases: Druck eines Gases: in Würfel fliegen n/6 Teilchen in Richtung einer Wand, innerhalb einer Zeit t erreichen diejenigen Teilchen die Wand, die maximal v t entfernt sind, das sind N N V N Avt V 6 V F Npimp / t pimp 2mv Kraft: Impulsänderung/Zeit , f l d / Druck: Kraft/Fläche, Mittelung über alle Teilchen p 13 nmv 2 nkBT • Zustandsgleichung n=N/V pV NkBT NA kBT RT ....Stoffmenge in mol bei Normalbedingungen (T bei Normalbedingungen (T0=273 273,15 K, p 15 K p0=101325 101325 Pa) Pa) R = p0.Vm,0/T0 = NAkB = 8,315J/mol K ... universelle Gaskonstante 15 Wärme Wä • Gasgemische verschieden Komponenten, reagieren nicht chemisch sei sei i Stoffmenge der i Stoffmenge der i‐ten ten Komponente mit m Komponente mit mi, M , Mi RT pi....Partialdruck der i‐ten Komponente pi i V Druck eines Gemisches ist gleich der Summe der Einzeldrucke (Dalton) Druck eines Gemisches ist gleich der Summe der Einzeldrucke (Dalton) RT p i pi i i V gleiches gilt für Partialvolumen Vi und Stoffmenge xi • Luft: Volumen in % Masse in % Partialdruck in Meereshöhe in Pa Stickstoff N2 78,09 75,52 79125 Sauerstoff O2 20,95 23,15 21228 Argon, Spuren von anderen Edelgasen, H2 0,93 1,28 942 Kohlendioxid 0,03 0,05 30 16 Wärme Wä • reale Gase: reale Gase: bei großen Gasdichten (gesättigeter Dampf) bewirkt Ausdehnung der Moleküle, bzw. Wechselwirkung zwischen Ihnen Abweichungen. Bei van der Waals Kräften (innerer Druck a/V2m, Eigenvolumen der Teilchen – Kovolumen b) p a Vm2 Vm b RT • Energie g mit pro Teilchen folgt Ekin 12 mv 2 23 kBT p 13 nmv 2 13 n2Ekin ,ges / N 23 V1 Ekin ,ges Ekin ,ges 23 RT mittlere Energie der Translation ! 3 Translationsrichtungen Energie pro Translationsfreiheitsgrad pro Teilchen Energie pro Translationsfreiheitsgrad pro Teilchen Ekin 12 N RT 12 kBT 17 Wärme Wä • bisher nur longitudinale Bewegungen, genaue Beschreibung berücksichtigt bisher nur longitudinale Bewegungen genaue Beschreibung berücksichtigt alle Arten der Bewegung • Freiheitsgrad: Möglichkeit der Bewegung 3 Raumrichtungen Kugel hätte im Prinzip noch Möglichkeit der Rotation Diese hat aber keinen Einfluss auf Rotation. Diese hat aber keinen Einfluss auf Translationsbewegung, d.h. auf Temperatur. Moleküle: Rotation koppelt mit Translation + 2 Fgr für 2 atomige Moleküle + 3 Fgr für 3 und mehratomige Moleküle zusätzlich noch Schwingungsfreiheitsgrade etc. zusätzlich noch Schwingungsfreiheitsgrade etc. • Gleichverteilungssatz im statistischen Gleichgewicht ist Energie im Mittel pro Freiheitsgrad ½kBT bei f Freiheitsgraden: Ekin 1 f nRT 2 18 Wärme Wä • Geschwindigkeitsverteilung nicht alle Teilchen mit gleicher Geschwindigkeit Verteilungsfunktion beschreibt, welche Geschwindigkeiten mit größerer Wahrscheinlichkeit angetroffen werden als andere werden als andere dN / N f (v)dv Anteil der Teilchen mit Geschwindigkeit zwischen v und v+dv Maxwell‐Boltzmann‐Verteilung 3/2 f (v)dv v 2 e mv /(2 kBT )dv 8k T vˆ mittlere Geschwindigkeit , häufigste v mB z B H2...1694 m/s, N z.B.: H 1694 m/s N2...453 m/s, CO 453 m/s CO2...361 m/s 361 m/s 2 m kBT 2 2 kBT m • mittlere freie Weglänge – Stoßquerschnitt mittlere Weglänge zwischen 2 Stößen l=1/n mittlere Weglänge zwischen 2 Stößen l=1/n Querschnitt =(r1+r2)2 19 Wä Wärme 3 3 Wärmemenge Wärmekapazität 3.3 Wärmemenge –Wärmekapazität um um Temperatur eines Körper zu erhöhen (senken) muß Temperatur eines Körper zu erhöhen (senken) muß Wärmemenge Wärmemenge zugeführt (entzogen) werden. Mit T1 (T2) Anfangs‐ (End‐) Temperatur • Wärmemenge Q c M T2 T1 cM T Einheit: 1J = 1 Nm = 1 Ws M...Gesamtmasse früher: Kalorie (cal) 1calth = 4,184 J (thermochemische Kalorie) Wärmemenge, um 1g Wasser von 14,5°C auf 15,5°C zu erwärmen. • spezifische spezifische Wärmekapazität Wärmekapazität c c Q MT Einheit: J / kg K c ist temperaturabhängig ! ebenso abhängig von Art der Erwärmung p gg gg g cp bei konst. Druck (Volumen wird größer, d.h. zusätzlich zur Erwärmung Arbeit gegen äußeren Luftdruck notwendig cV bei konst. Volumen (zugeführte Energie allein zur Erhöhung der bei konst. Volumen (zugeführte Energie allein zur Erhöhung der Temperatur) cp > cV 20 Wärme Wä • c von Atommasse abhängig: von Atommasse abhängig: c MQT Wärmekapazität C Q c m T NfkB T 1 2 M T 2fkm molare Wärmekapazität C mol NA 2f kB 24,9 Jmol‐1 K‐1 Wärmekapazitäten bei 0°C in J kg‐1 K‐1, bzw. J in J bzw J mol‐1 K‐1 Temperaturabhängigkeit von Cmol Wärmekapazitäten nach kinetischer Gastheorie 21 Wärme Wä • Wärmekapazität von Wasser Wärmekapazität von Wasser H2O Molekül gewinkelt sehr viele Freiheitsgrade (3x6) cH2O 4185 Jkg ‐1K‐1 75.3 Jmol‐1 K‐1 wegen Freiheitsgraden und geringer Masse wegen Freiheitsgraden und geringer Masse relativ hoch ! • Kalorimetrie K l i i Bestimmung der Wärmekapazitäten Mischkalorimeter: Testkörper (m Mischkalorimeter: Testkörper (m2) wird in ) wird in kochendem Wasser / im Wasserdampf (T2) erwärmt, danach in Wasser (m1, T1). A T Aus Temperaturänderungen folgt c t ä d f l t c1 m1 Cw Tm T1 c m2 T2 Tm CW...Wärmekapazität der Messaparatur, Tm...Mischtempertur 22 Wä Wärme Was ist Wärme ? Was ist Wärme ? • Temperatur: Maß für mittlere kinetische Energie Maß für mittlere kinetische Energie Etrans 12 mv 2 23 kBT Temperaturskala: T=0 alles in Ruhe, 1 Kelvin, (Celsius‐, Fahrenheitskala) Längen‐, Volumenausdehnung ‐> Thermometer • Zustandsgrößen – Zustandsgleichung mikroskopisches Modell pV NkBT NA kBT RT Gasgemische: Summe über Partialdrücke Gleichverteilungssatz im statistischen Gleichgewicht ist Energie im Mittel pro Freiheitsgrad ½kBT, bei f Freiheitsgraden: bei f 1 Geschwindigkeiten verteilt Ekin 2 f nRT RT 23