Parkinson-Syndrom und Parkinson-Krankheit
Werbung

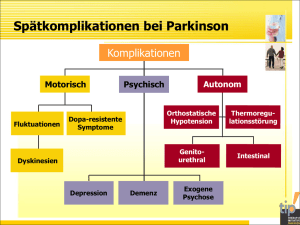
448 ÜBERSICHTSARTIKEL AIM Nicht heilbar, aber lange gut behandelbar Parkinson-Syndrom und ­Parkinson-Krankheit Dr. med. Ines Debove, Dr. med. Lenard Lachenmayer, Dr. med. Julia Müllner, Prof. Dr. med. Mathias Sturzenegger v ie we d Peer re a r tic le Neurologische Universitätsklinik, Inselspital, Universitätsspital Bern Bei Parkinson handelt es sich nicht nur um eine motorische Störung, es werden früh auch Psyche, Kognition und das vegetative Nervensystem (sogenannte nicht motorische Symptome) in Mitleidenschaft gezogen. Parkinson ist nicht nur eine Störung der dopaminergen Neurone in der Substantia nigra, sondern betrifft viele Neurotransmitter und im Verlauf Neurone des ganzen Gehirns und auch extrazerebral, so zum Beispiel gastrointestinal. Zwar beschränken sich die Therapiemöglichkeiten immer noch auf eine Symptombehandlung, aber diese besteht nicht (mehr) nur in der Dopaminsubstitution, sondern in multiplen pharmakologischen, physiotherapeutischen und chirurgischen Therapieoptionen. Einführung tinale, urologische, sexuelle, orthostatische und weitere vegetative Symptome). Diese verschiedenen Sym- Die Parkinson-Erkrankung (PD; idiopathisches Parkin- ptomkomplexe müssen bei der optimalen Wahl der son-Syndrom, Morbus Parkinson) ist nach der Alzhei- Anti-Parkinson-Therapie mitberücksichtigt werden. mer-Demenz die zweithäufigste neurodegenerative Einige der nicht motorischen Symptome wie Störung ­Erkrankung [1]. Sie wird heute als eine chronische, pro- des Geruchsinns, Obstipation, Depression oder REM- grediente, multisystemische, degenerative, neuronale Schlaf-Verhaltensstörung treten häufig sogar als Pro- Erkrankung verstanden, die nicht nur das dopaminerge dromalphase vor den motorischen Symptomen auf System, sondern auch die serotonerge, glutamaterge (prämotorische Symptome) [3]. Sie werden dann eine und GABAerge Neurotransmission betrifft. Daraus lei- besondere Bedeutung für die Frühdiagnostik gewin- ten sich motorische, aber auch vielseitige nicht moto- nen, wenn es einmal möglich sein wird, die Krank- rische Funktionsstörungen ab. heitsprogression zu beeinflussen. Die typischen und den Parkinsonismus definierenden motorischen Leitsymptome (auch Kernsymptome) sind eine Verlangsamung der Bewegungsabläufe (Bradyki- Parkinsonsyndrome – Abgrenzung nesie) zusammen mit einem erhöhten Muskeltonus Der Begriff Parkinson-Syndrom, auch als Parkinsonis- (Rigor) oder einem Ruhetremor oder beiden [2]. Brady- mus bezeichnet, umfasst eine Vielzahl von Erkrankun- kinesie und Rigor führen zu der typischen Haltung gen, die bezüglich Pathogenese, Therapieansprechen und dem typischen Gangbild. und Prognose allerdings nur wenig miteinander gemein Erst in den letzten Jahren wurde den nicht motorischen Symptomen vermehrt Beachtung geschenkt, da sie bezüglich Behinderung und Einschränkung der Lebensqualität mindestens ebenso wichtig sind. Dazu gehören psychiatrische Störungen (wie Depression, Angst, Apathie, Zwangsstörungen), Schlafstörungen, kognitive Einschränkungen (dysexekutive Syndrome, Demenz), Ines Debove aber auch autonome Funktionsstörungen (gastrointes- Abkürzungen: PSParkinson-Syndrom PD«Parkinson disease»; Parkinson-Krankheit, idiopathisches Parkinson-Syndrom (IPS), Morbus Parkinson LB «Lewy bodies» NMS «non motor symptoms» (nicht motorische Symptome) DBS «deep brain Stimulation» (Tiefenhirnstimulation) SWISS MEDICAL FORUM – SCHWEIZERISCHES MEDIZIN-FORUM 2017;17(20):448– 455 Published under the copyright license “Attribution – Non-Commercial – NoDerivatives 4.0”. No commercial reuse without permission. See: http://emh.ch/en/services/permissions.html 449 Übersichtsartikel AIM haben. Parkinson-Syndrome sind definiert durch die Darüber hinaus existieren aber auch andere neurode- drei motorischen Kardinalsymptome Brady-/Akinese generative Parkinson-Syndrome, die als atypische Par- sowie Rigor oder Ruhetremor oder beides, die nicht kinson-Syndrome zusammengefasst werden. Zu den primär durch visuelle, vestibuläre, zerebelläre oder pro- häufigsten atypischen Parkinson-Syndromen werden priozeptive Störungen zu erklären sind. Gemäss den die Multisystematrophie (MSA), die Demenz vom «UK (United Kingdom) Brain Bank criteria» und den Lewy-Körper-Typ (DLK), die progressive supranukleäre 2015 veröffentlichten «MDS (Movement Disorder Soci- Blickparese (PSP) und die kortikobasale Degeneration ety) clinical diagnostic criteria» sind für die Diagnose- (CBD) gezählt. Die Abgrenzung dieser Entitäten sollte stellung der Parkinson-Krankheit das Vorhandensein durch den Neurologen erfolgen und ist nicht immer von Brady-/Akinese und mindestens ein weiteres Kar- einfach, aber infolge unterschiedlicher Prognosen und dinalsymptom erforderlich. Es werden ­sogenannte Aus- Therapieansprechen durchaus relevant. Hinweise für schlusskriterien (alles klinische) formuliert, die nicht das Vorliegen eines möglichen atypischen Parkinson- vorhanden sein dürfen, sowie «red flags» (ebenfalls kli- Syndroms finden sich in Tabelle 2. nische), die für eine sichere Diagnosestellung auch nicht zugelassen sind [2]. Die Diagnosestellung erfolgt somit klinisch, kann aber in Zweifelsfällen durch eine Zusatzdiagnostik, beispielsweise nuklearmedizinische, bildgebende Methoden, ergänzt werden. Abgesehen von den symptomatischen (sekundären) Parkinson-Syndromen, die durch metabolische (z.B. M. Wilson, Hyperparathyreoidismus, Fahr-Syndrom) oder toxische Ursachen (z.B. Kohlenmonoxid, Mangan), Schädel-Hirn-Traumata, vaskuläre Schäden, Raumforderungen oder auch eine entzündliche Ursache hervor- Tabelle 2: Warnsymptome («red flags»), die auf ein atypisches Parkinson-Syndrom hinweisen (gemäss DGN-Leitlinien). Nichtansprechen auf hohe Dosen von L-DOPA (bis 1000 mg, Resorptionsstörung ausgeschlossen) Frühzeitig im Verlauf auftretende schwere Störungen des autonomen Nervensystems (orthostatische Hypotension, Synkopen, Impotenz oder verringerte genitale Erregbarkeit, Urininkontinenz oder -retention, Anhidrose) Zerebelläre Zeichen Pyramidenbahnzeichen, soweit nicht anderweitig erklärt (z.B. Schlaganfall) Okulogyre Krisen gerufen werden können, sind die Parkinson-Syndrome Ausgeprägter Anterokollis Folge neurodegenerativer Erkrankungen (Tab. 1) [3]. Deutliche (frühzeitige) Dysphagie oder Dysarthrie Supranukleäre vertikale Blickparese Tabelle 1: Parkinson-Syndrome. Frühe posturale Instabilität mit Stürzen (insbesondere nach hinten) Idiopathisches Parkinson-Syndrom Apraxie und/oder Aphasie Genetische Formen des Parkinson-Syndroms Atypische Parkinson-Syndrome Innerhalb des ersten Jahres auftretende Demenz mit Sprach- und Gedächtnisstörungen Demenz mit Lewy-Körpern (DLK) Stark fluktuierende Vigilanz und Müdigkeit Multisystematrophie (MSA) – Parkinsontyp (MSA-P) – Zerebellärer Typ (MSA-C) Innerhalb des ersten Jahres auftretende fluktuierende visuelle Halluzinationen Progressive supranukleäre Parese (PSP) Symmetrische Symptomatik Kortikobasale Degeneration (CBD) Akuter Beginn Somnolenzphasen, spontan oder nach Neuroleptikagebrauch Symptomatische (sekundäre) Parkinson-Syndrome Medikamenteninduziert (u.a. klassische Neuroleptika, L ­ ithium) Parkinsonkrankheit – Pathogenese Tumorbedingt Die Parkinson-Krankheit zählt zu den neurodegenera- Posttraumatisch Toxininduziert (z.B. durch Kohlenmonoxid, Mangan) Entzündlich (enzephalitisch) Metabolisch (z.B. Morbus Wilson, Hypoparathyreoidismus) Vaskuläre Leukoenzephalopathie Hydrozephalus tiven Erkrankungen. Histopathologisches Kennzeichen ist die abnorme Akkumulation und Ablagerung von aggregiertem α-Synuclein, vorwiegend, aber keineswegs ausschliesslich, in den dopaminergen Neuronen des zentralen Nervensystems (ZNS) in Form intrazellulärer Einschlusskörperchen, der «Lewy bodies» (LB). Das idiopathische Parkinson-Syndrom (IPS), das auch Dies führt zu einem Verlust dopaminerger Neurone in als primäres Parkinson-Syndrom, Parkinson-Krank- der Substantia nigra und sekundär zu einem Mangel heit (PD) oder Morbus Parkinson bezeichnet wird, an Dopamin im Putamen und Nucleus caudatus. stellt hierbei den Hauptanteil – etwa 75% der Krank- Die Ursachen sind in den meisten Fällen eines idiopa- heitsfälle – von neurodegenerativen Parkinson-Syn- thischen PS unbekannt – aufgrund des variablen klini- dromen dar und wird daher in der vorliegenden Über- schen Bildes geht man von einer Kombination ver- sichtsarbeit ausführlicher beschrieben. schiedener pathogenetischer Einflüsse aus [4]: SWISS MEDICAL FORUM – SCHWEIZERISCHES MEDIZIN-FORUM 2017;17(20):448– 455 Published under the copyright license “Attribution – Non-Commercial – NoDerivatives 4.0”. No commercial reuse without permission. See: http://emh.ch/en/services/permissions.html 450 Übersichtsartikel AIM 1. Genetische Faktoren: Ein deutlicher Hinweis auf ein muss das Vorliegen eines Parkinson-Syndroms klinisch genetisch bedingtes Parkinson-Syndrom ist typi- nachgewiesen sein. Die Manifestation der motorischen scherweise der Krankheitsbeginn vor dem 40. Le- Kardinalsymptome kann hierbei allerdings von Patient bensjahr. Familiäre, monogenetische Fälle machen zu Patient sehr heterogen sein. Wichtig ist ein schlei- weniger als 5% aus. Es sind mittlerweile über 15 ver- chender Beginn und langsame Symptomprogredienz schiedene Genmutationen mit autosomal domi- sowie eine stets asymmetrische (einseitig betonte) nantem oder rezessivem Erbgang bekannt. Aber Symptomausprägung [3]. auch ausserhalb monogenetischer Fälle spielt die familiäre Belastung eine Rolle: Für Geschwister von Bradykinesie/Akinesie Parkinsonpatienten ist das ­Risiko 6,7-fach und für Bei der Bradykinesie handelt es sich um eine Verlangsa- Kinder 3,2-fach erhöht, auch an PD zu erkranken. mung in der Initiation der Bewegung mit progressiver 2. Metabolische Faktoren, die zu ­erhöhtem oxydativem Verlangsamung bei Ausführung repetitiver Bewegun- Stress führen, so auch mitochondriale Funktionsstö- gen. Die Akinese stellt eine «Extremform» der Bradyki- rungen sowie abnorme Eliminationsmechanismen nese dar und ist durch eine hochgradige Bewegungs­ von Endo- und Exotoxinen werden postuliert. armut oder gar Bewegungslosigkeit gekennzeichnet. 3. Die vermehrte Exposition gegenüber bestimmten Die Brady-/Akinese kann sich nicht nur in einer Ver- Umwelttoxinen wie Schwermetallen (v.a. Mangan, langsamung von Bewegungen der Extremitäten und aber auch Kupfer, Blei oder Eisen), Pestiziden, Herbi- damit auch des Gangbildes äussern, sondern kann sich ziden, Schweissarbeiten und anderen ist epidemio- auch im Gesicht in Form einer Hypomimie oder selte- logisch ein erwiesener Risikofaktor. nem Lidschlag, in der Sprache (Dysarthrophonie) und auch im Schriftbild (Mikrographie) widerspiegeln. Der frühe Nachweis von Ablagerungen des abnormen α-Synucleins auch in extrazerebralen, gastrointestina- Parkinsontremor len Neuronen (Plexus und Ganglien) bei Parkinson­ Der typische Parkinsontremor ist ein Ruhetremor mit patienten hat der exotoxischen Hypothese wieder einer Frequenz von 4–6 Hz. Dieser tritt zu Beginn der Er- ­Auftrieb verliehen. Dies und die Beobachtung einer krankung seitenbetont auf, wird unmittelbar nach einer kaudokranialen Ausbreitung der LB in den ZNS-Neu­ Bewegungsinitiierung vorübergehend unterdrückt und ronen, beginnend im Bulbus olfactorius und in den tritt erst nach längerem statischen Vorhalten der Arme kaudalen Vagus-Kern-Neuronen, macht aktuell den ­ erneut auf («re-emergent tremor»). Bei der klassischen Eintritt eines kausalen Agens via Nasen- oder Darm- distalen Lokalisation an der oberen Extremität entsteht schleimhaut attraktiv (gastrointestinale Hypothese). durch die Pro- und Supinationsbewegung der Hand das Die PD könnte eine weitere Krankheit sein, die durch Bild des sogenannten «Pillendrehertremors». Durch ein abnorm gefaltetes Protein, das sich Prionen-ähn- kontralaterale Aktivierung, beim Gehen oder bei men- lich ausbreitet, verursacht wird. Vor allem weil sich im taler Belastung (wie z.B. Rückwärtszählen) kann sich ein extrazerebralen α-Synuclein-Nachweis möglicherweise latenter Ruhetremor demaskieren oder ein bereits vor- ein sehr früher Biomarker der Krankheit zeigt und handener Ruhetremor an Amplitude zunehmen. Typisch durch die Verhinderung der Proteinausbreitung eine ist beim idiopathischen Parkinson-Syndrom ein dista- Unterdrückung oder zumindest Verzögerung der Krank- les Verteilungsmuster (Arme/Hände, Bein), jedoch kann heitsprogression denkbar wäre, hat diese Hypothese sich ein Ruhetremor auch im Gesicht (Kinn, Lippen und der Parkisonforschung erst kürzlich grossen Auf- Kiefer) manifestieren. Untypische Lokalisationen sind schwung gegeben. Ganz neu sind Forschungsergeb- der Kopf (Ja-Ja- oder Nein-Nein-Tremor) und auch die nisse, die aufzeigen, dass das gastrointestinale Mikro- Stimme (Stimmtremor), die differentialdiagnostisch biom bei Parkinsonpatienten sich nicht nur von dem eher auf eine Dystonie hinweisen. gesunder Personen unterscheidet, sondern damit sogar ein Zusammenhang mit der Art der klinischen Rigor Symptomatik herzustellen ist. Der Rigor ist eine Muskeltonuserhöhung, die vom Pa­ ­ tienten als Steifigkeitsgefühl, gelegentlich sogar Parkinsonkrankheit – Klinik und ­Diagnosestellung schmerzhaft empfunden wird. Überprüft wird der Motorische Symptome Patient sich in einer entspannten Position befinden Die Diagnosestellung eines idiopathischen Parkinson- sollte. Hierbei zeigt sich der Rigor als ein zäher, gleich- Syndroms sollte in vier Schritten erfolgen. Zunächst mässiger, «bleirohrartiger» Widerstand, der im Gegen- ­Rigor durch eine passive Durchbewegung der grösseren Gelenke (Handgelenk, Nacken, Kniegelenk), wobei der SWISS MEDICAL FORUM – SCHWEIZERISCHES MEDIZIN-FORUM 2017;17(20):448– 455 Published under the copyright license “Attribution – Non-Commercial – NoDerivatives 4.0”. No commercial reuse without permission. See: http://emh.ch/en/services/permissions.html 451 Übersichtsartikel AIM satz zur Spastizität geschwindigkeitsunabhängig auftritt. Obwohl das «Zahnradphänomen» oft begleitend auftritt, erfüllt das alleinige Vorhandensein eines «Zahnradphänomens» ohne den zähen, «bleirohrartigen» Wi- Tabelle 3: Nicht motorische Symptome (NMS) bei der Parkinson-Krankheit. Vegetative derstand nicht die notwendigen Kriterien eines Rigors. Schlucken, Magen, Darm (~70%) Posturale Instabilität Schmerzen (~60%) Die posturale Instabilität wird als Störung der reflektorischen Anpassungsbewegungen nach passiver Auslenkung aus dem Gleichgewicht / Veränderung der Körperhaltung im Raum definiert. Sie ist Ausdruck der axialen Harnblase, Sexualfunktion (~80%) Schlafstörungen (50–90%) Müdigkeit (~40%) Atmung Herz-Kreislauf; v.a. Orthostase Riechfunktion Bewegungsstörung und äussert sich in einer Pro-, Retro- Sehfunktion und Lateropulsionstendenz, Festinationen (Propulsion Haut im Gang) und spontaner Stand- und Gangunsicherheit. Psychische Sie zeichnet sich leider durch ein schlechtes Ansprechen Depression (40–60%) auf dopaminerge Medikation aus und führt zu einem Angststörung (~40%) erhöhten Sturzrisiko und einer damit verbundenen er- Halluzinationen heblichen Reduktion der Lebensqualität. Bei der PD tritt die posturale Instabilität typischerweise erst nach einigen Jahren auf, deshalb gilt sie nach den neusten Dia­ gnosekriterien auch nicht als Kernsymptom [2]. Das frühzeitige Auftreten einer posturalen Instabilität (<1 Jahr) gilt als «red flag» und deutet auf ein atypisches Parkinson-Syndrom, insbesondere die progressive supranukleäre Paralyse (PSP) hin. Psychose Apathie Verhaltensstörungen Kognitive Verwirrtheit Demenz (20–30%) Frühe NMS REM-Schlaf-Verhaltensstörung Obstipation Orthostatische Hypotonie In einem zweiten Schritt sollte gezielt durch eine aus- Harndrang führliche Anamnese, bildgebende Verfahren und labor- Depression chemische Untersuchungen nach einer symptomati- Tagesschläfrigkeit schen (sekundären) Ursache gesucht werden (Tab. 1). Hyposmie Darüber hinaus sollte auf Warnsymptome («red flags»), die auf ein atypisches Parkinson-Syndrom hindeuten können, geachtet werden (siehe Tabelle 2). Unterstützende Kriterien, wie z.B. ein deutliches Ansprechen auf Levodopa, das Auftreten Levodopa-induzierter Dyskinesien im Krankheitsverlauf oder auch ein einseitig vorhandener Ruhetremor bekräftigen die Schmerzen Therapie-assoziierte NMS Psychose Orthostatische Hypotonie Tagesschläfrigkeit Schlafattacken Störung der Impulskontrolle Diagnose eines idiopathischen Parkinson-Syndroms. Nicht motorische Symptome Verhaltensstörung (RBD) und die Hyposmie auch vor Neben den motorischen Parkinson-Symptomen sollte dem Beginn der motorischen Symptome manifestie- auch den zahlreichen, nicht motorischen Symptomen ren. Die depressive Symptomatik kann sich nach (NMS) Aufmerksamkeit geschenkt werden, da diese mit ­Einnahme eines Dopaminagonisten/Pramipexol ver- einer signifikanten Reduktion der Lebensqualität der bessern. Sollte jedoch die Einnahme eines Antidepres- betroffenen Patienten einhergehen und zumindest sivums not­wendig sein, wird die Einnahme selek­tiver ­einige von ihnen gut behandelt werden können [3]. Serotonin-Wiederaufnahmehemmer (SSRI) und Sero- Hierzu zählen Störungen von Verhalten und Stimmung, tonin-Noradrenalin-Wiederaufnahmehemmer (SNRI) kognitive Dysfunktion, Störungen der Schlaf-Wach-Re- empfohlen, da diese zu keiner Verschlechterung der gulation, Dysautonomie und Schmerzen (Tab. 3). motorischen Symptomatik führen. Leider werden viele depressive Parkinsonpatienten nicht adäquat be- Depression handelt, weil die depressive Symptomatik innerhalb Ca. 30–40% der Parkinsonpatienten leiden an einer der motorischen PD-Symptomatik nicht e ­rkannt / ­Depression. Diese kann sich ebenso wie die REM-Schlaf- nicht gezielt gesucht wird. SWISS MEDICAL FORUM – SCHWEIZERISCHES MEDIZIN-FORUM 2017;17(20):448– 455 Published under the copyright license “Attribution – Non-Commercial – NoDerivatives 4.0”. No commercial reuse without permission. See: http://emh.ch/en/services/permissions.html 452 Übersichtsartikel AIM Halluzinationen und Psychosen Orthostatische Hypotension Beide Symptome können in Präsentation und Aus­ Blutdruckregulationsstörungen stellen bei vielen Par- prägung sehr variieren (von nicht störenden visuellen kinsonpatienten, insbesondere im Spätstadium der Er- Halluzinationen bis hin zu psychotischen Zuständen krankung, ein grosses Problem dar. Sie werden durch mit ausgeprägten Halluzinationen oder auch Wahn- die dopaminerge Medikation noch verstärkt. Konse­ vorstellungen). Hierbei empfiehlt sich in aller erster kutive Stürze erhöhen die Morbidität beträchtlich. Bis- ­Linie eine Anpassung der dopaminergen Medikation, her gibt es nur unzureichende Evidenz für jegliche Art beispielsweise durch Wechsel von einem Dopamin­ der Therapie. Generell ist je nach Möglichkeit die Re- agonisten auf L-DOPA, Dosisreduktion oder im Ex­ duktion aller Medikamente, die eine orthostatische tremfall Stoppen sämtlicher Medikamente mit einer ­Hypotension verschlechtern können, zu empfehlen; anticholinergen Wirkung. ­daneben sind nicht pharmakologische Massnahmen Sollte dennoch der Einsatz einer antipsychotischen (Stützstrümpfe, Schlafen mit erhöhtem Oberkörper, Medikation notwendig sein, so ist die Einnahme der Erhöhung der Salz- und Flüssigkeitszufuhr) zu empfeh- atypischen Neuroleptika Quetiapin und Clozapin emp- len. Je nach Bedarf können auch Alpha-Sympathomi- fohlen, da diese die motorischen Symptome nicht be- metika (Midodrin) oder Mineralocorticoide (Fludro- ziehungsweise erst in sehr hohen Dosen ungünstig be- cortison) eingesetzt werden. einflussen. Kognitive Einschränkungen Parkinsonkrankheit – Zusatzdiagnostik Die Demenz ist ein grosses Problem im fortgeschritte- Zur Abgrenzung gegenüber einigen symptomatischen nen Stadium, insbesondere für die pflegenden Ange- Ursachen (z.B. Raumforderung, Normaldruckhydroze- hörigen/Betreuenden. Die kognitive Einschränkung phalus, ischämische Läsionen oder Manganintoxika- ist oftmals der Hauptgrund, der schliesslich zur Insti- tion; Tab. 1) sollte im Verlaufe der Erstdiagnose eine bild- tutionalisierung in einem Pflegeheim führt. gebende Untersuchung (Magnetresonanztomographie Gemäss der längsten Follow-up-Studie wird das Ri- [MRT]) erfolgen. Die kranielle Kernspintomographie siko von Parkinsonpatienten, eine Demenz zu entwi- kann auch Befunde erbringen, die auf das Vorliegen ckeln, auf ca. 40% nach 10 Jahren und auf ca. 80% ­eines atypischen Parkinson-Syndroms hindeuten [2]. nach 20 Jahren Krankheitsdauer geschätzt. Jedoch Das Ansprechen auf L-DOPA (mehr als 30 % Verbesse- scheint das Alter (>70 Jahre) einen g ­ rös­seren, relevan- rung im MDS-UPDRS-Score) als bestätigendes diagnos- ten Risikofaktor darzustellen als die Dauer der Er- tisches Kriterium für eine PD kann durch einen Be- krankung. Bei fehlenden Hinweisen auf sympto­ handlungsversuch mit dopaminerger Medikation matische, behandelbare Ursachen der kognitiven innerhalb weniger Tage oder durch den L-DOPA-Test ge- Beeinträchtigung ist der Einsatz von Cholinesterase­ prüft werden. Diesbezüglich bleibt aber anzumerken, inhibitoren (z.B. Rivastigmin) empfohlen. dass der Tremor gelegentlich erst auf höhere L-DOPADosen anspricht und ein negativer L-DOPA-Test das Störungen des autonomen Nervensystems Vorliegen einer PD nicht sicher ausschliesst, sodass bei Viele der betroffenen Patienten leiden an Störungen klinisch dringendem Verdacht ein Behandlungsver- des autonomen Nervensystems, die sich in Form von such mit Levodopa über mehrere Monate (L-DOPA- Obstipation, Blasenfunktionsstörung, orthostatischer Trial) in jedem Fall zu empfehlen ist. Hypotension, erektiler Dysfunktion, Hyperhi­ drosis Der Einsatz von nuklearmedizinischen Techniken, die und Speichelfluss manifestieren können. Informationen über die Integrität des präsynaptischen, Alltagsrelevant sind vor allem die Obstipation und die nigrostriatalen Systems liefern (FP-CIT-SPECT und Fluo- orthostatische Hypotension. Bei der Obstipation soll- rodopa-PET), kann zur Differenzierung zwischen essen- ten zunächst alle Medikamente reduziert oder abge- tiellem Tremor und PD oder zum Ausschluss eines me- setzt werden, die potenziell eine Obstipation ver- dikamenteninduzierten Parkinson-Syndroms hilfreich schlechtern können; hierzu zählen insbesondere die sein. Eine sichere Unterscheidung zwischen einer PD anticholinerge Medikation und auch die Dopaminago- und einem atypischen PS ist durch diese Untersuchung nisten. Wichtig ist eine regelmässige und ausreichende allerdings nicht möglich. Hierzu können Verfahren zur Flüssigkeitszufuhr, eine ballaststoffreiche Ernährung, Darstellung der postsynaptischen Dopaminrezeptoren und regelmässige körperliche Betätigung. Sollte eine (IBZM-SPECT und Raclo­prid- oder Desmethoxyfallyprid- abführende Medikation notwendig sein, wird am ehes- PET) von Nutzen sein. In Anbetracht der Kosten und ten der Gebrauch von Quellstoffen wie Macrogol emp- meist fehlender therapeutischer Konsequenz sollten fohlen. diese Untersuchungen nur gezielt eingesetzt werden. SWISS MEDICAL FORUM – SCHWEIZERISCHES MEDIZIN-FORUM 2017;17(20):448– 455 Published under the copyright license “Attribution – Non-Commercial – NoDerivatives 4.0”. No commercial reuse without permission. See: http://emh.ch/en/services/permissions.html 453 Übersichtsartikel AIM Fremdanamnestische Angaben (Sprechen und Bewe- Die retardierten Levodopa-Präparate (Madopar DR® gungsunruhe im Schlaf, aus dem Bett fallen, lebhafte oder Sinemet CR®) sollten nur zur Nacht eingesetzt Albträume), die auf eine REM-Schlaf-Verhaltensstörung werden, da die verzögerte gastrointestinale Aufnahme hindeuten, können ein weiterer Hinweis auf eine neu- von Levodopa dazu führt, dass Levodopa mit Nah- rodegenerative Genese des PS (z. B. IPS oder MSA) geben rungseiweissen um die gastrointestinale Resorption und durch eine Polysomnographie erhärtet werden. konkurriert, was die Bioverfügbarkeit reduziert und Die Durchführung eines Schellong-Tests ist bei klini- der erreichte Plasmaspiegel erratisch wird. Bei nicht schen Hinweisen für eine autonome Störung oder bei retardierten Präparaten lässt sich dies einfach ver­ Verdacht auf eine MSA indiziert. Pathologisch ist hier- meiden, indem die Medikamenteneinnahme im Ab- bei ein systolischer Blutdruckabfall von mehr als stand von 30 min vor oder 60 min nach der Mahlzeit 20 mm Hg im Stehen. erfolgt. Bei Erkrankungsbeginn vor dem 50. Lebensjahr und Zu Beginn der Erkrankung kann, insbesondere bei ­klinischem Verdacht auf Morbus Wilson sollte die Be- ­jüngeren und kognitiv unauffälligen Patienten eine stimmung von Kupfer und Coeruloplasmin im Serum so- Monotherapie mit Dopaminagonisten erfolgen. Dopa- wie von Kupfer im 24-Stunden-Sammelurin erfolgen. minagonisten wirken direkt an den striatalen Dopa- Eine genetische Testung ist in der Regel bei Patienten minrezeptoren. Der Vorteil dieser dem Neurotrans- <40 Jahren empfehlenswert. Bei einem Erkrankungs­ mitter Dopamin ähnlichen Substanzen, ist die im alter >40 ist die Ausbeute der genetischen Testung un- Gegensatz zum L-DOPA längere Wirkdauer, bei den ergiebig; ausser es besteht ein eindeutiger mendeli- ­Retardpräparaten ist nur eine einmalige Einnahme am scher Vererbungsmodus wie zum Beispiel eine positive Tag notwendig. Zudem kann durch den Therapie­ Familienanamnese. beginn mit Dopaminagonisten und den dadurch ­späteren Einsatz von L-DOPA das Auftreten L-DOPA-­ Parkinsonkrankheit – Therapie induzierter Dyskinesien verzögert werden. Der Dopamin­agonist Rotigotin ist die einzige Substanz, die Eine kausale Therapie des Morbus Parkinson ist bislang zur transdermalen Applikation (Patch) zur Verfügung noch nicht möglich, auch kennen wir bislang keine steht. Das bietet nebst der potentiell kontinuierlichen Therapien zur Prävention der Krankheit oder ihrer Medikamentenapplikation auch Vorteile, wenn zum Progression. Insbesondere in den ersten Jahren der Er- Beispiel betont nächtliche Symptome bestehen oder krankung lassen sich deren Symptome jedoch gut wenn eine orale Applikation nur bedingt möglich ist durch Medikamente und Bewegungstherapie beein- (z.B. nach gastrointestinalen Operationen, Schluckstö- flussen, was den Patienten eine gute Lebensqualität er- rungen). möglicht [5]. Da die Krankheitsprogression nicht durch Dopaminagonisten können jedoch Nebenwirkungen Medikamente zu beeinflussen ist, hängt der Beginn auf das Verhalten haben, über die der behandelnde Arzt ­einer medikamentösen Therapie von den individuellen den Patienten und insbesondere auch dessen Angehö- Bedürfnissen des Patienten ab. Sie sollte aber nicht nur rige im Vorfeld aufklären sollte. So können Impulskon­ die motorischen, sondern auch die autonomen, kogni- trollstörungen wie Spielsucht, vermehrtes Risikover- tiven und psychiatrischen Symptome sowie die kom- halten, Kaufsucht, Sexsucht und Esssucht auftreten, die munikativen Fähigkeiten berücksichtigen. je nach Ausprägung schwerwiegende persönliche und An Substanzen stehen aktuell L-DOPA-Präparate in finanzielle Konsequenzen mit sich bringen können. Zu- Kombination mit einem Decarboxylasehemmer oder dem können durch Dopaminagonisten eine bei der Dopaminagonisten zur Verfügung, daneben können Parkinson-Erkrankung vermehrt auftretende Tages­ MAO-B-Hemmer eingesetzt werden und insbesondere schläfrigkeit verstärkt und Beinödeme begünstigt bei Tremor auch Anticholinergika. ­werden. Daneben kann ein sogenanntes «punding» Zur Verlängerung der L-DOPA-Wirkung im fortge- auftreten (zwanghafte Faszination und wiederholtes schrittenen Stadium können Levodopa-Präparate zu- Durchführen von Tätigkeiten wie Zusammen- und wie- sätzlich mit COMT-Hemmern (Entacapon, Tolcapon) der Auseinanderbauen, Sammeln oder Sortieren). Das kombiniert werden. Levodopa plus Decarboxylase- Auftreten dieser Nebenwirkungen ist individuell unter- hemmer plus Entacapon ist in einem Kombinations- schiedlich und dosisabhängig und wird oft unterschätzt präparat erhältlich (Stalevo®). Bei der zusätzlichen respektive nicht genügend exploriert. Diese neuropsy- Gabe von Tolcapon zu Levodopa plus Decarboxylase- chiatrischen Nebenwirkungen können das Nutzen/Ri- hemmer muss aufgrund einer möglichen Hepatotoxi- siko-Verhältnis zu Ungunsten der Dopaminagonisten zität in der Umstellungsphase eine engmaschige Kon­ kippen, sodass der frühe Einsatz von L-DOPA durchaus trolle der Transaminasen erfolgen. auch bei jüngeren Patienten zu bevorzugen ist. SWISS MEDICAL FORUM – SCHWEIZERISCHES MEDIZIN-FORUM 2017;17(20):448– 455 Published under the copyright license “Attribution – Non-Commercial – NoDerivatives 4.0”. No commercial reuse without permission. See: http://emh.ch/en/services/permissions.html 454 Übersichtsartikel AIM Bei fortgeschrittener Erkrankung ist eine alleinige Magenentleerung. Aufgrund der hohen Therapiekos- Therapie mit Dopaminagonisten jedoch nicht mehr ten und des technischen Aufwands kommt diese Thera- ausreichend, sodass eine Kombinationstherapie von pieform vor allem bei starken Wirkungsfluktuationen Levodopa-Decarboxylasehemmer und Dopaminago­ unter den peroralen Substanzen zum Einsatz. nisten notwendig wird. Bei Beginn der L-DOPA-Thera- Apomorphin ist ein subkutan via Pen oder kontinuier- pie ist meistens ein Einnahmeintervall von 5 Stunden lich via Pumpe applizierbarer kurz wirksamer Dopa- und drei Einnahmedosen ausreichend. Mit zunehmen- minagonist. Es wird angewandt bei nicht einsetzbarer der Neurodegeneration werden jedoch kürzere Ein- oraler Medikation oder wenn die orale Medikation die nahmeintervalle notwendig, da die Wirkdauer der Ein- Symptome wie schwere oder akut einsetzende und zeldosen abnimmt. Durch die Kombination mit einen schmerzhafte «off»-Perioden oder Dystonien nicht COMT-Hemmer kann die Wirkdauer etwas verlängert kontrollieren kann. werden. Bei abnehmender Wirkdauer von L-DOPA, sehr häufigen Mit fortschreitender Neurodegeneration nimmt die Einnahmefrequenzen, intolerablen Dyskinesien oder Empfindlichkeit der verbliebenen Neuronen auf schwan- ausgeprägten, schmerzhaften Blockaden, die medika- kende Levodopa-Plasmaspiegel zu, sodass es vor allem mentös nicht ausreichend zu unterdrücken sind, kann beim Erreichen des Wirkungspeaks zu Überbewegun- der Einsatz einer Tiefen Hirnstimulation (DBS, «deep gen, sogenannten Dyskinesien, kommt (Peak-Dose- brain stimulation») evaluiert werden. Hier ist die ad- Dyskinesien). Eine günstige Massnahme kann hier äquate Patientenselektion ein für den Erfolg ganz ent- sein, die Einzeldosen zu reduzieren und die Einnahme- scheidender Faktor. frequenzen zu erhöhen. Beim Morbus Parkinson sind hierbei drei Zielgebiete Regelmässiges Bewegungstraining (>150 min / Woche) etabliert. Junge (<70 Jahre), psychiatrisch unauffällige führt auch im Langzeitverlauf und unabhängig von der und kognitiv nicht eingeschränkte Patienten, die un- Krankheitsdauer zu einer Verbesserung von Lebens- ter L-DOPA keine oder nur minimale axiale Symptome qualität, Beweglichkeit und Selbständigkeit sowie einer zeigen, profitieren am ehesten von einer tiefen Hirn- Verlangsamung der Krankheitsprogression und des ko- stimulation im Nucleus subthalamicus (STN). gnitiven Abbaus. Ein individuell angepasstes modera- Beim tremordominantem Parkinson-Syndrom, insbe- tes Bewegungstraining mehrmals die Woche ist daher sondere im höheren Lebensalter ist der Nucleus ven­ in jedem Krankheitsstadium sehr zu empfehlen. tralis intermedius (VIM) eine gute Option. Die häufig Mit dem weiteren Fortschreiten der Erkrankung kön- zur Tremorkontrolle nötigen hohen L-DOPA-Dosen nen sogenannte biphasische Dyskinesien auftreten. können postoperativ deutlich reduziert werden, wo- Beim Über- oder Unterschreiten eines gewissen Plas- mit auch die beim älteren Patienten häufig störenden maspiegels kommt es zu unkontrollierten ausfahren- Nebenwirkungen der L-DOPA-Therapie wie Blutdruck- den, brüsken und teilweise schmerzhaften Bewegun- regulationsstörungen und Halluzinationen ebenfalls gen. Die sogenannten biphasischen Dyskinesien lassen reduziert werden können. sich unterdrücken, indem der Plasmaspiegel dauerhaft Die Stimulation im Globus pallidus internus (GPi) hat oberhalb des kritischen Niveaus gehalten wird (Dosis- ebenfalls einen günstigen Effekt auf die motorischen steigerung). Parkinsonsymptome, dieser ist jedoch weniger ausge- Der N-Methyl-D-Aspartat(NMDA)-Antagonist Amanta- prägt als bei der Stimulation im STN. Daher kann bei din ist einerseits antihypokinetisch wirksam, zusätzlich einer GPi-Stimulation die L-DOPA-Dosis postoperativ reduziert er für eine gewisse Zeit L-DOPA-induzierte nur wenig reduziert werden. Die Gefahr von postope- Dyskinesien. Bei kognitiv eingeschränkten Patienten rativen Verhaltensauffälligkeiten und Verschlechte- sollte jedoch auf die Gefahr von Halluzina­tionen, ins- rung des Gangbildes ist bei der Stimulation im GPi besondere bei abendlicher Gabe, geachtet werden. ­geringer, zudem unterdrückt die Stimulation im GPi Ebenso ist wegen der Gefahr der QT-Zeit-Verlängerung sehr gut die störenden Dyskinesien. bei kardialen Patienten die entsprechende Vorsicht ge- In den ersten Wochen nach der Operation sind regel- boten. Amantadin ist das einzige Präparat, das intrave- mässige Kontrollen und Anpassungen der Stimulation nös gegeben werden kann. wichtig, einerseits um den abklingenden Läsionseffekt Die kontinuierliche intrajejunale Levo-DOPA-Infusion (Symptomreduktion alleine durch das perifokale via perkutane gastrojejunale Sonde über eine Pumpe Ödem im Zielgebiet) abzufangen und die Therapie ent- («levodopa-carbidopa intestinal gel» [LCIG]) hat den sprechend anzupassen, andererseits auch um frühzei- Vorteil der kontinuierlichen L-DOPA-Plasmaspiegel, tig Komplikationen wie zum Beispiel Verhaltensauffäl- das heisst keine pulsatile Rezeptorstimulation, sowie ligkeiten zu erkennen und entsprechende Massnahmen der Unabhängigkeit der Medikamentenzufuhr von der treffen zu können. SWISS MEDICAL FORUM – SCHWEIZERISCHES MEDIZIN-FORUM 2017;17(20):448– 455 Published under the copyright license “Attribution – Non-Commercial – NoDerivatives 4.0”. No commercial reuse without permission. See: http://emh.ch/en/services/permissions.html 455 Übersichtsartikel AIM Verschiedene NMS sind ebenfalls einer Therapie zu- Befall extrazerebraler, gastrointestinaler Neurone Prof. Dr. med. gänglich, besonders sei auf die Depression hingewiesen. nahe und haben die histopathologische Ausbreitung der Mathias Sturzenegger Es ist wichtig, eine Depression, die bei PD gehäuft auf- «Lewy bodies» im Zeitverlauf korrelierend mit der kli­ tritt, als solche zu erkennen und nicht einfach der Par- nischen Symptomatik aufgezeigt. Diese neuen Erkennt- kinsonkrankheit zu subsummieren. Die Depression nisse wecken Hoffnungen hinsichtlich einer ­Primär- beim M. Parkinson kann und soll gezielt und erfolg- oder Sekundärprävention der PD. Dass genetische CH-3010 Bern reich behandelt werden (z.B. mit SSRI oder SNRI, z.B. Faktoren eine Rolle spielen, zeigen epidemiologische matthias.sturzenegger[at] Venlafaxin, Citalopram), da dies die Lebensqualität der Studien klar auf; wie aber diese bei der überwiegenden Patienten entscheidend verbessert. Zahl (ca. 95%) der nicht monogenetischen PD-Fälle ins Korrespondenz: Chefarzt und Stv. Klinik­ direktor Neurologische Universitätsklinik Inselspital Bern insel.ch. Spiel kommen und über welche (metabolischen) MeZusammenfassend ist der Morbus Parkinson heute chanismen, muss noch geklärt werden [4]. Man geht eine weiterhin nicht heilbare, aber doch über lange heute von einer Vielzahl möglicher Ursachen der PD Zeit sehr gut behandelbare Erkrankung. Da bislang aus, die beim individuellen Patienten unterschiedlich keine Hinweise auf eine mögliche Verzögerung der kombiniert sein können. Daraus ist abzuleiten, dass es Krankheitsprogression durch medikamentöse Mass- wohl schwierig werden könnte, kausale Therapien zu nahmen bestehen, sollte bezüglich Therapiebeginn finden. Somit sind berechtigterweise viele Forschungs- und Therapieanpassung immer das individuelle Be- anstrengungen auf restorative Therapiemethoden aus- dürfnis des Patienten im Vordergrund stehen. gerichtet. Hier ist von Seiten der Stammzellforschung mit dem Ziel des Ersatzes der verlorenen dopaminer- Ausblick gen und anderer Neurone einiges zu erwarten. Mit dem Ziel einer krankheitsmodifizierenden Behand- Anatomisch-pathologische Studienbefunde aus Lang- lung werden aktuell aktive und passive Immunisie- zeituntersuchungen der letzten Jahre legen den frühen rung gegen α-Synuclein und Inhibitoren oder Modulatoren der α-Synuclein-Aggregation in klinischen Studien Das Wichtigste für die Praxis • Vor jeder Therapie steht die korrekte Diagnose. Entscheidend für Therapieerfolg und Prognose ist die Abgrenzung des idiopathischen von sekun- evaluiert [5]. Verdankung Wir danken Frau Dr. med. Daniela Wiest, Fachärztin für Neurologie in Biel, für die kritische Durchsicht des Manuskripts. dären (symptomatischen) und anderen neurodegenerativen (atypischen) Parkinsonsyndromen. • Die Therapie der motorischen Symptome ist in den ersten Jahren sehr effizient («honey moon»); sie umfasst Pharmako- und Bewegungstherapie. Disclosure statement Die Autoren haben keine finanziellen oder persönlichen Verbindungen im Zusammenhang mit diesem Beitrag deklariert. Die Wahl von Medikation und Dosis muss individuell erfolgen und beurteilt werden. • Die nicht motorischen Symptome (NMS) können für die Beeinträchtigung der Lebensqualität dominieren und sollen gezielt erfasst und auch behandelt werden. Besonders sei hier die Depression erwähnt. • Parkinsonpatienten sollten vom Fachneurologen erstdiagnostiziert und bezüglich Therapieerfolg mitbeurteilt werden. • Bei ungenügendem Therapieansprechen oder Effizienzverlust im Verlauf sowie bei Therapiekomplikationen müssen eventuell invasive Therapiemassnahmen erwogen werden. Dazu soll eine Beurteilung in einem Zentrumsspital mit diesbezüglichem Angebot erfolgen. Literatur 1 Lee A, Gilbert RM. Epidemiology of Parkinson Disease. Neurol Clin. 2016;34(4):955–65. 2 Postuma RB, Berg D, Stern M, Poewe W, Olanow CW, Oertel W, et al. MDS clinical diagnostic criteria for Parkinson’s disease. Mov Disord. 2015;30(12):1591–601. 3 Christopher W. Hess, Michael S. Okun. Diagnosing Parkinson Disease. Continuum (Minneap Minn) 2016;22(4):1047–63. 4 von Coelln R, Shulman LM. Clinical subtypes and genetic heterogeneity: of lumping and splitting in Parkinson disease. Curr Opin Neurol. 2016;29(6):727–34. 5 Oertel W, Schulz JB. Current and experimental treatments of Parkinson disease: A guide for neuroscientists. J Neurochem. 2016;139Suppl1:325–37. SWISS MEDICAL FORUM – SCHWEIZERISCHES MEDIZIN-FORUM 2017;17(20):448– 455 Published under the copyright license “Attribution – Non-Commercial – NoDerivatives 4.0”. No commercial reuse without permission. See: http://emh.ch/en/services/permissions.html