Thieme: Taschenatlas Pathophysiologie
Werbung

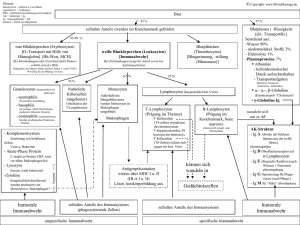
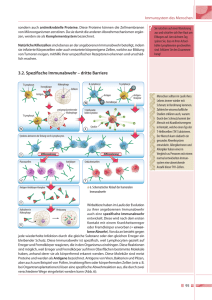
3 Blut 46 Immunabwehr Gegen Mikroorganismen (Bakterien, Viren, Pilze, Parasiten) und als „fremd“ identifizierte Makromoleküle besitzt der Körper eine unspezifische, angeborene und eine (damit verzahnte) spezifische, erworbene oder adaptive Immunabwehr. Erregerteile und großmolekulare Fremdstoffe stellen Antigene dar, auf die das spezifische Abwehrsystem mit der Aktivierung und Vermehrung monospezifischer Tund B-Lymphozyten (kurz: B- bzw. T-Zellen) reagiert. B-Zellen differenzieren dabei zu Plasmazellen, die Antikörper (Immunglobuline, Ig, mit den Untergruppen IgA, IgD, IgE, IgG, IgM) produzieren. Deren Aufgabe ist es, Antigene a) zu neutralisieren und b) zu opsonisieren sowie c) das Komplementsystem zu aktivieren (s. u.). Diese hochspezifischen Mechanismen der Immunabwehr dienen der Erkennung des jeweiligen Antigens, dessen Eliminierung dann relativ unspezifisch erfolgt. Außerdem wird das Antigen (mit T- bzw. BGedächtniszellen) „in Erinnerung“ behalten: immunologisches Gedächtnis. Aus den lymphatischen Vorläuferzellen, die noch keine Antigenrezeptoren besitzen, wird bei der Prägung im Thymus (T-Zellen) bzw. im Knochenmark (B-Zellen) ein Repertoire von > 108 verschiedenen monospezifischen, also jeweils gegen ein bestimmtes Antigen gerichteten, Lymphozytentypen gebildet. Solche, noch „naive“ Lymphozyten kreisen durch den Organismus (Blut → peripheres lymphatisches Gewebe → Lymphe → Blut). Entdecken sie dabei „ihr“ Antigen, was meist im lymphatischen Gewebe geschieht, vermehrt sich genau dieser Lymphozytentyp (klonale Selektion und Proliferation), und es entstehen zahlreiche, monospezifische Tochterzellen. Diese differenzieren sich zu „bewaffneten“ T-Zellen bzw. Plasmazellen, die schließlich für die Eliminierung des Antigens sorgen. Lymphozyten mit Rezeptoren gegen körpereigenes Gewebe werden nach der Erkennung „ihres“ Antigens frühzeitig im Thymus bzw. im Knochenmark eliminiert. Diese klonale Deletion bewirkt also eine (zentrale) immunologische Toleranz. Solcherart zwischen fremden und körpereigenen Antigenen zu unterscheiden, „lernt“ das Immunsystem etwa zum Zeitpunkt der Geburt. Die Stoffe, mit denen es zu dieser Zeit Kontakt bekommt, erkennt es normalerweise lebenslang als körpereigen, alle später dazukommenden als „fremd“. Versagt diese Unterscheidung, kommt es zu Autoimmunerkrankungen (→ S. 60). Das unspezifische System alleine kann, z. B. bei einer erstmaligen Maserninfektion, selten ver- hindern, dass sich die Viren im Körper vermehren und ausbreiten, d. h., es kommt zur Erkrankung. Die spezifische Immunabwehr mit T-Killerzellen (→B 2 auf S. 50 f.) und Immunglobulinen (zuerst IgM, dann IgG; →B 5) tritt nur langsam in Aktion (Primärantwort oder Sensibilisierung), schafft es aber dann doch, die Erreger unschädlich zu machen, d. h. die Masern heilen ab. Bei einer Zweitinfektion setzt die Antikörperproduktion (v. a. IgG) schlagartig ein (Sekundärantwort), die Viren werden gleich anfangs eliminiert, und eine erneute Erkrankung bleibt aus: Immunität. (Die Primärantwort mit anschließender Immunität kann auch durch Impfung mit Erreger-Antigen erreicht werden: aktive Immunisierung.) Der unspezifischen Abwehr (→ A) dienen gelöste Abwehrstoffe wie Lysozym und Komplementfaktoren (→ A 1) sowie Phagozyten, also v. a. Makrophagen (entstehen im Gewebe aus eingewanderten Monozyten) und neutrophile Granulozyten (→ A 2). Letztere werden, ebenso wie Monozyten und eosinophile Granulozyten, im Knochenmark gebildet, durchstreifen den Körper und werden schließlich an Orte, wo sich Erreger befinden, durch Chemokine angelockt (Chemotaxis). Dort setzen sie über die Ausschüttung weiterer Mediatoren die Entzündung in Gang (→ A 2, 4 u. S. 52 ff.). Die Phagozyten endozytieren den Erreger oder „fangen“ ihn in extrazellulären Pseudopodien-Netzen, schädigen ihn (vor allem nach ihrer Aktivierung, s. u. und B 6) durch Lysozym, durch Oxidantien wie Wasserstoffperoxid (H2O2) und Sauerstoffradikale (O2–, OH·, 1O2), durch Stickstoffmonoxid (NO) u. a. und „verdauen“ ihn mit ihren lysosomalen Enzymen (Lyse). Ist das Antigen zu groß (z. B. Würmer), werden die genannten Abwehrstoffe auch exozytiert (in diesem Fall v. a. von eosinophilen Granulozyten; → S. 170). Normalerweise wird die Konzentration der genannten Oxidanzien durch reduzierende Enzyme wie Katalase und Superoxid-Dismutase niedrig gehalten. Diese „Zügelung“ wird bei der Aktivierung des Phagozyten aufgegeben, wobei allerdings auch der Phagozyt selbst und u. U. sogar andere körpereigene Zellen geschädigt werden. Phagozytose und Lyse werden verstärkt (und bei Bakterien mit Polysaccharidkapsel erst ermöglicht), wenn die Antigenoberfläche mit IgM, IgG oder der Komplementkom- ▶ aus: Silbernagl u. a., Taschenatlas Pathophysiologie (ISBN 9783131021939) © 2009 Georg Thieme Verlag KG Tafel 3.8 Immunabwehr I 3 Blut A. Unspezifische Immunabwehr, verstärkt durch spezifische Antikörper zellulär humoral Rezeptoren für Fc und C3b Lysozym schädigt Membranen Interferone (IFN) neutrophile Granulozyten, Monozyten ® Makrophagen IFNa, b und g hemmen Virusvermehrung; IFNg aktiviert Makrophagen, Killerzellen, B- und T-Zellen Phagozytose Komplementaktivierung alternativ C3 An Antigenopsonisierung durch Ig und C3b Freisetzung von: Oxidanzien Proteasen Entzündungsmediatoren C1q Membranschädigung aktivierte Makrophagen (s. B6) en tig An C3a C4a C5a Entzündung Antigenopsonisierung An tig en Entzündungsmediatoren Aktivierung Membranangriffskomplex (C5 C9) 4 tig en Mastzellen, basophile Granulozyten Zytolyse Proteasen + Na Perforine H2O natürliche Killerzelle An + Na 3 H2O Oxidanzien Antigen: Erreger, Fremdzelle, virusinfizierte Körperzelle Ig Lyse Antigen-AntikörperKomplexe C3b C3b 1 klassisch C1q Mikroorganismen en tig 2 eosinophile Granulozyten ADCC Fc-Rezeptor IgE IgG Fc IgG 47 IgA IgE IgM IgG Immunglobuline (s. B5) aus: Silbernagl u. a., Taschenatlas Pathophysiologie (ISBN 9783131021939) © 2009 Georg Thieme Verlag KG