Problematische Wechselwirkungen zwischen den meistverkauften
Werbung

Diplomarbeit
Problematische Wechselwirkungen zwischen den
meistverkauften OTC-Präparaten in Österreich und
verschreibungspflichtigen Medikamenten
eingereicht von
Benedikt Humpel
zur Erlangung des akademischen Grades
Doktor der gesamten Heilkunde
(Dr. med. univ.)
an der
Medizinischen Universität Graz
ausgeführt am
Institut für Experimentelle und Klinische Pharmakologie
unter der Anleitung von Univ.-Prof.i.R. Mag.pharm. Dr. Eckhard
Beubler und Univ.-Prof. Dr.med.univ. Josef Donnerer
Graz, 21.02.2017
Eidesstattliche Erklärung
Ich erkläre ehrenwörtlich, dass ich die vorliegende Arbeit selbstständig und ohne
fremde Hilfe verfasst habe, andere als die angegebenen Quellen nicht verwendet
habe und die den benutzten Quellen wörtlich oder inhaltlich entnommenen Stellen
als solche kenntlich gemacht habe.
Graz, am 21.02.2017
Benedikt Humpel eh.
i
Danksagungen
Ich möchte mich bei meinen Diplomarbeitsbetreuern, speziell Herrn Univ.-Prof.i.R.
Mag.pharm. Dr. Eckhard Beubler für die Hilfe bei der Themenauswahl, für organisatorische Hilfe in der Anfangsphase, konstruktive Kommentare zum Aufbau und
den allgemein unkomplizierten Ablauf bei der Diplomarbeit bedanken.
Ein unglaublich großer Dank gebührt auch meinen Eltern, die es mir ermöglicht
haben, die Schule mit Matura abzuschließen, meinen zukünftigen Bildungsweg
selbst auszuwählen und mich die gesamte Ausbildung nicht nur mit ihrem Zuspruch unterstützt, sondern auch finanziert haben. Ohne sie und ihre Geduld wäre
es nicht möglich gewesen, diese Arbeit und das Studium abzuschließen.
Danke an meine Geschwister Sebastian, Magdalena und Teresa, die mich während des Studiums auch unterstützt haben.
Danke an den Meister der deutschen Sprache, Roman, der meine Arbeit korrigiert
hat. Danke auch an Martin und Angelika, die im englischen Teil der Arbeit meine
Fehler ausgemerzt haben.
Zuletzt ein großes Dankeschön an meine Familie, Freunde, Sportler und Bekannte, die mich durch meine Studienzeit begleitet haben und diese Zeit zu etwas ganz
Besonderem gemacht haben.
ii
Zusammenfassung
Hintergrund: Viele Menschen, vor allem jene der älteren Bevölkerungsgruppe,
nehmen Dauermedikamente ein. Oft werden zusätzliche rezeptfreie Medikamente
aus der Apotheke ohne Rücksprache mit einem Arzt oder einer Ärztin eingenommen. Dies kann zu Problemen führen.
Methoden: Aus bestehender Literatur wurden mögliche Interaktionen der am häufigsten verkauften, rezeptfrei in Österreich erhältlichen Medikamente herausgearbeitet.
Ergebnisse: Wie erwartet zeigen viele der häufig verkauften Over-the-counterPharmaka mögliche Wechselwirkungen mit verschreibungspflichtigen Medikamenten, die aber von Mensch zu Mensch verschieden stark ausgeprägt sein können.
In der Gruppe der topisch applizierten Präparate sind bei kleinflächiger, zeitlich
begrenzter Anwendung kaum Wechselwirkungen zu erwarten. Daten über systemische Bioverfügbarkeiten sind bei den meisten Wirkstoffen begrenzt bzw. kontrovers.
Bei Pharmaka, die topisch auf Schleimhäute bzw. im Darm wirken, sind keine
Wechselwirkungen zu erwarten.
Bei systemisch wirkenden Pharmaka sind vor allem Acetylsalicylsäure, Ibuprofen
und Paracetamol Wirkstoffe, die mit anderen Medikamenten interagieren. Die sauren Wirkstoffe erhöhen in Kombination mit gerinnungshemmenden Substanzen
unter anderem das Risiko für Blutungen, Paracetamol verursacht unter anderem
eine verlängerte INR-Zeit unter Cumarin-Therapie.
Systemisch eingenommene Antihistaminika verstärken einen durch andere Medikamente verursachten zentral dämpfenden Effekt.
Schlussfolgerung: Unter den häufigsten, rezeptfrei erhältlichen Präparaten, befinden sich vor allem unter den systemisch angewandten einige Wirkstoffe, die bei
gleichzeitiger Einnahme mit anderen Medikamenten interagieren können.
iii
Abstract
Background: Many people, especially elderly, are under treatment with permanent medication. In addition to that, people often use over-the-counter drugs purchased in pharmacies without consulting their doctor first, which can lead to problems.
Methods: Existing literature has been studied for possible interactions of the bestselling, non-prescription drugs in combination with prescription drugs in Austria.
Results: As expected, many of the best-selling over-the-counter drugs have possible interactions with prescription drugs, which can differ from individual to individual.
Within topically applied pharmaceuticals no interactions are to be expected when
applied on small areas and over a short period only. Data for systemic bioavailability are limited or controversial for most of the substances. Furthermore, no interactions are to be expected with pharmaceuticals which are applied on the mucosa or
with topical action in the intestines. In contrast, pharmaceuticals which are used
systemic, especially Acetylsalicylicacid, Ibuprofen and Paracetamol, often interact
with other substances. Acidic analgesics, for example, increase the risk of suffering from bleedings in combination with substances that alter coagulation, while
Paracetamol prolongs the INR-time with concurrent coumarin-therapy.
The use of systemic antihistamines intensifies the general supressing effects
caused by other pharmaceuticals.
Conclusion: Among the best-selling, over-the-counter drugs, many have possible
interactions with prescription-medication, especially those which are taken orally
with systemic action.
iv
Inhaltsverzeichnis
Danksagungen ........................................................................................................ ii
Zusammenfassung ................................................................................................. iii
Abstract .................................................................................................................. iv
Inhaltsverzeichnis .................................................................................................... v
Glossar und Abkürzungen .................................................................................... viii
Tabellenverzeichnis ................................................................................................ ix
1
Einleitung ........................................................................................................ 1
1.1
Problem: Selbstmedikation ...................................................................... 1
1.2
Arzneimittelinteraktionen .......................................................................... 2
1.2.1
Pharmakokinetische Interaktionen ...................................................... 2
1.2.1.1
Absorption .................................................................................... 2
1.2.1.2
Verteilung im Körper .................................................................... 3
1.2.1.3
Metabolismus ............................................................................... 3
1.2.1.4
Ausscheidung............................................................................... 4
1.2.2
Pharmakodynamische Interaktionen ................................................... 4
1.2.2.1
Synergistische/Additive Wirkung .................................................. 4
1.2.2.2
Antagonistische Wirkung .............................................................. 4
1.2.2.3
Wiederaufnahme von Neurotransmittern...................................... 4
2
Material und Methoden.................................................................................... 5
3
Die häufigsten rezeptfreien Präparate ............................................................. 6
4
3.1
Daten von Apothekern ............................................................................. 6
3.2
Daten von IMS Health .............................................................................. 8
3.2.1
Daten 3. Quartal 2015 ........................................................................ 8
3.2.2
Daten Gesamtjahr 2014 .................................................................... 10
Arzneimittelinteraktionen ............................................................................... 13
4.1
Topische Arzneimittel, Anwendung auf der Haut ................................... 13
4.1.1
Benzocain ......................................................................................... 14
4.1.2
Bifonazol ........................................................................................... 15
4.1.3
Clotrimazol ........................................................................................ 16
4.1.4
Dexpanthenol.................................................................................... 16
4.1.5
Diclofenac ......................................................................................... 17
4.1.6
Dimetindenmaleat ............................................................................. 19
v
4.1.7
Diphenhydraminhydrochlorid ............................................................ 19
4.1.8
Mucopolysaccharidpolyschwefelsäureester ...................................... 20
4.1.9
Povidon-Iod Komplex........................................................................ 21
4.1.9.1
Povidon-Iod und die Schilddrüse................................................ 21
4.1.9.2
Povidon-Iod und Blutzucker ....................................................... 22
4.1.9.3
Zusammenfassung Povidon-Iod................................................. 22
4.1.10
4.2
Zusammenfassung topische Arzneimittel ...................................... 22
Topische Arzneimittel, Anwendung auf den Schleim-häuten ................. 23
4.2.1
Benzydaminhydrochlorid .................................................................. 23
4.2.2
Oxymetazolinhydrochlorid, Xylometazolin ........................................ 24
4.3
Arzneimittel mit topischer Wirkung nach oraler Einnahme ..................... 25
4.3.1
4.4
Enterococcus faecium ...................................................................... 26
Oral systemisch wirksame Medikamente ............................................... 26
4.4.1
Acetylcystein ..................................................................................... 27
4.4.2
Acetylsalicylsäure ............................................................................. 27
4.4.2.1
ASS und Antiepileptika ............................................................... 27
4.4.2.2
ASS und blutdrucksenkende Substanzen .................................. 27
4.4.2.3
ASS und gerinnungshemmende Substanzen............................. 29
4.4.2.4
ASS und Psychopharmaka ........................................................ 30
4.4.2.5
ASS und Medikamente mit Einfluss auf den Stoffwechsel ......... 30
4.4.2.6
ASS und orale Kontrazeptiva ..................................................... 31
4.4.2.7
ASS und sonstige Medikamente ................................................ 31
4.4.2.8
Zusammenfassung Acetylsalicylsäure ....................................... 32
4.4.3
Bisacodyl .......................................................................................... 33
4.4.4
Coffein .............................................................................................. 34
4.4.4.1
Coffein und Antiepileptika........................................................... 34
4.4.4.2
Coffein und Psychopharmaka .................................................... 35
4.4.4.3
Coffein und stimulierende Medikamente .................................... 35
4.4.4.4
Coffein und sonstige Medikamente ............................................ 36
4.4.4.5
Zusammenfassung Coffein ........................................................ 36
4.4.5
H1-Antihistaminika (Dimetindenmaleat, Diphenhydramin) ................ 36
4.4.5.1
Antihistaminika und anticholinerge Substanzen ......................... 37
4.4.5.2
Antihistaminika und zentral dämpfende Substanzen .................. 37
4.4.5.3
Zusammenfassung Antihistaminika ............................................ 37
vi
4.4.6
Efeublätter ........................................................................................ 38
4.4.7
Eibischwurzelflüssigextrakt ............................................................... 38
4.4.8
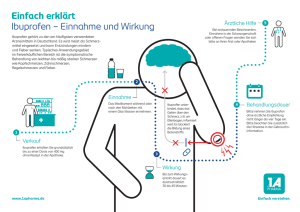
Ibuprofen, Ibuprofen Lysinsalz (NSAR) ............................................ 39
4.4.8.1
Ibuprofen und blutdrucksenkende Mittel .................................... 39
4.4.8.2
Ibuprofen und gerinnungshemmende Medikamente .................. 40
4.4.8.3
Ibuprofen und Medikamente mit Einfluss auf den Stoffwechsel . 41
4.4.8.4
Ibuprofen und sonstige Medikamente ........................................ 41
4.4.8.5
Zusammenfassung Ibuprofen..................................................... 43
4.4.9
Paracetamol...................................................................................... 43
4.4.9.1
Paracetamol und Antiepileptika .................................................. 43
4.4.9.2
Paracetamol und Cumarin.......................................................... 44
4.4.9.3
Paracetamol und orale Kontrazeptiva ........................................ 44
4.4.9.4
Paracetamol und sonstige Medikamente ................................... 44
4.4.9.5
Zusammenfassung Paracetamol................................................ 45
4.4.10
Passionsblumenextrakt ................................................................. 46
4.4.11
Pseudoephedrin-Hydrochlorid ....................................................... 46
4.4.11.1 Pseudoephedrin und blutdrucksteigernde Medikamente ........... 47
4.4.11.2 Zusammenfassung Pseudoephedrin-Hydrochlorid .................... 47
4.4.12
Tee-Präparate ............................................................................... 47
4.4.12.1 Dr. Kottas Johanniskrauttee, Sidroga Johanniskrauttee ............ 47
4.4.12.2 Tee-Präparate mit Süßholz ....................................................... 48
4.4.12.3 Zusammenfassung Tee-Präparate ............................................ 48
4.4.13
Thymianflüssigextrakt .................................................................... 49
4.4.14
Vitamin C (Ascorbinsäure), Zitronensäure..................................... 49
4.4.15
Zusammenfassung oral systemische Medikamente ...................... 50
5
Diskussion ..................................................................................................... 53
6
Literaturverzeichnis ....................................................................................... 55
vii
Glossar und Abkürzungen
ACE
– Angiotensin Converting Enzyme
ASS
– Acetylsalicylsäure
AUC
– area under the curve
HRT
– Hormon Replacement Therapy, Hormonersatztherapie
INR
– International Normalized Ratio
MAO
– Mono-Amino-Oxidase
NSAR
– Nicht Steroidale Anti Rheumatika
OTC
– Over the counter
SSRI
– Selektiver Serotonin Reuptake Inhibitor
syst.
– systemisch
viii
Tabellenverzeichnis
Tabelle 1: Darstellung der meistverkauften rezeptfreien Medikamente und ihrer
Wirkstoffe,4 Daten von Apothekern ........................................................................ 6
Tabelle 2: Darstellung der meistverkauften rezeptfreien Medikamente und ihrer
Wirkstoffe4 in Österreich, Daten von IMS Health (3. Quartal 2015) ........................ 8
Tabelle 3: Darstellung der meistverkauften rezeptfreien Medikamente und ihrer
Wirkstoffe4 in Österreich, Daten von IMS Health vom Gesamtjahr 2014 .............. 10
Tabelle 4: Tabellarische Darstellung der Interaktionen der topischen Arzneimittel
............................................................................................................................. 23
Tabelle 5: Tabellarische Darstellung der marginalen Interaktionen der oral
systemischen Arzneimittel .................................................................................... 50
Tabelle 6: Tabellarische Darstellung der gravierenden Interaktionen der oral
systemischen Arzneimittel .................................................................................... 51
ix
1 Einleitung
Die vorliegende Arbeit behandelt mögliche Interaktionen zwischen den am häufigsten in Österreich verkauften rezeptfreien und rezeptpflichtigen Medikamenten.
Es wurden die am häufigsten in Österreich verkauften, rezeptfreien Pharmaka erhoben, und in dieser Arbeit tabellarisch dargestellt. Eine Zusammenfassung der
einzelnen Wirkstoffe erfolgt nach Anwendungsart und alphabetisch geordnet. Einer kurzen Erläuterung der Einsatzgebiete und Wirkungen folgend, werden die
Interaktionsmöglichkeiten mit rezeptpflichtigen Medikamenten aufgelistet.
1.1 Problem: Selbstmedikation
Viele Menschen nehmen Medikamente, die vom Arzt verschrieben werden, ein,
jüngere Patienten oft eher nur über einen kurzen Zeitraum (z. B. Antibiotika bei
bakteriellen Infekten). Mit steigendem Alter und der damit verbundenen Zunahme
von chronischen Erkrankungen werden aber auch Langzeitmedikationen verordnet.
Da nicht jedes Mal der Arzt aufgesucht wird, wenn plötzlich kleine körperliche
Probleme im Alltag auftreten, besorgen sich viele Menschen Over-the-counterPräparate aus der Apotheke. Diese Medikamente können aber auch beträchtliche
Nebenwirkungen und auch Wechselwirkungen bei gleichzeitiger Einnahme mit
anderen Medikamenten haben, was vor allem bei Langzeitmedikation in der älteren Bevölkerung eine Rolle spielt.
Arzneimittelinteraktionen sind in der Medizin ein gut erforschtes Gebiet, bereits im
Studium wird angehenden Ärztinnen und Ärzten neben Wirkungen bestimmter
Pharmaka, auch deren Nebenwirkungen und gefährliche Wechselwirkungen gelehrt. In den Standardlehrbüchern, wie „Pharmakologie und Toxikologie“ der Dualen Reihe oder „Allgemeine und Spezielle Pharmakologie und Toxikologie“ von
Elsevier, werden die möglichen Wechselwirkungen der verschiedenen Wirkstoffgruppen grob skizziert, Details zu Interaktionen werden in diesen Lehrbüchern
1
aber nicht behandelt. Eine sehr gute und genaue Darstellung der einzelnen Wirkstoffinteraktionen findet man in „Stockley’s Drug Interactions“.
Die Gefährlichkeit von rezeptfreien Medikamenten wird oft mit dem Argument der
freien Erhältlichkeit heruntergespielt, da man annimmt, es könne bei der Anwendung ohnehin nichts passieren. Glücklicherweise werden Wechselwirkungen in
den meisten Fällen gut toleriert und oft gar nicht klinisch relevant, wobei die Interaktionen mancher Medikamentenkombinationen bei einigen Patienten oder Patientinnen teilweise gar nicht, bei anderen dafür sehr ausgeprägt sind.
1.2 Arzneimittelinteraktionen
Als Arzneimittelinteraktionen wird jener Mechanismus bezeichnet, durch den eine
Substanz durch die gleichzeitige Anwesenheit einer anderen Substanz verändert
wird.
Es muss sich dabei nicht unbedingt um einen unerwünschten Effekt handeln. Eine
additive Wirkungsverstärkung wird unter anderem bei schwer einzustellendem
Blutdruck angewandt, wenn ein einzelnes Medikament nicht genügend Wirkung
zeigt. Definitionsgemäß ist eine solche Wirkung zwar keine Interaktion per se,
durch die gleichzeitige Anwendung wird aber trotzdem ein Effekt hervorgerufen,
der einer Wechselwirkung nahekommt und in dieser Arbeit behandelt wird.1-3
1.2.1 Pharmakokinetische Interaktionen
Als pharmakokinetische Interaktionen werden Mechanismen bezeichnet, bei denen die Wirkung oder Anwesenheit von Substanz A, die Bioverfügbarkeit von
Substanz B verändern.1-3
1.2.1.1 Absorption
Oral eingenommene Arzneimittel werden im Magen und Darm über die Schleimhäute absorbiert. Möglichkeiten der Wechselwirkungen sind erhöhte bzw. verminderte Absorptionsgeschwindigkeit und erhöhte bzw. verminderte gesamte Absorption.1-3
2
Ursachen für eine veränderte Absorption können Veränderungen der gastrointestinalen pH-Werte, Chelat- oder Komplexbildung der Wirkstoffe, veränderte gastrointestinale Motilität, Induktion oder Inhibition von Transportproteinen oder durch
andere Medikamente verursachte Malabsorptionen sein.1, 3
1.2.1.2 Verteilung im Körper
Im Plasma werden Substanzen unterschiedlich stark an Proteine gebunden, wobei
meist nur der freie, nicht gebundene Anteil der Wirkstoffe auch aktiv einen Effekt
auslösen.
Bei Verabreichung mehrerer Medikamente kann eine Verschiebung der proteingebundenen Wirkstoffe den Anteil des freien Wirkstoffes erhöhen.
Wie bei der Absorption, kann auch bei der Verteilung im Körper eine Induktion oder Inhibition von Transportproteinen eine Rolle spielen.1, 3
1.2.1.3 Metabolismus
Einige Medikamente werden unverändert ausgeschieden, die meisten werden jedoch im Körper modifiziert, um ausgeschieden werden zu können.
Die Aufnahme der systemischen Medikamente bei oraler Anwendung erfolgt in der
Regel durch die Magen- oder Darmwand ins Blut, das direkt in die Leber fließt. In
der Leber werden die Wirkstoffe durch Enzyme (abhängig vom Wirkstoff) abgebaut. Manche Substanzen werden von sehr spezifischen Enzymen abgebaut, die
wiederum von anderen Substanzen induziert oder inhibiert werden. Dies führt zu
einer Veränderung des First-pass-Effekts, und somit der Menge des Wirkstoffs,
die in den Körper gelangt.
Als Folge der Enzyminduktion sind, will man den gleichen Effekt hervorrufen, immer höhere Wirkstoffmengen notwendig. Werden andere Substanzen von denselben Enzymen abgebaut wie die Induktoren, werden diese schneller abgebaut.
Gegenteilig arbeitet die Enzyminhibition, aus der die Akkumulation eines Wirkstoffes resultiert.
Abhängig von der Genetik eines Individuums, kann eine veränderte Aktivität von
Cytochrom P450 Enzymen vorliegen, was den möglicherweise unvorhergesehenen beschleunigten oder verlangsamten Abbau einer Substanz zur Folge hat, die
in weiterer Folge Einfluss auf andere Substanzen nehmen kann.1, 3
3
1.2.1.4 Ausscheidung
Abhängig von der Art, auf die eine Substanz aus dem Körper ausgeschieden wird,
können auch hier durch andere Wirkstoffe Veränderungen hervorgerufen werden.
Einige Möglichkeiten der veränderten Ausscheidung sind Veränderungen des pHWertes im Urin, Veränderungen der renalen Ausscheidung oder Veränderungen
des renalen Blutflusses.1, 3
1.2.2 Pharmakodynamische Interaktionen
Pharmakodynamische Interaktionen sind Mechanismen, bei denen der Effekt einer
Substanz A durch die Anwesenheit von Substanz B an der Bindungsstelle verändert wird.1, 3
1.2.2.1 Synergistische/Additive Wirkung
Substanzen, die den gleichen Effekt hervorrufen, fallen unter diese Kategorie. Als
Beispiel dienen hier zentral wirkende Antihistaminika, die in Kombination mit sedierenden Medikamenten eine verstärkte dämpfende Wirkung haben. Wie bereits
erwähnt ist dies keine eigentliche Interaktion, sie wird in dieser Arbeit aber als solche behandelt.1, 3
1.2.2.2 Antagonistische Wirkung
Wie auch bei der additiven Wirkung ist eine antagonistische Wirkung keine Interaktion per definitionem. Beispielhaft wäre die gleichzeitige Anwendung von Coffein
bei Anwendung von Hypnotika, um besser einschlafen zu können. Logischerweise
ist der stimulierende Effekt der Gegensatz zum sedierenden und eine Aufhebung
bzw. Abschwächung der Wirkungen ist zu erwarten.1, 3
1.2.2.3 Wiederaufnahme von Neurotransmittern
Substanzen, die Veränderungen der Konzentrationen von Neurotransmittern hervorrufen, bergen das Risiko, dass die Wirkung anderer Wirkstoffe einen erhöhten
oder abgeschwächten Effekt an denselben Synapsen hervorrufen. 1, 3
4
2 Material und Methoden
Es wurde eine Literaturrecherche zum Thema der Arzneimittelinteraktionen von
Over-the-counter-Medikamenten bei gleichzeitiger Anwendung mit verschreibungspflichtigen Medikamenten durchgeführt.
Es wurde in fachspezifischer Literatur nach möglichen Wechselwirkungen und Berichten von Wechselwirkungen gesucht, um die Interaktionen der in Österreich am
häufigsten verkauften OTC-Präparate mit verschreibungspflichtigen Medikamenten zu eruieren und ihr Risikopotential aufzuzeigen.
Zur Bearbeitung des Themas wurden Daten darüber benötigt, welche OTCMedikamente häufig verkauft werden.
Um einen Überblick über die meistverkauften, rezeptfreien Medikamente zu bekommen, wurde über Univ.-Prof.i.R. Mag.pharm. Dr. Beubler eine E-Mail mit der
Bitte um Bereitstellung von Daten für die weitere Bearbeitung an die steirischen
Apotheker ausgesandt.
Zusätzlich stellte die Firma Aewige einen Bericht von IMS Health über den österreichischen OTC-Markt zur Bearbeitung und Auswertung zur Verfügung.
Die Feststellung des wirkenden Agens und anderer Inhaltsstoffe der jeweiligen
Präparate wurde unter Zuhilfenahme des Austria Kodex durchgeführt.
Die Feststellung der genauen Nebenwirkungen und ihre zugrundeliegenden Ursachen erfolgte unter Zuhilfenahme der Herstellerinformationen; weitere Recherche
mithilfe der Internetdatenbanken PubMed, Google Scholar und GoPubMed sowie
einschlägiger Fachbücher.
5
3 Die häufigsten rezeptfreien Präparate
3.1 Daten von Apothekern
Auf die Anfrage an die Apotheker und Apothekerinnen über die Kammerinformation antworteten fünf Apotheken. In vier der fünf Antworten wurden Medikamentennamen angegeben, wobei keine Verkaufszahlen aus den Daten herauszulesen
waren.
In der folgenden Tabelle werden die genannten Präparate nach Anwendungsart
geordnet dargestellt. Da bei den Informationen der Apothekenbetreiber und Apothekenbetreiberinnen keine genauen Artikelinformationen übermittelt wurden, werden diese unter dem allgemein bekannten Handelsnamen zusammengefasst
(z. B. nicht „Aspirin Plus C“, sondern nur „Aspirin“), wobei diese bei alternierenden
Wirkstoffen extra angegeben werden. Zusätzlich wurden unterschiedliche Packungsgrößen sowie unterschiedliche Dosierungen ignoriert.
Tabelle 1: Darstellung der meistverkauften rezeptfreien Medikamente und ihrer Wirkstoffe,4
Daten von Apothekern
Präparat
Voltadol Schmerzgel
Bepanthen Wundheilsalbe,
diverse Präparate
Wirkstoff
Applikation
Diclofenac
Dexpanthenol
Vitawund Salbe
Chlorhexidindigluconat
Fenistil Gel
Dimetindenmaleat
Betaisodona Wundgel
Povidon-Iod Komplex
Hirudoid Gel,
Mucopolysaccharidpolyschwefel-
diverse Präparate
säureester
topisch
Haut
Ichthammolum
Inotyol Salbe
Hamamelis-Fluidextrakt
Zinkoxid
Titanoxid
6
Tantum verde,
diverse Präparate
Benzydaminhydrochlorid
2,4-Dichlorbenzylalkohol
Neo Angin
Levomenthol
topisch
oral/pharyngeal
Amylmetacresol
Vibrocil Nasen-Spray
Nasivin Nasen-Spray,
diverse Präparate
Phenylephrin
Dimetindenmaleat
Oxymetazolinhydrochlorid
topisch nasal
Luuf Naphazolin compositum Naphazolinhydrochlorid
Nasen-Spray
Diphenhydraminhydrochlorid
Omni-Biotic,
Bakterienstämme,
diverse Präparate
nicht im AustriaKodex
topische Wir-
Bioflorin Kapseln
Enterococcus faecium
kung Colon
Immun 44,
diverse Präparate
Mexavit C
Plantovir (Cistus incanus)
Polyphenole
nicht im AustriaKodex
Paracetamol
Ascorbinsäure
Ratiodolor
Ibuprofen Lysinsalz
Sangenor
Mono-L-Arginin-L-Aspartat
Prospan Brausetablette
Efeublättertrockenextrakt
Ascorbisal
Acetylsalicylsäure
Lecithin
Dulcolax
Bisacodyl
diverse Präparate
Ambroxolhydrochlorid
Mexalen
Paracetamol
Passedan
Passionsblumenextrakt
Ibumetin,
diverse Präparate
oral systemisch
Ascorbinsäure
Buerlecithin
Mucosolvan,
orale Einnahme,
Ibuprofen
7
Acetylsalicylsäure
Aspirin,
[Ascorbinsäure]
diverse Präparate
[Citronensäure]
[Pseudoephedrin-Hydrochlorid]
Rennie Antacidum
Calciumcarbonat
Magnesiumcarbonat
Acetylsalicylsäure
Thomapyrin,
diverse Präparate
Iberogast
Paracetamol
Coffein
diverse Pflanzenextrakte
Ist nur ein einzelner Wirkstoff angeführt, ist jener das wirkende Agens; ein in [eckiger Klammer] stehender Wirkstoff bedeutet eine Substanz mit möglicher Wirkung,
die bei unterschiedlichen Präparaten mit gleichem Namen (Aspirin, Aspirin Plus C)
nicht in allen Präparaten vorhanden ist.
3.2 Daten von IMS Health
3.2.1 Daten 3. Quartal 2015
In der folgenden Tabelle werden die genannten Präparate nach österreichweiten
Verkaufszahlen aus dem dritten Quartal 2015 geordnet dargestellt. Da im vorliegenden Bericht keine genauen Artikelinformationen übermittelt wurden, wurde angenommen, dass sowohl das angegebene Präparat als auch mögliche Variationen
davon (z. B. „forte“) mitgezählt wurden und somit variable Inhaltsstoffe enthalten,
die gesondert angegeben werden.
Tabelle 2: Darstellung der meistverkauften rezeptfreien Medikamente und ihrer Wirkstoffe4
in Österreich, Daten von IMS Health (3. Quartal 2015)
Rank
Präparat
Wirkstoff
1
Mexalen
Paracetamol
2
Bepanthen
Dexpanthenol
Applikation
oral syst.
topisch
Haut
8
Dr. Kottas Tee,
3
diverse Geschmacks- Geschmacksabhängig
oral syst.
richtungen
4
Voltadol
Diclofenac
5
Tantum verde
Benzydaminhydrochlorid
topisch
Haut
topisch oral/ pharyngeal
Acetylsalicylsäure
6
Thomapyrin
Paracetamol
oral syst.
Coffein
7
Nasivin
Oxymetazolinhydrochlorid
8
Ibumetin
Ibuprofen
topisch nasal
Acetylsalicylsäure
[Ascorbinsäure]
9
Aspirin C
[Citronensäure]
oral syst.
[PseudoephedrinHydrochlorid]
10
11
12
Betaisodona
Povidon-Iod Komplex
[Bifonazol]
Canesten
[Clotrimazol]
Fenistil,
Diverse Präparate
Dimetindenmaleat
topisch
Haut
oral syst.,
topisch Haut
Sidroga Tee,
13
diverse
Ges- Geschmacksabhängig
chmacksrichtungen
14
Dulcolax
Bisacodyl
15
Octanisept
Desinfektionsmittel
oral syst.
topisch
Haut
orale Einnahme,
16
Bioflorin
Enterococcus faecium
topische Wirkung
Colon
17
Hirudoid
Mucopolysaccharidpolyschwefelsäureester
topisch
Haut
9
18
Bronchostop
19
Ratiodolor akut
20
Apozema insecticum
Thymianflüssigextrakt
Eibischwurzelflüssigextrakt
oral syst.
Ibuprofen Lysinsalz
Benzocain
Diphenhydraminhydrochlorid
topisch
Haut
Wiederum gilt: Ist nur ein einzelner Wirkstoff angeführt, ist jener das wirkende Agens; ein in [eckiger Klammer] stehender Wirkstoff bedeutet eine Substanz mit
möglicher Wirkung, die bei unterschiedlichen Präparaten mit gleichem Namen
(Aspirin, Aspirin Plus C) nicht in allen Präparaten vorhanden ist.
3.2.2 Daten Gesamtjahr 2014
In der folgenden Tabelle werden die genannten Präparate nach österreichweiten
Verkaufszahlen aus dem Jahr 2014 geordnet dargestellt. Da im vorliegenden Bericht keine genauen Artikelinformationen übermittelt wurden, wurde angenommen,
dass sowohl das angegebene Präparat als auch mögliche Variationen davon (z. B.
„forte“) mitgezählt wurden und somit variable Inhaltsstoffe enthalten, die gesondert
angegeben werden.
Tabelle 3: Darstellung der meistverkauften rezeptfreien Medikamente und ihrer Wirkstoffe4
in Österreich, Daten von IMS Health vom Gesamtjahr 2014
Rank
1
Präparat
Mexalen
Wirkstoff
Paracetamol
Dr. Kottas Tee,
2
Applikation
diverse Geschmacks- Geschmacksabhängig
oral syst.
richtungen
3
Tantum verde
Benzydaminhydrochlorid
4
Bepanthen
Dexpanthenol
topisch oral/ pharyngeal
topisch
Haut
10
Acetylsalicylsäure
[Ascorbinsäure]
5
Aspirin C
[Citronensäure]
[Pseudoephedrin-
oral syst.
Hydrochlorid]
6
Bronchostop
7
Nasivin
Thymianflüssigextrakt
Eibischwurzelflüssigextrakt
Oxymetazolinhydrochlorid
topisch nasal
Acetylsalicylsäure
8
Thomapyrin
Paracetamol
oral syst.
Coffein
9
Voltadol
Diclofenac
10
Ibumetin
Ibuprofen
topisch
Haut
Sidroga Tee,
11
diverse Geschmacks- Geschmacksabhängig
oral syst.
richtungen
12
Prospan
Efeublätter-Trockenextrakt
13
Otrivin
Xylometazolin
14
Canesten
15
Betaisodona
Povidon-Iod Komplex
16
Passedan Herb
Passionsblumenextrakt
17
Dulcolax
Bisacodyl
[Bifonazol]
[Clotrimazol]
topisch nasal
topisch
Haut
oral syst.
orale Einnahme,
18
Bioflorin
Enterococcus faecium
topische Wirkung
Colon
19
Aeromuc
20
Hirudoid
Acetylcystein
Mucopolysaccharidpolyschwefelsäureester
oral syst.
topisch
Haut
Wiederum gilt: Ist nur ein einzelner Wirkstoff angeführt, ist jener das wirkende Agens; ein in [eckiger Klammer] stehender Wirkstoff bedeutet eine Substanz mit
11
möglicher Wirkung, die bei unterschiedlichen Präparaten mit gleichem Namen
(Aspirin, Aspirin Plus C) nicht in allen Präparaten vorhanden ist.
12
4 Arzneimittelinteraktionen
Folgend werden die Wirkstoffe der am häufigsten verkauften Medikamente aus
der Liste IMS Health einzeln dargestellt.
Es wird jeweils nur das wirkende Agens beschrieben, die Darstellung erfolgt in
Untergruppen nach Applikationsart grob in Arzneimittelgruppen unterteilt und alphabetisch geordnet.
Gelistet werden nur Interaktionen mit in Österreich verschreibungspflichtigen Medikamenten; Interaktionen mit anderen OTC-Wirkstoffen werden nicht dargestellt.
4.1 Topische Arzneimittel, Anwendung auf der Haut
Das Ziel bei topischer Applikation ist es, den Wirkstoff direkt am benötigten Ort
aufzutragen, ohne den restlichen Körper zu beeinflussen.
Ob ein Wirkstoff demnach resorbiert wird und in den systemischen Kreislauf gelangt, hängt zuallererst von der Trägersubstanz, in die der Wirkstoff eingebettet ist,
ab. Die größte Barriere bildet wegen des geringen Wassergehaltes das Stratum
corneum2, wodurch nun die Pharmakokinetik eine wichtige Rolle in der möglichen
systemischen Resorption einnimmt.
So werden hydrophile Pharmaka aufgrund der Eigenschaften der Haut kaum resorbiert, wohingegen lipophile Pharmaka gut resorbiert werden können und möglicherweise direkt, ohne präsystemische Elimination, in den systemischen Kreislauf aufgenommen werden.1 Arzneimittelinteraktionen bei topischer Applikation
hydrophiler Pharmaka sind somit als sehr unwahrscheinlich anzusehen.2
Bei den folgenden Stoffen wird davon ausgegangen, dass die in der Packungsbeilage empfohlene Dosierung vom Anwender oder von der Anwenderin nicht überschritten wird. Bei Applikation über die Haut kann eine Überdosierung in Form einer zu großzügigen Anwendung eine nicht unwesentliche Rolle in Bezug auf systemische Resorption und daraus resultierende Wechselwirkungen spielen.
Zusätzlich wird davon ausgegangen, dass nur ein einziges Präparat an einer Körperstelle während des Behandlungs-Zeitraums angewendet wird.
13
4.1.1 Benzocain
Benzocain ist ein Wirkstoff aus der Gruppe der Lokalanästhetika mit Wirkung über
die Blockade von spannungsabhängigen Natriumkanälen.2
Es gibt derzeit keine beschriebenen Fälle von Wechselwirkungen bei Anwendung
von Benzocain über die Haut.
Benzocain über die Schleimhäute
Bei topischer Anwendung über die Schleimhäute gibt es jedoch mehrere Berichte
von Patienten oder Patientinnen, die innerhalb der empfohlenen Dosierung mit
einer Methämoglobinämie reagierten. Im Rahmen der Behandlung von Schmerzen
beim Durchbruch der ersten Zähne bei einem Säugling, wurde von einer Methämoglobinämie mit folgender Beatmungspflicht berichtet.5
Fälle von Methämoglobinämie traten vor allem bei Säuglingen und alten Menschen auf,6 meistens im Rahmen von zahnärztlichen Eingriffen, Intubationen und
Broncho- bzw. Endoskopien.
Verwandte Medikamente
Die Hersteller der EMLA-Pflaster (enthält Prilocain und Lidocain) raten davon ab,
EMLA-Pflaster in Kombination mit Methämoglobinämien verursachenden Medikamenten zu verwenden.7
Da Benzocain in die gleiche Substanzklasse fällt, gibt es möglicherweise ein minimales Risiko, bei gleichzeitiger Anwendung mit Methämoglobinämie induzierenden Medikamenten, eine Methämoglobinämie zu erleiden.
Bei topischer Anwendung von Benzocain über die Haut wurden keine direkten
Hinweise gefunden, dass es bei gleichzeitiger Anwendung mit anderen Medikamenten bzw. verschreibungspflichtigen Medikamenten Wechselwirkungen gibt.
14
4.1.2 Bifonazol
Bifonazol ist ein Wirkstoff aus der Gruppe der Antimykotika, mit Wirkung durch
Hemmung der Ergosterolsynthese.2
Bei gesunder, intakter Haut wird weniger als 1% resorbiert, bei vaginaler Anwendung kann die Resorption bis zu 10% des aufgetragenen Wirkstoffs betragen. 1
Bifonazol und Warfarin
Der Hersteller Hexal gab 2007 an, dass bis dahin keine Wechselwirkungen von
topisch angewandtem Bifonazol mit anderen Medikamenten zu erwarten waren;8
wohingegen der Hersteller Bayer Vital im Jahr 2014 die Möglichkeit einer Resorption und folgender Interaktion mit Warfarin angab.9
Es ist bekannt, dass bei systemischer Azol-Einnahme die INR-Rate stark ansteigt.
2008 wurde eine Studie durchgeführt, um die Wirkung von topischer Anwendung
von Azolen auf die INR-Rate zu erforschen.10 Das Ergebnis dieser Studie zeigte,
dass bei großflächiger Anwendung von Bifonazol eine Resorption durchaus möglich ist und infolgedessen durch Inhibition des Enzyms CYP2C9 zu einem raschen
Anstieg des Warfarinspiegels und somit der INR führen kann. Limitiert wurde die
Studie allerdings dadurch, dass nur Patienten oder Patientinnen mit einer INR > 5
eingeschlossen wurden und der erhöhte Warfarinspiegel nicht direkt bestimmt
wurde, sondern durch die Erhöhung der INR gefolgert wurde.
Bei Einnahme von Coumarinen und gleichzeitiger großflächiger Anwendung von
Bifonazol sollten regelmäßige, engmaschige INR-Kontrollen durchgeführt werden,
um Komplikationen wie Blutungen zu vermeiden.
Sonst konnten bei topischer Anwendung von Bifonazol über die Haut keine Hinweise gefunden werden, dass es bei gleichzeitiger Anwendung mit anderen Medikamenten bzw. verschreibungspflichtigen Medikamenten Wechselwirkungen gibt.
15
4.1.3 Clotrimazol
Clotrimazol ist ein Wirkstoff aus der Gruppe der Antimykotika mit Wirkung durch
Hemmung der Ergosterolsynthese.2
Bei gesunder, intakter Haut wird weniger als 0.5% resorbiert, bei vaginaler Anwendung kann die Resorption bis zu 10% des aufgetragenen Wirkstoffs
betragen.11
Der Wirkstoff Clotrimazol ist nur zur topischen Anwendung zugelassen. Durch die
geringe systemische Resorption konnten bisher noch keine Arzneimittelinteraktionen bei gleichzeitiger topischer Anwendung von Clotrimazol und systemisch wirksamen Medikamenten beobachtet worden.
In der Fachinformation über Clotrimazol von Sandoz wird zwar darauf hingewiesen, dass Clotrimazol die Wirksamkeit von Amphotericin und anderen Polyenantibiotika vermindern kann,12 jedoch wurde in diesem Zusammenhang bei topischer
Anwendung von Clotrimazol keine Literatur gefunden, die diese Information bestätigte.
Bei topischer Anwendung von Clotrimazol über die Haut wurden keine Hinweise
gefunden, dass es bei gleichzeitiger Anwendung mit anderen Medikamenten bzw.
verschreibungspflichtigen Medikamenten Wechselwirkungen gibt.
4.1.4 Dexpanthenol
Dexpanthenol ist ein Provitamin von Vitamin B5. Bei topischer Anwendung auf der
Haut trägt es zu ihrer Regeneration bei. Im Körper wird Dexpanthenol zu Pantothensäure umgewandelt.
Bei topischer Anwendung sind keine systemischen Wechselwirkungen zu erwarten.13
16
Bei einem Einzelfall kam es zu einem postoperativen Anstieg der Wirkung von
Suxamethonium, was auf die gleichzeitige systemische Anwendung von Dexpanthenol zurückgeführt wurde. Bei sechs verschiedenen Menschen wurde versucht,
die herabgesetzte Atemtätigkeit bzw. Muskelarbeit mittels intraoperativer Gabe
von Pantothensäure, gefolgt von Succinylcholin, zu reproduzieren, was jedoch
fehlschlug.14
Bei topischer Anwendung von Dexpanthenol oder Pantothensäure über die Haut
wurden keine Hinweise gefunden, dass es bei gleichzeitiger Anwendung mit anderen Medikamenten bzw. verschreibungspflichtigen Medikamenten Wechselwirkungen gibt.
4.1.5 Diclofenac
Diclofenac ist ein Wirkstoff aus der Gruppe der Arylessigsäuren innerhalb der
NSAR, der nicht steroidalen Antirheumatika, mit Wirkung über die Inhibition von
Cyclooxygenase-1 und -2. Zur topischen Anwendung wird Diclofenac-Natrium
verwendet.11
Die Wirkung von Diclofenac bei der äußerlichen Anwendung als Salbe oder Gel
tritt nicht über das Eindringen in das betroffene Gewebe, sondern über systemische Resorption und Transport über die Blutbahn in das betroffene Gewebe ein.2
Kienzler, Gold und Nollevaux (2010) zeigten, dass die systemische Resorption bei
topischer Gabe um fünf- bis 17-fach geringer ist als bei oraler Gabe.15
Nicht gänzlich übereinstimmend mit obiger Feststellung ist die Information der
Firma GSK-Gebro Consumer Healthcare GmbH, die besagt, dass die maximalen
Plasmakonzentrationen bei topischer Anwendung im Vergleich zur oralen Einnahme um das 100-fache niedriger seien,16 beziehungsweise die Ergebnisse von
Miyatake et. al. (2009), die nur einen geringen Unterschied in den Plasmakonzentrationen bei topischer versus oraler Anwendung feststellten.17
Kritisch zu sehen ist allerdings die Tatsache, dass bei unterschiedlichen Testungen verschiedene Konzentrationen bzw. Zusammensetzungen der Gele, Cremes
17
oder Salben verwendet wurden, was die systemische Verfügbarkeit bei topischer
Applikation möglicherweise beeinflusst.
Zusätzlich wurde gezeigt, dass bei topischer Administration keine Hemmung der
Plättchenaggregation als Nebenwirkung auftrat.15 Rowcliffe et.al. (2016) bestätigten die fehlende Hemmung der Plättchenaggregation bei topischer Anwendung im
Vergleich zur oralen Einnahme.18
Die Elimination bei topischer Anwendung von Diclofenac ist im Vergleich zu oraler
Einnahme vier- bis sechsmal länger.19
Bei der bestehenden Datenlage ist es nicht eindeutig, inwiefern die topische Anwendung von Diclofenac Arzneimittelinteraktionen hervorrufen kann. Es gibt jedoch Studien, in denen Osteoarthritispatienten oder -patientinnen über längere
Zeiträume mit Diclofenac Gel behandelt wurden und abgesehen von Hautreaktionen keine unerwünschten Wirkungen auftraten.20 In einer Studie von Peniston et.
al. (2012) traten bei Patienten oder Patientinnen mit Komorbiditäten (Typ II Diabetes Mellitus, Hypertension, cerebro- oder cardiovaskuläre Krankheiten) im Vergleich zu Patienten oder Patientinnen ohne Komorbiditäten bzw. zu jüngeren Patienten oder Patientinnen keine gehäuften unerwünschten Wirkungen bei lokal aufgetragenem Diclofenac-Gel auf.21 Baraf et. al. (2012) stellten keinen Einfluss von
Alter oder Komorbiditäten in Bezug auf unerwünschte gastrointestinale, cardiovaskuläre oder renale Wirkungen bei Patienten oder Patientinnen mit topischer Diclofenac Behandlung fest.22
Indirekt kann man aus diesen Studien schließen, dass eine erhöhte Aufnahme von
Diclofenac in das System unwahrscheinlich ist.
Es ist zu erwarten, dass bei kleinflächiger topischer Anwendung von Diclofenac
aufgrund der vermutlich minimalen systemischen Resorption und veränderten Metabolisierung im Körper keine Wechselwirkungen mit anderen Medikamenten auftreten;16,
23
bei großflächiger Anwendung ist es nicht gänzlich auszuschließen,
dass NSAR-typische Wechselwirkungen, ähnlich wie bei oraler Einnahme, auftreten können. Diese Wechselwirkungen sind wegen der gleichen Substanzklasse
denen von Ibuprofen ähnlich, und werden im Kapitel der oralen Medikamente unter Ibuprofen behandelt.
18
Bei topischer Anwendung von Diclofenac über die Haut ist es zwar sehr unwahrscheinlich, aber nicht vollständig auszuschließen, dass bei gleichzeitiger Einnahme von anderen Medikamenten bzw. verschreibungspflichtigen Medikamenten
Wechselwirkungen auftreten können.
4.1.6 Dimetindenmaleat
Dimetindenmaleat ist ein H1-Histaminrezeptorantagonist, der in Gel-Form als abschwellendes Mittel bei Insektenstichen und Sonnenbrand angewandt wird.
Es gibt bisher keine Studien über das Interaktionspotenzial von Dimetindenmaleat
bei lokaler Anwendung mit folgender systemischer Resorption. Aufgrund der geringen Resorption bei topischer Anwendung ist es allerdings sehr unwahrscheinlich, dass es zu Interaktionen mit anderen Medikamenten kommt. 24
Bei topischer Anwendung von Dimetindenmaleat über die Haut wurden keine Hinweise gefunden, dass es bei gleichzeitiger Anwendung mit anderen Medikamenten bzw. verschreibungspflichtigen Medikamenten Wechselwirkungen gibt.
4.1.7 Diphenhydraminhydrochlorid
Diphenhydramin ist ein H1-Histaminrezeptorantagonist der ersten Generation und
wird in Gel-Form zur Behandlung von Insektenstichen benutzt.
Die systemische Aufnahme bei topisch angewandtem Diphenhydramin ist sehr
gering, wobei die Aufnahme von Mensch zu Mensch unterschiedlich sein kann
(Administration in einer Mischung mehrerer Wirkstoffe).25 Es gibt allerdings mehrere Berichte von toxischen Reaktionen nach lokaler, großflächiger Anwendung bei
Kindern, die im schlimmsten Fall sogar bis zum Tod führen können. 26 In der Packungsbeilage des Medikaments wird darauf hingewiesen, dass bei großflächiger
19
Anwendung unerwünschte systemische Nebenwirkungen auftreten können, 27 was
bis zu einem gewissen Grad doch auf eine Resorption schließen lässt.
Die Risiken bei systemischer Resorption in Kombination mit anderen Medikamenten werden in Punkt 4.4.5 (orale Einnahme von Antihistaminika (Dimetindenmaleat)) genauer erörtert.
Bei kurzer und kleinflächiger Anwendung von Diphenhydraminhydrochlorid über
die Haut sollten aufgrund der nur gering applizierten Wirkstoffmengen und geringer Resorption keine Wechselwirkungen mit anderen Medikamenten bzw. verschreibungspflichtigen Medikamenten zu erwarten sein.
Großflächige Anwendung kann jedoch durch systemische Resorption in Kombination mit anderen Medikamenten durchaus lebensbedrohliche Interaktionen verursachen.
4.1.8 Mucopolysaccharidpolyschwefelsäureester
Der Wirkstoff Mucolpolysaccharidpolyschwefelsäureester (auch bekannt als
Chondroitin Sulfat oder Heparinoidum MPS) ist ein Wirkstoff aus der Klasse der
Heparine und findet Anwendung in der lokalen Behandlung der Varikositas.
Bei lokaler Applikation von Heparinoidum MPS gibt es bisher keine Anhaltspunkte
auf Interaktionen mit anderen Medikamenten.28 Laut verschiedenen Fachinformationen wird weniger als 1% der applizierten Dosis resorbiert, wodurch das Risiko
einer Interaktion minimal ist.29
Bei topischer Anwendung von Mucopolysaccharidpolyschwefelsäureester über die
Haut wurden keine Hinweise gefunden, dass es bei gleichzeitiger Anwendung mit
anderen Medikamenten bzw. verschreibungspflichtigen Medikamenten Wechselwirkungen gibt.
20
4.1.9 Povidon-Iod Komplex
Povidon-Iod gibt es in verschiedener Form im Handel. Der Wirkstoff wird topisch
appliziert, mit dem Ziel, einen bestimmten Haut- oder Schleimhautbezirk zu desinfizieren.
Die Desinfektion findet über die Freisetzung von Iod statt, das antimikrobiell wirkt.
Povidon-Iod wird unter anderem als Desinfektionsmittel auf Wunden verwendet,
die Applikation erfolgt demnach auch auf nicht intakte Haut.
Iod wird bei Applikation auf die Haut resorbiert und dadurch systemisch verfügbar.30, 31 Bei nicht intakten Hautverhältnissen ist die Aufnahme von Iod zusätzlich
verstärkt; bei Anwendung zur Desinfektion bei Verbrennungen wurden eine stark
erhöhte Iod-Konzentration in Plasma und Urin festgestellt.32-34
Bei länger dauernder, großflächiger Anwendung von Povidon-Iod ist anzunehmen,
dass ein konstant erhöhter Iod-Spiegel im Körper vorherrscht, bevor der Überschuss endgültig ausgeschieden wird.
4.1.9.1 Povidon-Iod und die Schilddrüse
In der Schilddrüse wird Iod für ihren Metabolismus benötigt, bei erhöhter IodAufnahme kommt es jedoch zur paradoxen Reaktion der Hypothyreose, dem sogenannten Wolff-Chaikoff-Effekt, der auch im Rahmen therapeutischer Maßnahmen, z. B. Operationsvorbereitungen, genutzt wird. Bis heute ist dieser Mechanismus noch nicht vollständig verstanden.2,
11
Unabhängig von der Iod-
Plasmakonzentration, limitiert sich dieser Effekt beim Erwachsenen nach wenigen
Tagen von selbst.11, 35
Bei dauerhafter Einnahme von Lithiumpräparaten besteht ein erhöhtes Risiko, eine Hypothyreose zu erleiden;36 die zusätzliche, großflächige Nutzung von Povidon-Iod erhöht dieses Risiko kurzfristig. In Gebieten mit erhöhter Iod-Aufnahme
über die Nahrung bzw. in Kombination mit jodiertem Salz und gleichzeitiger Einnahme von Lithium-Präparaten gibt es ein erhöhtes Risiko von Hypothyreoidismus;37 bei Einnahme von Lithiumpräparaten sollte daher auf die Nutzung von Povidon-Iod verzichtet, und stattdessen die Benutzung eines anderen Desinfektionsmittels bevorzugt werden.
21
4.1.9.2 Povidon-Iod und Blutzucker
Bei Hautdesinfektion mit Betaisodona vor Blutzuckermessungen mit dem Freestyle Freedom Lite® Messgerät stellte sich heraus, dass vom Gerät wahrscheinlich
falsch niedrige Werte angezeigt werden.38 Falsche Werte beeinflussen die Dosierungen der Diabetesmedikation und stellen daher ein Risiko dar. Besonders kritisch sind falsch niedrige Werte im Rahmen der Feststellung von Gestationsdiabetes. Hierbei ist allerdings anzumerken, dass iod-haltige Desinfektionsmittel in der
Schwangerschaft wegen des fehlenden Escape-Phänomens des Neugeborenen
beim Wolff-Chaikoff Effekt ohnehin kontraindiziert sind.39
Im Rahmen von speziellen Diagnostiken sollte auf die Anwendung von iodhaltigen Desinfektionsmittels ebenfalls verzichtet werden.40 Da diese allerdings
von Spezialisten durchgeführt werden, die um die Möglichkeit verfälschter Ergebnisse wissen, wird hier nicht näher darauf eingegangen.
4.1.9.3 Zusammenfassung Povidon-Iod
Die Anwendung von Povidon-Iod ist bei gleichzeitiger Einnahme von Lithium nicht
empfehlenswert, da ein erhöhtes Risiko für Hypothyreoidismus besteht.
Bei der Benutzung von Blutzuckermessgeräten sollte ein im Beipacktext empfohlenes Desinfektionsmittel verwendet werden, um mögliche falsche Ergebnisse zu
vermeiden.
Bei topischer Anwendung von Povidon-Iod über die Haut wurden mit Ausnahme
von Lithium bzw. zur Desinfektion bei der Blutzuckermessung keine Hinweise gefunden, dass es bei gleichzeitiger Anwendung mit anderen Medikamenten bzw.
verschreibungspflichtigen Medikamenten Wechselwirkungen gibt.
4.1.10
Zusammenfassung topische Arzneimittel
Die Anwendung von topischen Pharmazeutika stellt bei gleichzeitiger Anwendung
mit anderen Medikamenten im Großteil der Fälle kein Problem dar.
In Ausnahmefällen, vor allem bei zu großflächiger und länger andauernder Nutzung eines Wirkstoffes, kann es aber zur systemischen Resorption kommen, wobei die Arzneimittelinteraktionen mit denen des oral eingenommenen Wirkstoffes
bzw. der Wirkstoffgruppe zu vergleichen sind.
22
Tabelle 4: Tabellarische Darstellung der Interaktionen der topischen Arzneimittel
Wirkstoffname
Interaktion mit
Bedeutung der Interaktion
Bifonazol
Warfarin
gravierend
Diphenhydraminhydrochlorid Sedativa
gravierend
Povidon-Iod
marginal
Lithium
Die Klassifikation „marginal“ oder „gravierend“ ergibt sich aus der vermuteten Häufigkeit der Basismedikation mit dem verschreibungspflichtigen Medikament in
Kombination mit Nutzung des OTC-Produktes und der Schwere der zu erwartenden Interaktion.
4.2 Topische Arzneimittel, Anwendung auf den Schleimhäuten
Das Ziel bei topischer Applikation ist es, den Wirkstoff direkt am benötigten Ort
aufzutragen, ohne den restlichen Körper zu beeinflussen.
Die systemische Resorption über Schleimhäute ist im Vergleich zur Haut höher,
da das Stratum corneum fehlt. Gleich wie bei der Haut gilt, dass lipophile Substanzen gut resorbiert werden; in der nasalen Mucosa werden aber auch hydrophile Substanzen resorbiert und können systemische Wirkungen hervorrufen. 1
Bei den folgenden Stoffen wird davon ausgegangen, dass die in der Packungsbeilage empfohlene Dosierung vom Anwender oder der Anwenderin nicht überschritten wird.
4.2.1 Benzydaminhydrochlorid
Benzydaminhydrochlorid ist ein Wirkstoff mit entzündungshemmender und
schmerzstillender Wirkung, der als OTC-Produkt gegen Schmerzen und Entzün-
23
dungen im Mund- und Rachenraum eingesetzt wird.41 Die Verabreichung erfolgt
im Großteil der Fälle als Lutschpastille.
Chasseaud und Catanese (1985) beschreiben zwar sehr hohe lokale Konzentrationen an der Anwendungsstelle, im Vergleich zur oralen Aufnahme jedoch eine
stark verringerte systemische Absorption und damit verbundene Wechselwirkungen mit anderen Medikamenten.42
Duckert, Widmer und Madar (1974) stellten fest, dass nach oraler Aufnahme von
Benzydamin unter Marcumar-Therapie eine nicht signifikante Erhöhung von Phenprocoumon auftrat.43 Bei mucosaler Anwendung von Benzydaminhydrochlorid ist
es durch die stark verringerte systemische Absorption jedoch unwahrscheinlich,
dass Interaktionen mit Antikoagulantien auftreten.3
Bei topischer Anwendung von Benzydaminhydrochlorid über die Schleimhaut wurden keine Hinweise gefunden, dass es bei gleichzeitiger Anwendung mit anderen
Medikamenten bzw. verschreibungspflichtigen Medikamenten Wechselwirkungen
gibt.
4.2.2 Oxymetazolinhydrochlorid, Xylometazolin
Oxymetazolinhydrochlorid und Xylometazolin sind Wirkstoffe der Sympathomimetika mit direkter Wirkung auf die Alpha-1- und Alpha-2-Rezeptoren.3,
11
Über die
Bindung der Rezeptoren an die Blutgefäße folgt eine vasokonstriktorische Reaktion.2 Bei lokaler Anwendung führt diese Reaktion zur Abschwellung der Nasenschleimhaut.
Die Herstellerfirma Merck beschreibt in der Information über Nasivin (Wirkstoff
Oxymetazolinhydrochlorid) eine mögliche Blutdruckerhöhung bei gleichzeitiger
Einnahme
von
Mono-Amino-Oxidase-Hemmern
oder
trizyklischen
Antidepressiva;44 bei normaler Dosierung seien hingegen keine Interaktionen zu
erwarten.45
24
Das zugrundeliegende Prinzip dieser Wechselwirkung ist eine erhöhte Akkumulation von Noradrenalin in den präsynaptischen Nervenenden der arteriellen Gefäße
durch die Einnahme von MAO-Inhibitoren. Bei Freisetzung des Noradrenalins und
gleichzeitiger Präsenz eines indirekt wirkenden Sympathomimetikums wird der
Abbau des Noradrenalins gehemmt und der blutdrucksteigernde Effekt somit verstärkt und verlängert.3, 46
Die Wirkungen von Oxymetazolinhydrochlorid und Xylometazolin als direkte Stimulatoren beruhen jedoch auf einer direkten Wirkung am Rezeptor und beeinflussen die Ausschüttung sowie den Abbau von Noradrenalin im synaptischen Spalt
nicht.
Es existieren keine Fallberichte von hypertensiven Krisen bei gleichzeitiger Verwendung von Oxymetazolin und MAO-Inhibitoren. Die Ursache von erhöhtem
Blutdruck liegt meist in der Überdosierung des Medikaments.47, 48
Da Oxymetazolinhydrochlorid und Xylometazolin als direkte Sympathomimetika
zwar eine vergleichbare Wirkung wie indirekte Sympathomimetika hervorrufen,
aber trotzdem einer anderen Untergruppe der Substanzklasse der Sympathomimetika angehören, beruhen die Warnungen in den Hersteller- bzw. Fachinformationen vermutlich auf den Wirkungen der indirekten Sympathomimetika.
Bei topischer Anwendung von Oxymetazolinhydrochlorid und Xylometazolin über
die Schleimhaut wurden keine Hinweise gefunden, dass es bei gleichzeitiger Anwendung mit anderen Medikamenten bzw. verschreibungspflichtigen Medikamenten Wechselwirkungen gibt.
4.3 Arzneimittel mit topischer Wirkung nach oraler Einnahme
Das Ziel bei topischer Applikation ist es, den Wirkstoff direkt am benötigten Ort
aufzutragen, ohne den restlichen Körper zu beeinflussen.
Speziell im Darm wirksame Pharmaka werden zwar oral eingenommen, entfalten
ihre Wirkung aber lokal begrenzt im Verdauungssystem, wo sie entweder im Lumen des Hohlorgans oder auf die Schleimhaut des Organs wirken.
25
Bei den folgenden Stoffen wird davon ausgegangen, dass die in der Packungsbeilage empfohlene Dosierung von dem Anwender oder der Anwenderin nicht überschritten wird.
4.3.1 Enterococcus faecium
Bioflorin enthält lebende Enterokokken vom Stamm Enterococcus faecium SF68.
Anwendung findet es in Kapselform bei Störungen der Darmflora und Durchfallerkrankungen.
Enterococcus faecium und Antibiotika
Der Hersteller selbst weist in den Herstellerangaben darauf hin, dass die Einnahme nicht zeitgleich mit Antibiotika-Präparaten erfolgen soll.49 In-vitro zeigte sich,
dass gebräuchliche Antibiotika gegen die Bakterien Enterococcus faecium wirksam sind.50
Mit Ausnahme der Empfindlichkeit auf antibiotische Wirkstoffe wurden bei
Enterococcus faecium keine Hinweise gefunden, dass es bei gleichzeitiger Anwendung mit anderen Medikamenten bzw. verschreibungspflichtigen Medikamenten Wechselwirkungen gibt.
4.4 Oral systemisch wirksame Medikamente
Es werden die Wirkstoffe der am häufigsten verkauften oralen Präparate mit systemischer Wirkung mit den bisher bekannten Arzneimittelinteraktionen vorgestellt.
Bei den folgenden Stoffen wird davon ausgegangen, dass die in der Packungsbeilage empfohlene Dosierung von dem Anwender oder der Anwenderin nicht überschritten sowie Hinweise zur Einnahme (unzerkaut, vor dem Essen, nach dem
Essen etc.) eingehalten werden.
26
4.4.1 Acetylcystein
Acetylcystein ist ein Mucolytikum, das zur Gruppe der Expectorantien gehört. Es
hat einen schleimlösenden Effekt und wird bei Erkrankungen der Bronchialwege
eingesetzt.
Bei Anwendung von Präparaten mit Acetylcystein wurden keine Hinweise gefunden, dass es bei gleichzeitiger Anwendung mit anderen Medikamenten bzw. verschreibungspflichtigen Medikamenten Wechselwirkungen gibt.
4.4.2 Acetylsalicylsäure
Acetylsalicylsäure
(ASS)
gehört
zur
Gruppe
der
sauren
antipyretisch-
antiphlogistischen Analgetika und wirkt über irreversible Hemmung der Cyclooxygenase.2 Eingesetzt wird ASS als Schmerzmittel und Entzündungshemmer
bei Erkältungen sowie als Langzeittherapie in niedrigen Dosen (bis 100mg täglich)
bei Erkrankungen des arteriellen Gefäßsystems als irreversibler Thrombozytenaggregationshemmer.
Bei der Selbstbehandlung im Fall eines grippalen Infektes oder bei Schmerzen
kommen in der Regel Einzeldosen ab 300-400mg zum Einsatz; die tägliche Maximaldosis wird mit z. B. 2,8g51 bzw. 3g52 von Hersteller zu Hersteller unterschiedlich hoch angegeben.
4.4.2.1 ASS und Antiepileptika
ASS und Valproat
Einzelne Fallberichte deuten darauf hin, dass die gleichzeitige Einnahme von Valproat und hochdosiertem ASS in seltenen Fällen zu einer Valproatintoxikation führen kann. Die Intoxikationssymptome verschwanden bei Absetzen von ASS wieder
vollständig.53
4.4.2.2 ASS und blutdrucksenkende Substanzen
ASS und ACE-Hemmer
27
Bei gleichzeitiger Einnahme von ACE-Hemmern zur Blutdrucksenkung und ASS in
niedriger Dosis täglich zur Gerinnungshemmung sind keine Veränderungen des
Blutdrucks zu erwarten.54, 55
Eine Studie zeigte jedoch, dass ASS 300mg bei jedem zweiten Patienten bzw.
jeder zweiten Patientin zu einem Wirkungsverlust des ACE-Hemmers und somit
zu einer Erhöhung des Blutdrucks führte.54 Widersprüchlich dazu gibt es aber
auch Daten, die belegen, dass bei täglicher ASS-Einnahme bis 325mg unter ACEInihibitor-Therapie keine Blutdruckänderungen auftreten.56
Patienten und Patientinnen mit ACE-Hemmer-Therapie sollten die Einnahme von
ASS in höheren Dosen, wie sie zur Schmerz- und Entzündungsbekämpfung benutzt werden, meiden, da es scheint, als ob höhere Aspirin-Dosen mit einem Wirkverlust der ACE-Blockade einhergehen.
Die Ursache dieser Interaktion ist nicht vollständig geklärt, es wird jedoch vermutet, dass Prostaglandine dabei eine Rolle spielen.3
ASS und Betablocker
Mehrere Studien belegen, dass die Einnahme von ASS den blutdrucksenkenden
Effekt von verschiedenen Betablockern nicht verändert. Bei Dosen von 650mg
bzw. auch 3,9g pro Tag über mehrere Wochen in Kombination mit Betablockern
wurde keine signifikante Erhöhung des Blutdrucks festgestellt. 57 1950mg Aspirin
täglich über 7 Tage hatte keinen Einfluss auf den Blutdruck bei gleichzeitiger Einnahme von Propranolol oder Pindolol.58
ASS und Carboanhydrasehemmer
Beruhend auf einigen wenigen Fallberichten sowie in Tierversuchen bestätigt, ist
das geringe Risiko einer Salicylatintoxikation bei gleichzeitiger Einnahme von Carboanhydrasehemmern und hochdosierter Acetylsalicylsäure.59
Es gibt mehrere Erklärungsansätze, der zugrundeliegende Mechanismus ist jedoch nicht bekannt.
ASS und Kaliumsparende Diuretika
Die gleichzeitige Einnahme von ASS und kaliumsparender Diuretika bewirkt eine
verminderte Natriurese;60 die zusätzliche Gabe von hochdosiertem ASS über ei28
nen Zeitraum von mehreren Wochen hat jedoch keinen Einfluss auf den Blutdruck.61
ASS und Schleifendiuretika
Die gleichzeitige Einnahme von hochdosiertem ASS (4g täglich) und Furosemid
hat keinen Einfluss auf die Kreatinin-Clearance, Kreatinin- oder NatriumAusscheidung.62 Widersprüchlich dazu stehen die Ergebnisse von Oyekan, Laniyonu und Ashorobi, die zum Schluss kamen, dass bei gleichzeitiger Einnahme
von ASS und Furosemid eine Reduktion der Natriurese um 30%, bzw. bei Einnahme mit 3 Stunden Zeitdifferenz eine Reduktion der Natriurese um ungefähr
10% stattfand.
Eine Interaktion bei gleichzeitiger Administration von ASS und Schleifendiuretika
bei oraler Anwendung scheint gegeben, die Ausprägung der Wirkungsreduzierung
der Diuretika ist jedoch nicht eindeutig.
4.4.2.3 ASS und gerinnungshemmende Substanzen
ASS und Clopidogrel
Die gleichzeitige Einnahme von ASS und Clopidogrel ist im Vergleich zur Monotherapie mit ASS respektive Clopidogrel mit einer stark erhöhten Blutungsgefahr
des oberen Gastrointestinaltraktes verbunden.63 Bei gleichzeitiger Nutzung von
bereits niedrig dosiertem ASS und Clopidogrel oder verwandter Wirkstoffe ist die
Blutungsgefahr generell erhöht.3
ASS und Cumarine
Bei gleichzeitiger Einnahme von niedrig dosiertem ASS und Cumarinen besteht
ein erhöhtes Blutungsrisiko.64 Bei kombinierter Einnahme von höher dosiertem
ASS (1,95g täglich) und Warfarin erhöhte sich die Blutungszeit von 4 Minuten unter Warfarin Monotherapie auf über 10 Minuten.65 Zusätzlich besteht bei Dosen
von ASS über 4g täglich und gleichzeitiger Cumarin-Therapie das Risiko einer
Veränderung der Prothrombinzeit.3, 65
ASS und Faktor-Xa-Inhibitoren
29
Die Kombination von ASS und Faktor-Xa-Inhibitoren (Apixaban, Edoxaban, Rivaroxaban) führt zu erhöhter Blutungsgefahr.
Apixaban kombiniert mit ASS verursacht bei Patienten oder Patientinnen nach
akutem Koronar-Syndrom, im Vergleich zu ASS kombiniert mit einem Placebo,
eine jährliche Erhöhung der Gefahr einer starken Blutung von 0,6% auf 2,8%. 66
Edoxaban kombiniert mit ASS in niedriger Dosierung führt zu einem doppelten
Risiko einer starken Blutung.67
Rivaroxaban kombiniert mit ASS verursacht bei Patienten oder Patientinnen mit
venösen Thrombembolien im Vergleich zu Rivaroxaban als Monotherapie eine
Erhöhung der Gefahr einer starken Blutung von 2,2 auf 4,8 Blutungen pro 100 Patientenjahren.68
Aufgrund der erhöhten Blutungsgefahr sollte ASS als OTC-Präparat in Kombination mit Rivaroxaban nicht oder nur mit großer Vorsicht angewendet werden.
ASS und Thrombin-Inhibitoren
Die gleichzeitige Einnahme von ASS und Dabigatran zeigt ein bei Einnahme von
ASS 81mg täglich bzw. 325mg täglich ein 1,5-fach bzw. 2-fach erhöhtes Blutungsrisiko.69 Es scheint, als ob ein ASS dosisabhängiges Blutungsrisiko besteht; diese
Annahme muss jedoch in weiteren Studien bestätigt werden.
4.4.2.4 ASS und Psychopharmaka
ASS und Trizyklische Antidepressiva
Als Folgestudie der im Jahr 2000 veröffentlichten Studie mit bereits festgestellter
Häufung von Nebenwirkungen bei kombinierter Gabe von ASS und Imipramin 70
veröffentlichten Juárez-Olguin et. al. (2002) eine weitere Studie und zeigten eine
Erhöhung der milden Nebenwirkungen auf das 1,5-Fache sowie eine Erhöhung
der schweren Nebenwirkungen um das 2,5-Fache bei Verwendung von Imipramin
zusammen mit ASS, im Vergleich zu Imipramin als Monotherapie.71
4.4.2.5 ASS und Medikamente mit Einfluss auf den Stoffwechsel
ASS und Sulfonylharnstoffe, Insulin
Die Wirkung von ASS als blutzuckersenkendes Mittel ist bereits seit Langem bekannt.72 Bei gleichzeitiger Anwendung von Sulfonylharnstoffen und höherdosier-
30
tem
ASS
kann
einen
stärkeren
blutzuckersenkenden
Effekt
haben
als
gewünscht.73
ASS und Urikosurika
Die gleichzeitige Einnahme von ASS bis 325mg täglich und Urikosurika scheint
keinen Einfluss auf die Harnsäurewerte im Blut bzw. auf die Ausscheidung zu haben.74 Ab bereits 700mg ASS75 wird jedoch der Effekt der Urikosurika reduziert
und die Harnsäureausscheidung sinkt, der Harnsäurespiegel im Blut steigt. 76
Bei kontinuierlicher Einnahme von Urikosurika sollte ASS zur Schmerz- oder Entzündungsbekämpfung vermieden werden, da mit gleichzeitiger Einnahme in therapeutischer Dosis das Risiko auf einen akuten Gichtanfall steigt.
4.4.2.6 ASS und orale Kontrazeptiva
Bei gleichzeitiger Einnahme von ASS (300mg bzw. 600mg) und oralen Kontrazeptiva (Ethinylestradiol und Norethisterone) waren die Plasmakonzentration, Plasmahalbwertszeit und AUC von ASS in beiden Dosierungen signifikant niedriger. 77
Bei gewünschter analgetischer Wirkung ist daher eine Dosisanpassung notwendig.
4.4.2.7 ASS und sonstige Medikamente
ASS und Cortison
Die gleichzeitige Einnahme von ASS und Cortison führt zu erhöhter Ausscheidung
und dadurch zu einem niedrigeren Wirkstoffspiegel von ASS als ohne Cortison.78
Um einen therapeutischen Effekt zu erreichen, muss daher mehr ASS eingenommen werden.79
Die Gefahr bei längerer Einnahme von ASS mit gleichzeitigem Ausschleichen von
Cortison liegt darin, dass es durch die nun verringerte Ausscheidung zu erhöhten
Salicylat-Konzentrationen und folgend auch zu Salicylat-Intoxikationen kommen
kann.
ASS und Digoxin
1982 wurden mehrere Studien veröffentlicht, die den Einfluss von ASS auf Digoxinspiegel untersuchten. Zusätzlich zu täglicher Digoxingabe verabreichten Fenster et. al. (1982) täglich 2925mg ASS, konnten jedoch keine Interaktionen feststel31
len.80 Isbary, Doering und König (1983) fanden hingegen eine um 31% erhöhte
Digoxinkonzentration im Serum.3,
81
Da keine Fallberichte zum Thema Digoxin-
Intoxikationen bei paralleler ASS Einnahme vorliegen, kann davon ausgegangen
werden, dass die gleichzeitige Nutzung keine Probleme verursacht.
ASS und Methotrexat
Bei gleichzeitiger Einnahme von ASS (3,9g täglich) und Methotrexat kam es zu
einer verzögerten systemischen renalen Methotrexat-Ausscheidung, verglichen
mit der Methotrexat-Einnahme ohne ASS.82 Bei intraarterieller Gabe von Methotrexat und gleichzeitiger Gabe von ASS besteht ein erhöhtes Risiko einer Panzytopenie;83 inwiefern dieses Risiko bei anderer Administration erhöht ist, bleibt offen.
ASS und Metoclopramid
Die Einnahme von Metoclopramid beschleunigt laut Ross-Lee et. al. (1983) die
Absorption von ASS bei Migräne-Patienten und -Patientinnen.84 Da diese Studie
nur bei Migräne-Patienten und -Patientinnen durchgeführt wurde, liegt jedoch kein
Vergleich zu gesunden Personen vor. Bei Untersuchungen an Gesunden zeigte
sich keine beschleunigte Absorption bei gleichzeitiger Einnahme von ASS und
Metoclopramid.85
ASS und Penicilline
Kampmann et. al. (1972) zeigten in einer Studie, dass die Verwendung von ASS
unter Penicillintherapie die Halbwertszeit von Penicillin erhöht,86 was jedoch für die
antimikrobielle Therapie nicht von Relevanz ist.
4.4.2.8 Zusammenfassung Acetylsalicylsäure
Acetylsalicylsäure hat sehr viele potentielle Nebenwirkungen und auch Arzneimittelinteraktionen. Aufgrund des erhöhten Blutungsrisikos besteht bei gleichzeitiger
Einnahme mit anderen Medikamenten, die Einfluss auf die Thrombozytenbildung
oder -wirkung haben, die erhöhte Gefahr, eine Blutung zu erleiden, die auf additiver Wirkung der gerinnungshemmenden Eigenschaften beruht.
Die irreversible Hemmung der COX führt auch ohne begleitende Risiken zu einem
erhöhten Blutungsrisiko. Um Blutungen zu vermeiden, sollte die Einnahme daher
nur so kurz wie möglich und so lange wie nötig erfolgen.
32
Bei Einnahme von über 10g ASS am Tag kann es zu Salicylatintoxikationen kommen; bei Selbstmedikation ein zwar nicht sehr wahrscheinliches, aber trotzdem
bestehendes Risiko.
Acetylsalicylsäure ist ein in niedrigen Dosierungen in Bezug auf Wechselwirkungen sehr gut erforschtes Medikament. Die Literatur in Bezug auf höhere Dosierungen, wie sie bei analgetischer Therapie erfordert werden, ist aber noch nicht lückenlos.
Bei systemischer Anwendung von Acetylsalicylsäure besteht, je nach Art der zusätzlich eingenommenen Medikamente, ein erhöhtes Risiko, dass Wechselwirkungen mit anderen Medikamenten bzw. verschreibungspflichtigen Medikamenten
auftreten.
4.4.3 Bisacodyl
Bisacodyl gehört zur Gruppe der antiresorptiv und sekretagog wirkenden Laxantien und wird zur Therapie bei Obstipationen eingesetzt. Die Verabreichung erfolgt
entweder oral, mit Metabolisierung über die Leber und Wirkungseintritt nach 8-12
Stunden, oder rektal, mit Wirkungseintritt nach 30-60 Minuten.2, 11
Bisacodyl und Digoxin
Die gleichzeitige Einnahme von Bisacodyl und Digoxin vermindert den Digoxinspiegel im Blut um ungefähr 12%, was sich jedoch vermeiden lässt, wenn Digoxin
zwei Stunden vor Bisacodyl eingenommen wird.87
Die Ursache der Interaktion ist nicht geklärt, Botzler und Ritter (1982) vermuteten,
dass der Grund eine beschleunigte Darmpassage oder durch Bisacodyl verursachte Volumenverteilungsänderungen sein könnten.88 Aufgrund der langen Dauer bis zum Wirkungseintritt von Bisacodyl sind diese Möglichkeiten aber kritisch zu
betrachten, ebenso die klinische Relevanz der vorliegenden Daten, vor allem in
Anbetracht der Vermeidbarkeit der Interaktion.
33
Die Überdosierung oder länger dauernde Einnahme von Bisacodyl oder Laxantien
allgemein kann zu groben Störungen im Wasser- und Elektrolythaushalt führen.
Es werden vermehrt Wasser, Natrium sowie Kalium ausgeschieden und es kann
zur Exsikkose, Hyponatriämie oder -kaliämie und damit verbundenen Risiken
kommen.
Bei Anwendung von Bisacodyl wurden Hinweise gefunden, dass es bei gleichzeitiger Anwendung mit anderen Medikamenten bzw. verschreibungspflichtigen Medikamenten Wechselwirkungen gibt, die zwar wahrscheinlich geringfügig, aber vor
allem vermeidbar sind.
4.4.4 Coffein
Coffein gehört zu den Methylxanthinen und wird als Bronchodilatator und Psychostimulantium eingesetzt. Eine Tasse Kaffee enthält etwa 100mg, ein Glas CocaCola rund 40mg Coffein.2 Eine Tablette Thomapyrin classic enthält 50mg
Coffein.89
Die Beifügung von Coffein zu Mitteln gegen Erkältung geschieht unter anderem
aufgrund der psychostimulierenden Wirkung.
Coffein ist ein Substrat von Cytochrom P450 1A2; es ist zu erwarten, dass der Abbau von Coffein bei gleichzeitiger Einnahme von CYP1A2-Induktoren beschleunigt
respektive CYP1A2-Inhibitoren verringert ist.
Obwohl es viele Interaktionen gibt, ist Coffein in den meisten Fällen also nicht das
beeinflussende, sondern das beeinflusste Medikament. Die Induktoren und Inhibitoren von CYP1A2 werden in dieser Arbeit nicht behandelt, sondern nur die Wirkstoffe, die von Coffein beeinflusst werden.
4.4.4.1 Coffein und Antiepileptika
Bei gleichzeitiger Einnahme von Phenytoin und Coffein beschleunigt Phenytoin die
Ausscheidung und reduziert die Halbwertszeit von Coffein um 50%.90
34
Vaz et. al. (1998) stellten fest, dass die gleichzeitige Einnahme von 300mg Coffein
und Carbamazepin die Plasmalevel von Carbamazepin reduzierte und auch die
Bioverfügbarkeit von Carbamazepin um ungefähr 32% verringerte.91
4.4.4.2 Coffein und Psychopharmaka
Coffein und Clozapin
Die Einnahme von Coffein erhöht die Clozapin-Konzentration um 20% bis 26% im
Vergleich zu fehlender Coffein-Einnahme.92 Das Absetzen von Coffein führt zu
einer Reduktion der Plasmakonzentration von Clozapin um 47%. Wenn Coffein
wieder zugeführt wird, steigt auch die Plasmakonzentration wieder.93
Coffein und Lithium
Die gleichzeitige Einnahme von Coffein und Lithium führt zu einer Erhöhung der
Lithium-Ausscheidung, verglichen mit einem Placebo. In der vorliegenden Studie
wurden 400mg Coffein verabreicht.94
Coffein und Selektive Serotonin-Reuptake-Inhibitoren (SSRI)
Die länger dauernde Einnahme von Coffein verringert die Plasmakonzentration
von Fluvoxamin, wobei die pharmakodynamischen Eigenschaften von Fluvoxamin
unbeeinflusst bleiben.95 In der vorliegenden Studie wurden 300mg Coffein verabreicht.
4.4.4.3 Coffein und stimulierende Medikamente
Coffein und Ephedrin
Die gleichzeitige Einnahme von Coffein und Ephedrin haben einen additiven, stimulativen Effekt, der vermutlich auf additiver oder synergistischer Wirkung beruht.
In der vorliegenden Studie wurden 200mg Coffein verabreicht.96
Coffein und Theophyllin
Die Einnahme von Coffein verringert die Ausscheidung von Theophyllin und erhöht die AUC desselben um 29% bzw. 40%.97 Wieder ist hier fraglich, ob diese
Daten bei der Anwendung von OTC-Präparaten Relevanz haben, da die Administrationsroute von Theophyllin in dieser Studie intravenös war.
35
4.4.4.4 Coffein und sonstige Medikamente
Coffein und Hypnotika
Die Einnahme von Coffein bei gleichzeitiger Einnahme von Pentobarbital als
Schlafmittel reduziert den hypnotischen Effekt von Pentobarbital.98
Wie bei den Barbituraten reduziert Coffein den Effekt der Benzodiazepine, wobei
die Reduktion abhängig von der eingenommenen Dosis des Coffeins ist (kein Effekt bei 125mg Coffein auf 12mg Midazolam, moderater Effekt bei 250mg Coffein
auf 12mg Midazolam).99
Ursache dafür ist die Stimulation des Gehirns durch Coffein, weshalb man allgemein abends Kaffee oder coffeinhaltige Getränke vermeiden sollte, wünscht man
gut zu schlafen.
4.4.4.5 Zusammenfassung Coffein
Coffein interagiert mit mehreren verschreibungspflichtigen Medikamenten. In Studien, in denen Interaktionen festgestellt wurden, wurden jedoch größere Mengen
von Coffein verwendet als üblicherweise bei der Verwendung eines OTCPräparates eingenommen werden.
Da Coffein kein Enzyminduktor oder -inhibitor ist, ist nicht zu erwarten, dass die
Pharmakokinetik anderer, über die Leber ausgeschiedener Substanzen wesentlich
beeinflusst wird. Im Fall von psychostimulativen Wechselwirkungen, beruht diese
in den meisten Fällen auf einer additiven Wirkung der Substanzen.
Eine beginnende Überdosierung von Coffein würde sich vor allem durch Tachykardie, Tremor, erhöhten Blutdruck und Mydriasis äußern; es ist jedoch wahrscheinlicher, diese Symptome durch Kaffee- oder Schwarzteekonsum auszulösen,
als durch Dosen in OTC-Präparaten.
Aufgrund der geringen Dosis ist es unwahrscheinlich, dass Coffein in OTCPräparaten mit anderen Medikamenten klinisch relevant interagiert.
4.4.5 H1-Antihistaminika (Dimetindenmaleat, Diphenhydramin)
Die Wirkstoffe Dimetindenmaleat und Diphenhydramin gehören beide zu den H1Antihistaminika der ersten Generation. Zusätzlich zum Antagonismus am H1Rezeptor, können Wirkstoffe dieser Gruppe auch Muscarinrezeptoren blockieren,
36
wodurch unerwünschte Nebenwirkungen, aber auch Interaktionen mit anderen
Medikamenten entstehen können.11
Diphenhydramin ist in der Leber ein schwacher Cytochrom P450 2D6 Inhibitor.100
Sollte bei topischer Anwendung eine große Menge systemisch absorbiert werden,
wäre es theoretisch möglich, dass Medikamente, die über P450 CYP2D6 metabolisiert werden, langsamer abgebaut werden und somit erhöhte Wirkstoffkonzentrationen als vorgesehen aufweisen.
4.4.5.1 Antihistaminika und anticholinerge Substanzen
Bei gleichzeitiger Anwendung von Antihistaminika mit anticholinergen Substanzen
kann es zu einer additiven Wirkungsverstärkung der antagonistischen Wirkung an
den Muscarinrezeptoren kommen. Die Folgen davon ähneln einer Überdosierung
von Muscarinrezeptorantagonisten. Hervorzuheben ist hier vor allem das Risiko
eines Glaukoms, das in Kombination mit vielen Medikamenten, wie z. B. Antipsychotika, Antidepressiva, MAO-Inhibitoren und bestimmter Antibiotika, erhöht ist.101
4.4.5.2 Antihistaminika und zentral dämpfende Substanzen
Bei gleichzeitiger Einnahme von Diphenhydramin und Diazepam ist ein stärkerer
psychomotorisch dämpfender Effekt zu erwarten als bei solitärer DiazepamEinnahme.102 Bei dauerhafter Einnahme von Diphenhydramin ist allerdings eine
Toleranzentwicklung mit folgender Abschwächung des dämpfenden Effekts von
Diphenhydramin auf Diazepam zu erwarten.103
1970 wurde eine Studie veröffentlicht, die belegt, dass die Gabe von Antihistaminika zusammen mit Opioiden die atemdepressive Wirkung der Opioide verstärkt,
aber nicht verlängert.104
Weitere Substanzen, deren zentral dämpfende Wirkung mit der von Antihistaminika additiv wirksam sein könnten, sind Antidepressiva, Beruhigungsmittel, Antiepileptika. Antiemetika, Procarbazin sowie andere Antihistaminika. 105
4.4.5.3 Zusammenfassung Antihistaminika
Die Wechselwirkungen von systemischen Antihistaminika beruhen auf additiver
Wirkungsverstärkung mit entweder zentral dämpfenden, oder anticholinerg wirkenden Substanzen.
37
Eine Überdosierung von Antihistaminika äußert sich je nach verwendetem Antihistaminikum initial durch anticholinerge Symptomatik und warme trockene Haut.
Speziell in der älteren Bevölkerungsgruppe gibt es viele Menschen, die Medikamente mit oben genannten Wirkungen benötigen; bei zusätzlich Einnahme von
Antihistaminika besteht daher ein erhöhtes Risiko, den zentral dämpfenden oder
anticholinergen Effekt zu übersehen oder unterschätzen.
4.4.6 Efeublätter
Präparate aus Efeublättern werden als sekretolytische Substanzen bei Erkältungen angewandt.4
Bei Anwendung von Präparaten mit Efeublättern als wirksames Agens wurden
keine Hinweise gefunden, dass es bei gleichzeitiger Anwendung mit anderen Medikamenten bzw. verschreibungspflichtigen Medikamenten Wechselwirkungen
gibt.
4.4.7 Eibischwurzelflüssigextrakt
Extrakte aus Eibischblättern oder -wurzeln werden bei Entzündungen im Rachenraum zur Reizlinderung angewandt.
Möglicherweise verzögert die Einnahme von Eibischblätter- und -wurzelpräparaten
die Absorption von anderen Medikamenten; es gibt jedoch keine Beweise für Interaktionen mit anderen Wirkstoffen.106
Bei Anwendung von Eibischpräparaten wurden keine Hinweise gefunden, dass es
bei gleichzeitiger Anwendung mit anderen Medikamenten bzw. verschreibungspflichtigen Medikamenten Wechselwirkungen gibt.
38
4.4.8 Ibuprofen, Ibuprofen Lysinsalz (NSAR)
Wie Acetylsalicylsäure gehört auch Ibuprofen zu den sauren antipyretischantiphlogistisch wirksamen Analgetika, wirkt jedoch im Gegensatz zu ASS über
eine reversible Hemmung der Cyclooxygenase.
Durch die reversible Hemmung der COX-1 wird die Thrombozytenaggregation von
Ibuprofen verhindert, durch die Reversibilität kann Ibuprofen aber nicht wie ASS
als therapeutischer Thrombozytenaggregationshemmer eingesetzt werden. 1
4.4.8.1 Ibuprofen und blutdrucksenkende Mittel
Ibuprofen und ACE-Hemmer
Eine 2003 veröffentlichte Studie zeigte, dass bei Einnahme von Ibuprofen 2400mg
über 4 Wochen bei mit ACE-Hemmern stabil eingestelltem Blutdruck sowohl der
systolische als auch der diastolische Blutdruck gering ansteigen.107 Eine andere,
im Jahr 2012 veröffentlichte Studie zeigte, dass Ibuprofen zusammen mit ACEHemmern, im Vergleich zu Acetaminophen mit ACE-Hemmern, einen leichten
Blutdruckanstieg verursacht.108
Ibuprofen und Betablocker
Bei Blutdruckeinstellung mit Betablockern und gleichzeitiger Einnahme von Ibuprofen ist ein größerer Blutdruckanstieg zu erwarten als bei Einnahme von Ibuprofen kombiniert mit Calciumkanalblockern oder ACE-Hemmern.108
In der Literatur finden sich mehr Studien, die über einen Blutdruckanstieg bei
gleichzeitiger Einnahme von Ibuprofen in Kombination mit einem Betablocker berichten als solche, die keinen Einfluss auf den Blutdruck finden. Es ist daher anzunehmen, dass Ibuprofen möglicherweise nicht bei allen, aber doch bei vielen Patienten und Patientinnen einen Effekt auf den Blutdruck unter Betablockertherapie
hat.
Ibuprofen und Calciumkanal Blocker
Die kurzzeitige Anwendung von Ibuprofen (1200mg täglich für drei Tage) verursacht bei mit Amlodipin eingestelltem Blutdruck eine Blutdruckerhöhung über eine
extrarenale, prohypertensive Hemmung der Cyclooxygenase.109
In einer Studie über Ibuprofen in Kombination mit Verapamil, wurde allerdings keine Veränderung des Blutdrucks festgestellt.110 Möglicherweise spielt hierbei die
39
Substanzklasse eine Rolle, beide Wirkstoffe blockieren Calciumkanäle, Amlodipin
gehört aber zu den Dihydropyridinen, Verapamil zu den Phenylalkylaminen. 2
Ibuprofen und Schleifendiuretika
Furosemid erhöht die Glomeruläre Filttrationsrate; ein Mechanismus, der bei der
gleichzeitigen Gabe von Ibuprofen (400mg) unterdrückt wird. Gleichzeitig wird
aber die Ausscheidung von Natrium nicht beeinflusst.111
Ibuprofen und Thiazide
Mehrere Studien liefern unterschiedliche Ergebnisse in Bezug auf die Anwendung
von Ibuprofen mit Thiaziddiuretika auf den Blutdruck. Teilweise konnte keine Veränderung des Blutdrucks festgestellt werden (Ibuprofen 1600mg täglich über 2
Wochen),112 andere Studien stellten eine geringe Erhöhung des systolischen Blutdrucks fest (Ibuprofen 1800mg täglich über 4 Wochen).113 Bei den Studien, die
eine Erhöhung des Blutdrucks feststellten, bleibt allerdings offen, ab welchem
Zeitpunkt bzw. ab welcher Dauer und Dosis bei der Anwendung von Ibuprofen
eine Erhöhung des Blutdrucks festgestellt werden kann sowie, ob es bei Einhaltung der vom Hersteller empfohlenen Dosierungen ebenfalls zu Blutdruckveränderungen kommt.
4.4.8.2 Ibuprofen und gerinnungshemmende Medikamente
Ibuprofen und Cumarine
Kurz nach Einführung von Ibuprofen wurden 1973 bzw. 1974 Studien zu Verträglichkeiten mit Vitamin-K-Antagonisten durchgeführt. Dabei fand man heraus, dass
die tägliche Einnahme von Ibuprofen in Dosen von 600mg bis 1800mg keinen Einfluss auf die gerinnungshemmende Therapie mit Warfarin hat, 114 und dass Ibuprofen 600mg täglich keinen Einfluss auf die Gerinnung, die Gerinnungszeit oder
die Plasmakonzentrationen von Phenprocoumon unter Phenprocoumontherapie
hat.115 Später wurde allerdings festgestellt, dass Ibuprofen zwar keinen Einfluss
auf die Prothrombinzeit und Thrombozytenzahl hat, aber die gleichzeitige Gabe
unter Cumarintherapie eine Verlängerung der Blutungszeit bewirkt. 116
Da Ibuprofen über Hemmung der COX-1 wirkt und dadurch die Thrombozytenaggregation gehemmt wird, ist zu vermuten, dass eine additive erhöhte Blutungsge-
40
fahr bei gleichzeitiger Einnahme mit anderen gerinnungshemmenden Substanzen
existiert.
4.4.8.3 Ibuprofen und Medikamente mit Einfluss auf den Stoffwechsel
Ibuprofen und Lipidsenker
Bei Einnahme von Ibuprofen unter Gemfibroziltherapie erhöhen sich die Halbwertszeit und AUC von R-Ibuprofen, der Einfluss auf S-Ibuprofen ist aber geringer
und klinisch kaum signifikant.117 Da der Großteil der Wirksamkeit von Ibuprofen
auf dem S-Racemat beruht, ist diese Interaktion mehr von wissenschaftlicher Relevanz.
Das nicht mehr verwendete Clofibrat verursachte, anders als Gemfibrozil, eine
erhöhte Ausscheidung und niedrigere AUC von Ibuprofen (R-Ibuprofen stärker
betroffen als S-Ibuprofen);118 es ist daher anzunehmen, dass Fibrate allgemein
einen Einfluss vor allem auf R-Ibuprofen haben; ob dieser nun auf verlangsamtem
oder beschleunigtem Abbau beruht, ist von Wirkstoff zu Wirkstoff unterschiedlich.
Die gleichzeitige Einnahme von Colestyramin und einer Einzeldosis Ibuprofen
führt zu einer verminderten AUC und Plasmalevel von Ibuprofen. 119
Ibuprofen und Sulfonylharnstoffe
Der blutzuckersenkende Effekt von Sulfonylharnstoffen wird von Ibuprofen leicht
gesteigert, ergab eine Studie von Sone, Takahashi und Yamada (1996). Die Studie an gesunden Menschen ergab, dass der freie Anteil an Glibenclamid unter
Ibuprofen-Therapie leicht erhöht, die Pharmakokinetik von Glibenclamid aber nicht
beeinflusst wird. Im schlimmsten Fall kann diese blutzuckersenkende Wirkung bis
zum hypoglykämischen Koma führen; es gibt bisher aber nur einen Fall, in dem
die Ursache einer Hypoglykämie auf Ibuprofen zurückgeführt wurde.120
4.4.8.4 Ibuprofen und sonstige Medikamente
Ibuprofen und Azole
Voriconazol und Fluconazol erhöhen sowohl die Spitzenplasmaspiegel als auch
die AUC von S-Ibuprofen, beeinflussen aber die Pharmakokinetik von R-Ibuprofen,
verglichen mit Einnahme von Ibuprofen ohne andere Wirkstoffe, kaum. In der Studie von Hynninen et al. (2006) erfolgte die Einnahme von Ibuprofen 400mg eine
Stunde nach Einnahme der Antimykotika. Es wird angenommen, dass die erhöh41
ten Konzentrationen von S-Ibuprofen als Substrat des Cytochrom P450 2C9 durch
eine Inhibition von CYP2C9 durch die Antimykotika verursacht wird. 121
Ibuprofen und Baclofen
Bei Langzeittherapie mit Baclofen kann es bei zusätzlicher Gabe von Ibuprofen zu
einer eingeschränkten renalen Ausscheidung von Baclofen und dadurch verursachte Toxizität kommen. Diesbezüglich liegt nur ein Fallbericht vor, wobei in diesem Fall mehr eine sehr ungünstige Konstellation von unerwünschten Nebenwirkungen als Wechselwirkungen der Medikamente vorliegen.122
Ibuprofen und Corticosteroide
Eine von Piper et al. (1991) veröffentlichte Studie zeigte ein erhöhtes Risiko bei
gleichzeitiger Einnahme von Cortikosteroiden und NSAR, ein Magenulkus zu erleiden.123 Langman et al. (1994) zeigten in einer weiteren Studie, dass das Risiko
für ein Magenulkus bei Ibuprofen im Vergleich zu anderen NSAR geringer ist sowie dass das Auftreten eines Magenulkus unter Corticosteroidtherapie auch von
der Dosis des NSAR abhängt.124
Ibuprofen und Hormonersatztherapie
Bei postmenopausaler Hormonersatztherapie (HRT) besteht ein geringeres Risiko,
einen Herzinfarkt zu erleiden als ohne HRT. Bei gleichzeitiger Einnahme von Ibuprofen (bzw. Ibuprofen, Diclofenac oder Naproxen) erhöht sich das relative Risiko,
einen Myokardinfarkt zu erleiden, auch über das Risiko eines Myokardinfarktes
ohne HRT hinaus. Ursache dieses erhöhten Risikos ist möglicherweise der Verlust
des cardioprotektiven Effekts der HRT, sobald Ibuprofen zusätzlich eingenommen
wird.125
Ibuprofen und Lithium
Bei gesunden Menschen unter Lithiumtherapie erhöht sich der Spiegel und verringert sich die Ausscheidung von Lithium bei gleichzeitiger Einnahme von Ibuprofen.126 In mehreren Fällen wurde von Symptomen von beginnenden Lithiumintoxikationen berichtet, als zusätzlich mit der Ibuprofen-Einnahme begonnen wurde.127, 128
42
Ibuprofen und Methotrexat
Bei gleichzeitiger Einnahme von Methotrexat und Ibuprofen verringert Ibuprofen
die renale Ausscheidung von Methotrexat und erhöht somit die Gefahr erhöhter
Methotrexatspiegel und -toxizitäten.129
4.4.8.5 Zusammenfassung Ibuprofen
Es gibt mehrere Medikamente, die Wechselwirkungen mit Ibuprofen zeigen. Die
relevantesten Interaktionen sind die geringe gegensätzliche Wirkung des blutdrucksenkenden Effektes bei einigen blutdruckregulierender Medikamenten und
die erhöhte Gefahr einer Blutung bei gleichzeitiger gerinnungshemmender Medikation aufgrund einer additiven Wirkung auf das Gerinnungssystem.
Eine Überdosierung von Ibuprofen würde sich zu Beginn durch eine Blutdrucksenkung bemerkbar machen; ein tödlicher Ausgang bei solitärer IbuprofenÜberdosierung ist nicht sehr wahrscheinlich; bei zusätzlicher Einnahme anderer
Medikamente oder Genussmittel kann es zur Aggravierung der Symptomatik
kommen.
Bei gleichzeitiger Anwendung mit anderen Medikamenten bzw. verschreibungspflichtigen Medikamenten ist daher Vorsicht geboten, da es im schlimmsten Fall
zu lebensbedrohlichen Wechselwirkungen kommen kann.
4.4.9 Paracetamol
Paracetamol gehört zur Gruppe der nichtsauren antipyretischen Analgetika und
wird als fiebersenkendes und schmerzstillendes Mittel angewandt. Die antiphlogistische Wirkung ist nicht so gut wie etwa bei Ibuprofen. Die Wirkungsweise ist nicht
vollständig bekannt, es wird jedoch vermutet, dass die Effekte durch eine zentrale
COX-Hemmung hervorgerufen werden. Der Abbau von Paracetamol geschieht in
der Leber; etwa die Hälfte wird zu Glucuroniden, ein Drittel zu Sulfaten umgebaut.
Der restliche Anteil wird entweder unverändert renal ausgeschieden oder mittels
Cytochrom P450 Enzymen metabolisiert und dann mit Glutathion inaktiviert.2, 11
4.4.9.1 Paracetamol und Antiepileptika
Bereits 1979 fanden Perucca und Richens, dass der Abbau von Paracetamol in
der Leber durch enzyminduzierende Antiepileptika beschleunigt wird. Auch wurde
43
damals schon vermutet, dass bei gleichzeitiger Einnahme von anderen Substanzen die eine Enzyminduktion in der Leber verursachen, der Metabolismus von Paracetamol die Leber so stark belasten kann, dass als Folge Lebernekrosen entstehen können.130 Mehrere Berichte von derartigen Fällen bestätigen diese Annahme, wobei Leberschäden auch schon bei therapeutischen Dosen von Paracetamol eintraten.131, 132
4.4.9.2 Paracetamol und Cumarin
Es gibt bereits mehrere Studien, die sich teilweise widersprechen, ob Paracetamol
mit gleichzeitiger Einnahme von Cumarinen einen Einfluss auf die INR hat oder
nicht; die Mehrzahl der Studien spricht jedoch von einer Interaktion im Sinne einer
Wirkverstärkung der Cumarine und somit Erhöhung der INR.3
Einzelne Fallberichte sprechen sehr für eine Erhöhung der INR unter Cumarintherapie mit Paracetamol als kausalem Zusammenhang.133, 134
Hughes, Patel und Saxena (2011) veröffentlichten eine Metastudie über die Interaktion von Paracetamol und Warfarin und fanden dabei heraus, dass erst ab einer
Dosis von 2g Paracetamol täglich an mehreren folgenden Tagen eine Veränderung in der INR zu bemerken ist. Der vermutete Mechanismus ist eine aufgrund
der erhöhten Menge an Paracetamol veränderte Metabolisierung in der Leber. 135
Patienten und Patientinnen unter Cumarintherapie sollten auf dieses Risiko hingewiesen werden, damit mögliche Komplikationen vermieden werden können.
4.4.9.3 Paracetamol und orale Kontrazeptiva
Mitchell et. al. (1983) erkannten, dass der Abbau von Paracetamol bei Frauen unter niedrig dosierten, östrogenbasierten oralen Kontrazeptiva beschleunigt ist. Der
beschleunigte Abbau wird durch eine verstärkte Glucuronidierung verursacht, die
anderen Eliminationswege bleiben unbeeinflusst.136 Leider gibt diese Studie keine
Auskunft über höher dosierte orale Kontrazeptiva.
4.4.9.4 Paracetamol und sonstige Medikamente
Paracetamol und Colestyramin
Die Einnahme von Paracetamol und Colestyramin zum gleichen Zeitpunkt reduziert die Absorption von Paracetamol. Die Reduktion in der Absorption kann je-
44
doch teilweise vermieden werden, wenn die Einnahme von Colestyramin eine
Stunde nach der Einnahme von Paracetamol erfolgt.137
Paracetamol und Probenecid
Probenecid ist ein nicht kompetitiver Inhibitor des Glucuronidierungsprozesses in
der Leber und reduziert den Abbau von Paracetamol durch Glucuronidierung.138
Es wurden keine Fallberichte zu Lebertoxizität bei gleichzeitiger Anwendung von
Probenecid und Paracetamol gefunden; es ist also fraglich, ob der verzögerte Abbau eine klinische Relevanz hat.
Paracetamol und Tyrosinkinaseinhibitoren
Kim et. al. (2011) zeigten, dass keine pharmakokinetische Interaktion zwischen
Paracetamol und Imatinib zu erwarten ist.139
Es gibt jedoch vereinzelte Berichte von Fällen, in denen es unter Tyrosinkinaseinhibitortherapie und gleichzeitiger Einnahme von Paracetamol zu Leberversagen
gekommen ist. In einer Tierstudie bei Mäusen kam es zu irreversiblen Leberschäden bei gleichzeitiger Administration von Imatinib und Paracetamol, deren Ursache möglicherweise im gemeinsamen Eliminationsweg über Cytochrom P450 Enzyme liegt.140
4.4.9.5 Zusammenfassung Paracetamol
Es gibt mehrere Medikamente, die Wechselwirkungen mit Paracetamol zeigen.
Die relevantesten Interaktionen sind die potentiellen Leberschäden bei gleichzeitiger Einnahme mit anderen Enzyminduktoren wie z. B. Antiepileptika sowie die
Verlängerung der INR-Zeit bei gleichzeitiger Einnahme von Cumarinen, da stärkere Blutungen das Resultat sein können.
Die beginnende Symptomatik einer Überdosierung von Paracetamol ist Übelkeit,
Erbrechen und Bauchschmerzen; später ist die typische Komplikation das Leberversagen, wofür das Risiko bei Alkoholkonsum verstärkt ist.
Bei gleichzeitiger Anwendung mit anderen Medikamenten bzw. verschreibungspflichtigen Medikamenten ist daher Vorsicht geboten, da es lebensbedrohliche
Wechselwirkungen gibt.
45
4.4.10
Passionsblumenextrakt
Präparate aus Passionsblumenextrakten (Passiflora) werden bei nervöser Unruhe
und bei Einschlafstörungen als Sedativa verwendet. 4
Als Sedativum ist bei Passionsblumenextrakten eine additive Wirkung mit anderen
sedativ wirksamen Substanzen zu erwarten (z. B. Antihistaminika); es wurden jedoch keine Berichte zu Interaktionen in dieser Richtung gefunden.
Ein Einzelfall beschreibt einen Mann, der bei Lorazepameinnahme gleichzeitig
Passiflora incarnata und Valeriana officinalis (Baldrian) ohne Rücksprache mit einem Arzt einnahm und daraufhin einen Tremor in den Händen und muskuläre
Schwäche entwickelte. Es wurde vermutet, dass die Kombination der Pflanzenextrakte die inhibitorischen Effekte von Lorazepam auf die GABA-Rezeptoren verstärkte und somit die Symptome auslöste.141
Offen bleibt, wie groß das Risiko auf eine Gesamtpopulation gesehen ist, da sonst
keine anderen Fallberichte über derartige Symptome bei der Kombination von
Passionsblume, Baldrian und Benzodiazepinen vorliegen.
Bei Anwendung von Präparaten mit Passionsblumenextrakten wird vor additiven
sedativen Effekten bei gleichzeitiger Anwendung mit anderen sedierenden Medikamenten gewarnt, es wurden aber keine Hinweise gefunden, dass es bei gleichzeitiger Anwendung mit anderen sedierenden Medikamenten bzw. verschreibungspflichtigen sedierenden Medikamenten Wechselwirkungen gibt.
4.4.11
Pseudoephedrin-Hydrochlorid
Pseudoephedrin-Hydrochlorid gehört zur Gruppe der indirekten Sympathomimetika und wird bei Erkältung oral eingesetzt. Es verursacht eine periphere Vasokonstriktion und wirkt somit abschwellend. Ein Beutel Aspirin-Complex-Granulat enthält 30mg Pseudoephedrin-Hydrochlorid.142
46
4.4.11.1
Pseudoephedrin und blutdrucksteigernde Medikamente
Pseudoephedrin und Bupropion
Die Kombination von Pseudoephedrin als Mittel gegen Erkältung zusammen mit
Bupropion kann zu einem erhöhten Gefäßtonus führen, im schlimmsten Fall bis zu
einer akuten Myocardischämie.143
Pseudoephedrin und MAO-Hemmer
Auf das Interaktionspotential indirekter Sympathomimetika mit MAO-Inhibitoren
wurde bereits im Kapitel von Oxymetazolinhydrochlorid und Xylometazolin eingegangen; es gilt auch für Pseudoephedrin, dass eine gleichzeitige Anwendung mit
MAO-Inhibitoren zu einem stark erhöhten Blutdruck führen kann.
4.4.11.2
Zusammenfassung Pseudoephedrin-Hydrochlorid
Bei Anwendung von Präparaten mit Pseudoephedrin-Hydrochlorid besteht das
Risiko, dass es bei gleichzeitiger Anwendung mit Medikamenten, die den Blutdruck steigern, einen verstärkten Effekt hat.
Sonst wurden keine Hinweise gefunden, dass es bei gleichzeitiger Anwendung
von Pseudoephedrin-Hydrochlorid mit anderen Medikamenten bzw. verschreibungspflichtigen Medikamenten Wechselwirkungen gibt.
4.4.12
Tee-Präparate
Folgend werden die Ingredienzien von Dr. Kottas und Sidroga Teesorten aufgelistet, die im Austria-Codex mit Interaktionshinweisen versehen sind.
4.4.12.1
Dr. Kottas Johanniskrauttee, Sidroga Johanniskrauttee
Johanniskraut (Hypericum) wird als OTC-Produkt als Tee bei psychischer Belastung eingesetzt; pro Teebeutel sind 1,7g bzw. 1,75g Johanniskraut enthalten. Johanniskraut ist ein Induktor von CYP 3A4.3
In einer Studie von Mueller et. al. (2004) wurde die Absorption von Johanniskraut,
und sein Einfluss auf die Pharmakokinetik von Digoxin abhängig von der zugeführten Arzneiform geprüft. Bei eingestelltem Digoxinspiegel wurden für 14 Tage
zweimal täglich 1,75g Johanniskraut mit 150ml Wasser 10 Minuten lang aufge47
gossen und danach getrunken. In Form des Tees konnte keine Interaktion mit Digoxin festgestellt werden.144
Möglicherweise ist ein Teil des mit CYP 3A4 interagierenden Wirkstoffes durch
das heiße Wasser inaktiviert geworden, nicht im Wasser gelöst oder absorbiert
worden. Es existieren vereinzelte Fälle, bei denen Johanniskraut in Form von Tee
als Ursache einer Medikamenteninteraktion identifiziert wurde. Leider gibt es aber
keine Angaben über die Menge an Johanniskraut, die dazu nötig war. In einem
Fall war die Menge an Tee mit zwei Litern beschrieben, was zwar eine höhere
Menge Johanniskraut vermuten, aber nicht sicher darauf schließen lässt.145, 146
Die Gefahr bei Einnahme von Johanniskraut liegt in der Induktion von CYP 3A4,
was einen beschleunigten Abbau von Medikamenten wie Digoxin, Ciclosporin oder
oralen Kontrazeptiva hat. Da es nicht wenige Menschen gibt, die orale Kontrazeptiva oder Digoxin einnehmen, können die Folgen der Selbstmedikation mit Hypericum eine ungewollte Schwangerschaft bei Geschlechtsverkehr ohne weiteren
Verhütungsmaßnahmen oder Aggravierung einer Herzinsuffizienz sein.
4.4.12.2
1
Tee-Präparate mit Süßholz
Verschiedene Präparate von Dr. Kottas und Sidroga enthalten Süßholz, wobei pro
Teebeutel 0,3g nicht überschritten werden.
Von Boganen, van Hee und Grundmeijer (2007) werden nicht mehr als 10g bis
30g Süßholz pro Tag empfohlen, um vor allem die Nebenwirkung eines erhöhten
Blutdrucks zu vermeiden.147 Aus der Konsumation von großen Mengen süßholzhaltigem Tee resultiert möglicherweise ein zu hoher bzw. schwer einstellbarer
Blutdruck.148
4.4.12.3
Zusammenfassung Tee-Präparate
Es ist unwahrscheinlich, dass bei Einhaltung der Dosierungen wie vom Hersteller
vorgeschrieben, die Konsumation von Tee-Präparaten bei gleichzeitiger Anwendung mit anderen Medikamenten bzw. verschreibungspflichtigen Medikamenten
Wechselwirkungen verursacht.
Sollten größere Dosen eingenommen werden, sind Wechselwirkungen mit anderen Medikamenten aber nicht auszuschließen.
48
4.4.13
Thymianflüssigextrakt
Extrakte aus Thymian werden bei Entzündungen im Rachenraum zur Reizlinderung angewandt.
Thymian hat eine synergistische Wirkung mit 5-Fluorouracil; worauf diese Wirkung
beruht und wie stark das antineoplastische Präparat beeinflusst wird, ist jedoch
nicht bekannt.149, 150
Bei Anwendung von Thymianpräparaten wurden keine Hinweise gefunden, dass
es bei gleichzeitiger Anwendung mit anderen Medikamenten bzw. verschreibungspflichtigen Medikamenten Wechselwirkungen gibt.
4.4.14
Vitamin C (Ascorbinsäure), Zitronensäure
Ascorbinsäure oder Zitronensäure werden ergänzend bei Erkältungen eingesetzt,
um einen möglichen Vitaminmangel auszugleichen. Zu Tabletten, Brausetabletten
oder Granulat werden pro Dosis zwischen 200mg und 250mg Ascorbinsäure hinzugefügt; bei hoher Dosierung bis 500mg.
Vitamin C und Eisenchelatbildner
Die Einnahme von 500mg Vitamin C unter Therapie mit Deferoxamin bei Thalassämia major führt zu einer bis zu 10-fach erhöhten Ausscheidung von Eisen
über die Niere sowie zu einer klinisch relevanten linksventrikulären Funktionsstörung.151 Durch die bereits bei niedriger Menge an Vitamin C auftretenden Interaktionen sollten Patienten oder Patientinnen unter Eisenchelatbildnertherapie auf die
Risiken von Erkältungspräparaten mit Ascorbinsäurezusatz hingewiesen werden.
Bei Einnahme von Ascorbinsäure oder Zitronensäure wurden, ausgenommen bei
kombinierter Einnahme mit Eisenchelatbildnern, keine klinisch relevanten bzw.
signifikaten Hinweise gefunden, dass es bei gleichzeitiger Anwendung mit ande-
49
ren Medikamenten bzw. verschreibungspflichtigen Medikamenten Wechselwirkungen gibt.
4.4.15
Zusammenfassung oral systemische Medikamente
Viele der meistverkauften rezeptfreien Medikamente beherbergen das Risiko, mit
anderen Medikamenten zu interagieren.
Ältere Menschen leiden oft unter Erkrankungen, die es erforderlich machen, Medikamente mit Einfluss auf die Gerinnung einzunehmen. Vor allem die sauren Analgetika können in dieser Hinsicht Probleme verursachen, da, wie beschrieben,
durch die additive Hemmung der Gerinnung eine erhöhte Gefahr für Blutungen
besteht.
Auch Paracetamol kann durch den Einfluss auf Cumarine ein erhöhtes Blutungsrisiko verursachen, das bei regelmäßigen INR-Kontrollen durch den behandelnden
Arzt aber erkannt und verringert werden kann.
Der durchschnittliche Käufer bzw. die durchschnittliche Käuferin von rezeptfreien
Medikamenten hat kein Fachwissen in Bezug auf Nebenwirkungen und mögliche
Interaktionen des verwendeten Präparats. Eine Rücksprache mit dem Arzt vor
dem Kauf eines OTC-Produkts ist zu empfehlen, um die bestmögliche Therapie
mit geringstem Risiko für Nebenwirkungen und Wechselwirkungen einleiten zu
können, wobei natürlich immer eine Nutzen-Risiko-Abwägung der einzelnen Substanzen gemacht werden sollte.
Folgend werden die Interaktionen der oral systemisch wirksamen Arzneimittel mit
marginaler Bedeutung kurz zusammengefasst.
Die Klassifikation „marginal“ ergibt sich aus der vermuteten Häufigkeit der Basismedikation mit dem verschreibungspflichtigen Medikament in Kombination mit
Nutzung des OTC-Produktes und der Schwere der zu erwartenden Interaktion.
Tabelle 5: Tabellarische Darstellung der marginalen Interaktionen der oral systemischen
Arzneimittel
Wirkstoffname
Interaktion mit
50
Valproat
Acetylsalicylsäure
Imipramin
blutzuckersenkende Substanzen
Cortison
Bisacodyl
Coffein
H1-Antihistaminika
Digoxin
Antiepileptika
Theophyllin
Anticholinergika
blutzuckersenkende Substanzen
Ibuprofen
Corticosteroide
Hormonersatztherapie
Methotrexat
Paracetamol
Pseudoephedrin-Hydrochlorid
Vitamin C
Tyrosinkinaseinhibitoren
blutdrucksteigernde Substanzen
MAO-Inhibitoren
Eisenchelatbildner
Folgend werden die Interaktionen der oral systemisch wirksamen Arzneimittel mit
gravierender Bedeutung kurz zusammengefasst.
Die Klassifikation „gravierend“ ergibt sich aus der vermuteten Häufigkeit der Basismedikation mit dem verschreibungspflichtigen Medikament in Kombination mit
Nutzung des OTC-Produktes und der Schwere der zu erwartenden Interaktion.
Tabelle 6: Tabellarische Darstellung der gravierenden Interaktionen der oral systemischen
Arzneimittel
Wirkstoffname
Acetylsalicylsäure
Interaktion mit
gerinnungshemmende Substanzen
blutdrucksenkende Substanzen
H1-Antihistaminika
zentral dämpfende Substanzen
Ibuprofen
gerinnungshemmende Substanzen
51
blutdrucksenkende Substanzen
Antiepileptika
Paracetamol
Cumarine
enzyminduzierende Substanzen
52
5 Diskussion
Die in Apotheken meistverkauften rezeptfrei erhältlichen Medikamente haben ein
großes Interaktionspotential mit verschreibungspflichtigen Medikamenten.
Vor allem die oral-systemisch wirksamen Medikamente, die gerne bei Erkältungen
oder Schmerzen zwischendurch eingenommen werden, haben ein nicht geringes
Risiko, mit anderen Medikamenten zu interagieren und unterschiedliche schwere,
unerwartete Wirkungen auszulösen.
In den meisten Fällen wird eine Interaktion mit verschreibungspflichtigen Medikamenten für die Anwender und Anwenderinnen nicht bemerkt und verläuft ohne
Komplikationen wie zum Beispiel der leicht blutdrucksteigernde Effekt von NSAR.
Die Person, die die Medikamentenkombination einnimmt, bemerkt mit großer
Wahrscheinlichkeit keinen Unterschied im täglichen Wohlbefinden; selbst bei der
Blutdruckmessung wird kaum eine Veränderung festgestellt. Wenn aber konstant
OTC-Medikamente eingenommen werden und der Blutdruck konstant auch nur
gering erhöht ist, birgt das möglicherweise Risiken, die auf eine Population gesehen doch eine Rolle spielen.
Bei Berichten von Kindern mit unerwünschten Arzneimittelwirkungen und wechselwirkungen ist kritisch zu hinterfragen, inwiefern die Wahrscheinlichkeit
gegeben ist, dass ein Kind z. B. großflächig Diphenhydramin topisch aufträgt und
gleichzeitig ein vom Arzt verschriebenes, zentral dämpfendes Medikament anwendet, sodass Atemdepressionen und Sauerstoffmangel die Folge sein können.
Auch wenn hier darüber berichtet wird, sind die Konstellationen in einigen Fällen
sehr unwahrscheinlich; trotzdem sollten sie nicht aus den Augen verloren werden.
Nicht nur bei Kindern, sondern auch bei Erwachsenen gibt es oftmals Langzeitmedikamente oder Behandlungen mit Medikamenten, die sehr speziell und nur bei
einer kleinen Gruppe von Personen angewandt werden. Es ist dabei eigentlich die
Aufgabe des behandelnden Arztes, die betroffenen Menschen über die Medikation
aufzuklären, und zu erläutern, welche rezeptfreien Medikamente eingenommen
bzw. vermieden werden sollen, um das Risiko einer Arzneimittelinteraktion so gering wie möglich zu halten.
53
Was die Recherche bei dieser Arbeit erschwert hat, waren die nur limitiert vorhandenen Daten über topisch angewandte Arzneimittel. Es gibt oft kontroverse Ergebnisse in Bezug auf die Absorption von verschiedenen Wirkstoffen. Es ist zu
hoffen, dass bei kaum vorhandenen Berichten über Wechselwirkungen nicht einige Risiken übersehen oder nicht in Arbeiten über Interaktionen miteinbezogen
werden.
Oft sind Medikamenteninteraktionen erforscht, die ab einer bestimmten Dosis auftreten, wie beispielsweise bei Coffein im Kombinationspräparat. Wechselwirkungen treten meist erst bei höheren Dosen auf, als sie in OTC-Präparaten enthalten
sind. Sollte dennoch die Dosis einer bestimmten Substanz erreicht werden, bei der
Interaktionen nachgewiesen und zu erwarten sind, sind bei der betroffenen Person
in der Regel die maximalen Dosen von anderen Inhaltsstoffen bereits überschritten und es kommt auch zu Überdosierungen und Nebenwirkungen der anderen
Substanzen.
Es ist möglich, dass aufgrund von Generika eine Verdünnung der Verkaufszahlen
von Substanzen stattgefunden hat, und dadurch häufig verkaufte Substanzen
nicht aufscheinen.
Der Fokus wurde auf Interaktionen gelegt, Nebenwirkungen wurden nicht, die
Symptome von Überdosierungen bei einigen Medikamenten maximal kurz angeschnitten, obwohl diese Risiken wie auch Arzneimittelinteraktionen schwerwiegende Folgen mit sich bringen können.
Der Inhalt dieser Diplomarbeit sind nur Interaktionen von OTC-Präparaten mit verschreibungspflichtigen Präparaten. In der Literatur gibt es auch viele Hinweise,
dass OTC-Medikamente mit anderen frei erhältlichen Medikamenten, mit Nahrungs- oder Genussmitteln oder auch rezeptpflichtige Medikamente mit Nahrungsoder Genussmitteln interagieren, diese wurden aber nicht in der Arbeit behandelt.
54
6 Literaturverzeichnis
1.
Graefe KH, Lutz W, Bönisch H. Duale Reihe, Pharmakologie und
Toxikologie. 2nd ed. Stuttgart: Thieme Verlag; 2016.
2.
Aktories K, Förstermann U, Hofmann F, Starke K. Allgemeine und Spezielle
Pharmakologie und Toxikologie. 11th ed. München: Urban & Fischer, Elsevier
GmbH; 2013.
3.
Preston CL. Stockley's Drug Interactions. 11th ed. London: Pharmaceutical
Press; 2016.
4.
Austria-Codex-Fachinformation Stand November 2016 [Zugriff 2.5.Jan2017].
5.
Bong CL, Hilliard J, Seefelder C. Severe Methemoglobinemia From Topical
Benzocaine 7.5% (Baby Orajel) Use for Teething Pain in a Toddler. Clinical
Pediatrics. 2008;48(2):209-211.
6.
Rodriguez
LF,
Smolik
LM,
Zbehlik
AJ.
Benzocaine-induced
methemoglobinemia: report of a severe reaction and review of the literature. The
Annals of pharmacotherapy. 1994;28(5):643-649.
7.
Herstellerinformation für EMLA-Pflaster: AstraZeneca GmbH; Stand April
2013 [Zugriff 18Jan2017]. Available from: http://www.fachinfo.de/pdf/007600.
8.
Herstellerinformation für Bifonazol Hexal: HEXAL AG; Stand September
2007
[Zugriff
18Jan2017].
Available
from:
http://de.oddb.org/de/drugs/fachinfo/uid/103116.
9.
Herstellerinformation für Canesten Extra Creme 1%: Bayer Vital GmbH;
Stand
März
2014
[Zugriff
18Jan2017].
Available
from:
https://www.canesten.de/static/documents/canesten_extra_creme.pdf.
10.
Alexandra J, Pautas E, Gouin-Thibault I, Siguret V, Loriot M.
Overanticoagulation with coumarin and cutaneous azole therapy. Annals of
Internal Medicine. 2008;148(8):633-635.
11.
Brunton L, Chabner B, Knollman B. Goodman & Gilman's The
Pharmacological Basis of Therapeutics. 12 ed: New York: McGraw-Hill; 2011.
12.
Herstellerinformation für Clotrimazol 1000mg / 100g Creme: Sandoz
Pharmaceuticals GmbH; Stand Februar 2008 [Zugriff 18Jan2017]. Available from:
http://www.sz-produkte.de/pdf/fi/clotrimazol1000mg100gcreme.pdf.
13.
Herstellerinformation für Panthenol: Winthrop Arzneimittel GmbH & Zentiva
Pharma GmbH; Stand Oktober 2014 [Zugriff 18Jan2017]. Available from:
https://www.zentiva.de/produkte/Panthenol-Lichtenstein/Downloads?id=1f85b056bff6-4141-b09b-3add0ee8df8a.
14.
Smith RM, Jr., Gottshall SC, Young JA. Succinylcholine-pantothenyl
alcohol. A reappraisal. Anesthesia and analgesia. 1969;48(2):205-208.
15.
Kienzler JL, Gold M, Nollevaux F. Systemic bioavailability of topical
diclofenac sodium gel 1% versus oral diclofenac sodium in healthy volunteers.
Journal of clinical pharmacology. 2010;50(1):50-61.
16.
Herstellerinformation für Voltadol-Schmerzgel: GSK-Gebro Consumer
Healthcare GmbH; Stand Mai 2016 [Zugriff 19Jan2017]. Available from:
http://www.pharmazie.com/graphic/A/20/1-23820.pdf.
17.
Miyatake S, Ichiyama H, Kondo E, Yasuda K. Randomized clinical
comparisons of diclofenac concentration in the soft tissues and blood plasma
between topical and oral applications. British journal of clinical pharmacology.
2009;67(1):125-129.
55
18.
Rowcliffe M, Nezami B, Westphal ES, Rainka M, Janda M, Bates V, et al.
Topical diclofenac does not affect the antiplatelet properties of aspirin as
compared to the intermediate effects of oral diclofenac: A prospective,
randomized, complete crossover study. Journal of clinical pharmacology.
2016;56(4):422-428.
19.
Holt RJ, Taiwo T, Kent JD. Bioequivalence of diclofenac sodium 2% and
1.5% topical solutions relative to oral diclofenac sodium in healthy volunteers.
Postgraduate medicine. 2015;127(6):581-590.
20.
Baraf HS, Gold MS, Clark MB, Altman RD. Safety and efficacy of topical
diclofenac sodium 1% gel in knee osteoarthritis: a randomized controlled trial. The
Physician and sportsmedicine. 2010;38(2):19-28.
21.
Peniston JH, Gold MS, Wieman MS, Alwine LK. Long-term tolerability of
topical diclofenac sodium 1% gel for osteoarthritis in seniors and patients with
comorbidities. Clinical interventions in aging. 2012;7:517-523.
22.
Baraf HS, Gold MS, Petruschke RA, Wieman MS. Tolerability of topical
diclofenac sodium 1% gel for osteoarthritis in seniors and patients with
comorbidities. The American journal of geriatric pharmacotherapy. 2012;10(1):4760.
23.
Herstellerinformation für Diclofenac Genericon 1% Gel: Genericon Pharma
Gesellschaft m.b.H.; Stand Juni 2012 [Zugriff 19Jan2017]. Available from:
http://www.genericon.at/db/bilder/928593_F_GI_12-0611_DiclofenacGenericonGel_Pr.pdf.
24.
Herstellerinformation für Fenistil Gel: GlaxoSmithKline Consumer
Healthcare GmbH & Co. KG; Stand Juni 2016 [Zugriff 19Jan2017]. Available from:
http://fachinformation.srz.de/pdf/glaxosmithklinechc/fenistilgel.pdf.
25.
Smith TJ, Ritter JK, Poklis JL, Fletcher D, Coyne PJ, Dodson P, et al. ABH
gel is not absorbed from the skin of normal volunteers. Journal of pain and
symptom management. 2012;43(5):961-966.
26.
Turner JW. Death of a child from topical diphenhydramine. The American
journal of forensic medicine and pathology. 2009;30(4):380-381.
27.
Herstellerinformation
für
Apozema
Insecticum:
APOMEDICA
Pharmazeutische Produkte GmbH; Stand Mai 2014 [Zugriff 19Jan2017]. Available
from: http://apomedica.com/at/media/produkte/apozema/insecticumgel/gi.pdf.
28.
Herstellerinformation für Hiroduid forte Salbe: Stada Arzneimittel GmbH;
Stand
Dezember
2013
[Zugriff
20Jan2017].
Available
from:
https://www.apoonline.at/media/packungsbeilagen/3514432.pdf.
29.
Fachinformation des Arzneimittelkompendium der Schweiz von Hirudoid:
Medinova AG; Stand März 2015 [Zugriff 20Jan2017]. Available from:
http://compendium.ch/mpro/mnr/1950/html/de.
30.
Arena Ansotegui J, Emparanza Knorr JI. [Iodine antiseptics are not
harmless]. Anales espanoles de pediatria. 2000;53(1):25-29.
31.
Tomoda C, Kitano H, Uruno T, Takamura Y, Ito Y, Miya A, et al.
Transcutaneous iodine absorption in adult patients with thyroid cancer disinfected
with povidone-iodine at operation. Thyroid : official journal of the American Thyroid
Association. 2005;15(6):600-603.
32.
Pietsch J, Meakins JL. Complications of povidone-iodine absorption in
topically treated burn patients. Lancet (London, England). 1976;1(7954):280-282.
33.
Aiba M, Ninomiya J, Furuya K, Arai H, Ishikawa H, Asaumi S, et al.
Induction of a critical elevation of povidone-iodine absorption in the treatment of a
burn patient: report of a case. Surgery today. 1999;29(2):157-159.
56
34.
Lavelle KJ, Doedens DJ, Kleit SA, Forney RB. Iodine absorption in burn
patients treated topically with povidone-iodine. Clinical Pharmacology &
Therapeutics. 1975;17(3):355-362.
35.
Wollf-Chaikoff-Effekt
[Available
from:
http://flexikon.doccheck.com/de/Wolff-Chaikoff-Effekt.
36.
Johnston AM, Eagles JM. Lithium-associated clinical hypothyroidism.
Prevalence and risk factors. The British journal of psychiatry : the journal of mental
science. 1999;175:336-339.
37.
Leutgeb U. Ambient iodine and lithium-associated clinical hypothyroidism.
The British Journal of Psychiatry. 2000;176(5):495-496.
38.
Lipshutz AM, Hawes EM. Probable glucometer interference caused by
topical iodine solution test site preparation. Journal of clinical pharmacy and
therapeutics. 2016;41(5):583-585.
39.
Kurtoglu S, Bastug O, Daar G, Halis H, Korkmaz L, Memur S, et al. Effect of
iodine loading on the thyroid hormone level of newborns living in Kayseri province.
American journal of perinatology. 2014;31(12):1087-1092.
40.
Herstellerinformation für Betaisodona Salbe: Mundipharma GmbH; Stand
Februar
2015
[Zugriff
20Jan2017].
Available
from:
https://www.mundipharma.de/fileadmin/mundipharmarelaunch/documents/public/gebrauchsinformationen/GI_Beta_Salbe.pdf.
41.
Herstellerinformation zu Tantum Verde 3mg - Pastillen mit Minzgeschmack:
Angelini Pharma Österreich GmbH; Stand Mai 2015 [Zugriff 23Jan2017]. Available
from: http://www.tantumverde.at/de-AT/downloads.html.
42.
Chasseaud LF, Catanese B. Pharmacokinetics of benzydamine.
International journal of tissue reactions. 1985;7(3):195-204.
43.
Duckert F, Widmer LK, Madar G. [Simultaneous oral anticoagulant and
benzydamine
therapy].
Schweizerische
medizinische
Wochenschrift.
1974;104(30):1069-1071.
44.
Herstellerinformation für Nasivin: Merck Selbstmedikation GmbH; Stand
März
2009
[Zugriff
23Jan2017].
Available
from:
https://www.nasivin.de/static/u/pdf/nasivin_spray.pdf.
45.
Fachinformation des Arzneimittelkompendium der Schweiz von Nasivin
Nasentropfen: Iromedica AG; Stand August 2014 [Zugriff 23Jan2017]. Available
from: https://compendium.ch/mpro/mnr/2340/html/de.
46.
Sympathomimetikum
[23Jan2017].
Available
from:
http://flexikon.doccheck.com/de/Sympathomimetikum.
47.
Heyman SN, Mevorach D, Ghanem J. Hypertensive crisis from chronic
intoxication with nasal decongestant and cough medications. DICP : the annals of
pharmacotherapy. 1991;25(10):1068-1070.
48.
Latham GJ, Jardine DS. Oxymetazoline and hypertensive crisis in a child:
can we prevent it? Paediatric anaesthesia. 2013;23(10):952-956.
49.
Herstellerinformation für Bioflorin: SANOVA PHARMA GesmbH; Stand
Dezember
2014
[Zugriff
23Jan2017].
Available
from:
http://www.sanova.at/tl_files/_Pharma/DE/Sanova-Bioflorin-FI.pdf.
50.
Fachinformation des Arzneimittelkompendium der Schweiz von Bioflorin:
sanofi-aventis (schweiz) ag; Stand Oktober 2014 [Zugriff 23Jan2017]. Available
from: https://compendium.ch/mpro/mnr/1603/html/de.
51.
Herstellerinformation für Aspirin C Brausetabletten: Bayer Austria
Ges.m.b.H.; Stand September 2013 [Zugriff 24Jan2017]. Available from:
https://www.bayer.at/static/documents/produkte/gi/aspirin/AspirinC.pdf.
57
52.
Herstellerinformation für Aspirin: Bayer Vital GmbH; Stand November 2016
[Zugriff 24Jan2017]. Available from: http://www.fachinfo.de/pdf/000174.
53.
Goulden KJ, Dooley JM, Camfield PR, Fraser AD. Clinical valproate toxicity
induced by acetylsalicylic acid. Neurology. 1987;37(8):1392-1394.
54.
Guazzi MD, Campodonico J, Celeste F, Guazzi M, Santambrogio G, Rossi
M, et al. Antihypertensive efficacy of angiotensin converting enzyme inhibition and
aspirin counteraction. Clinical pharmacology and therapeutics. 1998;63(1):79-86.
55.
Avanzini F, Palumbo G, Alli C, Roncaglioni MC, Ronchi E, Cristofari M, et
al. Effects of low-dose aspirin on clinic and ambulatory blood pressure in treated
hypertensive patients. Collaborative Group of the Primary Prevention Project
(PPP)--Hypertension study. American journal of hypertension. 2000;13(6 Pt
1):611-616.
56.
Nawarskas JJ, Townsend RR, Cirigliano MD, Spinler SA. Effect of aspirin
on blood pressure in hypertensive patients taking enalapril or losartan. American
journal of hypertension. 1999;12(8 Pt 1):784-789.
57.
Chalmers JP, West MJ, Wing LMH, Bune AJC, Graham JR. Effects of
Indomethacin, Sulindac, Naproxen, Aspirin, and Paracetamol in Treated
Hypertensive Patients. Clinical and Experimental Hypertension Part A: Theory and
Practice. 1984;6(6):1077-1093.
58.
Mills EH, Whitworth JA, Andrews J, Kincaid-Smith P. Non-steroidal antiinflammatory drugs and blood pressure. Australian and New Zealand journal of
medicine. 1982;12(5):478-482.
59.
Sweeney KR, Chapron DJ, Brandt JL, Gomolin IH, Feig PU, Kramer PA.
Toxic interaction between acetazolamide and salicylate: case reports and a
pharmacokinetic explanation. Clinical pharmacology and therapeutics.
1986;40(5):518-524.
60.
Ramsay LE, Harrison IR, Shelton JR, Vose CW. Influence of acetylsalicylic
acid on the renal handling of a spironolactone metabolite in healthy subjects.
European journal of clinical pharmacology. 1976;10(1):43-48.
61.
Hollifield JW. Failure of aspirin to antagonize the antihypertensive effect of
spironolactone in low-renin hypertension. Southern medical journal.
1976;69(8):1034-1036.
62.
Berg KJ. Acute effects of acetylsalicylic acid on renal function in normal
man. European journal of clinical pharmacology. 1977;11(2):117-123.
63.
Hallas J, Dall M, Andries A, Andersen BS, Aalykke C, Hansen JM, et al.
Use of single and combined antithrombotic therapy and risk of serious upper
gastrointestinal bleeding: population based case-control study. BMJ (Clinical
research ed). 2006;333(7571):726.
64.
Vitry AI, Roughead EE, Ramsay EN, Preiss AK, Ryan P, Gilbert AL, et al.
Major bleeding risk associated with warfarin and co-medications in the elderly
population. Pharmacoepidemiology and drug safety. 2011;20(10):1057-1063.
65.
O'Reilly RA, Sahud MA, Aggeler PM. IMPACT OF ASPIRIN AND
CHLORTHALIDONE
ON
THE
PHARMACODYNAMICS
OF
ORAL
ANTICOAGULANT DRUGS IN MAN*. Annals of the New York Academy of
Sciences. 1971;179(1):173-186.
66.
Herstellerinformation für Eliquis: Bristol-Myers Squibb Company & Pfizer
Inc;
Stand
Juli
2016
[Zugriff
25Jan2017].
Available
from:
http://packageinserts.bms.com/pi/pi_eliquis.pdf.
67.
Summary of product characteristics für Lixiana [25Jan2017]. Available
from:
http://www.ema.europa.eu/docs/en_GB/document_library/EPAR__Product_Information/human/002629/WC500189045.pdf.
58
68.
Davidson BL, Verheijen S, Lensing AW, Gebel M, Brighton TA, Lyons RM,
et al. Bleeding risk of patients with acute venous thromboembolism taking
nonsteroidal anti-inflammatory drugs or aspirin. JAMA internal medicine.
2014;174(6):947-953.
69.
Herstellerinformation für Pradaxa 110mg Hartkapseln: Boehringer
Ingelheim International GmbH; Stand Januar 2016 [Zugriff 25Jan2017]. Available
from: http://www.fachinfo.de/pdf/010964.
70.
Juarez-Olguin H, Jung-Cook H, Flores-Perez J, Lares-Asseff I. Adverse
effects of imipramine are increased by interaction with ASA in depressed patients.
Neuropsychopharmacology : official publication of the American College of
Neuropsychopharmacology. 2000;22(1):100-101.
71.
Juarez-Olguin H, Jung-Cook H, Flores-Perez J, Asseff IL. Clinical evidence
of an interaction between imipramine and acetylsalicylic acid on protein binding in
depressed patients. Clinical neuropharmacology. 2002;25(1):32-36.
72.
Reid J, Macdougall AI, Andrews MM. Aspirin and diabetes mellitus. British
medical journal. 1957;2(5053):1071-1074.
73.
Richardson T, Foster J, Mawer GE. Enhancement by sodium salicylate of
the blood glucose lowering effect of chlorpropamide-drug interaction or summation
of similar effects? British journal of clinical pharmacology. 1986;22(1):43-48.
74.
Harris M, Bryant LR, Danaher P, Alloway J. Effect of low dose daily aspirin
on serum urate levels and urinary excretion in patients receiving probenecid for
gouty arthritis. J Rheumatol. 2000;27(12):2873-2876.
75.
Kersley GD, Cook ER, Tovey DCJ. Value of Uricosuric Agents and in
Particular of G.28 315 in Gout. Annals of the Rheumatic Diseases.
1958;17(3):326-333.
76.
Sorensen LB, Levinson DJ. Clinical evaluation of benzbromarone: a new
uricosuric drug. Arthritis and rheumatism. 1976;19(2):183-190.
77.
Gupta KC, Joshi JV, Hazari K, Pohujani SM, Satoskar RS. Effect of low
estrogen combination oral contraceptive on metabolism of aspirin and
phenylbutazone. International journal of clinical pharmacology, therapy, and
toxicology. 1982;20(11):511-513.
78.
Klinenberg JR, Miller F. Effect of corticosteroids on blood salicylate
concentration. Jama. 1965;194(6):601-604.
79.
Graham GG, Champion GD, Day RO, Paull PD. Patterns of plasma
concentrations and urinary excretion of salicylate in rheumatoid arthritis. Clinical
pharmacology and therapeutics. 1977;22(4):410-420.
80.
Fenster PE, Comess KA, Hanson CD, Finley PR. Kinetics of the digoxinaspirin combination. Clinical pharmacology and therapeutics. 1982;32(4):428-430.
81.
Doering W, Isbary J. [Effect of tiaprofenic acid on serum digoxin
concentration]. Arzneimittel-Forschung. 1983;33(1):167-168.
82.
Stewart CF, Fleming RA, Germain BF, Seleznick MJ, Evans WE. Aspirin
alters methotrexate disposition in rheumatoid arthritis patients. Arthritis and
rheumatism. 1991;34(12):1514-1520.
83.
Zuik M, Mandel MA. Methotrexate--salicylate interaction: a clinical and
experimental study. Surgical forum. 1975;26:567-569.
84.
Ross-Lee LM, Eadie MJ, Heazlewood V, Bochner F, Tyrer JH. Aspirin
pharmacokinetics in migraine. The effect of metoclopramide. European journal of
clinical pharmacology. 1983;24(6):777-785.
85.
Manniche PM, Dinneen LC, Langemark M. The pharmacokinetics of the
individual constituents of an aspirin-metoclopramide combination ('Migravess').
Current medical research and opinion. 1984;9(3):153-156.
59
86.
Kampmann J, Hansen JM, Siersboek-Nielsen K, Laursen H. Effect of some
drugs on penicillin half-life in blood. Clinical pharmacology and therapeutics.
1972;13(4):516-519.
87.
Wang DJ, Chu KM, Chen JD, Tarn YH, Su DJ. [Drug interaction between
digoxin and bisacodyl]. Journal of the Formosan Medical Association = Taiwan yi
zhi. 1990;89(10):915-919, 913.
88.
Botzler R, Ritter U. [Effect of laxative measures on the serum concentration
of digoxin in the human]. Leber, Magen, Darm. 1982;12(6):255-257.
89.
Herstellerinformation für Thomapyrin classic Schmerztabletten: Boehringer
Ingelheim Pharma GmbH & Co. KG; Stand Dezember 2014 [Zugriff 26Jan2017].
Available
from:
https://www.thomapyrin.de/assets/thomapyrin/pdfs/thomapyrin_classic.20150310.
pdf.
90.
Wietholtz H, Zysset T, Kreiten K, Kohl D, Buchsel R, Matern S. Effect of
phenytoin, carbamazepine, and valproic acid on caffeine metabolism. European
journal of clinical pharmacology. 1989;36(4):401-406.
91.
Vaz J, Kulkarni C, David J, Joseph T. Influence of caffeine on
pharmacokinetic profile of sodium valproate and carbamazepine in normal human
volunteers. Indian journal of experimental biology. 1998;36(1):112-114.
92.
Raaska K, Raitasuo V, Laitila J, Neuvonen PJ. Effect of caffeine-containing
versus decaffeinated coffee on serum clozapine concentrations in hospitalised
patients. Basic & clinical pharmacology & toxicology. 2004;94(1):13-18.
93.
Carrillo JA, Herraiz AG, Ramos SI, Benitez J. Effects of caffeine withdrawal
from the diet on the metabolism of clozapine in schizophrenic patients. Journal of
clinical psychopharmacology. 1998;18(4):311-316.
94.
Shirley DG, Walter SJ, Noormohamed FH. Natriuretic effect of caffeine:
assessment of segmental sodium reabsorption in humans. Clinical science
(London, England : 1979). 2002;103(5):461-466.
95.
Fukasawa T, Yasui-Furukori N, Suzuki A, Ishii G, Inoue Y, Tateishi T, et al.
Effects of caffeine on the kinetics of fluvoxamine and its major metabolite in
plasma after a single oral dose of the drug. Therapeutic drug monitoring.
2006;28(3):308-311.
96.
Haller CA, Jacob P, 3rd, Benowitz NL. Enhanced stimulant and metabolic
effects of combined ephedrine and caffeine. Clinical pharmacology and
therapeutics. 2004;75(4):259-273.
97.
Jonkman JH, Sollie FA, Sauter R, Steinijans VW. The influence of caffeine
on the steady-state pharmacokinetics of theophylline. Clinical pharmacology and
therapeutics. 1991;49(3):248-255.
98.
Forrest WH, Jr., Bellville JW, Brown BW, Jr. The interaction of caffeine with
pentobarbital as a nighttime hypnotic. Anesthesiology. 1972;36(1):37-41.
99.
Mattila MJ, Vainio P, Nurminen ML, Vanakoski J, Seppala T. Midazolam 12
mg is moderately counteracted by 250 mg caffeine in man. International journal of
clinical pharmacology and therapeutics. 2000;38(12):581-587.
100. Polasek TM, Lin FPY, Miners JO, Doogue MP. Perpetrators of
pharmacokinetic drug–drug interactions arising from altered cytochrome P450
activity: a criteria-based assessment. British journal of clinical pharmacology.
2011;71(5):727-736.
101. Rath EZ. Drug-Induced Glaucoma (Glaucoma Secondary to Systemic
Medications): INTECH Open Access Publisher; 2011.
102. Moser L, Hüther KJ, Koch-Weser J, Lundt PV. Effects of terfenadine and
diphenhydramine alone or in combination with diazepam or alcohol on
60
psychomotor performance and subjective feelings. European journal of clinical
pharmacology. 1978;14(6):417-423.
103. Mattila MJ, Konno K. Acute and subacute actions on human performance
and interactions with diazepam of temelastine (SK & F 93944) and
diphenhydramine. European journal of clinical pharmacology. 1986;31(3):291-298.
104. Reier CE, Johnstone RE. Respiratory depression: narcotic versus narcotictranquilizer combinations. Anesthesia and analgesia. 1970;49(1):119-124.
105. Herstellerinformation für Fenistil Dragees: Novartis Consumer Health
GmbH; Stand September 2014 [Zugriff 30Jan2017]. Available from:
https://www.fenistil.de/static/downloads/GI_Fenistil_Dragees_902076_A54_4.pdf.
106. Blumenthal M. Interaction between herbs and conventional drugs.
Introductory considerations Herbalgram. 2000;49:52-63.
107. Palmer R, Weiss R, Zusman RM, Haig A, Flavin S, MacDonald B. Effects of
nabumetone, celecoxib, and ibuprofen on blood pressure control in hypertensive
patients on angiotensin converting enzyme inhibitors. American journal of
hypertension. 2003;16(2):135-139.
108. Aljadhey H, Tu W, Hansen RA, Blalock SJ, Brater DC, Murray MD.
Comparative effects of non-steroidal anti-inflammatory drugs (NSAIDs) on blood
pressure in patients with hypertension. BMC cardiovascular disorders. 2012;12:93.
109. Minuz P, Pancera P, Ribul M, Priante F, Degan M, Campedelli A, et al.
Amlodipine and haemodynamic effects of cyclo-oxygenase inhibition. British
journal of clinical pharmacology. 1995;39(1):45-50.
110. Houston MC, Weir M, Gray J, Ginsberg D, Szeto C, Kaihlenen PM, et al.
The effects of nonsteroidal anti-inflammatory drugs on blood pressures of patients
with hypertension controlled by verapamil. Archives of internal medicine.
1995;155(10):1049-1054.
111. Passmore AP, Copeland S, Johnston GD. A comparison of the effects of
ibuprofen and indomethacin upon renal haemodynamics and electrolyte excretion
in the presence and absence of frusemide. British journal of clinical pharmacology.
1989;27(4):483-490.
112. Davies JG, Rawlins DC, Busson M. Effect of ibuprofen on blood pressure
control by propranolol and bendrofluazide. The Journal of international medical
research. 1988;16(3):173-181.
113. Gurwitz JH, Everitt DE, Monane M, Glynn RJ, Choodnovskiy I, Beaudet MP,
et al. The impact of ibuprofen on the efficacy of antihypertensive treatment with
hydrochlorothiazide in elderly persons. The journals of gerontology Series A,
Biological sciences and medical sciences. 1996;51(2):M74-79.
114. Goncalves L. Influence of Ibuprofen on Haemostasis in Patients on
Anticoagulant Therapy. Journal of International Medical Research. 1973;1(3):180183.
115. Thilo D, Nyman D, Duckert F. A Study of the Effects of the Anti-Rheumatic
Drug Ibuprofen (Brufen®) on Patients Being Treated with the Oral Anti-Coagulant
Phenprocoumon (Marcoumar®). Journal of International Medical Research.
1974;2(4):276-278.
116. Schulman S, Henriksson K. Interaction of ibuprofen and warfarin on primary
haemostasis. British journal of rheumatology. 1989;28(1):46-49.
117. Tornio A, Niemi M, Neuvonen PJ, Backman JT. Stereoselective interaction
between the CYP2C8 inhibitor gemfibrozil and racemic ibuprofen. European
journal of clinical pharmacology. 2007;63(5):463-469.
61
118. Scheuerer S, Hall SD, Williams KM, Geisslinger G. Effect of clofibrate on
the chiral inversion of ibuprofen in healthy volunteers. Clinical pharmacology and
therapeutics. 1998;64(2):168-176.
119. al-Meshal MA, el-Sayed YM, al-Balla SR, Gouda MW. The effect of
colestipol and cholestyramine on ibuprofen bioavailability in man.
Biopharmaceutics & drug disposition. 1994;15(6):463-471.
120. Sone H, Takahashi A, Yamada N. IBuprofen-related hypoglycemia in a
patient receiving sulfonylurea. Annals of Internal Medicine. 2001;134(4):344-344.
121. Hynninen VV, Olkkola KT, Leino K, Lundgren S, Neuvonen PJ, Rane A, et
al. Effects of the antifungals voriconazole and fluconazole on the pharmacokinetics
of s-(+)- and R-(-)-Ibuprofen. Antimicrobial agents and chemotherapy.
2006;50(6):1967-1972.
122. Dahlin PA, George J. Baclofen toxicity associated with declining renal
clearance after ibuprofen. Drug intelligence & clinical pharmacy. 1984;18(10):805808.
123. Piper JM, Ray WA, Daugherty JR, Griffin MR. Corticosteroid use and peptic
ulcer disease: role of nonsteroidal anti-inflammatory drugs. Ann Intern Med.
1991;114(9):735-740.
124. Langman MJ, Weil J, Wainwright P, Lawson DH, Rawlins MD, Logan RF, et
al. Risks of bleeding peptic ulcer associated with individual non-steroidal antiinflammatory drugs. Lancet (London, England). 1994;343(8905):1075-1078.
125. Garcia Rodriguez LA, Egan K, FitzGerald GA. Traditional nonsteroidal antiinflammatory drugs and postmenopausal hormone therapy: a drug-drug
interaction? PLoS medicine. 2007;4(5):e157.
126. Kristoff CA, Hayes PE, Barr WH, Small RE, Townsend RJ, Ettigi PG. Effect
of ibuprofen on lithium plasma and red blood cell concentrations. Clinical
pharmacy. 1986;5(1):51-55.
127. Khan IH. Lithium and non-steroidal anti-inflammatory drugs. BMJ (Clinical
research ed). 1991;302(6791):1537-1538.
128. Ragheb M, Ban TA, Buchanan D, Frolich JC. Interaction of indomethacin
and ibuprofen with lithium in manic patients under a steady-state lithium level. The
Journal of clinical psychiatry. 1980;41(11):397-398.
129. Tracy TS, Krohn K, Jones DR, Bradley JD, Hall SD, Brater DC. The effects
of a salicylate, ibuprofen, and naproxen on the disposition of methotrexate in
patients with rheumatoid arthritis. European journal of clinical pharmacology.
1992;42(2):121-125.
130. Perucca E, Richens A. Paracetamol disposition in normal subjects and in
patients treated with antiepileptic drugs. British journal of clinical pharmacology.
1979;7(2):201-206.
131. Jickling G, Heino A, Ahmed SN. Acetaminophen toxicity with concomitant
use of carbamazepine. Epileptic disorders : international epilepsy journal with
videotape. 2009;11(4):329-332.
132. Wilson JT, Kasantikul V, Harbison R, Martin D. Death in an adolescent
following an overdose of acetaminophen and phenobarbital. American journal of
diseases of children (1960). 1978;132(5):466-473.
133. Gebauer MG, Nyfort-Hansen K, Henschke PJ, Gallus AS. Warfarin and
acetaminophen interaction. Pharmacotherapy. 2003;23(1):109-112.
134. Andrews FJ. Retroperitoneal haematoma after paracetamol increased
anticoagulation. Emergency medicine journal : EMJ. 2002;19(1):84-85.
62
135. Hughes GJ, Patel PN, Saxena N. Effect of acetaminophen on international
normalized ratio in patients receiving warfarin therapy. Pharmacotherapy.
2011;31(6):591-597.
136. Mitchell MC, Hanew T, Meredith CG, Schenker S. Effects of oral
contraceptive steroids on acetaminophen metabolism and elimination. Clinical
pharmacology and therapeutics. 1983;34(1):48-53.
137. Dordoni B, Willson RA, Thompson RP, Williams R. Reduction of absorption
of paracetamol by activated charcoal and cholestyramine: a possible therapeutic
measure. British medical journal. 1973;3(5871):86-87.
138. Kamali F. The effect of probenecid on paracetamol metabolism and
pharmacokinetics. European journal of clinical pharmacology. 1993;45(6):551-553.
139. Kim DW, Tan EY, Jin Y, Park S, Hayes M, Demirhan E, et al. Effects of
imatinib mesylate on the pharmacokinetics of paracetamol (acetaminophen) in
Korean patients with chronic myelogenous leukaemia. British journal of clinical
pharmacology. 2011;71(2):199-206.
140. Nassar I, Pasupati T, Judson JP, Segarra I. Histopathological study of the
hepatic and renal toxicity associated with the co-administration of imatinib and
acetaminophen in a preclinical mouse model. The Malaysian journal of pathology.
2010;32(1):1-11.
141. Carrasco MC, Vallejo JR, Pardo-de-Santayana M, Peral D, Martin MA,
Altimiras J. Interactions of Valeriana officinalis L. and Passiflora incarnata L. in a
patient treated with lorazepam. Phytotherapy research : PTR. 2009;23(12):17951796.
142. Fachinformation des Arzneitmittelkompendium der Schweiz von Aspirin
Complex: Bayer (Schweiz) AG; Stand Dezember 2015 [Zugriff 02Feb2017].
Available from: http://compendium.ch/mpro/mnr/20586/html/de.
143. Pederson KJ, Kuntz DH, Garbe GJ. Acute myocardial ischemia associated
with ingestion of bupropion and pseudoephedrine in a 21-year-old man. The
Canadian journal of cardiology. 2001;17(5):599-601.
144. Mueller SC, Uehleke B, Woehling H, Petzsch M, Majcher-Peszynska J,
Hehl EM, et al. Effect of St John's wort dose and preparations on the
pharmacokinetics of digoxin. Clinical pharmacology and therapeutics.
2004;75(6):546-557.
145. Alscher DM, Klotz U. Drug interaction of herbal tea containing St. John's
wort with cyclosporine. Transplant international : official journal of the European
Society for Organ Transplantation. 2003;16(7):543-544.
146. Andelic S. [Bigeminy--the result of interaction between digoxin and St.
John's wort]. Vojnosanitetski pregled. 2003;60(3):361-364.
147. Boganen H, van Hee K, Grundmeijer HG. [Hypertension due to liquorice
and liquorice tea consumption]. Nederlands tijdschrift voor geneeskunde.
2007;151(51):2825-2828.
148. Brouwers AJ, van der Meulen J. ['Licorice hypertension' also caused by
licorice tea]. Nederlands tijdschrift voor geneeskunde. 2001;145(15):744-747.
149. Posadzki P, Watson L, Ernst E. Herb–drug interactions: an overview of
systematic reviews. British journal of clinical pharmacology. 2013;75(3):603-618.
150. Basch E, Ulbricht C, Hammerness P, Bevins A, Sollars D. Thyme (Thymus
vulgaris L.), thymol. Journal of herbal pharmacotherapy. 2004;4(1):49-67.
151. Nienhuis AW, Griffith P, Strawczynski H, Henry W, Borer J, Leon M, et al.
Evaluation of cardiac function in patients with thalassemia major. Annals of the
New York Academy of Sciences. 1980;344(1):384-396.
63