6.3 Opioidrezeptor-Antagonisten
Werbung

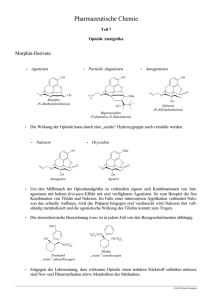
B 231 6.3 Opioidrezeptor-Antagonisten 6.2.7 Kontraindikationen 6.2.7 Kontraindikationen Opioidabhängigkeit, Zustand nach einer erfolgreichen Entzugstherapie, chronischobstruktive Lungenerkrankungen, Status asthmaticus, Ileus, Ateminsuffizienz, Behandlung mit MAO-Hemmstoffen (in diesem Fall können Opioide, insbesonders Pethidin, delirante Zustände mit zentraler Erregung, Hyperthermie und epileptiformen Krämpfen hervorrufen). Opioidabhängigkeit bzw. Z. n. nach erfolgreichem Entzug, COPD, Status asthmaticus, Ileus, Ateminsuffizienz, Behandlung mit MAOHemmstoffen. 6.2.8 Wechselwirkungen 6.2.8 Wechselwirkungen Die sedativ-hypnotischen und atemdepressiven Wirkungen der Opioide werden durch andere Sedativa (Alkohol, Benzodiazepine, sedierende Neureoleptika) erheblich verstärkt. Trizyklische Antidepressiva verstärken die analgetischen Wirkungen der Opioide. Opioid-Analgetika potenzieren die muskelrelaxierende Wirkung von curareartigen Muskelrelaxanzien. CYP2D 6-Hemmstoffe (s. S. 37) reduzieren die analgetische Wirkung von Codein und Dihydrocodein. Induktoren von CYP3A4 (s. S. 38) können in der Methadon-Substitutionstherapie einen Opioidentzug hervorrufen. Sedierung und Atemdepression↑ durch andere Sedativa. Wirkung von curareartigen Muskelrelaxanzien↑. Analgesie von Codein↓ durch CYP2D6-Hemmstoffe. Induktoren von CYP3A4 können in der Methadon-Substitutionstherapie einen Opioidentzug hervorrufen. 6.3 Opioidrezeptor-Antagonisten Naloxon und Naltrexon sind kompetitive Antagonisten der Opioidrezeptoren ohne agonistische Wirkung. Sie haben die höchste Affinität zu μ-, eine mittlere Affinität zu κ- und die niedrigste Affinität zu δ-Rezeptoren. Beide Substanzen leiten sich vom Morphinderivat Oxymorphon ab und unterscheiden sich von diesem lediglich durch Ersatz der Methylgruppe am N-Atom des Piperidinrings (vgl. Abb. B 6.6 auf S. 221) durch größere Substituenten. Naloxon wird nur i. v. angewendet und ist nur kurz wirksam (Tab. B 6.6). Dagegen kann Naltrexon auch oral verabreicht werden und ist darüber hinaus deutlich länger wirksam als Naloxon. Die lange Wirkdauer geht auf den wirksamen Metaboliten 6β-Naltrexol zurück, der einen wesentlichen Beitrag zur Naltrexon-Wirkung liefert und relativ langsam eliminiert wird. Die Wirkungen der beiden Substanzen sind abhängig von der Ausgangssituation der zu behandelnden Personen: Opioidnaive Patienten: Bei diesen Personen haben Naloxon und Naltrexon auch in höchsten Dosierungen kaum Wirkungen. Offensichtlich ist der Grad der tonischen Aktivierung von Opioidrezeptoren unter normalen Bedingungen sehr gering. Dennoch zeigen sich gewisse endokrinologische Effekte (Erhöhung der Plasmaspiegel von LH, FSH und ACTH) sowie eine Hemmung der analgetischen Wirkung von Stress, Akupunktur oder Plazebo. Mit Opioiden behandelte nichtabhängige Patienten: Bei ihnen werden alle wesentlichen Opioidwirkungen antagonisiert. Zur Unterdrückung der atemdepressiven Wirkung von Buprenorphin sind sehr hohe Naloxondosierungen (> 2 mg) 6.3 Opioidrezeptor-Antagonisten Naloxon und Naltrexon sind Antagonisten der Opioidrezeptoren. Sie leiten sich vom Morphinderivat Oxymorphon ab. Das kurzwirksame Naloxon kann nur i. v. (Tab. B 6.6), das länger wirksame Naltrexon auch oral verabreicht werden. Je nach Ausgangssituation variieren die Wirkungen: Opioidnaive Patienten: Naloxon und Naltrexon haben auch in höchsten Dosierungen kaum Wirkungen. Mit Opioiden behandelte nichtabhängige Patienten: Die wesentlichen Opioidwirkungen werden antagonisiert. Zur Unterdrückung der Atemdepression durch Buprenorphin sind sehr hohe Naloxondosierungen notwendig. Opioidabhängige: Naloxon oder Naltrexon lösen ein Entzugssyndrom aus. Bei nicht Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. Physische Abhängigkeit: Sie beinhaltet den körperlichen Zwang zum fortgesetzten Opioidmissbrauch und findet ihren Ausdruck im Auftreten von Entzugssymptomen, wenn die Opioidzufuhr unterbrochen wird. Die Entzugssymptome sind das genaue Gegenteil der Opioidwirkungen (z. B. Schmerzen statt Analgesie, zentrale Erregung statt zentrale Dämpfung, kardiovaskuläre Aktivierung statt kardiovaskuläre Dämpfung, Durchfall statt Obstipation). Bei der klinischen Symptomatik steht eine massive Sympathikusaktivierung im Vordergrund. Der Entzug ist umso intensiver, je stärker das Ausmaß der Toleranz und je rascher die Opioide vom μ-Rezeptor und aus dem Blut verschwinden. μ-Rezeptor-Antagonisten (Naloxon, Naltrexon) oder partielle Agonisten (Buprenorphin) können bei Süchtigen schwerste Entzugssymptome hervorrufen. Psychische Abhängigkeit: Sie geht zurück auf die Aktivierung der mesolimbischen dopaminergen Belohnungsbahn (s. S. 262) und beinhaltet einen positiven Verstärkereffekt für süchtiges Verhalten. Sie zeigt sich als zwanghaftes, unwiderstehliches Verlangen, Opioide auch nach jahrelanger Abstinenz immer wieder zu konsumieren (Opioid-Hunger oder „craving“). 232 B erforderlich, da Buprenorphin mit ausgesprochen hoher Affinität an μ-Rezeptoren bindet. Opioidabhängige: Bei ihnen wird durch die Gabe von Naloxon oder Naltrexon ein Entzugssyndrom ausgelöst. Auch bei nicht abhängigen Patienten mit einer Opioidintoxikation muss im Rahmen der Anwendung von Naloxon mit einer überschießenden Aktivierung der Atmung und des Sympathikus (verbunden mit Tachykardie und Hypertonie) gerechnet werden. Bei dieser Symptomatik handelt es sich ebenfalls um Entzugsphänomene. abhängigen Patienten mit einer Opioidintoxikation werden ähnliche Symptome beobachtet. Pharmakokinetische Daten und Dosierungen von Opioidrezeptor-Antagonisten Wirkstoff wirksamer Metabolit Naloxon Naltrexon 6β-Naltrexol Applikation Einzeldosis [mg] BV [%] HWZ [h] PEB [%] EFren [%] i. v. 0,4 2 1 35 0 p. o. 50 20 4 (13) 21 0 Indikationen: Opioidintoxikation: Naloxon wird i. v. verabreicht und der Patient künstlich beatmet. Bei intoxikierten Süchtigen muss vorsichtig die Dosis angesteuert werden, die die Atemdepression reduziert, aber noch keinen Entzug hervorruft. Aufhebung einer postoperativen Atemdepression ▶ Merke. Kombination mit Opioidrezeptor-Agonisten: Naloxon p. o. gibt es nur in Kombination mit dem Opioid Tilidin. Bei oraler Gabe beeinträchtigt Naloxon nicht die analgetische Wirkung von Tilidin (Tab. B 6.4). Bei missbräuchlicher i. v.-Anwendung führt Naloxon allerdings zum abrupten Entzug. Entzugstherapie („kalter Entzug“): Beim „ultraschnellen“ Entzug werden hohe Dosierungen von Naloxon während einer Allgemeinnarkose verabreicht und anschließend mit Naltrexon p. o. nachbehandelt. Rückfallprophylaxe nach Opioidentgiftung bei Suchtkranken: Naltrexon p. o. antagonisiert die Wirkungen von Heroin. Auch bei Alkoholabhängigen reduziert Naltrexon die Rückfallhäufigkeit nach Entzugstherapie. Die häufigsten unerwünschten Wirkungen sind Entzugssymptome. Für die Anwendung von Opioidrezeptor-Antagonisten gibt es folgende Indikationen: Opioidintoxikation: Klinisch zeigt sich die Symptomtrias Miosis, Atemdepression und Koma. Zur Behandlung wird Naloxon i. v. verabreicht und künstlich beatmet. Die Anfangsdosis von 0,4 mg wird anschließend in Abständen von 2 – 4 min so oft injiziert (5- bis 10-mal), bis die spontane Atmung wiederkehrt. Bei Süchtigen mit Symptomen einer Intoxikation muss die erste Dosis (0,2 – 0,4 mg) unter strikter Kontrolle der Atmung sehr langsam verabreicht werden, um die Dosis auszuloten, die die Atemdepression reduziert, aber noch keinen Entzug hervorruft. Aufhebung einer postoperativen Atemdepression: Injektionen von 0,2 mg Naloxon alle 2 – 4 min bis sich eine ausreichende Spontanatmung einstellt. ▶ Merke. Wegen der kurzen Halbwertszeit von Naloxon muss mit dem Wiederauftreten der opioidbedingten Atemdepression gerechnet und die Naloxoninjektion rechtzeitig wiederholt werden. Durch Rebound-Phänomene kann die wiederauftretende Atemdepression sogar noch verstärkt sein. Kombination mit Opioidrezeptor-Agonisten: Naloxon wird in der oralen Schmerztherapie in einer festen Kombination mit dem Opioid Tilidin (im Verhältnis 1,0:12,5 mg) verwendet. Da Naloxon sehr effizient präsystemisch eliminiert wird (hoher First-Pass-Metabolismus in der Leber), schmälert es bei oraler Verabreichung die analgetische Wirkung von Tilidin und Nortilidin (Tab. B 6.4) nicht. Wenn allerdings Opioidabhängige diese Kombination missbräuchlich i. v. anwenden, führt der antagonistische Effekt von Naloxon zum abrupten Entzug. Sie ist also nicht als Heroinersatz geeignet. Aus diesem Grund wird die Anwendung der Wirkstoffkombination auch nicht von der BtMVV reglementiert. Entzugstherapie („kalter Entzug“): Eine Strategie der Opioidentgiftung ist der „ultraschnelle“ Entzug. Dabei werden hohe Dosierungen von Naloxon (5 – 10 mg gefolgt von 0,4 – 0,8 mg/h als Infusion) während einer Allgemeinnarkose verabreicht und mit 50 mg/d Naltrexon p. o. nachbehandelt. Um die massive Aktivierung des sympathischen Nervensystems zu begrenzen, wird vor und nach dem Entzug Clonidin verabreicht (100 – 200 μg alle 4 h). Symptomorientiert werden zusätzlich auch andere Arzneistoffe angewendet (z. B. Doxepin oder Trimipramin, Diclofenac). Rückfallprophylaxe nach Opioidentgiftung bei Suchtkranken: Bei dieser Indikation wird ausschließlich Naltrexon p. o. verwendet. Meist ist eine Tagesdosis von 50 mg ausreichend, mit der die Wirkungen von 25 mg Heroin i. v. antagonisiert werden können. Auch bei Alkoholabhängigen reduziert Naltrexon die Rückfallhäufigkeit nach erfolgreicher Entzugstherapie. Die häufigsten unerwünschten Wirkungen sind Entzugssymptome infolge des Opioidrezeptor-Antagonismus. Nennenswerte Kontraindikationen und Wechselwirkungen sind nicht bekannt. Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. B-6.6 6 Nozizeptives System