Diagnostische Techniken
Werbung

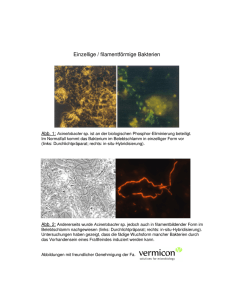
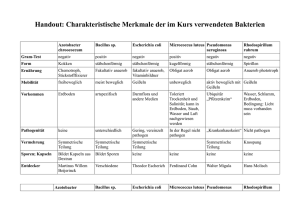
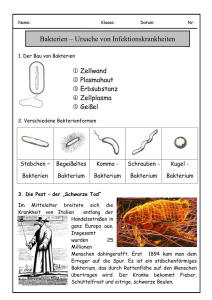
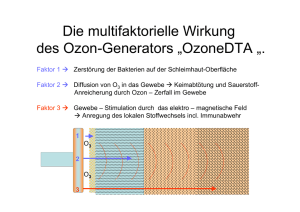
Diagnostische Techniken Makroskopie (Licht)Mikroskopie Übersichts-, Spezialfärbungen Enzymhistochemie Immunhistochemie Elektronenmikroskopie Durchflußzytometrie Molekularbiologie Proteinnachweis: Western Blot DNA-, RNA Quantifizierung Mutationsanalyse Makroskopie Veränderungen der Form Begrenzung Größe Gewicht Oberfläche, Struktur Farbe Konsistenz Asservierung von Gewebe und Zellen I Fixierung 4%iges Formalin (gesättigte Lsg. von Formaldehyd in H2O ca. 40%ig), pH 7.5, Phosphatpuffer, Eindringtiefe 1mm/h geeignet für: Konventionelle gefärbte Schnitte Immunhistochemie, ISH Gewinnung niedrigmolekularer DNA, RNA Alkohol Zytologische Präparate, ISH Gewinnung niedrigmolekularer DNA, RNA 2%iges Glutaraldehyd in Cacodylatpuffer Elektronenmikroskopie Asservierung von Gewebe und Zellen II Keine Fixierung – Einfrieren Eis: Enzymnachweis -20°C: Gefrierschnitte, Enzymnachweis -70°C/Flüssigstickstoff: hochmolekulare DNA, RNA Flüssigstickstoff-gekühltes Isopropanol Immunhistochemie, hochmolekulare DNA, RNA Speziallösungen: Guanidiniumthiocyanid (GTC) RNAlater etc. Einbettungs- und Schneideverfahren Konventionell: Wasserentzug durch „aufsteigende Alkoholreihe Xylol/Toluol Paraffinwachs Mikrotomschnitte: 4-6µm Warmes Wasserbad: „Strecken“ Entkalkung: Säure, EDTA Polyacrylamid-Einbettung Gewebearray Acrylatblock Färbemethoden Entparaffinierung: Xylol Rehydrierung: „absteigende Alkoholreihe“ Färbung HE (Hämatoxylin-Eosin) Blau: Zellkerne, Bakterien, Kalk, Zytoplasma, Knorpelgrundsubstanz Rot: Zytoplasma, Kollagen, Erythrozyten Entwässerung Einbettung, Eindeckung Spezialfärbungen I Giemsa Blau: feine Chromatinstrukturen, Bakterien Rot: Zytoplasma, kollagene Fasern Violett: Mastzellen van Gieson-Elastika Gelb: Muskulatur, Zytoplasma, Rot: Bindegewebe, Hyalin Schwarz: elastische Fasern, Zellkerne Gomöri Schwarz: Retikulinfasern Giemsa Gomöri Spezialfärbungen II PAS (Perjodsäure-Schiff-Reaktion) Rot: neutrale Glykosaminoglykane, Kohlehydrate, Glykogen Blau: Zellkerne Alcianblau: saure Glykosaminoglykane Sudan-Fettfärbung: rot Berliner-Blau: Eisen Gram (Bakterien) Blauviolett: gram+ Bakterien Rot: gram- Bakterien Ziehl-Neelsen: Mykobakterien Kongorot: Amyloid, grün polarisierend PAS Berliner Blau Ladewig OMS, 82a (Ladewig-Polarisation) 22.10. TU Enzymhistochemie Lokalisation von Enzymen im Schnittpräparat, Zellausstrichen Enzymaktivität setzt Substrat in sichtbaren Farbstoff um Frischgewebe Anwendungen Acetylcholinesterase: Innervationsstörungen (Mb. Hirschsprung) Chloracetat-Esterase: Granulozyten Immunhistochemie Lokalisation von Epitopen Zellbestandteile Zytoskelett Zelladhäsionsmoleküle Hormone Rezeptoren Erreger Phänotypisierung von Tumoren Immunhistochemie - Technik Gefrierschnitte Fixierung – Denaturierung Veränderung der Epitope Vorbehandlung der Schnittpräparate Proteolytische Enzyme Hitzebehandlung (Mikrowelle, Druckkochtopf) Markermoleküle Fluoreszierender Farbstoff, Enzym, kolloidales Gold Amplifikation des Signals Indirekte Methode, sekundäre Antikörper Mehrstufige Methoden: PAP: Peroxidase – Antiperoxidase APAAP: Alkalische Phosphatase – anti Alkalische Phosphatase ABC: Avidin – Biotin - Komplex CD CD 20 20 CD CD 33 CD CD 71 71 CD CD 66 66 Elektronenmikroskopie - Technik Glutaraldehyd u/o Paraformaldehyd – Fixierung Osmiumtetroxid – Nachfixierung Kunststoffeinbettung (Epon, Lowicryl) Schnittdicke 60-80nm (Diamantmesser) Kontrastierung: Uranylacetat, Bleicitrat Elektronenmikroskopie - Anwendungen Zellorganellen Mitochondrien, Peroxisomen, Endoplasmatisches Retikulum, Golgi, Lysosomen Zellmembranen, -verbindungen Zytoskelett Einschlusskörper Erreger: Viren Vermehrung von Mitochondrien Gestörte Z-Banden Kristalline Einschlüsse in Mitochondrien Viruseinschlußkörper (Zellkern)