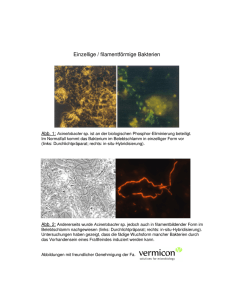
Charakterisierung von Bakterienpopulationen
Werbung

Charakterisierung von Bakterienpopulationen auf Pflanzenwurzeln mit CLSM-Volumendaten K. Rodenacker, B. A. Hense, M. Rothballer IBÖ/ARB Inhalt Stichwörter Material Methoden Beobachtungen Zusammenfassung © Rodenacker Stichwörter • • • • CLSM-Volumendaten Pflanzenwurzeln Bakterienpopulationen Charakterisierung © Rodenacker Stichwörter • CLSM-Volumendaten o λ-Stacks o Automatische Erfassung Stackfolgen zeitlich/örtlich o Auflösung (pixel/voxel size): x,y: 0,64 μm z: 1,00 μm © Rodenacker Stichwörter • Pflanzenwurzeln o Komplexer Aufbau (variabel über Zeit und Raum) o Multifunktionelles Organ o Strukturierte Oberfläche o Interaktionen mit anderen Organismen o Autofluoreszenz Bild aus: Ehlers/Noll: "Zellbiologie" (Serie Biologie), Westermann, Wien © Rodenacker Stichwörter • Bakterienpopulationen o pathogene, PGPR (plant growth promoting) o Epiphyt/Endophyt (extra-/intrazellulär) o Interaktionen: Nährstoffe, pathogene Substanzen, Antibiotika u.a. o Kommunikation © Rodenacker 10 µm Stichwörter • Charakterisierung o o o o Größe, Intensität Anzahl Lage Nachbarschaft räumliche Beziehung © Rodenacker Material • Bakterium: Azospirillum brasilense sp7 o o Epiphyt GFP-Markierung (induziert durch Wurzelexudate) • Pflanze: Weizen o o © Rodenacker Monoxenisch Nährmedium Biologische Fragestellung Aufklärung der molekularen Kommunikation und Interaktion von Bakterien auf der Wurzel Material © Rodenacker Methoden • Qualitativ o Visualisierung • Quantitativ o Segmentation o Interaktion o Vermessung © Rodenacker Methoden • Qualitativ o Visualisierung (Anaglyph) © Rodenacker Methoden • Qualitativ o Visualisierung (orthogonale Schnitte) Original © Rodenacker Bearbeitetes Original Methoden • Qualitativ o Visualisierung (virtual reality) Lokalisierung von Bakterien © Rodenacker Methoden • Quantitativ o Segmentation Wurzel Fermeture Radius 13*.64µm Schwelle: 5 -> Wurzelvolumen © Rodenacker Methoden • Quantitativ o Segmentation Bakterien in zwei verschiedenen Kanälen -> Bakterienvolumen -> Anzahl Cluster ... © Rodenacker Bakterien Methoden • Quantitativ o Vermessung Bakterien: Volumen Projizierte Fläche Fluoreszenzintensität Lage Ausdehnung in x, y und z o Wurzeln: Volumen Fluoreszenzintensität © Rodenacker Methoden • Quantitativ (Anzahl Bakterien) o Bestimmung der maximalen projizierten Fläche von isolierten Bakterien o Berechnung des mittleren Volumen -> Schätzung der Anzahl aus der Volumenverteilung -> Schätzung der Anzahl von Bakterienclustern © Rodenacker Methoden • Qualitativ o Visualisierung (Größen) interaktive Auswahl von Bakterien nach Größe © Rodenacker Methoden • Bakterien o Anzahlschätzung für zusammenhängende Objekte aus der Volumenverteilung Vorgabe mittleres Volumen Fitfunktion isoliert doppelt 3-fach Residual © Rodenacker Beobachtungen • Wurzel o Oberfläche o Volumen • Bakterien o o o o © Rodenacker Volumen Projizierte Fläche Intensität Anzahl Beobachtungen • Wurzel Oberfläche/Volumen Positionen Volumen eines Stacks tot. Volumen tot. Fläche Wurzel 1 Wurzel 2 10 10 40x512x512 60x512x512 42,95 64,42 1,07 1,07 geschätztes Wurzelvolumen Vw 33,10 49,34 geschätzte Wurzeloberfläche Aw 1,00 1,03 © Rodenacker pixel 106 µm3 mm2 106 µm3 mm2 Beobachtungen • Bakterien Volumen/Projizierte Fläche/Anzahlen tot. Bakterienvolumen proj. Bakterienfläche Anzahl zhgd. Bakterien(cluster) maximale proj. Bakterienfläche maximale proj. Bakterienfläche mittleres Bakterienvolumen geschätzte Bakterienanzahl aus Histogramm geschätzte Bakterienanzahl isoliert geschätzte Bakterienanzahl doppelt geschätzte Bakterienanzahl 3-fach geschätzte Bakterienanzahl 4-fach geschätzte Bakterienanzahl 5-fach Restvolumen Restanzahl © Rodenacker VtB nB VB VtB/VB Wurzel 1 21788,26 6959,51 1749 11 4,51 6,14 3546 3598 1021 427 129 82 18 Wurzel 2 33284,92 9933,62 1710 15 6,14 12,70 2621 2555 1290 210 174 0 0 5640,49 918 4734,60 323 µm3 µm2 pixel µm2 µm3 µm3 Beobachtungen • Bakterien Intensität/Auftreten Ausdehnung Z-Richtung (MODE) Fluoreszenz (MEAN) Bakterien/Wurzeloberfläche © Rodenacker Wurzel 1 Wurzel 2 4 5 µm 42,24 82,41 a.u. 3536,38 2536,19 1/mm2 Zusammenfassung • Probleme Durch das Erfassungssystem gegeben o Schwund der Fluoreszenz o Verlust durch nicht ideale Transparenz o Schwer zu standardisierende Einstellbedingungen Durch das Experiment gegeben o Reproduzierbarkeit, Wurzelsphäre, Natur • Stand o Makrogesteuerte Erfassung von Stack-Folgen o λ-Stacks für verbesserte Segmentation © Rodenacker Zusammenfassung • Zukunft o Zunehmende Anzahl von unterschiedlich markierten Bakterien • Info o http://rhizosphere.gsf.de • Dank an o David Fanning o Robert Schäfer o Konrad Sandau © Rodenacker