Nebenwirkungen von therapeutischen Proteinen
Werbung

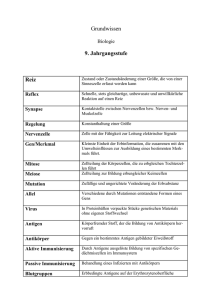
14 Forschung Medizin Pharmaceutical Tribune • 2. Jahrgang • Nr. 10 • 31. Mai 2010 Nebenwirkungen von therapeutischen Proteinen Nützlich – aber in Einzelfällen gefährlich Bei der therapeutischen Gabe von Substanzen unterscheidet man generell zwischen der aktiven und passiven Verabreichung, wobei im ersten Fall die klassische Impfung ge­ meint ist – das heißt, es wird eine er­ wünschte Immunreaktion gegen ein definiertes Protein gezielt induziert. Im Gegensatz dazu ist bei der pas­ siven Darreichung von therapeutisch wirksamen Molekülen (z.B. Antikör­ per in der Onkologie zur Tumorbe­ kämpfung oder Wachstumsfaktoren zur Anregung der Proliferation von speziellen Immunzellen) eine Im­ munreaktion höchst unerwünscht und gefährlich für den Patienten. Da­ her ist es behördlich vorgeschrieben, das immunogene Potenzial von Bio­ therapeutika mit fundierten analy­ tischen Methoden zu testen. Die aktive Applikation Unter Impfung versteht man die Stimulation des Immunsystems zur Bildung spezifischer Antikörper und spezifischer T-Zellen durch die Applikation von Antigenen. Die im Zuge einer Impfung ge­ nerierte Immunantwort entspricht dem Mechanismus, der während einer natürlicher Infektion abläuft. Ziel der aktiven Immunisierung ist letztlich die Bildung von neutrali­ sierenden Antikörpern, die Ausbil­ dung eines so genannten immuno­ logischen Gedächtnisses (Memory) bezüglich des Pathogens. Als Bei­ Schematische Darstellung der Immunantwort Grafik: Vela Labs WIEN – Die ungewollte Immunreaktion gegen therapeutische Proteine kann in Einzelfällen neben der Neutralisierung der Wirkung sogar zur Bedrohung des Patientenlebens führen. Daher wird von Behörden die Testung des immunologischen Potenzials zwingend vorgeschrieben. Nach Aufnahme des Proteins durch eine Antigen-präsentierende Zelle (APZ) wird dieses in Bruchstücke zerlegt und an der Oberfläche der APZ einer T-Zelle „präsentiert“. Die Interaktion der beiden Zellen erfolgt durch spezifische Proteinstrukturen und führt zur Reifung der T-Zelle. Trifft nun eine aktivierte T-Zelle auf eine naive B-Zelle, wird diese aktiviert und dadurch zur Antikörper-sezernierenden PlasmaZelle – gleichzeitig entstehen Memory-B-Zellen, die bei einer Reinfektion sofort wieder spezifische Antikörper produzieren. spiel sei hier FSME (FrühsommerMeningoenzephalitis) genannt, eine schwere Viruserkrankung, die zur Entzündung des Gehirns, der Hirnhäute und des Zentralnerven­ systems führt. Der Impfstoff besteht aus inak­ tivierten Viren und wird in den Muskel (intramuskulär) gespritzt. Innerhalb von etwa zwei Wochen baut dann das Immunsystem die spezifische Antwort auf. Diese führt dazu, dass bei wiederkehrender Ex­ position im Zuge einer Reinfektion sofort spezifische Antikörper zur Verfügung stehen, da diese „Me­ mory-B-Zellen“ bei der nächsten Infektion wesentlich schneller und besser reagieren können als nai­ ve, ruhende B-Zellen. Um eine Im­ munantwort mit entsprechender Stärke zu generieren, wird das je­ weilige Immunogen mit einem so genannten Adjuvans gemischt und dann appliziert. Als Adjuvanzien bezeichnet man Substanzen, die die Immunogenität erhöhen, aber mit dem Immunogen keine stabile Verbindung eingehen, sondern als Emulsion vorliegen und zwei Wirk­ weisen haben: (1) Lösliche Prote­ in-Antigene werden in partikuläres Material umgewandelt und dadurch von so genannten Antigen-präsen­ tierenden Zellen wesentlich besser aufgenommen und (2) danach auch wirkungsvoller den Zellen des Im­ munsystems zur „Weiterverarbei­ tung“ präsentiert (s. Abbildung)1. Die passive Applikation Unter passiver Immunisierung versteht man das intravenöse Ver­ abreichen von Antikörper-Präpara­ ten, die ganz spezifisch das Patho­ gen erkennen. Solche Antikörper werden aus den Seren von immu­ nisierten Tiere gewonnen oder sind gentechnisch hergestellt. Diese Ap­ plikationsform stellt eine wertvolle Notfallmaßnahme dar, da eine sehr schnelle Wirkung erreicht wird. Als Beispiel sei hier Tetanus (Wundstarr­ krampf) genannt, eine häufig töd­ lich verlaufende Infektionskrank­ heit, welche die muskelsteuernden Nervenzellen befällt und durch das Bakterium Clostridium tetani aus­ gelöst wird. Die resistenten Sporen des Bakteriums kommen nahezu überall vor, auch im Straßenstaub oder in der Gartenerde. Die Infekti­ on erfolgt durch das Eindringen der Sporen in Wunden. Nach einer Ver­ letzung wird, sofern kein oder unzu­ reichender Impfschutz besteht, so­ wohl eine aktive als auch passive, also eine simultane Immunisierung not­ wendig. Diese besteht aus der Injek­ tion eines (chemisch) abgeschwäch­ ten, aber immunogenen Toxins – dem so genannten Toxoid – aber auch aus einem kombinierten Teta­ nus-Diphtherie-Impfstoff und einer Injektion von mit menschlichen Anti­ körpern gegen den Tetanus­erreger angereichertem Serum. Die passiv wirkende Serumgabe soll das Zeit­ intervall bis zum Eintritt der Antikör­ perbildung (ungefähr zwei Wochen) überbrücken, die von der aktiven Toxoidgabe angeregt wurde. Ungewollte Reaktionen Neben der einmaligen passiven Gabe von spezifischen Antikör­ pern im Zuge der Notfallmaßnahme werden Proteine auch zu therapeu­ tischen Zwecken über eine länge­ re Zeit wiederholt verabreicht. Die­ se passive Applikation, besonders von Antikörpern, birgt das Risiko einer ungewollten Immunreaktion gegen das dargereichte Protein. Im therapeutischen Einsatzgebiet wer­ den heutzutage fast ausschließlich Proteine verwendet, die in diversen Wirtszellen rekombinant produziert werden. Neben E. coli finden vor allem Säugerzellsysteme wie CHO (Chinese Hamster Ovarian)-Zellen bei der Produktion von Biophar­ mazeutika Anwendung, insbeson­ dere im Bereich der rekombinanten monoklonalen Anti­körper. Hierbei wird die zu der humanen Amino­ säurensequenz korrespondieren­ de Nukleotidsequenz in die Pro­ duktionszellen eingebracht und von diesen in großen Mengen produ­ ziert. Das entstehende humane Pro­ tein wird dann großtechnisch ange­ reichert und für die Applikation im Menschen hochrein formuliert. Die Erfahrungen, die hierbei ge­ macht wurden, waren insofern über­ raschend, als vereinzelt eine Antikör­ perbildung (Anti Drug Antibodies – ADAs) gegen das passiv applizierte humane Protein nachgewiesen wer­ den konnte. ADAs stellen ein ernstes Problem dar, da sie (1) durch Bindung an das applizierte Protein dessen the­ rapeutische Wirkung zunichte ma­ chen können oder (2) durch Bildung von Immunkomplexen das Immun­ system so (über)aktivieren können, dass Gefahr für das Leben des Pati­ enten besteht. Besonders bei der Ap­ plikation von therapeutischen mo­ noklonalen Antikörpern besteht hier ein erhöhtes Gefahrenpotenzial, da deren spezifische Bindungsstruktu­ ren immunogenes Potenzial haben. Sowohl die amerikanische wie die europäische Gesundheitsbehörde haben die überragende Bedeutung der ungewollten Immunogenität für die Patienten erkannt und deren Tes­ tung als zulassungsrelevante Daten in den Monographien verankert2. Dr. Andreas Nechansky www.vela-labs.at 1 ancer Immunotherapy Biotechnology J. C (2006); 1:138–147 2 HAHA – nothing to laugh about. Measuring the immunogenicity (human anti-human anti­ body response) induced by humanized monoc­ lonal antibodies applying ELISA and SPR tech­ nology. J. Pharm. Biomed. Analysis (2010); 51: 252–254