Differenziertes Schilddrüsenkarzinom
Werbung

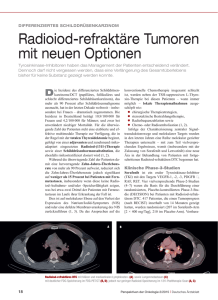
fortbildung · MEDIZIN FORUM Diagnostik und Therapie Differenziertes Schilddrüsenkarzinom Für die Prognose entscheidend sind das Tumorstadium und die Histologie Differenzierung. In den letzten Jahren haben molekulargenetische Marker immer mehr an Bedeutung gewonnen. B Pour le pronostic, il est décisif de connaître le stade de la tumeur et la différenciation histologique. Au cours des dernières années, les marqueurs génétiques moléculaires ont pris de l’ampleur. Epidemiologie Das differenzierte Schilddrüsenkarzinom hat einen Anteil an den gesamten Malignomerkrankungen von ca. 1%. In der Zeit von 2003– 2006 betrugen die registrierten Neuerkrankungen in der Schweiz 482/ Jahr was bei einer niedrigen Mortalitätsrate einen Verlust von 234 Lebensjahren nach sich zieht (1). Europaweit gesehen beträgt die Inzidenz 8.2/100 000 für Frauen und 3.3/100 000 für Männer, wobei in den letzten Jahren je nach Geschlecht und Region eine Zunahme von 30–60% zu verzeichnen war. Diskutiert wird eine häufigere und genauere Abklärung von Schilddrüsenerkrankungen, die zu einem Anstieg vor allem der niedrigeren Tumorstadien geführt hat (2, 3). Daten aus den USA, europäischen Zentren und eigene Daten können dieses nicht bestätigen, da sich hier ein Anstieg nicht nur der kleineren, sondern aller Tumorstadien zeigt (4–6). Interessant ist hierbei, dass der Anteil von Schilddrüsenkarzinomen in den operierten Schilddrüsen zugenommen hat, was einige Autoren auf eine bessere histologische Klassifizierung zurückführen (6–8). Diskutiert werden weiterhin verschiedene Einflussfaktoren auf ein mögliches Tumorwachstum wie Jodaufnahme, Autoimmunthyreoiditis, erhöhter TSH Spiegel, ein erhöhter Insulin Spiegel, Adipositas, Röntgen-Untersuchungen und Umweltgifte wie Nitrate und Kohlenwasserstoffe (7). Gesichert ist die erhöhte Inzidenz von Schilddrüsenkarzinomen nach externer Radiatio und nach Inkorporation grosser Radiojodmengen, z.B. nach Kernkraftunfällen (9, 10). Das durchschnittliche Erkrankungsalter liegt bei 44 bis 49 Jahren. Histologie Unterschieden wird zwischen papillären, follikulären sowie der histologischen Subgruppe der oxyphilzelligen oder Hurthlezell Karzinome und letztlich den anaplastischen Schilddrüsenkarzinomen. Hier ist besonders bei der papillären Differenzierung ein Anstieg zu verzeichnen mit Berichten über einen Anstieg insbesondere seitens der prognostisch schlechteren Tall Cell Variante [7,11]. Molekulargenetische Marker haben in den letzten Jahren zunehmend an Bedeutung gewonnen (12– 14). Mutationen in der BRAF Domäne können die Prognose der sonst eher vorteilhaften Verläufe papillärer Schilddrüsenkarzinome unabhängig von der initialen Tumorgrösse wesentlich verschlechtern (15). Diagnostik Trotz der hohen Inzidenz von Schilddrüsenknoten (40–50%) ist die Prävalenz von Schilddrüsenkarzinomen dennoch gering. Nur 5% info@onkologie _ 02 _ 2014 Dr. med. Sabine Weidner Prof. Dr. med. Thomas Krause Dr. med. Christian Boy Bern Bern Bern aller Schilddrüsenknoten weisen eine maligne Histologie auf (16). Horvath et al entwickelten ein auf der Sonographie basierendes System mit 6 Risikostufen (TIRADS) und erreichten bzgl. Malignität eine Accuracy von 94% (17). Bei Hinzunahme der Elastographie konnten Russ et al. in über 99% der Knoten ein Karzinom ausschliessen und eine zytologische Diagnostik einsparen (18). In der zytologischen Beurteilung hat die Einführung des Bethesdasystems zu einer erhöhten Transparenz und damit auch genaueren Stratifizierung des weiteren Vorgehens geführt. Es beinhaltet 6 Kategorien: 1 und 2 klar benigne, 5 und 6 verdächtig bzw. maligne. In Kategorie 3 und 4 befinden sich Atypien und unklare Neoplasien (19). Insbesondere hier bedarf es weiterer diagnostischer Hilfsmittel. Wale et al. setzten die Szintigraphie mit 99m-Tc-methoxyisobutylisonitril (99m-Tc-MIBI) bei unklarem zytologischem Ergebnis ein und fanden bei Nichtspeicherung ein in 97% benignes Ergebnis (20). Eine zusätzlich durchgeführte Cost-Effectiveness Kalkulation zeigte durch Einsparen von Repunktion und Operation eine Kostenersparnis (20). Studien aus Bellinzona, inkl. einer Metaanalyse, ergaben ähnliche Ergebnisse (21, 22). Zusätzlich empfehlen die Guidelines der ESMO Working Group bereits im Rahmen der Routine–Diagnostik zur zytologischen Beurteilung molekulargenetische Tests für BRAF, RAS, RET/PTC und PAX8/PPARgamma – Mutationen, die bei Positivität einer Malignitätswahrscheinlichkeit von 97% entsprechen (12, 14, 23). Einen zweiten Ansatz bietet der in den USA bereits etablierte Gene Expression Classifier, der anhand des zytologischen Präparates zu 95% Malignität ausschliesst. Dieser kann im Einzelfall auch in Europa angewendet werden (24). Operation Einigkeit der Leitlinien in der Empfehlung zur totalen Thyreoidektomie besteht bei Tumoren >4 cm und bei präoperativ bereits bekannter Metastasierung sowie zur Hemithyreoidektomie bei Vorliegen unifokaler Mikrokarzinome (<1cm) ohne bekannte Metastasierung. Diskutabel ist das Ausmass der Operation gemäss NCCN Guidelines bei Tumoren < 4cm wobei eine Fussnote hier feststellt, 35 fortbildung · MEDIZIN FORUM dass die Mehrheit der anwesenden Experten bei zytologisch bewiesenem Karzinom eine totale Thyreoidektomie empfiehlt. Eine prophylaktische Lymphadenektomie wird primär nicht empfohlen, wobei präoperativer Ultraschall und die Resektion von Lymphknoten bei klarem Metastasenverdacht angeraten werden (Tab. 1). Radiojodtherapie Die Radiojodtherapie wird gemäss o.g. Guidelines nach kompletter Thyreoidektomie empfohlen. Nach z.B. mittels Hemithyreoidektomie komplett reseziertem Mikrokarzinom ist sie aufgrund der in der Regel guten Prognose nicht notwendig. Um eine ausreichende TSH stimulierte Radiojodaufnahme zu erreichen ist alternativ zur Hormonkarenz für 3-4 Wochen mit nachfolgend hypothyreoter Beschwerdesymptomatik die postoperative Radiojodtherapie auch mittels Gabe von rekombinanten TSH (Thyrogen, gemäss SL) unter fortgesetzter Hormonsubstitution möglich. Dieses reduziert durch eine schnellere Radiojodausscheidung sowohl die Ganzkörperbelastung durch Radiojod wie auch Hypothyreose – bedingte Nebenwirkungen, insbesondere bei internistischen Begleiterkrankungen [25,26]. Bei Nachweis von Metastasen, z.B. im posttherapeutischen Ganzkörperscan, wird 4 bis 6 Monate im Anschluss an die erste Therapie eine zweite Radiojodbehandlung in der Regel mit höherer Dosis (7.4–11.1GBq) in kurativer Absicht durchgeführt. Dieses kann wenn notwendig bis zu einer kumulativen Grenzdosis von maximal 22 GBq mehrfach wiederholt werden (27). Die Radiojodtherapie kann aufgrund der radioaktiven Ausscheidungen nur auf speziell dafür ausgelegten Stationen durchgeführt werden. Sie dauert 3 bis 5 Tage und ist relativ nebenwirkungsarm. Bei Tab. 1 höheren Gesamtdosen sind neben selteneren Nebenwirkungen Beeinträchtigungen der Tränen- und Speichelproduktion zu be­obachten. PET-CT Eine initial ungünstige Differenzierung sowie ein trotz erfolgter Radiojodtherapien persistierender Tumormarker (TG) sind Indikationen für eine PET-CT. Im Allgemeinen ist eine 18F-FDGSpeicherung verbunden mit einer Dedifferenzierung und somit verminderten oder aufgehobenen Radiojodaufnahme. Seltene Ausnahmen sind „Mischtumoren“, die unterschiedliche Differenzierungsgrade aufweisen, so dass eine Therapie des gesamten Tumors (durch Mitbestrahlung der benachbarten schlechter speichernden Zellen) möglich wird. Diskutiert wird die prognostische Bedeutung des Glukosestoffwechsels (28). Eine weitere Indikation zur PET-CT ist die Therapiekontrolle von dedifferenziertem Tumorgewebe z.B. nach externer Radiatio oder unter Therapie mit Tyrosinkinaseinhibitoren (TKI). Radioonkologie/IMRT/Brachytherapie Bei dedifferenziertem Tumorgewebe zervikal oder bei nicht jodaviden Knochen und Weichteilmetastasen bietet die externe Radiatio eine gute Therapiealternative. Mittels neuer Bestrahlungstechniken wie der IMRT kann unter Schonung des umliegenden Gewebes nebenwirkungsarm bestrahlt werden. Eine effektive Möglichkeit ist, das Bestrahlungsfeld an die Stoffwechselaktivität im PET-CT anzupassen (29) (Abb. 1).Ferner besteht die Möglichkeit einer lokalen Bestrahlung mittels Brachytherapie (z.B. zervikale Lymphknotenmetastasen/ Tumorrezidiv) oder eine SIRT bei inoperablen Lebermetastasen. Synopsis aktueller operativer Handlungsempfehlungen für das differenzierte Schilddrüsenkarzinom (gemäss unterschiedlicher Leitlinien) Guideline Totale Thyreoidektomie (TT) NCCN 2013 T > 4 cm N pos M pos ATA 2009 T > 1 cm N pos M pos BTA 2007 T > 1 cm N pos AACE/AAES 2001 T > 1 cm N pos M pos Bilaterale Knoten Bilaterale Knoten Bilaterale Knoten Bilaterale Knoten Radiatio Radiatio Radiatio Radiatio Familiarität Familiarität Familiarität Familiarität Aggressive Histologie Optional Hemithyreoidektomie oder TT ETA 2006 T > 1 cm N pos M pos JSTS/JAES 2010 T > 4 cm N pos M pos Aggressive Histologie Patientenalter > 45 Jahre Patientenalter > 45 Jahre T1-4 T < 4 cm N neg M neg T < 1 cm N neg M neg unifokal unifokal T < 1 cm N neg T < 1 cm N neg M neg T < 1 cm T < 2 cm N neg M neg unifokal Patientenalter 15–45Jahre gut differenziert Prophylaktische Resektion zentrales Lymphknotenkompartiment nein nein nein nein unbestimmt unbestimmt Prophylaktische Resektion laterale Lymphknotenkompartimente nein nein nein nein unbestimmt unbestimmt NCCN, National Comprehensive Cancer Network ; ATA, American Thyroid Association ; BTA, British Thyroid Association ; AACE/AAES, American Association of Clinical Endocrinologists and American Association of Endocrine Surgeons; ETA, European Thyroid Association; JSTS/JAES, Japanese Society of Thyroid Surgery and Japan Association of Endocrine Surgeons; T, Tumorgrösse; N, Lymphknotenmetastasen; M, Fernmetastasen _ 2014 _ info@onkologie 3602 fortbildung · MEDIZIN FORUM ABB. 1 Patient (32 J.) nach Thyreoidektomie bei papillärem Schilddrüsenkarzinom pT4b N1 M1. Im Ganzkörperscan (A) nach Radiojodtherapie nur I-131 Speicherung im Schilddrüsenrestgewebe. Die F-18 FDG PET (B, C) hingegen zeigt multiple ossäre, pulmonale und Lymphknotenmetastasen. Systemische Therapie mit Tyrosinkinaseinhibitoren (TKI) Chemotherapien zeigen keine dauerhafte Stabilisierung und werden aktuell lediglich in der Therapie von anaplastischen Schilddrüsenkarzinomen empfohlen (30, 31). Seit 2005 haben TKI in Multizenterstudien eine vorübergehende Stabilisierung eines zuvor progredienten Tumorleidens gezeigt (32–34). Aufgrund der hierunter zu erwartenden Nebenwirkungen ist eine strenge Indika­tionsstellung sowie ein kontinuierliches und umfassendes klinisches und radiologisches Monitoring, angelehnt an die Studienprotokolle bereits erfolgter oder laufender Multizenterstudien, erforderlich. In der Schweiz ist die Anwendung von TKI beim differenzierten Schilddrüsenkarzinom aktuell nur im Rahmen eines Compassionate Use mit vorheriger Kostengutsprache der jeweiligen Krankenkasse möglich. Ein Einschluss in Multizenterstudien ist dem jedoch vorzuziehen. Zu beachten ist vor Einsatz einer TKI Therapie die mögliche Interaktion mit einer bereits bestehenden Medikation. Eine Kombination mit Biphosphonaten oder Denosumab (Xgeva) zur Stabilisierung von Knochenmetastasen ist möglich. Dr. med. Sabine Weidner Prof. Dr. med. Thomas Krause Dr. med. Christian Boy Universitätsklinik für Nuklearmedizin Inselspital, Universitätsspital Bern, 3010 Bern [email protected] B Literatur am Online-Beitrag unter: www.medinfo-verlag.ch info@onkologie _ 02 _ 2014 Take-Home Message ◆Prognostisch entscheidend ist neben dem Tumorstadium die histologische Differenzierung. ◆Sonographische Klassifizierung, Szintigraphie mit Tc-MIBI, zytologisches Staging nach Bethesda ggf. kombiniert mit molekularen Markern sind wichtige diagnostische Tools ◆Eine komplette Thyreoidektomie und adjuvante Radiojodtherapie ist bei Tumoren >1 cm sowie bei N1 und M1 Stadien zu empfehlen, bei Tumoren <1 cm optional ◆Dedifferenziertes Schilddrüsengewebe ist mittels PET-CT darstellbar und mittels Tyrosinkinaseinhibitoren systemisch, mittels IMRT und Chirurgie lokoregionär therapierbar Message à retenir ◆A part du stade tumoral, la différenciation histologique est cruciale pour le pronostique ◆La classification échographique, la scintigraphie au Tc-MIBI, le staging cytologique selon Bethesda éventuellement combiné avec des marqueurs moléculaires sont des outils importants pour le diagnostic ◆Une thyroïdectomie et un traitement adjuvant par l'iode radioactif sont recommandés pour les tumeurs > 1cm, stades N1 et M1, en option pour les tumeurs <1cm ◆Le tissu thyroïdien dédifférencié peut être représenté à l'aide de PETCT, et peut être traité de façon systémique par les inhibiteurs de la tyrosine kinase et de façon locorégional par IMRT et chirurgie 37 fortbildung · MEDIZIN FORUM Literatur: 1. Thyroid. In: NICER and swiss cancer registries. Scientific Publications. Publications reviewed by external experts. Swiss Cancer Bulletin Nr. 3/2009 Link: http:// www.nicer.org/assets/files/p_Thyroid_Hodgkin_disease_skb2009.pdf 2. Davies L, Welch HG. Increasing incidence of thyroid cancer in the united states, 1973-2002. JAMA. 2006;295:2164-2167. 3. Brito JP, Morris JC, Montori VM. Thyroid cancer: Zealous imaging has increased detection and treatment of low risk tumours. BMJ. 2013;347:f4706. 20.Wale A, Miles KA, Young B, Zammit C, Williams A, Quin J, Dizdarevic S. Combined tc-methoxyisobutylisonitrile scintigraphy and fine-needle aspiration cytology offers an accurate and potentially cost-effective investigative strategy for the assessment of solitary or dominant thyroid nodules. Eur J Nucl Med Mol Imaging. 2013. [Epub ahead of print] PMID: 24030667 21.Treglia G, Caldarella C, Saggiorato E, et al. Diagnostic performance of (99m)tc-MIBI scan in predicting the malignancy of thyroid nodules: A meta-analysis. Endocrine. 2013;44:70-78. 4. Chen AY, Jemal A, Ward EM. Increasing incidence of differentiated thyroid cancer in the united states, 1988-2005. Cancer. 2009;115:3801-3807. 22.Giovanella L, Suriano S, Maffioli M, Ceriani L, Spriano G. (99m)tc-sestamibi scanning in thyroid nodules with nondiagnostic cytology. Head Neck. 2010;32:607611. 5.Leenhardt L, Bernier MO, Boin-Pineau MH, et al. Advances in diagnostic practices affect thyroid cancer incidence in france. Eur J Endocrinol. 2004;150:133139. 23.Pacini F, Castagna MG, Brilli L, Pentheroudakis G, ESMO Guidelines Working Group. Thyroid cancer: ESMO clinical practice guidelines for diagnosis, treatment and follow-up. Ann Oncol. 2010;21 Suppl 5:v214-9. 6.Fahey TJ,3rd, Reeve TS, Delbridge L. Increasing incidence and changing presentation of thyroid cancer over a 30-year period. Br J Surg. 1995;82:518-520. 24.Alexander EK, Kennedy GC, Baloch ZW, et al. Preoperative diagnosis of benign thyroid nodules with indeterminate cytology. N Engl J Med. 2012;367:705-715. 7. Pellegriti G, Frasca F, Regalbuto C, Squatrito S, Vigneri R. Worldwide increasing incidence of thyroid cancer: Update on epidemiology and risk factors. J Cancer Epidemiol. 2013;2013:965212. 25.Dueren C, Dietlein M, Luster M, et al. The use of thyrogen in the treatment of differentiated thyroid carcinoma: An intraindividual comparison of clinical effects and implications of daily life. Exp Clin Endocrinol Diabetes. 2010;118:513-519. 8.Gharib H, Goellner JR. Fine-needle aspiration biopsy of the thyroid: An appraisal. Ann Intern Med. 1993;118:282-289. 26. Luster M, Hanscheid H, Freudenberg LS, Verburg FA. Radioiodine therapy of metastatic lesions of differentiated thyroid cancer. J Endocrinol Invest. 2012;35:21-29. 9. Williams D. Radiation carcinogenesis: Lessons from chernobyl. Oncogene. 2008;27 Suppl 2:S9-18. 10.Pearce MS, Salotti JA, Little MP, et al. Radiation exposure from CT scans in childhood and subsequent risk of leukaemia and brain tumours: A retrospective cohort study. Lancet. 2012;380:499-505. 11.Ceresini G, Corcione L, Michiara M, et al. Thyroid cancer incidence by histological type and related variants in a mildly iodine-deficient area of northern Italy, 1998 to 2009. Cancer. 2012;118:5473-5480. 12.Nikiforov YE, Yip L, Nikiforova MN. New strategies in diagnosing cancer in thyroid nodules: Impact of molecular markers. Clin Cancer Res. 2013;19:2283-2288. 13.Xing M, Haugen BR, Schlumberger M. Progress in molecular-based management of differentiated thyroid cancer. Lancet. 2013;381:1058-1069. 14.Cantara S, Capezzone M, Marchisotta S, et al. Impact of proto-oncogene mutation detection in cytological specimens from thyroid nodules improves the diagnostic accuracy of cytology. J Clin Endocrinol Metab. 2010;95:1365-1369. 15.Fernandez IJ, Piccin O, Sciascia S, et al. Clinical significance of BRAF mutation in thyroid papillary cancer. Otolaryngol Head Neck Surg. 2013;148:919-925. 16.Dean DS, Gharib H. Epidemiology of thyroid nodules. Best Pract Res Clin Endocrinol Metab. 2008;22:901-911. 17.Horvath E, Majlis S, Rossi R, et al. An ultrasonogram reporting system for thyroid nodules stratifying cancer risk for clinical management. J Clin Endocrinol Metab. 2009;94:1748-1751. 18.Russ G, Royer B, Bigorgne C, Rouxel A, Bienvenu-Perrard M, Leenhardt L. Prospective evaluation of thyroid imaging reporting and data system on 4550 nodules with and without elastography. Eur J Endocrinol. 2013;168:649-655. 27.Durante C, Haddy N, Baudin E, et al. Long-term outcome of 444 patients with distant metastases from papillary and follicular thyroid carcinoma: Benefits and limits of radioiodine therapy. J Clin Endocrinol Metab. 2006;91:2892-2899. 28.Robbins RJ, Larson SM. The value of positron emission tomography (PET) in the management of patients with thyroid cancer. Best Pract Res Clin Endocrinol Metab. 2008;22:1047-59. 29.Sun XS, Sun SR, Guevara N, et al. Indications of external beam radiation therapy in non-anaplastic thyroid cancer and impact of innovative radiation techniques. Crit Rev Oncol Hematol. 2013;86:52-68. 30.Sherman SI. Cytotoxic chemotherapy for differentiated thyroid carcinoma. Clin Oncol (R Coll Radiol). 2010;22:464-8. 31.Perri F, Lorenzo GD, Scarpati GD, Buonerba C. Anaplastic thyroid carcinoma: A comprehensive review of current and future therapeutic options. World J Clin Oncol. 2011;2:150-7. 32.Leboulleux S, Bastholt L, Krause T, et al. Vandetanib in locally advanced or metastatic differentiated thyroid cancer: a randomised, double-blind, phase 2 trial. Lancet Oncol. 2012;13:897-905. 33.Schneider TC, Abdulrahman RM, Corssmit EP, et al. Long-term analysis of the efficacy and tolerability of sorafenib in advanced radio-iodine refractory differentiated thyroid carcinoma: final results of a phase II trial. Eur J Endocrinol. 2012;167:643-50. 34.Anderson RT, Linnehan JE, Tongbram V, et al. Clinical, safety, and economic evidence in radioactive iodine-refractory differentiated thyroid cancer: a systematic literature review. Thyroid. 2013 Apr;23(4):392-407. 19.Cibas ES, Ali SZ, NCI Thyroid FNA State of the Science Conference. The bethesda system for reporting thyroid cytopathology. Am J Clin Pathol. 2009;132:658-665. _ 2014 _ info@onkologie 3802