Modulation durch regulatorische T-Zellen und CTLA-4
Werbung

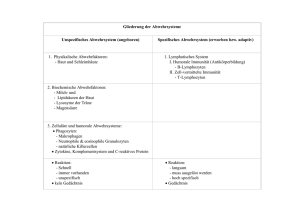
DOI 10.1515/labmed-2012-0061 Allergie und Autoimmunität/Allergy and Autoimmunity J Lab Med 2013; 37(3): 123–129 Redaktion: U. Sack/K. Conrad Katrin Hebel, Mandy Pierau, Holger Lingel, Michael Steiner, Hardy Krause, Gerhard Jorch und Monika C. Brunner-Weinzierl* Das neonatale Immunsystem: Modulation durch regulatorische T-Zellen und CTLA-4 (CD152) The neonatal immune system: modulation by regulatory T-cells and CTLA-4 Zusammenfassung: Fehlregulationen von CTLA-4 (CD152), einem auf der Oberfläche von Lymphozyten exprimiertem Glykoprotein, können zu chronischen Entzündungsreaktionen führen. Aufgrund neuer Erkenntnisse wird deutlich, dass CTLA-4 die Effektorfunktionen von T-Lymphozyten abschaltet und damit die Effektorphase von T-Lymphozyten beendet. Interessanterweise sind die CTLA-4 exprimierenden T-Lymphozyten resistent gegen Apoptose (programmierter Zelltod) und migrieren verstärkt in Lymphknoten und Gewebe. Weitere Studien zeigen, dass regulatorische T-Zellen, die unerwünschte Immunantworten abschalten, in vivo nur inhibieren können, wenn Sie über ein intaktes CTLA-4-Gen verfügen. Darüber hinaus hat sich bestätigt, dass CTLA-4 nicht nur-wie angenommen-auf T-Lymphozyten exprimiert wird, sondern auch auf B-Lymphozyten. So zeigen Mäuse mit genetischer Inaktivierung von CTLA-4 in B-Lymphozyten eine verstärkte Produktion von IgM nach Immunisierung. Interessanterweise exprimieren insbesondere B-Lymphozyten und T-Lymphozyten von Neugeborenen und Kleinkindern stark CTLA-4, was auf eine zentrale immunregulatorische Rolle bei frühkindlichen Immunantworten hindeutet. Moleküle, die wie CTLA-4 die Differenzierung von Lymphozyten regulieren, könnten einen neuen Ansatzpunkt bieten, um bereits im Kindesalter die Weichen für ein vor Autoimmunität und Allergie geschütztes Immunsystem zu stellen. Schlüsselwörter: Effektorzellen; Immunsystem; Kinder; Lymphozyten; Neugeborene; Regulatorische T-Zellen; Antikörper. Abstract: The dysregulation of CTLA-4 (CD152), a glycoprotein expressed on the surface of lymphocytes, may lead to chronic inflammation. Based on the recent scientific findings, it has become clear that CTLA-4 inhibits the effector function and, thus, shuts down the effector phase of the T-lymphocytes. Interestingly, the CTLA-4-expressing cells become resistant to apoptosis (programmed cell death) and increasingly migrate to the lymph nodes and tissues. Studies have shown that regulatory T cells (Tregs), which switch off unwanted immune responses can inhibit in vivo only if they express an intact CTLA-4 gene. Moreover, it was confirmed that CTLA-4 is not only expressed on the T-lymphocytes but also on the B-lymphocytes. The mice with genetic inactivation of CTLA-4 in the B-lymphocytes show an increased production of the IgM antibodies after immunization. Interestingly, in particular, the B- and T-lymphocytes from the newborns and infants show a strongly increased CTLA-4 expression, suggesting a key immunoregulatory role in the neonatal immune responses. The molecules such as CTLA-4, which regulate the differentiation of the lymphocytes, could provide therapeutic targets during the early childhood to set the course for protection against autoimmunity and allergy. Keywords: antibody; effector T-cell; immune system; infants; lymphocytes; newborns; regulatory T-cell. *Korrespondenz: Prof. Dr. Monika C. Brunner-Weinzierl, Experimentelle Pädiatrie und Neonatalogie, Universitätskinderklinik, Universitätsklinikum Magdeburg, Leipziger Str. 44, 39120 Magdeburg, Deutschland, Tel.: 0391/6724003, Fax: 0391/6724202, E-Mail: [email protected] Katrin Hebel, Mandy Pierau, Holger Lingel, Michael Steiner und Gerhard Jorch: Universitätskinderklinik, Universitätsklinikum Magdeburg, Magdeburg, Deutschland Hardy Krause: Kinderchirurgie, Universitätsklinikum Magdeburg, Magdeburg, Deutschland Einleitung Chronische adaptive Immunantworten tragen entscheidend zur Pathologie von Autoimmunerkrankungen wie Unauthenticated Download Date | 5/12/16 4:33 AM 124 Hebel et al.: CTLA-4 und das neonatal Immunsystem z.B. Juveniler Arthritis, Juveniler Diabetes und Atopischer Dermatitis bei. Die meisten adaptiven Immunantworten sind komplex geregelt und neben den T-Zellen sind B-Lymphozyten maßgeblich an der Aufrechterhaltung von Immunantworten beteiligt. Die primären Regulatoren der T-Zellen, welche deren Effektorfunktion und Differenzierung steuern, sind zusammen mit dem T-Zellrezeptor (TZR), die Homologe CD28 und CTLA-4 (CD152) [1–4]. CD28 und CTLA-4 binden hierbei die gleichen Liganden, CD80 und CD86 auf Antigen-präsentierenden Zellen (APZ), CTLA-4 allerdings mit einer wesentlich höheren Affinität. CTLA-4-Signale in T-Zellen wirken meist inhibierend [3–5] und regulieren bereits aktivierte T-Lymphozyten während verschiedener Phasen der T-Zellantwort [1]. Interessanterweise korrelieren Polymorphismen im CTLA-4-Gen mit dem Schweregrad von Autoimmunerkrankungen (zusammengefasst in [1]). So erweist sich auch das Biological CTLA-4Ig (Abatacept) zur therapeutischen Manipulation der CD28/CTLA-4-Achse der T-Zellstimulation als vielversprechend bei der Therapie von chronischen Entzündungen [6]-wenn auch die zugrundeliegenden molekularen und zellulären Mechanismen erst teilweise verstanden sind [7]. CTLA-4-vermittelte intrazelluläre Kommunikation CTLA-4 bindet als Homodimer CD80-Dimere, so dass ein gitterartiges Netzwerk entsteht (Abbildung 1) [12–14]. Die Expression von CTLA-4 auf T-Zellen erreicht ihr Maximum zwei Tage nach der Stimulation, wenn die Hauptfunktionen von CTLA-4 stattfinden [1, 4, 15]. CTLA-4 wird über intrazelluläre Vesikel zur Zellmembran transportiert, wo es polarisiert an der immunologischen Synapse exprimiert wird [12, 16]. Diese streng kontrollierte Lokalisation an der Zellmembran repräsentiert einen Hauptkontrollpunkt zur Steuerung seiner inhibitorischen Funktion [4, 12, 17]. Für T-Helfer (Th)-Zellen ist bekannt, dass CTLA-4 T-Zellantworten inhibiert, wobei andere kostimulatorische Moleküle, beispielsweise das CTLA-4-Homolog CD28, T-Zellantworten aktivieren. So vermitteln die Homologe CD28 und CTLA-4 verschiedene Eigenschaften der T-Zelle: Signale über CD28 vermitteln IL-2 Produktion und T-Zellproliferation-Vorgänge, die durch CTLA-4 gegenreguliert werden, indem IL-2 Transkription und Zellzyklus inhibiert werden [1, 13, 14, 18, 19]. CD28-Signale führen zu einer verstärkten Stabilisierung der IL-2 mRNA und regulieren Bcl-xL hoch-Funktionen, die nicht durch CTLA-4 gegenreguliert werden [13, 18]. CD28 bindet PI3′Kinase (PI3′K), A T-Lymphozyten B Aktivierte T-Lymphozyten Abbildung 1 Signaltransduktion von CTLA-4 in T-Lymphozyten (modifiziert nach [1]). CTLA-4 wird erst 1-2 Tage nach T-Zellaktivierung hochreguliert [4] und unterbindet dann generell die Genexpression, um die T-Zellantwort zu beenden. (A) In unstimulierten T-Lymphozyten bindet CTLA-4 AP-50 und PP2A, wodurch seine Internalisierung vermittelt wird [8]. (B) Neue Erkenntnisse zeigen, dass die Rolle von CTLA-4, insbesondere auf aktivierten T-Lymphozyten komplex ist. Nach Stimulation der T-Lymphozyten bindet CTLA 4 intrazellulär PI3Kinase und, wahrscheinlich indirekt, Shp-2 [9]. Hier können die CTLA-4-Signale zwar die Genexpression abschalten, aber auch Enzyme aktivieren. Bereits aktivierte T-Lymphozyten werden durch CTLA-4 in ihrer Proliferation inhibiert [4]. CTLA-4-Signale induzieren auch PI3Kinase-abhängiges Überleben in bereits aktivierten T-Lymphozyten und CTLA-4-Signale vermitteln Migration entlang von Chemokingradienten [10, 11]. Überlebende Lymphozyten am Ende einer Immunantwort könnten Vorläuferzellen von Gedächtniszellen sein. Bei B-Lymphozyten ist die proximale Signaltransduktion von CTLA-4 gänzlich unbekannt. die Grb-2 Adaptoren und die Phosphatase PP2A, während CTLA-4 PI3′K und die Phosphatasen PP2A und Shp-2 bindet (zusammengefasst in [4, 13, 20]). Die Verknüpfung von CD28 und CTLA-4 zu verschiedenen Signalmediatoren zeigt, dass CTLA-4 weder einfach die CD28-Signalgebung reguliert noch einfach nur das TZR-Signal blockiert [1, 4, 13, 18]. Die Hauptfunktion von CD8 T-Zellen ist die zytotoxische Lyse entarteter und infizierter Zellen. CD8 T-Zellen exprimieren nach Aktivierung CTLA-4 häufiger auf ihrer Oberfläche als CD4 T-Zellen [20]. Zwar wird bei Erstkontakt mit dem Antigen weder ihre Proliferation noch Apoptose durch CTLA-4 gesteuert, jedoch ihre IFNγ-Produktion. Wir konnten zeigen, dass dies durch selektive Regulation des Transkriptionsfaktors Eomesodermin erfolgt [21]. Eomesodermin reguliert in CD8 T-Zellen sowohl IFNγ als auch Effektormoleküle der zytotoxischen Lyse. Die Expression Unauthenticated Download Date | 5/12/16 4:33 AM Hebel et al.: CTLA-4 und das neonatal Immunsystem 125 von T-bet, der zentrale Transkriptionsfaktor für das IFNγGen, bleibt dabei unverändert. Da CTLA-4 insbesondere die IFNγhigh-Produzenten inhibiert, liegt es nahe, dass CTLA-4 damit auch den Pool der Gedächtniszellen beeinflusst [22]. CTLA-4 bei der Differenzierung von T-Lymphozyten Die Beobachtung, dass Oberflächen-exprimiertes CTLA-4 ausschließlich auf bereits aktivierten Lymphozyten detektierbar ist, impliziert, dass es hier eine zentrale Rolle spielt [4]. Wir konnten zeigen, dass CTLA-4 entscheidende Funktionen auf bereits aktivierten T-Lymphozyten vermittelt: Unterbindung von T-Zellproliferation [4], Unterbindung von Effektorfunktionen [20, 21], Induktion von Überleben [10] und Migration von T-Lymphozyten [23]. Lymphozyten, die ein CTLA-4-Signal erhalten, werden in ihrer Proliferation gestoppt und überleben [1]. Lymphozyten, die kein CTLA-4 exprimieren, werden kurzzeitig verstärkt proliferieren, um fremde Pathogene zu beseitigen, dann aber sterben sie [10]. So wird sichergestellt, dass die Immunantwort gestoppt wird. Zudem wandern T-Lymphozyten, die ein CTLA-4-Signal bekommen, entlang von inflammatorischen und homeostatischen Chemokingradienten [11, 23]. Die am Ende einer Immunantwort überlebenden Lymphozyten, die zu Gedächtnisnischen wandern können, könnten potentielle Vorläuferzellen von Gedächtniszellen sein. Gedächtniszellen tragen entscheidend zum chronischen Krankheitsverlauf von autoimmunen Prozessen bei. Unsere neueren Erkenntnisse über biochemische und funktionelle Konsequenzen der CTLA-4-vermittelten Effekte bereits aktivierter Lymphozyten sind zusammen mit der bisher bekannten Signaltransduktion von CTLA-4 in Abbildung 1 zusammengefasst. Das Modell zeigt u.a. die von uns neu beschriebenen, unabhängigen Funktionen von CTLA-4 während der späten T-Zelldifferenzierung (Abbildung 1, graue Kästen). CTLA-4 induziert spezifische Migration von Th1 Lymphozyten Fast alle Antigen-erfahrenen Zellen, die nicht-lymphoides Gewebe infiltrieren, exprimieren den Chemokinrezeptor CCR5. Bisher wurde gezeigt, dass CTLA-4 die Oberflächenexpression von CCR5 auf Th1 Lymphozyten vermittelt. Membranexpression von CCR5 [24] lässt jedoch nicht auf Migration schließen, da Chemokinrezeptoren ihre Signale über G-Proteine weiterleiten, die oft im inaktiven Zustand vorliegen. Wir haben in-vitro-Migrationsexperimente etabliert, um die spezifische Migration von Th1 Lymphozyten in vitro zu analysieren [11, 23]. Hierbei wird das Endothel durch eine Membran substituiert. Wir konnten zum ersten Mal zeigen, dass Th1 Lymphozyten, deren CTLA-4 Gen inaktiviert wurde, sehr viel weniger entlang des Entzündungs-assoziierten Chemokins Mip1β (CCL4) migrieren als Th1 Lymphozyten mit intaktem CTLA-4-Gen. Wir konnten die Ergebnisse bestätigen, indem wir voraktivierten Th1 Lymphozyten entweder ein CTLA-4-Signal vermittelt haben oder nicht. Th1 Lymphozyten, die ein CTLA-4 Signal erhalten haben, migrieren wesentlich besser spezifisch entlang eines Mip1β-Gradienten als Lymphozyten, die kein CTLA-4-Signal erhalten haben. Die molekularen Mechanismen der durch CTLA-4 initiierten Differenzierung von T-Lymphozyten sind nicht geklärt. Wir konnten bisher zeigen, dass bei der CTLA-4-vermittelten Modulation von T-Zellfunktionen, wie Proliferation und Zytokinproduktion [3, 4, 18, 20], aber auch bei Aktivierungs-induziertem Zelltod (eine Form der Apoptose) CTLA-4-Signale differentiell in die Genexpression eingreifen, indem sie die Aktivierung zentraler Transkriptionsfaktoren wie NFAT, Eomesodermin, GATA3 und FKHRL1 (nicht aber cKrox, AP1 oder T-bet!) inhibieren. Vor allem konnten wir zeigen, dass CTLA-4 die Expression von Bcl-2 und des Chemokinrezeptors CCR5 induziert und die Enzymaktivität von PI3′Kinase aktiviert [10, 11, 24]. CTLA-4 bei der B-Zelldifferenzierung B-Zellfunktionen gehen weit über die Antikörperproduktion hinaus und reichen von Antigen-Präsentation für T-Lymphozyten über kostimulatorische Funktion durch Expression und Produktion von Oberflächenmolekülen bis hin zur Produktion von Zytokinen, welche die Differenzierung von B- und T-Lymphozyten beeinflussen. Ebenso wie die Aktivierung und Effektorfunktionen der T-Lymphoyzten werden auch Funktionen von B-Lymphozyten durch Kostimulation kontrolliert. Es können Moleküle, wie z.B. CD40 und CD30, kostimulatorische Signale für B-Lymphozyten weiterleiten, wenn diese durch ihre Liganden auf T-Lymphozyten stimuliert werden [19]. Unsere Daten implizieren, dass CTLA-4, neben der Beeinflussung dieser Moleküle, die Differenzierung und Effektorfunktion von B-Lymphozyten nach ihrer Aktivierung steuert [20, 25]. Unauthenticated Download Date | 5/12/16 4:33 AM 126 Hebel et al.: CTLA-4 und das neonatal Immunsystem Wir konnten erstmals Hinweise aus der Literatur [26, 27] eindeutig darstellen, die davon ausgingen, dass B-Lymphozyten CTLA-4 exprimieren: Wir konnten zeigen, dass mRNA von CTLA-4, intrazelluläres CTLA-4 und membranständiges CTLA-4 auch von aktivierten B-Lymphozyten exprimiert wird [25]. Die Oberflächenexpression hat ihr Maximum 48–72 h nach Aktivierung der B-Lymphozyten in B-/T-Zellkokulturen. Um die Funktion von CTLA-4 auf B-Lymphozyten zu verstehen, generierten wir chimäre Tiere, in denen durch die kombinierte Transplantation von Knochenmark aus B-Zell-defizienten Tieren mit Knochenmark aus CTLA-4-/- Tieren im Verhältnis 80% zu 20% Mäuse entstanden, in denen CTLA-4 nur in allen B-Lymphozyten deletiert ist [25]. Eine thymusabhängige in vivo Immunisierung dieser Chimären führte zu einer verstärkten IgM-Produktion nach primärer und sekundärer Immunisierung [25]. Das neonatale Immunsystem weist im B-Zellkompartment in erster Linie B1-Lymphozyten auf. Diese B1-Lymphozyten zeigen Eigenschaften von regulatorischen Zellen, d.h. sie können T-Zellantworten inhibieren. TLRStimulationen von murinen, neonatalen B-Lymphozyten hatten gezeigt, dass diese anti-inflammatorisch wirken [28]. Sie vermitteln die Suppression von T-Lymphozyten durch sezerniertes IL-10. Unsere Vorarbeiten zeigen, dass diese neonatalen B-Lymphozyten CTLA-4 exprimieren (Daten nicht gezeigt). Es liegt die Vermutung nahe, dass auch regulatorische B-Lymphozyten CTLA-4 verwenden könnten, so wie es für regulatorische T-Lymphozyten (Treg) gezeigt wurde (s.u.). CTLA-4 und Treg Zellen Eine wichtige Rolle bei der Unterdrückung unerwünschter Immunantworten spielen Treg Zellen. Natürliche Treg (nTreg) Zellen (CD4+CD25+FoxP3+) werden im Thymus gebildet. Die nTreg Zellen besitzen die Fähigkeit, in vivo Autoimmunerkrankungen zu verhindern und in vitro antigenspezifische T-Zell-Proliferation und die T-Zell-Proliferation als Reaktion auf allogene Zellen zu unterdrücken [29, 30]. Es konnten bei Patienten mit Autoimmunerkrankungen wie Typ-I-Diabetes, Lupus Erythematodes, Rheumatoider Arthritis oder Multipler Sklerose verminderte TregZell-Anzahlen oder sogar Treg-Zell-Funktionen gezeigt werden [31]. Die Treg Zellen supprimieren die Aktivierung und Expansion inflammatorischer T Zellen. Für diese Funktion bei Treg Zellen ist CTLA-4, das von diesen Zellen konstitutiv exprimiert wird, fundamental. So werden Treg Zellen von CTLA-4-/- Mäuse zwar verstärkt ausgebildet, können aber ihre regulatorische Funktion nicht ausführen [32]. Die immunsuppressive Wirkung von Treg Zellen kann über lösliche, pleiotrop wirkende Faktoren wie TGF-β und IL-10 vermittelt werden [29, 33]. Zusätzlich sind aber auch Wirkungsweisen durch direkten Zellkontakt beschrieben [29]. Die Bindung des CTLA-4-Moleküls von Treg Zellen mit seinen Liganden CD80 und CD86 (B7) induziert die Reduktion der CD80- und CD86-Expression dendritischer Zellen, u.a durch direkte Trans-Endozytose, so dass weniger CD28 Signale möglich sind [34]. Damit greifen Treg Zellen aktiv in den Prozess der T-Zelldifferenzierung ein und könnten so auch die Ausbildung von Gedächtniszellen beeinflussen. Erste Hinweise zeigen, dass nTreg Zellen über CTLA-4 die Ausbildung multifunktionaler Gedächtniszellen fördern [35]. Für die Treg Zellen ist klar gezeigt, dass eine CTLA4-Expression für sie essenziell ist, damit sie in vivo regulatorisch wirken können [32, 36]. Wir konnten zeigen, dass CTLA-4-/- Mäuse, die bereits im Alter von 3-5 Wochen sterben, zwar sehr viele Treg Zellen generieren, diese aber nicht kompetent sind. Die Treg Zellen bekommen allerdings ohne CTLA-4 wiederum keinen pro-entzündlichen Phänotyp [37]. Injektionen von CTLA-4 exprimierenden Treg Zellen in neonatale CTLA-4-/- Mäuse verlängerten ihr Leben dramatisch [32]. CTLA-4 Expression auf CD4 T-Lymphozyten von Neonaten Der Neonat steht mit der Geburt einer großen Herausforderung gegenüber: Sein Immunsystem muss nun zugleich mit einer Fülle neuer Antigene aus der Umwelt zurechtkommen und sie vom „Selbst“ unterscheiden. Zudem muss sein Immunsystem erkennen, wann es sinnvoll ist gegen fremde Antigene, wie im Falle von Bakterien zu reagieren. Damit der Organismus des Neonaten hier keinen Schaden durch überschießende eigene Immunantworten nimmt oder gar Gedächtniszellen generiert, die perspektivisch dem Organismus schaden, reagiert es hyporeaktiv (zusammengefasst in [38]). Um diesen Schutz zu gewährleisten sind regulatorische Mechanismen des Immunsystems aktiv am Werk. Unsere neuesten Studien zeigen, dass im frühkindlichen Immunsystem die Expression von CTLA-4 auf CD4 T-Lymphozyten altersabhängig reguliert wird (Abbildung 2). Mit Hilfe einer Echtzeit-PCR konnten wir zeigen, dass im Rahmen einer alternativen T-Zellstimulation über anti-CD3 und anti-CD28, CD4 T-Lymphozyten von Neonaten einen deutlich höheren Unauthenticated Download Date | 5/12/16 4:33 AM Hebel et al.: CTLA-4 und das neonatal Immunsystem 127 Relative CTLA-4 mRNA expression 6 4 Neonaten Zellen [41]. Beim Fetus reifen aus den hämatopoetischen Stammzellen in erster Linie Treg Zellen, beim Erwachsenen T-Lymphozyten mit Effektorpotenzial. Vermutlich liegen beide Entwicklungsmöglichkeiten beim Neonaten parallel vor – wann genau auf die des Erwachsenen umgestellt wird, ist noch nicht bekannt. Erwachsene Donor 1 Donor 1 Donor 2 Donor 2A Donor 3 Donor 2B 2 0 Schlussfolgerung 0 1 2 3 Zeit, Tage Abbildung 2 Neonatale T-Lymphozyten exprimieren verstärkt CTLA-4. Quantitative Echtzeit-PCR zur Untersuchung der Regulation der CTLA-4 mRNA Expression in den naiven CD4 T-Lymphozyten von Neonaten und Erwachsenen. Die naiven CD4 T-Lymphozyten wurden an Tag 0 mit anti-CD3- und anti-CD28-gekoppelten Microbeads aktiviert [39]. Dargestellt ist jeweils die zeitabhängige CTLA-4 mRNA Expression in CD4 T-Lymphozyten von drei Neonaten (schwarze Symbole) und von zwei Erwachsenen (weiße Symbole). A und B unterscheiden stimulierte T-Lymphozyten eines Donors aus reichhaltigen (A) oder weniger reichhaltigen (B) Kulturmedien. Ohne Buchstabenzusatz wurden die Stimulationen im reichhaltigen Kulturmedium wie bei A durchgeführt. Anstieg der CTLA-4 Expression im Vergleich zu Erwachsenen aufweisen. Dies veranschaulicht, dass sich das neonatale Immunsystem bei der Regulation seiner Lymphozyten des CTLA-4 Moleküls bedient. Tatsächlich ist aus Feten bekannt, dass sie bereits Treg Zellen ausbilden, die zudem verstärkt CTLA-4 auf ihrer Oberfläche tragen [38, 40]. Im Fetus liegen bis zu 12% der CD4 T-Lymphozyten als Treg Zellen vor, beim Erwachsenen sind es lediglich 5%. Je früher ein Kind geboren wird, desto höher ist der Anteil an Treg Zellen. Erklärt wird der Unterschied durch die ontogenetisch unterschiedliche Entwicklung der Treg Das inhibitorisch wirkende Kostimulationsmolekül CTLA-4 ist nicht nur auf T-Lymphozyten, sondern auch auf B-Lymphozyten exprimiert und relevant für CD4-, CD8- und humorale B-Zellantworten in vivo. Die bereits beschriebenen Auswirkungen von CTLA-4-Signalen auf aktivierte Th-Lymphozyten, wie Deaktivierung, Schutz vor Aktivierungs-induziertem Zelltod, Rekrutierung in den Pool der Gedächtniszellen, Regulation der Migration – zusammen mit der verstärkten Expression von CTLA-4 auf neonatalen Lymphozyten, legen eine zentrale Rolle bei der restriktiven Begrenzung von Immunreaktionen im Kleinkindalter und damit bei der Verhinderung von chronischen Immunpathologien nahe. Diese zentrale immunregulatorische Rolle von CTLA-4 bei frühkindlichen Immunantworten bietet einen neuen Ansatzpunkt für therapeutische Strategien, um bereits im Kindesalter den Weg für ein vor Autoimmunität und Allergie geschütztes Immunsystem zu ebnen. Danksagung: Die Arbeit wurde durch die Deutsche Forschungsgemeinschaft (Br 1860/6) gefördert. Interessenkonflikt: Die Autoren erklären, dass keine wirtschaftlichen oder persönlichen Interessenkonflikte bestehen. Eingang Marsch 5, 2013; akzeptanz Marsch 27, 2013 Literatur 1. Brunner-Weinzierl MC, Hoff H, Burmester GR. Multiple functions for CD28 and cytotoxic T lymphocyte antigen-4 during different phases of T cell responses: implications for arthritis and autoimmune diseases. Arthritis Res Ther 2004;6:45–54. 2. Chambers CA, Sullivan TJ, Allison JP. Lymphoproliferation in CTLA-4-deficient mice is mediated by costimulation-dependent activation of CD4+ T cells. Immunity 1997;7:885–95. 3. Chambers CA, Kuhns MS, Allison JP. Cytotoxic T lymphocyte antigen-4 (CTLA-4) regulates primary and secondary peptide- specific CD4(+) T cell responses. Proc Natl Acad Sci USA 1999;96:8603–8. 4. Maszyna F, Hoff H, Kunkel D, Radbruch A, Brunner-Weinzierl MC. Diversity of clonal T cell proliferation is mediated by differential expression of CD152 (CTLA-4) on the cell surface of activated individual T lymphocytes. J Immunol 2003;171: 3459–66. 5. Waterhouse P, Marengere LE, Mittrucker HW, Mak TW. CTLA-4, a negative regulator of T-lymphocyte activation. Immunol Rev 1996;153:183–7. Unauthenticated Download Date | 5/12/16 4:33 AM 128 Hebel et al.: CTLA-4 und das neonatal Immunsystem 6. Kormendy D, Hoff H, Hoff P, Broker BM, Burmester GR, BrunnerWeinzierl MC. Impact of the CTLA-4/CD28 axis on the processes of joint inflammation in rheumatoid arthritis. Arthritis Rheum 2013;65:81–7. 7. Hoff H, Knieke K, Cabail Z, Hirseland H, Vratsanos G, Burmester GR, et al. Surface CD152 (CTLA-4) expression and signaling dictates longevity of CD28null T cells. J Immunol 2009;182:5342–51. 8. Baroja ML, Vijayakrishnan L, Bettelli E, Darlington PJ, Chau TA, Ling V, et al. Inhibition of CTLA-4 function by the regulatory subunit of serine/threonine phosphatase 2A. J Immunol 2002;168:5070–8. 9. Marengere LE, Waterhouse P, Duncan GS, Mittrucker HW, Feng GS, Mak TW. Regulation of T cell receptor signaling by tyrosine phosphatase SYP association with CTLA-4. Science 1996;272:1170–3. 10. Pandiyan P, Gartner D, Soezeri O, Radbruch A, Schulze-Osthoff K, Brunner-Weinzierl MC. CD152 (CTLA-4) determines the unequal resistance of Th1 and Th2 cells against activationinduced cell death by a mechanism requiring PI3 kinase function. J Exp Med 2004;199:831–42. 11. Knieke K, Lingel H, Chamaon K, Brunner-Weinzierl MC. Migration of Th1 lymphocytes is regulated by CD152 (CTLA-4)mediated signaling via PI3 kinase-dependent Akt activation. PLoS One 2012;7:e31391. 12. Egen JG, Allison JP. Cytotoxic T lymphocyte antigen-4 accumulation in the immunological synapse is regulated by TCR signal strength. Immunity 2002;16:23–35. 13. Hoff H, Burmester GR, Brunner-Weinzierl MC. CD28 and CD152: competition and cooperation. Signal Transduction 2006;4:260–7. 14. Pentcheva-Hoang T, Egen JG, Wojnoonski K, Allison JP. B7-1 and B7-2 selectively recruit CTLA-4 and CD28 to the immunological synapse. Immunity 2004;21:401–13. 15. Allison JP, Chambers C, Hurwitz, Sullivan T, Boitel B, Fournier SA, et al. A role for CTLA-4-mediated inhibitory signals in peripheral T cell tolerance? Novartis Found Symp 1998;215:92–8. 16. Linsley PS, Bradshaw J, Greene J, Peach R, Bennett KL, Mittler RS. Intracellular trafficking of CTLA-4 and focal localization towards sites of TCR engagement. Immunity 1996;4:535–43. 17. Egen JG, Kuhns MS, Allison JP. CTLA-4: new insights into its biological function and use in tumor immunotherapy. Nat Immunol 2002;3:611–8. 18. Brunner MC, Chambers CA, Chan FK, Hanke J, Winoto A, Allison JP. CTLA-4-Mediated inhibition of early events of T cell proliferation. J Immunol 1999;162:5813–20. 19. Frauwirth KA, Thompson CB. Activation and inhibition of lymphocytes by costimulation. J Clin Invest 2002;109: 295–9. 20. Pandiyan P, Hegel JK, Krueger M, Quandt D, BrunnerWeinzierl MC. High IFN-gamma production of individual CD8 T lymphocytes is controlled by CD152 (CTLA-4). J Immunol 2007;178:2132–40. 21. Hegel JK, Knieke K, Kolar P, Reiner SL, Brunner-Weinzierl MC. CD152 (CTLA-4) regulates effector functions of CD8+ T lymphocytes by repressing Eomesodermin. Eur J Immunol 2009;39:883–93. 22. Seder RA, Darrah PA, Roederer M. T-cell quality in memory and protection: implications for vaccine design. Nat Rev Immunol 2008;8:247–58. 23. Knieke K, Hoff H, Maszyna F, Kolar P, Schrage A, Hamann A, et al. CD152 (CTLA-4) determines CD4 T cell migration in vitro and in vivo. PLoS One 2009;4:e5702. 24. Riley JL, Schlienger K, Blair PJ, Carreno B, Craighead N, Kim D, et al. Modulation of susceptibility to HIV-1 infection by the cytotoxic T lymphocyte antigen 4 costimulatory molecule. J Exp Med 2000;191:1987–97. 25. Quandt D, Hoff H, Rudolph M, Fillatreau S, BrunnerWeinzierl MC. A new role of CTLA-4 on B cells in thymus-dependent immune responses in vivo. J Immunol 2007;179:7316–24. 26. Pioli C, Gatta L, Ubaldi V, Doria G. Inhibition of IgG1 and IgE production by stimulation of the B cell CTLA-4 receptor. J Immunol 2000;165:5530–6. 27. Steiner K, Moosig F, Csernok E, Selleng K, Gross WL, Fleischer B, et al. Increased expression of CTLA-4 (CD152) by T and B lymphocytes in Wegener’s granulomatosis. Clin Exp Immunol 2001;126:143–50. 28. Walker WE, Goldstein DR. Neonatal B cells suppress innate toll-like receptor immune responses and modulate alloimmunity. J Immunol 2007; 179:1700–10. 29. Akdis M, Verhagen J, Taylor A, Karamloo F, Karagiannidis C, Crameri R, et al. Immune responses in healthy and allergic individuals are characterized by a fine balance between allergen-specific T regulatory 1 and T helper 2 cells. J Exp Med 2004;199:1567–75. 30. Brusko TM, Wasserfall CH, Clare-Salzler MJ, Schatz DA, Atkinson MA. Functional defects and the influence of age on the frequency of CD4+ CD25+ T-cells in type 1 diabetes. Diabetes 2005;54:1407–14. 31. Miyara M, Amoura Z, Parizot C, Badoual C, Dorgham K, Trad S, et al. Global natural regulatory T cell depletion in active systemic lupus erythematosus. J Immunol 2005;175:8392–400. 32. Kolar P, Knieke K, Hegel JK, Quandt D, Burmester GR, Hoff H, et al. CTLA-4 (CD152) controls homeostasis and suppressive capacity of regulatory T cells in mice. Arthritis Rheum 2009;60:123–32. 33. Wambre E, DeLong JH, James EA, LaFond RE, Robinson D, Kwok WW. Differentiation stage determines pathologic and protective allergen-specific CD4+ T-cell outcomes during specific immunotherapy. J Allergy Clin Immunol 2012;129:544–51. 34. Qureshi OS, Zheng Y, Nakamura K, Attridge K, Manzotti C, Schmidt EM, et al. Trans-endocytosis of CD80 and CD86: a molecular basis for the cell-extrinsic function of CTLA-4. Science 2011;332:600–3. 35. Rudolph M, Hebel K, Miyamura Y, Maverakis E, BrunnerWeinzierl MC. Blockade of CTLA-4 decreases the generation of multifunctional memory CD4+ T cells in vivo. J Immunol 2011;186:5580–9. 36. Wing K, Onishi Y, Prieto-Martin P, Yamaguchi T, Miyara M, Fehervari Z, et al. CTLA-4 control over Foxp3+ regulatory T cell function. Science 2008;322:271–5. 37. Kolar P, Hoff H, Maschmeyer P, Burmester GR, BrunnerWeinzierl MC. CTLA-4 (CD152) blockade does not cause a pro-inflammatory cytokine profile in regulatory T cells. Clin Exp Rheumatol 2011;29:254–60. Unauthenticated Download Date | 5/12/16 4:33 AM Hebel et al.: CTLA-4 und das neonatal Immunsystem 129 38. Gieseler S, Brunner Weinzierl MC. Kinder zeigen erhöhtes Infektionsrisiko unter Intensivtherapie. Deutscher Ärzte-Verlag DIVI 2012;3:64–7. 39. Hebel K, Rudolph M, Kosak B, Chang HD, Butzmann J, BrunnerWeinzierl MC. IL-1β and TGF-β act antagonistically in induction and differentially in propagation of human proinflammatory precursor CD4+ T cells. J Immunol 2011;187:5627–35. 40. Darrasse-Jeze G, Marodon G, Salomon BL, Catala M, Klatzmann D. Ontogeny of CD4+CD25+ regulatory/suppressor T cells in human fetuses. Blood 2005;105:4715–21. 41. Mold JE, Venkatasubrahmanyam S, Burt TD, Michaelsson J, Rivera JM, Galkina SA, et al. Fetal and adult hematopoietic stem cells give rise to distinct T cell lineages in humans. Science 2010;330:1695–9. Unauthenticated Download Date | 5/12/16 4:33 AM