Dokumentieren 1465209
Werbung

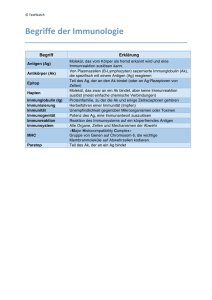
Immunbiologie Vorlesung 9 - 12.01.2005 - Seite 22 seelensammler.de/uni Komplementsystem Das Komplementsystem gehört zum angeborenen Immunsystem, es kann sehr rasch aktiviert werden. Experimente von Charles Bordet (Nobellpreis 1919) 1 - Serum mit Antikörpern gegen Bakterien. Bei Zugabe von Bakterien >> Lyse (Zerstörung der Zellwand > Störung des osmotischen Gleichgewichts > Zelle schwillt an > Zelle stirbt) der Bakterien. 2 - Serum mit Antikörpern gegen Bakterien - wir erhitzt (56°C) Bei Zugabe von Bakterien überleben die Bakterien jetzt. >> es gibt hitzeempfindliche Teile im Serum. Immunglobuline sind nicht hitzelabil, es gibt also eine zweite Komponente die hitzelabil ist und die lytische Funktion des Antikörpers unterstützt. Diese Komponente wurde Komplement genannt. Komplement ist icht ein Protein, sondern ein System von verschiedenen Proteinen, die miteinander interagieren. Biologische Funktionen des Komplementsystems - Zytolyse: Komplementkomponenten polymerisieren und bilden eine Pore > Plasmamembran wird zerstört >> osmotische Lyse´ - Opsonisation: Komplementproteine (Opsonine) binden an körperfremde Partikel - phagozytische Leukozyten erkennen dadurch körperfremde Partikel leichter (ähnlich wie bei AK). Diese haben Rezeptoren für Opsonine. Opsonine fördern die Phagozyten von körperfremden Partikeln. - Aktivierung von Entzündungsreaktionen: Proteolytische Fragmente von Komplementproteinen wirken auf Blutgefäße und inflammatorische Leukozyten - Komplementproteine binden an Immunkomplexe und werden mittels Phagozyten entfernt. (Damit Kapillargefäße nicht verstopft werden) Eigenschaften des Komplementsystems - Sequentielle Zymogenaktivierung (Zymogen wird aktiv wenn es gespalten wird) Das Komplementsystem enthält Proteolytische Enzyme, die nur dann aktiv werden, wenn sie proteolytisch gespalten werden (werden als Zymogene bezeichnet). - Proteolytische Kaskade: Sorgt für Signalverstärkung. Jeeds aktivierte enzym aktiviert eine Vielzahl anderer - Proteine des Komplementsystems sind im Blutplasma vorhanden, aber nicht aktiv. Die Aktivierung soll nur in eng begrenzten Bereichen stattfinden. Man unterscheidet zwei Wege: Komplement - Klassischer Weg: Immunglobulin bindet an Antigen Antikörper > Aktivierung des Komplementsystems, bindet an AK Bakterium - Alternativer Weg: Wurde später entdeckt. Bakterium Proteine des Komplementsystems binden direkt an Mikroben. Komplement - Das Komplementsystem kann andere Zellen zerstören. Dies wird durch lösliche und Membrangebundene Proteine reguliert. Dadurch wird: - die Komplementeaktivierung nach einem Reiz begrenzt oder gestoppt - die Aktivierung des Komplementsystems verhindert, wenn keine Mikroben vorhanden sind Immunbiologie Vorlesung 9 - 12.01.2005 - Seite 23 seelensammler.de/uni Komplementkaskade - Übersicht Proteine: C3 - wichtigstes Protein der Komplementaktivierung - C steht für Komplement, die Zahl zeigt die Reihenfolge der Entdeckung. Wird durch C3-Konvertase in C3a und C3b gespalten. Dabei steht das b für den größeren der beiden Teile, a für den kleineren (nur bei C2 umgekehrt). C3-Konvertase ist ein Komplementproteinkomplex aus C4b2a. C3b bindet an der C3-Konvertase und bildet C5-Konvertase (C4b2a3b). Aktivierte Komplexe werden mit einem Querstrich gekennzeichnet. C5-Konvertase spaltet C in C5a und C5b und leitet terminelle Ereignisse ein. Bei den letzten Schritten kommt es zukeinen proteolytischen Vorgängen, sondern nur zur Anlagerung von Komplementproteinen C6, C7, C8 und C9. Diese bilden eine Pore in der Membran - Membrane attack complex - MAC. Mehr zum klassischen Weg Ist einer der wichtigsten Effektormechanismen der humoralen Immunantwort (humorale Immunantwort = Abgabe ins Blutplasma). C1 - bindet an Fc Region der Antikörper. Es muß jedoch mindestens an zwei Fc Regionen binden, kann also nicht an freie Antikörpermoleküle binden. Am besten für eine Bindung eignet sich daher IgM (Pentamer). Bindet das IgM an einem Antigen, verändert es seine Form - erst dann kann das C1 daran binden. Protein C1q (=Erkennungsuntereinheit) bindet am Fc Teil des Immunglobulins. Zwei Serin-Proteasen C1r und C1 s bilden ein Tetramer C1s-C1r-C1r-C1s Autolytische Aktivierung von C1 C1r spaltet C1s >> C1s spaltet C4 und C2 Die C1 Funktion wird durch einen C1 Inhibitor reguliert (gehört zur Serpin Familie - SERinProtease-INhibitor). Dieser verhindert die C1 Aktivierung durch schwache Komplementaktivatoren. C4 - ist das zweite Serumprotein das beim klassischen Weg aktiviert wird. Wird von C1s gespalten >> C4a und C4b C4 bindet kovalent an die Zelloberfläche oder an Ig Molekül (starek Bindung) C2 - ist das dritte Serumprotein das beim klassischen Weg beteiligt ist. C2 bindet an C4b und wird dann von C1s gespalten >> C4b2a (C3 Konvertase) - bindet und spaltet C3 C3 - ist das vierte Serumprotein - bindet an C4b und wird von C2a gespalten Immunbiologie Vorlesung 9 - 12.01.2005 - Seite 24 seelensammler.de/uni MAC - C5b bindet an der Zelloberfläche. C5b bindet in der Folge C6. Nach Bindung von C7 und C5b,6 Komplex wird Komplex lipophil und wird in die Membran eingebaut. Anlagerung von C8 stabilisiert Komplex, kann Mikroorganismus lysieren. Anlagerung von C4 verstärkt lytische Aktivität des MAC. MAC ist permeabel für Ionen, Wasser und kleine lösliche Moleküle, nicht jedoch für große Moleküle (z.B. Proteine). Wasser strömt in die Zelle – osmotische Lyse. - Regulatorische Proteine, die die Bindung MAC verhindern: > CD59: bindet C8 und C9, dh kann kein MAC gebildet werden. > S-Protein bindet C5b,6,7 Komplex und verhindert die Einlagerung in die Membran > Regulatorische Proteine verindern, dass Körpereigene Zellen zerstört werden, die in der Nähe von aktivierten Mikroben liegen.