Proteinfaltung - Max-Planck
Werbung

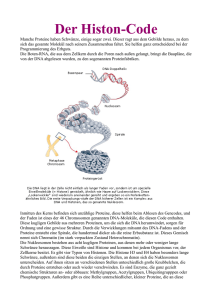
Proteinfaltung Origami in der Zelle O hne Proteine läuft nichts. Jede unserer Körperzellen enthält Tausende dieser Ei­ weißstoffe, die ebenso viel­ fältige wie lebensnotwendige Aufgaben erfüllen: Sie ermöglichen unzäh­ lige chemische Reaktionen, geben den Zel­ len Halt und Form und vermitteln unter­ schiedlichste Signale. Jedes Protein besteht aus durchschnittlich 100 bis 500 Amino­ säuren, die zu einer Kette verknüpft sind. Funktionsfähig wird eine neu hergestellte Aminosäurekette aber erst, wenn sie sich zu einer komplexen und hochspezifischen dreidimensionalen Gestalt gefaltet hat1 – auf den ersten Blick eine unlösbar schei­ nende Aufgabe, da jede Kette Abertausen­ de verschiedener Formen bilden kann. AusgeKlügelte FAltung Die meisten Proteine nehmen dennoch schnell und effizient die richtige Gestalt an. Wie gelingt das? Des Rätsels Lösung liegt in den Eigenschaften der verschiede­ nen Aminosäuren eines Proteins: Einige von ihnen lagern sich gern an Wassermo­ leküle an, andere stoßen diese eher ab. Die beiden Grundtypen kommen in den ein­ zelnen Abschnitten der Aminosäurekette unterschiedlich häufig vor. Sie bilden den Motor, der den Faltungsprozess antreibt: Wasser abweisende Aminosäuren haften aneinander und bilden einen kompakten Kern, während sich die anderen eher an der Proteinoberfläche anordnen. Das sorgt dafür, dass der Eiweißstoff im wasserhalti­ gen Körperinneren als stabiles und biolo­ gisch aktives Molekül seine Aufgabe erfül­ len kann. Bei größeren Proteinen falten sich unterschiedliche Teile erst getrennt voneinander zu so genannten Domänen, die sich dann ihrerseits aneinanderlagern. Für diese schwierige und komplexe Aufgabe hat die Zelle ein eigenes System zur Qualitätskontrolle entwickelt2,3. In den späten 1980er Jahren fanden Forscher spezialisierte Proteine, welche die falsche Faltung von Aminosäureketten vermeiden helfen. Diese molekularen Chaperone (»Anstandsdamen«) binden die Proteine und schützen sie, solange sie noch nicht fertig oder nicht richtig gefaltet sind. Fehler trotz Kontrolle Eine spezielle Gruppe solcher Helfermole­ küle, die so genannten Chaperonine, erin­ nern an kleine Treteimer mit einem Loch im Boden. Sie nehmen ungefaltete Protei­ ne auf, die darin ungestört ihre korrekte dreidimensionale Form einnehmen kön­ nen. Danach öffnet sich der Deckel des Chaperonins, das fertige Molekül kommt heraus und kann seine Arbeit aufnehmen. Zusätzlich besitzt jede Zelle ein Proteasom: eine Art Recyclingzentrum, das nicht benö­ tigte oder falsch gefaltete Eiweißstoffe in kleine Fragmente zerlegt, aus denen dann wieder neue Proteine entstehen können. Trotz dieser höchst aufwändigen Quali­ tätskontrolle entstehen immer wieder auch falsch gefaltete Proteine – in der Regel aus einem von zwei Gründen: Entweder bildet sich bereits von vornherein eine fehlerhaf­ te Aminosäurekette, oder ein normales Pro­ tein verliert später wieder seine korrekte Ge­ stalt. Beispiele für die erste Möglichkeit sind Mutationen in dem Gen für den Tumor­ suppressor p53, der beschädigte DNA­ Abschnitte repariert. Sie führen zu falsch gefaltetem, funktionsunfähigem p53­Prote­ in, wodurch möglicherweise Krebs entsteht. Auch der Mukoviszidose liegt ein fehlerhaft gefaltetes Eiweiß zu Grunde, das sich durch eine kritische Mutation bildet. Falsch geformte Proteine können nicht nur ihre biologischen Aufgaben nicht mehr erfüllen, sondern klumpen oft auch zu unlöslichen Aggregaten zusammen, die S tudien am Max-Planck-Institut für Biochemie erlauben einblicke in die Mechanismen, mit denen molekulare chaperone den Aufbau toxischer Proteinaggregate in zellen verhindern. diese 32 Forschungsperspektiven der Max-Planck-Gesellschaft | 2010+ sich in der Zelle oder ihrer unmittelbaren Umgebung ansammeln. Derartige Abfall­ produkte dürften das reibungslose Funk­ tionieren der Zelle beeinträchtigen und diese schädigen – unter Umständen mit dramatischen Folgen. Nach neuen Er­ kenntnissen spielt das vermutlich so ver­ ursachte Absterben von Nervenzellen eine entscheidende Rolle bei vielen altersab­ hängigen Krankheiten des Nervensystems, etwa bei Chorea Huntington (»erblichem Veitstanz«) und der Alzheimerdemenz4,5. Fluch des Alterns Warum treten solche Erkrankungen vor al­ lem bei älteren Menschen auf? Laut einer Untersuchung von 2007 scheint die Qua­ litätskontrolle mit höherem Lebensalter häufiger zu versagen. Dadurch sammeln sich allmählich immer mehr falsch gefal­ tete, potenziell schädigende Proteine an6. Die Gehirne von Patienten mit Alzheimer­ demenz etwa sind übersät mit charakteris­ tischen Plaques – Aggregaten aus so ge­ nannten Beta­Amyloid­Peptiden –, die sich um Nervenzellen herum anhäufen. Auch wenn noch nicht geklärt ist, ob die Plaques Ursache oder Folge der Krankheit sind – sie dürften für das massenhafte Absterben der Neurone sowie den Verlust des Gedächt­ nisses der Patienten zumindest mitverant­ wortlich sein. Die Erkenntnis, dass falsche Proteinfal­ tung anscheinend gleich mehreren alters­ bedingten Krankheiten zu Grunde liegt, bietet die Chance auf einen einheitlichen Therapieansatz für all diese Störungen. In Zellkulturen konnten Forscher bereits die Produktion molekularer Chaperone ankur­ beln, indem sie bestimmte Wirkstoffe hin­ zugaben. So verhinderten sie, dass sich in den Zellen unlösliche Huntingtin­Aggre­ gate bildeten – jene Proteinklumpen, die Chorea Huntington auslösen7. bemerkenswerte eigenschaft der chaperone kann bei der entwicklung neuer strategien im Kampf gegen neurodegenerative erkrankungen helfen (Behrends, C. et al., Mol. Cell 23, 887 – 897, 2006). BIOLOGIE UND MEDIZIN Proteine sind kettenartige eiweiß-riesenmoleküle, die sich zu komplizierten dreidimensionalen Formen falten. dieser Prozess durchläuft eine Qualitätskontrolle, kann aber dennoch fehlschlagen. Falsch gefaltete Proteine können sich zu Klumpen zusammenlagern, die für die zelle gefährlich werden. Bei verschiedenen altersbedingten Krankheiten wie etwa der Alzheimerdemenz sammeln sich solche Aggregate an. neue therapieansätze zielen darauf ab, die Proteinablagerungen abzubauen oder ihre entstehung zu verhindern. Bild 1 | Röntgenkristallographische Darstellung eines dreidimensional gefalteten Maltosebindungsproteins Zwar verstehen wir die grundlegenden Vorgänge bei der Proteinfaltung schon recht gut, doch gibt es noch viele wichtige Details zu erforschen und zentrale Fragen zu klären: Wie funktioniert das Qualitäts­ kontrollsystem im Detail und warum be­ ginnt es im Alter zu versagen? Weshalb sind fehlgefaltete Proteine für die Zelle über­ haupt so schädlich? Wie sieht ihre Struktur aus und wie interagieren sie mit anderen Molekülen? Und schließlich: Wie können wir toxische Proteinaggregate entfernen oder gar ihr Entstehen verhindern? eFFeKtIVere therAPIen Für die weitere Erforschung der Proteinfal­ tung gilt es nun, Wissen aus ganz unter­ schiedlichen Disziplinen zusammenzu­ bringen. So können Wissenschaftler mit Computersimulationen und biophysikali­ schen Methoden die molekularen Eigen­ schaften der gefährlichen Proteinaggregate und ihrer Zwischenstadien erkunden8. Wie toxisch solche Aggregate im Einzelfall tat­ sächlich wirken, lässt sich mit Hilfe von Gewebekulturen und Tierexperimenten untersuchen. Dank der so genannten quantitativen Proteomik können Biowissenschaftler auch herausfinden, wo die falsch gefalteten Pro­ teine in der Zelle angreifen und über wel­ che Mechanismen sie diese schädigen. Die Erforschung des Qualitätskontrollsystems schließlich sollte Aufschlüsse über die Vor­ gänge beim Altern und die damit verbun­ denen Krankheiten liefern. Forscher und Mediziner hoffen, auf dieser Grundlage effektivere Therapien zu entwickeln9,10. Dazu arbeiten sie derzeit an Strategien, um entweder die Protein­ aggregation aufzuhalten oder aber die zell­ eigenen Abwehrmechanismen zu akti­ vieren – also die Chaperone sowie pro­ teinabbauende Enzyme. Unter anderem durchforsten Experten riesige Molekülban­ ken, um geeignete Substanzen zu finden. Das Ziel: altersbedingte, bislang unheilba­ re Krankheiten kurieren – und so ein län­ geres Leben in Gesundheit ermöglichen. ➟ Bibliographie siehe Seiten 38 und 39 Bild 2 | Schema der Proteinfaltung Bild 3 | Struktur eines Chaperoninproteins 2010+ | Forschungsperspektiven der Max-Planck-Gesellschaft 33