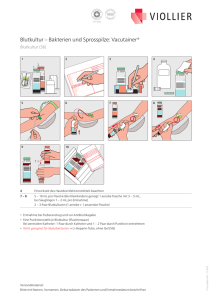
MUT 2016-BIOGM-LIVRET BLOOD.indd
Werbung

BLUTKULTUR EINE WICHTIGE UNTERSUCHUNG ZUR DIAGNOSTIK VON INFEKTIONEN DER BLUTBAHN Einführung Unserer besonderer Dank gilt Dr. Susan M. Novak-Weekley Ph.D., D(ABMM) Director of Microbiology, Kaiser Permanente, SCPMG Regional Reference Laboratories North Hollywood, CA, USA Wm. Michael Dunne, Jr. Ph.D. D(ABMM), F(AAM, CCM, IDSA, PIDJ) Vice President R&D North America, bioMerieux, Inc. Durham, NC, USA Adjunct Professor of Pathology & Immunology, Washington University School of Medicine, St. Louis, MO, USA Adjunct Professor of Pediatrics, Duke University School of Medicine, Durham, NC, USA für ihre wertvolle Mitarbeit und sorgfältige Prüfung dieses Leitfadens. “…der diagnostische Nachweis einer Bakteriämie und Fungämie gehört zu den wichtigsten Aufgaben klinisch mikrobiologischer Laboratorien... Eine positive Blutkultur weist darauf hin oder bestätigt, dass die Krankheit des Patienten durch eine Infektion ausgelöst wurde. Darüber hinaus erkennt sie den ursächlichen Erreger und ermöglicht eine Empfindlichkeitsprüfung zur Optimierung der Therapie.“ (3) Der mikrobiologische Nachweis einer Bakteriämie und Fungämie mit Hilfe der Blutkultur gehört zu den einfachsten und häufigsten Untersuchungen, die durchgeführt werden, um die Ursache von Infektionen in der Blutbahn festzustellen. Eine schnelle und präzise Identifizierung der pathogenen Bakterien oder Pilze im Blutkreislauf liefert lebenswichtige klinische Informationen, die für die Diagnostik und Behandlung der Sepsis notwendig sind. Sepsis ist ein komplexer Entzündungsprozess, der als eine weltweite Hauptursache für Morbidität und Mortalität noch immer weitgehend unterschätzt wird. Die jährlich Zahl an Sepsisfällen wird auf 19 Millionen geschätzt (4) und daraus folgernd fordert die Sepsis alle 3-4 Sekunden ein Todesopfer. (5) Eine frühzeitige Diagnostik und eine angemessene Therapie sind für die Verbesserung der Überlebensrate bei Sepsis-Patienten von entscheidender Bedeutung. Die Überlebenschancen sinken drastisch, je länger sich der Therapiebeginn verzögert. Wenn ein Patient innerhalb der ersten Stunde nach der Diagnose eine adäquate antimikrobielle Therapie erhält, beträgt seine Überlebenschance nahezu 80 %. Mit jeder weiteren Stunde sinkt diese um 7,6 %. Wenn der Patient jedoch anfänglich eine inadäquate Antibiotikatherapie erhält, sind seine Überlebenschancen fünfmal geringer. (6) Ziel dieses Leitfadens ist: lw ichtige Fragen zur Blutkultur zu beantworten lp raktische Empfehlungen für den routinemäßigen Umgang mit Blutkulturen zu geben le ine illustrierte schrittweise Anleitung zur Blutentnahme nach den Richtlinien der “Guten Laborpraxis” anzubieten. Dieser Leitfaden soll Ärzte, Pflegekräfte, Laborpersonal und Fachkräfte in Gesundheitseinrichtungen unterstützen und hilfreiche Informationen für den Umgang mit Blutkulturen geben. 1 Definitionen Bakteriämie: die Anwesenheit von Bakterien im Blut. Die Bakteriämie kann transient, kontinuierlich oder intermittierend sein. Inhalt Blutkultur: Blutprobe, die zur Anzucht von Mikroorganismen in Blutkulturflaschen gegeben wird. Sie ermöglicht den Nachweis von potenziellen Krankheitserregern bei Patienten mit Verdacht auf eine Bakteriämie oder Fungämie. l Was ist eine Blutkultur? 4 l Blutkulturreihen: eine Gruppe von zeitlich zusammenhängenden Blutkulturen, die abgenommen werden, um festzustellen, ob bei einem Patient eine Bakteriämie oder eine Fungämie vorliegt. W arum sind Blutkulturen wichtig? 4 l Wann sollte eine Blutkultur durchgeführt werden? 5 Blutkulturpaar: die Kombination von Blutkulturflaschen (eine aerobe und eine anaerobe Flasche), in die eine einzelne Blutprobe überimpft wird. l Welches Blutvolumen sollte entnommen werden? 6 Fungämie: die Anwesenheit von Pilzen im Blut. l Wie viele Blutkultur-Sets sollten angelegt werden? 8 l W elche Medien sollen verwendet werden? 10 l Entnahmezeitpunkt 11 l Wie werden Blutkulturen entnommen 12 l Welche Inkubationszeiten werden empfohlen? 14 l Kontaminante oder pathogener Erreger? 15 l Spezialthema: Infektiöse Endokarditis 18 l Verarbeitung von positiven Blutkulturen 20 l Interpretation der Ergebnisse 22 l Richtlinien Blutkultur/Sepsis 24 l Literatur 26 l Empfehlungen zur Blutentnahme 30 Infektion der Blutbahn: eine mit einer Bakteriämie oder Fungämie verbundene Infektion. Kontaminante: ein aus der Blutkultur isolierter Mikroorganismus, der während der Probennahme oder Probenverarbeitung in die Blutkultur eingeführt wurde und nicht als verantwortlicher Erreger der Infektion der Blutbahn gilt (das heißt, die Isolate waren zum Zeitpunkt der Blutentnahme nicht im Blut des Patienten vorhanden). Kontamination: die Anwesenheit von Mikroorganismen in der Flasche, welche während der Blutentnahme in die Blutkultur gelangten, tatsächlich jedoch nicht im Blutkreislauf des Patienten vorhanden waren. Sepsis: eine lebensbedrohliche Organfehlfunktion, die durch eine dysregulierte Reaktion des Wirts auf die Infektion hervorgerufen wird. (1) Septikämie: klinisches Syndrom, das durch Fieber, Schüttelfrost, Unwohlsein, Tachykardie, etc. charakterisiert wird, wenn die zirkulierenden Bakterien sich schneller vermehren, als dass sie durch die Phagozytose eliminiert werden. (2) Septische Episode: eine Episode der Sepsis oder des septischen Schocks, in der eine Blutkultur oder eine Blutkulturreihe abgenommen wird. Septischer Schock: ein septischer Zustand, bei dem die zirkulatorischen und zellulären/metabolischen Störungen so hoch sind, dass sich die Mortalität deutlich erhöht. (1) Source: Wayne, P.A. Principles and procedures for Blood Cultures; Approved Guideline, CLSI document M47-A. Clinical and Laboratory Standards Institute (CLSI); 2007 unless otherwise specified. 2 3 Was ist eine Blutkultur? Der Beginn einer angemessenen Antibiotikatherapie innerhalb der ersten 24 – 48 Stunden führt zu: (10-14) Eine Blutkultur ist eine mikrobiologische Untersuchung von Blut, um festzustellen, ob infektiöse Mikroorganismen (Bakterien oder Pilze) im Blutkreislauf des Patienten vorhanden sind. Hierfür wird dem Patienten Blut entnommen und in Flaschen überimpft, die ein Nährmedium enthalten. • einer Senkung der infektionsbedingten Mortalität (20 – 30 %) • einer schnelleren Genesung und einer kürzeren Verweildauer im Krankenhaus • geringeren Nebenwirkungen • einer Senkung des Risikos von Antibiotikaresistenz • einer Kostenreduktion (Verweildauer, Therapie, Diagnostik) • zum Nachweis von Mikroorganismen im Blutkreislauf • zur Identifizierung der mikrobiologischen Krankheitserreger im Blutkreislauf DIE 3 • als Hilfsmittel zur Feststellung der WICHTIGSTEN ZIELE Ursache einer Infektion EINER BLUTKUTLUR *: (z. B. Endokarditis) • zum Nachweis des verantwortlichen • Bestätigung einer infektiösen Genese Erregers, um durch eine • Identifizierung des Krankheitserregers anschließende Empfindlichkeitsprüfung • Empfehlungen zur die Antibiotikatherapie zu optimieren Antibiotikatherapie * Gemäß den Richtlinien der ESCMID (European Society of Clinical Microbiology and Infectious Diseases – Europäische Gesellschaft für klinische Mikrobiologie und Infektionskrankheiten), 2012.(7) Warum sind Blutkulturen wichtig? Die Blutkultur ist das am meisten verwendete diagnostische Werkzeug zum Nachweis einer Bakteriämie und Fungämie. Sie ist das wichtigste Hilfsmittel zur Diagnostik der Ätiologie von Infektionen der Blutbahn oder einer Sepsis und hat entscheidende Auswirkungen auf die Behandlung von Patienten mit diesen Erkrankungen. Eine positive Blutkultur gibt Hinweise oder bestätigt die infektiöse Ursache der Erkrankung des Patienten.(3) Sie weist den verantwortlichen Erreger nach, für den eine Empfindlichkeitsprüfung durchgeführt werden kann, um die Antibiotikatherapie zu optimieren.(3) Die Sepsis ist eine der größten Herausforderungen in der Intensivmedizin. Eine frühzeitige Diagnose ist einer der entscheidendsten Faktoren für das Überleben des Patienten. Eine frühzeitige Identifizierung der Erreger im Blut kann ein entscheidender Schritt zur Sicherstellung der richtigen Antibiotikatherapie sein und der möglichst frühzeitige Start einer effektiven Antibiotikatherapie kann entscheidende Auswirkungen auf den Behandlungserfolg der Erkrankung haben. (8, 9) 4 Abbildung 1: Eine schnelle effiziente Antibiotikatherapie erhöht die Überlebenschancen Nach Kumar A, et al. Crit Care Med. 2006;34(6):1589-96. (15) Gesamte Patienten (%) Blutkulturen werden verwendet: 100 Überlebensrate der Patienten (%) Patienten mit effizienter Antibiotikatherapie 80 60 40 20 0 0 Stunden 1 2 3 4 5 6 9 12 24 36 Zeit bis zur Verabreichung der Antibiotikatherapie Wann sollte eine Blutkultur durchgeführt werden? Blutkulturen sollten immer durchgeführt werden, wenn der Verdacht auf eine Infektion in der Blutbahn oder eine Sepsis besteht. Klinische Symptome, die den Verdacht auf eine Infektion in der Blutbahn nahelegen: • unspezifisches Fieber (≥ 38 °C) oder Hypothermie (≤ 36 °C) • Schock, Schüttelfrost, Rigor • schwere lokale Infektionen (Meningitis, Endokarditis, Pneumonie, Pyelonephritis, intra-abdominale Entzündung…). • abnormal erhöhte Herzfrequenz • niedriger oder hoher Blutdruck • erhöhte Atemfrequenz 5 Entnahmezeitpunkt einer Blutkultur: • so früh wie möglich nach Auftreten der klinischen Symptome; • idealerweise vor Beginn der antimikrobiellen Therapie (16). Wenn der Patient bereits eine Antibiotikatherapie erhält, kann die Wiederfindung von Mikroorganismen erhöht werden, wenn das Blut unmittelbar vor Verabreichung der nächsten Antibiotikagabe abgenommen wird und das Blut in Flaschen inokuliert wird, die spezielle Medien zur antimikrobiellen Neutralisation enthalten. Welches Blutvolumen sollte entnommen werden? Die optimale Wiederfindungsrate von Bakterien und Pilzen hängt von der richtigen Blutmenge ab, mit der die Blutkulturflaschen beimpft werden. Die Entnahme einer ausreichenden Blutmenge verbessert den Nachweis pathogener Bakterien oder Pilze, die nur in geringen Mengen vorhanden sind. Dies ist insbesondere wichtig, wenn der Verdacht auf eine endovaskuläre Infektion (wie beispielsweise eine Endokarditis) vorliegt. Die für jedes Blutkulturset erhaltene Blutmenge ist die wichtigste Einflussgröße bei der Wiederfindung von Mikroorganismen bei Patienten mit einer Infektion in der Blutbahn. (17, 18) Die Blutkulturflaschen dienen dazu, das empfohlene Verhältnis Blut : Bouillon (1 : 5 bis 1 : 10) mit dem optimalem Blutvolumen zu beimpfen. Kommerzielle kontinuierlich überwachte Blutkultursysteme können ein kleineres Blut-Bouillon Verhältnis (< 1 : 5) verwenden, durch die Zugabe von Natriumpolyanetholsulfonat (SPS), welches im Blut vorhandene inhibierende Substanzen inaktiviert. (3) * Erwachsene Für Erwachsene wird eine Blutmenge von 20 bis 30 ml pro Blutkulturset empfohlen. (3, 16) Da jedes Set aus einer aeroben und einer anaeroben Flasche besteht, sollte jede Flasche mit zirka 10 ml Blut beimpft werden. Dieses Volumen wird empfohlen, um die Wiederfindung von Krankheitserregern zu optimieren, deren Konzentration bei einer Bakteriämie/Fungämie oft weniger als 1 Kolonie-bildende Einheit (KBE) pro ml Blut beträgt. 6 Weiterhin wird allgemein empfohlen, dass zwei oder drei Blutkultursets (zwei Flaschen pro Set) pro septische Episode verwendet werden. Dies bedeutet, dass für den erwachsenen Patienten 40 bis 60 ml Blut für 4 bis 6 Flaschen abgenommen werden, die mit 10 ml pro Flasche beimpft werden. Mit jedem zusätzlichen Milliliter Blut erhöht sich in direktem Verhältnis die Anzahl der wiedergefundenen Mikroorganismen im Blut von Erwachsenen bis zu 30 ml. (19) Diese Korrelation bezieht sich auf die geringe Anzahl an KBE in einem Milliliter Erwachsenenblut. (3) * Pädiatrie Die optimale Blutmenge für Säuglinge und Kinder ist weniger gut beschrieben. Verfügbare Daten zeigen jedoch, dass die Wiederfindung der Krankheitserreger ebenfalls in direktem Verhältnis zur kultivierten Blutmenge ansteigt. (16, 20) Es wird empfohlen, das Blutvolumen in Abhängigkeit vom Gewicht des Patienten zu wählen (siehe Tabelle 1). Sofern kein Verdacht auf eine anaerobe Infektion besteht, sollte eine aerobe Flasche verwendet werden. (21) Zur Verwendung bei Kindern < 2 Jahren sind Blutkulturflaschen mit angepasster Zusammensetzung des Nährmediums kommerziell erhältlich. Sie sind speziell dafür konzipiert, das normale Verhältnis Blut : Bouillon (1 : 5 bis 1 : 10) mit kleineren Blutvolumina einzuhalten. Es wurde gezeigt, dass diese Flaschen eine bessere Wiederfindung von Mikroorganismen aufweisen. (3) Tabelle 1: Blutmenge, die für Kulturen bei Säuglingen und Kindern empfohlen wird (20) Nach Kellogg et al. Häufigkeit einer low-level Bakteriämie bei Kindern von der Geburt bis zum Alter von 15 Jahren. J Clin Microbiol. 2000; 38:2181-2185. Gewicht des Patienten Empfohlene Gesamte Blutmenge Blutmenge für des Patienten die Kultur (ml) (ml) Kultur Kultur Nr. 1 Nr. 2 Gesamtvolumen für die Kultur (ml) Prozentualer Anteil an der gesamten Blutmenge des Patienten 2 4 kg lb ≤1 ≤2,2 50-99 2 1,1-2 2,2-4,4 100-200 2 2 4 4 2,1-12,7 4,5-27 >200 4 2 6 3 12,8-36,3 28-80 >800 10 10 20 2,5 >36,3 >80 >2.200 20-30 20-30 40-60 1,8-2,7 7 Wie viele Blutkultursets sollten angelegt werden? Da Bakterien und Pilze im Blutkreislauf möglicherweise nicht konstant vorhanden sind, hat ein einzelnes Blutkulturset nur eine begrenzte Sensitivität. In einer Studie mit Blutkultursystemen mit kontinuierlichem Monitoring wurde die kumulative Sensitivität über einen Zeitraum von 24 h untersucht. Die gesamte Ausbeute an Krankheitserregern aus drei Blutkultursets (2 Flaschen pro Set) mit einem Blutvolumen von 20 ml je Set (10 ml pro Flasche) betrug demnach: 73,1 % mit dem ersten Set, 89,7 % mit den zwei ersten Sets und 98,3 % mit den drei ersten Sets. Um jedoch eine Nachweisrate von > 99 % für Infektionen in der Blutbahn zu erhalten, können bis zu 4 Blutkultursets erforderlich sein. (22) Abbildung 2: Kumulative Sensitivität von Blutkultursets (22) Nach Lee et al. Detection of Bloodstream Infections in Adults: How Many Blood Cultures Are Needed? (Nachweis von Infektionen im Blutkreislauf bei Erwachsenen: Wie viele Blutkulturen sind erforderlich?) J Clin Microbiol. 2007; 45:3546-3548 Sensitivität des Nachweises 100 % 80 % Die Richtlinien empfehlen daher 2 oder vorzugsweise 3 Blutkultursets für jede septische Episode zu verwenden. (3, 7, 16) Wenn 2 oder 3 Sets entnommen werden und die Kulturen nach 24 – 48 Stunden noch immer negativ sind, der Patient jedoch immer noch potenziell septisch ist, können 2 bis 3 weitere Kulturen angelegt werden, siehe nachfolgende Abbildung. (16) Abbildung 3: Empfohlene Anzahl an Blutkultursets Nach Baron, E.J., et al. Cumitech 1C, Blood Cultures IV. Coordinating ed., E.J. Baron. ASM Press, Washington, D.C. 2005 98,3 % 89,7 % 90 % Eine Kontaminante ist im Allgemeinen nur in einer Flasche eines Blutkultursets vorhanden, während bei einer echten Infektion der Blutbahn mehrere Blutkulturflaschen/-sets positiv sind. 73,1 % 2 oder 3 Blutkultursets (aerob + anaerob) für jede septische Episode entnehmen Wenn die Kultur nach 24 – 48 Stunden noch negativ ist und der Patient ohne nachgewiesene Ursache noch immer potenziell septisch ist 2 oder 3 weitere Blutkultursets (aerob + anaerob) entnehmen Wenn die Kultur nach 24 Stunden noch negativ ist 70 % 20 ml 40 ml 60 ml Für Erwachsene sollte niemals nur eine einzige Blutkulturflasche bzw. Blutkulturset angelegt werden, da dieses Blutvolumen für die Anzucht nicht ausreichen würde und eine signifikante Anzahl an nicht erkannten Bakteriämien zur Folge hätte. (3, 22) 8 Das Protokoll gegebenenfalls wiederholen Die Inkubation verlängern Eine nicht mikrobielle Genese prüfen 9 Welche Medien sollen verwendet werden? Mikroorganismen, die Infektionen der Blutbahn hervorrufen, sind von unterschiedlichster Art (aerob, anaerob, Pilze, anspruchsvolle Mikroorganismen...). Einige benötigen zusätzlich zu den Nährstoffelementen spezifische Wachstumsfaktoren und/oder eine spezielle Atmosphäre. Wenn der Patient bereits eine antimikrobielle Therapie erhält, sollten spezielle Medien verwendet werden, die eine Neutralisation der antimikrobiellen Aktivität ermöglichen. Es wurde gezeigt, dass Medien mit antimikrobieller Neutralisation im Vergleich zu Standardmedien die Wiederfindung erhöhen und einen schnelleren Nachweis ermöglichen. (23-26) l E s ist empfehlenswert, für jedes Blutkulturset von Erwachsenen routinemäßig eine aerobe und eine anaerobe Blutkulturflasche zu beimpfen. l as entnommene Blut sollte zu gleichen Teilen in die aerobe D und die anaerobe Flasche überimpft werden. l enn keine anaerobe Flasche verwendet wird, sollte diese W immer durch eine weitere aerobe Flasche ersetzt werden, um sicherzustellen, dass die für die Anzucht verwendete Blutmenge ausreichend ist. (27) Ein Blutkulturmedium muss: ausreichend sensitiv sein: • um einen breiten Bereich an klinisch relevanten Erregern aber auch anspruchsvolle Mikroorganismen (Neisseria, Haemophilus...) sowie • Mikroorganismen, die nur wenig CO2 freisetzen (Brucella, Acinetobacter...) nachzuweisen l l vielseitig sein: das heißt für alle Probenarten ein Ergebnis liefern können (Erwachsene, Kinder, Patienten unter Antibiotikatherapie, sterile Körperflüssigkeiten...) 10 Welche Flasche sollte zuerst beimpft werden? Wird ein Butterfly-Entnahmesystem verwendet, sollte zuerst die aerobe Flasche befüllt werden, um den Eintritt von Luft aus dem Entnahmebesteck in die anaerobe Flasche zu vermeiden. Wird die Blutentnahme mit Kanüle und Spritze durchgeführt, beimpfen Sie zuerst die anaerobe Flasche, um das Eindringen von Luft zu verhindern. Entspricht die Menge des aufgezogenen Blutes nicht dem empfohlenen Volumen*, sollte zirka 10 ml Blut zuerst in die aerobe Flasche gegeben werden, da die meisten Bakteriämien durch aerobe und fakultative Bakterien hervorgerufen werden. Außerdem werden pathogene Hefen und strikt aerobe Keime (z. B. Pseudomonas) fast ausschließlich in aeroben Flaschen nachgewiesen. Danach ist die anaerobe Flasche mit dem restlichen Blut zu beimpfen. (8) *Näheres zu den empfohlenen Volumina finden Sie auf den Seiten 6/7 “Welches Blutvolumen sollte entnommen werden?“ Entnahmezeitpunkt Studien haben gezeigt, dass der Zeitabstand zwischen zwei Blutentnahmen kein entscheidender Faktor ist, da die diagnostische Wiederfindung die gleiche ist. (7) Richtlinien empfehlen, dass die ersten beiden/drei Sets (2 Flaschen/ Set) einer Blutkultur entweder innerhalb einer kurzen Zeitspanne (z. B. innerhalb 1 Stunde) oder als einzelne einmalig abgenommene Probe entnommen werden. (3, 7, 16) Die Auswirkungen der jeweils verwendeten Blutentnahmemethode (z. B. einzelne oder mehrere Venenpunktionen, Butterfly-Blutentnahmeset oder Entnahme mit Kanüle und Spritze) auf die Kontaminationsrate sollten berücksichtigt werden. (7) Blutentnahmen in regelmäßigen Abständen von beispielsweise 1 bis 2 Stunden werden nur zur Überwachung einer kontinuierlichen Bakteriämie/Fungämie bei Patienten mit Verdacht auf eine infektiöse Endokarditis oder einer anderen endovaskulären (z. B. Katheterassoziierten) Infektion empfohlen. (16) 11 10 wichtige Schritte für eine korrekte Blutentnahme: Eine illustrierte Schritt für Schritt Anleitung finden Sie auf Seite 30. Bei schweren Infektionen oder um die Sensitivität des Nachweises zu erhöhen (beispielsweise bei Pyelonephritis) können zwei bis drei weitere Blutkultursets angelegt werden, wenn die ersten 2 – 3 Blutkulturen nach 24 – 48 Stunden Inkubation negativ sind. Dies hängt auch von den beteiligten Mikroorganismen ab, da die Sensitivität bei Keimen wie Escherichia coli oder Staphylococcus aureus relativ gut ist, während sie für Pseudomonas aeruginosa, Streptokokken oder Pilzen geringer ist. (28) 1 Kontrollieren Sie die Flaschen vor Gebrauch auf eventuelle Beschädigung oder Verfallsanzeichen. Verwenden Sie keine Flaschen mit Medien, die Anzeichen einer Trübung aufweisen oder eine Gasentwicklung zeigen, welches auf eine mögliche Kontamination hinweist. 2 Prüfen Sie das Verfallsdatum jeder Flasche. Verwerfen Sie Flaschen mit abgelaufenem Verfallsdatum. 3 Halten Sie das in Ihrer Gesundheitseinrichtung vorgeschriebene Protokoll zur Blutentnahme genau ein und beachten Sie die StandardVorsichtsmaßnahmen zur Handhabung von Blut am Krankenbett. 4 Die Blutkulturflaschen sollten eindeutig und korrekt mit dem Namen Wie werden Blutkulturen entnommen? Die Blutentnahme ist ein wichtiger Schritt beim Anlegen einer Blutkultur. Während des gesamten Verfahrens müssen die üblichen Vorsichtsmaßnahmen und strikt aseptische Bedingungen eingehalten werden. Die Einhaltung der Empfehlungen zur Entnahme von Blut für Blutkulturen können die Qualität und den klinischen Wert der Blutkulturuntersuchung verbessern und Probenkontaminationen sowie „falsch-positive“ Ablesungen reduzieren. des Patienten, sowie dem Datum, der Uhrzeit und der Punktionsstelle (Venenpunktion oder intravaskuläres Entnahmebesteck) beschriftet werden. 5 Jedes Blutkulturset sollte eine aerobe und eine anaerobe Flasche umfassen. 6 Blut für die Blutkultur sollte venös und nicht arteriell entnommen werden.(30) 7 Es ist empfehlenswert, das Blut wegen des erhöhten Kontaminationsrisikos nicht über einen venösen oder arteriellen Katheter zu entnehmen.(31) 8 Desinfizieren Sie die Haut vor der Probennahme mit einem geeigneten Desinfektionsmittel, wie Chlorhexidin in 70 %igem Isopropylalkohol oder einer Jodtinktur auf einem Wattetupfer oder einem Applikator.(3) 9 Transportieren Sie die beimpften Flaschen und den vollständig Eine fachgerechte, kontaminationsfreie Probengewinnung ist für präzise und zuverlässige Blutkulturergebnisse von entscheidender Bedeutung. Es wird empfohlen, die Blutkulturen nur von geschultem Fachpersonal (Mediziner, Pflegepersonal, Laborfachkräfte) abnehmen zu lassen. (29) ausgefüllten Begleitschein so schnell wie möglich in das klinisch mikrobiologische Labor, gemäß CLSI vorzugsweise innerhalb von 2 Stunden.(3) Jede zeitliche Verzögerung bei der Blutkulturdiagnostik kann ein erhöhtes Risiko für falsch negative Ergebnisse zur Folge haben. Sind Verzögerungen zu erwarten, ist es wichtig, die Gebrauchsanweisungen des Herstellers zu beachten. Die europäische Gesellschaft für Mikrobiologie und Infektiologie (ESCMID) empfiehlt bei zeitlichen Verzögerungen beispielsweise folgende Vorgehensweise: Blutkulturen, die in Systemen mit kontinuierlicher Überwachung getestet werden, sollten vorübergehend bei Raumtemperatur gelagert werden, während Flaschen für die manuelle Testung so schnell wie möglich inkubiert werden sollten.(32) Auch hier sollten die Gebrauchsanweisungen des Herstellers beachtet werden. Die Nutzung eines Rohrpostsystems kann den schnellen Transport der Flaschen in das mikrobiologische Labor erleichtern, jedoch ist bei der Verwendung von Glasflaschen bei diesem Transportsystem besondere Vorsicht geboten. (33) 10 Alle Blutkulturen sollten unter Angabe des Datums und der Uhrzeit der Blutentnahme, der Entnahmestelle und der Indikation in den Patientenunterlagen dokumentiert werden. 12 13 Welche Inkubationszeiten werden empfohlen? Kontaminante oder pathogener Erreger? Die aktuellen Empfehlungen zur Standardinkubationszeit von Blutkulturen in der Routine für Systeme mit kontinuierlichem Monitoring beträgt fünf Tage. (34) Veröffentlichten Studien zufolge jedoch können drei Tage ausreichen, um über 97 % der klinisch signifikanten Mikroorganismen nachzuweisen. Eine Studie von Bourbeau, et al. (JCM, 2005) untersuchte die Zahl der pro Tag isolierten relevanten Mikroorganismen in 35.500 aufeinanderfolgenden Blutkulturen, die über einen Zeitraum von mehr als 30 Monaten gesammelt wurden: 2.609 waren klinisch signifikante Isolate und 1.097 waren Kontaminanten. (35) Abbildung 4: Klinisch signifikante Isolate pro Tag (35) Nach Bourbeau PP et al. Routine incubation of BacT/ALERT® FA and FN blood culture bottles for more than 3 days may not be necessary. J Clin Microbiol. 2005;43:2506-2509 80 % 74,1% 60 % 40 % 19,7% 20 % 0% 3,6% 1,7% 0,9% Tag 1 Tag 2 Tag 3 Tag 4 Tag 5 Diese Ergebnisse zeigen, dass 97,4 % der klinisch signifikanten Isolate innerhalb der ersten 3 Inkubationstage und 93,8 % innerhalb der ersten 2 Inkubationstage wiedergefunden wurden. Inkubation anspruchsvoller Mikroorganismen Eine weitere Studie von Cockerill, et al. (CID, 2004) hat gezeigt, dass bei Verwendung eines Blutkultursystems mit kontinuierlichem Monitoring 99,5 % der nicht auf eine Endokarditis zurückzuführenden Infektionen in der Blutbahn und 100 % der Endokarditis-Episoden innerhalb von 5 Inkubationstagen nachgewiesen wurden.(19) Diese Daten zeigen, dass bei einem Verdacht auf eine Endokarditis, bei der anspruchsvolle Mikroorganismen* vorkommen können, die früher empfohlenen längeren Inkubationszeiten nicht mehr notwendig sind, wenn Blutkultursysteme mit kontinuierlichem Monitoring verwendet werden. (16) * darunter Brucella, Capnocytophaga und Campylobacter spp., sowie die sogenannte HACEK-Gruppe (Haemophilus (außer H. influenzae) Spezies, Aggregatibacter (früher Actinobacillus) Spezies, Cardiobacterium hominis, Eikenella corrodens und Kingella Spezies) (36) 14 Die Kontamination von Blutproben während der Blutentnahme hat eine signifikante Anzahl an falsch positiven Ergebnissen zur Folge und kann für den Heilungserfolg schwerwiegende negative Konsequenzen haben. Als falsch positiv bezeichnet man das Wachstum von Bakterien in der Blutkulturflasche, die bei der Probennahme eingeführt wurden und welche nicht im Blutkreislauf des Patienten vorhanden waren. Die Kontamination kann über die Haut des Patienten, das Blutentnahmebesteck, die Hände der die Blutentnahme durchführenden Person oder die Umwelt hervorgerufen werden. Die Gewinnung einer kontaminationsfreien Blutprobe ist für den klinischen Nutzen einer Blutkulturdiagnostik von entscheidender Bedeutung. Bestimmte Mikroorganismen wie Koagulase-negative Staphylokokken, Streptokokken der Viridans-Gruppe, Bacillus spp, Propionibacterium spp., diphtheroide Bakterien, Micrococcus spp. rufen nur selten schwere bakterielle Infektionen oder eine Infektion des Blutes hervor. Diese Keime sind häufige Hautkontaminanten, und obwohl sie unter bestimmten Umständen schwere Infektionen hervorrufen können, kann deren Nachweis in einem einzigen Blutkulturset als klinisch nicht relevant betrachtet werden. Es ist jedoch wichtig, zu beachten, dass Koagulase-negative Staphylokokken die häufigste Ursache sowohl für Katheter- als auch prothetisch-assoziierte Infektionen sind und in bis zu 20 % der Fälle klinisch signifikant sein können. (37) Die Frage, ob es sich bei dem in der Blutkultur wiedergefundenen Mikroorganismus um einen echten Krankheitserreger oder um eine Kontaminante handelt, ist für den Kliniker oftmals eine große Herausforderung. Wenn es eine Kontaminante ist, wird der Patient möglicherweise unnötig mit Antibiotika behandelt. Dies hat weitere Risiken für den Patienten zur Folge. Die Beurteilung, ob es sich um einen echten Krankheitserreger handelt oder ob eine Kontaminante vorliegt, sollte auf der Grundlage dessen erfolgen, ob das Blut durch Venenpunktion oder mit einem intra-vaskulären Entnahmesystem abgenommen wurde, und der mehrfachen Isolierung der gleichen Spezies. Dies zeigt, wie wichtig es ist, die Blutentnahmestelle auf dem Anforderungsschein der Blutkultur mit anzugeben. 15 Im Gegensatz zu einer infektiösen Endokarditis oder anderen echt positiven Infektionen des Blutes ist bei einer kontaminierten Blutkultur im Allgemeinen nur eine einzige Blutkulturflasche positiv. Diese Information ist für Ärzte von großem praktischem Wert und unterstreicht die Wichtigkeit, zwei bis drei Blutkultursets von verschiedenen Körperstellen anzulegen. (16) Die Kontaminationsraten können effizient gesenkt werden, wenn die Vorschriften für die Händehygiene und die Richtlinien der Guten Laborpraxis für die Blutentnahme strikt eingehalten werden. Dies gilt insbesondere für die Hautdesinfektion, die Venenpunktion und den Transfer der Probe in die Blutkulturflasche. Dennoch ist es selbst bei Verwendung der besten Blutentnahmeprotokolle nicht möglich, die Kontaminationsrate unter 2 % zu senken.(38) Gemäß den Empfehlungen der Amerikanischen Gesellschaft für Mikrobiologie und dem CLSI sollte die Kontaminationsrate 3 % der gesamten Blutentnahmen nicht übersteigen. (3, 16) Einfluss der Kontaminationsraten Eine kontaminierte Blutkultur kann eine unnötige Antibiotikatherapie, längere Liegezeiten und höhere Kosten mit sich bringen. Es wurde gezeigt, dass jeder falsch positive Befund: l die Verweildauer verlängert – im Durchschnitt um 1 Tag. (39) l die intravenöse Antibiotikagabe um 39 % erhöht. (39) l zusätzliche Folgekosten in Höhe von insgesamt 5.000 bis 8.720 US $ mit sich bringt.(40, 41) l die Laborkosten um 20 % erhöht.(39) l die Antibiotikatherapie um 3 Tage verlängert. (39) Abbildung 5: Beispiel eines Labor-basierten Algorithmus zur Bestimmung der Kontaminationsrate in Blutkulturen (42) Nach Richter et al. Minimizing the workup of blood culture contaminants: implementation and evaluation of a laboratory-based algorithm. J Clin Microbiol. 2002;40:2437-2444. Aus der Blutkultur isolierte potenzielle Kontaminante* Weitere Entnahmen +/- 48 h? NEIN Prüfung durch qualifiziertes Fachpersonal NEIN Wahrscheinlich Kontaminante; keine Empfindlichkeitsprüfung, solange keine Anforderung vorliegt NEIN Prüfung durch qualifiziertes Fachpersonal JA Positiv mit demselben Erreger? JA Streptokokken der Viridans-Gruppe? JA Pathogen; Empfindlichkeitsprüfung durchführen **Mikroorganismen wie Koagulase-negative Staphylokokken, Streptococcus viridans, Bacillus spp, Propionibacterium spp., diphtheroids, Micrococcus spp. 16 17 Spezialthema: Infektiöse Endokarditis Die Blutkultur ist für die Diagnostik einer infektiösen Endokarditis (Infektion der Herzklappen) entscheidend. Bei dieser schwer zu erfassenden Erkrankung müssen während der fieberhaften Episoden, in denen die Bakterien/Pilze in den Blutkreislauf geschwemmt werden, gegebenenfalls wiederholt Blutkulturen entnommen werden. Bei Patienten mit einer infektiösen Endokarditis erhält man in mehr als 90 % der Fälle eine positive Blutkultur, vorausgesetzt, es werden optimale Kulturbedingungen eingehalten. (43) Akute infektiöse Endokarditis Fulminante, innerhalb weniger Tage bis Wochen rasch fortschreitende Erkrankung, die durch hoch virulente Erreger wie Staphylococcus aureus hervorgerufen werden kann. Bei vorliegendem Verdacht muss auf Grund der Schwere dieser Erkrankung sofort eine Blutkultur angelegt werden, um eine unnötige Verzögerung der Therapie zu vermeiden. l Vor Beginn einer empirischen Antibiotikatherapie sollten innerhalb von 30 min mehrere Blutkultursets entnommen werden. (44) Subakute infektiöse Endokarditis Wenn der Verdacht auf eine subakute Infektion vorliegt, ist eine schnelle empirische Antibiotikatherapie im Allgemeinen nicht angezeigt. Wichtiger ist es, eine mikrobiologische Diagnostik durchzuführen. l Vor Beginn der Antibiotikatherapie sollten mehrere Blutkultursets mit einem zeitlichen Abstand von 30 min bis 1 h angelegt werden. Dies kann helfen, eine kontinuierliche Bakteriämie zu dokumentieren und kann von zusätzlicher diagnostischer Bedeutung sein. (3) Wie viele Kulturen? Um zwischen einer Kontamination und einer echten Bakteriämie zu unterscheiden, sollten insgesamt drei bis fünf Blutkultursets ausreichen. l Zunächst sollten zwei bis drei Blutkultursets von Patienten mit Verdacht auf eine infektiöse Endokarditis abgenommen werden. Wenn die ersten 2 – 3 Sets nach 24 – 48 h negativ sind, zwei bis drei weitere Sets abnehmen. (3) Häufig wird Patienten bei einem Verdacht auf eine infektiöse Endokarditis bereits vor der Blutentnahme eine Antibiotikatherapie verabreicht. Dies ist die wichtigste Ursache einer “Kultur-negativen“ infektiösen Endokarditis. Es ist deshalb wichtig, ein Blutkulturmedium zu verwenden, das in der Lage ist, das mikrobielle Wachstum in Anwesenheit von Antibiotika zu unterstützen (siehe Seiten 10/11 „Welche Medien sollen verwendet werden?“). (48, 49) Eine „Kultur-negative“ Endokarditis kann jedoch auch auf anspruchsvolle Mikroorganismen, wie Aspergillus spp., Brucella spp., Coxiella burnetii, Chlamydia spp. und HACEK* Mikroorganismen zurückzuführen sein. l Da die derzeitigen Blutkultursysteme mit kontinuierlichem Monitoring alle HACEK und andere anspruchsvolle Mikroorganismen innerhalb von 5 Tagen nachweisen, wird eine Verlängerung der Inkubationszeit über diesen Zeitraum hinaus nicht mehr als notwendig angesehen. Wenn jedoch alle Blutkulturen nach 5 Tagen noch negativ sind und weiterhin der Verdacht auf eine infektiöse Endokarditis besteht, sollte von allen Flaschen eine Subkultur auf Kochblut-Agar angelegt werden. (50) Infektiöse mykotische Endokarditis Während die mykotische Endokarditis früher nur selten auftrat, nimmt die Inzidenz derzeit deutlich zu. (45) Candida ist der häufigste pathogene Pilz, der eine infektiöse Endokarditis hervorruft. (46) Bei Einhaltung optimaler Entnahmebedingungen beträgt die Ausbeute positiver Blutkulturen bei der mykotischen Endokarditis für Candida spp. 83 bis 95 %. (47) * HACEK = Haemophilus (außer H. influenzae) Spezies, Aggregatibacter (früher Actinobacillus) Spezies, Cardiobacterium hominis, Eikenella corrodens und Kingella Spezies. (36) 18 19 Verarbeitung von positiven Blutkulturen Die heutigen Blutkultursysteme mit kontinuierlichem Monitoring bieten derzeit die beste Lösung zur Verarbeitung von Blutkulturen. Die allgemein akzeptierten Inkubationszeiten variieren von 5 – 7 Tagen, meist inkubiert man für 5 Tage. (27) Die Studie in Abbildung 4 zeigt, dass 98 % aller positiven Proben innerhalb der ersten 3 Tage nachgewiesen wurden (siehe Seite 14). (35) Patienten, die einen septischen Schock entwickeln, zeigen eine Mortalitätsrate, die pro Stunde um 7,6 % ansteigt, solange sie keine angemessene Therapie erhalten. (15) Meldet das Gerät einen positiven Befund, wird die Flasche aus dem System genommen. Anschließend wird eine Gramfärbung durchgeführt und eine Subkultur angelegt. lE rgibt die Gramfärbung ein Ergebnis, sollte die Morphologie des Keimes sofort dem behandelnden Arzt weitergegeben werden. Danach sollten weitere Subkulturen oder Schnelltests (z. B. molekularbiologische Diagnostik) zur Identifizierung des Keimes und so schnell wie möglich eine Antibiotika-Empfindlichkeitsprüfung durchgeführt werden. lE rgibt die Gramfärbung kein Ergebnis, wird dem Arzt kein Befund übermittelt, solange die Subkultur kein Wachstum zeigt. Eine positive Blutkultur ist ein klinisch relevantes Ergebnis, das so schnell wie möglich weitergegeben werden muss, da es die Therapieentscheidung des Arztes unmittelbar beeinflusst. Studien haben gezeigt, dass ein schnell weitergeleiteter Befund den Heilungserfolg und die Effizienz des Patientenmanagements entscheidend verbessern. (51, 52) Neue technologische Entwicklungen wie MALDI-TOF (Matrix-Assisted Laser Desorption Ionization Time of Flight) bieten die Möglichkeit einer schnellen und sicheren Identifizierung des Erregers. Molekularbiologische Verfahren können die häufigsten Erreger in positiven Blutkulturen identifizieren sowie spezifische mit Infektionen der Blutbahn in Zusammenhang stehende Gene für eine Antibiotikaresistenz nachweisen. Eine schnelle Identifizierung bietet dem Kliniker die Möglichkeit, schneller eine zielgerichtetere und effiziente Antibiotikatherapie zu verordnen und damit den Behandlungserfolg positiv zu beeinflussen. (54-56) Außerdem sollten für positive Blutkulturen AntibiotikaEmpfindlichkeitsprüfungen durchgeführt werden, um dem behandelnden Arzt einen vollständigen Befund zu liefern. Eine sachgemäße Verwendung von Antibiotika ist für die Behandlung von Infektionen der Blutbahn und der Sepsis von entscheidender Bedeutung. Eine genaue Bestimmung des antimikrobiellen Resistenzprofils des verantwortlichen Erregers ermöglicht die Wahl der am besten geeigneten Antibiotikatherapie und kann einen wichtigen Beitrag für den Heilungserfolg leisten. Blutkulturen können bei sachgemäßer Verarbeitung klinisch relevante Informationen liefern, die das Patienten-Outcome verbessern können, die Dauer des Krankenhausaufenthaltes reduzieren und den Antibiotika-Verbrauch senken. Eine von Barenfanger, et al. (Am J Clin Pathol, 2008) durchgeführte Studie hat gezeigt, dass die Gramfärbung von positiven Blutkulturen ein sehr wichtiges Kriterium für die Wahl einer angemessenen Therapie und den Behandlungserfolg ist. Die Studie weist einen statistisch signifikanten Anstieg der Mortalitätsrate bei Patienten nach, deren Blutkulturen mit zeitlicher Verzögerung bearbeitet wurden (z. B. Gramfärbung mehr als 1 Stunde nach dem positiven Nachweis in der Blutkultur durchgeführt; P = 0,0389). Eine zeitnahe Durchführung und Weiterleitung der Gram-Ergebnisse haben einen entscheidenden Einfluss auf die Patientenversorgung. Diese Studie unterstützt die Notwendigkeit von Blutkultursystemen, die permanent (24/7) verfügbar sind. (53) 20 21 Interpretation der Ergebnisse Das mikrobiologische Labor kann dem Arzt wertvolle Informationen liefern und bei der Beantwortung der Frage helfen, ob eine Blutkultur wirklich positiv oder falsch positiv (kontaminiert) ist. So kann die Identität des isolierten Mikroorganismus Aufschluss darüber geben, ob die Kultur kontaminiert ist, und die Anzahl der mit demselben Organismus infizierten, positiven Kulturen kann dazu beitragen, eine echte Infektion zu erkennen.(57) Die Zeit bis zum Vorliegen einer positiven Blutkultur ist ein weiterer Faktor, der dazu dient, eine mögliche Kontamination zu erkennen, da Kontaminanten auf Grund der niedrigeren Bio-Last gewöhnlich eine verzögerte (längere) Zeit bis zum Nachweis aufweisen. Das Labor sollte in Absprache mit der medizinischen Leitung einen Algorithmus erstellen, der hilft, festzustellen, ob es sich bei dem isolierten Keim um eine Kontaminante oder einen infektiösen Erreger handelt. Vorhersagemodelle wie der nachstehende Algorithmus können für die Interpretation der Blutkulturergebnisse nur richtungsweisend sein. (42, 57, 58) Neben diesen Richtlinien sollten klinische Informationen wie der Blutstatus des Patienten, das Vorhandensein von Kathetern, radiologische Befunde usw. mit in Betracht gezogen werden. Abbildung 6: Beispiel für einen Algorithmus zur Interpretation von Blutkulturen 1 2 Mehr als eine positive Flasche mit pathogenem Erreger Nur eine positive Flasche monomikrobielle Kultur + klinische Symptome (z. B. Endokarditis, Meningitis, Pneumonie...) polymikrobielle Kultur (mit dem entsprechenden klinischen Hintergrund z. B. Transplantate, intraabdominale Infektion, immunsupprimierter Patient...) wahrscheinliche Infektion der Blutbahn Infektion in der Blutbahn wenn pathogener Keim: Listeria, S. aureus, Brucella, Haemophilus, Enterobacteriaceae, … Wahrscheinliche Infektion der Blutbahn wenn normale Hautflora: Propionibacterium, Corynebacterium, Bacillus, negative Staphylokokken Wenn Streptokokken der Viridans-Gruppe oder Koagulase-negative Staphylokokken und Konsistenz mit klinischem Setting (z. B. Verweilkatheter, prothetische Herzklappe, immunsupprimierter Patient) Wahrscheinliche Kontamination Wahrscheinliche Infektion der Blutbahn 3 Negative Blutkultur, aber klinische Symptomatik Blutentnahme wiederholen Nicht-infektiöse Ätiologie in Erwägung ziehen Prüfen, ob virale Genese oder nicht kultivierbarer Organismus 22 23 Richtlinien Blutkultur/Sepsis LAND REGION Frankreich RICHTLINIEN l REMIC 2015. Automatisation des cultures microbiennes : quel cahier des charges ? Chapitre 11 http://www.sfm-microbiologie.org/ Internationale Richtlinien Deutschland l Reinhart K et al., Prevention, diagnosis, therapy and follow-up care of sepsis: 1st revision of S-2k guidelines of the German Sepsis Society (Deutsche SepsisGesellschaft e.V. (DSG)) and the German Interdisciplinary Association of Intensive Care and Emergency Medicine (DIVI). German Medical Science, 2010, Vol. 8: 1-86 WHO guidelines on drawing blood: best practices in Phlebotomy. World Health Organization 2010. http://whqlibdoc.who.int/publications/ 2010/9789241599221_eng.pdf Surviving sepsis campaign: international guidelines for management of severe sepsis and septic shock: 2012. Dellinger RP., et al. Crit Care Med. 2013;41:580-637. http://www.survivingsepsis.org/guidelines/Pages/default.aspx The Third International Consensus Definitions for Sepsis and Septic Shock (Sepsis-3). Singer M., et al. JAMA. 2016;315(8):801-810. http://jama.jamanetwork.com/article.aspx?articleid=2492881 http://www.ncbi.nlm.nih.gov/pmc/articles/PMC2899863/pdf/ GMS-08-14.pdf Südafrika l http://www.fidssa.co.za/Guidelines/Guideline_for_the_optimal_ use_of_blood_cultures.pdf UK l Australien Australia Clinical Excellence Commission Sepsis Kills Program: Adult Blood Culture Sampling Guide v2 2012 SHPN (CEC) 120077 http://www.cec.health.nsw.gov.au/__data/assets/pdf_ file/0005/259412/adult-blood-culture-sampling-guideline.pdf Brasilien l Elmor de Araujo MR, Hemocultura: recomendações de coleta, processamento e interpretação dos resultados, J Infect Control 2012; 1: 08-19 http://www.iqg.com.br/pbsp/img_up/01355393320.pdf Europa https://www.escmid.org/escmid_library/manual_of_microbiology/ Taking blood cultures - a summary of best practice: Saving lives reducing infection, delivering clean and safe care. London: Department of Health; 2007. http://webarchive.nationalarchives.gov.uk/20120118164404/ hcai.dh.gov.uk/files/2011/03/Document_Blood_culture_ FINAL_100826.pdf USA American Society for Microbiology: Cumitech 1C, 2005 (EJ Baron et al.) ASM Press l Clinical and Laboratory Standards Institute (CLSI®), document M47-A, Vol 27, 2007 (ML Wilson et al.) l Emergency Nurses Association (ENA). Clinical Practice Guideline: Prevention of Blood Culture Contamination l https://www.ena.org/practice-research/research/CPG/Documents/ BCCCPG.pdf l European Society for Clinical Microbiology and Infectious Diseases, European Manual for Clinical Microbiology, 1st Edition, 2012. 24 l RICHTLINIEN l U K Standards for Microbiology Investigations. Investigation of Blood Cultures (for Organisms other than Mycobacterium species). Bacteriology | B 37 | Issue no: 8 | Issue date: 04.11.14 | Page: 1 of 51. Issued by the Standards Unit, Health Protection Agency, PHE. https://www.gov.uk/government/uploads/system/uploads/ attachment_data/file/372070/B_37i8.pdf Nationale Richtlinien LAND REGION Guideline for the optimal use of blood cultures. SAMJ 2010; Vol. 100, No. 12: 839-843 SAMJ l E. Septimus. CDC Clinician Guide for Collecting Cultures. 2015 http://www.cdc.gov/getsmart/healthcare/implementation/ clinician guide.html 25 Literatur 1. Singer M., et al. The Third International Consensus Definitions for Sepsis and Septic Shock (Sepsis-3). JAMA. 2016;315(8):801-810 17. Mermel L.A., Maki D.G. Detection of bacteremia in adults : consequences of culturing an inadequate volume of blood. Ann Intern Med. 1993;119:270-272 2. Koneman E.W., et al., Color Atlas and Textbook of Diagnostic Microbiology. Third Edition 18. Bouza E, Sousa D, Rodríguez-Créixems M, Lechuz JG, Muñoz P. Is the volume of blood cultured still a significant factor in the diagnosis of bloodstream infections? J Clin Microbiol. 2007 45:2765-9 3. Principles and procedures for Blood Cultures; Approved Guideline, CLSI document M47-A. Clinical and Laboratory Standards Institute (CLSI); Wayne, P.A. 2007 4. Adhikari N.K.J., Fowler R.A., Bhagwanjee S., Rubenfeld G.D., Critical care and the global burden of critical illness in adults. Lancet 2010;376:1339–1346 5. WSD fact sheet 2013/www.world-sepsis-day.org 6. Kumar, A, et al. Initiation of inappropriate antimicrobial therapy results in a fivefold reduction of survival in human septic shock. Chest. 2009 Nov;136(5):1237-48 7. European Society for Clinical Microbiology and Infectious Diseases, European Manual for Clinical Microbiology, 1st Edition, 2012 8. Garey KW., Rege M., Manjunath P. Pai, Mingo DE., Suda KJ., Turpin RS., Bearden DT. Time to Initiation of Fluconazole Therapy Impacts Mortality in Patients with Candidemia: A Multi-Institutional Study. Clin Infect Dis. 2006;43(1):25-31 9. Khatib R., Saeed S., Sharma M., Riederer K., Fakih MG., Johnson LB. Impact of initial antibiotic choice and delayed appropriate treatment on the outcome of Staphylococcus aureus bacteremia. Eur J Clin Microbial Infect Dis. 2006;25(3):181-5 10. Kollef MH, Sherman G, Ward S, Fraser VJ. Inadequate antimicrobial treatment of infections: a risk factor for hospital mortality among critically ill patients. Chest. 1999;115(2):462-74 11. Harbarth S., Garbino J., Pugin J., Romand J.A., Lew D., Pittet D. Inappropriate initial antimicrobial therapy and its effect on survival in a clinical trial of immunomodulating therapy for severe sepsis. Am J Med. 2003;115(7):529–535 12. Lodise T.P., McKinnon P.S., Swiderski L., Rybak M.J. Outcomes Analysis of Delayed Antibiotic Treatment for Hospital-Acquired Staphylococcus aureus Bacteremia. CID 2003:36:1419-1423 13. Kang C.I., Kim S.H., Kim H.B., Park S.W., Choe Y.J,. Oh M.D., Kim E.C., Choe K.W. Pseudomonas aeruginosa bacteremia: risk factors for mortality and influence of delayed receipt of effective antimicrobial therapy on clinical outcome. Clin Infect Dis. 2003;37(6):745-51 14. Forrest G.N., Mankes K., Jabra-Rizk M.A., Weekes E., Johnson J.K., Lincalis D.P., Venezia R.A. Peptide Nucleic Acid Fluorescence In Situ Hybridization-Based Identification of Candida albicans and Its Impact on Mortality and Antifungal Therapy Costs. J Clin Microbiol. 2006 Sep; 44(9): 3381–3383 15. Kumar A, et al. Duration of hypotension before initiation of effective antimicrobial therapy is the critical determinant of survival in human septic shock. Crit Care Med. 2006;34(6):1589-96 16. Baron, E.J., M.P. Weinstein, W.M. Dunne, Jr., P. Yagupsky, D.F. Welch, and D.M. Wilson. Cumitech 1C, Blood Cultures IV. Coordinating ed., E.J. Baron. ASM Press, Washington, D.C. 2005 26 19. Cockerill FR III, Wilson J.W., Vetter E.A., et al. Optimal testing parameters for blood cultures. Clin Infect Dis. 2004 ;38 :1724-1730 20. Kellogg J.A., Manzella J.P., Bankert D.A. Frequency of low-level bacteremia in children from birth to fifteen years of age. J Clin Microbiol. 2000;38:2181-2185 21. Freedman S.B., Roosevelt G.E. Utility of anaerobic blood cultures in a pediatric emergency department. Pediatr Emerg Care. 2004;20(7):433-6 22. Lee A., Weinstein MP., Mirrett S., Reller LB. Detection of Bloodstream Infections in Adults: How Many Blood Cultures Are Needed? J Clin Microbiol 2007;45:3546-3548 23. Lee DH., Kim S.C., Bae IG., Koh EH., Kim S., Clinical Evaluation of BacT/ALERT FA Plus and FN Plus Bottles Compared with Standard Bottles , J. Clin. Microbiol. 2013; 51(12): 4150-4155 24. Amarsy-Guerle R., Mougari F., Jacquier H., Oliary J., Benmansour H., Riahi J., Berçot B., Raskine L., Cambau E., High medical impact of implementing the new polymeric bead-based BacT/ALERT® FA Plus and FN Plus blood culture bottles in standard care, Eur J. Clin. Microbiol Dis. 2015;34(5):1031-1037 25. Kirn T.J., Mirrett S., Reller L.B., Weinstein M.P., Controlled Clinical Comparison of BacT/ALERT FA Plus and FN Plus Blood Culture Media with BacT/ALERT FA and FN Blood Culture Media, J. Clin. Microbiol. 2014; 52(3): 839-843 26. Doern C., Mirrett S., Halstead D., Abid J., Okada P., Reller L.B. Controlled Clinical Comparison of New Pediatric Medium with Adsorbent Polymeric Beads (PF Plus) versus Charcoal-Containing PF Medium in the BacT/ALERT Blood Culture System, J. Clin. Microbiol. 2014; 52(6): 1898-1900 27. Riley J.A., Heiter B.J., Bourbeau P.P. Comparison of recovery of blood culture isolates from two BacT/ALERT FAN aerobic blood culture bottles with recovery from one FAN aerobic bottle and one FAN anaerobic bottle. J.Clin. Microbiol. 2003;41:213-217 28. Weinstein, M. P., M. L. Towns, S. M. Quartey, S. Mirrett, L. G. Reimer, G. Parmigiani, and L. B. Reller. The clinical significance of positive blood cultures in the 1990s; a prospective comprehensive evaluation of the microbiology, epidemiology, and outcome of bacteremia and fungemia in adults. Clin. Infect. Dis. 1997;24:584–602 29. UK Department of Health: Taking Blood Cultures – A summary of best practice. 2007 30. Weinstein M.P. Current blood culture methods and systems: clinical concepts, technology, and interpretation of results. Clin Infect Dis. 1996 ;23 :40-46 31. Everts R.J., Vinson E.N., Adholla P.O., Reller L.B. Contamination of catheter-drawn blood cultures. J. Clin Microbiol. 2001;39:3393-3394 32. Cornaglia G., et al. European Manual of Microbiology. ESCMID-SFM 2012 27 33. Kirm T.J., Weinstein M.P. Update on blood cultures: how to obtain, process, report, and interpret. Clin Microbiol Infect. 2013;19(6):513–520 34. Wilson M.L., Mirrett S., Reller L.B. et al. Recovery of clinically important microorganisms from the BacT/ALERT blood culture system does not require testing for 7 days. Diagn Microbiol Infect Dis. 1993;16:31-34 35. Bourbeau PP., Foltzer M. Routine incubation of BacT/ALERT FA and FN blood culture bottles for more than 3 days may not be necessary. J Clin Microbiol. 2005;43:2506-2509 36. Clinical Infectious Disease. Edited by David Schlossberg. Cambridge University Press, 2015 37. Keri K. Hall and Jason A. Lyman, Updated Review of Blood Culture Contamination, Clin. Microbiol. Rev. 2006, 19(4):788 38. Dunne W.M. Jr., Nolte F.S., Wilson M.L. Cumitech 1B, Blood Cultures III. Coordinating ed., Hindler J.A. ASM Press. Washington, D.C. 1997 39. Hall, K.K. and J.A. Lyman. Updated review of blood culture contamination. Clinical Microbiology Reviews. 2006;19:788-802 40. Bamber, A.I., J. G. Cunniffe, D. Nayar, R. Ganguly and E. Falconer. The effectiveness of introducing blood culture collection packs to reduce contamination. British Journal of Biomedical Science. 2009;66(1):1-9. 41. Gander, R. M., L. Byrd, M. DeCrescenzo, S. Hirany and M. Bowen, J. Baughman. Impact of blood cultures drawn by phlebotomy on contamination rates and health care costs in a hospital emergency department. J. Clin. Microbiol. 2009;47:1021-1024 42. Richter S.S., Beekman S.E., Croco D.J., Koontz R.P., Pfaller M.A., Doern G.V. Minimizing the workup of blood culture contaminants: implementation and evaluation of a laboratory-based algorithm. J Clin Microbiol. 2002;40:2437-2444 43. Towns M.L., Reller L.B. Diagnostic methods: current best practices and guidelines for isolation of bacteria and fungi in infective endocarditis. Infect Dis Clin N Am. 2002;16:363-376 44. Osborn TM., Nguyen HB., Rivers EP. Emergency medicine and the surviving sepsis campaign: an international approach to managing severe sepsis and septic shock. Ann Emerg Med 2005;46:228-231 45. Rubenstein E., Lang R. Fungal endocarditis. Eur Heart J. 1995; 16(Suppl B):84-89 46. Ellis ME., Al-Abdely H., Standridge A., Greer W., Venturea W. Fungal endocarditis: evidence in the world literature, 1965-1995. 2001;32:50-62 47. McLeod R., Remington JS. Fungal endocarditis. In: Rahimtoola SH et al., eds. Infective Endocarditis. New York, NY: Gune & Stratton.1978:211-290 50. Baron EJ., Scott JD., Tompkins LS. Prolonged incubation and extensive subculturing do not increase recovery of clinically significant microorganisms from standard automated blood cultures. Clin Infect Dis. 2005;41:1677-1680 51. Beekmann SE., Diekama D.J., Chapin KC., Goern GV. Effects of rapid detection of bloodstream infections on length of hospitalization and hospital charges. J Clin Microbiol. 2003;41:3119-3125 52. Munson E., Diekema DJ., Beekmann SE., Chapin KC., Doern GV. Detection and treatment of bloodstream infection: laboratory reporting and antimicrobial management. J Clin Microbiol. 2003;41:495-497 53. Barenfanger J, Graham DR, Kolluri L, Sangwan G, Lawhorn J, Drake CA, Verhulst SJ, Peterson R, Moja LB, Ertmoed MM, Moja AB, Shevlin DW, Vautrain R, Callahan CD. Decreased Mortality Associated With Prompt Gram Staining of Blood Cultures, Am J Clin Pathol 2008;130:870-876 54. Timbrook T, Boger MS, Steed LL,Hurst JM, 2015. Unanticipated Multiplex PCR Identification of Polymicrobial Blood Culture Resulting in Earlier Isolation, Susceptibilities, and Optimization of Clinical Care. J. Clin. Microbiol. 2015;53(7):2371-3 55. Bauer KA, West JE, Balada‐Llasat J, Pancholi P, Stevenson KB, Goff DA. An Antimicrobial Stewardship Program’s Impact with Rapid Polymerase Chain Reaction Methicillin‐Resistant Staphylococcus aureus / S. aureus Blood Culture Test in Patients with S. aureus Bacteremia. Clin. Infect. Dis. 2010;51(9):1074-1080. 56. Dierkes C, Ehrenstein B, Siebig S, Linde H-J, Reischl U, Salzberger B. Clinical impact of a commercially available multiplex PCR system for rapid detection of pathogens in patients with presumed sepsis. BMC Infect. Dis. 2009;9(1):126 57. Weinstein MP. Blood Culture Contamination: Persisting Problems and Partial Progress. J Clin Microbiol. 2003;41:2275-2278 58. Weinstein MP., Towns ML, Quartey SM. et al. The clinical significance of positive blood cultures in the 1990s: a prospective comprehensive evaluation of the microbiology, epidemiology and outcome of bacteremia and fungemia in adults. Clin Infect Dis. 1997;24:584-602 59. Applied Phlebotomy. Dennis J. Ernst, Dennis J. Ernst (MT(ASCP)). Lippincott Williams & Wilkins, 2005 60. Essentials Of Medical Laboratory Practice. Constance L Lieseke, Elizabeth A Zeibig. F.A. Davis, 2012 61. Qamruddin A, Khanna N, Orr D. Peripheral blood culture contamination in adults and venipuncture technique: prospective cohort study.J Clin Pathol. 2008 61:509-13 48. Ziegler R., Johnscher I., Martus P., Lendardt D., Just HM. Controlled Clinical Laboratory Comparison of Two Supplemented Aerobic and Anaerobic Media Used in Automated Blood Culture Systems To Detect Bloodstream Infections. J Clin Microbiol. 1998;36:657-661 49. Pohlman JK., Kirkley BA., Easley KA., Basille BA., Washington JA. Controlled Clinical Evaluation of BACTEC Plus Aerobic/F and BacT/ALERT Aerobic FAN Bottles for Detection of Bloodstream Infections. J Clin Microbiol. 1995;33:2856-2858 28 29 Empfehlungen zur Blutentnahme ZUSAMMENFASSUNG DER REGELN DER “GUTEN LABORPRAXIS“ A) Mittels Blutentnahme-Set mit Butterfly-Kanüle (bevorzugte Methode zur Blutentnahme)59, 60, 61 1. Vorbereitung der Blutentnahme Überprüfen Sie die Identität des Patienten und legen Sie vor Beginn der Blutentnahme alle dafür benötigten Materialien bereit. Vergewissern Sie sich, dass das Verfallsdatum der Blutkulturflaschen nicht überschritten ist. Verwenden Sie keine Flaschen mit Anzeichen einer Beschädigung, Qualitätsminderung oder Kontamination. Es wird empfohlen, die Markierung auf dem Flaschenetikett «Fill-to» zu verwenden oder Blutkulturflaschen etwa 10 ml über dem Füllstand des Mediums zu markieren, um die richtige Füllhöhe anzuzeigen. 3. Vorbereitung der Venenpunktionsstelle Falls die Haut sichtbar verschmutzt ist, reinigen Sie diese mit Wasser und Seife. Verwenden Sie eine Einweg-Staubinde und tasten Sie nach einer Vene. Verwenden Sie saubere Untersuchungshandschuhe (sterile Handschuhe sind nicht erforderlich). Reinigen Sie die Hautstelle mit einem geeigneten Desinfektionsmittel wie z. B. Chlorhexidin in 70 % Isopropyl-Alkohol oder mit einem mit Jodtinktur getränkten Tupfer oder Applikator. Die Punktionsstelle ist erst dann vollständig steril, wenn das Desinfektionsmittel komplett verdunstet ist. Waschen Sie Ihre Hände mit Wasser und Seife und trocknen Sie die Hände ab oder verwenden Sie ein alkoholbasiertes Händedesinfektionsmittel oder eine andere anerkannte wirksame Lösung zur Händedesinfektion. Entfernen Sie die Plastikschutzkappe der Blutkulturflaschen und desinfizieren Sie das Septum mittels eines Wattetupfers oder Applikators mit einem geeigneten und anerkannten Desinfektionsmittel wie z. B. Chlorhexidin in 70 % Isopropylalkohol, 70 % Isopropylalkohol oder Jod. Verwenden Sie für jede Flasche einen neuen Tupfer/Applikator. Lassen Sie das Gummiseptum zur vollständigen Desinfektion komplett trocknen. Falls Blut für zusätzliche Untersuchungen entnommen werden soll, kann ein Adaptereinsatz in der Adapterkappe erforderlich sein. Der Einsatz dient dazu, die Blutentnahmeröhrchen sicher auf der Nadel zu positionieren. Sind zusätzliche Blutuntersuchungen angefordert, nehmen Sie immer zuerst die Blutkultur ab. 7. Beenden der Blutentnahme 4. Blutentnahme Befestigen Sie ein Butterfly Blutentnahme-Set auf einer Adapterkappe*. Um eine Kontamination der Punktionsstelle zu verhindern, palpieren Sie die Vene vor dem Einstechen der Kanüle nicht erneut. Stechen Sie die Kanüle in die vorbereitete Punktionsstelle. 2. Vorbereitung der Flaschen 6. Zusätzliche Blutuntersuchungen 5. Beimpfung der Blutkulturflasche Setzen Sie die Adapterkappe zuerst auf die aerobe Blutkulturflasche und drücken Sie die Kappe gerade nach unten, um das Septum zu durchstechen. Halten Sie die Flasche unterhalb der Ebene der Entnahmestelle in aufrechter Position und nehmen Sie bei Erwachsenen 10 ml Blut pro Flasche ab und bei Kindern bis zu 4 ml Blut für eine pädiatrische Blutkulturflasche**. Stellen Sie sicher, dass die Flasche korrekt bis zur Markierung «Fill-to» oder bis zur angebrachten Sollfüllhöhe befüllt ist. Sobald die aerobe Flasche beimpft wurde, wiederholen Sie den Vorgang mit der anaeroben Flasche. Entsorgen Sie das Butterfly-Entnahmeset in einem Sicherheitsbehälter und decken Sie die Punktionsstelle mit einem geeigneten Verband ab. Ziehen Sie die Handschuhe aus und waschen Sie die Hände, bevor Sie die Dokumentation mit Angabe der Indikation, Datum, Entnahmezeitpunkt, Punktionsstelle und eventuellen Komplikationen durchführen. Bringen Sie zusätzliche Etiketten nur auf dem dafür vorgesehenen Feld auf dem Flaschenetikett an und achten Sie darauf, dass der Barcode auf der Blutkulturflasche nicht verdeckt wird. Stellen Sie sicher, dass die abreißbaren Barcode-Etiketten nicht entfernt wurden. Sollten die zusätzlichen Etiketten einen Barcode enthalten, platzieren Sie diese genauso wie den Flaschen-Barcode. Beimpfte Flaschen sollten schnellstmöglich zur Untersuchung ins Labor gebracht werden; gemäß den Richtlinien des CLSI möglichst innerhalb von 2 Stunden.(3) Falls Verzögerungen zu erwarten sind, befolgen Sie bitte unbedingt die Gebrauchsanweisung des Herstellers *Die Verwendung von Blutentnahme-Sets ohne Adapter ist nicht zu empfehlen. ** Halten Sie die Blutkulturflasche nicht horizontal oder kopfüber und nehmen Sie das Blut nicht mit einer Nadel ab, die direkt mit der Adapterkappe verbunden ist, da der Füllstand während der Abnahme nicht kontrolliert werden kann und ein Risiko für den Rückfluss von Medium aus der Flasche in den Blutkreislauf besteht. Diese Empfehlungen basieren auf den Best Practices zur Blutentnahme und Anlage von Blutkulturen der World Health Organization (WHO guidelines on drawing blood: best practices in phlebotomy. 2010. ISBN 978 92 4 159922 1). Die Best Practices können zwischen den Einrichtungen des Gesundheitswesens variieren; die geltenden Richtlinien der jeweiligen Einrichtung sind zu beachten. 30 Recommendations for blood culture collection A SUMMARY OF GOOD PRACTICE B) Mittels Spritze und Kanüle Konventionelle Nadeln und Spritzen sollten wann immer möglich durch die sichereren Blutentnahme-Sets mit Butterfly-Kanüle ersetzt werden.(59, 60, 61) Sie sollten nur verwendet werden, wenn die entsprechenden präventiven Maßnahmen zur Vermeidung eines versehentlichen Blutkontaktes konsequent eingehalten werden.* Nadeln dürfen nicht wieder verschlossen, absichtlich verbogen, mit der Hand abgebrochen, von der Einmalspritze abgezogen oder anderweitig mit der Hand manipuliert werden. Nadeln sollen nicht vor der Beimpfung der Flasche(n) mit Blut gewechselt werden. 1. Vorbereitung der Blutentnahme Überprüfen Sie die Identität des Patienten und legen Sie vor Beginn der Blutentnahme alle dafür benötigten Materialien bereit. Vergewissern Sie sich, dass das Verfallsdatum der Blutkulturflaschen nicht überschritten ist. Verwenden Sie keine Flaschen mit Anzeichen einer Beschädigung, Qualitätsminderung oder Kontamination. Es wird empfohlen, die Markierung auf dem Flaschenetikett «Fill-to» zu verwenden oder Blutkulturflaschen etwa 10 ml über dem Füllstand des Mediums zu markieren, um die richtige Füllhöhe anzuzeigen. 2. Vorbereitung der Flaschen Waschen Sie Ihre Hände mit Wasser und Seife und trocknen Sie die Hände ab oder verwenden Sie ein alkoholbasiertes Händedesinfektionsmittel oder eine andere anerkannte wirksame Lösung zur Händedesinfektion. Entfernen Sie die Plastikschutzkappe der Blutkulturflaschen und desinfizieren Sie das Septum mittels eines Wattetupfers oder Applikators mit einem geeigneten und anerkannten Desinfektionsmittel wie z. B. Chlorhexidin in 70 % Isopropylalkohol, 70 % Isopropylalkohol oder Jod. Verwenden Sie für jede Flasche einen neuen Tupfer/Applikator. Lassen Sie das Gummiseptum zur vollständigen Desinfektion komplett trocknen. 3. Vorbereitung der Venenpunktionsstelle Falls die Haut sichtbar verschmutzt ist, reinigen Sie diese mit Wasser und Seife. Verwenden Sie eine Einweg-Staubinde und tasten Sie nach einer Vene. Verwenden Sie saubere Untersuchungshandschuhe (sterile Handschuhe sind nicht erforderlich). Reinigen Sie die Hautstelle mit einem geeigneten Desinfektionsmittel wie z. B. Chlorhexidin in 70 % Isopropyl-Alkohol oder mit einem mit Jodtinktur getränkten Tupfer oder Applikator. Die Punktionsstelle ist erst dann vollständig steril, wenn das Desinfektionsmittel komplett verdunstet ist. 5. Beimpfung der Blutkulturflasche Nehmen Sie die Blutprobe ab. Überführen Sie das Blut in die Blutkulturflaschen, beginnend mit der anaeroben Flasche. Halten Sie die Flasche aufrecht und nehmen Sie bei Erwachsenen 10 ml Blut pro Flasche ab und bei Kindern bis zu 4 ml Blut für eine pädiatrische Blutkulturflasche. Stellen Sie sicher, dass die Flasche korrekt bis zur Markierung «Fill-to» oder bis zur angebrachten Sollfüllhöhe befüllt ist. Sobald die anaerobe Flasche beimpft wurde, wiederholen Sie den Vorgang mit der aeroben Flasche. 6. Beenden der Blutentnahme Entsorgen Sie die Kanüle und die Spritze in einem Sicherheitsbehälter und decken Sie die Punktionsstelle mit einem geeigneten Verband ab. Ziehen Sie die Handschuhe aus und waschen Sie die Hände, bevor Sie die Dokumentation mit Angabe der Indikation, Datum, Entnahmezeitpunkt, Punktionsstelle und eventuellen Komplikationen durchführen. Bringen Sie zusätzliche Etiketten nur in dem dafür vorgesehenen Feld auf dem Flaschenetikett an und achten Sie darauf, dass der Barcode auf der Blutkulturflasche nicht verdeckt wird. Stellen Sie sicher, dass die abreißbaren Barcode-Etiketten nicht entfernt wurden. Sollten die zusätzlichen Etiketten einen Barcode enthalten, platzieren Sie diese genauso wie den FlaschenBarcode. Beimpfte Flaschen sollten schnellstmöglich zur Untersuchung ins Labor gebracht werden; gemäß den Richtlinien des CLSI möglichst innerhalb von 2 Stunden.(3) Falls Verzögerungen zu erwarten sind, befolgen Sie bitte unbedingt die Gebrauchsanweisung des Herstellers. 4. Blutentnahme Befestigen Sie eine Kanüle auf einer Spritze. Um eine Kontamination zu verhindern, palpieren Sie die vorbereitete Vene vor dem Einführen der Nadel nicht erneut. Führen Sie die Kanüle in die vorbereitete Vene ein. * Beachten Sie anerkannte Richtlinien wie z. B. : http://www.who.int/injection_safety/phleb_final_screen_ready.pdf http://www.cdc.gov/niosh/docs/2000-108/pdfs/2000-108.pdf Diese Empfehlungen basieren auf den Best Practices zur Blutentnahme und Anlage von Blutkulturen der World Health Organization (WHO guidelines on drawing blood: best practices in phlebotomy. 2010. ISBN 978 92 4 159922 1). Die Best Practices können zwischen den Einrichtungen des Gesundheitswesens variieren; die geltenden Richtlinien der jeweiligen Einrichtung sind zu beachten. 05-17 / 9312781/010/DE/C / Dieses Dokument ist rechtlich nicht bindend. bioMérieux behält sich das Recht vor, ohne Mitteilung Änderungen vorzunehmen. BIOMÉRIEUX und das blaue Logo sind angemeldete und/oder eingetragene Marken von bioMérieux S.A. oder einer ihrer Niederlassungen oder Tochtergesellschaften. CLSI ist eine Marke der Clinical Laboratory and Standards Institute, Inc. Andere Namen oder Waren sind Eigentum ihrer jeweiligen Besitzer. / Fotos: Callimedia / bioMérieux S.A. 673 620 399 RCS Lyon / Gedruckt in Frankreich / théra RCS Lyon B 398 160 242 Weitere Broschüren: Fragen Sie Ihre örtliche bioMérieux-Vertretung. Die Inhalte dieser Broschüre haben nur empfehlenden Charakter und keinen Anspruch auf Vollständigkeit. Für die vom Mediziner gestellte Diagnose und die verordnete Therapie ist bioMérieux S.A. in keinster Weise haftbar. Wenden Sie sich immer an einen Ärztlichen Direktor, Arzt oder anderen qualifizierten Gesundheitsdienstleister im Hinblick auf die Prozesse und/oder Protokolle zur Diagnostik und Behandung von medizinischen Erkrankungen. bioMérieux Deutschland GmbH Weberstraße 8 72622 Nürtingen Tel.: 07022 3007-0 Fax : 07022 36110 www.biomerieux.de www.biomerieux-diagnostics.com