Identifizierung und Charakterisierung von Neuronen des Hirnstamms
Werbung
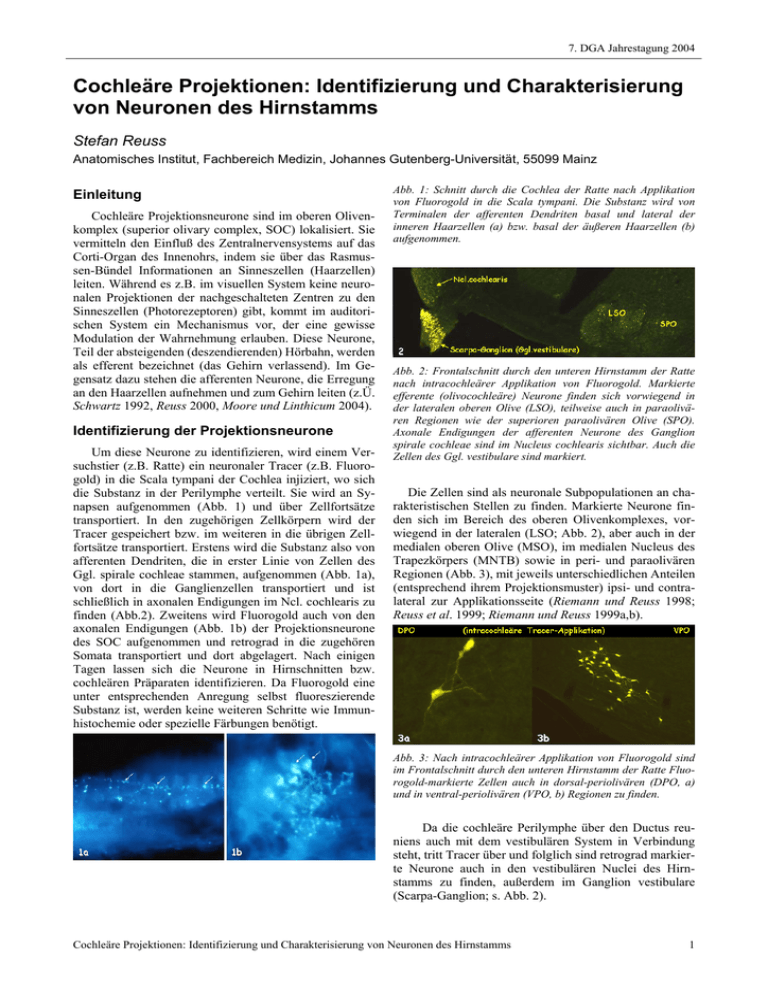
7. DGA Jahrestagung 2004 Cochleäre Projektionen: Identifizierung und Charakterisierung von Neuronen des Hirnstamms Stefan Reuss Anatomisches Institut, Fachbereich Medizin, Johannes Gutenberg-Universität, 55099 Mainz Einleitung Cochleäre Projektionsneurone sind im oberen Olivenkomplex (superior olivary complex, SOC) lokalisiert. Sie vermitteln den Einfluß des Zentralnervensystems auf das Corti-Organ des Innenohrs, indem sie über das Rasmussen-Bündel Informationen an Sinneszellen (Haarzellen) leiten. Während es z.B. im visuellen System keine neuronalen Projektionen der nachgeschalteten Zentren zu den Sinneszellen (Photorezeptoren) gibt, kommt im auditorischen System ein Mechanismus vor, der eine gewisse Modulation der Wahrnehmung erlauben. Diese Neurone, Teil der absteigenden (deszendierenden) Hörbahn, werden als efferent bezeichnet (das Gehirn verlassend). Im Gegensatz dazu stehen die afferenten Neurone, die Erregung an den Haarzellen aufnehmen und zum Gehirn leiten (z.Ü. Schwartz 1992, Reuss 2000, Moore und Linthicum 2004). Identifizierung der Projektionsneurone Um diese Neurone zu identifizieren, wird einem Versuchstier (z.B. Ratte) ein neuronaler Tracer (z.B. Fluorogold) in die Scala tympani der Cochlea injiziert, wo sich die Substanz in der Perilymphe verteilt. Sie wird an Synapsen aufgenommen (Abb. 1) und über Zellfortsätze transportiert. In den zugehörigen Zellkörpern wird der Tracer gespeichert bzw. im weiteren in die übrigen Zellfortsätze transportiert. Erstens wird die Substanz also von afferenten Dendriten, die in erster Linie von Zellen des Ggl. spirale cochleae stammen, aufgenommen (Abb. 1a), von dort in die Ganglienzellen transportiert und ist schließlich in axonalen Endigungen im Ncl. cochlearis zu finden (Abb.2). Zweitens wird Fluorogold auch von den axonalen Endigungen (Abb. 1b) der Projektionsneurone des SOC aufgenommen und retrograd in die zugehören Somata transportiert und dort abgelagert. Nach einigen Tagen lassen sich die Neurone in Hirnschnitten bzw. cochleären Präparaten identifizieren. Da Fluorogold eine unter entsprechenden Anregung selbst fluoreszierende Substanz ist, werden keine weiteren Schritte wie Immunhistochemie oder spezielle Färbungen benötigt. Abb. 1: Schnitt durch die Cochlea der Ratte nach Applikation von Fluorogold in die Scala tympani. Die Substanz wird von Terminalen der afferenten Dendriten basal und lateral der inneren Haarzellen (a) bzw. basal der äußeren Haarzellen (b) aufgenommen. Abb. 2: Frontalschnitt durch den unteren Hirnstamm der Ratte nach intracochleärer Applikation von Fluorogold. Markierte efferente (olivocochleäre) Neurone finden sich vorwiegend in der lateralen oberen Olive (LSO), teilweise auch in paraolivären Regionen wie der superioren paraolivären Olive (SPO). Axonale Endigungen der afferenten Neurone des Ganglion spirale cochleae sind im Nucleus cochlearis sichtbar. Auch die Zellen des Ggl. vestibulare sind markiert. Die Zellen sind als neuronale Subpopulationen an charakteristischen Stellen zu finden. Markierte Neurone finden sich im Bereich des oberen Olivenkomplexes, vorwiegend in der lateralen (LSO; Abb. 2), aber auch in der medialen oberen Olive (MSO), im medialen Nucleus des Trapezkörpers (MNTB) sowie in peri- und paraolivären Regionen (Abb. 3), mit jeweils unterschiedlichen Anteilen (entsprechend ihrem Projektionsmuster) ipsi- und contralateral zur Applikationsseite (Riemann und Reuss 1998; Reuss et al. 1999; Riemann und Reuss 1999a,b). Abb. 3: Nach intracochleärer Applikation von Fluorogold sind im Frontalschnitt durch den unteren Hirnstamm der Ratte Fluorogold-markierte Zellen auch in dorsal-periolivären (DPO, a) und in ventral-periolivären (VPO, b) Regionen zu finden. Da die cochleäre Perilymphe über den Ductus reuniens auch mit dem vestibulären System in Verbindung steht, tritt Tracer über und folglich sind retrograd markierte Neurone auch in den vestibulären Nuclei des Hirnstamms zu finden, außerdem im Ganglion vestibulare (Scarpa-Ganglion; s. Abb. 2). Cochleäre Projektionen: Identifizierung und Charakterisierung von Neuronen des Hirnstamms 1 7. DGA Jahrestagung 2004 Charakterisierung von Transmittersystemen Dieses neuronale Tracing läßt sich erfolgreich mit Methoden zur Untersuchung neuroaktiver Substanzen nutzen. Dabei kann untersucht werden, welche Transmittersubstanzen die identifizierten Neurone selbst bilden bzw. durch welche sie reguliert werden, was sich morphologisch als Innervation zeigen würde. In der Vergangenheit wurde das Vorkommen mehrerer Substanzen beschrieben, u.a. die Neurotransmitter Azetylcholin, Serotonin, GABA, Glutamat, Glycin sowie die Neuromodulatoren Substanz P und CGRP (z.Ü. Eybalin 1993). Die hier vorgestellten Untersuchungen konzentrierten sich auf eine Substanz, die einerseits als Neurotransmitter bzw. -modulator angesehen, andererseits mit der Regulierung des Blutflusses im Innenohrs in Verbindung gebracht wird. Es handelt sich dabei um das gasförmige, kurzlebige Molekül Stickstoffmonoxid („Stickoxid“, NO), das in Neuronen durch das Enzym neuronale NO-Synthase (nNOS) gebildet wird. Gegen dieses Peptid gerichtete Antiseren sind kommerziell erhältlich und können benutzt werden, um in Kombination mit neuronalem Tracing entsprechende neuronale Gruppen zu charakterisieren. Darüberhinaus sind Doppel- und Tripelmarkierungen verschiedener Transmitter mit unterschiedlichen Fluoreszenzfarben möglich (zu methodischen Aspekten s. Reuss und Reuss 2001). Stickoxid-produzierende Neurone im oberen Olivenkomplex Mit hoher Wahrscheinlichkeit kann aus dem Vorhandensein des Enzyms nNOS in einem Neuron auf die Produktion von Stickoxid durch diese Zelle geschlossen werden, wenn auch die quantitativen Aspekte (Aktivität des Enzyms) dabei nur in Näherung berücksichtigt werden können. Positive Neurone finden sich in allen Teilen des SOC in relativ großer Zahl (Reuss 1998), wobei nicht nur das Protein nachgewiesen werden kann, sondern auch durch in situ-Hybridisierung die entsprechende mRNA demonstriert wird (Abb. 4). Quantitative Untersuchungen an Meerschweinchen, Ratten und Hamstern in meinem Labor haben gezeigt, daß in der LSO sechs bis sieben Prozent der Neurone olivocochleäre Projektionsneurons sind, daß zehn bis 20 Prozent der LSO-Neurone nNOS enthalten, daß aber nur zwei bis vier Prozent der olivocochleären Neurone nitrerg sind (Abb. 5). Abb. 5: Kombinierte Darstellung im selben Schnitt der lateralen superioren Olivenregion (LSO) nach intracochleärer Applikation von Fluorogold (a) und mit immunhistochemischer Darstellung der neuronalen Stickoxidsynthase (nNOS, b). Pfeile deuten jeweils auf markierte Zellen hin. Während auch im MNTB nur fünf bis sechs Prozent der Neurone olivocochleäre Neurone sind, enthalten aber 50-70 % der Neurone nNOS und nahezu alle olivocochleären Neurone sind nitrerg (Abb. 6). Die übrigen olivären Zellgruppen (MSO und perioliväre) enthalten zwar nNOS-immunreaktive Zellen und Projektionsneurone, aber keine doppeltmarkierten Zellen. Abb. 6: Kombinierte Darstellung im selben Schnitt des medialen Nucleus des Trapezkörpers (MNTB) nach intracochleärer Applikation von Fluorogold (a) und mit immunhistochemischer Darstellung der neuronaler Stickoxidsynthase (nNOS, b). py=Pyramidenbahn Herkunft und Wirkung des cochleären Stickoxids Abb. 4: In situ-Hybridisierung zur Darstellung der mRNA für neuronale Stickoxid-Synthase (Frontalschnitt, Ratte). Signale finden sich vor allem in der lateralen Olive (LSO) und im medialen Nucleus des Trapezkörpers (MNTB), lokalisiert dorsal der Pyramidenbahn (py). Mehrere neurale Quellen stehen für cochleäres Stickoxid zur Verfügung. Erstens sind die meisten Ganglienzellen des Ggl. spirale cochleae nitrerg (Riemann und Reuss 1999a), zweitens stammt eine zusätzliche nitrerge Projektion aus dem Ggl. trigeminale (Ggl. Gasseri; s. Reuss und Riemann 1999b), drittens sind - wie hier gezeigt - auch Subpopulationen der cochleären Projektionsneurone sowie deren Synapsen nitrerg. Es kann daher davon ausgegangen werden, daß von Neuronen produziertes NO auch in der Cochlea zur Verfügung steht. Interessanterweise projiziert nur ein kleiner Teil der nitrergen Neurone des SOC in die Cochlea; ähnliches gilt - wie wir kürzlich gezeigt haben (Schaeffer et al. 2003) auch für die olivocolliculäre Projektion. Unsere nächsten Untersuchungen sollen klären, ob weitere NOproduzierende Zellen des SOC die Kerngebiete des Lateralen Lemniscus innervieren und/oder ob Stickoxid eher intrinsisch regulierende Aufgaben übernimmt. Besonders Cochleäre Projektionen: Identifizierung und Charakterisierung von Neuronen des Hirnstamms 2 7. DGA Jahrestagung 2004 interessante funktionelle Aspekte sind dabei alterskorrelierte Veränderungen (Reuss et al, 2000), NO-GlutamatWechselwirkung (Glutamat bewirkt Calcium-Influx, wodurch nNOS aktiviert wird), die Stimulation der cGMP-Produktion sowie verstärkte TransmitterFreisetzung durch NO, und die Regulation des cochleären Blutflusses. Auf jeden Fall aber stellt das Vorkommen dieser gefäßrelaxierenden, in höheren Konzentrationen jedoch neurotoxischen Substanz in oberem Olivenkomplex und Cochlea einen interessanten Aspekt physiologischer und pathophysiologischer Mechanismen des Innenohres dar (z.Ü. Reuss und Riemann 2000). Danksagung Ich danke U. Disque-Kaiser, PD Dr. R. Riemann und Dr. D. Schaeffer für wertvolle Hilfe, Kooperation und Diskussion sowie DFG und MAIFOR-Programm der Johannes Gutenberg-Universität für die finanzielle Förderung meiner Arbeiten am auditorischen Hirnstamm. Literatur Eybalin M (1993) Neurotransmitters and neuromodulators of the mammalian cochlea. Physiol Rev 73, 309-373 Moore JK, Linthicum FH (2004) Auditory System. In: The Human Nervous System, Second Edition, Elsevier (USA), pp. 1241-1279 Reuss MH, Reuss S (2001) Nitric oxide synthase neurons in the rodent spinal cord: Distribution, relation to substance P fibers, and effects of dorsal rhizotomy. J Chem Neuroanat 21, 181-196 Reuss S (1998) Nitric oxide synthase in the auditory brain stem. Neuroreport 9, 3643-3647 Reuss S (2000) Introduction to the superior olivary complex. Microsc Res Tech 51, 303-306 Reuss S, Riemann R (2000) Distribution and projections of nitric oxide synthase neurons in the rodent superior olivary complex. Microsc Res Tech 51, 318-329 Reuss S, Disque-Kaiser U, De Liz S, Ruffer M, Riemann R (1999) Immunofluorescence study of neuropeptides in identified neurons of the rat auditory superior olivary complex. Cell Tissue Res 297, 13-21 Reuss S, Schaeffer DF, Laages MH, Riemann R (2000) Evidence for increased nitric oxide production in the auditory brain stem of the aged dwarf hamster (Phodopus sungorus): An NADPH-diaphorase histochemical study. Mech Ageing Develop 112, 125-134 Riemann R, Reuss S (1998) Projection neurons in the superior olivary complex of the rat auditory brainstem: A double retrograde tracing study. Otorhinolaryngology 60, 278-282 Riemann R, Reuss S (1999a) Nitric oxide synthase in identified olivocochlear projection neurons in rat and guinea pig. Hearing Res 135, 181-185 Riemann R, Reuss S (1999b) Nitric oxide synthase in trigeminal ganglion cells projecting to the cochlea of rat and guinea pig. Neuroreport 10, 2641-2645 Schaeffer DF, Reuss MH, Riemann R, Reuss S (2003) A nitrergic projection from the superior olivary complex to the inferior colliculus of the rat. Hearing Res 183, 67-72 Schwartz IR (1992) The superior olivary complex and lateral lemniscal nuclei. In: Webster DB, Popper AN, Fay RF (Eds) The Mammalian Auditory Pathway: Neuroanatomy, Springer-Verlag, New York, pp. 117167 Cochleäre Projektionen: Identifizierung und Charakterisierung von Neuronen des Hirnstamms 3











