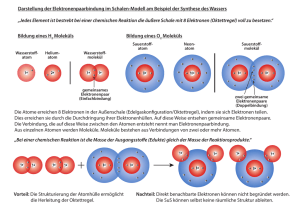
Infoblatt Atombindung
Werbung

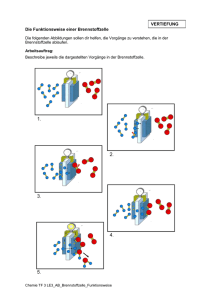
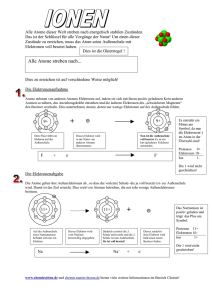
Name: Klasse: Datum: ACLT Atombindung Arbeitsauftrag: 1. Lesen Sie den Text durch! 2. Ergänzen Sie die Tabelle “Atombindung" mit Hilfe des Textes! 1. Wie entsteht eine Atombindung? Wenn Atome aufeinandertreffen, muss es nicht zu einem Elektronenübergang kommen, wie das z.B. bei den elektronenabgebenden Alkalimetallatomen (1. Hauptgruppe) und den Atomen elektronenaufnehmender Elemente wie Chlor oder Sauerstoff leicht möglich ist. Das elektrische Kraftfeld des positiv geladenen Atomkerns reicht über das Atom hinaus. Atome können daher die Elektronen anderer Atome anziehen. Beim Aufeinandertreffen von zwei Nichtmetallatomen können die Elektronen des einen Atoms in den Anziehungsbereich des Atomkerns des anderen geraten. Auf diese Weise können zwei Atome einander festhalten (Bindung). Die Nichtmetallatome können gleich oder unterschiedlich sein. Die Bindung kommt zustande, weil das bindende Elektronenpaar von beiden Atomkernen der Nichtmetallatome angezogen wird. Gleichzeitig schirmt das bindende Elektronenpaar die Kerne voneinander ab und verringert die Abstoßung zwischen ihren positiven Ladungen. Das Elektronenpaar bildet den ,,Klebstoff“, der die Atome zusammenhält. Die Bindung zwischen den Atomen wird durch die (negativ geladenen) Elektronen zwischen den (positiv) geladenen Atomkernen bewirkt. Auf diese Weise entsteht aus zwei Atomen ein Molekül (s. Abb. 1: Molekül). Atomkern (positiv geladen) Abb. 1: Molekül Diese Bindungsart bezeichnet man als Atombindung, Elektronenpaarbindung oder kovalente Bindung. Zwei Elektronen (mit entgegengesetztem Spin) bilden durch Kopplung ein Bindungselektronenpaar, zu dem jeder Partner ein Elektron geliefert hat. Das bindende Elektronenpaar wird als Strich dargestellt. 2. Bekannte Beispiele sind die Bildung der Moleküle Wasserstoff (H2) und Chlor (Cl2) Das Wasserstoffmolekül H2 ist das einfachste Beispiel einer Atombindung. Bei der Annäherung zweier Wasserstoffatome durchdringen sich die Elektronenhüllen, so dass (von einem Standpunkt aus betrachtet) jedes Wasserstoffatom die Elektronenanordnung des Edelgases Helium erhält. H• + •H Darstellung in Form von Orbitalen: H •• H A n o r g a n i s c h e Name: Klasse: Datum: C h e m i e Atombindung Die Elektronenhüllen der beiden Chloratome durchdringen sich so, dass jedes Atom die Elektronenanordnung des Edelgases Argon erreicht. Von den acht Elektronen, die jedes Chloratom für sich beansprucht, stammen sieben von ihm selbst, eines ist vom anderen Chloratom „entlehnt“. Diese beiden gemeinsam genutzten Elektronen bewirken die Bindung, sie werden als bindendes Elektronenpaar bezeichnet. Cl + Cl Cl Cl Cl + Cl Cl Cl 3. Warum gehen Atome Atombindungen ein? Das Erreichen der Edelgaskonfiguration und damit ein energiearmer stabiler Zustand können auch hier als Triebkraft für die Bildung von Molekülen (Verbindungen) aus Atomen (Elementen) angesehen werden. Im H2-Molekül kann jedes Atom die mit zwei Elektronen besetzte Außenschale des Heliums erlangen und im Cl2-Molekül hat jedes Chloratom die mit acht Elektronen besetzte Außenschale des Argons (Oktettbesetzung). Durch das Erreichen der Edelgaskonfiguration befinden sich die Moleküle in einem energieärmeren und damit stabileren Zustand als wenn sie in Form der einzelnen Atome vorliegen. So wird beispielsweise bei der Bildung des Wasserstoffmoleküls aus den einzelnen Wasserstoffatomen Energie frei (436,3 kJ/mol). D.h., das Wasserstoffmolekül ist energieärmer und somit stabiler als die beiden einzelnen Wasserstoffatome. 4. Eigenschaften von Stoffen mit Atombindungen Atombindungen wirken nur innerhalb von Molekülen. Die einzelnen Moleküle beeinflussen sich untereinander nicht. Daraus folgen typische Eigenschaften für diese Verbindungen. Kleine Moleküle bilden Gase (Beispiele: H2, Cl2, O2 und N2), größere Moleküle gehören zu leicht verdampfbaren Flüssigkeiten (Beispiele: Organische Flüssigkeiten, Kohlenwasserstoffe). Feste Stoffe mit Atombindungen sind selten (z.B.: Diamant oder Silicium bilden Atomgitter). Die meisten Stoffe mit Atombindungen wie Gase und Flüssigkeiten haben folglich niedrige Schmelz- und Siedepunkte. Dieses ist darauf zurückzuführen, dass die Moleküle nach außen hin meist neutral sind und dadurch üben sie nur schwache Anziehungskräfte aufeinander aus. Die Verformbarkeit von Gasen und Flüssigkeiten ist sehr hoch, da zwischen den Stoffen mit Atombindungen keine starken Anziehungskräfte bestehen. Wegen des Fehlens von Ladungen und freien Elektronen sind die genannten Stoffe elektrische Nichtleiter.