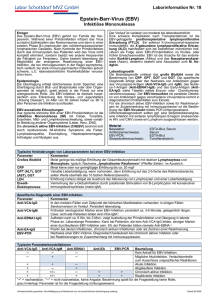
EBV-Infektion - Stufendiagnostik bei immunkompetenten Patienten
Werbung

fhg – Zentrum für Gesundheitsberufe Tirol GmbH FH-Bachelor-Studiengang Biomedizinische Analytik EBV-Infektion Stufendiagnostik bei immunkompetenten Patienten Bachelorarbeit 2 VerfasserIn: Sabine Legner BetreuerIn: Dr. Maria Elisabeth Mustafa-Korninger Innsbruck, im August 2013 Inhaltsverzeichnis 1. Zusammenfassung! 3 2. Abstract! 4 3. Ziel der Arbeit! 5 4. Einleitung! 6 4.1 Spezifische Antigene! 7 4.2 Serologische Nachweismethoden! 10 4.3 Spezifische Antikörper! 11 4.4 Vergleich der unterschiedlichen Vorgehensweisen! 14 4.5 Vergleich der Interpretationen! 17 5. Material und Methoden! 24 6. Ergebnisse! 29 7. Schlussfolgerung! 33 8. Literatur! 38 2 1. Zusammenfassung Die infektiöse Mononukleose ist eine Erkrankung mit Symptomen wie akuter Tonsillitis, Lymphknotenschwellungen, Hepatosplenomegalie und Mononukleose (atypische Lymphozyten und mononukleäre Zellen) [1]. Durch die Labordiagnostik soll eine Infektion mit EBV (Epstein-Barr Virus) bestätigt werden. Andere Ursachen wie Infektionen mit Cytomegalievirus (CMV), Parvovirus B19, HHV-6 (humanes Herpesvirus 6), HIV oder Toxoplasma gondii sollen ausgeschlossen werden. In der EBV-Serologie gibt es verschiedenste in der Literatur beschriebene diagnostische Wege und Befundinterpretationen. Ausgegangen wird zum Beispiel von der Bestimmung der Antikörper gegen VCA (IgM und IgG) und EBNA-1 (IgG) in einem Schritt. Beschrieben werden auch Vorgehensweisen beginnend mit der Detektion der Antikörper gegen EBNA-1 oder einem IgG-Immunoblot. Dadurch entstehen verschiedene Möglichkeiten der Befundinterpretation. Zur Abklärung einer EBV-Infektion werden zwei IgG-Nachweise (VCA-IgG und EBNA-1-IgG) und ein IgM-Nachweis (VCA-IgM) empfohlen. Ziel der Arbeit ist es, festzustellen, ob zwei unterschiedliche IgG-Bestimmungen notwendig sind, um zwischen einer frischen Infektion, einer durchgemachten Infektion oder einer Seronegativität zu unterscheiden. Verglichen wurde, ob die Interpretation der Ergebnisse der Antikörperbestimmung von EBNA-1-IgG und VCA-IgM zur gleichen Aussage führt. Insgesamt wurden retrospektiv die Befundinterpretationen von 381 PatientInnen verglichen. Die labordiagnostische Untersuchung erfolgte mittels einem Chemilumineszenzassay (CLIA) mit Liaison XL (DiaSorin, Saluggia, Italien). Getestet wurden bei allen PatientInnen die Antikörper gegen VCA-IgG, VCA-IgM und EBNA-1-IgG. Die ursprüngliche Interpretation erfolgte nach der empfohlenen Vorgehensweise der Firma DiaSorin. Mit den von der Firma DiaSorin vorgegebenen Grenzwerte wurde eine Übereinstimmung der Interpretationen von 72,22 % gefunden. Wurden die Grenzwerte bei EBNA-1-IgG mit 20 E/mL und bei VCA-IgM mit 50 E/mL gerechnet, waren die Befundinterpretationen zu 91,53 % gleich. 3 2. Abstract Infectious mononucleosis is a syndrome with symptoms like lymphadenopathy and pharyngitis, hepatosplenomegalie and an increase in the number of the mononuclear cells. [1] It is important, to ensure an infection with EBV (EpsteinBarr Virus). There are several causes who have to be excluded, for example other infectious diseases induced by cytomegalovirus (CMV), parvovirus B19, HHV-6, HIV or Toxoplasma gondii. Many ways of diagnosis and interpretations are shown in the journals. One possibility based on detection of antibodies against VCA (IgM und IgG) and EBNA-1 (IgG) at the same time. A further alternative is the search for EBNA-1-IgGantibodies or the detecting of IgG-antibodies by immunoblotting. This is due to have many ways to report an interpretation by the resulsts. Two tests for detecting IgG-antibodies (VCA-IgG and ENBA-1-IgG) and one test for the search for IgM-antibodies are in use. Object of this paper is to show, if there is a need for using all three tests to distinguish acute from past infection and from seronegativity. The interpretation of the res ults from the detection of EBNA-1-IgG antibodies and VCA-IgM-antibodies was compared with the primary interpretation. In total there were 381 samples, which were evaluated retrospectively. The sera were measured with a chemiluminescent immunoassay (CLIA) by Liaison XL (DiaSorin, Saluggia, Italien). IgG-antibodies against EBNA-1 and VCA and IgM-antibodies against VCA have been detected in each sample. The primary interpretation is based on the recommendation from DiaSorin. Using the predefined values the agreement was 72,22 %. By calculating the results with new values (EBNA-1-IgG: 20 E/mL and VCA-IgM: 50 E/mL) there was an accordance of 91,53 %. 4 3. Ziel der Arbeit Ziel der Arbeit ist es, anhand der erhobenen Testergebnisse eine Stufendiagnostik zur Abklärung einer EBV-Infektion zu erstellen. Es soll zwischen einer Primärinfektion, einer bereits durchgemachten EBV-Infektion und einer Seronegativität unterschieden werden. In der angeführten Literatur ist ausreichend beschrieben, dass die Bestimmung der Antikörper gegen VCA (IgG und IgM) und EBNA-1 dafür genügt. Durch eine retrospektive Datenerhebung und deren Auswertung soll gezeigt werden, dass für die Routinediagnostik die Antikörperbestimmung von VCA-IgM und EBNA-1-IgG in den meisten Fällen ausreichend ist. Nur bei fraglichen Ergebnissen ist eine weitere Abklärung erforderlich. Durch diese Stufendiagnostik kann die Aussage der Antikörperbestimmung eventuell erhöht werden. Es soll gezeigt werden, dass es sinnvoll ist, auch das Alter der Patienten und andere Marker wie eine reaktive Lymphozytose oder erhöhte Transaminasen in die Interpretation der Ergebnisse mit einzubeziehen. Diese stufenweise Vorgehensweise soll eine individuelle, ökonomisch sinnvolle und aussagekräftige Labordiagnostik ermöglichen. Nicht eingegangen wird auf die Besonderheiten bei EBV-assoziierten Erkrankungen und immunsupprimierten Patienten. 5 4. Einleitung Das humanpathogene Epstein-Barr-Virus ist der wichtigste Erreger der infektiösen Mononukleose. Der Mensch ist der einzige Wirt für das EBV. Eine Infektion mit dem EBV erfolgt meist im Kindheitsalter und verläuft in der Mehrzahl aller Fälle symptomlos. Bei Erreichen des Erwachsenenalters haben die meisten Menschen eine EBV-Infektion durchgemacht. Die Durchseuchungsrate wird auf 90 bis fast 100 % [1,2,3,4,6,7,9,10,15,19] in der angegebenen Literatur geschätzt. Beim EBV handelt es sich um ein doppelsträngiges DNA-Virus. Es besteht aus einer Hülle, dem Tegument und einem isokaedrischen Kapsid. [1] Übertragen wird das Epstein-Barr-Virus über den Speichel als Tröpfchen- oder Kontaktinfektion. [1] Die Dauer der Inkubationszeit wird in der Literatur unterschiedlich beschrieben. Dabei werden Zeiträume von 14 bis 50 Tagen oder 4 bis 8 Wochen [1], von 30 bis 50 Tagen [1] oder 4 bis 6 Wochen [5] angegeben. Kommt es zu einem Infektionsverlauf mit klinischer Symptomatik, kann man auch labordiagnostisch Veränderungen, wie eine Erhöhung der Transaminasen oder eine Vermehrung der Lymphozyten, finden. Die Lymphozytose ist durch die charakteristische Vermehrung mononukleärer Zellen bedingt. Zur Bestätigung einer EBV-Infektion wird in der Routine heute der serologische Nachweis von Antikörpern durchgeführt. Der Erregernachweis mittels PCR ist nur in speziellen Fragestellungen, wie z. B. bei immunsupprimierten Patienten oder bei EBV-assoziierten Erkrankungen, indiziert. Folgende Antigene werden als Zielantigene für den Nachweis einer EBV-Infektion eingesetzt: 6 4.1 Spezifische Antigene VCA (Virus-Kapsid-Antigen) Das isokaedrische Kapsid wird aus 5 Proteinen gebildet und besteht aus 162 Kapsomeren [1]. Gegen einzelne Proteine des Virus-Kapsid-Antigens werden zu verschiedenen Zeitpunkten der Infektion in unterschiedlicher Häufigkeit Antikörper gebildet. Für den Antikörpernachweis werden hauptsächlich Protein 23 (p23), Protein 18 (p18) und Glykoprotein 125 (gp125) eingesetzt. [3] Gegen die Proteine der VCAs können IgM-, IgG- und IgA-Antikörper gebildet werden. Bei einer Primärinfektion sind IgM-Antikörper häufig vor IgG-Antikörpern nachweisbar. Diese können jedoch nicht immer, aber meist [1,4] serologisch erfasst werden. Angegeben wird eine Nachweisbarkeit von IgM-Antikörpern in zirka 90 % der Fälle [3]. Unabhängig vom Krankheitsverlauf sind IgM-Antikörper längere Zeit nachweisbar. VCA-IgG-Antikörper persisitieren lebenslang. [1,3,4,9,11,20] Bei dem EBV-assoziierten Nasopharynxkarzinom können VCA-IgA-Antikörper bereits bei der Entstehung des Karzinoms nachgewiesen werden. In diesem Fall hat die Bestimmung von VCA-IgA eine prognostische Bedeutung. [9] EBNA (Epstein-Barr-Virus Nukleotid Antigen) Bisher wurden mehrere EBNA-Proteine beschrieben. Dazu gehören EBNA-1, EBNA-2, EBNA-3A/B/C und EBNA-LP [1]. In der Diagnostik wird der Nachweis von IgG-Antikörpern gegen EBNA-1 und EBNA-2 eingesetzt. Antikörper gegen EBNA-1-Proteine werden Wochen bis Monate nach Krankheitsbeginn gebildet. EBNA-1-IgG-Antikörper sind lebenslang nachweisbar [4,11,20]. Daher ist der Nachweis von EBNA-1-IgG-Antikörpern beweisend für eine früher stattgefundene Infektion. EBNA-2-IgG-Antikörper sind möglicherweise schon während einer Primärinfektion aber auch später zu finden. [1,2,3,4,5] 7 EBNA-2-Antikörper eignen sich daher nicht zur Differenzierung einer Primärinfektion oder einer früher durchgemachten Infektion. Deshalb sollten die in der Routine eingesetzten Tests spezifisch auf EBNA-1-Antikörper sein. [1,3] In seltenen Fällen kann es vorkommen, dass die IgG-Antikörper gegen EBNA-1 unter die Nachweisgrenze sinken oder erst gar nicht gebildet werden. Hier ist eine weiterführende Diagnostik indiziert. [3,4] EA (Early Antigen) In der Immunfluoreszenz sind bisher zwei Early-Antigen-Proteine beschrieben worden. Man unterscheidet das Early-Antigen diffuse (EA-D) und das EarlyAntigen restricted (EA-R). [16] Serologisch können EA-D und EA-R nicht unterschieden werden. Nachweisbar sind Antikörper der Immunglobulinklassen G und A gegen EA. Bei 30 - 85 % der PatientInnen mit einer Primärinfektion kommt es zur Bildung von Antikörpern gegen EA [3] in den ersten 3 bis 4 Wochen [20]. Die EA-Antikörper sind 3 bis 4 Monate nachweisbar [20]. In 20 - 30 % der Fälle bleiben diese für Jahre bestehen [16,20]. Dem Nachweis der EA-Antikörper wird in den verschiedenen Arbeiten eine unterschiedliche Bedeutung gegeben. Teils wird angegeben, dass die Erfassung der Antikörper gegen EA von keiner und geringer Bedeutung in der Routine ist [1,2,3,4]. Andererseits wird beschrieben, dass zur Unterscheidung zwischen einer Primärinfektion und einer Reaktivierung ein Antikörpernachweis gegen EA sensitiver ist als die Bestimmung von Antikörpern gegen VCA-IgM [5]. Hohe Titer von EA-Antikörpern findet man bei Patienten mit Nasopharyngealkarzinom oder bei Reaktivierung [20]. 8 MA (Membranantigen) Das Membranantigen besteht aus den drei Glykoproteinen gp350, gp250 und gp85. Diese befinden sich auf der viralen Oberfläche und auf der Membran von infizierten Zellen. [20] Antikörper, die gegen Membranglykoproteine gerichtet sind, scheinen einen Einfluss auf die Ausbreitung der EBV-Infektion zu haben und schützen vor einer Refinfektion [20]. MA-Antikörper sind neutralisierend und steigen während einer frischen Infektion langsam an. Die MA-Antigene finden gelegentlich Anwendung bei Blot-Tests. [3] In kommerziell erhältlichen Testsystemen werden für die serologische Diagnostik unterschiedliche Antigene eingesetzt. Üblicherweise kommen die Antikörper gegen VCA (IgM und IgG) und EBNA-1 (IgG) zum Einsatz. Der Nachweis von EAAntikörpern hat sich in der Routinediagnostik nicht durchgesetzt. Die eingesetzten Antigene werden unterschiedlich hergestellt. Heute werden üblicherweise statt nativ aufgereinigten Antigenen rekombinant hergestellte Antigene verwendet. Rekombinant erzeugte Antigene sind in ihrer Struktur eindeutig definierbar. Dadurch ist ihre Sensitivität und Spezifität besser erfassbar. Allerdings geht dadurch die Tertiär- und Quartärstruktur der Proteine verloren. Die Mehrzahl der Hersteller verwendet bei VCA-IgG und VCA-IgM rekombinant hergestelltes Protein 18 (p18). Immulite arbeitet beim Nachweis von VCA-IgGAntikörpern mit Glykoprotein 125 (gp125). Bei Euroimmun kommen nativ aufgereinigte Antigene zum Einsatz. Nicht spezifiziert werden die verwendeten Antigene bei der Bestimmung am Architect. Beim Antigen EBNA-1 kommt meist ein rekombinant hergestelltes Antigen zur Anwendung. Immulite und Vidas verwenden Protein 72 (p72). Bei allen anderen wird das genaue Antigen nicht angegeben. Tabelle1 zeigt einen Vergleich der von den Herstellern angegebenen Antigene. 9 Tabelle 1: Vergleich der angegebenen Antigene. Quelle: [12-19,21-23] Antigen VCA-IgG VCA-IgM EBNA-1 synthetisches p18 synthetisches synthetisches EBNA-1 Architect VCA-Antigen VCA-Antigen EBNA-1 Antigen Immulite gp125 rekombinantes p18 rekombinantes p72 Vidas rekombinantes p18 rekombinantes p18 rekombinantes p72 ELISA DiaSorin rekombinantes p18 rekombinantes p18 rekombinantes EBNA-1 Enzygnost rekombinantes p18 rekombinantes p18 - Novagnost rekombinantes p18 rekombinantes p18 rekombinantes EBNA-1 Euroimmun nativ, Mischung aus versch. viralen Kapsidantigenen nativ, gp125 aus EBVinfizierten P3HR1Zellen rekombinant, Expression aus Insektenzellen Liaison XL 4.2 Serologische Nachweismethoden Heterophile Antikörper Paul und Bunnell entdeckten, dass das Serum von Patienten mit einer infektiösen Mononukleose Schaferythrozyten agglutiniert. Dabei handelt es sich um unspezifische IgM-Antikörper [11]. Nach den Entdeckern wurde dieser Test PaulBunnell-Test benannt. Dieser Schnelltest ist Mononukleose-spezifisch, aber nicht EBV-spezifisch. Zuerst erfolgt eine Vorabsorption der nicht-mononukleose-typischen GewebsAutoantikörper. Danach werden die heterophilen Antikörper über die Antigene auf tierischen Erythrozyten nachgewiesen. [1] Bei atypischen Verläufen weist der Test nur eine geringe Sensitivität auf. Bei einer HIV-Primärinfektion kann dieser falsch positiv sein. [1] Bei Kindern sind die unspezifische Abwehr und die Bildung von heterophilen Antikörpern noch nicht so 10 ausgeprägt. Im Alter von 2 bis 5 Jahren können bei 50 % der Kinder keine heterophilen Antikörper nachgewiesen werden [4]. Dieser Test ist heute durch die spezifischen Antikörpernachweise abgelöst worden. 4.3 Spezifische Antikörper IIFT (indirekter Immunfluoreszenztest) Als Goldstandard für die EBV-Serologie wird der indirekte Immunfluoreszenztest (IIFT) beschrieben [4,10,15,17]. Verwendet werden humane EBV-transformierte B-Zell-Linien von Patienten mit Burkitt-Lymphom (P3HR-1 Zelllinie) oder die Raji Zelllnie. Beide Zelllinien unterscheiden sich in der Expression ihrer Antigene. Die Raji Zelllinie exprimiert EBNAs und keine VCA, die P3HR-1 Zelllinie produziert EBNA-1 und in 5 - 20 % VCA im Zellkern. [4] Der IIFT ist arbeitsaufwändig, nicht automatisierbar und die Interpretation ist subjektiv [10,15,17]. Daher ist diese Nachweismethode in der Routinediagnostik nicht einsetzbar. In der Routinediagnostik werden heute meist enzyme-linked immunosorbent assays (ELISA) und Chemilumineszenzassays (CLIA) verwendet. Die Resultate sind mit den Ergebnissen des IFT vergleichbar [3] Enzyme-linked immunosorbent assay (ELISA, EIA) Der ELISA wird normalerweise in einer Mikrotiterplatte durchgeführt. An die feste Phase (Mikrotiterplatte) ist ein definiertes Antigen gebunden. Durch die Verwendung eines bekannten Antigens kommt es bei Vorhandensein des passenden Antikörpers im Serum der PatientInnen zu einer Antigen-AntikörperReaktion. Die gesuchten Antikörper werden mit Hilfe einer Enzym-SubstratReaktion gemessen. 11 Abb. 1: Prinzip eines ELISA. Quelle: http://www.piercenet.com/browse.cfm? fldID=F88ADEC9-1B43-4585-922E-836FE09D8403 Wie in Abbildung 1 gezeigt, gibt es beim ELISA verschiedene Möglichkeiten. Man unterscheidet grundsätzlich zwischen der direkten, der indirekten und der „Sandwich“-Methode. Beim direkten ELISA ist die feste Phase mit einem definierten Antigen beschichtet. Der im Serum eventuell vorhandene Antikörper bindet an das Antigen. (siehe Abbildung 1, Direct Assay) Der indirekte ELISA beinhaltet zwei Schritte. Ist in der Probe der gesuchte Antikörper (primärer Antikörper) vorhanden, bindet dieser an das definierte Antigen. Ein weiterer markierter Antikörper (sekundärer Antikörper) erkennt den ersten, bereits gebundenen Antikörper. (siehe Abbildung 1, Indirect Assay) Bei der Sandwichmethode wird das vorhandene Antigen zwischen zwei Antikörpern detekiert. Die feste Phase ist mit einem bekannten Antikörper (capture antibody) beschichtet. Das Antigen bindet an diesen. Ein primärer Antikörper, der unmarkiert ist, erkennt das Antigen und adsorbiert daran. An diesen Antikörper bindet ein markierter, sekundärer Antikörper. Gemessen wird die durch den Substratumsatz erzeugte Farbreaktion. [8] Diese Methoden kommen bei ELISA DiaSorin, Novagnost und Enzygnost zum Einsatz. 12 Enzyme-linked fluorescence assay (ELFA) Das selbe Prinzip wie beim ELISA findet man beim ELFA. Der einzige Unterschied besteht darin, dass statt einer Farbreaktion eine Fluoreszenzreaktion stattfindet, die gemessen wird. Vidas arbeitet mit dieser Methode. Chemiluminescence immuno assay (CLIA), Chemiluminescent microparticle immunoassay (CMIA) Beim CLIA und CMIA werden als feste Phase magnetische Partikel (Beads) verwendet. Die Antigen-Antikörper-Reaktion funktioniert gleich wie beim ELISA. Gemessen wird die Chemilumineszenz. Mit dem CLIA arbeiten Liaison XL und Immulite. Der CMIA wird beim Architect eingesetzt. Immunoblot Der Vorteil eines Immunoblots liegt darin, dass mehrere Antigene auf einem Streifen aufgebracht sind. Durch den Einsatz mehrerer Antigene erhält man eine höhere Aussagekraft der Ergebnisse. In den angegebenen Blotsystemen kommen rekombinant hergestellte oder nativ aufgereinigte Antigene zum Einsatz. Verwendet werden verschiedene Antigene wie p72 (EBNA-1), p18 (VCA), p23 (VCA), p54 (EA) und p138 (EA) [4]. Es finden sich auch Testsysteme, in denen gp350/250 (MA) und ZEBRA (IEA - Immediate Early Antigen) eingesetzt werden. Immunoblots zum Nachweis für IgM- und IgG-Antikörper sind zur Bestätigung eines Screeningtests geeignet. [20] Da die einzelnen Testsysteme unterschiedliche Antigene und Reagenzien verwenden, sind sie untereinander schwer vergleichbar. Diese Methode verwendet Euroimmun. 13 4.4 Vergleich der unterschiedlichen Vorgehensweisen In den Abbildungen 2 bis 4 findet sich ein Vergleich der unterschiedlichen Diagnosewege wie sie in der Literatur aufgezeigt werden. Teilweise sind auch die Befundinterpretationen enthalten. Das Vorgehen für die Diagnostik richtet sich nach den nachgewiesenen Antikörpern. EBNA-1-IgG positiv negativ schwach positiv alte Infektion VCA* negativ positiv hoher Titer keine EBV-Infektion Primärinfektion Reaktivierung VCA-IgM Bestätigung Primärinfektion Abb. 2: Stufendiagnostik und Interpretation einer EBV-Infektion. Quelle: Thomas, Lothar: Labor und Diagnose. Frankfurt/Main: TH-Books Verlagsgesellschaft mbH, 2012, 8. Auflage, Band 2 [5] * nicht näher definiert Die in Abbildung 2 dargestellte Vorgehensweise wird damit begründet, dass die Antikörper gegen EBNA-1 erst spät im Verlauf einer EBV-Infektion gebildet werden. In die Entscheidungsfindung wird auch die Höhe der nachgewiesenen 14 Antikörper mit einbezogen. Der Nachweis von Antikörpern gegen EBNA-1 ist beweisend für eine durchgemachte Infektion mit EBV. Bei negativem oder schwach positivem Ergebnis (erste Titerstufe) der EBNA-1-IgG-AntikörperBestimmung sollen Antikörper gegen VCA bestimmt werden. Fällt dieser Nachweis negativ aus, liegt keine EBV-Infektion vor. Sind hohe Titer nachweisbar (ab 1:160), handelt es sich wahrscheinlich um eine relativ frische oder reaktivierte Infektion. Durch einen positiven Nachweis von VCA-IgM-Antikörpern kann eine Primärinfektion bestätigt werden. [5] Da die Testergebnisse mit Titerstufen angegeben werden, sind die Bestimmungen höchstwahrscheinlich mit einem IFT durchgeführt worden. EBNA-1-IgG positiv negativ alte Infektion VCA-IgG positiv negativ VCA-IgM seronegativ positiv Primärinfektion negativ weiterführende Diagnostik Abb. 3: EBV-Testkonzept: Ablauf- und Interpretationsschema einer immunglobulinklassenorientierten Diagnostik. modifiziert nach Abb. 35.9 Quelle: Neumeister, Birgit et al.: Mikrobiologische Diagnostik. Stuttgart/New York: Georg Thieme, 2009, 2., vollständig überarbeitete Auflage [3] 15 Bei der in Abbildung 3 gezeigten immunglobulinklassenorientierten Diagnostik kommen die Parameter VCA-IgG, VCA-IgM und EBNA-1-IgG zum Einsatz. Dabei handelt es sich um eine Kombination von spezifischen IgM- und IgG-Antikörpern. [3] Unspezifische Reaktionen im Rahmen anderer Viruserkrankungen werden bei der Konstellation EBNA-1-IgG negativ, VCA-IgG und VCA-IgM positiv nicht berücksichtigt. EBV-Blot-IgG VCA-positiv EBNA-1- oder p18-positiv VCA-positiv EBNA-1- und p18-negativ EBV-Blot-IgG Avidität hochavide Antikörper alte Infektion niedrigavide Antikörper Primärinfektion Abb. 4: EBV-Testkonzept: Ablauf- und Interpretationsschema einer aviditätsorientierten Diagnostik. modifiziert nach Abb. 35.10 Quelle: Neumeister, Birgit et al.: Mikrobiologische Diagnostik. Stuttgart/New York: Georg Thieme, 2009, 2., vollständig überarbeitete Auflage [3] Ausgegangen wird von einem IgG-Immunoblot, der Antigene von VCA und EBNA-1 enthält. Werden VCA-Antikörper isoliert nachgewiesen, erfolgt eine Bestimmung der Avidität. Die aviditätsorientierte Diagnostik nimmt darauf Bezug, dass bei einer Primärinfektion nur niedrigavide Antikörper gebildet werden. Im späteren Verlauf sind nur noch hochavide Antikörper nachweisbar [1,3]. Dadurch kann, wie in Abbildung 4 gezeigt, eine Unterscheidung zwischen Primärinfektion und durchgemachter Infektion unterschieden werden. [3] 16 4.5 Vergleich der Interpretationen Serologisch findet man mit dem Auftreten der klinischen Symptomatik IgM- und IgG-Antikörper gegen das Virus-Kapsid-Antigen (VCA). IgG-Antikörper gegen EBNA-1 sind erst im weiteren Verlauf der Infektion nachweisbar. Während der akuten Phase der Infektion können eventuell VCA-IgG-Antikörper in geringerer Konzentration als VCA-IgM-Antikörper nachgewiesen werden. Nach drei bis sechs Monaten nach Infektionsbeginn verschwinden die Antikörper gegen VCA-IgM und es werden Antikörper gegen EBNA-1 gebildet. Die Antikörper gegen EBNA-1 und VCA-IgG persistieren lebenslang. [11] Die Tabellen 2 bis 10 führen Befundinterpretationen an, die in der Literatur beschrieben werden. In den Tabellen 3, 5 und 6 wird auch der Nachweis der EAAntikörper in die Befundinterpretation mit einbezogen. Die Ergebnisse der VCA-IgG-, VCA-IgM- und EBNA-1-Antikörper-Bestimmung werden in den aufgelisteten Arbeiten unterschiedlich gewertet. Sowohl qualitative wie auch quantitative Resultate werden für die Bewertung herangezogen. Die Diagnosen „akute Infektion, Primärinfektion, infektiöse Mononukleose, subklinische Infektion (Kinder), akute Infektion in der Frühphase oder akute Primärinfektion“ stehen für den Nachweis von IgG- und IgM-Antikörper gegen VCA. Auf Grauzonen oder grenzwertige Resultate wird nicht ausreichend eingegangen. Werden sowohl VCA-Immunglobuline als auch EBNA-1-IgG-Antikörper nachgewiesen, findet sich in den angeführten Tabellen die Diagnose „Übergangsphase, transiente Infektion oder zweifelhaftes Ergebnis“. Bei dieser Antikörperkonstellation wird laut Literatur eine weitere labordiagnostische Abklärung durch Bestimmung von Blutbild und Transaminasen, sowie ein Ausschluss anderer viraler Erkrankungen empfohlen. [4,20] 17 Tabelle 2: Diagnostische Beurteilung der EBV-Serologie bei verschiedenen Infektionsformen. modifiziert nach Tabelle 63.3 Quelle: Dörr, Hans W./Gerlich Wolfram H.: Medizinische Virologie. Stuttgart/New York: Georg Thieme, 2009, 2., komplett überarbeitete und erweiterte Auflage [1] VCA EBNA-1 Infektionsform IgG IgM IgG keine Infektion - - - akute Infektion + + - frühere Infektion + - + Bei Ergebnissen, die nicht in Tabelle 1 aufgezeigt sind, wird eine Bestimmung der Avidität empfohlen. [1] Tabelle 3: Differenzierung Primärinfektion und Reaktivierung. Quelle: Hofmann, Friedrich/Tiller Friedich W.: Praktische Infektiologie. Heidelberg/München/Landsberg/Frechen/Hamburg: ecomed Medizin, 2012, 3. überarbeitete und erweiterte Auflage [2] Infektionsform EA VCA-IgG VCA-IgM EBNA-IgG Primärinfektion + * ggf. + - Reaktivierung + + * + * keine Ergebnisse angegeben Die in Tabelle 3 angeführten Interpretationen beziehen sich auf eine Bestimmung der Antikörper mit ELISA und IIFT. [2] Nicht beschrieben wird, mit welchen Nachweismethoden die verschiedenen Antikörper detektiert wurden. 18 Tabelle 4: State-of-the-art interpretation of EBV-specific serological profiles for diagnoses. modifiziert nach Tabelle 2 Quelle: Hess, Ralf D.: Routine Epstein-Barr Virus Diagnostics from the Laboratory Perspective: Still Challenging after 35 Years. In: Journal of Clinical Microbiology, 42(8), 2004, 3381-3387 [4] VCA Infektionsform EBNA-1 IgG IgG IgM keine Infektion - - - akute Infektion + + - alte Infektion + - + weitere Abklärung + - - weitere Abklärung + + + weitere Abklärung - + - unplausibel - - + In Tabelle 4 sind verschiedene Infektionsformen dargestellt. Vorzugsweise soll die Antikörperbestimmung aus einer Serumprobe in der Akutphase durchgeführt werden. Bei unklaren Ergebnissen wird eine weitere Abklärung mittels Aviditätsbestimmung, Western Blot oder PCR empfohlen. [4] Tabelle 5: Charakteristische Antikörperspektren bei Patienten mit EBV-assoziierten Krankheiten. modifiziert nach Tabelle 43-15 Quelle: Thomas, Lothar: Labor und Diagnose. Frankfurt/Main: TH-Books Verlagsgesellschaft mbH, 2012, 8. Auflage, Band 2 [5] VCA EA EA-D EA-R EBNA-1 IgM IgG IgA IgG IgA IgG IgG - - - - - - - infektiöse Mononukleose +++ ++++ + + - +/- - subklinische Infektion (Kinder) +++ ++++ + - - + - - ++ - - - +/- + (+) ++++ ++ ++ + ++ (+) Infektionsform nicht-infektiöse Mononukleose lang zurückliegende Primärinfektion reaktivierte Infektion 19 Weitere verschiedene diagnostische Möglichkeiten werden in Tabelle 5 dargestellt. Die Bestimmung der EA-Antikörper wird zur Unterscheidung zwischen einer Primärinfektion und einer Reaktivierung verwendet. Der Nachweis von restricted Antigen (EA-R) und diffusem Antigen (EA-D) mittels IIFT findet vor allem beim Burkitt-Lymphom seine Anwendung. [5] Tabelle 6: Interpretation des serologischen Profils beim Vidas. modifiziert nacht: Quelle: http:// www.biomerieux.de/servlet/srt/bio/germany/dynPage?open=GRM_CLN_ PRD&doc=GRM_CLN_PRD_G_PRD_CLN_51&pubparams.sform=0&lang=de EA IgG VCA IgM VCA IgG EBNA keine Infektion - - - - akute Infektion +/- + + - - - + + vorhergegangene Infektion Tabelle 6 zeigt die Bestätigung einer EBV Infektion und die Ermöglichung der Profil-Auswertung beim Vidas. Bei 80 % der Patienten können EA im frühen Stadium nachgewiesen werden. In der Routinediagnostik einer infektiösen Mononukleose wird dies derzeit nicht berücksichtigt. [vgl. http:// www.biomerieux.de/servlet/srt/bio/germany/dynPage?open=GRM_CLN_ PRD&doc=GRM_CLN_PRD_G_PRD_CLN_51&pubparams.sform=0&lang=de] 20 Tabelle 7: Mögliche Interpretation/Testempfehlung beim Architect. Quelle: https:// abbottdiagnostics.com/getIFUPDF.cfm?controlNumber=G34263 VCA IgG IgM EBNA-1 IgG Seronegativ (keine Infektion) - - - Akute Primärinfektion in der Frühphase* - + - Akute Primärinfektion + + - Transiente Infektion* + + + Zurückliegende Infektion + - + Isoliertes VCA-IgG* + - - Isoliertes EBNA-1-IgG* - - + Mögliche Indikation.../Testempfehlung - nicht reaktiv, + reaktiv, * 1 - 2 Wochen nach der ersten Probennahme eine neue Probe testen Tabelle 8: Ermittlung des Stadiums der EBV-Infektion mit den Architect EBV Assays. modifiziert nach Quelle: https://abbottdiagnostics.com/getIFUPDF.cfm?controlNumber=G34263 VCA IgG IgM EBNA-1 IgG Seronegativ (keine Infektion) - - - / GZ Akute Primärinfektion in der Frühphase - + / GZ - / GZ Akute Primärinfektion + / GZ + / GZ - / GZ Transiente Infektion + / GZ + (GZ)* + Zurückliegende Infektion + / GZ - + Isoliertes VCA-IgG + / GZ - - / GZ - - + Infektionsstadium Isoliertes EBNA-1-IgG * Proben mit nicht eindeutigem Ergebnis (Grauzone - GZ) im VCA-IgM und Reaktivität mit EBNA-1-IgG sollten als zurückliegende Infektion eingestuft werden. Tabelle 7 und 8 zeigen die Testempfehlungen und die Ermittlung des Infektionsstadiums beim Architect. Bei einigen Konstellationen wird eine 21 neuerliche Blutabnahme nach 1 bis 2 Wochen nach der ersten Blutabnahme empfohlen. [21,22,23] Tabelle 9: Reaktionsschema für LIAISON®. modifiziert nach http://assayinfo.diasorin. com/download/IFUk_de_310510_01.pdf Anti-VCA Anti-EBNA IgG IgG negativ negativ negativ - Frühphase positiv negativ negativ - Akute Phase positiv positiv negativ - Übergangsphase positiv positiv positiv Vergangene EBV-Infektion negativ positiv positiv Für EBV zweifelhafte Reaktivität negativ positiv negativ Für EBV unbekannte Reaktivität negativ negativ positiv Reaktionsschema für LIAISON® EBV Für EBV negative Personen Anti-EBV IgM EBV-Primärinfektion Das in Tabelle 9 gezeigte Interpretationsschema kann direkt im Gerät angewandt werden. [12-14] Es bezieht sich rein auf die qualitativen Ergebnisse. 22 Tabelle 10: Interpretationsschema für LIAISON®. modifiziert nach http://assayinfo.diasorin.com/ download/IFUk_de_310510_01.pdf Ergebnis des Anti-EBV IgM Ergebnis des Anti-VCA IgG Ergebnis des Anti-EBNA IgG < 20 E/mL < 20 E/mL < 20 E/mL Negativ für EBV ≥ 20 E/mL < 20 E/mL < 20 E/mL Verdächtige EBV-Primärinfektion (Frühphase). ≥ 20 E/mL ≥ 20 E/mL < 20 E/mL EBV-Primärinfektion (akute Phase). ≥ 40 E/mL ≥ 20 E/mL ≥ 20 E/mL EBV-Primärinfektion (Übergangsphase). < 40 E/mL ≥ 20 E/mL ≥ 20 E/mL Vergangene oder reaktivierte EBVInfektion. < 20 E/mL ≥ 20 E/mL ≥ 5 E/mL Vergangene oder reaktivierte EBVInfektion. < 20 E/mL ≥ 20 E/mL < 5 E/mL Zweifelhaftes Ergebnis (nur das AntiVCA IgG ist positiv). Andere Ergebnisse Interpretation Für EBV unbekannte Reaktivität. Um eine bessere Eingrenzung zwischen den Phasen einer EBV-Infektion zu erhalten, sollte die Bestimmung von Anti-VCA-IgG, Anti-VCA-IgM und AntiEBNA-1-IgG gleichzeitig erfolgen. Tabelle 10 stellt die empfohlene Interpretation dar. Es können verschiedene Grenzwerte verwendet werden, wenn mehrfache EBV-Nachweise mit Liaison XL durchgeführt werden. Dadurch soll die Interpretation verbessert werden. [12,13,14] Der Graubereich liegt bei EBNA-1-IgG bei 5 - 20 E/mL und bei VCA-IgM bei 20 40 E/mL. Zum Teil werden diese Werte in solchen Bereichen benutzt, um die EBVInfektion in Phasen einzuteilen. [12,13,14] 23 5. Material und Methoden PatientInnenkollektiv Serumproben von 381 PatientInnen im Alter von 1 bis 86 Jahren wurden in einem Zeitraum vom 28.09.2012 bis 08.07.2013 gesammelt. Die Seren wurden eingefroren und bei -20°C gelagert. VCA-IgM- und IgG-Antikörper sowie EBNA-1IgG-Antikörper wurden mittels eines Chemilumineszenz-Immunoassays (CLIA, Liaison XL) analysiert. Fehlende Ergebnisse wurden im Nachhinein erhoben. Ausgeschlossen wurden PatientInnen mit nachgewiesener akuter Cytomegalieinfektion, da IgM-Antikörper gegen CMV mit VCA-IgM-Antikörpern des EBV kreuzreagieren können. Bei 12 PatientInnen bestand der Verdacht auf eine Cytomegalieinfektion, da IgM-Antikörper gegen das Cytomegalievirus nachgewiesen werden konnten. Bei diesen PatientInnen wurde ein direkter Erregernachweis mittels PCR angeschlossen. In drei Fällen konnte eine Cytomegalieinfektion nachgewiesen werden. Bei den verbleibenden 9 PatientInnen wurde eine Primärinfektion mit CMV ausgeschlossen. Die Ergebnisse der quantitativen Bestimmung von Antikörper gegen VCA-IgG, VCA-IgM und EBNA-1-IgG wurde bei 378 Patienten ausgewertet. Methode Bei den EBV IgG- und IgM-Antikörperbestimmung für Liaison handelt es sich um quantitative Bestimmungen von IgG- und IgM-Antikörpern gegen das EpsteinBarr-Virus aus Serum oder Plasma. Der Test wurde am Liaison XL (DiaSorin, Saluggia, Italien) durchgeführt. 24 Probenmaterial Für die Bestimmung wurde humanes Serum verwendet werden. Für die EBVAntikörperbestimmung ist ein Mindestvolumen von 170 μl (20 μl Probe und 150 μl Totvolumen) erforderlich. Testprinzip indirekter CLIA Die Magnetpartikel sind mit dem jeweiligen Antigen beschichtet. Eventuell vorhandene Antikörper binden sich in der ersten Inkubation an diese Magnetpartikel. Ungebundenes Material wird durch einen Waschzyklus entfernt. Während der zweiten Inkubation binden monoklonale Anti-Human-IgG-Antikörper (Maus) an die bereits gebundenen Antikörper. Ungebundenes Material wird durch einen Waschschritt entfernt. Durch Hinzufügen der Starterreagenzien wird die Chemilumineszenz (Lichtsignal) angeregt. Das entstandene Lichtsignal wird von einem Photomultiplier gemessen und in relativen Lichteinheiten (RLU) angegeben. Die RLU sind proportional zur Konzentration der gebundenen Antikörper. [12,13,14] Testprinzip VCA-IgM-Antikörperbestimmung Bei der quantitativen IgM-Antikörperbestimmung ist die Festphase mit einem spezifischen Kapsid-Antigen (VCA) beschichtet. Als Hauptkomponente wird synthetisches Peptid p18 verwendet. Zur Vermeidung von Interferenzen durch menschliche Anti-VCA-IgG oder durch erhöhten Rheumafaktor, wird ein Puffer mit Anti-Human-IgG (Ziege) als Absorptions-Reagenz zugesetzt. Der Messbereich liegt bei 10 - 160 E/mL. Werte < 20 E/mL sind mit negativ bewertet, Ergebnisse zwischen 20 und 40 sind grenzwertig. Ergebnisse ≥ 40 werden positiv bewertet. [13] 25 Testprinzip VCA-IgG-Antikörperbestimmung Bei der quantitativen IgG-Antikörperbestimmung ist die Festphase mit einem spezifischen Kapsid-Antigen (VCA) beschichtet. Als Hauptkomponente wird das synthetische Peptid p18 verwendet. Der Messbereich liegt bei 10 - 750 E/mL Anti-VCA-IgG. Werte < 20 E/mL werden mit negativ bewertet, Wert ≥ 20 E/mL gelten als positiv. [12] Testprinzip EBNA-IgG-Antikörperbestimmung Für die quantitative Bestimmung der EBNA-1-IgG-Antikörper ist die Festphase mit einem synthetischen EBNA-1-Peptid beschichtet. Der Messbereich liegt bei 3 - 600 E/mL, Anti-EBNA-IgG. Ergebnisse, die < 5 E/mL sind , sind mit negativ bewertet, Werte mit ≥ 20 mit positiv. Ergebnisse zwischen 5 und 20 werden als grenzwertig betrachtet. [14] Befundinterpretation Bei der Befundinterpretation wurden die vom Hersteller angegebenen Grenzwerte herangezogen (siehe Tabelle 11). Bei fraglichen Ergebnissen, wie zum Beispiel bei positivem Ergebnis bei VCA-IgG und grenzwertigem oder positivem Ergebnis bei VCA-IgM, wurden weitere Parameter einbezogen. Berücksichtigt wurden die klinische Fragestellung, die Ergebnisse der Transaminasen, vor allem der Alaninaminotransferase (ALAT) und des Blutbilds sowie das Alter. Aufgrund dieser Zusammenschau wurde entweder eine Befundung erstellt oder zur weiteren Abklärung eine Bestimmung der IgG-Antikörper gegen EBNA-1 durchgeführt. Tabelle 12 zeigt die Interpretationen der Resultate in der die Antikörperbestimmung gegen EBNA-1 mit einbezogen ist. 26 Tabelle 11: Alte EBV Befundung. VCA-IgG E/ml Bewertung VCAIgM E/ml Bewertung Befundung <20 negativ <20 negativ Serologisch kein Hinweis auf eine EBV-Infektion. <20 negativ 20 - 40 grenzwertig <20 negativ >40 positiv Serologisch Hinweis auf eine EBVPrimärinfektion. >20 positiv <20 negativ Spricht gegen eine frische EBV-Infektion, Erstkontakt hat bereits früher stattgefunden. >20 * positiv 20 - 40 * grenzwertig Der serologische Befund spricht mit größter Wahrscheinlichkeit gegen eine frische EBVInfektion. >20 * positiv >40 * positiv Serologisch Hinweis auf eine EBV-Infektion. Eine frische Infektion kann nicht mit Sicherheit ausgeschlossen werden. * Im Zusammenschau mit dem Gesamtbefund - Alter, Leukozytose, Lymphozytose, aktivierte Lymphozyten, erhöhte Leberenzyme (ALAT) beurteilen, bei serologisch unklaren Befunden - EBNA-IgG nachfordern. Tabelle 12: Alte EBV Befundung mit EBNA-1-IgG. VCAIgG E/ml Bewertung VCA-IgM E/ml Bewertung EBNAIgG Bewertung Befundung >20 positiv 20 - 40 grenzwertig <5 negativ Serologisch Hinweis auf eine EBV-Infektion. >20 positiv 20 - 40 grenzwertig 5 - 20 grenzwertig Serologisch Hinweis auf eine EBV-Infektion. >20 positiv 20 - 40 grenzwertig >20 positiv Spricht gegen eine frische EBV-Infektion, Erstkontakt hat bereits früher stattgefunden. >20 positiv >40 positiv <5 negativ Serologisch Hinweis auf eine EBV-Infektion. >20 positiv >40 positiv 5 - 20 grenzwertig Serologisch Hinweis auf eine EBV-Infektion. >20 positiv >40 positiv >20 positiv Spricht gegen eine frische EBV-Infektion, Erstkontakt hat bereits früher stattgefunden. 27 Für die neu entwickelte Befundinterpretation wurden die Ergebnisse von der Bestimmung der EBNA-1-IgG-Antikörper und der VCA-IgM-Antikörper herangezogen. Bei fehlendem Antikörpernachweis der EBNA-1-IgG wurde der Test im Nachhinein durchgeführt. Ebenfalls wurden die Aussagen der Ergebnisse der VCA-IgG-Antikörper in Kombination mit der VCA-IgM-Antikörperbestimmung verglichen. Die Interpretationen wurden auf wenige Aussagen reduziert. Unterschieden wurde zwischen Seronegativität, einer frischen Infektion oder einer bereits durchgemachten Infektion. 28 6. Ergebnisse Zuerst wurde von den Ergebnissen der Antikörperbestimmung von EBNA-1-IgG und VCA-IgM ausgegangen. Zu Berechnung der Befundinterpretation wurden die in Tabelle 13 aufgelisteten Grenzwerte (Cutoff) verwendet. Tabelle 13: Vergleich der neuen Interpretation in Bezug auf die vorherige Aussage ausgehend von der Bestimmung von EBNA-1-IgG und VCA-IgM. EBNA-1-IgG Cutoff E/mL VCA-IgM Cutoff E/mL richtig diskrepant 5 20 67,99 % 121 20 20 72,22 % 105 20 40 88,36 % 44 20 50 91,53 % 32 Mit „richtig“ wurden die PatientInnen bewertet, bei denen die Befundinterpretationen übereinstimmten. PatientInnen mit positivem Nachweis von EBNA-1-IgG-Antikörpern und VCA-IgM-Antikörpern wurden mit „diskrepant“ gewertet. Die größte Übereinstimmung der Aussagen wurde mit Grenzwerten von 20 E/mL bei EBNA-1-IgG und 50 E/mL bei VCA-IgM erreicht. Mit diesen Cutoffs wird die Spezifität der Aussage scheinbar erhöht. Ein weiterer Vergleich wird in Tabelle 14 dargestellt. Hier wurden zur Berechnung der Interpretation die Ergebnisse von den Bestimmungen der VCA-IgG- und der VCA-IgM-Antikörper einbezogen. 29 Tabelle 14: Vergleich der neuen Interpretation in Bezug auf die vorherige Aussage ausgehend von der Bestimmung von VCA-IgG und VCA-IgM. VCA-IgG Cutoff E/mL VCA-IgM Cutoff E/mL richtig diskrepant 20 20 57,67 % 160 20 50 80,95 % 72 50 50 84,39 % 59 150 50 92,06 % 30 300 50 95,50 % 17 Die beste Übereinstimmung mit 95,50 % richtigen Aussagen wurde mit einem Grenzwert von 300 E/mL bei VCA-IgG und 50 E/mL bei VCA-IgM gefunden. Wird mit einem Cutoff von 150 E/mL VCA-IgG gerechnet, sind 92,06 % der Interpretationen richtig. Aus den Ergebnissen der Berechnungen, die in den Tabellen 13 und 14 dargestellt sind, wurden die Grenzwerte neu definiert. Diese sind in Tabelle 15 aufgelistet. Der Nachweis von VCA-IgG scheint erst ab hohen Ergebnissen zu einer Reduzierung der unklaren Aussagen zu führen. Daher wurden die neuen Befundinterpretationen, die in Tabelle 16 dargestellt sind, ohne VCA-IgG erstellt. Tabelle 15: Erhobene Grenzwerte. Antikörper positiv EBNA-1-IgG ≥ 20 U/mL VCA-IgM ≥ 50 U/mL 30 Tabelle 16: Neue Befundinterpretationen und Anzahl der Interpretationen. EBNA-1-IgG VCA-IgM Interpretation n = 378 - - seronegativ 73 + - durchgemachte Infektion 230 - + frische Infektion 43 + + zweifelhaftes Ergebnis* 32 * weitere Abklärung erforderlich Die in Tabelle 16 dargestellten Interpretationen wurden mit den ursprünglichen Aussagen verglichen. Von 378 ausgewerteten Ergebnissen stimmten die Aussagen von 347 (91,8 %) Proben überein. Um sicherzustellen, dass mit den neuen Grenzwerten die selben validen Aussagen gefunden werden, wurden die VCA-IgG-Antikörper mit einbezogen. Die Anzahl der jeweiligen Befundinterpretationen wird in Tabelle 17 dargestellt. Tabelle 17: Befundinterpretation und Anzahl der gefundenen Ergebnisse. n = 378 Testergebnis Anzahl Bewertung EBNA-1-IgG: negativ VCA-IgM: negativ 73 Bestimmung von VCA-IgG EBNA-1-IgG: positiv VCA-IgM: negativ 230 alte Infektion EBNA-1-IgG: negativ VCA-IgM: positiv 43 Primärinfektion EBNA-1-IgG: positiv VCA-IgM: positiv 32 zweifelhaft * * weitere Abklärung notwendig Tabelle 17 zeigt die Befundinterpretationen der 378 ausgewerteten Proben. Die VCA-IgG-Antikörperbestimmung ist nur in speziellen Fällen erforderlich. Mit der neuen Vorgehensweise werden isolierte VCA-IgG nicht gefunden. Diese würden mit der neuen Befundinterpretation mit seronegativ befundet. Daher ist in diesem Fall eine Bestimmung der VCA-IgG-Antikörper indiziert. 31 Tabelle 18: Ergebnisse der VCA-IgG-Antikörperbestimmung bei EBNA-1-IgG und VCA-IgM negativen PatientInnen. Testergebnis Anzahl Bewertung VCA-IgG Anzahl Bewertung Bestimmung von VCA-IgG positiv 42 zweifelhaft * 73 negativ 31 seronegativ EBNA-1-IgG: negativ VCA-IgM: negativ * weitere Abklärung notwendig Wie in Tabelle 18 dargestellt, waren insgesamt 73 PatientInnen EBNA-1-IgG und VCA-IgM negativ. Bei 31 Proben war das VCA-IgG negativ. Diese PatientInnen wurden richtig mit seronegativ interpretiert. In 42 Fällen wurden isolierte VCA-IgGAntikörper gefunden. Diese können nur durch die Einbeziehung anderer Parameter wie Anamnese, Transaminasen und Blutbild beurteilt werden. 230 PatientInnen waren EBNA-1-IgG positiv und VCA-IgM negativ. Diese wurden mit „alte Infektion“ bewertet. EBNA-1-IgG negativ und VCA-IgM positiv wurde mit „Primärinfektion“ interpretiert. Mit dieser Konstellation wurden 43 PatientInnen gefunden. Bei den Ergebnissen „Primärinfektion“ und „alte Infektion“ führte das Resultat der Antikörperbestimmung VCA-IgG zu keiner anderen Bewertung. Bei 32 (8,5 %) PatientInnen waren EBNA-1-IgG-Antikörper und VCA-IgMAntikörper nachweisbar. In allen 32 Proben waren auch VCA-IgG-Antikörper nachweisbar. Diese Ergebnis wird mit zweifelhaft bewertet. Eine weitere Abklärung ist indiziert. Isolierte EBNA-1-IgG-Antikörper fanden sich bei 21 Fällen. Dies hat keinen Einfluss auf die neue Befundinterpretation. 32 7. Schlussfolgerung Es konnte dargestellt werden, dass die Interpretationen von EBNA-1-IgG, VCAIgG und VCA-IgM unterschiedlich beschrieben sind. In Ausnahmefällen wird zur weiteren Differenzierung der Nachweis von EA-Antikörpern empfohlen. Der Nachweis der Antikörper gegen EA ist jedoch umstritten, da diese sowohl bei einer frischen Infektion mit EBV nachweisbar sind, als auch bei einer durchgemachten Infektion nachweisbar sein können [1,2,3,4,20]. Zum Teil werden bei den Interpretationen der serologischen Ergebnisse vom Verlauf der EBV-Infektion abhängig gemacht. In den meisten Arbeiten wird allerdings ausreichend beschrieben, dass bei immunkompetenten PatientInnen die wichtigste Unterscheidung zwischen einer Primärinfektion und einer durchgemachten Infektion zu treffen ist. Derzeit ist nicht bekannt, was die Reaktivierung einer EBV-Infektion bewirkt. Es scheint aber, dass bei immungesunden Patienten das Erkennen einer Reaktivierung nicht krankheitsrelevant ist. Die Bestimmung der EBV-Antikörper ist nicht standardisiert, da unterschiedliche Antigene eingesetzt werden und diese verschieden aufbereitet werden. Daher ist ein Vergleich der Resultate schwierig. Spezifität und Sensitivität der beschriebenen Testmethoden unterscheiden sich signifikant. Berücksichtigt werden sollte, dass die qualitativen Ergebnisse von Immunfloureszenz-Tests mit den quantitativen Ergebnissen verschiedener ELISA-Methoden nur bedingt vergleichbar sind. Es scheint, dass Antikörper gegen EBNA-1 erst im späteren Verlauf einer EBVInfektion nachweisbar sind. Das kann entweder daran liegen, dass die Bildung der Antikörper erst spät erfolgt oder dass die Testsysteme so aufgebaut sind, dass EBNA-1-IgG-Antikörper erst später erfasst werden. Als Einzelbestimmung ist die Antikörpermenge für die Beurteilung des Infektionsstadiums nicht aussagekräftig. Im Verlauf oder in Zusammenschau mit anderen labordiagnostischen Parametern, kann die quantitative Bestimmung von 33 den spezifischen Immunglobulinen hilfreich sein. Nach Infektion ist der Nachweis von EBNA-1-IgG für die Aussage einer durchgemachten Infektion valide. Die Menge an nachweisbarem EBNA-1-IgG ist individuell sehr unterschiedlich und daher für die Unterscheidung zwischen einer durchgemachten Infektion und einer reaktivierten Infektion zu hinterfragen. Das heißt, dass aufgrund der Höhe der EBNA-1-IgG-Antikörper nicht darauf zurück geschlossen werden, wie lange eine Infektion mit EBV her ist. 5 % der PatientInnen bilden keine Antikörper gegen EBNA-1 nach einer EBVInfektion. Hier kann es zum Nachweis von isolierten VCA-IgG-Antikörpern kommen. [20] Ein Problem stellen nicht eindeutig interpretierbare Ergebnisse dar. Zu Beginn der EBV-Infektion können Antikörper gegen VCA-IgG und VCA-IgM nachgewiesen werden, wobei manchmal VCA-IgM-Antikörper bereits früher detektiert werden können. Bei isoliert nachgewiesenen VCA-IgM-Antikörpern kann es sich also um eine frische Infektion handeln, bei der die Antikörper gegen VCA-IgG noch nicht detektierbar sind. Jedoch kann durch die Antikörperbildung gegen andere Viren, wie z. B. gegen verschiedene Herpesviren, Parvovirus B19 oder Toxoplasma gondii der IgM-Antikörpernachweis unspezifisch positiv reagieren. Erhöhte Rheumafaktoren, Kälteagglutinine oder Autoantikörper können ebenfalls zu falsch positivem VCA-IgM-Antikörper-Nachweis führen. Mit dem Nachweis von erhöhten Rheumafaktoren ist nicht gesichert, dass die positive Bestimmung von VCA-IgM-Antikörpern unspezifisch ist [20]. Für eine Sicherung der Diagnose eigenen sich Transaminasen und Blutbild. Bei Bedarf müssen andere virale Erkrankungen ausgeschlossen werden. Sind Antikörper gegen VCA-IgG, VCA-IgM und EBNA-1 nachweisbar, handelt es sich eventuell um eine frische Infektion, bei der EBNA-1-Antikörper bereits früh gebildet wurden. Zirka 5 % der Laborbefunde weisen diese Konstellation auf. Bei den untersuchten Proben konnten bei 32 PatientInnen alle drei Antikörper nachgewiesen werden, dies entspricht 8,47 %. Hier ist eine weiterführende 34 Diagnostik indiziert. Es sollten Kreuzreaktionen der VCA-IgM-Bestimmung oder andere virale Erkrankungen ausgeschlossen werden. Eine serologische Unterscheidung zwischen einer frischen Infektion und einer Reaktivierung kann jedoch nicht getroffen werden. In den verschiedenen Befundinterpretationen findet man unterschiedliche Aussagen, wenn EBNA-1-IgG-Antikörper, VCA-IgM-Antikörper und VCA-IgGAntikörper nachweisbar sind. Mögliche Interpretationen in der Literatur sind „reaktivierte Infektion“ [5], „transiente Infektion“ [21-23], „EBV-Primärinfektion in der Übergangsphase“ [12-14], unklares Ergebnis [19], „späte Primärinfektion oder Reaktivierung“ [20]. Ebenso verhält es sich mit isoliert nachweisbaren VCA-IgG-Antikörpern. Hier findet man folgende Interpretationen: „für EBV zweifelhafte Reaktivität“ [12-14], unklares Ergebnis [19], „Akute oder durchgemachte Infektion“ [20] oder „isoliertes VCA-IgG“ „1 bis 2 Wochen nach der ersten Probe eine neue Probe testen“. Bei manchen PatientInnen sind VCA-IgG-Antikörper bereits vor den VCA-IgMAntikörpern nachweisbar. Um auch diese Primärinfektionen zu erfassen, sollte ein VCA-IgG-Antikörpernachweis bei negativem EBNA-1-IgG und negativem VCA-IgM erfolgen. Durch die Einbeziehung verschiedener anderer Laborparameter wie die Transaminasen, das Blutbild, oder auch der Verlauf der Antikörperbestimmung, sowie die Anamnese, kann eine klinisch valide Aussage getroffen werden. Der Ablauf der neuen Stufendiagnostik ist in Abbildung 5 dargestellt. 35 EBNA-1-IgG VCA-IgM EBNA: positiv IgM: negativ alte Infektion EBNA: negativ IgM: negativ VCA-IgG EBNA: negativ IgM: positiv positiv EBNA: positiv IgM: positiv zweifelhaft negativ Primärinfektion seronegativ weitere Abklärung * * Anamnese, weitere Laborbefunde wie Blutbild, Transaminasen und ev. Virusserologie Abb. 5: Stufendiagnostik einer EBV-Infektion. Zur Erhebung des Immunstatus würde eine Bestimmung der EBNA-1-IgGAntikörper ausreichen. Um eine frische Infektion nicht zu übersehen, sollte jedoch zusätzlich ein Nachweis der VCA-IgM-Antikörper durchgeführt werden. Bei positivem EBNA-1-IgG Nachweis und negativen VCA-IgM-Antikörpern kann davon ausgegangen werden, dass es sich um eine bereits durchgemachte EBVInfektion handelt. Sind keine Antikörper gegen EBNA-1 nachweisbar und es können VCA-IgMAntikörper detektiert werden, weist dies auf eine Primärinfektion hin. Können weder EBNA-1-IgG-Antikörper noch VCA-IgM-Antikörper nachgewiesen werden, folgt der Nachweis von VCA-IgG-Antikörpern. Bei negativem Ergebnis ist der/die PatientIn seronegativ. Ist das Resultat positiv, sollte eine weitere Abklärung 36 erfolgen. Dazu gehören Anamnese, weitere Laborparameter wie Transaminasen und Blutbild, sowie eine weiterführende Virusserologie. Bei positivem VCA-IgM- und EBNA-1-IgG-Antikörper-Nachweis ist die Spezifität von VCA-IgM und EBNA-1-IgG zu überprüfen. Eventuelle Kreuzreaktionen oder unspezifische Reaktionen sollten ausgeschlossen werden. In allen anderen Fällen führt die Bestimmung der Antikörper gegen VCA-IgG zu keiner valideren Aussage. Aufgrund der Ergebnisse ist die Bestimmung von VCA-IgG-Antikörpern bei 73 von 378 PatientInnen indiziert. Bei 305 Proben kann der VCA-IgG-Nachweis eingespart werden. Bei automatisierten Systemen könnte folgende Vorgehensweise angewandt werden: Für die Erhebung des Immunstatus könnten zuerst Antikörper gegen EBNA-1 nachgewiesen werden. Ist das Ergebnis positiv, kann von einer bereits durchgemachten EBV-Infektion ausgegangen werden. Bei negativem Ergebnis sollten als Reflextest ein VCA-IgM-Antikörper-Nachweis angeschlossen werden. Bei negativem VCA-IgM sollte eine Bestimmung der VCA-IgG-Antikörper erfolgen, um eine frische Infektion nicht zu übersehen. Voraussetzung wäre, dass der Test für den Nachweis der EBNA-1-IgG-Antikörper sowohl eine hohe Sensitivität als auch eine hohe Spezifität ausweist und der Cutoff so gewählt wird, dass ein positives Ergebnis erst einige Wochen nach Infektionsbeginn möglich ist. Aufgrund der erhobenen Ergebnisse wird jedoch das in Abbildung 5 gezeigt Vorgehen empfohlen. Die Bestimmung der EBNA-1-IgG-Antikörper und VCA-IgMAntikörper sollte in einem Schritt erfolgen, um eine Primärinfektion nicht zu übersehen. Dies hat auch den Vorteil, dass ein unspezifischer Nachweis von VCAIgM-Antikörpern ein Hinweis auf eine andere virale Erkrankung sein kann. Dies bietet eine Hilfestellung bei der Differentialdiagnose. Durch die Reflextestung in einem automatisierten System ist durch eine Reduzierung der Bestimmung der VCA-IgG-Antikörper eine kosteneffektive und effiziente EBV-Diagnostik möglich. 37 8. Literatur [1]$ Dörr, Hans W./Gerlich Wolfram H.: Medizinische Virologie. Stuttgart/New York: Georg Thieme, 2009, 2., komplett überarbeitete und erweiterte Auflage [2]$ Hofmann, Friedrich/Tiller Friedich W.: Praktische Infektiologie. Heidelberg/ München/Landsberg/Frechen/Hamburg: ecomed Medizin, 2012, 3. überarbeitete und erweiterte Auflage [3]$ Neumeister, Birgit et al.: Mikrobiologische Diagnostik. Stuttgart/New York: Georg Thieme, 2009, 2., vollständig überarbeitete Auflage [4]$ Hess, Ralf D.: Routine Epstein-Barr Virus Diagnostics from the Laboratory Perspective: Still Challenging after 35 Years. In: Journal of Clinical Microbiology, 42(8), 2004, 3381-3387 [5]$ Thomas, Lothar: Labor und Diagnose. Frankfurt/Main: TH-Books Verlagsgesellschaft mbH, 2012, 8. Auflage, Band 2 [6]$ Cohen, Jeffrey I.: Epstein-Barr Virus Infection. In: The New England Journal of Medicine Volume 343, Number 7, 2000, 481-492 [7]$ Stevens, Servi J.C. et al (2002).: Comparison of quantitative competitive PCR with LightCycler-based PCR for measuring Epstein-Barr virus DNA load in clinical specimens. In: Journal of Clinical Microbiology, 40(11), 2002, 3986–92 [8]$ Lottspeich, Friedrich/Engels, Joachim W. (Hrsg.): Bioanalytik. Berlin/ Heidelberg: Springer-Verlag Berlin Heidelberg, 2012, 3. Auflage [9]$ Suerbaum, Sebastian et al.: Medizinische Mikrobiologie und Infektiologie. Berlin/Heidelberg/New York: Springer-Verlag Berlin Heidelberg, 2012, 7. Auflage [10]$ Gulley, Margaret L./Tang, Weihua: Laboratory Assays for Epstein-Barr Virus-Related Disease. In: Journal of Molecular Diagnostics, Vol. 10, No. 4, 2008, 279-292 [11] Odumade, Oludare A. et al: Progress and Problems in Understanding and Managing Primary Epstein-Barr Virus Infections. In: Clinical Microbiology Reviews, Vol. 24, No. 1, Jan. 2011, 193-209 [12]$ http://assayinfo.diasorin.com/download/IFUk_de_310510_01.pdf [13]$ http://assayinfo.diasorin.com/download/IFUk_de_310500_02.pdf [14]$ http://assayinfo.diasorin.com/download/IFUk_de_310520_03.pdf 38 [15]$ Lupo, J. et al: Performance of Two Commercially Available Automated Immunoassays for the Determination of Epstein-Barr Virus Serological Status. In: Clin Vaccine Immunol 19, 2012, 929–934 [16]$ Crowley, Andrea et al: Is There Diagnostic Value in Detection of Immunoglobulin G Antibodies to the Epstein-Barr Virus Early Antigen? In: Biores Open Access 1, 2012, 291–296. [17]$ De Ory, Fernando et al: Evaluation of four commercial systems for the diagnosis of Epstein-Barr virus primary infections. In: Clin. Vaccine Immunol. 18, 2011, 444–448. [18]$ Berth, Mario/Bosmans, Eugene: Comparison of Three Automated Immunoassay Methods for the Determination of Epstein-Barr Virus-Specific Immunoglobulin M. In: Clin Vaccine Immunol 17, 2010, 559–563. [19]$ Kreuzer, Christina et al: Reliability of the Siemens Enzygnost and Novagnost Epstein-Barr Virus assays for routine laboratory diagnosis: agreement with clinical diagnosis and comparison with the Merifluor Epstein-Barr Virus immunofluorescence assay. In: BMC Infect Dis 13, 2013, 260 [20]$ De Paschale, Massimo/Clerici, Pierangelo: Serological diagnosis of Epstein-Barr virus infection: Problems and solutions. In: World Journal of Virology 1, 2012, 31-43 [21]$ https://abbottdiagnostics.com/getIFUPDF.cfm?controlNumber=G34263 [22]$ https://abbottdiagnostics.com/getIFUPDF.cfm?controlNumber=G34289 [23]$ https://abbottdiagnostics.com/getIFUPDF.cfm?controlNumber=G34285 39