Krebsmedikamente bei pulmonaler arterieller Hypertonie
Werbung

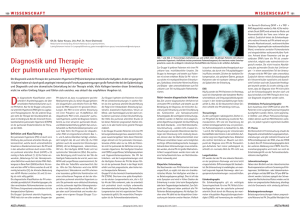
Schermuly, Ralph et al. | Krebsmedikamente bei pulmonaler ... Tätigkeitsbericht 2008 Entwicklungs- und Evolutionsbiologie/GenetikImmun- und Infektionsbiologie/Medizin Krebsmedikamente bei pulmonaler arterieller Hypertonie Schermuly, Ralph; Seeger, Werner; Max-Planck-Institut für Herz- und Lungenforschung, Bad Nauheim Abteilung - Entwicklung und Umbau der Lunge Korrespondierender Autor Schermuly, Ralph, E-Mail: [email protected] Zusammenfassung Ein Gefäßwandumbau (Remodeling) von Lungenarterien spielt die entscheidende Rolle in der Pathogenese von pulmonaler arterieller Hypertonie (PAH), auch bekannt als Lungenbluthochdruck. Dieser Umbau führt zu einer Anreicherung von Zellen in der Gefäßwand und damit zu einem Lumenverlust. Ein neuer Therapieansatz besteht darin, diese gutartige Zellwucherung mittels Krebsmedikamenten zu unterbinden und so den strukturellen Wandumbau in den erkrankten Gefäßen rückgängig zu machen (Reverse Remodeling). Hemmstoffe von Tyrosinkinasen haben in präklinischen Modellen und ersten klinischen Heilversuchen überragende Ergebnisse gezeigt. Abstract Pulmonary vascular remodeling of lung arteries plays an important role in the pathogenesis of pulmonary arterial hypertension (PAH). This leads to an accumulation of cells in the vessel wall and to a reduced vascular lumen. New therapeutic approaches try to reduce the benign proliferation and attempt to reverse the remodeling of the pulmonary arteries using anti-cancer drugs. In the focus of our interest are inhibitors of tyrosine-kinases, which showed promising effects in preclinical models of pulmonary hypertension and first clinical studies. Die pulmonale arterielle Hypertonie (PAH) – Lungenbluthochdruck – ist eine lebensbedrohende Erkrankung, welche durch eine fortschreitende Gefäßveränderung der Lungenarterien gekennzeichnet ist. Es gibt für diese Erkrankung bisher keine Heilung [1]. Die heute zugelassenen medikamentösen Therapien verfolgen fast ausschließlich nur das Ziel, die pulmonalen Gefäße zu erweitern (Vasodilatation). Die (Weiter)Entwicklung einer optimalen Therapie der PAH sollte allerdings nicht nur mit Vasodilatantien erfolgen, sondern auch einen direkten anti-proliferativen Ansatz umfassen, da die endotheliale Dysfunktion, die Verdickung der Adventitia, die Intimaproliferation und die Proliferation sowie die Migration glatter Muskelzellen [2] ebenfalls wichtige pathologische Charakteristika der PAH sind. Weitere wichtige Merkmale des Lungenbluthochdrucks sind außerdem die In-situ-Thrombose sowie der oxidative Stress. Durch die oben angeführten proliferativen Vorgänge kommt es zu einem perfusionsbegrenzenden Lumenverlust – vor allem die Proliferation glatter Gefäßmuskelzellen spielt bei der Verlegung des Gefäßbettes eine entscheidende Rolle. Hier konnten in den letzten Jahren durch den Einsatz von Elastase-Hemmstoffen, Rho-Kinase-Hemmstoffen oder Serotonin-Antagonisten in tierexperimentellen Modellen der pulmonalen Hypertonie deutliche Anti-Remodeling-Effekte erzielt werden. Die klinische Relevanz dieser Ansätze ist jedoch noch unklar. Interessanterweise findet man funktionelle, biochemische und zelluläre Gemeinsamkeiten zwischen diesen „benignen“, also gutartigen pulmonalvaskulären Proliferationsprozessen und dem malignen, bösartigen Tumorwachstum [3]. Unter anderem gibt es bei Krebserkrankungen eine Dysregulation von © 2008 Max-Planck-Gesellschaft www.mpg.de Tätigkeitsbericht 2008 Schermuly, Ralph et al. | Krebsmedikamente bei pulmonaler ... Wachstumsfaktoren mit nachgeschalteten Rezeptor-Tyrosinkinasen (RTK). Wachstumsfaktoren wie PDGF (Platelet Derived Growth Factor), FGF (Fibroblast Growth Factor), EGF (Epidermal Growth Factor) oder IGF (Insulin-like Growth Factor) sind kausal in Tumorwachstum, Invasion und Metastasierung involviert. Der neuesten Generation der Rezeptorantagonisten gelingt es, das Tumorwachstum mit einem gewissen Grad an Selektivität zu hemmen. Durch die Behandlung mit diesen so genannten Tyrosinkinase-Hemmern wird die durch eine Aktivierung der Rezeptor-Tyrosinkinase vermittelte Signalübertragung zum Zellkern unterbunden. In der Folge wird die Zellvermehrung gehemmt und Prozesse des Zellsterbens (Apoptose) werden induziert [4]. Krebsmedikamente gegen Lungenbluthochdruck Bei der abnormalen Proliferation und Migration glatter Gefäßmuskelzellen (VSMC), wie sie bei der pulmonalen arteriellen Hypertonie auftritt, spielen die Wachstumsfaktoren (PDGF, b-FGF, EGF) eine wichtige Rolle: Insbesondere PDGF und der PDGF-β-Rezeptor sind bei PAH erhöht exprimiert, wie jüngst in experimentellen Modellen der pulmonalen Hypertonie und in humanem Gewebe von PAHPatienten nachgewiesen werden konnte. Die neueste Generation der Krebsmedikamente, die Tyrosinkinase-Hemmstoffe, besitzen aufgrund des günstigen Nebenwirkungsprofils eine exzellente klinische Perspektive. Medikamente aus dieser Substanzklasse sind bereits zur Therapie maligner Erkrankungen zugelassen. Die Arbeitsgruppe um Ralph Schermuly konnte kürzlich an Modellen der experimentellen pulmonalen Hypertonie zeigen, dass der PDGF-Rezeptorantagonist Imatinib (Gleevec®, STI571), welcher zur Therapie der chronisch myelomischen Leukämie und progressiver maligner gastrointestinaler Tumoren zugelassen ist, eine überragende antiproliferative Wirkung mit Induktion von Reverse Remodeling bei PAH besitzt. So führte eine chronische Imatinib-Therapie der Versuchstiere mit bereits bestehender pulmonaler Hypertonie zu einer weitgehenden Rückführung des strukturellen Gefäßwandumbaus sowie der hämodynamischen Veränderungen (Abb. 1). Insbesondere der pulmonal-arterielle Druck, welcher mittels einer telemetrischen Technik kontinuierlich gemessen wurde, konnte eindrucksvoll reduziert werden. Als relevanter Wirkmechanismus wurden die Reduktion der Proliferation und die Zunahme der Apoptose identifiziert. Darüber hinaus konnten die Wissenschaftler am MPI für Herz- und Lungenforschung erstmals klinisch die Wirksamkeit von Imatinib bei einem Patienten mit schwerster pulmonaler Hypertonie zeigen [5, 6]. www.mpg.de © 2008 Max-Planck-Gesellschaft Schermuly, Ralph et al. | Krebsmedikamente bei pulmonaler ... Tätigkeitsbericht 2008 Abb. 1: Vergleich von Lungenarterien bei einem an pulmonaler arterieller Hypertonie erkrankten Patienten und einem gesunden Donor. links: Lungenarterie eines Patienten mit PAH mit einer deutlichen Verdickung der Gefäßwand und Verringerung des Lumens. rechts: Lungenarterie eines Gesunden. (ECM: extrazelluläre Matrix) Urheber: Max-Planck-Institut für Herz- und Lungenforschung/Schermuly Allerdings sind noch wesentliche grundlagenwissenschaftliche und klinische Fragen zum Expressionsprofil von Tyrosinkinasen unter physiologischen und pathophysiologischen (vaskuloproliferativen) Bedingungen offen. Weiterhin muss geklärt werden, inwieweit andere Rezeptor-TyrosinkinaseHemmstoffe mit einem möglicherweise optimierten Antagonisten-Profil noch besser geeignet sind, das Therapieziel der Rückführung der strukturellen Gefäßwandveränderungen (Reverse Remodeling) zu erreichen. Erst kürzlich konnten Schermuly und seine Mitarbeiter zeigen, dass der neue MultikinaseHemmstoff Sorafenib nicht nur die pulmonale Hypertonie, sondern auch die Herzhypertrophie signifikant senken kann [7]. Umbauprozesse am rechten Herzen Aufgrund des oben erwähnten Lumenverlusts durch die proliferativen Veränderungen in den Pulmonalarterien bei PAH steigt die Druckbelastung in der pulmonalen Zirkulation, und es kommt nachfolgend zu einer erhöhten Nachlast für den rechten Ventrikel. Dies resultiert in Umbauprozessen in Form von Herzvergrößerung, Fibrose und interstitieller Entzündung (myokardiales Remodeling). Zunächst stellt das übermäßige Wachstum zusammen mit einer passiven Erweiterung der rechten Herzkammer als Folge der PAH einen Adaptationsprozess des Herzens an die erhöhte Leistungsanforderung dar. Die rechtsventrikuläre Adaptation ist einer der wichtigsten prognostischen Faktoren bei pulmonaler arterieller Hypertonie [8]. Unter chronischer Belastung nimmt im weiteren Verlauf das Muskelwachstum ab und die Überdehnung der Herzkammerwand stark zu (Dilatation). Diese Überdehnung der Herzkammer weist eine schlechte Prognose auf. Die dilatierte rechte Kammer mit resultierender verminderter Kontraktionkraft ist nicht mehr in der Lage, das Blut gegen die erhöhte Nachlast auszuwerfen. Somit sterben Patienten mit PAH letztendlich am sogenannten Rechtsherzversagen. Nach wie vor gibt es zur direkten Behandlung der dargestellten Umbauprozesse im Bereich des rechten Herzens, welches letztendlich mit dem Untergang von vitalem Myokardgewebe einhergeht, keine Therapieansätze. Da zugrunde gegangenes Herzmuskelgewebe nach bisherigen Erkenntnissen nicht ersetzt werden kann, werden die Phasen des Remodelings auf Proteinebene in einem Tiermodell © 2008 Max-Planck-Gesellschaft www.mpg.de Tätigkeitsbericht 2008 Schermuly, Ralph et al. | Krebsmedikamente bei pulmonaler ... für rechtsventrikuläre Herzhypertrophie untersucht. Um essentielle Regulatoren der rechtsventrikulären Hypertrophie infolge PAH zu ermitteln, soll ein sogenannter proteomics approach durchgeführt werden. Dieser beinhaltet Techniken, welche die simultane Detektion einer Vielzahl von Proteinen und deren Modifikationen aus dem Herzgewebe ermöglichen. Die Aufschlüsselung des Proteinhaushalts soll die morphologische und die molekularbiologische Analyse von Remodeling-Vorgängen im rechten Herzen ergänzen und zur Entdeckung spezifischer Marker und Schlüsselproteine hypertropher Prozesse im rechten Herzen beitragen. Letztlich soll dies zur Identifikation möglicher therapeutischer Zielstrukturen dienen. So wollen die Forscher Kenntnisse zur Entwicklung neuer, ursächlicher Therapieansätze insbesondere der rechtsventrikulären Hypertrophie gewinnen, welche in der bisherigen, hauptsächlich die linksventrikuläre Hypertrophie betreffenden Forschung eine eher untergeordnete Rolle spielte. Inwiefern medikamentöse Therapien der pulmonalen arteriellen Hypertonie einen direkten Einfluss auf die Umbauprozesse am rechten Herzen haben (können) oder nur indirekt über die Reduktion der rechtsventrikulären Nachlast zu einer Abnahme der Hypertrophie des rechten Ventrikels führen, ist bisher unbekannt und von großem wissenschaftlichen Interesse. Dennoch zeigen aktuelle Forschungsergebnisse am Beispiel des Tyrosin- und Serin-/Threonin-Kinase-Inhibitors Sorafenib die Möglichkeit eines kombinierten Wirkmechanismus auf [7]. www.mpg.de © 2008 Max-Planck-Gesellschaft Schermuly, Ralph et al. | Krebsmedikamente bei pulmonaler ... Tätigkeitsbericht 2008 Literaturhinweise [1] D. B. Taichmann, J. Mandel: Epidemiology of pulmonary arterial hypertension. Clinics in Chest Medicine 28, 1-22 (2007). [2] R. M. Tuder, J. C. Mareki, A. Richter, I. Fijalkowska, S. Flores: Pathology of pulmonary hypertension. Clinics in Chest Medicine 28, 23-42 (2007). [3] S. D. Lee, K. R. Shoyer, N. E. Markham, C. D. Cool, N. F. Voelkel, R. M. Tuder: Monoclonal endothelial cell proliferation is present in primary but not secondary pulmonary hypertension. Journal of Clinical Investigation 101(5), 927-934 (1998). [4] A. Arora, E.M. Scholar: Role of tyrosine kinase inhibitors in cancer therapy. The Journal of Pharmacology and Experimental Therapeutics 315, 971-979 (2005). [5] H. A. Ghofrani, W. Seeger und F. Grimminger: Imatinib for the treatment of pulmonary arterial hypertension. New England Journal of Medicine 353, 1412-1413 (2005). [6] R.T. Schermuly, E. Dony, H.A. Ghofrani, S. Pullamsetti, R. Savai, M. Roth, A. Sydykov, Y.J. Lai, N. Weissmann, W. Seeger, F Grimminger: Reversal of experimental pulmonary hypertension by PDGF inhibition. Journal of Clinical Investigation 115, 2811-2821 (2005). [7] M. Klein, R. T. Schermuly, P. Ellinghaus, H. Milting, B. Riedl, S. Nikolova, S. S. Pullamsetti, N. Weissmann, E. Dony, R. Savai, H. A. Ghofrani, F. Grimminger, A. E. Busch, S. Schäfer: Combined tyrosine and serine/threonine kinase inhibition by sorafenib prevents progression of experimental pulmonary hypertension and myocardial remodeling. Circulation 118(20), 2081-2090 (2008). [8] M. R. Bristow , L. S. Zisman, B. D. Lowes, W. T. Abraham, D. B. Badesch, B. M. Groves, N. F. Voelkel , D. M. B. Lynch, R. Q. Quaife: The pressure-overloaded right ventricle in pulmonary hypertension. Chest 114, 101-106 (1998). Drittmittelfinanzierung DFG, Humboldt-Stiftung, DAAD, Higher Education Commission (Pakistan) © 2008 Max-Planck-Gesellschaft www.mpg.de