Institut für Klinische Molekular
Werbung

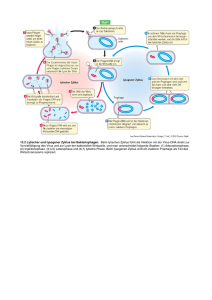
Institute of Clinical Molecular Biology and Tumour Genetics DIE INSTITUTE Institut für Klinische Molekularbiologie und Tumorgenetik Munich (Director: Prof. Dr. Georg W. Bornkamm) München (Direktor: Prof. Dr. Georg W. Bornkamm) auptthema des Instituts ist die Aufklärung zellulärer Signalwege, die in Zellen des hämatopoetischen Systems Proliferation, Überleben, Differenzierung und funktionelle Aktivierung der Zellen steuern sowie der Störung dieser Signalwege durch genetische Veränderungen der Zellen im Laufe der malignen Entartung. Die genetischen Veränderungen der Zellen können dabei sowohl durch Aufnahme von zusätzlicher genetischer Information in die Zelle verursacht sein (Virusinfektion) als auch durch Umorganisation des bestehenden, in Chromosomen strukturierten genetischen Materials (Chromosomentranslokationen) und zur Störung der Regulation von Genen führen, die physiologischerweise an der Kontrolle der Proliferation und dem Überleben der Zelle beteiligt sind (sog. Onkogene). Am Institut beschäftigt sich die Abteilung für Genvektoren unter Leitung von Prof. W. Hammerschmidt mit den Grundlagen viraler Onkogenese und der Entwicklung von viralen Vektoren für die Therapie maligner Erkrankungen. Am Institut waren 20 Wissenschaftler(innen), 10 technische Mitarbeiter(innen) und 17 Doktoranden beschäftigt. H Der diesjährige Jahresbericht widmet sich dem Thema Regulation der Viruslatenz. esearch in the Institute is concerned with the elucidation of the signal transduction pathways that regulate the proliferation, survival, differentiation, and functional activation of cells of the haematopoietic system, as well as with the perturbation of these pathways by the genetic changes that arise in the course of malignant transformation. Such genetic changes may be caused by uptake of additional genetic information by the cells (viral infection), or by reorganisation of the existing genetic material that is organised in chromosomes (chromosomal translocations), and can lead to perturbed expression of genes involved in proliferation and survival (so called oncogenes). Within the Institute, the Department of Gene Vectors led by Prof. W. Hammerschmidt is looking at the basic mechanisms of viral oncogenesis and the development of viral vectors for therapy of malignant diseases. In 2002 there were 20 scientists, 10 technicians, and 17 postgraduate students at the Institute. This year’s annual report focuses on the regulation of virus latency. R Kontrolle der Latenz des Epstein-Barr Virus Das Epstein-Barr Virus (EBV) ist ein ubiquitär verbreitetes menschliches Herpesvirus. Die Primärinfektion verläuft im Kindesalter meist inapparent, sie kann aber – vor allem bei älteren Kindern und jungen Er- 199 GSF wachsenen – zum klinischen Bild der infektiösen Mononukleose führen, einer durch Lymphknotenschwellungen und Fieber charakterisierten, sich selbst limitierenden lymphoproliferativen Erkrankung. Das Epstein-Barr Virus hat das Interesse der Krebsforscher erregt, weil es in vivo und in vitro primäre menschliche B-Lymphozyten infizieren und zur Proliferation anregt und weil es mit einer Reihe menschlicher maligner Erkrankungen assoziiert ist. Damit wird umschrieben, dass die genetische Information des Virus regelmäßig in Tumoren gefunden und zum Teil auch in Proteine übersetzt wird, ohne dass man in den meisten Fällen versteht, wie das Virus zur malignen Entartung der Zelle beiträgt. Die Assoziation des Virus mit einer malignen Erkrankung ist jedoch die Ausnahme. In der Regel begrenzt sich die Infektion selbst: die einsetzende Zellproliferation löst eine massive T-Zell-Immunantwort aus, die sich gegen die virusinfizierten Zellen richtet und die infizierten proliferierenden Zellen eliminiert (Abb. 1). Wie bei allen Herpesviren führt aber die gegen das Virus gerichtete Immunantwort nicht zur Elimination des Virus aus dem Körper. Das Virus benutzt das zelluläre Immunsystem, um für sich selbst eine Nische zum Überleben und zur Koexistenz mit seinem Wirt zu finden: es überwintert in inaktiver Form in den Gedächtniszellen, die nach einer erneuten Antigenexposition für die Bildung von hochaf- finen Antikörpern verantwortlich sind. Aus diesen Zellen kann das Virus bei Immunsuppression reaktiviert werden, einen lytischen Zyklus zur Virusvermehrung durchlaufen und wieder mit einer neuen Infektion von Lymphozyten beginnen. Die unterschiedlichen Modi der Virus-Wirtsinteraktion unter physiologischen Bedingungen machen dieses Virus – neben der Rolle als mögliches Tumorvirus – für den Wissenschaftler besonders interessant: (1) die nichtproduktive Infektion (d.h. Infektion ohne Bildung von viralen Partikeln) mit gleichzeitiger Induktion von Proliferation der infizierten Zellen durch virale Proteine, (2) der lytische Zyklus mit Replikation der viralen DNA und Bildung von infektiösen Nachkommen und (3) der Übergang in den Winterschlaf, aus dem das Virus unter bestimmten Bedingungen reaktiviert werden kann. Welche molekularen Prozesse den verschiedenen Formen der Virus-Wirtsinteraktion zu Grunde liegen und den Übergang von einem Schicksal in das andere bestimmen, ist nicht verstanden. Der Eingang in den lytischen Zyklus und die Produktion von infektiösen Nachkommen ist nicht mit dem Überleben der infizierten Zelle vereinbar. Umgekehrt führt die nicht-produktive Infektion von menschlichen B-Lymphozyten zur kontinuierlichen Proliferation der Zellen in vitro, ein Phänomen, das Transformation oder Immortalisation genannt wird. Nachdem diese beiden Virus-Wirtsinteraktion in vivo Das experimentelle In-vitro-System LATENZ Antigen EBNA2-ER + estrogen LATENZ EBNA1 CD40L - estrogen EBNA1 CD21, 23 CD21, 23 BZLF1 EA PROLIFERATION EBNA1, 2, 3A,3B,3C/ LP/LMP1,2 Abb. 1: Die drei Modi der Virus-Wirtsinteraktion in vivo: Induktion von B-Zellproliferation, die von zytotoxischen T-Zellen begrenzt wird (links), lytischer Zyklus mit Virusproduktion (rechts) und in vivo Latenz in Gedächtnis-B-Lymphozyten (Mitte). 200 GSF BZLF1 LMP1 VCA, MA PROLIFERATION EBNA1, 2, 3A,3B,3C/ LP/LMP1, 2 +/- anti-IgM +/- TPA VCA, MA +/- anti-IgM +/- TPA EA Abb. 2: Das experimentelle System: EREB2-Zellen sind konditional immortalisierte menschliche B-Lymphozyten. Sie proliferieren in Gegenwart von Östrogen und schalten nach Hormonentzug das virusinduzierte Proliferationsprogramm ab. DIE INSTITUTE 60 % VCA-positive cells Modi der Virus-Wirtsinteraktion sich gegenseitig ausschließen, haben wir postuliert, dass diejenigen viralen Proteine, die die Zellproliferation steuern und die Zelle immortalisieren, auch gleichzeitig den lytischen Zyklus des Virus unterdrücken sollten. Um diese Hypothese zu prüfen und den Beitrag einzelner viraler Latenz-Gene für die Unterdrückung des lytischen Zyklus untersuchen zu können, haben wir ein konditionales Zellsystem geschaffen, in dem EBNA2, einer der zentralen viralen Regulatoren der Zellproliferation, an- und abgeschaltet werden kann. Primäre menschliche B-Lymphozyten wurden mit einem transformationsdefekten Virusstamm infiziert, dem das EBNA2-Gen fehlt. Durch Infektion mit einem zweiten rekombinanten Virus wurde die Funktion von EBNA2 durch ein Gen komplementiert, das für ein Fusionsprotein – bestehend aus EBNA2 und der Hormonbindungsdomäne des Östrogenrezeptors – kodiert. In Abwesenheit von Östrogen bindet die Hormonbindungsdomäne des Östrogenrezeptors an HSP90, wodurch das gesamte Fusionsprotein inclusive des EBNA2-Anteils entfaltet wird. Bei Zugabe von Hormon dissoziiert HSP90 ab, so dass das Fusionsprotein eine aktive Konformation annimmt. Da EBNA2 die Expression aller an der Immortalisation beteiligter viraler und zellulärer Gene steuert, wird dadurch der Prozess der Zellimmortalisation von der Präsenz von Östrogen abhängig. In Gegenwart von Hormon proliferieren diese EREB2 (für Estrogen-Rezeptor und EBNA2) genannten Zellen, in Abwesenheit von Hormon verlassen sie den Zellzyklus und sterben innerhalb weniger Tage ab. Mit diesem experimentellen System konnten wir prüfen, ob an der Immortalisation beteiligte virale Proteine tatsächlich die Induktion des lytischen Zyklus blockieren (Abb. 2). Behandelt man EREB2-Zellen in Gegenwart von Östrogen mit Induktoren des lytischen Zyklus wie anti-IgM oder dem Phorbolester TPA, sind die Zellen fast resistent und lassen sich kaum in den lytischen Zyklus treiben. Behandelt man dagegen die Zellen mit anti-IgM oder TPA in Abwesenheit von Östrogen, lässt sich in ca. 30 bis 50 40 no stimulus TPA anti-IGM 30 20 10 0 plus estrogen minus estrogen Abb. 3: Induktion des lytischen Zyklus und Produktion von Viruskapsidantigen (VCA) in Hormon-behandelten und Hormon-depletierten EREB2-Zellen. Das virale LMP1-Antigen kann die Induzierbarkeit des lytischen Zyklus in proliferierenden Zellen verhindern (Daten nicht gezeigt). 40% der Zellen der lytische Zyklus induzieren (Abb. 3). Diese Befunde belegen, dass ein an der Immortalisation beteiligtes virales Protein die Induzierbarkeit des lytischen Zyklus blockiert. Dies ist LMP1: konstitutive Expression des von EBNA2 induzierten LMP1-Proteins, das selbst transformierende Eigenschaften für Nagerzellen besitzt, unterdrückt die Induzierbarkeit des lytischen Zyklus auch in Abwesenheit von Hormon. LMP1 ist ein virales Membranprotein, das an seiner intrazellulären C-terminalen Domäne Signalmoleküle der TRAF-Familie bindet. Diese Moleküle sind mit den intrazellulären Signaltransduktionsdomänen der Rezeptoren der TNF-Rezeptorfamilie (TNF-R assoziierte Faktoren) assoziiert. Ein für B-Zellen besonders wichtiger Vertreter dieser Rezeptorfamilie ist das zelluläre CD40-Protein, das Signale von aktivierten T-Zellen übermittelt. Verlust des CD40-Liganden ist durch eine schwere Immunsuppression mit Unfähigkeit zur Bildung von hochaffinen IgGAntiköpern gekennzeichnet. Auf Grund der funktionellen Homologie zwischen CD40 und LMP1 lag es nahe zu prüfen, ob auch die Stimulation des CD40-Rezeptors die Induktion des lytischen Zyklus blockiert. Dies ist tatsächlich der Fall. Behandlung von Östrogen-deprivierten EREB2-Zellen 201 GSF 50 100 150 250 LTK-CD40L 50 100 150 250 no treatment LTK x 105 cells TPA BZLF1 anti-IgM Abb. 4: CD40-Stimulation blockiert die Induktion des lytischen Zyklus (gemessen an der Synthese des frühen viralen BZLF1-Antigens) in Hormondepletierten EREB2-Zellen durch TPA und antiIgM. Hormon-depletierte EREB2-Zellen wurden mit LTK-Kontrollzellen sowie mit LTK-CD40L-Zellen, die den CD40 Liganden konstitutiv exprimieren, kokultiviert. Mit steigender Zellzahl ergibt sich eine klare Dosis-Wirkungsbeziehung. mit CD40-Ligand unterdrückt die Induktion des lytischen Zyklus durch anti-IgM oder TPA (Abb. 4). Die Tatsache, dass CD40-Stimulation die Induktion des lytischen Zyklus blockiert, hat wichtige Implikationen für die VirusWirtsbeziehung in der Latenz. Trifft eine B-Gedächtniszelle auf das für sie passende Antigen, so wird sie nur dann zur Plasmazelle ausreifen, wenn sie gleichzeitig ein Signal von einer aktivierten T-Zelle über den CD40-Liganden empfängt. Fehlt das CD40-Signal, induziert die Stimulation des B-Zellrezeptors Zelltod. Entsprechendes gilt für eine B-Gedächtniszelle, in der ein virales Genom schlummert. Trifft eine das Virusgenom tragende Gedächtniszelle ihr Antigen und empfängt gleichzeitig über CD40 ein Signal von einer aktivierten TZelle, so wird die Virusreaktivierung und die Induktion des lytischen Zyklus unterdrückt (Abb. 1). Empfängt eine solche Zelle dagegen ein Signal vom B-Zellrezeptor ohne T-Zellstimulation, wird das Virus reaktiviert und ein lytischer Zyklus induziert. Diese Befunde erhellen zum ersten Mal den lange bekannten Zusammenhang zwischen Immunsuppression und Virusreaktivierung. Immunsuppression führt zur funktionellen Inaktivierung der T-Zellen und/oder zur T-Zelldepletion. Unter diesen Bedingungen vermehrt stattfindende Antigenexposition führt zur Reaktivierung des Virus und zur dramatischen Erhöhung der Viruslast im Körper. Da Virusreaktivierung und Viruslast wichtige Risikofaktoren für die Entstehung EBV-assoziierter Lymphome sind, sind diese Befunde auch klinisch von hoher Relevanz. Zusammenarbeit Mitarbeiter des Instituts sind am Lehrbetrieb der Münchner Universitäten beteiligt. Die Arbeiten des Instituts wurden mit Drittmitteln der Deutschen Forschungsgemeinschaft (DFG), der Europäischen Gemeinschaft, der Deutschen Krebshilfe, der Wilhelm-Sander-Stiftung, des Bayerischen Forschungsverbundes, der Firma Hoffmann-LaRoche und des National Institute of Health, USA, unterstützt. Weiter ist das Institut an regionalen und nationalen Projekten der Universität München und des Bundesministeriums für Bildung und Forschung (BMBF) beteiligt. Ausgewählte Veröffentlichungen Adler, B., Schaadt, E., Kempkes, B., Zimber-Strobl, U., Baier, B., Bornkamm, G.W.: Control of Epstein-Barr virus reactivation by activated CD40 and viral latent membrane protein 1. Proc. Natl. Acad. Sci. U.S.A. 99, 437–442 (2002) 202 GSF Staege, M.S., Lee, Steven P., Frisan, T., Mautner, J., Scgolz, S., Pajic, A., Rickinson, A.B., Masucci, M.G., Polack, A., Bornkamm, G.W. MYC overexpression imposes a nonimmunogenic phenotype on Epstein-Barr virus-infected B cells. Proc. Natl. Acad. Sci. U.S.A. 99, 4550–4555 (2002) Nahta, R., Iglehart, J.D., Kempkes, B. Schmidt, E.V. Ratelimiting Effects of Cyclin D1 in Transformation by ErbB2 Predicts Synergy between Herceptin and Flavopiridol. Cancer research 62, 2267–2271 (2002) Horndasch, M., Raschke, E.E., Bommer, G., Schuhmacher, M., Dumont, E., Kuklik-Roos, C., Eick, D., Kempkes, B.: EBV antagonizes the anti-proliferative activity of TGF-ß but does not abolish TGF-ß signalling. Int. J. Cancer 101, 442–447 (2002) Röcken, M., Hültner, L. Heavy functions for light chains. Nature Medicine 8, 668–670 (2002)