bodyguard auf abwegen
Werbung

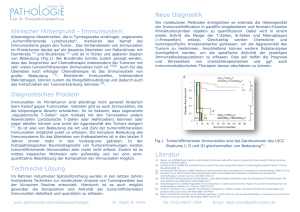
Für seine Untersuchungen zur Multiplen Sklerose, einer bislang unheilbaren Immunkrankheit, erhielt Professor Reinhard Hohlfeld im letzten Jahr den Sobek-Forschungspreis. Dem Direktor der Klinischen Neuroimmunologie der LMU gelang als Erstem die Isolierung und Züchtung derjenigen Art von Immunzellen, die bei Autoimmunerkrankungen wie Multiple Sklerose körpereigenes Gewebe angreifen. Diese Zellen und ihre Reaktionen sollen nun weiter charakterisiert werden, um letztlich die Heilungschancen für diese Leiden zu verbessern. SUSANNE WEDLICH bodyguard auf abwegen A ttackiert vom eigenen Beschützer: So müssen sich Patienten fühlen, die an einer Autoimmunerkrankung leiden. Der fehlgeleitete Übeltäter ist ihr eigenes Immunsystem, die wichtigste Waffe im Kampf gegen Krankheitserreger und Giftstoffe. Im gesunden Körper unterscheidet das Abwehrsystem zwischen Fremd und Selbst. Bei Autoimmunerkrankungen aber wird körpereigenes Material ebenso aggressiv attackiert wie ein Krankheitserreger. Professor Reinhard Hohlfeld gehört zu den Forschern, die sich diesen schweren Leiden widmen. Er leitet das Institut für Klinische Neuroimmunologie der LMU sowie eine Gruppe in der Abteilung für Neuroimmunologie des Max-PlanckInstituts für Neurobiologie in Martinsried. „Gemeinsam mit unserem langjährigen Kooperationspartner Hartmut Wekerle vom Max-Planck-Institut für Neurobiologie untersuchen wir die Entstehung, die Entwicklung und die Behandlung von neuroimmunologischen Erkrankungen“, sagt Reinhard Hohlfeld. „Darunter versteht man Leiden, die das Zentralnervensystem betreffen und wahrscheinlich auf Autoimmunität beruhen.“ Eine außergewöhnlich stimulierende Umgebung findet seine Forschung auch im Rahmen des Sonderforschungsbereichs (SFB) 571 „Autoimmunreaktionen: Von den Manifestationen über die Mechanismen zur Therapie“, in dem verschiedene Autoimmunerkrankungen untersucht werden. Reinhard Hohlfeld ist Sprecher des Programms. „Bei den meisten menschlichen Autoimmunerkrankungen sind die Therapiemöglichkeiten noch unbefriedigend – eine wirkliche Heilung ist schon gar nicht möglich“, erklärt er. „Das hat auch damit zu tun, dass immunologische Untersuchungen beim Menschen besondere methodische Anforderungen stellen, für die es oft noch keine optimalen Lösungen gibt.“ Wichtig sind für den Wissenschaftler deshalb speziell für seine Fragestellungen geeignete Tiermodelle, wie sie in dem SFB zur Verfügung stehen. Mit ihrer Hilfe lassen sich auch grundlegende Fragen der Entstehung von Autoimmunreaktionen studieren. „So erreichen wir ein enges Wechselspiel zwischen den eher krankheitsbezogenen und den an den Grundlagen orientierten Projekten“, so Reinhard Hohlfeld. „Das übersetzt sich ganz zwanglos in ein hohes Maß an Kooperativität zwischen den einzelnen Gruppen innerhalb des SFB.“ Ein Schwerpunkt seiner Forschung ist die Multiple Sklerose, kurz MS, eine der häufigsten Autoimmunerkrankungen. Bei diesem meist schubweise verlaufenden Leiden des zentralen Nervensystems werden Nervenfasern zerstört. Bestimmte Immunzellen, so genannte T-Lymphozyten, attackieren die fettreiche Schutzschicht der Nervenfasern. Dieses Myelin besteht aus einzelnen Zellen, die sich um die langen Fortsätze der Nervenzellen wickeln, um sie zu isolieren und die Signalweiterleitung entlang der Neuronen zu ermöglichen. Letztlich kommt es zu einem unwiederbringlichen Verlust von Myelin und zu einem Untergang der betroffenen Neuronen. Nach und nach zeigen sich ausgedehnte 43 LEBENSWISSENSCHAFTEN 7 Immunzellen (Makrophagen, braun gefärbt) im Gehirn eines MSPatienten „umzingeln“ ein Blutgefäß (links im Bild). 5 MS-Herde im histologisch gefärbten Hirnschnitt. Die normale Marksubstanz erscheint dunkelblau gefärbt. Der helle Fleck rechts unten entspricht einer Hirnkammer. Die MS-Herde erscheinen als unregelmäßig hellblau gefärbte Areale. Schädigungen in Gehirn und Rückenmark. Je nachdem, wo und in welchem Ausmaß diese Läsionen vorliegen, können verschiedene Symptome auftreten. Sehverlust und Sprachschwierigkeiten gehören dazu, aber auch Zittern, Taubheitsgefühl oder eine Einschränkung der Blasenfunktion sowie der Mobilität. Für seine Arbeit an dieser schweren Erkrankung wurde Reinhard Hohlfeld im letzten Jahr mit dem Sobek-Forschungspreis eine der weltweit bedeutendsten Auszeichnungen auf dem Gebiet der Erforschung der Multiplen Sklerose verliehen. Der Preis geht auf eine Initiative der Sobek-Stiftung zurück und wurde dieses Jahr zum fünften Mal vergeben. Mit 100.000 Euro ist er der höchst dotierte MS-Forschungspreis in Europa. Reinhard Hohlfeld erhielt die Auszeichnung für sein wissenschaftliches Gesamtwerk. Besonders bemerkenswert ist, dass ihm 1984 als Erstem die Isolierung humaner T-Helfer-Lymphozyten und ihre Züchtung in Kultur gelang. „Diese Immunzellen spielen eine zentrale Rolle bei der Körperabwehr“, berichtet er. „Sie helfen beispielsweise bei der Vernichtung von Bakterien und Viren und können sogar Krebszellen zerstören.“ Im gesunden Körper werden T-Lymphozyten, die sich gegen körpereigenes Material richten, frühzeitig aussortiert und vernichtet. Auf bisher unbekannte Weise entkommen bei Autoimmunität aber einige dieser fehlgeleiteten Immunzellen der Selektion. Wenn sie dann in einer Art Überreaktion Bestandteile des eigenen Körpers bekämpfen, kann das zu Multipler Sklerose oder anderen Autoimmunerkrankungen führen. INTENSIVER AUSTAUSCH ZWISCHEN IMMUN- UND NERVENSYSTEM Eine weitere Gruppe von Immunzellen, die von Reinhard Hohlfeld und seinem Team in diesem Zusammenhang untersucht werden, sind die Antikörper produzierenden B-Zellen. Auch sie können sich gegen körpereigenes Material wenden, wobei sie wohl auch mit den autoreaktiven T-Zellen kooperieren. So konnte gezeigt werden, dass auch Antikörper an Strukturen in der Myelinhülle der Neuronen von Patienten mit Multipler Sklerose binden. „Besonders interessant ist, dass die verschiedenen Immunzellen das Gehirn nicht nur schädigen“, so der Wissenschaftler. „Wir haben nachgewiesen, dass sie durch die Freisetzung von Nervenwachstumsfaktoren auch helfend eingreifen. Insgesamt findet ein überraschend intensiver Austausch zwischen dem Immunsystem und dem Nervensystem statt. Nicht nur die Immunzellen wirken auf die Neuronen, auch die Zellen des Nervensystems produzieren immunverändernde Stoffe.“ Diese unerwarteten Interaktionen könnten direkte Implikationen für die Therapie von Multipler Sklerose haben. „Wir können diese T-Zellen aus dem Blut gewinnen und in ihren Eigenschaften charakterisieren“, sagt er. „Wichtig ist uns auch die Identifizierung und genaue Darstellung der zellulären Andockstellen der T-Lymphozyten. Bei unserer Analyse kommt es vor allem darauf an, verschiedene Untersuchungsansätze möglichst optimal zu verbinden und zu nutzen sowie geeignete Tiermodelle zu konstruieren.“ Letztlich geht es den Forschenden darum, die Strukuren zu finden, die von diesen vermutlich autoaggressiven Immunzellen erkannt und attackiert werden. „Nur bei wenigen menschlichen Autoimmunerkrankungen konnten diese so genannten Autoantigene bisher 44 LEBENSWISSENSCHAFTEN 3 Läsionen im Gehirn eines MS-Patienten (Kernspintomogramm). A: Entzündungsherde erscheinen als asymetrisch verteilte weiße Punkte. Die Schmetterlingsähnliche Figur in der Bildmitte entspricht den Hirnkammern. B: Zwei Herde nehmen Kontrastmittel auf, d.h. sind akut entzündet. identifiziert werden“, so Reinhard Hohlfeld. „Das hat beispielsweise bei der Multiplen Skerose damit zu tun, dass sich hinter diesem Etikett wahrscheinlich mehrere entzündliche Erkrankungen des Zentralnervensystems verstecken, die noch dazu verschiedene Ursachen haben. Dazu kommt, dass das notwendige Untersuchungsmaterial – bestenfalls Biopsiegewebe, oft aber nur Blut oder Gewebeflüssigkeit – nur schwer zu beschaffen ist und zudem durch die medikamentöse Unterdrückung des Immunsystems beeinflusst wird.“ Diese Medikamente wirken eher unspezifisch. In der Regel verändern und unterdrücken sie das Immunsystem oder hemmen Entzündungen. Sie verhelfen aber den Betroffenen zu einer besseren Lebensqualität und einer nur mehr gering reduzierten Lebenserwartung. Die Forschung aber hofft auf eine vollständige Heilung oder wenigstens die Entwicklung einer zielgerichteten Therapie, die beispielsweise die autoreaktiven Immunzellen abfängt, die attackierten Strukturen im Myelin blockiert, dieses wieder aufbaut oder die gesamten Neuronen schützt. Noch aber wird die Multiple Sklerose dafür zu wenig verstanden. Unklar ist unter anderem, wie das Leiden entsteht, auch wenn es einige Hinweise auf mögliche Ursachen gibt. Bekannt ist beispielsweise, dass Frauen mehr als doppelt so häufig betroffen sind wie Männer, was auf die Wirkung von Hormonen zurückgeführt wird. Denn die Erkrankung tritt häufig in der Pubertät auf und verläuft nach der Menopause weniger schwer. Diskutiert werden aber auch Umweltfaktoren als mögliche Auslöser. Vieles deutet darauf hin, dass die Kindheit in diesem Zusammenhang eine entscheidende Lebensphase ist. Auch Krankheitserreger könnten eine Rolle spielen. Nach dieser These kommt es in vielen Fällen zu Autoimmunität, weil das Immunsystem körpereigene Strukturen aufgrund struktureller Ähnlichkeit mit Krankheitserregern verwechselt. Letztlich muss wohl aber auch die genetische Veranlagung berücksichtigt werden. Menschen europäischer Abstammung beispielsweise sind in derselben Umgebung viel häufiger betroffen als etwa die eingeborenen Aborigines Australiens, die Maori in Neuseeland oder die kanadischen Inuit. Vorerst wirft die Multiple Sklerose noch mehr Fragen auf, als die Medizin Antworten bereitstellt. Es muss noch viel geforscht werden, um all die Puzzlestücke an Erkenntnis zusammenfügen zu können. Unterstützung könnte jetzt aber auch von anderer Seite kommen. Bislang wurden die einzelnen Autoimmunerkrankungen in der Regel getrennt untersucht. Zunehmend aber wendet sich die Wissenschaft dem Gesamtphänomen Autoimmunität zu, um gemeinsame Prinzipien aufzudecken. Auch Reinhard Hohlfeld möchte sich mit seiner Forschung nicht auf einen Bereich beschränken. „Im Rahmen unserer Arbeit beschäftigen wir uns vor allem mit der Multiplen Sklerose“, sagt er. „Wir erhoffen uns von unserer Arbeit aber breite Anwendungsmöglichkeiten – auch bei anderen Autoimmunerkrankungen.“ Prof. Dr. Reinhard Hohlfeld ist seit 1990 Leiter einer integrierten Forschergruppe, die zwischen der Neurologischen Universitätsklinik und dem Max-Planck-Institut für Neurobiologie in Martinsried angesiedelt ist. Er leitet auch das Institut für Klinische Neuroimmunologie und ist Sprecher des Sonderforschungsbereiches 571 „Autoimmunreaktionen: Von den Manifestationen über die Mechanismen zur Therapie“. [email protected] http://sfb571.web.med.uni-muenchen.de 45 LEBENSWISSENSCHAFTEN