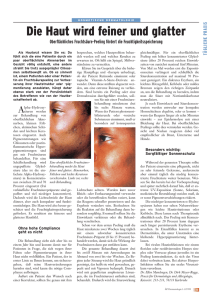
1. Maligne Tumore als Krankheit
Werbung
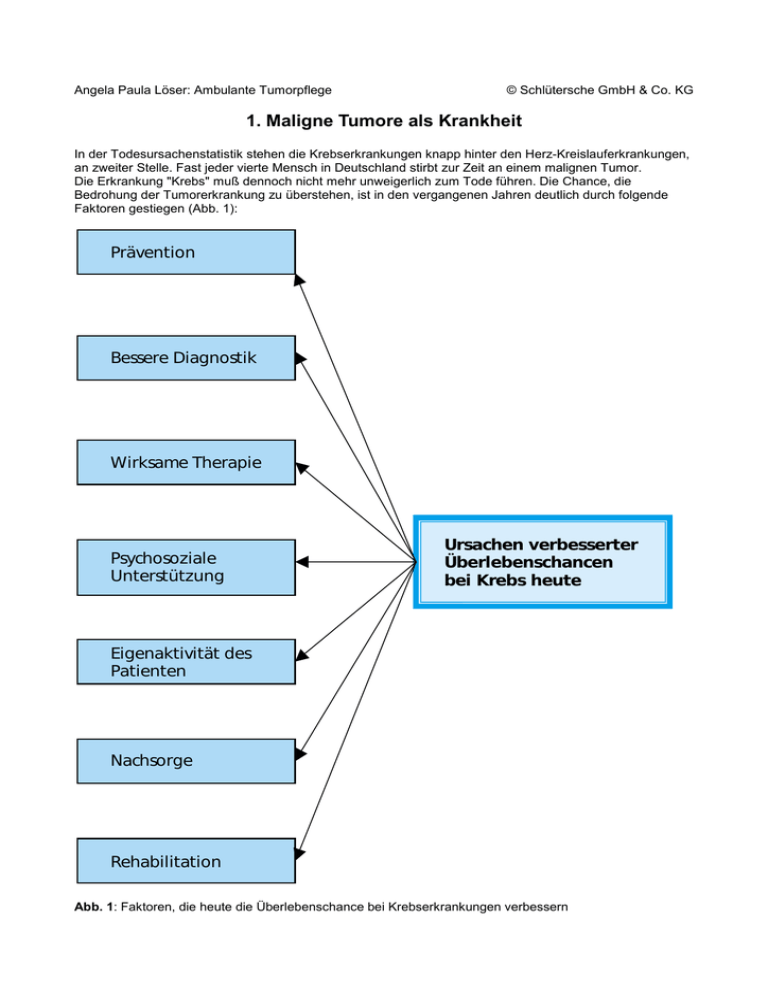
Angela Paula Löser: Ambulante Tumorpflege © Schlütersche GmbH & Co. KG 1. Maligne Tumore als Krankheit In der Todesursachenstatistik stehen die Krebserkrankungen knapp hinter den Herz-Kreislauferkrankungen, an zweiter Stelle. Fast jeder vierte Mensch in Deutschland stirbt zur Zeit an einem malignen Tumor. Die Erkrankung "Krebs" muß dennoch nicht mehr unweigerlich zum Tode führen. Die Chance, die Bedrohung der Tumorerkrankung zu überstehen, ist in den vergangenen Jahren deutlich durch folgende Faktoren gestiegen (Abb. 1): Prävention Bessere Diagnostik Wirksame Therapie Psychosoziale Unterstützung Ursachen verbesserter Überlebenschancen bei Krebs heute Eigenaktivität des Patienten Nachsorge Rehabilitation Abb. 1: Faktoren, die heute die Überlebenschance bei Krebserkrankungen verbessern - Verbesserte Möglichkeit der Prävention durch differenzierte Kenntnisse über Entstehungsmechanismen - frühzeitige Diagnose durch den Einsatz moderner diagnostischer Maßnahmen - Erhöhung der Heilungschance, durch verbesserte Therapieverfahren - verbesserte Möglichkeiten der Nachsorge (festgelegte Untersuchungsprogramme zur Früherkennung von Rezidiven und Metastasen) - Früherkennung von krankheits- und therapiebedingten Schäden - Rehabilitation (= Maßnahmen zur Wiederherstellung eines bestmöglichen Zustandes und Ermöglichen eines weitgehend normalen Lebens) - Verbesserung der Prognose bei einigen Tumorarten durch eine intensivere soziale Unterstützung, z. B. durch Selbsthilfegruppen (z. B. beim Mamma-Karzinom) 1.1. Tumorzellentstehung und -ausbreitung Nach einem streng geregelten Ablaufschema, in dem Zelluntergang und Zellneubildung kontrolliert werden, funktioniert die Zellerneuerung. Alle Zellen unterliegen den in ihrem Erbgut vorgegebenen oder durch bestimmte Faktoren (z. B. Wachstumsfaktoren) geregelten Gesetzmäßigkeiten. Ähnlich wie bei einem Kopiervorgang werden die neuen Zellen immer nach dem Prinzip der Mutterzelle nachgebildet. Kommt es jedoch zur Störung, kann dieser geregelte Prozeß aus dem Gleichgewicht geraten und es entstehen nachfolgend veränderte Produkte. Hier unterscheiden wir zwei Hauptmechanismen: 1.1.1. Adaptationsvorgänge Durch Prozeßstörung kann sich ein verändertes Wachstumsverhalten einstellen. Hinsichtlich der Adaptation lassen sich unterschiedliche Formen feststellen (Abb. 2): Atrophie: Es kommt zur Reduktion von Zellzahl und Zellgröße, meist infolge einer Stoffwechselreduktion. Bsp. Bei der Osteoporose kommt es bedingt durch Immobilität zu einer Abnahme der Knochenbälkchen mit veränderter Funktion. Hypertrophie: Es kommt zur Größenzunahme bereits bestehender Zellen eines bestimmten Gewebes infolge gesteigerte Belastung oder eines erhöhten Stoffwechsels. Bsp. Muskelhypertrophie bei Sportlern. Hyperplasie: Es kommt zur Zunahme der bestehenden Zellzahl innerhalb eines Gewebes. Bsp. Narbenkelloidbildung. Metaplasie: Es kommt zur Transformation (Umwandlung) einer Zellart in eine andere, innerhalb eines Gewebes, mit veränderten Eigenschaften. Bsp. Veränderung des Lungengewebes in bindegewebige Strukturen bei Morbus Boeck. 1.1.2. Wachstumsvorgänge Im Gegensatz zu den Adapatationsvorgängen zeichnet sich hier ein überschüssiges Zellwachstum ab, welches nicht mehr mit den physiologischen Bedürfnissen des betroffenen Gewebes innerhalb des Organismus übereinstimmt. Es handelt sich hierbei nicht mehr um einen Adapatationsvorgang an eine veränderte Situation im Sinne einer veränderten, aber Atrophie Hypertrophie Hyperplasie Metaplasie Normaler Zustand Abb. 2: Schematische Darstellung der unterschiedlichen Adaptationsformen noch nicht bösartigen Gewebeveränderung, sondern um eine echte Fehlfunktion. Diese Fehlfunktion bedeutet nun eine Gewebevermehrung - es entsteht ein Tumor, eine Geschwulst oder ein Neoplasma, je nach Eigenschaften der Gewebeart. 1.1.3. Teilungsverhalten normaler und krankhafter Zellverbände Ein Tumor entwickelt sich nicht von heute auf morgen. Vielfach vergehen 5-10 Jahre, ehe aus der ersten entarteten Zelle eine klinisch nachweisbare Geschwulst entsteht. A) Knäuelstadium (Prophase) B) Muttersternphase (Metaphase) C) Trennung der Kernhälften (Anaphase) D) Tochtersternphase (späte Anaphase) E) Endphase (Telophase oder Rekonstruktionsphase) Abb. 3: Zellteilung Mehrere Schritte müssen zunächst ablaufen: Die Zelle, als kleinste Einheit unseres Körpers ist Ausgangsort einer Krebsgeschwulst. In ihrem Zellkern enthält sie alle wichtigen Erbinformationen (= Chromosomen). Sie verfügt über die Angaben zu Zellteilungsvorgängen, späterem Aussehen und Funktion der Zelle. Ständig finden Zellteilungsvorgänge im Körper statt. Es entstehen nach dem gleichen Muster immer neue Zellen, überalterte sterben ab (Abb. 3). Ablauf des Zellteilungsvorgangs: 1.1.3.1 Die molekulare Uhr des Zellzyklus Nicht allein die aus dem Gleichgewicht geratenen Signalübermittlungssysteme, die bei gesunden Zellen Wachstum und Vermehrung steuern, führen zur ungezügelten Vermehrung von Tumorzellen, auch der als Uhr des Zellteilungssystems wirkende Mechanismus ist gestört. Im Zellkern findet sich dieser Mechanismus, der als ein Verbund von miteinander kommunizierenden und wechselwirkenden Proteinen den zeitlichen Ablauf des Zellzyklus steuert. Ein Überwiegen der stimulierenden Proteine führt dann zu einem beschleunigtem Ablauf der Zellregeneration. 1.1.3.2 Lebensdauer der Zellen Je nach Zelltyp kann eine Zelle viele Jahre lebensfähig bleiben (z. B. Nervengewebe) oder nach kurzer Zeit (Darmgewebe) absterben. Externe Signale geben der in der Ruhephase sich befindenden Zelle entweder den Reiz zum Wiedereintritt in den Zellzyklus, aktivieren sie damit zur Zellerneuerung oder provozieren den Eintritt in die Apoptose, das bedeutet in den programmierten Zelltod. 1.1.3.3 Phasen der Zellteilung Wie Abbildungen 4 und 5 zeigen, laufen in jeder Zelle unterschiedliche Phasen ab. G1-Phase (G = englisch growth/Wachstum) Im Anschluß an die M-Phase (= Mitosephase, also zu Beginn des Zellzyklus nimmt die Zelle an Größe zu und synthetisiert neue Proteine, Nukleinsäuren und weitere Stoffe. In der G-Phase findet auch die Zelldifferenzierung -, d. h. Ausbau und Reifung zu einem bestimmten Zelltyp statt. Am Ende der G1-Phase, am sogenannten Restriktionspunkt entscheidet die Zelle, ob sie in den Zyklus zurückkehrt, in Ruhe verharrt, oder abstirbt. So können z. B. chromosomale DNS-Schäden, die in der M-Phase aufgetreten sind, den durch die Zelle selbstgesteuerten Zelltod (Apoptose) induzieren. Hier handelt es sich um einen körpereigenen Schutzmechanismus. GO-Phase Die ausgereifte, funktionsfähige Zelle durchläuft nun einen Ruhezyklus, der auch als GO-Phase bezeichnet. Diese Zellen befinden sich nicht akut in der Teilungssituation, sind aber auch nicht im Absterben begriffen. Es sind die reifen Zellen, die ihre Funktion wahrnehmen. Metabolische Aktivität kennzeichnet diese Phase. In der Ruhephase entscheidet die Zelle, wann sie durch Wachstumsfaktoren gesteuert, wieder in den Zellteilungszyklus eintritt. S-Phase (S = Synthese) Hat sich die Zelle am Restriktionspunkt dazu entschieden, unwiderruflich in den Zellzyklus einzutreten, werden in der S-Phase im Zellkern Desoxiribonukleinsäuren (Bausteine der Chromosomen) synthetisiert. Beim Menschen finden sich normalerweise 46 Chromosomen, die sich nun teilen. Ziel dieses Vorgangs ist es, das Erbgut zu verdoppeln. In dieser Phase ist die Zelle besonders anfällig gegenüber äußeren Einflüssen (z. B. Kanzerogene oder ionisierende Strahlen). G2-Phase Im Anschluß an die S-Phase folgt jetzt die G2-Phase, die auch als prämitotische Phase bezeichnet wird. Sie dauert nur wenige Stunden und beinhaltet den weiteren, wenn auch geringfügigeren, Eiweißaufbau sowie den Umbau der Zellmembran, schon im Hinblick auf die Zellteilung. In der G-Phase enthält die Zelle schon das Erbmaterial in doppelter Anlage. Zelle im Ruhezustand Erkennen von wesentlichen Zellschäden durch die Zelle selbst Weitgehend normale Funktion, regelrechter Zellaufbau Einsatz und Aktivierung von selbstzerstörenden Mechanismen Erneuerung der Zelle durch erneute Zellteilung Selbstgesteuerter Zelltod = Apoptose Abb. 4: Zellzyklus und selbstgesteuerter Zelltod M-Phase Hier findet die eigentliche Zellteilung statt. In einem Teilungsvorgang werden nun Chromosomen und Zellteile in zwei identische Tochterzellen geteilt. Ein neuer Zellzyklus beginnt. Der programmierte Zelltod (Apoptose) Ablauf des programmierten Zelltodes Der programmierte Zelltod wird von der Zelle selbst induziert. Hormone, Wachstumsfaktoren oder andere chemische Substanzen, die z. B. bei Chromosomenaberrationen, bei Mutation eines Proto-Onkogens in ein Onkogen oder bei Verlust von Tumorsuppressorgenen aktiviert werden, führen zu veränderten Reaktionen innerhalb der Zelle: der Proteingehalt nimmt ab, die Kalziumkonzentration in der Zelle nimmt zu. Dadurch kommt es zu einem Wachstumsstopp, zur Auflösung der DNS und letztlich zum Zelltod. Die Häufigkeit der Zellteilungen hängt davon ab, ob sie sich in einem funktionsfähigen Zustand befinden oder ob sie absterben. Normalerweise bilden sich immer nur soviel neue Zellen, wie vorher zugrunde gegangen sind. Bei einem Schnitt in den Finger z. B. werden nur so lange neue Zellen gebildet, bis der Defekt vollständig geschlos- Wirkung von zellzerstörenden Hormonen Cylin E und Cylin D Wachstumsfaktoren Verlust der Tumorsuppressorgene DNS-Schäden in der Zelle Abnahme der Proteine im Zellkern Zunahme der CalziumKonzentration in der Zelle Zelltod = Apoptose Abb. 5: Ablauf der Apoptose sen ist. Danach erhalten die Zellen einen Befehl, ihre gesteigerte Neubildung einzustellen. Wird dieses Naturgesetz nicht mehr eingehalten, kann es zu einem überschießendem Wachstum als Zeichen eines krankhaften Prozesses kommen. Nichtprogrammierter Zelltod Eher zufällig und im Sinne einer Nekrose auftretend, kann ein nicht programmierter Zelltod ausgelöst werden. Dabei gehen keinerlei Impulse von der Zelle aus, sie bleibt inaktiv. Ein solcher Zelluntergang kann z. B. durch Veränderungen der Durchlässigkeit der Zellmembran ausgelöst werden, bei der es zum Druckanstieg innerhalb der Zelle kommt. Gesunde Zelle mit normaler Zellinformation Einwirkung krebserregender Einflüsse Veränderte Zelle mit pathologischem Genmaterial DNS-Repair Gesunde Zelle mit normalen Genmaterial Zelluläre Abwehr Humorale Abwehr Phagozytäre Abwehr Entartete Zelle Vernichtung der entarteten Zelle Abb. 6: Reparaturmechanismen des Körpers zur Eliminierung von Krebszellen Schließlich wird der Druck so massiv, daß die Zelle platzt. 1.1.3.4 Wachstumsfaktoren und ihr Einfluß auf die Zellteilung Sich ständig erneuernde Gewebe wie z. B. Blutzellen unterliegen einer Wachstumskontrolle durch sogenannte Wachstumsfaktoren. Diese greifen regulier end, im Sinne einer Beschleunigung oder Verlangsamung, je nach Bedarf, in die Zellerneuerungsvorgänge ein. Für die Blutbildung sind unter anderem folgende Wachstumsfaktoren bekannt: - Erythropoetin - ein Stoff der die Erythrozytenproduktion anregt (Handelsname: Eprex) - Granulozytenkolonie-stimulierender Faktor (G-CSF) regt die Produktion von Granulozyten an. (Handelsnamen: Neupogen) - Granulozyten- und Makrophagenkolonie-stimulierender Faktor (GM-CSF) regt die Produktion von Monozyten/Makrophagen und Granulozyten an. (Handelsname: Leukomax) 1.1.3.5 Pathologische Zellteilung und Tumorentstehung Die Veränderung der Chromosomen mit Weitergabe falscher Zellinformationen ist immer Voraussetzung für die Entstehung von Tumorzellen. Chromosomenschäden können z. B. unter Einwirkung von Krebsnoxen (sog. Kanzerogene) durch Mutation entstehen. Jeden Tag werden mehrere hundert entartete Zellen im menschlichen Organismus gebildet. Im gesunden Zustand eliminiert der Organismus diese, so daß die Entwicklung eines komplexen Zellverbandes nicht möglich ist. 1.2. Ursachen für Krebs Bislang konnten eine ganze Anzahl von sicher kanzerogen wirkenden Stoffen und krebserregenden Faktoren und Verhaltensweisen analysiert werden. Daneben gibt es zahlreiche Faktoren, die mit hoher Wahrscheinlichkeit, vielfach durch kombiniertes, zeitgleiches Zusammentreffen, an der Entstehung einer bösartigen Tumorerkrankung beteiligt sein können. Tabelle 1 zeigt krebsverursachende Faktoren. Weitere wahrscheinliche, untereinander sich beeinflussende Faktoren - Sozioökonomische Faktoren: Menschen, die in einer wirtschaftlich und sozial reduzierten Situation leben, leiden häufiger an Krebs im Mundbodenbereich, an Magen-, Lungen-, Leber-, Speiseröhren- und Gebärmutterhalskrebs. Wahrscheinlich hängt dies mit einer schlechteren Ernährung, unzureichenden hygienischen Verhältnissen (häufigerer und stärkerer Kontakt mit krebsauslösenden Bakterien und Viren) sowie mit geringeren psychohygienischen Kompensationsmechanismen zusammen. - Fortpflanzung: Eine frühe Menarche, eine spät einsetzende Menopause und eine in späteren Jahren (ca. nach dem 30. Lebensjahr einsetzende erste Schwangerschaft scheinen ein Risiko für die Entstehung von Brustkrebs zu sein. Möglicherweise hängt dies mit den körpereigenen Sexualhormonen (hier Östrogene) zusammen. - Umweltverschmutzung: Obwohl noch nicht bei allen Faktoren der eindeutige Zusammenhang mit einer möglichen Krebserkrankung geklärt ist, scheinen folgende Faktoren eine Rolle zu spielen: organische Chlorverbindungen, Benzol, hohe Abgaskonzentrationen von Dieselmotoren, pestizidhaltige Luft (z. B. bei benachbarten Gärtnereien oder landwirtschaftlichen Nutzfläche n), evtl. Nähe zu Sondermülldeponien. - Krebspersönlichkeit: Eine echte "Krebspersönlichkeit" bei welcher bestimmte Charaktermerkmale die Entstehung der Krebskrankheit auslösen können, wird immer noch kontrovers diskutiert. Inzwischen bewiesen ist, daß Frauen in den ersten 5 Jahren nach dem Verlust eines geliebten Menschen ein signifikant höheres Krebsrisiko, insbesondere hinsichtlich des Mamma-Karzinoms haben. Auch scheint nach einer Stress-Belastung die Infektionsanfälligkeit allgemein höher zu sein. Der direkte Tabelle 1: Krebsverursachende Faktoren Krebsnoxe Ernährung - Genuß gesättigter Fettsäuren (z. B. tierische Fette), dunkles Fleisch - Mangel an frischem Obst und Gemüse ( Mangel an Antioxidantien) - Genuß von sehr heißen Getränken - Genuß von salzhaltigen Speisen - zu hohe Energiezufuhr (Adipositas) - Alkoholabusus - Nikotin Chemische oder physikalische Agens - Nitrathaltige Speisen - Nitrosamine - Benzpyrene - Aflatoxin (Stoffwechselprodukt von Pilzen) - Arsen - Asbest - Anilinfarbstoffe - Benzol - Dieselabgase - Mineralöl - Formaldehyd - arsenfreie Pestizide - Anstreichfarben - Ruß - ionisierende Strahlen - UV-Strahlen - radioaktive Substanzen - Elektromagnetische Felder z.B. in der Nähe von Strommasten Potentieller Krebs Dickdarmkarzinom Prostata-Karzinom Alle Tumorarten Speiseröhrenkrebs Nasopharynxkarzinome Brustkrebs, Gebärmutterschleimhautkrebs Krebs der oberen Atemwege, Kehlkopfkarzinom, Magen-, Dickdarmkarzinom Bronchialkarzinom, Zungengrundkarzinom, Kehlkopfkarzinom Dickdarmkarzinom, Magenkarzinom Magen-Darm-Karzinome Magen-Darm-Karzinome Magen-Darm-Karzinome, Leberkarzinom Lungenkrebs, Hautkrebs Mesotheliom, Lungenkarzinom Blasenkrebs Myeloische Leukämie Lungenkrebs Hautkrebs Nasopharynxkarzinom Lungenkrebs Lungenkrebs Hautkrebs Knochenmarkskrebs (Leukämien) übrige Tumore, Melanome Leukämien, Lymphome, Schilddrüsen-Karzinome Krebserzeugende Wirkung bislang fraglich Krebssnoxe Potentieller Krebs - Mobiltelephone - Chromosomendefekte, - Trisomie 21 (Morbus Down) - Mikrorganismen - Epstein-Barr-Virus Krebserzeugende Wirkung fraglich Leukämien - HIV-Virus - Helicobakter pylori - Papillomavirus - Schistosomen - Clamydien - Hepatitis B und Hepatitis C-Virus Naso-Pharynxkarzinome Hodgkin-Lymphome Non-Hodgkin-Lymphome Karposi-Sarkom evtl. Magenkarzinom Krebserkrankungen der Genitalien Leberkarzinom Blasenkarzinom Zervixkarzinom Leberkarzinom Ernährung Chemische Noxen ? Gene Erbfaktoren Ursachen für KrebsErkrankungen ? ? Soziale Faktoren Viren ? UmweltFaktoren Strahlen Psyche Abb. 7: Ursachen für Krebs Tabelle 2: Merkmale gutartiger und bösartiger Tumore gutartige/benigne Zellen geregeltes Wachstum, Wachstums- und Vermehrungsgrenzen werden durch die Zelle geregelt kein zerstörendes Wachstum keine Absiedlung von Tochtergeschwülsten (Metastasen) Keine Rezidivneigung Entstehung der Tumore aus reifen Zellen Bösartige/maligne Zellen Unkontrolliertes Wachstum, Grenzen werden nicht eingehalten destruktives Wachstum Neigung zur Bildung von Tochtergeschwülsten Neigung zum Wiederauftreten (= Rezidivneigung) Tumorbildung aus unreifen, undifferenzierten Zellen Zusammenhang zwischen der Krebsentstehung und speziellen Charaktermerkmalen konnte jedoch nicht hinreichend bewiesen werden. - Erbfaktoren: Erbliche Veränderung der Gene (Mutation ) oder das erblich weitergegebende Fehlen von steuernden, krebszellzerstörend en Mechanismen, bedeutet ein echtes Krebsrisiko. Inzwischen lassen sich für einige vererbbare Tumore die entsprechenden Gene isolieren. Hieraus resultiert die Möglichkeit, für entsprechende Menschen eine gewisse Krebserkrankungswahrscheinlichkeit vorauszusagen und damit die Entfernung des gefährdeten Organs im jeweiligen Erkrankungsalter zu postulieren. Bsp. Kolonkarzarzinom bei FAP (familiäre adenomatöse Polyposis). Hier würde dem Betroffenen angeraten, bei entsprechender erblicher Disposition, den gefährdeten Kolonteil operativ, vor dem Auftreten der Krebserkrankung zu entfernen. 1.3. Merkmale gutartiger und bösartiger Tumore Benigne und maligne Gewebe zeichnen sich durch unterschiedliche Charaktereigenschaften aus. Erläuterung zu Tabelle 2. 1.3.1. Wachstums- und Vermehrungsgrenzen Gutartige Tumore wachsen normalerweise nur innerhalb ihrer eigenen Gewebe. Sie sind bevorzugt von einer Bindegewebskapsel umgeben und lassen sich daher häufig schon rein makroskopisch von den unebenen, höckrig aussehenden, in andere Gewebe hineinwachsenden bösartigen Tumoren unterscheiden. Die normalen Gesetzmäßigkeiten im Prozeß der Zellerneuerung sind bei Malignomen außer Kontrolle geraten. Es kommt zu Störungen im Gleichgewicht zwischen Zellverlust/Zelluntergang und Zellerneuerung. Diese unkontrol- Zelluntergang Zelluntergang Zellneubildung Es besteht ein Gleichgewicht zwischen Zellverlust und Neubildung. Die Zellen entsprechen in Anzahl, Funktionen und Form der Ursprungszelle, Wachstumsgrenzen werden eingehalten Zellneubildung Es besteht ein Ungleichgewicht zwischen Zellverlust und Neubildung. Die Zellen entsprechen nicht mehr hinsichtlich Anzahl, Funktion und Form der Ursprungszelle, Wachstumsgrenzen werden nicht mehr eingehalten. Abb. 8: Gleichgewicht zwischen Zelltod und Zellneubildung lierte Vermehrung der entstandenen Krebszellen führt zur Tumorbildung. 1.3.2. Wachstums- und Vermehrungsform Gutartige Tumore zerstören nicht die umgebenden Strukturen, sondern verdrängen sie eher. Maligne Gewebe hingegen vernichten die Nachbarstrukturen . Sie nehmen Platz und Funktion der sonst vorhandenen Gewebe ein. Bsp.: Bei Leukämien werden die gesunden Blutkörperchen, insbesondere die weißen Blutkörperchen verdrängt und die Bildungsstellen im Knochenmark im Sinne der Neubildung von malignen Leukozyten verändert. 1.3.3. Bildung von Tochterzellen (Metastasen) Während gesunde Gewebe niemals zur Absiedlung von Tochterzellen neigen, sind maligne Tumore besonders durch diese Eigenschaft charakterisiert. Malignomzellen vermögen über verschiedene Wege den ursprünglichen Geschwulstort zu verlassen, um sich an anderer Stelle wieder anzusiedeln. 1.3.4. Rezidivneigung Gutartige Tumore treten nach vollständiger Entfernung nicht wieder an gleicher Lokalisation auf. Bösartige Tumore hingegen neigen zum Wiederauftreten. Merkmale einer differenzierten Zelle Vorhandene Ähnlichkeit mit einer normalen Zelle Fehlen von Merkmalen gesunder Zellen, Verlust der Ähnlichkeit mit einer normalen Zelle Differenzierte Zelle Undifferenzierte Tumorzelle Abb. 9: Differenzierung bei malignen und benignen Zellen 1.3.5. Reifungsgrad der Zellen/Zelldifferenzierung Im Gegensatz zu gutartigen Tumoren, die immer aus reifen Zellen gebildet wurden, lassen sich bei malignen Tumoren meistens unterschiedliche Reifegrad e nachweisen. Da erst die reifen Zellen die eigentlichen Charaktermerkmale dieser Gewebeart ausmachen, werden die unreifen Zellen als undifferenziert bezeichnet. Tumorzellen haben vielfach die Eigenschaften, sich zu einer reifen Stufe zu differenzieren, verloren (daher der Versuch, durch unterschiedliche Stoffe, wie z. B. Retinolsäuren die Reifung der unreifen Zellstufen zu provozieren und damit die Eigenschaften reifer = benigner Zellen zu erzielen). Je undifferenzierter eine Tumorzelle ist, desto bösartiger und aggressiv er ist sie in ihrem Verhalten. Mit zunehmender Indifferenz steigt bedingt durch die stark erhöhte Zellteilung die Ansprechrate auf eine Chemotherapie, aber auch die Rezidivgefahr. 1.4. Tumore/Geschwülste Alle Veränderungen, die mit einer Gewebevermehrung einhergehen, werden als Tumore bezeichnet. Je nach Zellart, Krankheitsverlauf, Behandlungsbedürftigkeit und Prognose, wird eine weitere Differenzierung hinsichtlich der Malignität vorgenommen. Tabelle 3 verdeutlicht dies. 1.4.1. Wachstumseigenschaften maligner Tumore Genau wie normale Zellen unterliegen Tumorzellen dem Zellteilungszyklus, wobei sie ungewöhnlich kurz in der G1-Phase verbleiben. Tu- Tabelle 3: Übersicht über Tumore unterschiedlichen Malignitätsgrades Gutartige = benigne Tumore Lipome (Tumore des Fettgewebes) Fibrome (Bindegewebs-Tumore) Myome (Tumore der Muskulatur) Adenome (Tumore des Drüsengewebes) Semimaligne Tumore/ Präcanzerosen - Colitis ulcerosa Kolonkarzinom - familiäre Poliposis coli Kolonkarzinom Blasenpapillomatose Blasenkarzinom Ostitis deformans Paget Knochensarkom Bösartige = maligne Tumore - Karzinome (maligne Tumore epithelialer Herkunft) - Sarkome (maligne Tumore des Binde- und Stützgewebes) - Lymphome (maligne Tumore des Lymphatischen Gewebes) - Leukosen (maligne Tumore der blutbildenden Organe) - Liposarkome (Fettgewebstumore) - Myosarkome (Muskelzellsarkome) - Angiosarkome (Malignome der Blutgefäße) morzellen weisen damit eine schnelleren Reduplikation auf und können sich nicht entsprechend ausdifferenzieren. Auch bedeutet die fehlerhafte Verweildauer in der G1-Phase oft Fehlen oder Verzögerung des vorprogrammierte n Zelltodes (Apoptose). Der Organismus verliert hier die Fähigkeit, selbst die "Mangelprodukte" zu erkennen und zu eliminieren. Trotz der fehlerhaften Ausdifferenzierung zeigt auch Tumorgewebe jeweils eine Population ruhender, sich teilender und inaktiver Zellen, wenn auch die Aufteilung der einzelnen Populationen durch die fehlende Regulation von Wachstumsfaktoren unkoordiniert ist. Im Prozeß der Tumorentstehung vergehen von der Entwicklung der ersten entarteten Zellen bis zum klinisch nachweisbaren Tumor, d. h. bis zum Ausbruch der Krankheit häufig viele Jahre. Innerhalb dieses Prozessen laufen mehrere Phasen nacheinander ab. 1. Phase - Induktionsphase = Zellentartungsphase Durch verschiedene Karzinogene wird die Chromosomenstruktur innerhalb einer Zelle verändert. Normalerweise wird diese nun durch die körpereigenen Reparaturmechanismen (Reparaturgene, die die Induktion der Apoptose einleiten oder durch körpereigene Abwehrzellen) eliminiert. Bei Aussetzen dieser Mechanismen kann sich nach einem langen Zeitraum hier eine Tumorzelle entwickeln, die dann nicht mehr den normalen Kontrollmechanismen im Prozeß des Zellzyklus unterliegt. Merke Induktionsphase = Entartung einer gesunden Zelle zur Krebszelle durch Mutation. 2. Phase - In-situ-Phase Es haben sich bereits mehrere Krebszellen zu einer kleinen Kolonie, meist nur wenige Millimeter groß, ausgebildet. Die entarteten Zellen zeigen noch ausschließlich flache Ausbreitung, haben kein eigenes Blutversorgungssystem (darum können sie sich nur sehr langsam vermehren) und sind ausschließlich auf langsam ablaufen de Diffusionsvorgänge im Rahmen des Nährstofftransportes angewiesen. Diese Phase kann über viele Jahre andauern und wird vielfach als Präkanzerose bezeichnet. Die Chance in dieser Phase liegt in der Entfernung solcher In-situ-Herde und damit in der Prävention einer echten Tumorkrankheit. Merke In-Situ-Phase = Entstehung erster Krebszellkolonien. Keine eigene Versorgung vorhanden, langsames Wachstum. 3. Phase - Invasionsphase Mit zunehmender Vergrößerung beginnt der Tumor, durch den selbst gebildeten TAF = Tumorangiogenesefaktor nahegelegene Blutgefäße zur Aussprießung feiner Kapillaren anzuregen. Diese Kapillare versorgen bald den noch kleinen Tumor direkt mit Blut. Nährstofftransport und Abtransport von Schlackenstoffen garantieren nun einen deutlich besseren Stoffwechsel im Tumorbereich, wodurch schnelleres Wachstum möglich wird. Mit zunehmender Größe wird durch die Tumorverdopplungszeit das Wachstum schneller. Bei den einzelnen Tumoren ist die Tumorverdopplungszeit sehr unterschiedlich. Sie hängt u. a. von der Stärke der Wachstumsfraktion (= Anzahl der sich teilenden Zellen) ab. Schon kurz nach der Vaskularisierung (Versorgung des Tumors mit Blutgefäßen), beginnt der Tumor sein invasives Wachstum. Es kommt zum Durchtritt durch die Basalmembran und schließlich zum Eindringen in Blutgefäße, andere Gewebe oder Lymphbahnen. Neben der Größe der Wachstumsfraktion ist damit die Blutversorgung der wichtigste beeinflussende Faktor im Prozeß der Tumorausbreitung. Auch beeinflussen jetzt bei einigen Tumoren bestimmte Hormone die Wachstumsfraktion indem sie die malignen Zellen zur schnelleren Teilung anregen. Diese Tumorzellen besitzen spezielle Hormonrezeptoren (z. B. beim Mammakarzinom). Diese Kenntnis macht sich die antihormonelle Therapie später zunutze). Merke Invasionsphase = Phase der Vaskularisierung, schnelleres Wachstum, invasives Wachstum, Einleitung der Metastasierung. 4. Phase - Metastasierungsphase Nachdem die ersten Zellen den Durchtritt durch die Basalmembran und damit den Eintritt in Blut- oder Lymphgefäße erreicht haben, steht der weiteren Ausbreitung nichts mehr im Wege. Das Metastasierungsverhalten der verschiedenen Tumore ist unterschiedlich. Das kleinzellige Bronchialkarzinom oder das Mamma-Karzinom metastasieren bereits sehr früh, während das Cervixkarzinom erst spät Tochtergeschwülste aussetzt. Da sich jedoch Schätzungen zur Folge, bei etwa 50 % aller onkologischer Patienten bereits bei Diagnosestellung Mikrometastasen gebildet haben, wird nach heutigen Gesichtspunkten häufig eine adjuvante Therapie nach operativer Entfernung der Primärgeschwulst angestrebt, d. h. eine sich der OP anschließende Chemo- oder Radiotherapie. Ziel dieser Kombination ist es, nicht erkennbare Mikrometastasen zu zerstören. Die Gefahr von Lokalrezidiven oder Metastasen kann hierdurch reduziert werden. 1. Phase 2. Phase 3. Phase 4. Phase Induktionsphase: Entartung einer gesunden Zelle durch Mutation In-situ-Phase: Entstehung erster Krebszellkolonien Invasionsphase: Phase der Gefäßversorgung Schnelles Wachstum Metastasierungsphase: Tumorvermehrung Abb. 10: Tumorwachstumsphasen Merke Metastasen werden nach Einbruch in Lymph- oder Blutgefäßbahnen oder entlang seröser Häute abgesetzt. Das Metastasierungsverhalten der einzelnen Tumore ist unterschiedlich. 1.4.2. Metastasierungsmuster Jeder Tumor zeigt ein charakteristisches Metastasierungsmuster. Die Verbindung zu Blutgefäßen, Lymphbahnen oder Kontakt zu serösen Häuten spielt dabei eine große Bedeutung. 1.4.2.1 Phasen der Metastasierung 1. Phase - Einbruch des Tumors in Blutgefäße, Lymphbahnen oder Körperhöhlen. Ehe ein Tumor Tochtergeschwülste absiedeln kann, muß er an einen Transportweg angeschlossen sein. Solange der Tumor sich ohne Gefäßanschluß innerhalb einer Gewebeschicht befindet, kann er sich hier nur lokal ausdehnen. Nachdem die Tumorzelle die ersten Hürden zur Metastasierung, d. h. den Durchtritt durch Basalmembran und Endothelmembran der Gefäßwand überstand en hat, sind noch weitere "Belastungsproben" zu überstehen, ehe sie sich ansiedeln kann. 2. Phase - Ablösung einzelner Tumorzellen aus dem Gesamtverband, Weitertransport mit Blut, Lymphe oder entlang einer serösen Haut oder fortgeleitetes Wachstum. 3. Phase - Bei Verschleppung der Tumorzellen über Blutgefäße besteht die Notwendigkeit der Anheftung am Endothel einer Gefäßwand. Am häufigsten verfangen sich die abgesie- delten Krebszellen im nächsten Kapillarnetz (bei den meisten Organen ist dies die Lunge, bei Organen des Magen-Darm-Traktes ist es die Leber) und lösen daher dort am häufigsten Metastasen aus. Durch ihre Größe und die häufig bestehende Verbindung mit Thrombozyten (damit sie sich nun besser an die Gefäßwand anlegen können und die von Thrombozyten gebildeten Wachstumsfaktoren zum eigenen Überleben nutzen), verfangen sie sich im Kapillarnetz wie in einem Fischernetz. Doch nicht jeder Krebszelle gelingt es überhaupt weiterzuleben. Nur etwa jede 10 000ste Krebszelle vermag sich wegen fehlender Anhaftung an Rezeptoren an einer Gefäßwand anzulagern. Die übrigen sterben meist unter den hohen Anforderungen im sich bewegenden Blutstrom, durch Vernichtung durch Blutabwehrzellen oder durch Nährstoffmangel ab. 4. Phase - Sie beinhaltet, Manipulation der Anhaftstelle und Mißbrauch der dortigen Zellfunktion mit eigenem Nutzen. Nachdem sich die Tumorzelle angeheftet hat, muß es ihr nun gelingen, die dortigen Zellen zu manipulieren, ihren eigenen Zellauftrag auf diese zu übertragen und dort nach ureigenem Tumorzellmuster neue Zellen zu bilden. 1.4.2.2 Metastasierungswege Je nach Lokalisation des Primärtumors und abhängig von den Eigenschaften der Zellart, können Malignome auf unterschiedlichen Wegen Tochtergeschwülste absetzen. - Hämatogene Metastasierung (Absiedlung durch Gefäßanschluß) Schon kurze Zeit nach der Vaskularisierung steht den Tumorzellen dieser Weg offen. Auf hämatogenen Wegen können die abgesetzten malignen Zellen nahezu jede Lokalisation erreichen, wobei sie vielfach entweder im Kapillarstromgebiet der näheren Umgebung abgefangen werden oder z. B. nach Einstrom in die Leber zu einer massiven Verteilung im gesamten Organismus führen. - Lymphogene Metastasierung (Absiedlung durch Anschluß an Lymphbahnen) Nach Infiltration in nahegelegene Lymphbahnen werden die eingeschleusten Tumorzellen weitertransportiert und unterliegen vielfach in der nächsten Lymphknotenstation dem Abwehrsystem. Mit steigender Tumorzellzahl erschöpfen sich dann die Abwehraktivitäten der Lymphknoten, wodurch sich jetzt entartete Zellen ansiedeln und zu regelrechten Lymphknotenmetastasen führen können. Es folgt dann die Metastasierung über den Lymphweg zur nächsten Lymphknotenstation oder über Einschleusung per Duktus thoracikus in das hämatogene System in andere Organe. - Metastasierung durch Implantation (in Körperhöhlen) Innerhalb von Körperhöhlen können sich an der Gewebeoberfläche befindende Tumorzellen allein durch die Schwerkraft absetzen und an anderer Stelle wieder ansiedeln. So kann es innerhalb kurzer Zeit z. B. in der Peritonelhöhle, im Pleuraspalt oder im Spinalkanal zu einer massiven Metastasierung mit multiplen Metastasen kommen. - Bei Operationen z. B. können durch das Skalpell oder durch die Handschuhe des Chirurgen einzelne Tumorzellverbände losgelöst und verschleppt werden. Metastasierungsmuster verschiedener Tumore Jeder Tumor hat seine ureigenen Metastasierungsmuster. Hämatogene Metastasierung Metastasierung durch Implantation Metastasierungswege Lymphogene Metastasierung Metastasierung entlang seröser Häute Abb. 11: Metastasierungswege Tabelle 4 zeigt typische Tochtergeschwulstlokalisationen auf. Tabelle 4: Metastasierungsmuster unterschiedlicher Tumore Primärtumor Mamma-Karzinom Prostata-Karzinom kleinzelliges Bronchial-Karzinom Häufige Metastasierungslokalisation - Knochen - Lunge - Gehirn - Niere - Leber - Knochen - Gehirn - Knochenmark - Leber - Nebenniere follikuläres Schilddrüsen-Karzinom Morbus Hodgkin Malignes Melanom Magen-Karzinom Kolon-Karzinom Hoden-Karzinom - Knochen - Lunge - Knochen - Pleura - Nieren - Magen - Darm - Haut - Lymphknoten - Leber - Gehirn - Darm - Leber - Lunge - Knochen - Gehirn - Leber - Lunge - retroperitoneale Metastasen - Lunge - Leber - Lymphknoten 1.5. Krankheitsstadien und Klassifikation Vor Beginn der Behandlung, müssen Gewebeart und Krankheitsstadium festgelegt werden. Nicht immer gehören ausschließlich die direkten Tumorauswirkungen zur Festlegung des Krankheitsstadiums. Beim Morbus Hodgkin z. B. werden indirekte Zeichen der Erkrankung wie nächtliches Schwitzen, Gewichtsabnahme und Fieber als sogenannte B-Symptomatik zur Stadieneinteilung hinzugenommen. Dies ist von Bedeutung, da die Prognose bei bestehender B-Symptomatik fast immer schlechter ist. Nach medizinischen Kriterien gibt es verschiedene Möglichkeiten zur Stadienteinteilung. Stadieneinteilung nach dem Allgemeinzustand Hierbei wird der Allgemeinzustand bewertet und eine Eingruppierung vorgenommen: 0 = keine Beschwerden 1 = ambulante ärztliche Betreuung notwendig, leichte Beschwer den 2 = mittelstarke Beschwerden, Patient ist zeitweise bettlägerig 3 = vollständige Bettlägerigkeit, starke Schmerzen 4 = terminaler Zustand, sehr starke Beschwerden Diese Einteilung gibt keine genauen Auskünfte über das vorliegende Krankheitsstadium. Hinzu kommt, daß die subjektive Bewertung der Beschwerden durch den Patienten keine objektive Stadieneinteilung zuläßt. Stadieneinteilung in drei Stufen In den Anfängen der Onkologie wurden die meisten Tumore in folgende Stadien eingeteilt: Stadium Stadium 0 Stadium I Stadium II Stadium III Stadium IV Definition Carcinoma in Situ (Präinvasives Karzinom) Frühe lokale Invasion, keine Metastasierung nachweisbar Begrenzte lokale Tumorausbreitung mit geringfügigem regionalen Lymphknotenbefall Ausgedehnter lokaler Tumorbefall mit stärkerem regionalen Lymphknotenbefall Stark ausgedehnter Tumorbefall (meist inoperabel) mit starkem Befall der Lymphknoten oder jedes Tumorstadium mit Nachweis von Fernmetastasen Die Einteilungen für die jeweilige Tumorart werden durch die UICC (Union Internationale Contrele Cancer) immer wieder in Zusammenarbeit mit Facharztvereinigungen überprüft und modifiziert. Im Bereich der Gynäkologie, wird die Stadieneinteilung für das Korpuskarzinom z. B. nach den FIGORichtlinien vorgenommen, die sich an die eben gezeigte Stadieneinteilung anlehnt. FIGO-Stadieneinteilung für das Korpuskarzinom Stadium Stadium 0 Stadium I Stadium Ia Stadium Ib Stadium II Stadium III Stadium IV Stadium IVa Stadium IVb Definition Präinvasives Karzinom Karzinom auf das Corpus uteri beschränkt Uteruskavum < 8 cm oder weniger in der Länge Uteruskavum > 8 cm in der Länge Karzinom befällt Gebärmutterhals, breitet sich aber nicht über den Uterus aus Karzinom breitet sich außerhalb des Uterus aus, befällt Vagina, bleibt aber auf die eigentlichen Genitalorgane begrenzt Karzinom befällt die Schleimhaut der Harnblase oder des Rektums und/oder breitet sich über das kleine Becken hinaus aus Fernmetastasen Stadieneinteilung nach der TNM-Klassifikation Um noch genauere Aussagen über Tumorausbreitung, Lymphknoten- und Metastasenstatus geben zu können, wurde in den vergangen Jahren für viele Tumorarten die sogenannte TNM-Klassifikation erarbeitet. Die TNM-Klassifikation war auch die Bedingung für den internationalen Vergleich z. B. der Tumorinzidenz oder auch von Behandlungserfolgen bei unterschiedlich en Therapiestrategien. Die TNM-Einteilung basiert auf drei Hauptsäulen und benennt Ausbreitung von Tumormassen im Primärtumor, in Lymphknoten und weiteren Metastasenlokalisationen. TNM-Stadieneinteilungen 1 2 3 - T = Primärtumor. Hochgestellte Zahlen T , T , T geben Größe und Ausdehnung des Tumors an - N = Noduli/Lymphknoten. Lokalisation befallener Lymphknoten - M = Metastasen. Feststellung über Lokalisation von Tochtergeschwulstabsiedlungen TNM-Einteilung am Beispiel des Mamma-Karzinoms Stadium T = Primärtumor T is 0 T 1 T 1a T 1b T 1c T 2 T 3 T 4 T 4a T 4b T 4c T N = regionäre Lymphknoten 0 N 1 N 2 N 3 N M = Fernmetastasen 0 M 1 M Definition Präinvasives Karzinom Kein klinisch nachweisbarer Tumor in der Brust Tumor 0,2 cm oder weniger in der größten Ausdehnung 0,5 cm oder weniger in größter Ausdehnung mehr als 0,5 cm, nicht mehr als 1 cm mehr als 1 cm, nicht mehr als 2 cm Tumor, dessen Durchmesser mehr als 2 cm, aber weniger als 5 cm beträgt Tumor, dessen Durchmesser mehr als 5 cm beträgt Tumor jeder Größe mit direkter Ausbreitung auf die Thoraxwand oder die Haut mit Ausdehnung in die Brustwand 4a 4b mit Ödemen, Ulzerationen der Haut oder Satellitenmetastasen/Kriterien und gemeinsam entzündliches Karzinom Keine regionären Lymphknotenmetastasen vorhanden Tastbare, bewegliche Lymphknotenmetastasen in der gleichseitigen Achselhöhle 1 Wie N , aber an andere Strukturen oder untereinander fixiert Gleichseitige Lymphknotenmetastasen entlang der Arteria mammaria interna Keine Fernmetastasen Fernmetastasen vorhanden Diese Einteilung hat sich bis heute bewährt. Bedingt durch eine international gültige Stadieneinteilung können auch standardisierte Therapieschemata erarbeitet werden. Studien zur Erfolgskontrolle und zum Vergleich sind dadurch möglich. Die TNM-Klassfikation ist auf Lymphome und Leukämien nicht anwendbar, da sich hierbei nicht zwischen Primärtumorbefall und Metastasen unterscheiden läßt. Zur Einstufung der Lymphome wird die Ann-Arber-Klassifikation bevorzugt, die die anatomische Ausbreitung des Tumors mit Zahlen von I-IV bewertet und Fehlen oder Auftreten bestimmt er Symptome wie Nachschweiß, Fieber oder Gewichtsverlust mit der Zusatzangabe A oder B vervollständigt. Eine auftretende B-Symptomatik verschlechtert die Prognose vielfach. Ann-Arber-Stadieneinteilung bei Morbus Hodgkin Stadium Definition Stadium I Befall einer einzelnen Lymphknotenregion (I) oder eines einzelnen extralymphatischen Organs Stadium II Befall von 2 oder mehreren Lymphknotenregionen auf der gleichen Seite des Zwerchfells (II) oder lokalisierter Befall eines extralymphatischen Organs sowie einer oder mehrerer Lymphknotenregionen auf der gleichen Seite des Zwerchfells (IIE) Befall einer Lymphknotenregion auf beiden Seiten des Zwerchfells Stadium III (III) oder von einem lokaliserten Befall eines extralymphatischen Organs (IIIE) oder vom Befall der Milz (III S) oder vom Befall der Milz und extralymphatischer Organe (III SE) begleitet Stadium IV Diffuser oder disseminierter Befall eines oder mehrerer extralymphatischer Organe mit oder ohne Lymphknotenbefall A-Symptomatik Ohne Begleitsymptomatik B-Symptomatk Mit Begleitsymptomen: Fieber, Schwitzen, Gewichtsverlust > 10 % des Körpergewichtes in 6 Monaten Einteilung nach Gewebetyp Hier wird der Gewebetyp nach histologischen Gesichtspunkten differenziert, um die Ansprechbarkeit auf bestimmte Behandlungsmethoden, typische Metastasierungsmuster und Verhaltensweisen des Tumors feststellen zu können Einteilung nach dem Malignitätsgrad (Grading) Um Therapieplanung und Prognose festlegen zu können, wird vielfach auch die Einteilung nach dem Malignitätsgrad festgestellt. Neben dem Differenzierungsgrad gibt die dreiteilige Skala auch Wachstumsgeschwindigkeit (Anzahl der Mitosen) sowie Aussehen von Zellkernen und Gesamtzelle an. Gradeinteilung Differenzierung Grad I: gut differenziert Grad II: mäßig gut differenziert Grad III: schlecht differenziert Um ein möglichst genaues Bild zum bestehenden Krankheitsstadium, zur Planung der Behandlungsmethode und Prognose darstellen zu können, werden vielfach verschiedene Einteilungssysteme kombiniert. 1.6. Spezifische und unspezifische Symptome einer Tumorerkrankung Symptome, die im Rahmen einer malignen Erkrankung auftreten, sind niemals Früh-, sondern immer Spätsymptome, d. h. der Tumor hat bereits ein bestimmtes Ausmaß erreicht und der Körper reagiert. • • • • • • • • • • • • • • Warnsignale bei Krebs Unklare Gewichtsabnahme Blutbeimengungen in Urin, Stuhl, Sputum, Vaginalsekret ( außerhalb der Menstruation ) Unregelmäßige Blutungen, blutiger, fleischfarbener Ausfluß Durchfall, Verstopfung, kleine Blutbeimengungen im Stuhl Blutiger Urin, sich wiederholender, langandauernder Blasenkatarrh, häufiger Harndrang Blutiger Schleim, häufiger Stuhldrang Länger als 4 Wochen andauernder Husten oder bei Rauchern, Veränderung des Hustenverhaltens Heiserkeit, Schluckbeschwerden, Fremdkörpergefühl Tastbare Knoten im Bereich von Hoden, Brust oder Lymphknoten Sich plötzlich verändernde Muttermale oder Warzen Auftretende Abneigung gegen bestimmte Speisen Leistungsknick, Müdigkeit Weißliche Verfärbung und Verdickung der Schleimhaut Ausfluß aus der Brustwarze Abb. 12: Warnsignale einer Tumorerkrankung Abhängig von Lokalisation, Größe und Art des Tumors können folgende Erscheinungen auftreten: - Dauerhusten oder -heiserkeit, länger als 4 Wochen auftretend - Blutbeimengungen in Sputum, Urin, Stuhl - unregelmäßige Menstruationsblutungen, fleischfarbener Ausfluß, - Blutungen nach dem Geschlechtsverkehr, Blutungen nach den Wechseljahren - Schmerzen beim Wasserlassen, nicht deutbare Kreuzschmerzen über einen längeren Zeitraum - länger anhaltende Magen-Darm-Beschwerden, Schluckbeschwerden, - blutiges Erbrechen, anhaltende Übelkeit - nicht oder schlecht heilende Wunden - Muttermale, Warzen oder sonstige Hautveränderungen, die plötzlich nässen, jucken, bluten, sich vergrößern oder sich sonstwie verändern - Stuhlunregelmäßigkeiten wie z. B. paradoxe Diarrhoe Als mögliches Zeichen einer bösartigen Erkrankung kann es zu folgenden eher indirekten Veränderungen kommen: - unklare Gewichtsabnahme von mehreren Kg Körpergewicht, ohne Änderung des Eßverhaltens in 3 Monaten - Appetitlosigkeit, Völlegefühl, Widerwillen gegen bestimmte Speisen (insbesondere gegen Fleisch und Wurstwaren) - Allgemeine Leistungsminderung, Schwächegefühl - Temperaturerhöhung (subfebrile Temperaturen) - Schwitzen, insbesondere nachts - Veränderungen der Haut und Schleimhaut; bedingt durch eine Knochenmarksdepression kann es zu Blutungen, Entzündungen oder Zeichen einer Anämie kommen - Schmerzen durch Nervenkompression oder durch Infiltration (Einwachsen) in andere Gewebe und durch Druck auf diese Spezielle Tumorauswirkungen finden sich auch im Rahmen der Paraneoplasien (durch direkte oder indirekte Tumorauswirkung entstehende Erscheinungen fern vom Tumor). Alle genannten Zeichen können aber auch Hinweise auf andere Erkrankungen geben, so daß in jedem Fall eine genaue Diagnostik zur Klärung erforderlich ist. Werden bei der Krankenbeobachtung solche Symptome festgestellt, sollte der Kranke nicht durch überflüssige Vermutungen verunsichert, sondern sachlich zur Arztkonsultation bewegt werden. Bei alten Menschen können derartige Anzeichen auch durch degenerative Veränderungen auftreten, doch auch hier ist eine differenzierte Abklärung notwendig. Ebenso können im Alter oder bei Begleiterkrankungen (z. B. Diabetes mellitus) Symptome verfälscht oder verschleiert sein. 1.7. Präkanzerosen Unter Präkanzerosen versteht man Zustände oder Veränderungen, die gehäuft zu malignen Tumoren prädisponieren. Häufig tritt der Tumor dabei erst Jahre oder Jahrzehnte nach Auftreten der präkanzerotischen Veränderungen auf. Als Präkanzerosen gelten: - Chronische Reizzustände, Entzündungen, Narben - Benigne tumoröse Erkrankungen als Vorstufe zu Malignomen Tabelle 5 zeigt Präkanzerosen mit den jeweiligen Malignomtypen. In der heutigen Zeit bedeutet das Wissen um Präkanzerosen die Chance, einerseits durch frühzeitige und engmaschige Kontrollen einen malignen Befund möglichst frühzeitig zu erkennen, anderseits durch Beseitigung des präkanzerotischen Zustandes die Entartung zu vermeiden. 1.8. Häufige Tumorerkrankungen In den unterschiedlichen Ländern lassen sich verschiedene Häufungen von Tumorerkrankungen erkennen. Dies hängt mit dem Vorhandensein spezifischer Risikofaktoren (z. B. Ernährung, Umwelt, Lebensweise, hygienische Standards) sowie mit der erblichen Disposition in der jeweiligen Region zusammen. Nachfolgend sollen nur kurz die in Westeuropa am häufigsten vorkommenden Tumorerkrankungen aufgezeigt werden. Tabelle 5: Präkanzerosendisponierende Tumoren Präkanzerose 1. Chronische Reizzustände - Colitits ulzerosa, Morbus Crohn - Cholelithiasis - Zustand nach Tuberkulose - Hauttuberkulose (Lupus vulgaris) - Magenresektion nach Billroth-II-OP - atrophische Gastritis, gekoppelt mit perniziöser Anämie - Bilharziose (Pärchenegelbefall der Blase) - Chronische Osteomyelitis mit Fistelbildungen - Xeroderma pigmentosum (genetisch bedingte Störung im Reparationsmechanismus des Erbguts der Hautzellen) Malignom 2. benigne tumoröse Erkrankungen - Dickdarmpolypen (insbesondere, wenn die Polypen 2 cm Durchmesser überschreiten und rezidivierend auftreten) - Polyposis coli (vererbbare Dickdarmerkrankung mit Ausbildung hunderter Polypen im gesamten Kolon) - Ostitis deformans Paget - Kryptochismus - proliferierende Mastopathie - Blasenpapillomatose - adulte Kehlkopfpapillomatose - Dermatomyositis - Neurofibromatose Malignom Adenokarzinom des Kolons Adenokarzinom des Darms Gallenblasenkarzinom Bronchialkarzinom Plattenepithelkarzinom der Haut Magenkarzinom Magenkarzinom Blasenkarzinom Fistelkarzinom Plattenepithelkarzinom Plattenepithelkarzinom der Haut Kolonkarzinom Knochensarkom Hodenkarzinom Mammakarzinom Blasenkarzinom Kehlkopfkarzinom Hautkarzinom Neurofibrosarkom 1.8.1. Kolorektale Karzinome Tumorgruppe Allgemeines/Epidemiologie nach Brustkrebs bei Frauen und Lungenkrebs bei Männern, häufigste Todesursache Inzidenz zunehmend Risikofaktoren - Alter über 45 - chronische Darmentzündungen wie Colitis ulzerose, Morbus Crohn, - Polyposis Coli - faserarme, fettreiche Kost - Übergewicht - erbliche Disposition Symptome - Veränderungen der Stuhlsäule - paradoxe Diarrhoe - Blut im Stuhl - Anämie - Tumorwarnsignale Diagnostik rectale Palpation/Rektoskopie Koloskopie mit Biopsie Differentialdiagnose entzündliche Darmerkrankungen Tumorart / Kolorektale Karzinome Ziel der Diagnostik Beurteilung der Operabilität / Staging Histologie fast immer Adenokarzinome Tumorklassifikation/Stadieneint eilung TNM-Klassifikation Stadiengruppierung Stadieneinteilung nach Dukes Hinweise Besondere Gefahren /Komplikationen - Verengung der Darmpassage bis zum Ileus - Blutung - Verjauchung durch Tumorzerfall Therapie Chirurgische Maßnahmen - Resektion des betroffenen Darmabschnittes mit Lymphdrüsen unter kurativer Absicht- wenn möglich - Palliativ zur Wiederherstellung der Darmpassage Strahlentherapie Wegen der geringen Strahlensensibilität und den umgebenden, empfindlichen Organen des kleinen Beckens, kommt eine Strahlentherapie eher selten in Frage. Chemotherapie zeigt eher geringe Wirksamkeit. Weitere Verfahren bei distalen Rektumkarzinomen wird unter palliativer Absicht evtl. eine kryochirurgische Therapie durchgeführt Prognose Heilungschance 20-90 %, abhängig von Ausbreitung, Differenzierungsgrad der Zellen und Fähigkeit des Operateurs 1. 8.2. Magenkarzinom Tumorgruppe Allgemeines/Epidemiologie Männer doppelt so häufig betroffen wie Frauen Erkrankungsinzidenz in den letzten Jahren abnehmend, wahrscheinlich aufgrund verbesserter Ernährungsgewohnheiten Tumorart / Magenkarzinom Ziel der Diagnostik Diagnosesicherung Beurteilung der Operabilität Ausschluß von Fernmetastasen Risikofaktoren Histologie - Ernährungsverhalten (reichlich 95 % Adenokarzinome gepökelte, gesalzene, geräucherte Nahrung) - Nitratreiche Nahrung - Rauchen - chronische Gastritis - Infektionen mir Helikobacter pylori - erbliche Faktoren - Blutgruppe A Symptome 5 % Sarkome oder maligne NonHodgkin-Lymphome Tumorklassifikation/ Stadieneinteilung / TNMKlassifikation - Gewichtsabnahme - Appetitlosigkeit - Völlegefühl - Druckschmerz im Oberbauch Diagnostik Gastroskopie mit Biopsie Differentialdiagnose Ulkus ventrikuli Therapie Chirurgische Maßnahmen - Totale Gastrektomie mit Entfernung der lokalen Lymphknoten und großem Netz - Kurative OP meist nicht möglich - Palliative Operation zur Stillung von Blutungen oder zur Einlage einer stenoseüberbrückenden Endoprothese Strahlentherapie eher als Palliativmaßnahme bei Fernmetastasen möglich, da der Primärtumor nur sehr gering strahlensensibel ist Chemotherapie Remissionsraten von 20-40 %, bei Vorliegen von Lymphknotenmetastasen bei ca. 20 %. Hinweise frühzeitiger Lymphknotenbefall Weitere Verfahren Besondere Gefahren /Komplikationen Magenblutungen Passagebehinderung im Magen, dadurch Unfähigkeit zu essen Prognose Bei Radikaloperation - ohne Lymphknotenmetastasen ca. 50 % - mit Lymphknotenmetastasen ca. 20 % Heilung 1.8.3. Mammakarzinom Tumorgruppe Allgemeines/Epidemiologie häufigste Krebserkrankung der Frau ab dem 65. Lebensjahr ansteigende Inzidenz Tumorart / Mammakarzinom Ziel der Diagnostik Ausschluß gutartiger MammaVeränderungen Risikofaktoren - Alter, - Erbliche Disposition - evtl. Hormone, - Ernährung - Kinderlosigkeit, hohes Alter bei der ersten Geburt, - Adipositas, - Alkohol - Menopause ab dem 52. L.J. Symptome Histologie Nichtinvasive Karzinome (ca. 10 %) z.B. intraduktales oder lobuläres Karzinom Invasive Karzinome (ca. 50 %) Invasives duktales Karzinom Tumorklassifikation / Stadieneinteilung / TNM-Klassifikation - knotige Veränderung - Größenveränderung - Flüssigkeitsabsonderung aus nur einer Brust - Einziehungen - Seitendifferenzen Diagnostik Hinweise - Selbstuntersuchung der Frau - Tastuntersuchung durch den Arzt - Mammografie - Punktionszytologie - Ultraschall - Thorax-Röntgen, Skelettszintigrafie, OberbauchSonografie Differentialdiagnose Besondere Gefahren /Komplikationen Mastitis Knochenmetastasen treten frühzeitig auf. Therapie Chirurgische Maßnahmen Chirurgische Maßnahmen Operative Entfernung des Primärtumors mit Sicherheitsabstand und Entfernung positiver axillärer Lymphknoten Strahlentherapie mit kurativer Zielsetzung nach Mastektomie, zur Behandlung von Skelettmetastasen oder zur Behandlung von Hirnmetastasen, nach brusterhaltender chirurgischer Therapie im Bereich des Lymphabflusses Chemotherapie eine adjuvante Chemotherapie oder Hormonbehandlung vermag die rezidivfreie Zeit zu verlängern Weitere Verfahren Hormonbehandlung bei Vorhandensein von Hormonrezeptoren Prognose 10-Jahres-Überlebensrate: ohne Lymphknotenbefall 75 % bei Befall von 1-3 Lymphknoten: 25-65 % bei Befall von mehr als 3 Lymphknoten: 15-30 % 1.8.4. Zervixkarzinom Tumorgruppe Allgemeines/Epidemiologie häufigstes Genitalkarzinom bei der Frau Altersgipfel für invasive Karzinome zwischen dem 40. und 60. Lebensjahr Risikofaktoren - Anzahl der Sexualpartner - früher Geschlechtsverkehr in der Jugend - Papillomaviren - Rauchen Symptome Tumorart / Zervixkarzinom Ziel der Diagnostik Ausschluß anderer Ursachen Therapie Chirurgische Maßnahmen Bis Stadium IIb Radikaloperation nach Wertheim-Meighs Histologie 90-95 % Plattenepithelkarzinome unterschiedlicher Differenzierung 5-10 % Adenokarzinome Strahlentherapie bei primärer Inoperabilität und Lokalrezidiv, Verbesserung der Erfolge durch Kombination von Chemo- und Strahlentherapie Tumorklassifikation / Stadieneinteilung / TNM-Klassifikation Chemotherapie - keine Frühsysmptome vorhanden präoperativ zur Tumorverkleinerung Adjuvant zur Senkung des Rezidivrisikos Palliativ bei Fernmetastasen - blutiger vaginaler Ausfluß - fleischfarbener Ausfluß nach der Menopause - postkoitale Blutungen - atypische Genitalblutungen Diagnostik Gynäkologische Untersuchung mit Inspektion der Portio und zytologischem Abstrich Differentialdiagnose entzündliche Ursachen Hinweise Weitere Verfahren Besondere Gefahren /Komplikationen Miktions- und Defäkationsbeschwerden in fortgeschritteneren Stadien Prognose nach kompletter Entfernung der Tumormassen 60-100 % Heilungschance 1.8.5. Korpuskarzinom Tumorgruppe Allgemeines/Epidemiologie Inzidenz steigt im höheren Alter an Der Erkrankungsgipfel liegt jenseits des 60. Lebensjahres 80 % aller Erkrankungen treten nach der Menopause auf Tumorart / Korpuskarzinom Ziel der Diagnostik Beurteilung von Tumorausbreitung und Operabilität Ausschluß bzw. Sicherung von Fernmetastasen Risikofaktoren - Alter über 60 Jahre - frühe erste Periode - späte Menopause - Adipositas, häufig kombiniert mit Diabetes und Hypertonie - Familiär, erbliche Disposition - Kinderlosigkeit Symptome Histologie 70 % Adenokarzinome mit unterschiedlicher Differenzierung (G 1-G 3) Tumorklassifikation / Stadieneinteilung / TNM-Klassifikation und FIGORichtlinien - postmenopausale Blutungen - in Spätstadien: Unterbauchschmerzen, eitriger, riechender Ausfluß - palpierbarer Tumor - Blutungen aus Rektum oder Blase durch Fistelbildung Diagnostik Fraktionierte Abrasio Hysteroskopie (endoskopische Untersuchung der Gebärmutter) Differentialdiagnose Therapie Chirurgische Maßnahmen mit kurativer Absicht Operation und Strahlentherapie bei vorliegenden Fernmetastasen (Stadium IV b) zusätzlich zur Strahlentherapie Hormongabe oder Chemotherapie (dann mit palliativem Ziel) Strahlentherapie eine alleinige Radiatio zeigt nicht die Erfolge der Operation Chemotherapie Insbesondere bei Fernmetastasen wird eine Chemotherapie durchgeführt Hinweise Weitere Verfahren Besondere Gefahren /Komplikationen Prognose Gesamte 5-Jahres-"berlebenszeit 65% Stadium I - 70-90% Stadium II - 50% Stadium III - 30% Stadium IV - 10% 1.8.6. Ovarialkarzinom Tumorgruppe Allgemeines/Epidemiologie Steigende Inzidenz ab dem 40. Lebensjahr Tumorart / Ovarialkarzinom Ziel der Diagnostik Ausschluß nichtgynäkologischer Erkrankungen Feststellung der Ausdehnung des Tumorbefalls Risikofaktoren - familiäre Disposition Histologie Karzinome (Überwiegender Teil) maligne Keimzelltumoren muzinöse Tumore undifferenzierte Malignome Sarkome (sehr selten) Metastasen anderer Primärtumore - keine oder nur wenige Schwangerschaften - Adipositas mit hohem Fettverzehr - Brustkrebs oder Gebärmutterkrebs in der Anamnese Symptome Tumorklassifikation / Stadieneinteilung / TNM-Klassifikation - keine Frühsymptome vorhanden Therapie Chirurgische Maßnahmen Entfernung möglichst der gesamten Tumormasse (Debulking) durch Entfernung beider Eierstöcke, der Gebärmutter, des großen Netzes und ggf. der umgebenden Lymphknoten Strahlentherapie als perkutane Radiotherapie oder als Applikation von Radionukliden in den Bauchraum möglich Chemotherapie Chemotherapeutika zeigen gute Wirksamkeit - Spätsymptome: Zunahme des Leibesumfangs bei stagnierendem oder sinkendem Körpergewicht Diagnostik Gynäkologische Palpation Sonografie intravaginal, Abdomen und Beckenorgane Hinweise Weitere Verfahren Da in 6-10 % der Fälle der maligne Ovarialbefund Metastasengewebe anderer Primärtumore darstellt, bedarf es der gezielten Diagnostik Differentialdiagnose Besondere Gefahren /Komplikationen Ovarialmetastasen andere Tumore Prognose 5-Jahres-Überlebensrate: Stadium I - 70-80 % Stadium II - 25-45 % Stadium III - 5-20 % 1.8 .7. Prostatakarzinom Tumorgruppe Allgemeines/Epidemiologie zweithäufigste Karzinomerkrankung beim Mann, typischer "Alterskrebs Tumorart / Prostatakarzinom Therapie Ziel der Diagnostik Chirurgische Maßnahmen Ausschluß einer Prostatitis, Zystitis mit kurativem Ziel - Entfernung der Prostata, samt Kapsel, der Samenblasen mit palliativem Ziel - transurethrale Prostataresektion Risikofaktoren - Alter über 60 Histologie Adenokarzinome (in 90 % der Fälle) Symptome G1 - gut differenzierte, leichte Aplasie G2 - mäßig differenziert, mäßige Aplasie G3 - schlecht differenziert, ausgeprägte Anaplasie G4 - undifferenziertes Gewebe Tumorklassifikation / Stadieneinteilung / TNM-Klassifikation - in frühen Stadien zeigen sich keine Symptome - In Spätstadien: Harnverhalt, Mikro- oder Makrohämaturie, bei Metastasen: Kreuzschmerzen, Ischiasbeschwerden, rheumaähnliche Schmerzen Diagnostik Rektale Palpation der Prostata Strahlentherapie bevorzugt palliativ zur Blutstillung bei blutenden Prostatakarzinomen mit Zeichen der Makrohämaturie oder bei Knochenschmerzen verursachenden Metastasen Chemotherapie wirksame Chemotherapiestrategien sind zur Zeit nicht bekannt Hinweise Weitere Verfahren Testosteronentzug durch Hemmung, Hodenentfernung Besondere Gefahren /Komplikationen Metastasierung: frühzeitig in die Knochen Prognose Prostataspezifisches Antigen (PSA) Probebiopsie Differentialdiagnose nach kurativer Zielsetzung - 5-Jahres-Überlebensrate - über 80 % bei palliativer Behandlung - wenige Wochen bis Jahre 1.8.8. Harnblasenkarzinom Tumorgruppe Allgemeines/Epidemiologie Männer 3 x so häufig betroffen wie Frauen Altersgipfel zwischen dem 50. und 75. Lebensjahr Tumorart / Harnblasenkarzinom Ziel der Diagnostik Festlegung des Tumorstadiums Festlegung der Operabilität Risikofaktoren - Medikamentenmißbrauch (phenacetinhaltige Substanzen, Rauchen, chronische Entzündungen) - Exposition mit Anillinfarbstoffen - Rauchen Symptome Histologie Übergangsepithel - 95 % Tumorklassifikation / Stadieneinteilung / TNM-Klassifikation - Makrohämaturie ohne Schmerzen Diagnostik Zystoskopie (Blasenspiegelung) Zytologische Urinuntersuchung Ultraschall der Blase i.V. Urogramm Becken-CT Hinweise Differentialdiagnose Besondere Gefahren /Komplikationen Therapie Chirurgische Maßnahmen Transurethrale Elektroresektion der Blase (TUR-B) als oberflächliche Maßnahme, Teilentfernung der Blase Totalentfernung bei ausgedehnten Befunden, Anlage einer Harnableitung Die OP ist die Methode der Wahl Strahlentherapie Palliativ wird eine Radiatio bei nicht operablen Tumoren eingesetzt Chemotherapie Als Indukationsbehandlung kann eine Chemotherapie durchgeführt werden bei metastasierenden oder lokal nicht operablen Tumoren. Weitere Verfahren In begrenzten, oberflächlichen Frühstadien wird die Blase zytostatisch lokal durch Spülungen behandelt BCG-Instillation Prognose Die allgemeine 5-JahresÜberlebenszeit liegt zwischen 2090 %, je nach Ausdehnung 1.8.9. Hodentumore Tumorgruppe Allgemeines/Epidemiologie zwischen 25 und 30 Jahren 10-15 % aller Krebstodesfälle Leistenhoden/Bauchhoden Risikofaktoren - Lage des Hodens außerhalb des Skrotums Symptome - Schmerzlose Vergrößerung des Hodens tastbarer Knoten Diagnostik Palpation des Hodens Tumormarker β-HCG und AFP Ultraschall des Hodens Differentialdiagnose Tumorart / Hodentumore Therapie Ziel der Diagnostik Chirurgische Maßnahmen Feststellung der Tumorerkrankung Operative Entfernung (Semikastration) plus Lymphknotenentfernung Histologie Strahlentherapie Keimzelltumore - 90 %, davon Gutes Ansprechen der Seminome Seminome Chorionkarzinome hohe Strahlenresistenz der Chorionkarzinome Chemotherapie Tumorklassifikation / Stadieneinteilung / TNM-Klassifikation Gutes Ansprechen der Seminome Gutes Ansprechen der Chorionkarzinome Chemotherapie meist nach OP Hinweise Weitere Verfahren praetherapeutisch Samenspende Besondere Gefahren Prognose /Komplikationen Metastasierung: frühzeitig 5-Jahres-Überlebensrate: retroperitoneal und in die Knochen Stadium I - ca. 100 % Stadium II - über 90 % Stadium III - ca. 60 % 1. 8.10. AML (Akute myeloische Leukämie) Tumorgruppe Allgemeines/Epidemiologie Tumorart / AML (Akute myeloische Leukämie) Ziel der Diagnostik Abklärung benigner Knochenmarkerkrankungen Histologie die Histologie ergibt sich aus dem Reifegrad der entarteten Zellen Risikofaktoren - alkylierende Zytostatika - Ionisierende Strahlen - Rauchen (doppelt hohes Risiko) - Genetische Faktoren (Trisomie 21 - 20fach höheres Risiko) Symptome Tumorklassifikation / Stadieneinteilung / FAB-Klassifikation der AML - Granulozytopenie mit allen Zeichen der Infektanfälligkeit - Thrombozytopenie mit Blutungsneigung - Anämie (Blässe, Leistungsschwäche) Diagnostik Hinweise Blutbildausstrich und Ohne Behandlung führen akute Differentialblutbild Leukosen innerhalb 14 Tage bis Knochenmarkpunktion wenige Wochen zum Tod durch bedrohliche Infekte oder Blutungen Differentialdiagnose Besondere Gefahren /Komplikationen Therapie Chirurgische Maßnahmen entfallen wegen der systemischen Betroffenheit Strahlentherapie entfällt Chemotherapie Allein die invasive Chemotherapie ist in der Lage, durch Zerstörung aller Leukämiezellen eine Remission zu erreichen Weitere Verfahren Retinoide (Abkömmlinge des Vitamin A) können bei der akuten promyelozytären Leukämie (FAB M) Remissionen erzielen. Prognose Mittlere Überlebenszeit ohne Behandlung 2 Monate nach Diagnosestellung nach Chemotherapie 20 % Langzeitüberlebende nach Chemotherapie und Knochenmarktransplantation über 50 % Langzeitüberlebende 1.8.11. CML (Chronisch myeloische Leukämie) Tumorgruppe Allgemeines/Epidemiologie Häufigkeitsgipfel zwischen dem 30. und 50. Lebensjahr Risikofaktoren - Gehäuftes Auftreten nach Strahlenexposition Symptome - - in der chronischen Phase: Müdigkeit, Gewichtsverlust, Milzvergrößerung, evtl. Thrombosen, Blutungen, Gichtanfälle in der akzelerierenden Phase: Tumorart / CML (Chronisch myeloische Leukämie) Ziel der Diagnostik Nachweis der Erkrankung Sicherung des Stadiums Histologie wie bei der akuten Leukämie Tumorklassifikation / Stadieneinteilung Therapie Chirurgische Maßnahmen entfällt wegen der systemischen Erkrankung Strahlentherapie ggf. Milzbestrahlung gegen Schmerzen ggf. Ganzkörperbestrahlung vor der KMT Chemotherapie n der akuten Phase als Induktionstherapie in der chronischen Phase als perorale Monotherapie zur Konsolidierung als Hochdosischemotherapie vor der vermehrte Allgemeinsymptome wie z. B. Fieber - in der akuten Phase: wie in der chronischen Phase, zusätzlich Panzytopenie, Infekte, Blutungen Diagnostik Hinweise Blutbild Knochenmarksausstrich Eine Heilung ist nur bei jungen Patienten nach Knochenmarktransplantation möglich (liegt jedoch auch unter 20 %) Differentialdiagnose Besondere Gefahren /Komplikationen Bei Wechsel von der chronischen in die akute "Schubphase" kann der Patient wie bei der AMl rasch an einem Infekt oder an einer Blutung versterben. KMT Weitere Verfahren Alpha-Interferon - wirksam in der chronischen Phase Leukozytenapherese Auswaschen von Leukozyten aus dem peripheren Blut Prognose langer Krankheitsverlauf 5-10 Jahre 1.8.12. CLL (Chronisch lymphatische Leukämie) Tumorgruppe Tumorart / CLL (Chronisch lymphatische Leukämie) Allgemeines/Epidemiologie Ziel der Diagnostik Auftreten häufiger bei Männern als Sicherung der Diagnose bei Frauen, gehäuftes Auftreten ab Klärung des Stadiums dem 50. Lebensjahr Risikofaktoren Histologie - keine bekannt Therapie Symptome Chirurgische Maßnahmen Die chirurgische Therapie ist wegen der systemisch auftretenden Erkrankung sinnlos. Strahlentherapie Evtl. Strahlentherapie bei großen Lymphomen oder stark vergrößerter Milz Chemotherapie Lymphknotenschwellungen Anämie, Thrombozytopenie Leukozytopenie oft keine körperlichen Symptome vorhanden Diagnostik Blutbildausstrich Knochenmarkausstrich evtl. immunologische Untersuchung - Differentialdiagnose andere Lymphome Tumorklassifikation / Stadieneinteilung Stadieneinteilung nach Binet oder Stadieneinteilung nach Rai Hinweise Infekte sind die häufigste Todesursache bei der CLL es ist bislang keine definitive Heilung möglich Besondere Gefahren /Komplikationen Kompression wesentlicher Strukturen Eine kurative Chemotherapie ist nicht möglich. Mit palliativer Zielsetzung zeigen Chemotherapeutika gute Wirksamkeit Weitere Verfahren ggf. Kortisonbehandlung Prognose Nach Binet-Einteilung ist die mittlere Überlebenszeit relativ gut: Binet-Stadium A - über 10 Jahre Binet-Stadium B - ca. 5 Jahre Binet-Stadium C - ca. 2 Jahre 1.8.13. Hodgkin-Lymphome Tumorgruppe Allgemeines/Epidemiologie Männer sind häufiger betroffen als Frauen (Verhältnis 10 : 6) Der Altersgipfel liegt zwischen dem 15. und 30. Lebensjahr und jenseits des 50. Lebensjahres, HodgkinLymphome machen 25 % aller malignen Lymphome aus Risikofaktoren - familiäre Disposition - Epstein-Barr-Virus-Exposition - Umweltgifte Symptome zunächst schmerzfreie Lymphknotenschwellungen - Allgemeinsymptome: Müdigkeit, Leistungsschwäche, Fieber, Nachtschweiß, seltener Alkoholschmerz in den befallenen Organen, uncharakteristischer Juckreiz Diagnostik Lymphknotenextirpation zwecks histologischer Untersuchung, ansonsten weitere Untersuchungen zur Stadieneinteilung - Differentialdiagnose Tumorart / Hodgkin-Lymphome Ziel der Diagnostik Festlegung des Krankheitsstadiums Planung der Therapie Therapie Chirurgische Maßnahmen als Biopsie zur Diagnosesicherung Histologie Typisches Erkennungszeichen sind die Sternbergschen Riesenzellen Unterscheidung nach 4 Subtypen: lymphozytenreicher Typ lymphozytenarmer Typ nodulär-sklerosierender Typ Mischtyp Tumorklassifikation / Stadieneinteilung Ann-Arber-Klassifikation Strahlentherapie Bestrahlung der befallenen Lymphknoten bis hin zur Mantelund y-Feld-Bestrahlung In Stadium IA und IIA alleinige Strahlentherapie Kombination mit Chemotherapie bei ungünstigem Befall Hinweise B-Symptomatik verschlechtert meist die Prognose: ungeklärter Gewichtsverlust von über 10 % in 6 Monaten, längeranhaltendes, ungeklärtes Fieber über 38 ³C, Nachtschweiß Besondere Gefahren /Komplikationen Chemotherapie Alleinige Chemotherapie in Stadium IIIB und IV Kombinierte Chemo-Strahlentherapie bei ungünstigem Befall Weitere Verfahren Bei Rezidiv oder ungenügendem Ansprechen auf eine Chemotherapie wird eine Hochdosistherapie mit anschließender KMT oder Stammzelltransplantation empfohlen Prognose in lokalisierten Stadien: 10 Jahresüberlebensrate: 85-95 %, in fortgeschrittenen Stadien:40-60 % 1 .8.14. Non-Hodgkin-Lymphome Tumorgruppe Allgemeines/Epidemiologie Männer häufiger betroffen als Frauen, Altersgipfel im 7. Lebensjahrzehnt Risikofaktoren - evtl. virale Genese (BurkittLymphom nach Epstein-BarrInfektion) - Störungen im Immunsystem, ionisierende Strahlen, Zytostatikaexposition Symptome Tumorart / Non-HodgkinLymphome Ziel der Diagnostik Staging Therapie Histologie Hodgkinzellen/Sternberg ReedZellen Kieler-Klassifikation International-Working Formulation (IWF) Strahlentherapie In lokalisierten Frühstadien Strahlentherapie mit potentiell kurativem Ziel Tumorklassifikation / Stadieneinteilung Stadieneinteilung nach Ann-Arber: - Ähnlich wie Morbus Hodgkin: I Maximal eine LK-Station oder - häufiger Beschwerden im eine extralymphatische Region Mund- und Rachenbereich oder im Magen-Darm -Bereich, befallen, II Befall mehrere LK-Regionen häufig schmerzlose oder Befall eines Lymphknotenschwellungen. extralymphatischen Gewebes auf evtl. primärer Hautbefall einer Seite des Zwerchfells III Befall von LK-Regionen beidseits des Zwerchfells einschließlich lokalisierter Befall von Milz oder eines anderen extralymphatischen Gewebes IV disseminierter Befall von LK und extralymphatischen Geweben Diagnostik Hinweise Lymphknotenextirpation evtl. Interferon alpha als Erhaltungstherapie Differentialdiagnose Besondere Gefahren /Komplikationen Chirurgische Maßnahmen Chemotherapie In fortgeschrittenen Stadien Chemotherapie mit palliativem Ziel Weitere Verfahren Bei Rezidiven - erneute Chemotherapie oder palliative Strahlentherapie Prognose abhängig von Malignitätsgrad, Ausbreitung 1 .8.15. Plasmozytom Tumorgruppe Allgemeines/Epidemiologie Männer häufiger betroffen als Frauen, Altersgipfel im 7. und 8. Lebensjahrzehnt Risikofaktoren - erbliche Disposition - Strahlenexposition (10-30 Jahre vor Erkrankung) Symptome Tumorart / Plasmozytom Ziel der Diagnostik Ausschluß anderer Knochenerkrankungen Therapie Chirurgische Maßnahmen Stabilisierung von Frakturen Histologie histologisch entsteht das Plasmozytom aus pathologisch veränderten Plasmazellen Strahlentherapie Eine kurative Strahlentherapie ist nur bei solitärem Auftreten möglich. Die palliative Strahlentherapie wird bei schmerzhaften oder frakturgefährdeten Skelettbereichen durchgeführt. Chemotherapie Tumorklassifikation / Stadieneinteilung - rheumaähnliche Beschwerden, Einteilung nach Durie und Salmon Knochenschmerzen, - Spontanfrakturen durch Osteolysen, - Blutungsneigung, Anämie, - Infektneigung, Proteinurie, - Leukopenie, Thrombopenie, evtl. Niereninsuffizienz Diagnostik Hinweise Knochenmarkzytologie und Thromboseneigung durch Histologie per Viscositätserhöhung Beckenkammbiopsie, Blutbild, Untersuchung der Nierenfunktion, Röntgen: Schädel, Wirbelsäule, Becken, Thorax, Extremitäten, Ephorese Differentialdiagnose Besondere Gefahren /Komplikationen Tumoren mit Pathologische Frakturen Knochenmetastasierung Nierenversagen Palliative Chemotherapie bei multiplen Plasmozytomherden zur Reduktion der Gesamtmyelomzellen Weitere Verfahren Prognose Abhängig vom Erkrankungsstadium: Mittlere 5-Jahres-Überlebensrate 25-30 % IA - 5 Jahre IB, IIA und B - 4,5 Jahre IIIA - 2,5 Jahre IIIB - 14 Monate 1.8.16. Bronchialkarzinom Tumorgruppe Allgemeines/Epidemiologie - häufigste Neuerkrankung beim Mann - bei Frauen Zunahme der Inzidenz - Altersgipfel zwischen 45 und 85 Jahre Risikofaktoren - inhalatives Rauchen, - ionisierende Strahlen, - Z. n. TBC Tumorart / Bronchialkarzinom Ziel der Diagnostik - Feststellung der Ausdehnung der Krankheit - Sicherung der Histologie - Beurteilung der Operabilität - Beurteilung der richtigen Therapieform Histologie - kleinzelliges Bronchialkarzinom - Nichtkleinzelliges Bronchialkarzinom: Plattenepithelkarzinom Adenokarzinom - großzelliges Karzinom adenosquamatöses Karzinom Symptome - Husten, der länger als 4 Wochen besteht - Veränderung des Hustenverhaltens - Blutbeimengungen beim Sputum - Schmerzen - Atemnot - Heiserkeit Stadieneinteilung bei nichtkleinzelligen BC - Stadium 0 Tis No Mo 1-2 - Stadium I T No Mo 1-2 1 - Stadium II T N Mo 1-2 2 - Stadium IIIA T N Mo 3 -2 T No Mo - Stadium IIIB jedes 3 T N Mo T4 jedes Mo N - Stadium 4 jedes jedes M1 T N Therapie Chirurgische Maßnahmen - bei Kleinzellern nur, wenn der Tumor in seiner Ausdehnung begrenzt ist - bei Nichtkleinzellern mit kurativer Zielsetzung Strahlentherapie - Kurative Zielsetzung, bei "limited disease", nach kompletter Tumorrückbildung infolge der abgeschlossenen Chemotherapie (weniger Lokalrezidive) - zur Erreichung einer kompletten Tumorrückbildung nach inkompletter Rückbildung infolge Chemotherapie - zur Erreichung einer Komplettremission nach unzureichender Wirkung der Chemotherapie bei begrenzter Tumorausbreitung - Adjuvant, als Schädelbestrahlung zur Metastasenprophylaxe - Palliativ, zur Linderung TUbedingter Symptome Chemotherapie - Kurativ - bei "limited disease" - Palliativ - bei schlechter Prognose (z. B. Rezidiv nach Chemotherapie, rasche Verschlechterung des Allgemeinzustandes) 1.8.16. Bronchialkarzinom - Fortsetzung Diagnostik - Thoraxröntgen - Zytologie/Sputum und Bronchialsekret - Bronchoskopie mit Biopsie - evtl. Mediastinoskopie - CT/MNR (Brust, Bauch, Schädel) - Differentialdiagnose / weitere Verfahren Skelettszintigrafie Oberbauchsonografie Knochenbiopsien EKG, Lungenfunktion und Blutgasanalyse Besondere Gefahren /Komplikationen - bei kleinzelligen BC "Limited disease"= Tumor ist auf eine Thoraxseite begrenzt "Extended disease"= Tumorausdehnung über "limited disease" hinaus Übersicht über Verfahren - In Frühstadien (selten) kann eine Operation vor oder nach einer Chemotherapie sowie im Anschluß eine Radiatio durchgeführt werden. Bei kleinzelligen BC ist die Therapieform der Wahl die Chemotherapie. - Häufig erfolgt nach Beendigung der Zytostase eine ergänzende Radiatio im Bereich der Tumorregion Prognose - - - Im Stadium "limited disease" Remissionsraten von über 80 %, jedoch meist von kurzer Dauer (6-8 Monate) Die mittlere Überlebenszeit liegt bei einem Jahr. Bei "extended disease" liegen die Remissionsraten bei 60 %, die mittlere Überlebensdauer bei unter 6 Monaten. 1.9. Notfallsituationen Notfallsituationen verursachen für den Betroffenen durch eine meist unerwartete Reaktion eine akute Lebensbedrohung. Auftretende Notfallsituationen erfordern umgehendes, zielgerichtetes und fachlich kompetentes Agieren der Pflegenden. Im ambulanten Pflegebereich zeichnet sich hier die Notwendigkeit ab, onkologische Patienten nur von qualifizierten Krankenschwestern und Krankenpflegern betreuen zu lassen. Sowohl die Beobachtung von Veränderungen, die auf einen kommenden Notfall hinweisen, wie auch das Erkennen der aufgetretene n Notfallsituation sowie der Effektivität eingeleiteter Notfallmaßnahme n stehen in dichter Abhängigkeit von der Qualität und Erfahrung des Pflegenden. Somit hängt das weitere Schicksal des Betroffenen von der fachlichen Kompetenz des Pflegenden in der ambulanten Pflege ab. Tabelle 6: Strategisches Vorgehen im Notfall bei onkologischen Patienten - Anpassung an den neuen Informationsstand, durch ständige Fort- und Weiterbildung Qualifikation durch Information - Analyse potentieller Notfallreaktionen (ggf. zusammen mit dem Arzt), bei Übernahme eines Patienten mit Tumorerkrankung Interaktion mit dem Arzt - Planung von Beobachtungskriterien in die Pflegeplanung (z. B. Bewußtseinslage und Pulsbeobachtung bei drohendem Hirndruck) Planung von präventiv-wirksamen Maßnahmen (z. B. Obstipationsprophylaxe bei Gefahr des Ileus) Entwicklung von Standards Dokumentation von Beobachtungen und Maßnahmen Pflegeplanung und Dokumentation Einbezug des Patienten in die Pflege Pflegevisiten zur Qualitätssicherung Fallbesprechung im Team Förderung der Eigenaktivität des Patienten Qualitätssicherung durch Interaktion mit Kollegen - - - Einteilung der Notfallsituationen Onkologische Notfallsituationen lassen sich unterteilen in verschiedene Gruppen. Tabelle 7: Einteilung der onkologischen Notfallsituationen Notfälle durch direkte Tumorwirkung - Ileus - Hirndruck durch intracranielle Drucksteigerung - Arteria Carotis-Ruptur - Rückenmarkskompression und Querschnittslähmung - Obere Einflußstauung Notfälle durch Störung der Blutgerinnung und Viskosität - Hämorrhagische Diathese - Thrombosen - Disseminierte intravasale Gerinnung Notfälle durch Elektrolyt- und Stoffwechselentgleisung - Tumorlysesyndrom - Hyperkalzämische Krise Notfälle verschiedener Ursache - Respiratorische Insuffizienz/Lungenblutung - Zytostatikainduzierte Alveolitis - Akut auftretende Sepsis - Hirnblutung Zusammenarbeit zwischen Pflegenden und Ärzten Anders als im stationären Bereich, sind ambulant Pflegende häufig in der ersten Phase der Notfallsituation auf sich allein gestellt. Die ersten Schritte werden durch sie eingeleitet und häufig bleibt dann die Hilflosigkeit des passiven Begleitens, d. h. mit dem Patienten gemeinsam auf den Notarzt oder Hausarzt zu warten. Die Betreuung von onkologischen Patienten im ambulanten Bereich kann ohne Qualitätsverluste gegenüber einer stationären Versorgung nur dann funktionieren, wenn hier die ärztliche Notfallversorgung gewährleistet ist. Die folgenden Tabellen zeigen schematisch die wichtigsten Informationen zu den verschiedenen Notfällen. 1.9.1. Notfälle durch direkte Tumorwirkung 1.9.1.1 Ileus/intestinale Obstruktion Als Ileus bezeichnet man einen durch ein mechanisches Hindernis ausgelösten Darmverschluß oder durch Darmlähmung (Paralyse) bedingte Transportstörung . In beiden Fällen kommt es zur kompletten oder inkompletten Passageunterbrechung. Durch direktes Tumorwachstum kommt es bevorzugt zum mechanischen Ileus. Risikopatienten Patienten mit: - Zustand nach Bauch-OP - Zustand nach Bestrahlung im abdominellen Bereich - Kolonkarzinom - Ovarialkarzinom - Malignem Melanom - Blasenkarzinom - Zervixkarzinom Symptome - krampfartige Leibschmerzen - aufgetriebener Leib - evtl. Veränderung der Stuhlsäule bei langsam zunehmendem Verschluß - evtl. Diarrhoe - evtl. Erbrechen Prognose Die häufig bei malignen Lymphomen, Zervixkarzinomen und Blasentumoren durchgeführten Bestrahlungen führen schnell zu einer Narbenbildung im abdominellen Bereich. Nach operativer Beseitigung des mechanischen Ileus ist hier die Prognose gut. Im Gegensatz hierzu ist der Ileus bei den übrigen Tumoren eher durch lumeneinenengendes Tumorwachstum als durch Strangbildung bedingt. Hier wird eher palliativ ein Stoma oder eine Kurzschlußverbindung angelegt, um Nahrungspassage und Lebensqualität zu erhalten. Therapie Die operative Ausschaltung des mechanischen Hindernisses ist die einzige befriedigende Lösung. Es wird hierzu ein Anus praeter = Stoma oder eine Umgehungsanastomose angelegt. Pflege Pflegerische Interventionen sind zielgerichtet auf: - Vermeidung lebensbedrohlicher Komplikationen - Reduktion von Schmerzen - Verbesserung der Lebensqualität Qualifikation des Pflegenden evtl. Kenntnisse über spezielle Bauchmassagen Pflegeplanung bei Ileusgefahr Pflegeproblem Gefahr des Darmverschlusses Pflegemaßnahme Pflegeziel Erhalt der normalen Darmpassage - geeignete Maßnahmen zur regelmäßigen Stuhlpassage planen - Flüssigkeitszufuhr erhöhen - Buttermilch, Pflaumensaft oder abführende Tees einsetzen - keine stark quellenden Speisen in größerer Menge geben (z. B. Apfelsinen, Spargel) Häufig jedoch setzt der Ileus spontan und notfallartig ein. Pflegende im ambulanten Bereich informieren bei Erkennen spezifischer Symptome umgehend den Arzt, damit gemeinsam das weitere Vorgehen geplant und eine Krankenhauseinweisung zur Operation in die Wege geleitet werden kann. Pflegeplanung bei bestehender intestinaler Obstruktion Pflegeproblem Aufstoßen, Erbrechen durch Passagehindernis Meteorismus Gefahr der Kachexie wenn der Patient aufgrund zunehmender Obstruktionszeichen nur noch breiige und flüssige Nahrung zu sich nimmt Pflegemaßnahme - Patienten beruhigen - Arzt informieren - evtl. Magensonde legen - ggf. Antiemetika nach Arztanordnung verabreichen - Urinausfuhr beobachten und messen - feuchte Wärme - Kümmel-Fenchel-Anis-Tee - sanfte Bauchmassage - Errechnen des Energiebedarfs - Zusammenstellen einer individuell angemessenen Ernährung (bei Malignom 40 % Fett, 30 % KH, 30 % Eiweiß) - Kalorienreiche Zwischenmahlzeiten anbieten Pflegeziel - Vermeidung von Stuhlerbrechen - Verbesserung / Wiederherstellung der Lebensqualität - Einleitung weitere Maßnahmen - Windabgang ermöglichen - Erhalt/ Wiederaufbau eines angemessenen Ernährungszustandes Bei bestehendem Verdacht auf eine intestinale Obstruktion ist es ratsam, nicht sinnlose Zeit zu vergeuden. Ein Schockzustand oder die Notwendigkeit zur Durchführung einer Notoperation im Nachtdienst des operierenden Arztes reduziert die Chancen des Betroffenen, diese Komplikation zu überleben. 1.9.1.2 Hirndruck/intrakranielle Drucksteigerung Risikopatienten Patienten mit: - Hirnmetastasen - epithelialen Tumoren (insbesondere Mamma-, Bronchial-Karzinom) - primären Hirntumoren - Bluthochdruck - Koagulopathien Symptome - Kopfschmerzen - Übelkeit/Erbrechen später - Bewußtseinsveränderungen - Nackensteifigkeit - Sehstörungen - Veränderungen der Schmerzempfindung - Pupillenverengung - evtl. Krämpfe (ähnlich epileptischen Krämpfen) bei weiterem Fortschreiten: - Bewußtlosigkeit - Pupillenerweiterung - durch Zusammenbruch der Atem- und Kreislauffunktion Tod Prognose Die Prognose ist fast bei allein Hirndruckursachen im onkologischen Bereich schlecht. Lediglich die kurative Entfernung eines Hirntumors oder einer Solitärmetastase stellt eine Ausnahme dar. Therapie Durch Kortikosteroide lassen sich Hirndruckzeichen meist schnell lindern. Zur Ursachenausschaltung eignen sich OP, Chemo- oder Strahlentherapie, je nach Lokalisation und Ansprechbarkeit. Kopfhochlagerung Pflege Pflegerische Maßnahmen werden vorrangig mit folgender Zielsetzung durchgeführt: - frühzeitiges Erkennen von hirndruckbedingten Symptomen - Mitentscheidung im therapeutischen Team durch Einbringen beobachteter Informationen (z. B. Bewußtseinslage) - Linderung von Beschwerden und Erhalt oder Wiederherstellung der größtmöglichen Lebensqualität Qualifikation des Pflegenden - Neurologische Grundkenntnisse (z. B. zu Reaktionen des Gehirns auf intrakranielle Drucksteigerung) - Kenntnisse zur Krankenbeobachtung - Bestehendes Vertrauensverhältnis zum Patienten Vorhandener Austausch mit Arzt und Kollegen ist möglich Pflegeplanung bei Hirndruck Pflegeproblem Übelkeit und Erbrechen Pflegemaßnahme - Patient erhält Wunschkost - ständig kaltes Wasser bereitstellen - Kopf hochlagern Patient leidet unter - Schmerzanalyse durchführen Kopfschmerzen, fühlt sich dadurch - evtl. tagesabhängiges beeinträchtigt Auftreten analysieren - Lärmbelästigung ausschalten z. B. kein lautes Radio - Patient soll Kopf nicht bücken - Hustenattacken vermeiden (Lavendelöl) - Opstipationsprophylaxe - evtl. Oberkörperhochlagerung - evtl. Kühlkissen für den Kopf - beim Patienten verweilen Patient reagiert desorientiert, ist - evtl. um Hilfe (Angehörige z. nicht klar bei Bewußtsein, zeigt B.) bitten, falls dies der Patient Symptome der Angst wünscht - Hilfen zur Orientierung geben (Zeit, Ort, Raum und Person benennen) - Basale Stimulation einsetzen - Ruhig auf den Patienten einwirken - Patienten auffordern, seine Gefühle und Empfindungen, Ängste und Gedanken auszusprechen Veränderungen der Herz-Kreislauf - regelmäßige Pulskontrolle - und Atemfunktionen z. B. - regelmäßige Bradykardie als Hirndruckzeichen Blutdruckkontrolle - regelmäßige Hypertonie Blutdruckkontrolle Pflegeziel - Lebensqualität wird erhalten - Linderung der Schmerzen Förderung/Wiederherstellung der Lebensqualität - Patient erfährt Gefühl der Sicherheit und Geborgenheit Patient fühlt sich nicht allein gelassen Einbezug von Patienteninformationen in Krankenbeobachtung und Pflegeplanung möglich - - - Hypotonie - Erhöhung der Flüssigkeitszufuhr - Temperaturanstieg bei Druck auf das Zwischenhirn - Temperaturkontrolle, meist zentrale fiebersenkende Maßnahmen erforderlich, Verabreichung nach Arztanordnung - Erkennen bradykarder Veränderungen, Einleitung weiterer Therapieverfahren Erkennen einer hirndruckbedingten Blutdruckveränderung Abfangen der hypotonen Blutdruckkrise Erkennen hirndruckbedingter Temperaturveränderungen Pflegeplanung bei Hirndruck - Fortsetzung Pflegeproblem Tachypnoe bei Beeinträchtigung des Stammhirns Pflegemaßnahme - Beobachtung der Atmung - sofortige Arztinformation bei Veränderungen Krampfneigung/Potentielle Gefahr - Überprüfen, ob der Patient von Krampfanfällen über diese Möglichkeit informiert wurde, sonst Arztgespräch einleiten - Pat. über Notfallvorgehen informieren - Gummikeil bereitlegen - evtl. Bettenden mit Decke abpolstern - mit dem Arzt über Reserve/Notfallmedikation sprechen Abnorme Hunger- und Lustgefühle Bei 1 - Salzhaltige Speisen und 1. verstärkter Salzhunger Getränke (z. B. Brühe) 2. Hunger auf Süßigkeiten anbieten - Ein- und Ausfuhrbilanz - Absprache mit dem Arzt Einschränkungen der Mobilität durch zunehmenden Hirndruck Bei 2 - Auf Wünsche des Patienten eingehen - engmaschige BZ-Kontrollen - viel trinken lassen - in früheren Stadien Oberkörperhochlagerung - Durchführung der Dekubitus-, Kontraktur, Pneumonie- und Thromboseprophylaxe- Pflegeziel - Erkennen von Atemveränderungen - - - - - Patient kann Vertrauen aufbauen, durch Erhalt von Informationen Patient kann Angst abbauen Patient erkennt die Sicherheitsmaßnahmen und fühlt sich sicher schnelles Eingreifen im Notfall ist möglich Vermeidung von Verletzungen Patient fühlt sich in seinen Wünschen angemessen behandelt Erhalt der Lebensqualität Verbesserung des hirnvenösen Blutabflusses Vermeidung immobilisationsbedingter Schäden Im Rahmen hirndruckbedingter Veränderungen von Herz-Kreislauffunktionen und Atemsituation bleibt in der Pflege vorrangig die Krankenbeobachtung mit dem Ziel, Störungen möglichst frühzeitig erkennen zu können. Geeignete, symptomorientierte Maßnahmen greifen wegen der meist zentralen Beeinträchtigung nicht. Angeordnete Kortikosteroide senken hierbei den Hirndruck und reduzieren damit die Problematik. Im Endstadium des bestehenden Hirndruck reicht diese Wirkung jedoch häufig nicht mehr aus. Wirksame Strategien fehlen hier. 1.9.1.3 Ruptur der Arteria Carotis Risikopatienten: - Patienten mit Hals-Kopf-Tumoren - Zustand nach therapiebedingter Gefäßschädigung (z. B. OP plus Radiatio) - Infiltration der Arteria Carotis durch Tumorgewebe im Terminalstadium - Pat. mit zusätzlicher Thrombopenie nach Zytostase Symptome - Bei Arrosion der Arteria Carotis und Infiltration: häufig vorangehende kleinere Blutung, Schmerzen, Nervenfunktionsstörungen als Vorzeichen Prognose Der meist vorangehenden kleinen Blutung folgt bei der Arrosion nahezu immer eine stärkere, die schließlich zum Tod des Patienten führt. Bei der postoperativen Blutung ist die Prognose günstiger, wobei sich Diagnostik und Therapie insgesamt an der allgemeinen Prognose orientiere n sollten. Therapie Bei Gefahr einer Arteria Carotis-Ruptur sollte ein erfahrener Gefäßchirurg hinzugezogen werden, der über das weitere Procedere im entsprechenden Fall befindet. Bei ausgedehnter Arrosion durch Tumorinfiltration stehen ohnehin meist keine therapeutischen Möglichkeiten mehr zur Verfügung, da es sich vielfach um "austherapierte" Patienten handelt. Pflege Pflegerische Maßnahmen werden durchgeführt unter der Zielsetzung: - Vermeidung einer postoperativen Carotis-Ruptur - Unterstützung und Begleitung des Patienten im Bewußtsein dieser Gefahr - Hilfe bei der Entscheidung für oder gegen eine Therapie Qualifikation des Pflegenden - Kenntnisse über Notfallsituation sind vorhanden - Vertrauensverhältnis zum Patienten besteht - Pflegender ist in der Sterbebegleitung erfahren - Regeln zur patientenzentrierten Gesprächsführung sind bekannt - Pflegende/r erhält Unterstützung vom Team Pflegeplanung bei potentieller Rupturgefahr Pflegeproblem Gefahr der Ruptur durch a) postop. Wundinfektion Pflegemaßnahme - b) Husten/Reizhusten - c) Nausea/Emesis z. B. nach Chemotherapie - - steriler Verbandswechsel 1-2 täglich Wundbeobachtung Vorbeugung einer Infektion durch allg. Infektprophylaxe Pat. auffordern, nicht zu rauchen ggf. Lavendel-BrustKompresse Lavendelöl in Duftlampe evtl. Zitronenöl in Duftlampe Patienten beruhigen Sorge für regelmäßige Einnahme verordneter Antiemetika Kühle Getränke anbieten Pflegeziel - komplikationslose Wundheilung - komplikationslose Atmung Förderung von Wohlbefinden Vermeidung von Nausea/Emesis Pflegeplanung bei potentieller Rupturgefahr - Fortsetzung Pflegeproblem d) Pressen bei Obstipation Pflegemaßnahme - Pat. auffordern morgens auf nüchternen Magen ein Glase lauwarmes Wasser zu trinken - Kolonstimulierende Einreibung - ggf. Fenchel-, Kümmelölmassage der Bauchregion - ballaststoffreiche Nahrung (mit ausreichend Flüssigkeit) - milder abführender Tee - nach Arztanordnung Laxantien - evtl. Umstellung der Opioide 2) Stress mit entstehender Hektik, - mit dem Patienten über seine Bewegungsdrang und Angst durch Angst sprechen Sehen, Fühlen oder Spüren des - Verständnis für seine Angst Tumors zeigen - ihn motivieren, seine Angst niederzuschreiben, anstelle zu schreien - eigene Hilflosigkeit zugeben - weiterreichende Gesprächsangebote z. B. mit dem Arzt anbieten - evtl. bei Patienteneinverständnis Sedierung erwirken Pflegeziel - Förderung der Darmmotorik - Erleichterung des Stuhlgangs - Förderung von Wohlbefinden - Patient kann seine Ängste anders ausdrücken Patient wird ruhig Patient akzeptiert sich und seine Angst stressbedingter Druckanstieg wird vermieden Pflegeplanung bei bestehender Arteria Carotis-Blutung Pflegeproblem 1. Bestehende, kleine postoperative Blutung Pflegemaßnahme - Patienten beruhigen - Arzt informieren - Wunde beobachten - engmaschige Vitalzeichenkontrolle 2. stärkere arterielle Blutung - Ertasten der Arteria Carotis manuelle Kompression der Arteria Carotis bis zum Eintreffen des Notarztes Pflegeziel - Patient erkennt klar, aber nicht überängstlich seine Situation - einsetzende stärkere Blutung wird erkannt - Herz-Kreislaufkomplikationen werden frühzeitig erkannt - Minimierung des Blutverlustes bis zur Operation (Operationsindikation fraglich) Pflegeplanung bei bestehender Arteria Carotis-Blutung - Fortsetzung Pflegeproblem 3. bestehende Blutung bei tumorbedingter Ruptur Pflegemaßnahme - beim Patienten bleiben - Situation wach aber nicht hektisch erkennen - Patienten beruhigen - Patient soll sich in Seitenlage legen - durch Absaugen Aspiration und Herunterschlucken von Blut vermeiden - Patient über alle Schritte informieren - evtl. Angehörige bei Wunsch des Patienten informieren - nach Wünschen fragen Pflegeziel - Patient und evtl. Angehörige sind in der Lage, die Situation ohne Panik zu erleben - Patient spürt Verständnis und kann ggf. Wünsche äußern Gerade am Beispiel der Arteria-Carotis-Ruptur läßt sich das Problem einer unzureichenden Patientenaufklärung verdeutlichen. Wurde mit dem Kranken im Frühstadium einer absehbaren Arteria Carotis-Ruptur über das potenzielle lebensbedrohliche Problem gesprochen und hatte dieser die Möglichkeit, das nahende Ende seines Lebens zu akzeptieren, so wird er in der gegebenen Notfallsituation ruhiger und gelassener damit umgehen können. 1.9.1.4 Rückenmarkskompression und Querschnittssymtomatik Risikopatienten Patienten mit: - Skelettmetastasen, die vom Wirbelkörper ausgehend, in den Wirbelkanal einwachsen - Metastasen der Meningen (= Rückenmarkshäute) Gehäuft kommt es zur Rückenmarkkompression beim: - Bronchialkarzinom - Plasmozytom - Prostatakarzinom - Mammakarzinom - Non-Hodgkin-Lymphom - Primärtumor im Spinalkanal Symptome - Sowohl seitenbetonte Symptome als auch beidseitig auftretende Symptome sind möglich - Schmerzen kommen in fast 90 % aller Fälle vor und gehen den Befunden meist längerfristig voraus - Parästhesien (Kribbeln, Taubheit, Brennen) - Störungen beim Wasserlassen oder Stuhlgang - bei zunehmender Rückenmarkkompression - evtl. Querschnittsymptomatik Prognose Eine echte Querschnittslähmung kommt bei skelettmetastasenbedingten Wirbelkörperfrakturen nur in Ausnahmefällen vor, da die Wirbelkörper bevorzugt im vorderen Bereich zusammensinken und die Nervenaustrittstellen meistens relativ unbeschädigt bleiben. Bei bestehender Querschnittssymptomatik liegt vielfach auch eine Rückenmarkskompression durch Tumorwachstum vor. Therapie Chirurgie - Laminektomie (Entfernung eines oder mehrerer Wirbelbögen) und/oder - Stabilisierungsoperationen (z. B. mit Fixateur intern) oder Eingabe von Knochenzement. - ggf. Reduktion der Tumormasse Radiatio - Als Kombinationsbehandlung Operation/Radiatio, falls der lokale Tumor nur unzureichend entfernt werden konnte Als Primärbehandlung bei Inoperabilität Chemotherapie - nur bei hoher Sensibilität für Medikamente nur in Ausnahmesituationen, z. B. bei Lymphomen, Kortikoidgaben Pflege - Intensive Krankenbeobachtung im Bereich der aufgetretenen oder potentiellen Probleme - intensive psychische und pflegerische Betreuung - Unterstützung bei allen Aktivitäten, die der Patient nicht selbständig durchführen kann Prognose Bei zunehmendem Tumorwachstum nimmt die Gefahr der Querschnittsymptomatik zu. Pflegeplanung bei drohender/bestehender Rückenmarkkompression Pflegeproblem Patient hat Angst, daß sich eine Rückenmarkkompression entwickelt oder eine bestehende Symptomatik zunimmt Patient klagt über Parästhesien, sensorische oder motorische Ausfälle - im Bereich der Hände - im Bereich der Beine Pflegemaßnahme - Verständnis für die Situation des Patienten zeigen - Akzeptanz für seine Ängste aufbringen - Gespräche anbieten - ggf. für ein Gespräch mit dem Arzt sorgen - aufzeigen, daß alle möglichen Maßnahmen zur Vorbeugung sowie zur Vermeidung eingesetzt werden - Dokumentation der geäußerten Beschwerden im Pflegebericht - Information des Arztes - ggf. Einsatz von Hilfsmitteln im Bereich der selbständigen Ernährung (Tasse mit Doppelgriffen, Besteck mit dicken Griffen, Deckelöffner) und Kleidung (Knopfschließhilfen) - evtl. Gehhilfe vermitteln Pflegeziel - Patient kann sich in seiner Angst angenommen fühlen - Patient kann realistisches Bild der bestehenden Situation annehmen - Patient kann sich mit seiner Situation in angemessener Weise auseinandersetzen - - Symptome werden entsprechend ihrer Bedeutung bewertet Patient kann entstandene Defizite ausgleichen und erhält seine Selbständigkeit Pflegeplanung bei drohender/bestehender Rückenmarkkompression - Fortsetzung Pflegeproblem Pflegemaßnahme - auf Heizkissen, Wärmflaschen und andere Wärmespender, sowie auf Eispackungen verzichten Patient leidet unter Schmerzen in - Dokumentation der den entsprechenden Bereichen Beschwerden - Verabreichung von Schmerzmitteln Patient schildert Miktionsstörungen - Toilettentraining, - ggf. aufsaugende Materialien Kann Harn nicht mehr willentlich Blasenklopftraining halten, es kommt zur Inkontinenz - ggf. Fußzonenreflexmassage Patient spürt keinen Harndrang - nach strenger mehr Indikationsstellung Zeitweise kommt es zum Dauerkatheter Harnverhalt - bei Harnverhalt - Eukalyptuskompressen auf die Blasengegend Patient leidet unter Obstipation - Krankenbeobachtung - Einsatz obstipationsprophylaktischer Maßnahmen - Durchführung ärztlich verordneter Maßnahmen Pneumoniegefahr durch - Pneumoniegefahr Atemfunktionsstörungen (Totraumvergrößerer, Atemtherapie, Inhalationen, atemstimulierende Einreibungen etc.) - Atembeobachtung Pflegeziel - Patient kann Selbständigkeit/Sicherheit erhalten - Erhalt einer intakten Haut - Patient erfährt Schmerzlinderung - - - - - Thrombosegefahr durch Immobilität - Ausstreichende Massagen aktive/passive Bewegungsübungen Krankengymnastik Antithrombosestrümpfe ggf. Verabreichung von Heparin nach Arztanordnung - Reduktion der Inkontinenz durch regelmäßiges Urinausscheiden Linderung der Symptome Patient kann Probleme kompensieren, fühlt sich sicher Blase wird innerviert, Patient kann Harn ablasen auftretende Ileusproblematik kann frühzeitig erkannt werden Stuhlausscheidung erfolgt regelmäßig und ohne Beschwerden Ein- und Ausatmung wird verbessert möglichst alle Lungensegmente werden belüftet Erhalt/Wiederherstellung einer gesunden Lungenfunktion Störungen und Veränderungen werden frühzeitig erkannt der venöse Blutfluß wird gefördert Fließeigenschaften des Blutes werden verbessert "Verdünnung" des Blutes Pflegeplanung bei drohender/bestehender Rückenmarkkompression - Fortsetzung Pflegeproblem Dekubitusgefahr durch ständiges Liegen Pflegemaßnahme - Umlagern nach Plan - Superweichlagerung - Massage der betroffenen Areale - ggf. Clinitron-Bett Kontrakturgefahr durch - Passive und aktive eingeschränkte Wahrnehmung von Krankengymnastik Schmerzen, sowie durch unzureichende Bewegung - Analyse der betroffenen Patient kann sich nicht mehr Bereiche selbständig in allen Bereichen des - Erstellen eines Pflegeplans täglichen Lebens versorgen gemeinsam mit dem Patienten - ggf. Unterstützung oder Übernahme bestimmter Handlungen Pflegeziel - gefährdete Hautareale wer den entlastet - Erhalt einer funktionsfähigen, intakten Haut - Erhalt der Beweglichkeit der betroffenen Gelenke - Patient kann sich weitgehend in den betroffenen Bereichen versorgen Patient fühlt sich sicher - 1.9.1.5 Obere Einflußstauung Risikopatienten Patienten mit: - Bronchialkarzinom - Malignem Lymphom - metastasierendem Mammakarzinom - Thymom Symptome: - Gefühl des unspezifischen Kopfdruckes - gestaute Halsvenen - Schwellung von Gesicht, Hals- und Armregion - evtl. blaurote Verfärbung des Gesichts - Dyspnoe Prognose Der Zustand des Patienten verschlechtert sich ohne Therapie meist rasch. Bei guter Therapierbarkeit sollte schnell behandelt werden, um die Prognose entsprechend zu verbessern Therapie Hochdosierte Kortisontherapie als Akutnotfalltherapie Diuretika Behandlung der Ursache durch Strahlen- oder Chemotherapie ggf . Heparinisierung ggf. Sauerstofftherapie Pflege An dringlichster Stelle ist die psychische Betreuung zu sehen. Weiterhin stehen die Linderung der Atemnot und die Vermeidung von Komplikationen im Vordergrund Qualifikation Die Gespräche mit dem stark verunsicherten, ängstlichen Patienten werden von einer qualifizierten Pflegefachkraft übernommen Pflegeplanung für Patienten mit bestehender oberer Einflußstauung Pflegeproblem Patient leidet unter Atemnot, sitzt überwiegend nach Luft schnappend, aufrecht im Bett Pflegemaßnahme - Überwachung und Dokumentation der Atemfrequenz - geeignete Lagerung (ggf. Oberkörperhochlagerung) - Mobilisation auf das Nötigste einschränken - alle erforderlichen Utensilien in Griffweite stellen - ggf. Fenster öffnen - nach Arztanordnung Sauerstoffgabe Es besteht Soor- und - Sorge für ausreichende Parotitisgefahr durch Mundatmung Befeuchtung der und Diuretika Mundschleimhaut, Patient soll in kurzen Abständen kleine Schlucke trinken oder Mund einsprühen (ggf. Salbeitee) - saure Bonbons lutschen lassen Patient hat Angst, ist verunsichert - Verständnis zeigen für die Angst des Patienten durch seinen angeschwollenen - Aufzeigen, daß die Therapie Hals und durch das bläulich mit dem Ziel der Reduktion verfärbte Gesicht dieser Beschwerden durchgeführt wird - ggf. für Arztinformation sorgen - ggf. Sorge für regelmäßige Diuretikaeinnahme - ggf. Gewichtskontrolle - ggf. Flüssigkeitsbilanz Patient hat erhöhte - Thromboseprophylaxe Thrombosegefahr durch durchführen (Patient soll ggf. Immobilisation und Beine im Bett bewegen, Zehen Diuretikaeinnahme anziehen und strecken), - ausstreichende Waschungen - Antithrombosestrümpfe - ggf. Heparinisierung nach Arztanordnung Pflegeziel - Istzustand wird erfaßt - Atmung wird erleichtert - Patient kann besser durchatmen - - - Mundschleimhaut wird angefeuchtet Speichelfluß wird angeregt Patient fühlt sich in seiner Angst begleitet Patient kann Angst reduzieren Blutzirkulation und venöser Rückfluß werden gefördert 1.9.2. Notfälle durch Störungen im Bereich der Blutgerinnung 1.9.2.1 Blutungsneigung /hämorrhagische Diathese Risikopatienten Patienten mit: - Leukämie - Chemotherapie - Bestrahlung des Knochenmarks - Sepsis Symptome Die Symptome sind abhängig von der Lokalisation der Auswirkung: 1. Allg. Blutungen: Hämatome, Petechien, Zahnfleischblutungen, Blut im Urin, Blut im Stuhl 2. Herz-Kreislauf-System: Schwäche, Tachykardie, Dyspnoe, Lungenödem, kardiale Dekompensation 3. Gerinnungssystem: Spontanblutungen aus allen Körperöffnungen oder Punktionsstellen 4. Auge - Sehstörungen, Netzhautblutungen, Gefäßschwellungen 5. ZNS - Schwindel, Verwirrtheit, Kopfschmerzen, Orthostase, Benommenheit, Krämpfe, psychische Veränderungen Prognose Die Prognose hängt eindeutig vom Ausmaß der Thrombozytopenie, sowie von möglichen Komplikationen und Folgen ab. Therapie Thrombozytensubstitution Behandlung der Grundkrankheit Pflege Die Kontrolle hinsichtlich möglicher Blutungen sowie die Information des Patienten zum geeigneten Verhalten steht hier eindeutig im Vordergrund der Pflege Qualifikation Eine gravierende Thrombozytopenie gehört zu den lebensbedrohlichen Veränderungen. Aus diesem Grunde sollte die Pflege und Krankenbeobachtung nur einer qualifizierten Fachkraft übertragen werden. Pflegeplanung bei hämorrhagischer Diathese (allgemeiner Blutungsneigung) Pflegeproblem Gefahr der Blutung Pflegemaßnahme Pflegeziel Blutungsprophylaxe Erhalten einer intakten Haut und Schleimhaut Patient soll: - keine Wärmeanwendungen - keine heißen Bäder - keine Massagen - kein Abklopfen des Thorax - keine einengende Kleidung (Gürtel, BH) - keine Zäpfchen, rektales Fiebermessen - kein übermäßiges RR-messen - keine Nagelpflege durch Pflegekraft - kein Umgang mit scharfen oder spitzen Gegenständen Pflegeplanung bei hämorrhagischer Diathese (allgemeiner Blutungsneigung) - Fortsetzung Pflegeproblem bestehende Nasenblutung (Epistaxis) bestehende Blutung im MundRachenbereich Gastrointestinale Blutungen Pflegemaßnahme - keine verletzungsgefährdeten Arbeiten - keine i.m.-Injektionen - keine Manipulationen in Nase oder Ohren - keine grobkörnige Nahrung erhalten - sturzprophylaktische Maßnahmen durchführen - Eiskompresse oder kalten Waschlappen in den Nacken legen - Nasenflügel mit zwei Fingern zusammenpressen - Schnupfenspray mit gefäßverengenden Substanzen (Olynth, Otriven, Nasivin) anwenden - Kopf hoch lagern - behandelnden Arzt informieren - bei starker oder sistierender Blutung in die Klinik fahren (Tamponade wird dort gelegt) - Zahnpflege nur vorsichtig mit weicher Zahnbürste durchführen - mehrmals am Tag Mund mit Munddusche spülen - kein Müsli oder andere grobkörnige Nahrung essen - keine zu heißen Getränke trinken - mehrmals täglich mit KamilleSalbeitee spülen - mehrmals täglich kalten Kamille-Salbeitee trinken lassen - Arzt informieren - Stuhlbeobachtung (Melaena)/Teerstuhl - ggf. Gabe von H2-Blockern Pflegeziel - Blutung steht nach kurzer Zeit - Erhalt einer gesunden, funktionsfähigen Schleimhaut Infektionen heilen ab Blutungen stehen nach kurzer Zeit - - Erhalt einer gesunden, funktionsfähigen Schleimhaut Blutung wird frühzeitig erkannt Pflegeplanung bei hämorrhagischer Diathese (allgemeiner Blutungsneigung) - Fortsetzung Pflegeproblem Blutung im Bereich von Haut und Muskulatur Hämatome Petechien (kleine punktförmige Hautblutungen) Blutungen nach Punktionen Pflegemaßnahme - keine i.m.-Injektionen - keine ausgiebigen RRKontrollen - Sturzprophylaktische Maßnahmen - keine Massagen - Druckverband anlegen ggf. Kühlpackung auflegen Pflegeziel - Erhalt eines gesunden, funktionsfähigen Muskelgewebes - Punktionsstelle wird komprimiert, Blutung steht schnell 1.9.2.2 Thrombosen Patienten mit onkologischen Grunderkrankungen erleiden häufiger eine Thrombose als andere Patienten. Auch die Thrombosekomplikationsrate ist erhöht. Risikopatienten für Hyperkoagulabilität Patienten mit: - Dehydratation - Hypotension - Immobilisierung - Hormontherapie - Chirurgische Eingriffe - Chemotherapie - Tumorbedingte Kompression und/oder Infiltration von Gefäßen - Tumorbedingte Bildung von gerinnungsaktivierenden Faktoren (Paraneoplasie) Symptome Die Symptomatik hängt ab von der betroffenen Gefäßlokalisation: Hautbetroffenheit: Ödematöse Schwellung Extremitätenbetroffenheit: Entzündungszeichen: (Rötung, Schwellung, Schmerz und Wärme), harte Gefäßstränge, lokale Druckempfindlichkeit, Ruheschmerz, herabgesetzte oder nicht palpable Gefäßpulse, evtl. erweiterte Venen Hals-Gesichtbetroffenheit: massive Schwellung im Hals-Gesichtsbereich, gestaute Halsvenen, livide verfärbtes Gesicht Prognose Bei Beinvenenthrombosen kann sich die Thrombosierung bis in die Beckenvenen ausweiten. Lösen sich hier Thromben, kann es zur Lungenembolie kommen. Bei Thrombusbildung an den Herzklappen, besteht die Gefahr, durch Lösung einen Hirninfarkt auszulösen Therapie Prävention steht vor Therapie. Gefährdete Patienten werden heparinisiert. Pflege Alle erforderlichen Maßnahmen im Bereich der Thromboseprophylaxe werden durchgeführt Pflegeplanung für thrombosegefährdete Patienten Pflegeproblem Patient ist thrombosegefährdet Patient zeigt Thrombosezeichen Pflegemaßnahme - Sorge für ausreichend Flüssigkeit - Flüssigkeitsbilanz - Kontrolle von Ödemen - Isometrische Übungen - Frühzeitige Mobilisation - Ausstreichen der Beine (vorher mit Arzt absprechen) - anregende Waschungen - Anlegen elastischer Strümpfe oder Binden vor dem Aufstehen oder über 24 Stunden - Kontrolle und Beobachtung der Thrombosezeichen - Information des Arztes - Hochlagerung der betroffenen Körperregion - Kühlende Wickel Nach Arztanordnung: - Verabreichung entsprechender Medikamente - absolute Bettruhe - Beobachtung hinsichtlich der Thrombosezeichen/siehe Symptome - keine Massage ohne Zusage des Arztes durchführen Pflegeziel - Verdünnung des Blutes Anregen des Blutflusses Förderung der Venenfunktion (Pumpe) - Förderung des Rückflusses - Erkennen einer Thrombose Einleitung einer wirksamen Therapie Förderung des Rückflusses/ Entlastung Reduktion von Schmerzen und Entzündungszeichen 1.9.2.3 Disseminierte intravaskuläre Gerinnung (DIG) Hierbei kommt es zu einer vermehrten Gerinnung und Bildung von Thromben, insbesondere in kleinen Gefäßen und Kapillaren. Dadurch bedingt steigt der Verbrauch von Blutplättchen und Gerinnungsfaktoren (besonders von Faktor V, VII und Prothrombin) mit nachfolgender Thrombopenie. Prothrombinzeit und Plasmathrombinzeit sind verlängert. Als Konsequenz dieser Veränderungen zeigt sich schließlich eine vermehrte Bildung von Fibrinogenspaltprodukten und Fibrinolyse. Der kombinierte gesteigerte Verbrauch von Blutplättchen und Gerinnungsfaktoren steigert die Blutungsneigung. Ursache der DIG bei Tumorpatienten können freigesetzte Gewebsfaktoren sein. Risikopatienten Patienten mit: - Malignemerkrankungen (Ursachen noch nicht hinlänglich bekannt) - Patienten mit Sepsis Symptome 1. Blutungen - Hämorrhagien, vor allem Haut- und Schleimhautblutungen - Blutungen an Einstichstellen - Gastrointestinale Blutungen - Blutungen im Urogenitaltrakt 2. Thrombosen vor allem in den kleinen Gefäßen der Finger und Zehen Prognose nur bei aktiver Intensivtherapie gut Therapie - Maßnahmen zur Bekämpfung der Grundkrankheit (d. h. Therapie einer bestehenden Sepsis oder Tumorkrankheit) - bei Blutungen - Fresh-frozen-Plasma, Kryopräzipitat - bei Thrombopenie - Verabreichung von Thrombozytenkonzentraten - bei Mikrothrombenbildung - intravenöse Heparinisierung Pflege Im Vordergrund steht die intensive Überwachung, sowie eine umfassende pflegerische Betreuung. Patienten mit DIG können nicht im ambulanten Bereich betreut werden. Qualifikation: Die Überwachung kann hier nur von einer examinierten Pflegefachkraft übernommen werden. Pflegeplanung für Patienten mit DIG Pflegeproblem Patient leidet unter allgemeiner Blutungsneigung Patient blutet bereits Pflegemaßnahme Patient soll: - Verletzungen vermeiden (keine harten Zahnbürsten, keine Naßrasur) - keine Wattestäbchen zur Nasen- oder Ohrenpflege benutzen - Fußpflege nicht selbständig durchführen(darf hier nur von einer qualifizierten Pediküre durchgeführt werden) - sturzprophylaktische Maßnahmen durchführen - keine i.m.-Injektionen erhalten - keine Suppositorien bekommen - keine rektale Temperaturkontrolle durchführen - keine grobkörnigen Speisen (Müsli) essen bei Hautblutung Druckverband anlegen - Überwachung des Patienten Pflegeziel - Erhalt einer intakten, funktionsfähigen Haut und Schleimhaut - Komplikationen frühzeitig erkennen Blutung zum Stillstand bringen 1.9.3 Notfälle durch Elektrolyt- und Stoffwechselentgleisung 1.9.3.1 Tumorlysesyndrom Bedingt durch einen massiven Tumorzerfall, entweder spontan auftretend oder während Chemotherapie, kann es zu metabolischen Entgleisungen und Störungen des Elektrolythaushaltes kommen. Das Tumorlysesyndrom stellt eine lebensbedrohliche Gefahr dar. Risikopatienten Patienten mit: - bestimmten Lymphomen - Leukämien - kleinzelligem Bronchialkarzinom Symptome - Oligo- oder Anurie durch Einschränkung der Nierenfunktion mit folgender Hyperurikämie - Hyperkaliämie - Hyperphosphatämie - Hypokalzämie - Herzrhythmusstörungen - tetanische Muskelkrämpfe Prognose Das Tumorlysesyndrom stellt eine lebensbedrohliche Komplikation dar und führt, ohne erfolgreiche Behandlung, zum Tod. Therapie - ausreichende Flüssigkeitszufuhr von 3-4 Litern/24 Std. - Diuretikaapplikation zur Förderung der Diurese und Förderung der Ausscheidung von Kalium (möglichst Furosemid oder ähnliche Substanz) - Flüssigkeitsbilanzierung - Allopurinol (Zyloric) zur Vermeidung einer Hyperurikämie Pflege Patienten mit drohendem oder bestehendem Tumorlysesyndrom bedürfen einer Intensivpflege. - Kontrolle der Vitalzeichen in engen Abständen - Flüssigkeitsbilanzierung - Krankenbeobachtung Qualifikation des Pflegenden Die Betreuung von Patienten mit Tumorlysesyndrom gehört in die Hände einer onkologisch qualifizierten Pflegekraft oder sogar in die Intensivpflege Insbesondere bei bestimmten Tumoren kann es aufgrund des raschen Tumorwachstums, bei gleichzeitiger Entwicklungsverzögerung tumorversorgender Gefäße zu einem massiven Zerfall von Tumorzellen kommen. Dies geschieht auch als Folge einer Chemotherapie. Das frei werdende Kern- und Zytoplasmamaterial führt zu einer Dekompensation des Purinstoffwechsels und schließlich zur Hyperurikämie. Häufig kommt es, bedingt durch gleichzeitig ansteigende Harnsäurewerte, auch zum Nierenversagen, wodurch die Harnsäureausscheidung weiter reduziert wird. Die nun im Serum entstehenden hohen Harnsäurekonzentrationen schlagen sich auch im Bereich der Nierentubuli nieder und fördern damit das Nierenversagen. Gleichzeitig werden durch den Zellzerfall hohe Mengen Kalium und Phosphat im Blut freigesetzt, wodurch es zu Reizleitungsstörungen des Herzens, zur generellen Schwäche des Muskelgewebes bis hin zur Lähmung kommen kann. Außerdem können Zelltrümmer Kapillarschäden insbesondere der Niere verursachen. Pflegeplanung bei drohendem/bestehendem Tumorlysesyndrom Pflegeproblem Gefahr der Einschränkung der Nierenfunktion bei steigenden Harnsäurewerten Pflegemaßnahme Pflegeziel - Erhalt einer physiologischen - Sorge für eine ausreichende Nierenfunktion Flüssigkeitszufuhr (mindestens 3-4 Liter pro Tag) - Durchführung einer genauen Flüssigkeitsbilanzierung - Sorge für Durchführung der geplanten Diuretikagabe und Allopurinolverabreichung - Kontrolle des Urin-PH-Wertes (sollte um 7 liegen) - Hautbeobachtung (Hautausschlag bei Allopurinolunverträglichkeit) 1.9.3.2 Hyperkalzämie Die Erhöhung der Serumkalziumspiegel über 2,7 mmol/l wird als Hyperkalzämie bezeichnet. Hyperkalzämische Komplikationen treten relativ schnell bei onkologischen Patienten auf, wobei sich eine Häufung bei bestimmten Tumoren abzeichnet. Kalzium spielt eine wichtige Rolle bei der Reizleitungsübermittlung in den Zellen des Körpers, speziell in Herzmuskelzellen und Nervenfasern. Risikopatienten Patienten mit: - Plattenepithelkarzinom der Lunge - Prostatakarzinom - Mammakarzinom - Plasmozytom - maligneres Lymphom - T-Zell-Leukämie - Nierenzellkarzinom Symptome Die Symptome können sich in unterschiedlichen Organsystemen zeigen: - Herz: Rhythmusstörungen, Brady- oder Tachoarrhythmie, Vorhofflimmern, AV-Blockierungen - Niere: Polyurige, Nephrolithiasis, Nierenversagen - Muskulatur: herabgesetzter Muskeltonus, Schwäche - Stoffwechsel: Dehydratation (Gewichtsverlust) - ZNS/Psyche: Verwirrtheit, Persönlichkeitsveränderungen, Somnolez, Koma, Müdigkeit, Depression Prognose Unbehandelt können insbesondere die Auswirkungen auf Herz und ZNS zum Tode führen Therapie - Förderung der Diurese zur Verstärkung der Kalziumausscheidung über die Niere - Ausgleich des Flüssigkeitshaushaltes (ca. 3-4 Liter Flüssigkeit/ Tag) - Reduktion der enteralen Kalziumresorption - Reduktion der Kalziummobilisation aus dem Knochen (durch Kalzitoningabe und Verabreichung von Biphosphonaten) Cortisongabe Pflege Neben den direkt auf die Vermeidung einer hyperkälzämischen Krise ausgerichteten Maßnahmen, obliegt es den Pflegenden für eine kalziumarme Kost zu sorgen und Patient und Angehörige nach einer eingehenden Arztinformation vertiefend zu informieren. Qualifikation des Pflegenden Auch die hyperkalzämische Krise gehört zu den lebensbedrohlichen Notfallsituationen und ihr Erkennen bedarf der fachlichen Qualifikation. Pflegeplanung bei drohender oder bestehender hyperkalzämischer Krise Pflegeproblem Gefahr der kardialen Probleme (z. B. kardiale Dekompensation mit Symptomen wie Hustenreiz, Ödeme, Atemnot oder Rhythmusstörungen mit Anzeichen von Pulsveränderungen) Gefahr der Dehydratation Pflegemaßnahme - regelmäßige Krankenbeobachtung (Atmung) - regelmäßige Pulskontrollen - - Gefahr der Entstehung von Nausea/Emesis - Obstipation - Gefahr der psychoneurologischen Veränderungen: - Müdigkeit - Verwirrtheit - Somnolenz - Persönlichkeitsveränderungen - Koma auf erhöhte Flüssigkeitszufuhr achten (mindestens 2-3 Liter/Tag) Sorge für regelmäßige und konsequente Flüssigkeitsbilanzierung (evtl. Anleitung des Patienten und seiner Angehörigen) Durchführung regelmäßiger Puls- und Blutdruckkontrollen Sorge für regelmäßige Einnahme von Antiemetika Information des Patienten über ursächliche Zusammenhänge Durchführung einer effektiven Obstipationsprophylaxe Sorge für eine ausreichende Flüssigkeitszufuhr Sorge für eine kalziumarme Ernährung (keine Milchprodukte) Pflegeziel - Anzeichen einer kardiale n Dekompensation werden frühzeitig erkannt - Patient fühlt sich sicher - - - - - - Kalziumausscheidung über die Niere wird gefördert durch Verstärkung der Diurese Patient fühlt sich sicher Förderung/Erhalt einer physiologischen Magen-DarmFunktion Erhalt von Wohlbefinden Normalisierung der psychoneurologischen Situation Patient fühlt sich ausgeglichen und sicher Pflegeplanung bei drohender oder bestehender hyperkalzämischer Krise - Fortsetzung Pflegeproblem Gefahr osteolysebedingter, pathologischer Frakturen bei Mobilisation des Skelettkalzium zur Aufrechterhaltung stabiler Blut kalziumwerte Pflegemaßnahme - Information des Patienten über frakturvermeidende Bewegungsmuster (z. B. Technik zum richtigen Aufstehen aus dem Bett oder vom Stuhl) Seite 103, 104 - Durchführung sturzprophylaktischer Maßnahmen - Vorsichtiges Mobilisieren (drehende oder belastende Bewegungen vermeiden), dabei isometrische Übungen bevorzugen Pflegeziel - Erhalt eines funktionsfähigen, unverletzten Knochengerüstes - Erhalt der normalen Beweglichkeit - Erhalt/Wiederaufbau von Knochensubstanz Patienten, die unter hyperkalzämischen Störungen leiden, werden nahezu immer stationär aufgenommen, um den kardialen Störungen entsprechend schnell entgegenwirken zu können. 1.9.4. Notfälle verschiedener Ursache 1.9.4.1 Respiratorische Insuffizienz Symptome, die aus Veränderungen der Atmung resultieren, sind für den Patienten meist stark beeinträchtigend, quälend und auch schwierig zu behandeln. Unter dem Begriff der respiratorischen Insuffizienz werden verschiedene Begriffe integriert. Während der Begriff Dyspnoe eher das subjektive Empfinde n der erschwerten Atemnot und die Angst vor dem Erstickungstod charakterisier t, zielt die respiratorische Insuffizienz eher auf Veränderungen der äußeren und inneren Atmung ab. Da Dyspnoe vom Patienten oftmals gravierender wahrgenommen wird, als Verschiebungen von Sauerstoff und Kohlendioxid, soll dieser Terminus hier bevorzugt behandelt werden. Risikopatienten: Pulmonale Ursachen: - bronchiale, tumorbedingte Einengung der Atemwege - Atelektase - Pneumonie - Pneumothorax - chronisch obstruktive Lungenveränderung - Pleuraerguß - Lymphangiosis carcinomatosa - Lungenembolie - strahlentherapiebedingte Lungenfibrose Kardiale Ursachen: - Linksherzinsuffizienz - obere Einflußstauung - tumoröser Perikardbefall - Perikarderguß Neuromuskuläre Ursachen: - Schwäche der Muskulatur bei Kachexie Andere Ursachen: - Fieber - Angst - Anämie - Ascites - Hepatomegalie Symptome: - Dyspnoe (siehe oben) - Tachypnoe - Hyperpnoe - Hyperventilation Prognose Die respiratorische Insuffizienz im Terminalstadium einer Tumorerkrankung wird durch das Fortschreiten der Grunderkrankung beeinflußt. Therapie - falls möglich, Einsatz einer wirksamen Tumortherapie bei oberer Einflußstauung, bzw. Therapie einer Herzinsuffizienz - Kortikosteroide (bronchodilatatorische, anti-entzündliche, antiödematöse Wirkung) - ggf. Sedative und Anxiolytika - Bronchodilatatoren zur Erweiterung der Bronchien - Opiate (reduzieren den Atemantrieb, wirken anxiolytisch und sedierend) - Antibiotika bei Infektionen - Sauerstoffgabe Pflege Pflegerische Interventionen zielen neben der Sorge für regelmäßige Verabreichung der ärztlich verordneten Medikation vor allem auf Maßnahmen zur Verbesserung der Lebensqualität. Qualifikation der Pflegenden Zur Erfüllung entsprechend medikamentöser Maßnahmen, zur Beurteilung der aktuellen Befindlichkeit, zum Erkennen von zusätzlich auftretenden Störungen, ist eine qualifizierte Pflegekraft erforderlich. Pflegeplanung bei Respiratorischer Insuffizienz Pflegeproblem Patient leidet unter Husten, Sekret ist zähflüssig und schwer abzuhusten Pflegemaßnahme Pflegeziel - Patient kann verflüssigtes - Sorge für ausreichende Sekret leichter abhusten Flüssigkeitszufuhr - ggf. Hilfe bei Inhalationen - rhythmische Einreibungen (ASE) - ggf. Verabreichung von Sekretolytika - 3 \x tägl. 1 Tasse Thymiantee - TV-Lagerung Patient fühlt sich durch nächtliche - abends Brust-Lavendelwickel - Patient kann nachts schlafen - abends 1 Tasse Hustentee mit Hustenattacken tagsüber Codein (nach Arztanordnung) geschwächt und kann nachts nicht - Anfeuchtung der Raumluft im schlafen Schlafzimmer Patient leidet unter rasselnden Atemgeräuschen in der Terminalphase ("Death rattle"), Angehörige fühlen sich hilflos - - Lagerung in halbaufrechter Position Nach Arztanordnung Verabreichung von Scopolamin (Anticholinergikum) ggf. naso-pharyngiales Absaugen - Patient kann besser abhusten Reduktion der Sekretneubildung Patient kann nach Entfernen des Sekretes leichter durchatmen 1.9.4.2 Lungenblutung - Hämoptoe Risikopatienten Patienten mit: - Bronchialkarzinom - HNO-Tumoren - Strahlentherapie im Bereich der Lunge - Metastasen im Bereich der Lunge - Thrombopenie mit allgemeiner hämorrhagischer Diathese - Pneumonie - Lungenembolie - Tuberkulose Symptome Expektoration (Auswurf) von blutigem Husten bis hin zur massiven Blutung Prognose Abhängig vom Ausmaß der Blutung und von der Ursache. Therapie - bronchiale Absaugung - ggf. kausale Therapie z. B. mit Laserbehandlung - ggf. Radiatio - ggf. chirurgische Blutstillung - ggf. angiographische Embolisation - bei hämorhagischer Diathese, Gabe von Thrombozytenkonzentraten Bei massiv einsetzender Blutung in der Terminalphase: - Information der Angehörigen bei drohendem Notfall - Vorbereitung auf die Situation - Sedierung - Schmerzlinderung - Absaugung - Lagerung Pflege Pflege zielt hier in erster Linie auf eine angemessene psychosoziale Begleitung des Patienten. Insbesondere in der terminalen Phase gilt es weiterhin, durch zügiges Handeln Linderung zu verschaffen. Qualifikation des Pflegenden Kenntnisse über richtiges Absaugen und Umgang mit den Ängsten des Patienten sind erforderlich . Pflegeplanung bei Patienten mit Lungenblutung Pflegeproblem Patient hat Angst bei einsetzender Blutung aus den Atemwegen Patient leidet unter akuter massiver Hämoptoe in der Terminalphase Pflegemaßnahme - Patienten beruhigen, bei ihm bleiben, Sicherheit ausstrahlen - Arzt informieren - Patient in die aufrechte Körperhaltung bringen (Oberkörperhochlagerung) - Bronchialwege absaugen - Oberkörperhochlagerung - konstante Begleitung ermöglichen Pflegeziel - Patient fühlt sich begleitet, erkennt, daß Maßnahmen eingeleitet werden - Patient kann atmen Patient fühlt sich nicht alleingelassen Pflegeplanung bei Patienten mit Lungenblutung - Fortsetzung Pflegeproblem Angehörige fühlen sich hilflos, bei massiv einsetzender Blutung Pflegemaßnahme - Angehörige aus der Akutsituation der Hilflosigkeit bringen (Hektik verschlimmert die Angst des Patienten) - Erstversorgung des Patienten - Betreuung der Angehörigen (diese dürfen ihre Angst und Hilflosigkeit aussprechen, dürfen weinen) Pflegeziel - Angehörige empfinden ihre Reaktion nicht als falsch, fühlen sich verstanden 1.9.4.3 Zytostatikabedingte Alveolitis Unter Veränderungen der pulmonalen Toxizität von Zytostatika, fällt auch die zytostatikainduzierte Alveolitis. Zu unterscheiden sind die akute allergische Alveolitis (Anzeichen sind Dyspnoe, Tachypnoe und Lungenödem) von der irreversiblen Lungenfibrose. Risikopatienten für die Entstehung der Lungenfibrose, sind Patienten mit: - vorangegangener oder bestehender Strahlentherapie - Vortherapie mit Bleomycin - parallele Therapie mit Cyclophosphamid - Narkosen oder Behandlungen mit hoher Sauerstoffkonzentration in den letzten 6 Monaten - hohes Lebensalter Symptome - trockener Husten - Dyspnoe - Tachypnoe - Fieber - ggf. Rasselgeräusche Prognose: Geringfügige Veränderungen sind häufig reversibel. Spätstadien, die charakterisiert sind durch Verdickung der Aleveolarsepten, Zunahme des fibrotischen Anteils im Lungengerüst, lassen sich nicht mehr wirksam behandeln und führen zum Tod. Therapie Die wirksamste Therapie ist das Absetzen der entsprechenden zytostatischen Noxe im Frühstadium (z. B. Bleomycin, Cyclophosphamid, Carmustin (BCNU), Busulfan und Mitomycin C). Ob Glukokortikoide eine günstige Wirkung haben, ist bislang nicht ausreichend gesichert. Pflege Die Krankenbeobachtung (Atmung) bei entsprechend gefährdeten Patienten steht im Mittelpunkt pflegerischen Handelns. Qualifikation des Pflegenden Entspechende Kenntnisse zur Atembeobachtung sind erforderlich. Pflegeplanung bei Patienten mit drohender/bestehender Lungenfibrose Pflegeproblem Patient leidet unter trockenem Husten Pflegemaßnahme - Durchführung einer differenzierten Atembeobachtung - Arztinformation - Durchführung von Pflegeziel - lungenfibrotische Veränderungen werden frühzeitig erkannt. - Veränderung der Therapie wird erwirkt Maßnahmen zur allg. Hustenstillung (z. B. hustenstillende Tees, Codein) - Patient erfährt Maßnahmen zur Verbesserung seiner Situation, fühlt sich nicht aufgegeben. 1.9.4.4 Akut auftretende Sepsis Im Gegensatz zu einer lokal auftretenden Infektion, handelt es sich bei Sepsis um eine regelrechte Überschwemmung des Blutes mit Keimen. Entsprechend schwer ist das Krankheitsbild und die Gefahr der Lebensbedrohung. Risikopatienten Patienten mit: - Neutropenie (bei länger als 3 Wochen persistierender Neutropenie erleiden nahezu 10 % der Patienten eine Sepsis) - Plamozytom - Leukämie - Strahlen- oder Chemotherapie - zentralvenösen Kathetern - Infekte des Respirationstraktes Symptome - hohes Fieber - Tachykardie - Exsikkose - Störungen des Bewußtseins - Niereninsuffizienz - Gerinnungsstörungen (DIG) - Eine Sepsis kann bei Tumorpatienten oder unter Chemotherapie atypisch verlaufen. Prognose Die Prognose hängt vom Allgemeinzustand des Patienten, von der Keimart, der Effizienz einer Behandlung, Alter und Vorerkrankungen ab. Therapie - prophylaktische orale Darmdekontamination - Breitband-Antibiotika - Antimykotika - ggf. Leukozytenstimulierende Faktoren - die weitere Therapie erfolgt je nach Erregerart und Lokalisation eines möglichen Ausgangsherdes Pflege Pflegerisches Handeln zielt vor allem auf die Prävention einer Infektion. Bei bereits aufgetretenen Infekten steht vor allem die Aufklärung des Patienten und seiner Angehörigen über geeignetes Verhalten, die Durchführung entsprechender hygienischer und medizinisch-pflegerischer Maßnahmen im Vordergrund. Qualifikation des Pflegenden Während vor wenigen Jahren Patienten mit sinkenden Granulozytenzahlen stationär aufgenommen wurden, wird der Patient heute, wegen der Gefahr der Infektion mit opportunistischen und krankenhausstabilen Keimen, länger im eigenen häuslichen Umfeld belassen. Pflegende, die diese Patienten betreuen, müssen ein weitreichendes onkologisches Basiswissen besitzen. Pflegeplanung bei Infektneigung findet sich unter allgemeiner Pflege, Seite 146 1.9.4.5 Hirnblutung Prinzipiell kann bei onkologischen Patienten jede erdenkliche Form einer Blutung im Hirn auftreten. Es zeigen sich dann die typischen Apoplexiesymtome. Behandlungs- und Pflegeschemata entsprechen dort dem Apoplektischen Insult. An dieser Stelle soll daher nur kurz auf die akute Hirnblutung bei onkologischen Patienten eingegangen werden. Risikopatienten Patienten mit: - Tumoren oder Metastasen im Hirnbereich - allgemeiner hämorrhagischer Diäthese - Infektionen im Gehirn - Schädelbestrahlung - hohem Alter Symptome bei onkologischen Patienten meist als gravierende Blutung auftretend: - zunehmende Bewusstseinstrübung - Kopfschmerzen - Sehstörungen - Schwindel - Koordinationsstörungen - Sensibilitätsstörungen - Kau- und Schluckstörungen - zunehmende Halbseitensymptomatik - Sprechstörungen - Psychische Veränderungen Prognose Bei höherem Alter, infamster Prognose der Tumorerkrankung oder gravierenden Blutungen, werden nur eingeschränkt invasive Maßnahmen durchgeführt. Therapie - Neurochirurgische Maßnahmen nur bei guter Prognose - ansonsten lebensqualitätsverbessernde Maßnahmen: Sedation, Schmerzmedikation - Kortikosteroide Pflege Pflegerisches Handeln zielt vor allem auf die Vermeidung einer Hirnblutung, d. h. auf die Durchführung der Sturzprophylaxe, Blutungsprophylaxe, Hilfe in der Ausführung der Aktivitäten des täglichen Lebens. Qualifikation der Pflegenden Kenntnisse über Ursachen einer Hirnblutung, Anzeichen und Maßnahmen bei aufgetretener Hirnblutung sollten vorhanden sein. Da eine entsprechende Pflegeplanung sich immer an den Symptomen, d. h. am jeweilig betroffenen Hirnareal orientiert, kann sie an dieser Stelle pauschal nicht aufgenommen werden.