Abfolge Werkstoff-Workshop IdeenExpo 2011
Werbung

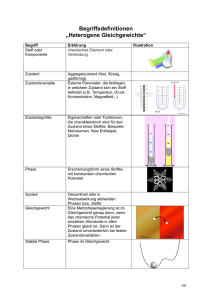
Schulworkshop Gießereitechnik der TU Clausthal für naturwissenschaftliche Kurse der Oberstufe an Gymnasien Im Workshop Gießereitechnik der TU Clausthal an Gymnasien (Dauer 90 – 135 Minuten) wird im praktischen Teil das Formgebungsverfahren Handformen im Sandguss vorgeführt oder auch in mehreren Gruppen von den SchülerInnen selbst durchgeführt. Im Mittelpunkt des theoretischen Teils des Gießerei-Workshops steht eine elementare Einführung in die Welt der Phasendiagramme. Diese grenzen in Abhängigkeit von der Temperatur und chemischer Zusammensetzung die Bereiche fester und flüssiger Phase gegeneinander ab und sind die ‚Landkarte’ der Werkstoffeigenschaften des Gießereiingenieurs.1 Alle Experimente dienen dem Ziel, durch Analogiebeispiele den Schülerinnen und Schülern eine qualitative Vorstellung davon zu vermitteln, was der Materialwissenschaftler unter einer Phase versteht und welche Parameter die Phasenübergänge von flüssig nach fest beeinflussen. Ist der Ausschnitt des Phasendiagramms, dem eine Schmelze zugeordnet werden kann, im Wesentlichen bekannt, können aus dem Kurvenverlauf der Abkühlung der Schmelze die im Innern der Schmelze ablaufenden Umwandlungsvorgänge aufgrund der freigesetzten Kristallbildungswärme erschlossen werden. Je nach System weist die Abkühlungskurve charakteristische Knick- und Haltepunkte auf. Diese Methode der Untersuchung einer Schmelze wird Thermische Analyse genannt und kann zur Qualitätskontrolle vor einem Abguss eingesetzt werden. Auf deren praktische Vorführung steuert der Workshop hin; sie beschließt den Workshop. Die Vorführung erfolgt anhand einer unter-, einer eutektischen und einer übereutektischen Al-Si-Schmelze. Die Phasenumwandlung wird von der Aufnahme innerer Energie (Aufschmelzen) oder Freisetzen innerer Energie begleitet. Wird (zeitweilig) keine innere Energie mehr freigesetzt, schreitet die äußere Abkühlung wieder fort. Der ‚Knick- oder Haltepunkt’ ändert seine Verlauf und nähert sich der Newton’schen Abkühlungskurve: Die vormals flüssige Schmelze hat einen Phasenübergang vollzogen. Sofern in der festen Phase keine Kristallumwandlungsprozesse mehr stattfinden, hat das Metall einen neuen thermodynamisch stabilen Bereich erreicht – ein neues Energieminimum. Mit der Thermischen Analyse, der Aufzeichnung der Zeit/Temperaturkurve kann der Gießereiingenieur daher beim Phasenübergang von flüssig nach fest in die Schmelze ‚hineinschauen’. Um nun bei den Schülerinnen und Schülern eine physikalische Grundvorstellung für die Bedeutung von stabilen und labilen Gleichgewichtspunkten zu vermitteln, wird zunächst die Analogie mit dem tiefsten Punkt einer gebogenen Schale gewählt – eine Kugel sitzt im Potentialminimum der konkaven Halbschale. Das ist ein stabiler Gleichgewichtsbereich. Aus geringsten Störungen treibt das System ins Potenzialminimum zurück – diese Situation entspricht dem weiten Temperaturfenster flüssiger oder fester Phasen. Es kann nur eine Phase stabil vorliegen. Säße die Kugel aber auf dem Krümmungsbogen einer konvexen Schale, so würde das System bei kleinsten Störungen aus dem labilen Gleichgewicht umkippen in Richtung neuer, 1 Diese Aussage stimmt exakt nur, wenn (mindestens) das ZTU-Diagramm hinzugenommen wird. Durch zeitlich gesteuerte, definierte Wärmezufuhr und Wärmeentzug im festen Zustand können Kristallumwandlungen ausgelöst werden, welche die Eigenschaften maßgeblich verändern. Das ZTU-Diagramm steht senkrecht auf dem, in Abhängigkeit von der Anzahl der Hauptlegierungsbestandteile mehrdimensionalen Phasendiagramm. Der Workshop wählt immer (plakative) Vereinfachungen. thermodynamisch stabiler Gleichgewichtslagen. Diese Situation entspricht dem Übergang über eine Phasengrenze hinweg – von Flüssig nach Fest oder vice versa. An den Übergangspunkten – oder in den Übergangsbereichen labiler Gleichgewichtslagen2 bestehen zwei Phasen gleichzeitig. Was dies bedeutet, soll mit einer Analogie verdeutlicht werden: Unterhalb von minus ein Grad Celsius befindet sich reines, festes Wassereis im thermodynamisch stabilen Zustand. Bei Null Grad Celsius existieren feste und flüssige Phase im labilen Gleichgewicht miteinander. Durch die Zugabe von Salz kann nun die Lage dieses Gleichgewichtspunktes zu tieferen Punkten verschoben werden. Diese Analogie kann mit dem einfachen Experiment von den SuS nachvollzogen werden – Ablesung der Temperatur an einem Thermometer bei mehreren, in ihrem Salzgehalt variierenden Wasser/Eisgemischen. Verbunden mit der praktischen Erfahrung der bekannten herzförmigen Taschenwärmer – beim Übergang von Flüssig nach Fest wird Kristalllisationswärme freigesetzt - ist, qualitativ das Verständnis geweckt für die prinzipielle Vorgehensweise der ‚Thermischen Analyse’: Dem Salzgehalt beim Wasser ‚entspricht’ bei der metallischen Schmelze die Art und Menge der zugegebenen Legierungsbestandteile. Im einfachen Zweistoffsystem Aluminium/Silizium kann die chemische Zusammensetzung einer Schmelze einer spezifischen Umwandlungstemperatur von Flüssig nach Fest zugeordnet werden. Aus der Aufzeichnung vieler Abkühlungskurven kann mithilfe der gewonnen Knickund Haltepunkte ein Phasendiagramm erstellt werden. Den einzelnen Phasenbereichen können sodann durch weitere materialkundliche Untersuchungen die legierungsspezifischen Werkstoffeigenschaften zugeordnet werden. So wird die ‚Landkarte’ der Gusswerkstoffe vermessen, bzw. in Neuland systematisch vorgestoßen. Und im Umkehrschluss kann - bei bekanntem System – die Qualität einer Schmelze überprüft werden. Dass in einem flüssigen Gemisch verschiedener Elemente diese einzeln, sofern sie nicht gemeinsame Mischkristallreihen bilden, wiederum unterschiedliche Übergangstemperaturen für die Umwandlung von Flüssig nach Fest aufweisen, lässt sich am Analogiebeispiel von Zucker, gelöst in heißem Wasser, und der allmählichen Ausscheidung des festen Zuckers bei Temperaturabsenkung in das umgebende, noch flüssige Wasser illustrieren, bis auch dieses, bei noch weiterer Temperaturabsenkung, fest wird und gefriert. 3 Nimmt man nun noch die phänomenologisch überraschende Umkehrung der Phasenabfolge von Fest nach Flüssig zu Gasförmig bei Wasser durch die Druckabsenkung über einer Wasseroberfläche hinzu - das Wasser siedet und gefriert sofort danach, dann hat der Vortragende alle Einflussgrößen der Aggregatszustandsänderungen Druck, Temperatur, Zusammensetzung an anschaulichen Beispielen vorgeführt: 2 Verschiebung des Phasengleichgewichts von Wasser und Eis durch Zugabe von Salz/ in erster Näherung einer Analogie zur Veränderung der Kristallisationstemperaturen verschiedener Legierungen Einführung der Latentwärme/Schmelzenergie am Beispiel des Phasenwechselmediums Taschenwärmer und den Umgebungsdruck Temperaturfenster bei Mischkristallbildungen, Temperaturpunkte bei reinen Metallen. Die reine ‚Zuckerphase wäre dann von reinem Wassereis umgeben. Die Dichteanomalie des Wassers aufgrund seiner besonderen Kristallstrukturen findet bei den Metallen natürlich nicht statt, ist aber auch für das hier verlangte Grundverständnis – was kennzeichnet eine Phasenumwandlung? - irrelevant. 3 Die Korrelation zwischen der aus dem ‚Chaos’ einer flüssigen Schmelze (alle Atome weisen nur eine Nahordnung auf) zur entstandenen, weitgehend regelmäßigen, sich räumlichen wiederholenden Kristallstruktur und den Materialeigenschaften kann in einigen Fällen auch anschaulich plausibel gemacht, wie im Falle des duktilen kubisch flächenzentrierten reinen Eisens oder dem hexagonal erstarrenden, nahezu nicht kalt umformbaren Magnesium. Die vorhandenen oder fehlenden Gleitebenen können an Modellkristallgittern vor Augen geführt werden. Wie weit die Palette möglicher Materialeigenschaften reicht, wird in dem Workshop exemplarisch an zwei Sondermetallen vorgeführt - einer Feder aus einer Nickel-TitanFormgedächtnislegierung und der Clausthaler Entwicklung einer hoch dämpfenden Legierung, welche die Schallenergie durch das ‚Umklappen’ zweier Kristallgitterzustände in innere Reibung verzehrt (Maxidamp). In einem Ausblick kann die Einstellung der Werkstoffeigenschaften durch Abschätzung der Phasenanteile nach dem Hebelgesetz erläutert werden. Jochen Brinkmann M.A. Technische Universität Clausthal Kontaktstelle Schule - Universität Adolph-Roemer-Straße 2a 38678 Clausthal-Zellerfeld Tel. 05323 72 77 55 Fax. 05323 72 77 59 http://www.we.tu-clausthal.de/