Kristallisationsgeschwindigkeit - Institut für Physikalische Chemie
Werbung

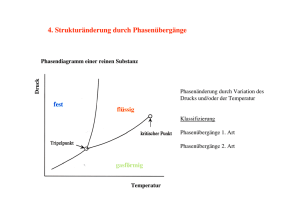
TU Clausthal Institut für Physikalische Chemie Grundpraktikum 18. KRISTALLISATIONSGESCHWINDIGKEIT Stand 03/11/2006 Kristallisationsgeschwindigkeit 1. Versuchsplatz Komponenten: - U-Rohr mit Versuchssubstanz - Thermometer - Bechergläser - Bunsenbrenner 2. Allgemeines zum Versuch Viele Werkstoffe sind kristallin (Metalle, Keramiken) oder teilkristallin (50% der technischen Polymere) und kommen während ihrer Herstellung oder Verarbeitung auch im flüssigen Zustand vor. Der Übergang in den festen Zustand erfolgt nach Abkühlen bis unter den Schmelzpunkt. Während der Erstarrung geht die Anordnung der Atome aus einer Nahordnung in eine Fernordnung über. Diese Umwandlung erfolgt in zwei Schritten. Im ersten Schritt findet die Keimbildung statt. Sie endet mit der Herausbildung wachstumsfähiger stabiler Partikel (Keime). Die zweite Stufe umfasst die Phase des Wachstums. Während des Wachstums lagern sich kontinuierlich weitere Atome an die vorhandenen Keime und schon entstandenen Kristallite an, bis die Schmelze vollständig aufgebraucht ist. Keimbildung Am Schmelzpunkt erfolgt der Übergang aus der flüssigen in die feste Phase. Die Erklärung hierfür wäre die geringere freie Volumenenergie des Festkörpers im Vergleich zur Flüssigkeit. Die frei werdende Energiedifferenz beträgt Abb. 1 Übergang vom flüssigen in den festen Zustand ∆GV und wächst mit dem Volumen des Festkörpers an. Gleichzeitig entsteht jedoch mit der festen Phase auch eine Grenzfläche zur umgebenden Flüssigkeit (Abb.1). Diese Grenzfläche ist mit einer freien Oberflächenenergie verbunden, die ebenfalls mit der Größe des Festkörpers anwächst. Die Gesamtänderung der Energie ergibt sich 1 TU Clausthal Institut für Physikalische Chemie Grundpraktikum 18. KRISTALLISATIONSGESCHWINDIGKEIT somit aus der Bilanz Oberflächenenergie: der freigesetzten Volumenenergie und Stand 03/11/2006 der verbrauchten 4 ∆G = p r 3 ∆GV + 4p r 2σ 3 Hierbei bedeuten 4/3πr3 das Volumen des kugelförmigen Keimlings mit dem Radius r, 4πr2 seine Oberfläche, σ die freie Oberflächenenergie und ∆GV die freie Volumenenergie, die mit negativem Vorzeichen in diese Abb. 2 Die freie Gesamtenergie bei der Erstarrung Bilanz eingeht (Abb. 2). Solange ändert sich mit der Größe des Körpers der Festkörper noch sehr klein ist (im Radius kleiner als r* in der Abbildung), nimmt seine freie Gesamtenergie beim Wachsen zu. Daher möchte er sich wieder auflö sen und Energie abgeben. Er befindet sich in dem noch instabilen Stadium des Embryos (Vorkeim) (Abb.3). Die Schmelze ist unterkühlt. Die Differenz von Gleichgewichtsschmelztemperatur TS und vorliegender Temperatur T ist die Unterkühlung. Erst nach Überschreiten von r* (s. Abb. 2) nimmt die Gesamtenergie mit wachsendem Radius ab. Aus dem Vorkeim hat sich ein stabiler Keim entwickelt. Die Keimbildungs phase ist abgeschlossen, und es beginnt die Wachstumsphase. Aber auch oberhalb der Schmelztemperatur können sich in kleinen Bereichen Atome ordnen. Diese Bereiche werden als Kluster bezeichnet; sie dienen als Ausgangsstufe für die Vorkeime. Abb. 3 Kluster, Vorkeime und Keime in Abhängigkeit von der Unterkühlung Bei geringer Unterkühlung kann es vorkommen, dass die „großen“ Keime auf Kosten der „kleinen“ Embryonen wachsen („die Großen fressen die Kleinen“). Dieser Vorgang wird als Ostwald-Reifung bezeichnet. Ostwald- Reifung findet auch beim Bearbeiten von heißen Metallteilen statt. Nach vielen Bearbeitungsschritten hat sich die mittlere Korngröße erhöht. Da Korngrenzen bei Metallen stark zur mechanischen Festigkeit beitragen, ist dieser Prozess in der Regel unerwünscht. Umgekehrt muss man bei geringer Unterkühlung 2 TU Clausthal Institut für Physikalische Chemie Grundpraktikum 18. KRISTALLISATIONSGESCHWINDIGKEIT Stand 03/11/2006 arbeiten, wenn man große Einkristalle erhalten will. Man muss die Anzahl der Keime klein halten. Unter homogener Keimbildung versteht man die Keimbildung in der reinen Schmelze ohne Beteiligung von Fremdkörperoberflächen. Sie setzt eine ausreichend große Unterkühlung voraus. Durch die niedrige Temperatur können sich erstens mehr Atome anhäufen und größere Vorkeime bilden, und zweitens verringert sich der kritische Radius r* als Folge des größeren energetischen Unterschieds von flüssiger und fester Phase. Homogene Keimbildung spielt Abb. 2 Glatte Erstarrungsfront kaum eine Rolle. Praktisch findet die Keimbildung an Verunreinigungen oder Behälterwänden statt, deren Oberflächen hierfür günstige energetische Bedingungen bieten. Die Keimbildung erfordert wegen der verringerten Grenzfläche weniger Atome, und die notwendige Unterkühlung ist damit geringer. Diese auf Fremdoberflächen stattfindende Keimbildung wird als heterogene Keimbildung bezeichnet. Häufig werden den Schmelzen absichtlich Fremdpartikel zugesetzt. Diesen Vorgang bezeichnet man als Kornfeinen oder Impfen. Nachdem die Keimbildung abgeschlossen ist, wächst der Festkörper durch Anlagerung von Atomen aus der Schmelze weiter an. Das Kristallwachstum ist ein im wesentlichen kinetisch bestimmter Prozess. Die äußere Form der Kristalle (der Kristallhabitus, Nadeln, Plättchen, Kuben, ...) wird dadurch bestimmt, welche Kristallflächen am schnellsten Wachsen. Der Kristallhabitus kann durch wachstumshemmende Agentien beeinflusst werden. Zu solchen Mitteln greift man z. B. um Streusalz in kubischer Form (rieselfähig) zu erhalten. Abb. 3 Dendritisches Wachstum 3 TU Clausthal Institut für Physikalische Chemie Grundpraktikum 18. KRISTALLISATIONSGESCHWINDIGKEIT Stand 03/11/2006 Der Wachstumsvorgang hängt vom Abtransport der freigesetzten Wärme ab. Diese besteht aus zwei Anteilen: der spezifischen Wärme der Schmelze und der latenten Erstarrungswärme. Spezifische Wärme wird freigesetzt, wenn sich die Schmelze bis auf die Erstarrungstemperatur abkühlt. Die latente Wärme wird erst beim Erstarrungsvorgang frei. Wenn sich die Temperatur der Schmelze oberhalb der Erstarrungstemperatur befindet, können sich an der Wachstumsfront keine Erhebungen ausbilden. Die Grenzfläche zur Schmelze verschiebt sich planar. Die latente Wärme wird von der Grenzfläche durch den Festkörper abgeleitet. Bei schwacher Keimbildung unterkühlt sich die Schmelze, bevor die Erstarrung einsetzt. Bei unterkühlter Schmelze können Erhebungen auf der Grenzfläche fest/flüssig schnell als Dendriten anwachsen. Die latente Erstarrungswärme wird an die Schmelze abgeführt und deren Unterkühlung dadurch vermindert. Dendriten wachsen solange, bis die unterkühlte Schmelze sich auf Erstarrungstemperatur erwärmt hat. Die Endgröße eines Kornes ist abhängig von der Anzahl der Keime und ihrer Verteilung. Die Kristallisationsgeschwindigkeit (Kristallvolumen pro Zeiteinheit) hängt vom Unterschied der freien Energie zwischen der Schmelze und dem Kristall ab, Abb. 4 Errstarrungsgesetze der mit zunehmender Unterkühlung zunimmt. Die Kristallisationsgeschwindigkeit ist außerdem von der Beweglichkeit der Atome abhängig, die mit zunehmender Unterkühlung abnimmt. Diese Beweglichkeit betrifft vor allem die laterale Diffusion von adsorbierten Atomen auf den Kristallflächen. Dadurch ergibt sich für eine bestimmte Temperatur ein Maximum (Abb. 6). Außerdem muss berücksichtigt werden, dass in der Grenzfläche die Schmelzwärme frei wird. Die Erstarrung kann erst fortschreiten, wenn die Wärme abgeführt wird. Die Erstarrungsgeschwindigkeit ist daher durch die Geschwindigkeit der Wärmeabfuhr begrenzt. 3. Orientieren Sie sich über − − − − Oberflächenerscheinungen reale Kristalle Grundzüge der Thermodynamik Gitterenergie 4 TU Clausthal Institut für Physikalische Chemie Grundpraktikum 18. KRISTALLISATIONSGESCHWINDIGKEIT Stand 03/11/2006 4. Literatur Ulrich – Jost G. Tamman G. Tamman M. Volmer Eugen - Wicke Klockmann P. W. Atkins Kurzes Lehrbuch der Physikalischen Chemie Kristallisieren und Schmelzen Lehrbuch der heterogenen Gleichgewichte Kinetik der Phasenbildung Grundriss der Physikalischen Chemie Lehrbuch der Mineralogie Physikalische Chemie 5. Aufgabe Bestimmen Sie die Kristallisationsgeschwindigkeit von Thymol (Tm = 51°C) in Abhängigkeit von der Temperatur im Bereich von –10°C bis 40°C in Abständen von 10°C. 6. Versuchsdurchführung Zunächst wird die sich in einem U- Rohr befindende Substanz im Wasserbad vollständig aufgeschmolzen. Anschließend bringt man das Rohr in ein Bad mit der jeweiligen Versuchstemperatur. Hat die Substanz nach einigen Minuten noch nicht begonnen zu kristallisieren, so muss der Prozess durch Zugabe eines Impfkristalls eingeleitet werden. Gemessen wird die Zeit, in der die Kristallisation ein Intervall von 30 mm durchschreitet (Stoppuhr!). Die Bestimmung ist für jede Temperatur zweimal auszuführen. 7. Auswertung Die Mittelwerte werden in mm/min umgerechnet und graphisch gegen die Temperatur aufgetragen. 8. R/S Sätze der verwendeten Chemikalien Thymol: R: 22-34 S: 1/2-26-28-36/37/39 Gesundheitsschädlich beim Verschlucken. Verursacht Verätzungen. Unter Verschluss und für Kinder unzugänglich aufbewahren. Bei Berührung mit den Augen gründlich mit Wasser abspülen und Arzt konsultieren. Bei Berührung mit der Haut sofort abwaschen Bei der Arbeit geeignete Schutzkleidung, Schutzhandschuhe und Schutzbrille / Gesichtsschutz tragen. 5