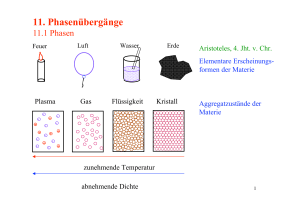
Phasenübergänge
Werbung
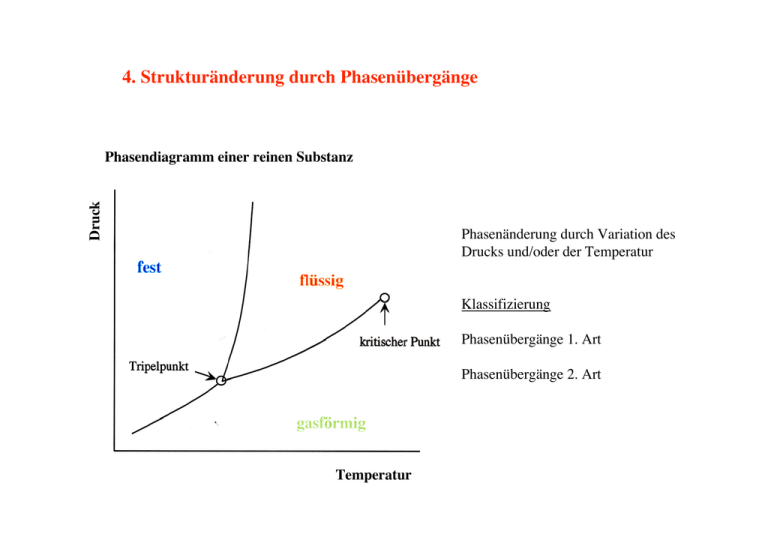
4. Strukturänderung durch Phasenübergänge Druck Phasendiagramm einer reinen Substanz Phasenänderung durch Variation des Drucks und/oder der Temperatur Klassifizierung Phasenübergänge 1. Art Phasenübergänge 2. Art Temperatur Beispiele: 1. Art 2. Art Kristallisation Kondensation Sublimation Martensitische Umwandlung Ordnung-Unordnung (AB) Bildung von Domänen (Ferroelektrika, Ferromagn. Flussgitter in Supraleitern 2) Ferroelektrizität Ferromagnetismus Supraleitung Superfluidität Ordnung-Unordnung (AB) Umwandlungen am kritischen Punkt Phasenübergänge 1. Art Charakterisierung durch: Keimbildung Latente Wärme Hysterese Effekte Keimbildung Bildung von Clustern der Tochterphase in der Mutterphase → Energiegewinn Aufbau einer Grenzfläche → Energieaufwand Clausius Clapeyron Bei der Übergangstemperatur stehen beide Phasen miteinander im thermodynamischen Gleichgewicht T = Tu → G1 ( P,T ) = G 2 ( P,T ) Entwicklung der freien Enthalpie um Tu G 1 ∂G1 ∂G 2 ∂G 2 2 ( P0 ,T0 ) + dP + dT .... = G ( P0 ,T0 ) + dP ∂P + dT ∂T ..... ∂G ∂T ∂G1 ∂G ∂G − dP S1 − S 2 ∂T ∂T = = dT ∂G1 ∂G 2 V 1 − V 2 − ∂P ∂P 1 2 Entropiesprung Volumensprung beide Phasen besitzen unterschiedliche Eigenschaften Phasenübergänge 2. Art T = Tc → ΔS = 0,ΔV = 0 Beide Phasen besitzen gleiche Eigenschaften am kritischen Punkt Keine Ausdehnungsarbeit Kein Energieaufwand Keine Grenzflächenenergie Keine Hysterese Effekte Fluktuation des Ordnungsparameters werden bei Annäherung an die kritische Temperatur sehr groß Enthalpie, Entropie und spez. Wärme Kontinuierlicher Übergang Freie Enthalpie G Diskontinuierlicher Übergang Temperatur Entropie S Temperatur Temperatur Temperatur Kontinuierlicher Übergang Spez. Wärme C Diskontinuierlicher Übergang Temperatur TÜ: Übergangstemperatur Temperatur TC: kritische Temperatur Ordnungsparameter Amorpher Festkörper Kristall Überstruktur Magnetische Ordnung Elektrische Ordnung Supraleiter Charakterisierung der Phase durch eine Größe, die sie eindeutig von allen anderen Phasen unterscheidet: Einige Beispiele: Phase Ordnungsparameter Flüssigkeit Kristall Überstruktur Ferromagnetische Ordnung Supraleiter Supraflüssigkeit Dichtedifferenz zum Gas Gittersymmetrie Anteil der richtig besetzten Gitterplätze Spontane Magnetisierung Energielücke zum normal leitenden Zustand Dichte der suprafluiden Komponente Phasenübergänge 1. Ordnung •Sprünge in den extensiven Größen am Phasenübergang •Behinderung des Anwachsens der Fluktuationen •Existenz einer Aktivierungsschwelle für die Keimbildung •Unterkühlung - Überhitzung Beispiel: Verdampfen einer Flüssigkeit V V , ΔV ≠ 0,Verdampfungswärme Dampf Flüssigkeit Phasenübergänge 1. Ordnung: Schmelzen eines Festkörpers Kristallisation einer Schmelze Strukturelle Umwandlungen in Festkörpern Aufbau einer Grenzfläche zwischen zwei verschiedenen Phasen erfordert Energie •Existenz einer Aktivierungsschwelle zur Keimbildung •Kompensation durch Erniedrigung der freien Enthalpie Freie Energie-Differenz: Treibende Kraft für den Phasenübergang Erstarrung von Flüssigkeiten: Phasenübergang 1. Ordnung Latente Wärme ∆Hf, Kristallkeimbildung Thermodynamische Variable: p,T thermodynamische Zustandsfunktion: G(p,T) = H - TS T<TL „treibende Kraft“: ∆GV = GS - GL< 0 ∆GV = 0 Schmelzpunkt TL (Liquidustemperatur) ∆Hf = TL∆Sf ΔGV = ΔH − T ΔS Unterkühlung TL ΔH = ΔH f − ∫ Δc dT L p T TL ΔS = ΔS f − ∫ T Δc pL T dT σ >0 ΔG* > 0 ΔT = TL − T > 0 Erstarren von Flüssigkeiten: Keimbildung und Unterkühlung Beobachtung: Unterkühlung → Aktivierungsschwelle → für Kristallisation Grenzflächenspannung zwischen Kristallkeim und Schmelze σ > 0 Energiebilanz für Bildung eines kugelförmigen Keims mit Radius r (für T< TL): ∆G Heterogene Keimbildung Im Gegensatz zur homogenen Keimbildung ist heterogene Keimbildung extrinsisch. Effekt: Erniedrigung des Volumens des kritischen Keims und der Aktivierungsenergie um Faktor f(θ). Spinodale van der Waals Isothermen zeigen im Zweiphasengebiet Maxima/Minima a ⎞ ⎛ ⎜⎝ p + 2 ⎟⎠ (V − b ) = NkT V Unterkühlbarkeit der Flüssigkeit: E - D Überhitzbarkeit des Gases: A - B Im Bereich D - B wird die Kompressibilität negativ KT = − 1 ∂V V ∂P Reziproke Steigung der Isothermen < 0. Thermodynamisch nicht möglich, da Volumenvergrößerung bei Druckerhöhung Überhitzung/ Unterkühlung Überhitzung: Blasenkammer z.B.: Füllung mit flüssigem Wasserstoff, Überhitzung durch rasche Expansion heterogene Keimbildung von Dampfbläschen durch extrinsische Teilchen Sichtbarmachung der Teilchenspur Unterkühlung: Nebelkammer z.B. Füllung mit Methan. Unterkühlung des Gases extrinsische Teilchen verursachen Kondensstreifen Sichtbarmachung der Teilchenspur