11. Phasenübergänge
Werbung
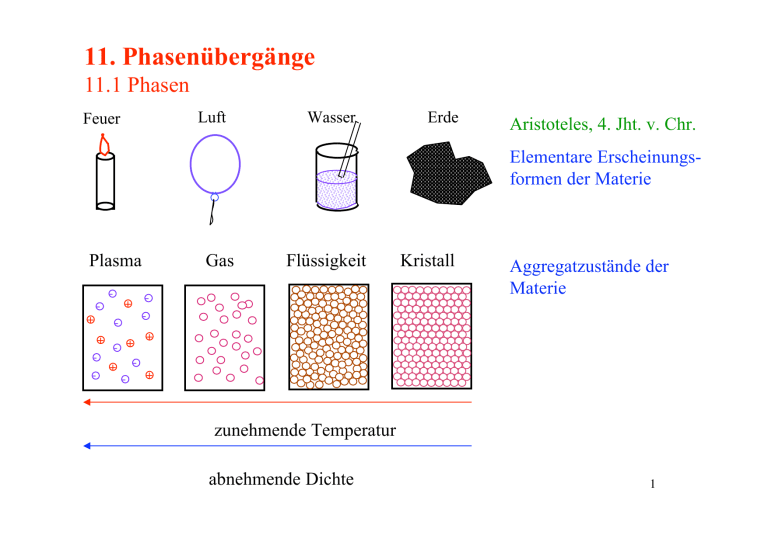
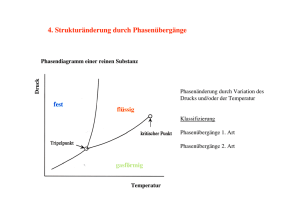
11. Phasenübergänge 11.1 Phasen Luft Feuer Wasser Erde Aristoteles, 4. Jht. v. Chr. Elementare Erscheinungsformen der Materie Plasma + - - + - + - - Gas Flüssigkeit - Kristall Aggregatzustände der Materie - + - + + + - zunehmende Temperatur abnehmende Dichte 1 11.2 Unterschiedliche Phasen im festen Zustand Amorpher Festkörper Magnetische Ordnung Kristall Überstruktur -+ -+ -+ -+ -+ -+ -+ -+ -+ -+ -+ -+ -+ -+ -+ -+ Elektrische Ordnung "quinta essentia" Supraleiter 2 Ordnungsparameter Charakterisierung der Phase durch eine Größe, Ordnungsparameter, die sie eindeutig von allen anderen Phasen unterscheidet Einige Beispiele Phase Ordnungsparameter Flüssigkeit Dichtedifferenz zum Gas Kristall Gittersymmetrie Überstruktur Anteil der richtig besetzten Gitterplätze Ferromagnetische Ordnung Spontane Magnetisierung Supraleiter Energielücke zum normalleitenden Zustand Supraflüssigkeit Dichte der suprafluiden Komponente 3 11.3 Existenzbereiche von Phasen Unter welchen Bedingungen treten welche Phasen in welchen Stoffen auf? Tc Temperatur Ising-Modell: z S = +1 S = -1 Eges = ∑ J i, j Si S j i, j Tc = J /(kB tanh( 2 −1)) Ferromagnet Paramagnet € 4 11.4 Materialkonstanten kondensierter Materie Feldgrößen: Druck P, Temperatur T, elektrisches Feld E, magnetisches Feld B, intensive Größen Thermodynamisch konjugierte Mengengrößen: Volumen V, Entropie S, elektrisches Dipolmoment me, magnetisches Dipolmoment mm, extensive Größen Produkt aus Feldgröße und Mengengröße ergibt eine Energie. Thermodynamisches Potential Φ: : Φ = E + V · P + S · T + me · E + mm·B Statische Materialkonstanten: χ ( XY ) ∂X = ∂Y X: Mengengröße Y: Feldgröße χ: verallgemeinerte Suszeptibilität 5 € Intensive Feldgrößen € € € € Extensive Feldgrößen mm (Am2) me(Asm) V (m3) S ((J/K) Y X T(K) Wärmekapazität χ (ST ) = ∂S ∂T Wärmeausdehnung P (N/m2) Piezokalorischer Effekt χ (SP ) = ∂S ∂P Kompressibilität E (V/m) B (Vs/m2) Elektrokalorischer MagnetokaloriEffekt scher Effekt χ (SE ) = ∂S ∂E Elektrostriktion χ (SB ) = ∂S ∂B Magnetostriktion ∂V χ (VT ) = ∂T € Pyroelektrischer ∂V χ (VP ) = ∂P € Piezoelektrischer ∂V χ (VE ) = ∂E € Elektrische Effekt Effekt Polarisierbarkeit Magneto-elektrischer Effekt Pyromagnetischer Effekt Piezomagnetischer Effekt scher Effekt barkeit ∂m χ (meT ) = e € ∂T ∂m χ (me P ) = e € ∂P € ∂V ∂B ∂m ∂m χ (me E ) = e χ (me B ) = e ∂E ∂B € Elektro-magneti- Magnetisier- ∂m ∂m ∂m χ (mmT ) = m χ (mm P ) = m χ (mm E ) = m € ∂T € ∂P € ∂E € χ (VB ) = € χ (mm B ) = ∂mm ∂B 6 11.5 Transportkoeffizienten Materie nicht im thermodynamischen Gleichgewicht Entstehung von Flüssen (Masse, Energie, Impuls, elektr. Ladung, etc.) Transportgleichungen: JX: Fluß (Stromdichte) = (∂X/∂t)/A FY: treibende Kraft = grad Y LXY: Transportkoeffizienten JX = LXY FY Reservoir 1 Y(1) JX A z Reservoir 2 Y(2) 7 Treibende Kraft Fluß (Stromdichte) JX FY JQ (J/m2s) grad T (K/m) Wärmeleitung Thermomech- Jm anischer (kg/m2s) Effekt JN (m-2s-1) Jq (A/m2) Soret-Effekt grad P (kg/m2s2) grad c (m-4) Mechanokal- Diffusionsrischer Effekt Wärme (Dufour) grad U (V/m) PeltierEffekt MasseTransport Diffusion ElektrizitätsLeitung 8 € 11.6 Flüssigkeiten Gas E=0 η= 10-5 kg/(ms) K ≈ 1 / bar τ ≈ 10-10 s Flüssigkeit Festkörper E≈0 η = 10-3 kg/(ms) K ≈ 10-9 / bar τ ≈ 10-8 s E = 1011 N/m2 η∞ K ≈ 10-10 / bar τ ∞ (T=0) Atomare Wechselwirkung (Lennard-Jones-Potential): 12 6 σ σ U (r ) = 4ε − r r Anziehender Term (Coulomb-WW) Abstoßender Term (Pauli-Prinzip) 9 Beschreibung der Nahordnung durch Korrelationsfunktionen g(r,t ) = g s (r,t ) + g p (r,t ) Paarkorrelationsfunktion Selbstkorrelationsfunktion Energie: € f N2 E = NkB T + 2 2V ∫ U (r ) g 2 (r ) 4 π r dr p V Potentielle Energie Kinetische Energie € Suszeptibilität: ∂E f N2 CV = = NkB + 2V ∂T V 2 ∂g p ∫ U (r ) ∂T 4πr 2 dr V 10 Paarkorrelationsfunktion einer Flüssigkeit und Nahordnung Transportkoeffizienten dynamische Vorgänge Zeitabhängigkeit der Korrelationsfunktion Brown’sche Bewegung der Atome Selbstkorrelationsfunktion gs(r,t) r2 g s (r,t ) = exp − 3/2 N 4D ⋅ t 4π ⋅ D ⋅ t ) ( V 1 Mittleres Abstandsquadrat: € r N = V ∞ 2 2 r g (r,t ) 4 π r dr ∫ s 0 Diffusionskoeffizient D: 〉 € 2 r2〉 = 6D·t 1 2 D= ν ⋅L 6 Platzwechselfrequenz ν Energieschwelle ∆ε Sprungweite L 11 11.7 Wärmekapazität Konstantes Volumen dV=0: dE CV = dT V Experiment: konstanter Druck dP=0: Umrechnung CP = CV + 9α 2p VT / κ T Verschiedene Beiträge: ges G E P C =C +C +C = E ∂E G ∂E P ∂E + + € ∂T ∂T ∂T ) ( ( ) ( ) Phononen kooperativer Anteil Elektronen CV Spezifische Wärme von Eisen Fe Gitteranteil α γ γ Elektronenanteil Ferromagnetische Umwandlung 0 300 600 900 1200 δ Schmelzen 1500 T (K) 1800 12 11.8 Änderungen der spezifischen Wärme bei Umwandlungen Kooperative Anteile treten bei Phasenübergängen auf. G Freie Enthalpie: G G = H - TS = E - PV - TS ∂G ∂G = −S; = −V ; ∂T P ∂P T ∂ 2G ∂S 2 = − = ∂T P ∂T P 1 ∂H CP = T ∂T P T S S ∆S CP ∞ Tu 1. Ordnung CP T ∞ Tc 2. Ordnung T € 13 11.9 Klassifizierung der Phasenübergänge Klassifizierung nach Phasenübergängen 1. und 2. Art und höherer Ordnung Beispiele: 1. Art 2. Art Kristallisation Kondensation Sublimation Martensitische Umwandlung Ordnung-Unordnung (A3B) Bildung von Domänen (Ferroelektrika, Ferromagnete, Flußgitter in Supraleitern 2. Art Ferroelektrizität Ferromagnetismus Supraleitung Superfluidität Ordnung-Unordnung (AB) Umwandlungen am kritischen Punkt 14 11.10 Phasenübergänge 1. Art Charakterisierung durch: Keimbildung Latente Wärme Hysterese Effekte Keimbildung: Bildung von Clustern der Tochterphase 2 in der Mutterphase 1 Energiegewinn Aufbau einer Grenzfläche Energieaufwand Phase 1 Phase 2 15 Bei der Übergangstemperatur stehen beide Phasen miteinander im Gleichgewicht T = TE G1(PE,TE) = G2(PE,TE) Entwicklung der freien Enthalpie um TE: ∂G1 ∂G1 ∂G 2 ∂G 2 2 G (PE ,TE ) + dP + dT ....... = G (PE ,TE ) + dP + dT ....... ∂P ∂T ∂P ∂T 1 Clausius-Clapeyron € € 1 2 ∂G ∂G − 1 2 dP ∂T S − S ∂T = = dT ∂G1 ∂G2 V 1 − V 2 − ∂P ∂P Entropiesprung, Volumensprung beide Phasen besitzen unterschiedliche Eigenschaften am Übergangspunkt (PE,TE) 16 Phasenübergänge 1. Ordnung • Sprünge in den extensiven Größen am Phasenübergang • Behinderung des Anwachsens der Fluktuationen • Existenz einer Aktivierungsschwelle für die Keimbildung • Unterkühlung - Überhitzung Beispiel: Verdampfen einer Flüssigkeit VDampf >> VFlüssigkeit, ∆V ≠ 0, Verdampfungswärme Phasenübergänge 1. Ordnung: Schmelzen eines Festkörpers Kristallisation einer Schmelze Strukturelle Umwandlungen in Festkörpern 17 Aufbau einer Grenzfläche zwischen zwei verschiedenen Phasen erfordert Energie: • Existenz einer Aktivierungsschwelle zur Keimbildung • Kompensation durch Erniedrigung der freien Enthalpie Energiebilanz während der Keimbildung: ΔG = 4π 3 R ⋅ ΔGV − 4π R2 ⋅ σ 3 Volumenterm € Volumen- und Grenzflächenterm haben unterschiedliche Abhängigkeit vom Keimradius ∆G durchläuft ein Maximum bei der Energieschwelle ∆G* und beim kritischen Keimradius R*! Grenzflächenterm ∆GV = G2 - G1 < 0 (T < TE): Enthalpiegewinn σ > 0: Energieaufwand durch Grenzfläche ∆G Energieschwelle ∆G* zur Aktivierung wachstumsfähiger Keime: ΔG * = 16π σ 4ΔGV 3 4πR2σ ∆G* R* R 4/3 πR3∆Gv 18 € Reaktionskinetik, Phasengleichgewicht flüssig-fest Zufuhr der Schmelzenthalpie kontrolliert das Schmelzen einer Substanz: Geschwindigkeiten der Teilreaktionen: RM: Schmelzen, RF: Erstarren Anzahl der an der Reaktion beteiligten Atome Akkomodationskoeffizienten Geometriefaktoren Schwingungsfrequenzen Aktivierungsenergien Gaskonstante 24 12 0 0 kfz/ hdp ∆Sf≈20,4 J/mol K F2, Cl2 400 krz ∆Sf≈8,5 J/mol K 800 1200 1600 Schmelztemperatur [K] ∆Hf = ∆Sf·TE 2000 ΔH f AM ≈ ln F RTE A RM Cu 2400 1800 1200 TE(Cu) RF 600 T = T E: R F = R M Ebene Grenzfläche: G M = GF Metalle: N S ≈ NL vS ≈ v L kovalente Strukturen ∆Sf≈ 15 J/mol K 36 3000 500 1000 1500 2000 Temperatur (K) Energie Schmelzenthalpie [kJ/mol] NL,S: AM,F: GM,F: vS,L: QM,F: R: RM, RF (cm/s) 3600 RM = NS·AM ·GM ·vS ·exp(-QM/RT) RF = NL·AF ·GF ·vL ·exp(-QF/RT) QF QM ∆Hf ∆Hf = QM - QF 19 11.11 Phasenübergänge 2. Art T = Tc ∆S = 0, ∆V = 0 Tc: kritische Temperatur Beide Phasen besitzen gleiche Eigenschaften am kritischen Punkt. Erste Ableitung der freien Enthalpie zeigt keinen Sprung bei Tc, sondern verläuft stetig. Extensive Größen beider Phasen am kritischen Punkt werden gleich Keine Grenzflächenenergie zwischen beiden Phasen Keine Aktivierungsschwelle zur Keimbildung Keine latente Wärme Fluktuationen des Ordnunsgparameters werden bei Annäherung an die kritische Temperatur sehr groß; Schwankungen durch Brown’sche Wärmebewegung der Atome (Molekühle) T Tc: Zunahme der Reichweite und Abnahme der Relaxationszeiten der Fluktuationen, dies gilt bei Annäherung an den kritischen Punkt von hohen und tiefen Temperaturen. 20 Kritische Fluktuationen T >> Tc Reduzierte Temperatur: Korrelationslänge: Lebensdauer: Tr = |T -Tc|/Tc ξ τ 10-5 - 10-2 (1000 - 10) nm (10-10 - 10-11) s T > Tc ξ T − T −2 / 3 c ξ ∝ Tc T − T −1/ 3 c τ ∝ Tc τ Korrelationslänge (mittlerer Radius) T ≈ Tc € Lebensdauer € Tc T Tc T Helle Quadrate: Spin oben Dunkle Quadrate: Spin unten 21 Kritische Exponenten Experiment: T ≥ T c: χ≈ (T - Tc)-1,41 γ= -1,41 Gleichbeschaffenheit beider Phasen am kritischen Punkt Verhalten thermodynamischer Eigenschaften bei Tc: A(Y ) = Ao € Y − Yc Yc z A: Y: Yc: z: Eigenschaft Feldgröße (T,P,B,E) kritischer Wert der Feldgröße kritischer Exponent z > 0: A 0 für Y Yc z < 0: A ∞ für Y Yc z = 0: logarithmische Divergenz Deutung durch Renormierungstheorie Nobelpreis 1982: K. G. Wilson Gültigkeitsbereich: 10-5 < Tr < 10-2 Atomabstand << Korrelationslänge << Probenabmessungen : Theorie: γ = -1,39 100 Ni χ 10 , 1,0 0,1 0,01 10-5 10-4 10-3 10-2 Tr 22 Universalität von Phasenübergängen 2. Ordnung Symmetrie des Ordnungsparameters: Anzahl n seiner wechselwirkenden Komponenten, n: “Spindimension” n = 1: Ising Modell n = 2: XY - Modell n = 3: Heisenberg - Modell Bedingung: kurzreichweitige Kräfte Wechselwirkungsenergie < kBT Reichweite << Korrelationslänge Universalität: Gleiche kritische Exponenten für unterschiedliche Phasenübergänge Beispiele: z < 0: Kompressibilität eines FlüssigkeitsGas-Systems, Tc: kritischer Punkt Magnetische Suszeptibilität eines Ferromagneten, Tc: Curie-Temperatur z > 0: Energielücke für Cooper-Paare in supraflüssigem 3He, Tc: Lambda-Punkt Untergittermagnetisierung des antiferroMagnetischen NiO, Tc: Néel-Temperatur Allein die geometrischen Eigenschaften der Fluktuationen bestimmen die makroskopischen Eigenschaften der Materie in der Nähe kritischer Punkte, unabhängig 23 von der Art der Wechselwirkung zwischen den Atomen!