Resultate der Behandlung sinunasaler
Werbung

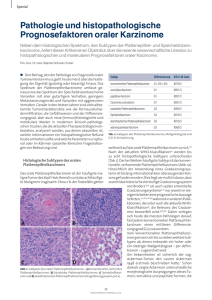
Universitätsspital Zürich Klinik für Ohren-, Nasen, Hals- und Gesichtschirurgie Vorsteher: Prof. Dr. med. S. Schmid ___________________________________________________________________________ Arbeit unter Leitung von PD Dr. med. S. Stöckli Resultate der Behandlung sinunasaler Malignome von 1980 bis 1999 INAUGURAL-DISSERTATION zur Erlangung der Doktorwürde der Medizinischen Fakultät der Universität Zürich vorgelegt von Margareta Lipp-Sauer von Rheinau ZH, Untervaz GR und Kroatien Genehmigt auf Antrag von Prof. Dr. med. S. Schmid Zürich 2003 Inhaltsverzeichnis Seite 1. Zusammenfassung Hintergrund. Sinunasale Karzinome sind selten und histologisch von grosser Variabilität. In der Literatur sind deshalb häufig nur kleine Kollektive zu finden, die Histologie ist nicht einheitlich oder die Studien erstrecken sich über lange Zeitintervalle, in denen die Diagnostik und Therapie variieren. Das Ziel der vorliegenden Arbeit ist die Auswertung der Patienten mit einem sinunasalen Malignom, die an einem einzigen Zentrum behandelt wurden über einen Zeitraum, in dem die Abklärung und Therapie für alle Patienten gleich waren. Neben Untersuchung der demographischen Daten an einer grösseren Patientenpopulation wird besonderer Wert auf die Auswertung histologisch homogener Patientengruppen gelegt. Die Daten werden mit der aktuellen Literatur verglichen. Methoden. Es wurden 150 Patienten mit einem sinunasalen Karzinom retrospektiv ausgewertet, die zwischen 1980 und 1999 an der Klinik für ORL am Universitätsspital Zürich behandelt wurden. Für die ganze Patientengruppe wurden die demographischen Daten bestimmt und die Gruppe nach Histologie, Tumorlokalisation, Stadien und Symptomen aufgeschlüsselt. Das Outcome wurde für die Karzinome mit den Untergruppen der Plattenepithel- und der Adenokarzinome sowie für die Melanome bestimmt. Resultate. Die demographischen Daten sowie die Verteilung auf die verschiedenen Histologien, Lokalisationen und Stadien entsprechen weitgehend anderen Studien. Das tumorspezifische 5-Jahres-Überleben betrug 67% für die Karzinome, 64.4% für die Adenokarzinome und 67.8% für die Plattenepithelkarzinome. Die lokoregionäre Kontrolle war 63.5% resp. 61.1% und 68.4%. Für die Melanome ist das tumorspezifische 5-JahresÜberleben 13.5% und die lokoregionäre Kontrolle nach 3 Jahren noch 9.5%. Interpretation. Unsere Daten sind vergleichbar mit den Daten aus der Literatur. Das tumorspezifische Überleben und die lokale Kontrolle sind für die Karzinome gleich oder sogar etwas besser als in den verglichenen Studien. Für die Melanome ist die Prognose sehr schlecht. In unserer Arbeit sind die Resultate noch schlechter als in der Literatur. Dies ist auf die kleinen Kollektive zurückzuführen, welche bei kleinen Änderungen der Patientenzahlen prozentual zu grossen Unterschieden führen. Schlussfolgerungen. Mit 150 Patienten haben wir eine im Vergleich zur Literatur grössere Serie. Wir haben einen Zeitraum gewählt, in dem die Patienten bezüglich Diagnostik und Therapie gleiche Voraussetzungen hatten. Für die Auswertung des Outcomes haben wir ausserdem histologisch homogene Gruppen mit statistisch genügend grossen Gruppen gewählt. Die untersuchten Parameter und die Resultate entsprechen denen aus der neueren Literatur. Einzig für die Melanome sind unsere Daten noch schlechter als die in der Literatur berichteten. Dies ist zurückzuführen auf die in allen Arbeiten vorkommenden kleinen Patientenzahlen bei einem prognostisch schlechten Tumor. 2. Einleitung 2.1. Allgemeines über sinunasale Malignome Die sinunasalen Tumoren machen ca. 3% aller Malignome im ORL-Bereich, respektive zwischen 0,3 und 1% aller Malignome aus. Es handelt sich somit um eine seltene Erkrankung. Bei den Karzinomen sind die Männer etwa doppelt so häufig befallen wie die Frauen. Als Risikofaktoren gelten organische Stäube, darunter vor allem Holzstaub sowie Nickel und Chrom (Scherer und Sack, 1996) Dadurch, dass die sinunasalen Karzinome relativ unspezifische Symptome hervorrufen (Nasenatmungsbehinderung, einseitige Rhinorrhoe), werden sie häufig erst spät und in einem lokal fortgeschrittenen Stadium entdeckt. Durch ihre enge Nachbarschaft zur Orbita und zur Schädelbasis und die geringe Metastasierungstendenz, stellen sie hauptsächlich ein lokales Problem dar. 2.2. Anatomie, Einteilung und Histologie Aufgrund des komplexen Aufbaus des Nasennebenhöhlensystems und der für die Tumorausdehnung wichtigen Nachbarschaftsbeziehungen soll die Anatomie im Folgenden kurz skizziert werden. Diese ist auch für das Verständnis der Computertomographie (CT) dieser Region von grundlegender Bedeutung. Abbildung 1 Frontalschnitt durch Nase und Nasennebenhöhlen (aus Scherer u. Sack, 1996, modifiziert nach Million u. Cassisi, 1993) Die Nasenhaupthöhle reicht vom Limen nasi bis zur Choane. Der Nasenboden wird von der Maxilla und dem Os palatinum gebildet, das Nasendach vorne durch das Os nasale und hinten durch die Lamina cribrosa, welche die Nasenhöhle von der vorderen Schädelgrube trennt. Die laterale Wand ist durch drei Nasenmuscheln gegliedert, welche den unteren, mittleren und oberen Nasengang bilden. Der untere Nasengang enthält die Ausmündung des Tränengangs. In den mittleren Nasengang münden der Sinus frontalis, die vorderen Ethmoidalzellen sowie der Sinus maxillaris. Im oberen Nasengang befindet sich die Öffnung der hinteren Ethmoidalzellen sowie das Ostium des Sinus sphenoidalis. Durch Tumoren Im Bereich der Nasenhaupthöhle kommt es durch lokale Obstruktion zu Nasenatmungsbehinderung und einseitiger Rhinorrhoe, sowie durch Verlegung der Nebenhöhlenostien zu Sinusitiden und durch Tränenwegsverlegung zu Tränenfluss. Der Sinus maxillaris ist der grösste paranasale Sinus. Seine mediale Wand bildet die laterale Nasenwand, der Boden hat enge Beziehung zu den Zahnwurzeln, die vordere Wand grenzt an die Wangenmuskulatur und das Dach der Kieferhöhle ist gleichzeitig der Orbitaboden, in dem der N. infraorbitalis verläuft. Nach hinten grenzt der Sinus maxillaris an die Fossa pterygopalatina mit den Ästen des N. trigeminus und der A. maxillaris. Durch Tumoren in der unteren Etage des Sinus maxillaris kommt es zu Zahnlockerungen, Durchbruch zum Gaumen oder in die Nasenhöhle mit Symptomen wie oben beschrieben. Tumoren der mittleren Etage brechen am häufigsten zur Wange durch und führen zu Schwellungen und Wangenhypästhesien. Bricht der Tumor nach dorsal durch, kommt es durch Destruktion der Fossa pterygopalatina zur Kieferklemme. Tumoren der oberen Etage führen vor allem zum Einbruch in die Orbita mit entsprechender Augensymptomatik. Der Sinus ethmoidalis besteht aus vorderen und hinteren Cellulae ethmoidales. Er grenzt oben an die vordere Schädelbasis. Nach lateral ist er nur durch die dünne Lamina papyracea von der Orbita getrennt und nach hinten grenzt er an den Sinus sphenoidalis. Die mediale Grenze bilden die obere und die mittlere Nasenmuschel. Die Tumoren des Sinus ethmoidalis zeigen häufig einen Einbruch nach intrakraniell oder intraorbital. Der Sinus sphenoidalis liegt im Os sphenoidale, hinter und etwas oberhalb der oberen Muschel. Die obere Wand grenzt an die vordere und mittlere Schädelgrube sowie das Chiasma opticum und die Hypophyse. An der Seitenwand befindet sich der Sinus cavernosus, A. carotis interna und die Hirnnerven II-IV. Der Boden bildet das Rachendach und das Dach der Choanen. Hinter der sehr dicken Hinterwand liegt die hintere Schädelgrube und die Pons. Bei intrakraniellem Tumordurchbruch kommt es zu starken parietal lokalisierten Kopfschmerzen. Der Sinus frontalis ist über den Ductus nasofrontalis mit der Nasenhöhle verbunden. Der Boden des Sinus frontalis ist ein Teil des Orbitadaches und die Hinterwand ein Teil der vorderen Schädelgrube. Dies sind auch die zwei typischen Stellen für den Tumordurchbruch aus der Stirnhöhle. Die untenstehende Abbildung zeigt die TNM-Einteilung der sinunasalen Tumoren gemäss UICC 1997. Tabelle 1 TNM-Einteilung gemäss UICC 1997 Histologisch zeigen die primären Nasen- und Nasennebenhöhlenkarzinome eine grosse Vielfalt. Von den malignen Tumoren finden sich am häufigsten Plattenepithel- und glanduläre Karzinome, daneben sind Lymphome, Melanome und Sarkome sowie weitere, seltenere Tumoren zu finden. 2.3. Ziel der Studie Dadurch, dass es sich bei den Nasenhöhlen- und Nasennebenhöhlenmalignomen um seltene Tumoren mit einer grossen histologischen Variabilität handelt, ist die Literatur häufig uneinheitlich oder beinhaltet kleine Patientenkollektive. In der vorliegenden Arbeit wollten wir die an der Klinik für Ohren-, Nasen,- Hals und Gesichtschirurgie des Universitätsspitals Zürich behandelten Patienten im Zeitraum von 20 Jahren bezüglich der demographischen Daten und des Outcomes auswerten. Dabei sollte besonderer Wert auf die Einteilung zu histologisch homogenen und genügend grossen Gruppen gelegt und ein Vergleich zur Literatur gezogen werden. 3. Patienten und Methode Die folgende Arbeit ist eine retrospektive Analyse aller Patienten, die wegen eines Malignoms im Bereich der Nasenhaupt- und -nebenhöhlen an der Klinik für Ohren-, Nasen-, Hals- und Gesichtschirurgie des Universitätsspitals Zürich im Zeitraum zwischen Januar 1980 und Dezember 1999 behandelt wurden. Ab 1980 wurde mit der Einführung der Computertomographie eine genauere präoperative Diagnostik und gleichzeitig eine moderne 3D-Therapieplanung in der Radiotherapie möglich, weshalb der Zeitraum der Analyse so gewählt wurde. Die Patienten wurden anhand des Diagnosecodes (ICD Code) aus der klinikinternen Datenbank identifiziert. Die Analyse erfolgte anhand der Krankengeschichten, der radiologischen Dokumente und der klinikinternen Datenbank. Die klinische Abklärung beinhaltete bei allen Patienten eine sorgfältige klinische Untersuchung mit Endoskopie der Nasenhaupthöhle und der einsehbaren Nebenhöhlen. Die Diagnose wurde in allen Fällen histologisch gesichert. Alle Patienten wurden anhand der Krankengeschichten und der radiologischen Diagnostik gemäss dem TNM-Atlas der UICC (Union Internationale Contre le Cancer) von 1997 neu eingeteilt. Somit ist die Kongruenz bezüglich Staging gewährleistet. Für das T-Stadium wurde bei allen Patienten ein Computertomogramm des Nasennebenhöhlensystems herangezogen. Das N-staging erfolgte etwas inhomogen entweder anhand der Palpationsbefunde oder durchgeführter CTs oder Sonographien. Zur Fernmetastasensuche wurden einzig konventionelle Röntgenaufnahmen des Thorax in zwei Ebenen durchgeführt. Nur bei pathologischen Befunden wurden diese mittels CT weiter abgeklärt. Das N- und M-Stadium wurde, wo nichts Anderes in den Röntgenbefunden oder Krankengeschichte vermerkt war, als N0 resp. M0 angenommen. Aufgrund dieser Abklärungen wurde entschieden, ob ein Patient kurativ behandelt werden konnte. Kurative Therapieoptionen beinhalten die chirurgische Resektion des Tumors und/oder dessen Bestrahlung. Auf die genauere Operationstechnik wird in dieser Arbeit nicht weiter eingegangen, da diese in einem Patientenkollektiv, welches sich über einen sehr langen Zeitraum erstreckt, sehr inhomogen ist. Prinzipiell wurde eine makroskopisch vollstaendige Tumorresektion durchgefuehrt, wobei die Resektionsraender aufgrund naheliegender vitaler Strukturen naturgemaess zum Teil minimal waren. Als Zugaenge zum Primaertumor wurden entweder koronare, transfrontale oder transfaziale Wege gewaehlt. Eine Neck Dissection wurde nur bei vorhandenen Lymphknotenmetastasen durchgefuehrt. Die Technik der Bestrahlung ist in diesem Zeitraum gleich geblieben. Grundsätzlich muss zwischen einer primär kurativen, einer präoperativen und einer postoperativen Radiotherapie unterschieden werden. Bei der primär kurativen Radiotherapie müssen höhere Dosen gewählt werden als für die prä- oder postoperative Therapie. Für Plattenepithelkarzinome ist eine minimale Dosis von 60 Gy in 6 Wochen erforderlich (wünschenswert sind Dosen von über 70 Gy). Prä- und postoperativ sind Dosen von 50 Gy mit Dosisaufsättigung bis 60-65Gy im Resttumorbereich oder Risikoregionen notwendig. Bei Lymphomen werden niedrigere Dosen benötigt. Je nach Lymphomtyp und -grösse sind Dosen von 40-50 Gy erforderlich. Die Felderwahl richtet sich nach der initialen Tumorausdehnung. Vor allem gegen die Orbita sollte ein ausreichender Sicherheitsabstand gewählt werden, da es bei den dünnen Orbitawänden leicht zum Tumordurchbruch kommt. Da die Lymphknoten nur in ca 10% befallen sind, wird der Lymphabfluss bei klinischem N0-Stadium nicht mitbehandelt. Die folgende Abbildung zeigt eine typische Feldanordnung für die Bestrahlung des Sinus maxillaris. Das laterale Feld ist um 10° ausgekippt, um das Gegenauge zu schonen. Abbildung 2 Dosisverteilung bei Bestrahlung des linken Sinus maxillaris durch ein ventrales und ein seitliches Bestrahlungsfeld mit Keilfiltern (aus Sack und Thesen 1993) Dosislimittierend ist die Nachbarschaft zu strahlensensiblen Strukturen wie Auge, Chiasma, Tränendrüse und ZNS. (Die Tränendrüse ist zwar nicht in der Nachbarschaft, wird aber durchstrahlt bei den seitlichen Feldern). Die Toleranz der einzelnen Organe ist aus der folgenden Tabelle ersichtlich: Organ TD 5/5 (Gy)* TD 50/5 (Gy)* Strahlenfolge Linse 10 18 Katarakt Retina 45 50 Erblindung Opticus/Chiasma 50 65 Erblindung Hirn (Temporallappen) 60 75 Nekrose Tränendrüse ca 45 ca 60 Dry-Eye-Syndrom Tabelle 2 nach Emami et al. (1991) *TD 5/5 und TD 50/5 Werte sind definiert als diejenige Gesamtdosis, nach der es in etwa 5% resp. 50% der Fälle innerhalb von 5 Jahren zu schwerwiegenden Komplikationen an dem betreffenden bestrahlten Organ kommt. Als primäre Endpunkte wurden das krankheitsspezifische und das rezidivfreie Überleben der kurativ behandelten Patienten mit Karzinomen mit den Untergruppen der Plattenepithelkarzinome und der Adenokarzinome und Melanomen. Die statistische Auswertung erfolgte mit Kaplan-Meier Überlebenskurven. Dabei wurden nur Patienten mit einem follow up von über zwei Jahren berücksichtigt. Ausserdem wurden alle Patienten , welche bei der letzten Kontrolle nicht tumorfrei waren, für die Auswertung als gestorben betrachtet. Sekundäre Endpunkte waren die Geschlechterverteilung, Altersverteilung, die Prävalenz der verschiedenen Histologien sowie die Häufigkeit der verschiedenen Therapiemodalitäten. Die Spätfolgen und Komplikationen der Therapien und die Lebensqualität der Patienten wurden nicht erfasst, da die Angaben nur unvollständig vorliegen und retrospektiv insbesondere die Lebensqualität - schwierig zu erfassen sind. 4. Resultate Im Zeitraum zwischen 1980 und 1999 wurden an der Klinik für Ohren-, Nasen-, Hals- und Gesichtschirurgie des Universitätsspitals Zürich insgesamt 165 Patienten wegen eines Malignoms der Nasenhaupt- und -nebenhöhlen behandelt. Darunter sind 10 Patienten, die primär an einer anderen Klinik behandelt wurden und 5 Patienten, deren Krankengeschichten nicht mehr auffindbar waren. Diese 15 Patienten wurden daher aus der Studie ausgeschlossen, so dass das Patientenkollektiv, welches evaluiert wurde, 150 Patienten betrug. 4.1. Geschlechterverteilung Von den 150 primär am USZ behandelten Patienten sind 56 (37%) Frauen und 94 (63%) Männer. 4.2. Altersverteilung Das Durchschnittsalter betrug 58.5 Jahre (1 - 90 Jahre) 4.3. Histologien Die Tabelle 3 zeigt die Prävalenz der verschiedenen Histologien im untersuchten Patientenkollektiv. Karzinome machen hierbei deutlich die Mehrheit aus, wobei das Plattenepithelkarzinom und das Adenokarzinom die deutlich häufigsten Histologien ausmachen. Histologie Karzinome - Plattenepithel - Adeno - Adenoidzystisch - undifferenziert Lymphome Melanom Sarkom Esthesioneuroblastom andere n (%) 77 (51,3%) -31 (20,7%) -29 (19,3%) - 8 (5,3%) - 9 (6%) 16 (10,7%) 21 (14%) 13 (8,7%) 10 (6,7%) 13 (8,7%) Tabelle 3 Praevalenz der verschiedenen Histologien (n=150) Unter der Rubrik "andere" sind folgende seltene Histologien subsummiert: 2 Plasmocytome, 2 Metastasen anderer Tumoren (Mammakarzinom, Bronchuskarzinom), 2 Mukoepidermoidkarzinome, 1 Schwannom, 1 Transitionalzellkarzinom, 1 Basalzellkarzinom, 1 Haemangiopericytom, 1 Desmoosteoblastom, 1 Ameloblastom, 1 Teratom mit Neuroblastom Von den 29 Patienten mit Adenokarzinomen haben 11 eine Holzstaubexposition gehabt und ein Patient hat in der Lederverarbeitung gearbeitet. 4.4. Lokalisation Die meisten Tumoren sind in der Nasenhaupthöhle lokalisiert. Die Nasennebenhöhlenmalignome sind manchmal so ausgedehnt, dass der Ursprungssinus nicht mehr eruierbar ist oder nicht einmal bestimmt werden kann, ob der Tumor der Nasenhaupthöhle oder -nebenhöhle entspringt. Die folgende Tabelle zeigt die Verteilung auf die Lokalisationen für alle Histologien gemeinsam sowie gesondert für die Karzinome Nasenhaupthöhle Sinus maxillaris Nasennebenhöhlen* Nasenhaupthöhle + nebenhöhlen* Sinus ethmoidalis Nasenseptum Sinus sphenoidalis total alle Histologien 68 (45.3%) 33(22.0%) 31(20.7%) 6(4.0%) nur Karzinome 33(42.9%) 28(36.4%) 2(2.6%) 4(5.2%) 9(6.0%) 2(1.3%) 1(0.7%) 150(100%) 8(10.4%) 1(1.3%) 1(1.3%) 77(100%) Tabelle 4 initiale Tumorlokalisation für alle Malignome sowie für die Karzinome allein * der Ursprungsort konnte wegen der Ausdehnung nicht genauer bestimmt werden Bei den Melanomen sind alle Tumoren in der Nasenhaupthöhle lokalisiert. Bei zwei Patienten dehnt sich der Tumor weiter in den Sinus maxillaris aus, bei 4 weiteren Patienten sind mehrere Nasennebenhöhlen mitbetroffen. 4.5. Symptome Die klassischen Symptome von sinunasalen Karzinomen sind einseitige Nasenatmungsbehinderung, Epistaxis und Schmerzen. Diese waren auch in diesem Patientengut weitaus am häufigsten. Symptome verursacht durch Infiltration in die Nachbarschaft, insbesondere in die Orbita, waren seltener. Tabelle 5 zeigt eine Zusammenfassung der von den Patienten geschilderten Symptome bei Diagnosestellung. Symptom Einseitige Nasenatmungsbehinderung Epistaxis Schmerzen wässrige oder eitrige Rhinorrhoe andere (Schwellung, Hypästhesie, Wange, Anosmie) Augensymptome(Diplopie, Exophthalmus, Epiphora, Visusabnahme) N (%) 37 (31,4%) 22 (18,6%) 19 (16,1%) 18 (15,2%) 12 (10,2%) 10 (8,5%) Tabelle 5 Häufigkeit der initialen Symptome 4.6.Verteilung der TNM-Stadien bei Karzinomen Als grösste Gruppe wurden die Karzinome weiter evaluiert (n=77). Die Tabelle 6 zeigt die Verteilung der TNM-Stadien gemäss UICC 1997 (TNM Atlas, Fourth Edition 1997). Die meisten Patienten zeigten zwar ein lokal fortgeschrittenes Tumorwachstum, jedoch meist keine regionären Lymphknotenmetastasen. Ausserdem wies kein Patient bei der Diagnosestellung Fernmetastasen auf. Lediglich bei einer Patientin wurden in der postoperativen Positronen Emmissions Tomographie (PET) disseminierte Lungenmetastasen festgestellt. N / T 0 1 4 (5,2%) 2 9 (11,7%) 3 12 (15,6%) 4 45 (58,4%) x 1 (1,3%) 1 2 total 0 (0%) 0 (0%) 4 (5,2%) 0 (0%) 0 (0%) 9 (11,7%) 1 (1,3%) 0 (0%) 13 (16,9%) 3 (3,9%) 2 (2,6%) 50 (64,9%) 0 (0%) 0 (0%) 1 (1,3%) Tabelle 6 Verteilung der TNM-Stadien bei den Karzinomen (n=77) Insgesamt mussten 50 Patienten dem Stadium T4 zugeordnet werden. Die Ursachen für diese Klassierung sind in Tabelle 7 wiedergegeben. Ursache Infiltration Orbita* und Schädelbasis Infiltration Sin. sphenoidalis und/oder Sin. frontalis Orbitainfiltration Infiltration Sin. sphenoidalis und Schädelbasis Infiltration Orbita, Sin. sphenoidalis und Schädelbasis Infiltration Orbita und Sin. sphenoidalis Epipharynxinfiltration Infiltration Schädelbasis und/oder intrakranieller Tumor Infiltration Orbita und Epipharynx Infiltration Orbita, Sin. sphenoidalis und Epipharynx Infiltration Sin. sphenoidalis und Epipharynx Infiltration Sin. sphenoidalis, Schädelbasis und Epipharynx n (%) Patienten 10 (20%) 10 (20%) 8 (16%) 5 (10%) 4 (8%) 3 (6%) 3 (6%) 3 (6%) 1 (2%) 1 (2%) 1 (2%) 1 (2%) Tabelle 7 Ursachen und Anzahl für Zuordnung zu T4 (n=50) * nur eine Infiltration des Orbitainhalts oder der Orbitaspitze wird als T4 betrachtet, jedoch nicht der alleinige Durchbruch der lamina papyracea oder die Infiltration der vorderen Augenabschnitte 4.7. Tumorstadien bei Melanomen Für die Schleimhautmelanome kann das sonst übliche Staging nach Clarke oder Breslow nicht angewandt werden. Ebensowenig existiert eine TNM Klassifikation. Die Schleimhautmelanome werden meist nach klinischem Stadium eingeteilt. In unserer Studie hatten 19 Patienten (95%) bei der Diagnose ein Stadium I (Tumor lokalisiert), kein Patient ein Stadium II (Tumor mit lokoregionären LK-Metastasen) und ein Patient (5%) ein Stadium III (Tumor und Fernmetastasen). 4.8.Therapiemodalität bei Karzinomen Von den 77 Patienten mit einem Karzinom wurden schliesslich 66 in kurativer und 11 in palliativer Absicht behandelt. Die Ursachen für die palliative Behandlung war bei allen 11 Patienten in einer lokal zu ausgedehnten Tumorausbreitung zu finden. Ein Patient zeigte zudem bei Diagnosestellung bereits Fernmetastasen, 1 Patient war zudem aus Gründen der Komorbidität nicht operabel und zwei Patienten verweigerten jegliche Therapie. Von den 11 palliativ behandelten Patienten hatten 4 ein Plattenepithel-Karzinom, 4 ein Adeno-Karzinom, 2 ein undifferenziertes und einer ein adenoidzystisches Karzinom. Die schliesslich 66 kurativ behandelten Patienten mit Karzinom wurden wie in Tabelle 8 dargestellt behandelt. alleinige Operation Operation und postoperative Radiotherapie präoperative Radiotherapie und Operation alleinige Radiotherapie 28* 25 5 8 Tabelle 8 Therapiemodalität bei Patienten mit Karzinomen (n=66) * 2 Patienten dieser Gruppe haben eine postop. Radiotherapie abgelehnt, bei einer Patientin wurde die postoperative Radiotherapie empfohen, aber der follow up fehlt. 4.9. Therapiemodalität bei den Melanomen Von den 20 Patienten mit einem histologisch gesicherten Melanom wurden vier palliativ behandelt. Drei wegen der lokalen Ausdehnung, ausserdem wies ein Patient auch Fernmetastasen auf. Von den 16 kurativ behandelten Patienten wurden alle operiert, zwei erhielten zusätzlich eine postoperative Radiotherapie. 4.10. Outcome Die Analyse des outcomes wurde nur für die Gruppe der kurativ behandelten Patienten mit einem Karzinom (n=66) (mit den Untergruppen Plattenepithelkarzinome (n=27) und Adenokarzinome (n=25)) oder einem malignen Melanom (n=16) durchgeführt, da alle anderen Gruppen zu kleine Patientenzahlen enthalten. 7 Patienten mit einem Karzinom wurden für die Auswertung ausgeschlossen, weil sie keinen follow up haben. 6 dieser Patienten kommen aus dem Ausland und bei einem finden sich keine Angaben in den Akten. Von diesen 7 Patienten hatten 3 ein Adenokarzinom, 2 ein adenoidzystisches Karzinom, einer ein Plattenepithel- und einer ein undifferenziertes Karzinom. Somit wurden 59 Patienten mit einem Karzinom respektive 26 mit einem Plattenepithel- und 22 mit einem Adeno-Karzinom ausgewertet. Bei den Patienten mit einem Melanom gibt es lediglich von einem Patienten aus Italien keinen follow up. Somit wurden noch 15 Patienten weiter ausgewertet 4.10.1. Gesamtüberleben und tumorfreies Überleben Da lediglich zwei Patienten interkurrent gestorben sind, sind die Kurven fürs Gesamtüberleben und für das tumorfreie Überleben fast identisch. Wir haben deshalb lediglich das tumorfreie Überleben bestimmt. Nachfolgend sind die Kurven fürs tumorspezifische Überleben zu sehen. 4.10.1.1. Tumorspezifisches Überleben für Patienten mit Karzinomen Abbildung 3 Kurve für tumorspezifisches Überleben aller Patienten mit einem Karzinom n=59 2-Jahres-DSS: 71% Pat. at risk: 39 3-Jahres-DSS: 69% 5_Jahres-DSS: 67% Pat. at risk: Pat. at risk: 33 26 In den ersten zwei Jahren sind die meisten tumorbedingten Todesfälle zu verzeichnen. Nach zwei Jahren beträgt das tumorfreie Überleben 71 % und fällt nach drei Jahren auf 69% und nach 5 Jahren auf 67% ab. 4.10.1.2. Tumorspezifisches Überleben für Patienten mit einem Plattenepithelkarzinom Abbildung 4 Kurve für tumorspezifisches Überleben der Patienten mit einem Plattenepithelkarzinom n=26 2-Jahres-DSS: 67.8% 3-Jahres-DSS: 67.8% 5-Jahres-DSS: 67.8% Pat. at risk: Pat. at risk: Pat. at risk: 17 15 10 Alle tumorbedingten Todesfälle bei den Patienten mit einem Plattenepithelkarzinom ereignen sich in den ersten zwei Jahren. Das tumorspezifische Überleben beträgt 68% und bleibt nach 3 und 5 Jahren gleich. 4.10.1.3. Tumorspezifisches Überleben für Patienten mit einem Adenokarzinom Abbildung 5 Kurve für tumorspezifisches Überleben der Patienten mit einem Adenokarzinom n=22 2-Jahres-DSS: 75.6% Pat. at risk: 16 3-Jahres-DSS: 75.6% Pat. at risk: 15 5-Jahres-DSS: 64.4% Pat. at risk: 12 (10-Jahres-DSS:53.6% Pat. at risk: 4) Das tumorspezifische Überleben bei Patienten mit einem Adenokarzinom beträgt nach 2 und 3 Jahren 76%, fällt nach 5 Jahren auf 64% und nach 10 Jahren weiter auf 54% ab. 4.10.1.4.Tumorspezifisches Überleben bei Patienten mit einem Melanom. Abbildung 6 Kurve für tumorspezifisches Überleben der Patienten mit einem Melanom 2-Jahres-DSS: 40.2% 3-Jahres-DSS: 20.1% 5-Jahres-DSS: 13.4% Pat. at risk: Pat. at risk: Pat. at risk: 7 4 2 Das tumorspezifische Überleben bei Patienten mit einem Melanom beträgt nach 2 Jahren lediglich noch 40% und fällt nach 3 Jahren auf 20% und nach 5 Jahren auf 13% ab (wobei nach 5 Jahren nur noch 2 Patienten at risk sind). 4.10.2. Rezidivfreies Überleben Von den 66 kurativ behandelten Patienten mit einem Karzinom haben 7 keinen follow up. Von den restlichen 59 Patienten haben 23 Patienten ein Rezidiv gehabt. Die Rezidive verteilen sich wie folgt auf die Lokalisationen: lokal Lymphknoten lokal und Matastasen Metastasen 21 0 1 1 Tabelle 9 Lokalisation der Rezidive Auffallend ist, dass kein Patient im Bereich der Lymphknoten rezidiviert ist Bezüglich der Histologie zeigt sich für die Rezidive folgende Verteilung: 9 PlattenepithelKarzinome (von 26 kurativ behandelten), 7 Adenokarzinome (von 22 kurativ behandelten), 4 adenoidzystische Karzinome (von 5 kurativ behandelten), 3 undifferenzierte Karzinome (von 6 kurativ behandelten). Die mittlere Zeit bis zum Rezidiv und die Rezidivlokalisation ist in der Tabelle 10 aufgeführt. Dabei ist auffällig, dass die Adenokarzinome die längste Latenz bis zum Rezidiv aufweisen, sogar länger als die adenoidzystischen Karzinome. Am schnellsten rezidivierten die undifferenzierten Karzinome. Die meisten Rezidive traten lokal auf, Metastasen finden sich nur zwei, eine bei Adenokarzinom und eine bei Plattenepithelkarzinom gleichzeitig mit einem Lokalrezidiv. Histologie Adenokarzinome Adenoidzystische Karzinome Plattenepithelkarzinome undifferenzierte Karzinome Mittlere Zeit in Monaten (Min./Max.) 29.3 (3-89) 28.3 (2-77) 15.6 (2-20) 7.5 (0-15) Lokalisation 6 lokal, 1 Metastase (subglottische Trachea, nach 58 Monaten) alle 4 Rezidive lokal 8 lokal, 1 lokal+Metastasen alle 3 Rezidive lokal Tabelle 10 Mittlere Zeit bis zum Rezidiv und Lokalisation Von den 16 Patienten, die kurativ behandelt wurden wegen einem Melanom hat ein Pat.keinen follow up. Von den restlichen 15 Patienten hatten 14 ein Rezidiv. Die Tabelle 11 zeigt die Rezidivlokalisationen: lokal 8 lokal und Metastasen 1 lokal und Lymphknoten und Metastasen 1 Lymphknoten 1 Metastasen 1 nicht bekannt 2* Tabelle 11 Rezidivlokalisation bei den Melanomen *von den zwei Patienten ist lediglich bekannt, dass sie am Tumor verstorben sind, jedoch nicht die Rezidivlokalisation Nachfolgend sind die Kurven für das rezidivfreie Überleben der Patienten mit einem Karzinom, mit Plattenepithel-Karzinom, Adenokarzinom und Melanom zu sehen. 4.10.2.1. Rezidivfreies Überleben aller Patienten mit einem Karzinom Abbildung 7 Kurve für rezidivfreies Überleben aller Patienten mit einem Karzinom n=59 2-Jahres-TTR: 63.5% Pat. at risk: 3-Jahres-TTR: 63.5% Pat. at risk: 5-Jahres-TTR: 63.5% Pat. at risk: ( 10-Jahres-Wert: 51.6% Pat. at 33 29 22 risk: 3) Die Rezidive treten hauptsächlich in den ersten zwei Jahren auf. Nach zwei Jahren sind noch 64% der Patienten rezidivfrei. Nach drei und fünf Jahren beträgt das rezidivfreie Überleben unverändert 64% Die Kurve fällt jedoch nach mehr als fünf Jahren wieder ab. In dieser Kurve eingeschlossen sind alle Patienten mit einem Karzinom, also auch Patienten mit einem Adenooder Adenoidzystischen Karzinom. 4.10.2.2. Rezidivfreies Überleben der Patienten mit einem Plattenepithelkarzinom Abbildung 8 Kurve für rezidivfreies Überleben der Patienten mit einem Plattenepithelkarzinom n=26 2-Jahres-TTR: 68.4% 3-Jahres-TTR: 68.4% 5-Jahres-TTR: 68.4% Pat. at risk: Pat. at risk: Pat. at risk: 17 16 10 Bei Patienten mit Plattenepithel- Karzinomen sind die Rezidive alle in den ersten zwei Jahren nach der Behandlung aufgetreten. Nach dieser Zeit sind noch 68% der Patienten rezidivfrei. Dies bleibt auch nach 3 und 5 Jahren gleich. 4.10.2.3. rezidivfreies Überleben der Patienten mit einem Adenokarzinom Abbildung 9 Kurve für rezidivfreies Überleben für Patienten mit einem Adenokarzinom n=22 2-Jahres-TTR: 61.1% 3-Jahres-TTR: 61.1% 5-Jahres-TTR: 61.1% ( 10-Jahres-TTR 45.8% Pat. Pat. Pat. Pat. at at at at risk: risk: risk: risk: 13 12 10 2) Bei Patienten mit einem Adenokarzinom treten die meisten Rezidive in den ersten zwei Jahren auf. Nach 2 Jahren sind noch 61% der Patienten krankheitsfrei, was nach 3 und 5 Jahren gleich bleibt. Die Kurve fällt jedoch nach 5 Jahren nochmals ab. Es ist dabei bemerkenswert, dass auch nach fünf Jahren ein Rezidiv lokal aufgetreten ist und keine Metastasen für die Reduktion des rezidivfreien Überlebens verantwortlich sind. ( Die Rezidive sind wie folgt aufgetreten: bei 2 Patienten sind zunächst lokal Rezidive aufgetreten nach 9 resp. 16 Monaten. Nach einer zunächst erfolgreichen Salvage- Operation sind die Patienten nach 58 resp. 42 Monaten lokal und im Bereich der Lunge rezidiviert. Drei Patienten hatten ein Rezidiv lokal nach 12, 59 und 89 Monaten und konnten erfolgreich operiert werden. Bei 4 Patienten ist lediglich ein Eintrag in der Krankengeschichte, dass sie an Tumor verstorben sind (nach 4, 6, 8 und 22 Monaten), aber nicht, ob sie nur lokal Tumor hatten oder metastasiert sind.) 4.10.2.4. Rezidivfreies Überleben für Patienten mit einem Melanom Abbildung 10 Kurve für rezidivfreies Überleben für Patienten mit einem Melanom n=15 2-Jahres-TRR: 19% 3-Jahres-TRR: 9.5% Pat. at risk: Pat. at risk: 3 2 Das rezidivfreie Überleben der Melanompatienten ist mit 19% nach 2 Jahren und 10% nach 3 Jahren sehr tief, wobei zu berücksichtigen ist, dass zu diesem Zeitpunkt lediglich noch 3 respektive 2 Patienten at risk sind. 5. Diskussion Die Tumoren der Nasenhaupt- und -nebenhöhlen, welche 3% aller ORL-Tumoren ausmachen, sind selten. Dies bedingt, dass die grösseren Serien über längere Zeitintervalle untersucht werden, in denen sich die diagnostischen und therapeutischen Möglichkeiten ändern. Ausserdem beinhalten sie auch häufig verschiedene Histologien mit unterschiedlichem biologischem Verhalten und somit verschiedenen Therapien und outcome. In unserer Arbeit haben wir den Zeitraum der Untersuchung so gewählt, dass die Patienten alle eine vergleichbare Abklärung und Therapie erhielten. Das ab 1980 eingesetzte CT (und etwas später das MRI) erlaubt einerseits eine genauere Diagnostik, andererseits die moderne Radiotherapie mit CT-gesteuerter dreidimensionaler Bestrahlungsplanung. Die Histologien haben wir voneinander getrennt untersucht. Damit sind die einzelnen Gruppen zwar kleiner und statistisch schwieriger auszuwerten, dafür aber homogener und die Aussagen relevanter. Im Zeitraum von 1980 bis 1999 sind 150 Patienten untersucht worden. Das ist eine der grösseren Serien im Vergleich mit der publizierten Literatur. In der Diskussion habe ich unsere Daten mit denen aus den Arbeiten von Dulguerov(2001), Grau(2001), Katz(2002), und Tiwari(2000) verglichen. Die Arbeit von Dulguerov zeigt die eigene Serie von 220 Patienten, welche von 1975 bis 1994 an der University of California LA und im Universitätsspital Genf behandelt wurden, sowie eine systematische Übersicht aller Arbeiten über Patienten mit Karzinomen der Nasenhaupt- und -nebenhöhlen von 1960 bis 1999. Eingeschlossen wurden nur Arbeiten mit Patientenzahlen >20 und einem follow up von mindestens 2 Jahren. Ausserdem mussten mindestens 2/3 der Patienten histologisch ein Karzinom aufweisen. In der Arbeit von Grau sind 5 retrospektive Serien aus 5 dänischen Zentren mit 315 Patienten zusammengefasst, welche von 1982 bis 1991 behandelt wurden. Diese Arbeit habe ich vor allem ausgewählt, um die demographischen Daten sowie die prozentuale Verteilung der Lokalisationen und der Histologien mit unserer Arbeit zu vergleichen. Die eher Radiotherapie- orientierte Arbeit von Katz schliesst 78 Patienten mit Karzinomen sowie Esthesioneuroblastomen ein, die von 1964 bis 1998 an der University of Florida behandelt wurden. Die Lymphome, Plasmozytome, Sarkome und Melanome wurden für die Auswertung ausgeschlossen. Hingegen wurden auch alle Patienten mit Sinus maxillarisKarzinomen ausgeschlossen. Bei Tiwari werden 59 Patienten mit Malignomen des Sinus maxillaris (43 mit Karzinomen) ausgewertet, welche von 1975 bis 1994 am Universitätsspital Amsterdam behandelt wurden. Die Daten von Melanompatienten habe ich mit den Arbeiten von Brandwein(1997) und von Patel(2002) verglichen. Brandwein wertet die Daten der eigenen 25 Patienten mit einem sinunasalen Melanom aus, welche zwischen 1977 und 1995 behandelt wurden und untersucht in einer Meta-Analyse 163 weitere Patienten bezüglich Alter, Geschlechtsverteilung, Lokalisation und outcome. Patel beschreibt das outcome von 35 Patienten mit sinunasalen und von 24 Patienten mit oralen Melanomen, die von 1978 bis 1998 behandelt wurden, und bestimmt Risikofaktoren für schlechteres Überleben. 5.1. Geschlechter- und Altersverteilung Unser Kollektiv ist bezüglich Alter und Geschlecht mit anderen Studien vergleichbar n Männer (%) Frauen (%) Mittl. Alter (Jahre) Lipp 2002 150 63 37 58.5 Dulguerov 2001 220 62 38 58 Grau 2001 315 63 37 66 Katz 2002 78 63 37 57 Tiwari 2000 59 65 35 n.a. Tabelle 12 Demographische Daten in den verschiedenen Studien 5.2. Lokalisation Die Lokalisation der Tumoren zeigt wie bei den anderen Studien, dass die Nasenhaupthöhle und der Sinus maxillaris am häufigsten betroffen sind. Zwischen den einzelnen Studien gibt es gewisse Unterschiede in der prozentualen Verteilung auf die grössten Gruppen. Neben dem erwähnten Grund der Seltenheit der Tumoren, kommt dazu, dass die meist fortgeschrittenen Tumoren mehrere Lokalisationen betreffen und deshalb schwer eindeutig einer Region zugeordnet werden können. In unserer Arbeit wie auch in der Arbeit von Dulguerov wurde die Primärokalisation in der Regel von der Austrittsdiagnose in der Krankengeschichte übernommen oder - wo diese nicht vorhanden war - aus den klinischen, radiologischen und operativen Angaben bestimmt. Tabelle 13 zeigt die Verteilung auf die verschiedenen Lokalisationen in den verschiedenen Arbeiten: unsere Arbeit 43% 36% 10% 5% 3% 1% 1% Nasenhaupthöhle Sin. maxillaris Ethmoid NNH+NHH* NNH** Nasenseptum Sin.sphenoidalis Sin.frontalis Dulguerov 30% 47% 17% 2% Grau 50% 44% 4% 3% 1% 2% Tabelle 13 Prozentuale Verteilung auf die verschiedenen Lokalisationen In allen vorliegenden Arbeiten sind die Vestibulum nasi Tumoren ausgeschlossen *Tumor so gross, dass Ursprung nicht zu bestimmen war ** Ursprungssinus nicht bestimmbar wegen Ausdehnung oder mangelnden Angaben in den Akten Bei unseren Patienten sind die Melanome alle in der Nasenhaupthöhle lokalisiert, ausserdem dehnen sie sich bei zwei Patienten in den Sinus maxillaris und bei vier Patienten in mehrere Nebenhöhlen aus. Die Melanome sind in der Arbeit von Brandwein ebenfalls alle in der Nasenhaupthöhle lokalisiert. Vier Patienten weisen ausserdem multiple Lokalisationen auf. Bei Patel waren 29 Melanome in der Nasenhaupthöhle und 6 in den Nebenhöhlen zu finden. 5.3. TNM-Stadien In unserer Arbeit weisen 2/3 der Patienten ein Stadium T4 auf, sind also lokal sehr fortgeschritten. Dies hat auch Auswirkung auf die Therapie und das outcome. Erstaunlich ist die in allen Arbeiten hohe Zahl der T3 und T4 Tumoren und dazu die vergleichsweise niedrige Zahl der positiven Lymphknoten. Dulguerov findet bei den Tumoren des Sin. maxillaris und ethmoidalis in 80% sowie 70% bei Plattenepithel- und undifferenzierten Karzinomen ein Stadium T3 oder T4. Die folgende Tabelle zeigt die Verteilung auf die verschiedenen TNM-Stadien: unsere Arbeit Dulguerov Grau Tiwari T1 5.2% 11.4% n.a. 0% T2 11.7% 23.2% n.a. 16% T3 16.9% 23.6% n.a. 47% T4 64.9% 41.8% n.a. 37% N0 92.2% 97.7% 90% 96% N+ 7.8% 2.3% 10% 4% Tabelle 14 Verteilung auf die TNM-Stadien 5.4. Tumorstadien bei Melanomen Brandwein hat die Melanome nicht alle nach Stadien, sondern vor allem nach Tumorgrösse geordnet. Bei Patel finden sich in Übereinstimmung mit unseren Daten vor allem lokalisierte M1 1.8% n.a. Stadien. Von unseren Patienten hatte lediglich einer bei der Diagnose Metastasen und keiner wies Lymphknoten auf. In der Arbeit von Patel hatten 47 Patienten ein Stadium I, 8 ein Stadium II und 4 ein Stadium III, wobei die sinunasalen und die oralen Melanome zusammengenommen wurden. Dabei wiesen vor allem die oralen Melanome Lymphknotenmetastasen auf. 5.5. Noxen Von unseren 150 Patienten hatten 11 eine Holzstaubexposition und einer hat in der Lederverarbeitung gearbeitet (total 12 Pat. (8%)). Dies deckt sich mit dem bei Grau gefundenen Resultat (27 Schreiner von insgesamt 315Patienten (9%)) 5.6. Therapiemodalität Die meisten Patienten erhielten eine kombinierte Therapie, dies wahrscheinlich wegen der meist fortgeschrittenen Stadien. Dulguerov gibt als Kriterium für eine postoperative Radiotherapie schlechte prognostische Faktoren an (Karzinome des Sinus maxillaris und ethmoidalis, Stadium T3 und T4, histologisch undifferenziertes Karzinom) Dies waren auch in unserer Arbeit die Gründe für eine prä- oder postoperative Radiotherapie, ausserdem auch eine R1- Resektion. In der Tabelle 15 sind die verschiedenen Therapiemodalitäten prozentual aufgeführt. Operation Operation und Radiotherapie Radiotherapie zusätzlich Chemotherapie unsere Arbeit* 42% 46% Dulguerov 21% 57% Grau 8% 45% Katz 0% 40% Tiwari 3% 76% 12% 6% 22% 14% 47% 15% 60% 5% 21% 29% Tabelle 15 Therapiemodalitäten bei Karzinomen *nur Patienten mit Karzinomen berücksichtigt Die Patienten mit einem Melanom wurden alle operiert. Von unseren 16 kurativ behandelten Patienten erhielten 2 (12.5%) eine adjuvante Radiotherapie. Von den 25 Patienten in der Arbeit von Brandwein wurden 6 (25%) postoperativ bestrahlt und von den 35 Patienten bei Patel waren es 14 (40%). In keiner Patientenpopulation konnten klare Kriterien für eine postoperative Radiotherapie gefunden werden. 5.7. Histologien In allen Studien sind die Karzinome am häufigsten. Bei Dulguerov wie auch bei uns machen dabei die Plattenepithel- und die Adenokarzinome ca 80% aller Karzinome aus. Die restlichen Histologien sind abgesehen vom Melanom selten. In unserer Patientenpopulation finden sich etwas weniger Plattenepithel-Karzinome und adenoidzystische Karzinome sowie mehr Adeno-Karzinome und Melanome als in den anderen angeführten Studien. Eine mögliche Erklärung ist die Seltenheit der Tumoren, wodurch kleine Änderungen in der Patientenzahl prozentual stärker ins Gewicht fallen. Eine andere Erklärung ist der Ausschluss gewisser Lokalisationen oder Histologien in den Studien, wodurch sich die prozentuale Verteilung auf die verbliebenen Histologien ändert. Die nachfolgende Tabelle zeigt den prozentualen Anteil der histologischen Gruppen bei den verschiedenen Arbeiten: PE Adenokarzinom Adenoidzyst. Karzinom unsere Daten 21% 19% 5% Dulguerov 32% 6% 9% Grau 40% 13% 7% Katz* 32% 18% 18% Tiwari** 73% 10% 10% undifferenziert Lymphome Melanome Sarkome Esthesioneurobl astome andere 6% 10% 14% 9% 7% 8% 10% 9% 13% 10% 7% 11% 12% 4% 4% n.a. ausgeschl. ausgeschl. ausgeschl. 19% n.a. n.a. n.a. n.a. n.a. 9% 1% 2% 5% 7% Tabelle 16 Prozentuale Verteilung der Histologien *ohne Sinus maxillaris-Tumoren ** nur Sinus maxillaris-Tumoren n.a.: nicht angegeben Aufgrund von Häufigkeit haben wir nur die Karzinome mit den Untergruppen der Plattenepithel- und der Adenokarzinome sowie die Melanome bezüglich outcome ausgewertet. 5.8. Outcome Wir haben unsere Daten mit der grossen eigenen Serie von Dulguerov sowie mit seiner MetaAnalyse der Daten aus den 90-er Jahren verglichen. Unser tumorspezifisches 5-Jahres-Überleben für alle Karzinome gemeinsam betrug 67%, für Adeno-Ca 64.4% und für Plattenepithel-Ca 67.8%. Das rezidivfreie Überleben betrug 63.5% resp. 61.1% resp. 68.4% Dulguerov fand ein 5-Jahres- tumorspezifisches Überleben von 78% für Adeno- und glanduläre Karzinome sowie 60% für Plattenepithel-Karzinome. Wie auch in unseren Überlebenskurven zeigte sich ein Abfall für Plattenepithel-Karzinome in den ersten 2-3 Jahren. Bei Adeno- und glandulären Karzinomen traten Rezidive bis 10 Jahre nach der Primärtherapie auf. Am schlechtesten schnitten die undifferenzierten Karzinome ab mit einem 5-Jahres-üUberleben von 40%. Diese Gruppe wurde bei uns zusammen mit der Gruppe aller Karzinome untersucht. In der Meta-Analyse der Arbeiten aus den 90-er Jahren betragen die Überlebensdaten für die Plattenepithel- und die Adeno-Karzinome 50%. Wir haben das Outcome nicht nach Stadien unterteilt ausgewertet, da für Stadien T1 und T2 die Patientenzahlen zu klein sind. In der Arbeit von Dulguerov und in seiner Meta-Analyse zeigt sich aber eine starke Abhängigkeit des Outcome vom ursprünglichen T-Stadium. In seiner eigenen Arbeit findet er 91% Überleben bei Stadium T1, 64%für T2, 70% für T3 und 50% für T4. Die Zahlen aus der Meta-Analyse betragen 90%, 70%, 44% und 28% für Stadien T1, T2, T3 und T4. Verglichen mit diesen Daten sind unsere Resultate sehr gut, insbesondere wenn der hohe Anteil der fortgeschrittenen T4-Tumoren berücksichtigt wird. Sie sind mindestens ebenbürtig, wenn nicht tendentiell besser für die Gruppe der Patienten mit Plattenepithel-Karzinomen. Für die Gruppe der Adenokarzinome sind die Resultate etwas schlechter, aber in der Arbeit von Dulguerov sind auch die prognostisch günstigeren adenoidzystischen Karzinome mit den Adenokarzinomen zusammengenommen. Für die Melanome sind die Resultate mit 13.5% 5-Jahres-Überleben und 9.5% 3-Jahresrezidivfreiem Überleben sehr schlecht. Insbesondere sind sie noch deutlich schlechter als bei Brandwein (36% 5-Jahres-Überleben) oder bei Patel (tumorspezifisches 5-Jahres-Überleben 47%). Die Resultate müssen relativiert werden wegen der naturgemäss geringen Patientenzahlen in allen Arbeiten. Ein Einfluss der postoperativen Radiotherapie (bei 12.5% unserer Patienten, bei 25% der Patienten in der Arbeit von Brandwein und 40% in der Arbeit von Patel) auf die lokale Kontrolle kann bei diesen geringen Patientenzahlen ebenfalls nicht nachgewiesen werden. 5.9. Zusammenfassung und Schlussfolgerung Die Tumoren der Nasenhöhle und der -nebenhöhlen sind selten und zeigen eine grosse histologische Variabilität. Durch die Nachbarschaft zu Orbita und Schädelbasis, dem meist lokal fortgeschrittenen Stadium bei der Diagnose und der geringen Metastasierungstendenz stellen sie vor allem ein lokales Problem dar. Die Literaturangaben sind häufig nicht einheitlich bezüglich der Histologie oder sie haben zu kleine Kollektive für eine statistisch sinnvolle Auswertung. Das Ziel unserer Arbeit war die Erfassung der an der Klinik für ORL im Universitätsspital Zürich behandelten Patienten mit einem Malignom der Nasenhöhle oder Nasennebenhöhle im Zeitraum von 1980 bis 1999. Durch die Einführung des CT wurde in den 80-ger Jahren eine verbesserte Diagnostik sowle die 3D-CT-Radiotherapieplanung möglich. Wir haben den Zeitraum so gewählt, dass die Patienten alle die gleiche Abklärung und Therapie erhielten. Ausserdem wollten wir die Histologien gesondert untersuchen, da sie sich prognostisch und therapeutisch voneinander unterscheiden. Deshalb wurde die Gruppe der kurativ behandelten Patienten mit einem Karzinom sowie die Untergruppen der Patienten mit einem Adeno- und Plattenepithelkarzinom weiter untersucht bezüglich outcome. Ebenso wurde die Patientengruppe mit einem Melanom weiter ausgewertet. Andere Histologien wurden wegen zu kleiner Patientenzahlen nicht weiter ausgewertet. Die Daten wurden anschliessend mit der Literatur verglichen. Mit 150 Patienten haben wir eine im Vergleich mit der Literatur grössere Serie. Die demographischen Daten sowie die Stadienverteilung, Verteilung auf die verschiedenen Histologien und Lokalisationen ist vergleichbar mit den anderen Studien. Das Outcome bei den Karzinomen ist mit 67% 5Jahres-Überleben und 63.5% lokaler Kontrolle ebenfalls vergleichbar mit den neueren publizierten Daten. Für gewisse Untergruppen wie Plattenepithelkarzinome isind unsere Resultate sogar besser. Sehr schlecht ist die Prognose bei den Melanomen, was sich ebenfalls mit den Daten aus der Literatur deckt. Ob sich in der Zukunft die Resultate bei den Tumoren der Nasenhöhle und -nebenhöhlen noch verbessern lassen, hängt wohl im Wesentlichen von einer Verbesserung der lokalen Kontrolle ab. Hier dürfte die neue Möglichkeit der intensitätsmodulierten Radiotherapie mit noch exakterer Bestrahlungsplanung und dadurch Möglichkeit der Applikation höherer Bestrahlungsdosen ohne erhöhte Morbidität für die umliegenden gesunden Gewebe eine wichtige Rolle spielen. Ob Immuntherapie oder die Kombination aller Therapiemodalitäten, allenfalls auch mit Chemotherapie, eine weitere Verbesserung bei der Behandlung der Schleimhautmelanome bringt, wird ebenfalls noch zu klären sein. 6. Literaturverzeichnis Dulguerov P, Jacobsen MS, Allal AS, Lehmann W, Calcaterra Th, Nasal and paranasal sinus carcinoma: are we making progress? A series of 220 patients and a systematic review. Cancer Dec 2001;92(12):3012-29 Grau C, Jacobsen MH, Harbo G, Svane-Knudsen V, Wederwang K, Larsen SK, Rytter C. Sinonasal cancer in Denmark 1982-1991 - a nationwide survey Acta Oncol 2001;40(1):19-23 Katz TS, Mendenhall WM, Morris CG, Amdur RJ, Hinerman RW, Villaret DB. Malignant tumors of the nasal cavity and paranasal sinuses. Head Neck 2002 Sep;24(9):821-9 Tiwari R, Hardillo JA, Mehta D, Slotman B, Tobi H, Croonenburg E, van der Waal I, Snow GB. Squamous cell carcinoma of maxillary sinus. Head Neck 2000 Mar;22(2):164-9 Scherrer Million/Cassisi TNM-Atlas Sack/Thesen 7. Dank und Widmung 8. Curriculum vitae Margareta Lipp-Sauer von Rheinau ZH und Untervaz GR und Kroatien 24.10.1965 Geboren in Zagreb