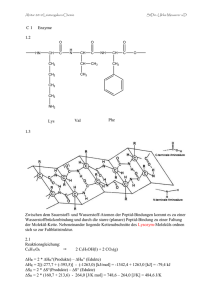
NMR - Prof. Dick
Werbung

UNIVERSITÄT REGENSBURG Institut für Physikalische und Theoretische Chemie Prof. Dr. B. Dick PHYSIKALISCH-CHEMISCHES PRAKTIKUM (Teil Ic) (Spektroskopie) Versuch NMR Protonenresonanz 0 http://www-dick.chemie.uni-regensburg.de/studium/praktikum1c.html 1 1 Theoretische Grundlagen 1.1 Magnetische Kernmomente und Kern-Zeeman-Effekt Atomkerne besitzen einen mechanischen Drehimpuls, den Kerndrehimpuls ~I. Dieser kann nur in bestimmten diskreten Größen auftreten: | ~I |= h̄ · p I · (I + 1) (1.1) Darin ist I die Kerndrehimpulsquantenzahl, die z. B. für Protonen den Wert 1/2 hat. Bezüglich einer ausgezeichneten Richtung z, die beispielsweise durch ein äußeres magnetisches Feld ~B 1 vorgegeben ist, kann ein Kerndrehimpuls nur bestimmte diskrete Orientierungen einnehmen. Iz = h̄ · MI (1.2) MI = −I, −I + 1, ..., I − 1, I . (1.3) mit Für ein Proton ist demnach MI = + 12 oder − 12 . Atomkerne haben ein magnetisches Dipolmoment~µI , das dem Kerndrehimpuls ~I proportional ist: 1 ~ als auch Zur Beschreibung eines Magnetfeldes werden in der Literatur sowohl die magnetische Feldstärke H die magnetische Flußdichte ~B verwendet. Die magnet. Flußdichte (auch magnet. Induktion) hängt im Vakuum ~ zusammen. µo = 4π ·10−7 V ·s·A−1 ·m−1 (magn. Feldkonstante). mit der magnet. Feldstärke gemäß ~B = µo H Dimensionen: i h i h A H: m B: [T ] = V ·2s m In nachfolgender Darstellung wird das Magnetfeld durch die magnet. Flußdichte ~B charakterisiert. 2 ~µI = γ ·~I |~µI |= γ· | ~I |= γ ·h̄ · (1.4) p I(I + 1) γ ist das gyromagnetische Verhältnis. Der Wert von γ läßt sich durch ein Produkt aus Naturkonstanten und einem Kern-g-Faktor gN , dessen Wert für unterschiedliche Kernarten verschieden ist, ausdrücken: γ = gN · µN · 1 h̄ (1.5) mit dem Kernmagneton µN = e ·h̄/(2 · m p) (e = Elementarladung, m p = Protonenmasse). Auch das magnetische Moment nimmt bezüglich der ausgezeichneten z-Richtung nur bestimmte Werte an: µI,z = γ ·h̄ · MI (1.6) mit dem MI -Wertbereich gemäß (1.3). Die Energie eines magnetischen Momentes in einem äußeren Magnetfeld der magnetischen Flußdichte ~B, | ~B |= B, ist E = −(~µI · ~B) (1.7) EMI = −γ ·h̄ · MI · B = −gN · µN · MI · B (1.8) und wegen (1.6) Da für ein Proton nur die MI -Werte +1/2 und -1/2 möglich sind, ergibt sich als Funktion des Magnetfeldes eine Aufspaltung der Energieniveaus gemäß Abb. 1.1. Die Energiedifferenz (Zeeman-Aufspaltung) beträgt ∆E = gN · µN · B (1.9) Diese Energiedifferenz liegt bei einer magnet. Flußdichte B von ca. 1 Tesla (= 10 000 Gauß) im Energiebereich der Mikrowellen. 3 Abbildung 1.1: Energieniveaus eines magnetischen Kernmoments in Abhängigkeit vom äußeren Magnetfeld der magnet. Flußdichte B; I =1/2. 1.2 Chemische Verschiebung Die Methode zur Untersuchung dieser energetischen Zeeman-Aufspaltung, die sog. kernmagnetische Resonanz, 2 hat für die Aufklärung von Moleküleigenschaften große Bedeutung erlangt, weil je nach der Struktur der die Kerne umgebenden Elektronensysteme eine charakteristische Verringerung (Abschirmung) des äußeren Magnetfeldes erfolgt. Diese Abschirmung wird durch die chemische Umgebung“ eines Atoms beeinflußt. Aus der kernmagnetischen ” Resonanz lassen sich deshalb Aussagen über die Elektronenstruktur von gebundenen Atomen sowie über die relative Anordnung von Atomen in Molekülen gewinnen. Die am Kernort wirksame Flußdichte B läßt sich in guter Näherung durch folgenden Ausdruck beschreiben B = B o − σ · Bo (1.10) Darin bedeuten Bo die Flußdichte des äußeren Magnetfeldes und σ die sog. Abschirmkonstante. σ ist eine kleine, stets positive Zahl (Größenordnung bei Wasserstoff: 10−5 ). Die Größe der Abschirmkonstanten wird durch folgende Faktoren beeinflußt: Induktiver Effekt: Das äußere Magnetfeld induziert in der Elektronenhülle Kreisströme; diese erzeugen am Kernort ein kleines, dem äußeren Feld entgegengesetztes Magnetfeld. Folglich wird Bo reduziert. Dieser Beitrag zu σ wird mit σloc bezeichnet. σloc ist proportional der Elektronendichte am Kernort. Anisotrope Zusatzfelder: Neben σloc kann noch ein weiterer Anteil σnonloc auftreten, der seinen Ursprung im magnetischen Einfluß von Nachbargruppen hat. Ein Beispiel ist der Ringstrom“ der Benzol-π” Elektronen durch den am Ort der Benzol-Protonen eine Erhöhung des Magnetfeldes entsteht (Entschirmung der Protonen). Es gilt immer 2 Englisch: NMR = nuclear magnetic resonance 4 |σnonloc | σloc . Der Gesamtwert der Abschirmkonstanten σ wird auch durch äußere Einflüsse, z. B. Wechselwirkungen mit dem Lösungsmittel verändert. Die Größe der Zeeman-Aufspaltung und damit die Resonanzfrequenz ν (∆E = h · ν) wird demnach durch folgende Faktoren festgelegt: • Art des Atomkerns (charakterisiert durch gN ) • Stärke des äußeren Magnetfeldes Bo • Abschirmkonstante σ (bestimmt durch die chemische Umgebung“) ” Da σ stets positiv ist, verringert sich der Abstand der Zeeman-Niveaus, wenn man von einem nackten Kern zu einem molekülgebundenen Kern übergeht (s. Abb. 1.2). Abbildung 1.2: Änderung der Zeeman-Aufspaltung durch Abschirmung des Kerns für Protonen. Die Darstellung ist nicht maßstabsgetreu. Der σ-Wert läßt sich meßtechnisch im allgemeinen dadurch erfassen, daß eine feste Frequenz νo auf die Probe eingestrahlt und dann das äußere Magnetfeld Bo variiert wird, bis Resonanz eintritt. Dabei stellt sich das Problem, daß sowohl Bo als auch νo äußerst genau bestimmt werden müßten, denn die auftretenden Effekte liegen nur in der Größenordnung von 10−5 . Da derartige Messungen meßtechnisch schwierig durchzuführen sind, bezieht man sich im allgemeinen auf eine Referenzsubstanz und betrachtet die chemische Verschiebung δ gegenüber dieser Referenz: Bei fest eingestellter Frequenz νo gilt für die Referenzsubstanz: νo = 1 · gN · µN · Bo,re f · (1 − σre f ) h 5 (1.11) und für die Probe νo = 1 · gN · µN · Bo,x · (1 − σx) . h (1.12) Eine Kombination von (1.11) und (1.12) ergibt Bo,re f · (1 − σre f ) = Bo,x · (1 − σx ) , (1.13) und nach Umformung näherungsweise: Bo,re f − Bo,x ≈ σre f − σx = δx,re f ≡ δ . Bo,re f (1.14) δ heißt chemische Verschiebung. Die (relative) Veränderung der Resonanz-Magnetfeldstärke gegenüber einer Referenz liefert demnach den Unterschied der chemischen Abschirmungen bzw. den δ-Wert (s. Tab. 1.1 und Tab. 1.2). Als Referenzsubstanz verwendet man zur Untersuchung organischer Moleküle bei der Protonenresonanz i. a. Tetramethylsilan [(CH3)4 Si ≡ T MS]. Kerne eines Moleküls, die sich durch Symmetrieoperationen des Moleküls ineinander überführen lassen, nennt man chemisch äquivalent. Chemisch äquivalente Kerne zeigen dieselbe chemische Verschiebung. Tabelle 1.1: Chemische Verschiebungen von Methyl-, Methylen- und Methin-Protonen (in ppm). Methylprotonen Proton CH3 —C CH3 —C—C=C CH3 —C—O CH3 —C=C CH3 —Ar O CH3 C @ R δ 0,9 1,1 1,4 1,6 2,3 2,2 Methylenprotonen Proton —C—CH2—C —C—CH2—C—C=C —C—CH2—C—O —C—CH2—C=C —C—CH2—Ar O —C—CH2 C @ R δ 1,4 1,7 1,9 2,3 2,7 Methinprotonen Proton —C—CH—C —C—CH—C—O 2,0 —CH—Ar 3,0 O 2,4 —C—CH @ @ —C—CH Ar O CH3 @ O 2,0 C R O 2,6 C 2,7 C O CH3 δ 1,5 —C—CH2 2,2 C @ O—R 6 O—R 3,3 C @ Ar Tabelle 1.1: Chemische Verschiebungen von Methyl-, Methylen- und Methin-Protonen (in ppm). O CH3 2,4 C @ O—Ar O CH3 O 2,0 C @ —C—CH2 @ N—R CH3 —O—R 3,3 CH3 —O—C=C 3,8 3,8 CH3 —O—Ar 2,2 C N—R —C—CH2 —C—CH2—O—H —C—CH2—O—Ar O —C—CH2 C @ R 3,4 3,6 4,3 —C—CH—O—R 3,7 —C—CH—OH 3,9 —C—CH2—N 2,5 —C—CH—N 2,8 —C—CH2—S —C—CH2—NO2 —C—CH2—C—NO2 —C—CH2—C=C—C=O CH2 C C @ C=O 2,4 4,4 2,1 2,4 —C—CH—S —C—CH—NO2 3,2 4,7 —C—CH2—Cl —C—CH2—Br —C—CH2—J 3,6 3,5 3,2 —C—CH—Br —C—CH—J 4,3 4,3 —C—CH2—C≡N 2,3 —C—CHH—C≡N 2,7 O 4,1 —C—CH 4,8 C @ Ar O CH3 3,7 C @ R CH3 —N CH3 —N + R3 CH3 —N—Ar CH3 —S CH3 —C—NO2 CH3 —C=C—C=O 2,3 3,3 3,0 2,1 1,6 2,0 C=C(CH3 )—C=O 1,8 2,4 O CH3—N 2,9 C @ R O C—CH 7 4,1 C @ R Tabelle 1.2: Bereiche der chemischen Verschiebungen von Protonen in ungesättigten Systemen. Proton δ Proton δ R—CHO Ar—CHO 9,4 - 10,0 —C=CH— 9,7 - 10,5 —C=CH—CO 4,5 - 6,0 5,8 - 6,7 H—CO—O H—CO—N —C≡C—H 8,0 - 8,2 8,0 - 8,2 1,8 - 3,1 6,5 - 7,8 4,0 - 5,0 6,0 - 8,1 —CH=C—CO —CH=C—O —C=CH—O Aromatische —CH=C—N 1 Protonen 6,0 - 9,0 —C=CH—N 1 Aromatische Heterocyclen inbegriffen 3,7 - 5,0 5,7 - 8,0 Tabelle 1.2: Bereiche der chemischen Verschiebungen von Protonen in ungesättigten Systemen. Proton δ δ Proton Ar—NH2 R—COOH ca. 3,3 Ar—OH 10,5 - 12 R—OOC—CH3 ca. 5 - 6 2,1 ROOC—CH2 —C CH3 —OH CH—OH 2,2 - 2,5 4,1 - 4,4 CH2 —OH 4,1 - 4,4 4,1 - 4,4 1.3 Spin-Spin-Kopplung Bei hoher Auflösung findet man, daß die in Abschnitt 1.2 diskutierten NMR-Signale i. a. eine Feinstruktur, sog. Multipletts, aufweisen, und daß der Abstand der Feinstrukturlinien in den Multipletts unabhängig von der Magnetfeldstärke ist. Diese Aufspaltung resultiert aus einer indirekten (durch bindende Elektronenpaare vermittelten) Wechselwirkung zwischen Kernspins, die an verschiedenen Atomen lokalisiert sind. Meistens brauchen wegen der kurzen Reichweite der Wechselwirkungen nur Spin-Spin-Kopplungen über maximal drei σ-Bindungen berücksichtigt werden. Die Energie der Spin-Spin-Kopplung zwischen zwei Kernen A und B ist → − → − JAB · I (A) · I (B) 8 → − → − Darin sind JAB die Spin-Spin-Kopplungskonstante (s. Tab. 1.3) und I (A), I (B) die Kernspin-Vektoren. Um die Multipletts interpretieren zu können, wird der Begriff der magnetischen Äquivalenz eingeführt: Zwei Kerne heißen magnetisch äquivalent, wenn sie • gleiche chemische Verschiebung haben und • die jeweils gleiche Spin-Spin-Kopplungskonstante zu jedem anderen Kern haben, der nicht die gleiche Verschiebung hat. Eine Aufspaltung in Multipletts erscheint nur dann im Spektrum, wenn magnetisch inäquivalente Kerne in Wechselwirkung treten. Unter der Wirkung von n untereinander magnetisch äquivalenten Kernen A (mit I = 1/2) spaltet das Signal eines nichtäquivalenten Kernes B (mit I = 1/2) in n+l äquidistante Multiplettlinien auf, deren Intensitätsverhältnisse sich durch Binomialkoeffizienten beschreiben lassen (Pascal’sches Dreieck). Der Abstand zwischen den einzelnen Linien des Multipletts entspricht der Kopplungskonstante JAB . Das Spin-Multiplett eines Kerns A, der mit mehreren Gruppen B, C, D, ... koppelt, die jeweils n1 , n2 , n3 , ... magnetisch äquivalente Kerne mit I = 1/2 enthalten, besteht aus insgesamt (n1 + 1) · (n2 + 1) · (n3 + 1)· .... Übergängen. Im Spektrum können diese beobachtet werden, wenn JAB , JBC , ... von sehr unterschiedlicher Größe sind. Sind die Kopplungskonstanten gleich oder nahezu gleich, so ergibt sich aufgrund der energetischen Gleichheit von Übergängen eine Verringerung auf (n1 + n2 + ... + 1) Multiplettlinien. 9 Tabelle 1.3: Spin-Spin-Kopplungskonstanten einiger Protonen-Systeme. JH,H 0 [Hz] Gesamter Typischer Bereich System @ H 0 - 25 @ 0 H @ C H—C H0 0-8 @ @ 10 - 15 @ @ ∼7 6-8 @ @ @ CH 5-7 CH 0 — C C C C C C H0 0-1 @ 7 - 10 12 - 18 14 - 16 JH,H 0 6 - 10 JH,H 00 0 - 3 JH,H 000 0 - 1 8 2 1 0 - 3,5 2 0-3 0,5 - 2 0-2 1 2-3 2,5 @ H "bb" "H " ∼6 0 - 12 @ H0 ∼7 0 b b 00 b""b H CH3 @ H0 H CH3—CH20 — CH3 System H C JH,H 0 [Hz] Gesamter Typischer Bereich H000 0 H C CH—CH0 4 - 10 5-7 C CH—CH0 C 6 - 13 10 - 13 0-3 2 5-8 7 @ CH —CH0 O C = CH — CH0 = O @ 10 C —CH @ @ @ 0 H C CH0 @ CH C C CH C CH0 CH0 @ 2 Das Meßprinzip Die Abb. 2.1 zeigt das Schema eines NMR-Spektrometers. Die Probe befindet sich in einem Magnetfeld innerhalb einer Resonatorspule. Die Resonanzfrequenz wird konstant gehalten. Das Magnetfeld läßt sich mittels einer Zusatzspule auf den Polschuhen des Magneten einfach variieren (Feldverschiebung). Sowohl an die Konstanz der eingestrahlten Hochfrequenz als auch an die Homogenität des Magnetfeldes sind sehr hohe Anforderungen zu stellen. Um trotzdem auftretende Inhomogenitäten auszumitteln, läßt man außerdem die Probe, die sich in einem Probenröhrchen befindet, um seine Längsachse rotieren (Rotationsfrequenz ca. 40 Hz). Im Falle einer Resonanz entzieht die Probe wegen der erfolgenden Absorption dem Generator Energie und verstimmt damit eine Meßbrücke. Diese Verstimmung, die proportional zur Stärke der Absorption in der Probe ist, wird elektronisch in ein Meßsignal umgewandelt und auf einen Schreiber gegeben (y-Achse). Die Schreiber-x-Achse ist mit der Feldverschiebung gekoppelt. Eine spezielle elektronische Anordnung erlaubt eine Integration der Spektren, so daß damit eine Aussage über die relative Intensität der einzelnen Meßsignale möglich ist. Für die Messung werden ca. 30 mg Substanz, in ca. 0,5 ml CCl4 oder CDCl3 aufgelöst, in das Probenröhrchen gefüllt und mit einem Tropfen Referenzsubstanz (TMS) versetzt. 11 Abbildung 2.1: Schema eines NMR-Spektrometers mit Einspulen-Verfahren. 12 Literaturverzeichnis [1] H. Yersin: Vorlesung Physikalische Chemie II (Kerne - Atome - Moleküle, Spektroskopische Methoden). [2] D. H. Williams, I. Fleming: Spectroscopic Methods in Organic Chemistry; 5th edition, McGraw-Hill Book Company, London, 1995. [3] H. Friebolin: Ein- und zweidimensionale NMR-Spektroskopie; 2. Auflage, VCH, Weinheim, 1992. [4] A. Carrington, A. D. McLachlan: Introduction to Magnetic Resonance; Chapman and Hall, London, 1979. [5] M. Hesse, H. Meier, B. Zeeh: Spektroskopische Methoden in der organischen Chemie; 5. Auflage, Thieme, Stuttgart, 1995. 13 3 Aufgabenstellung • Es sind die Strukturformeln von fünf Substanzen mit Hilfe ihrer NMR-Spektren zu bestimmen. Die Summenformeln und Stoffklassen sind jeweils angegeben. Zur Identifizierung der Substanzen sind den Spektren die Werte für - die chemische Verschiebung δ (ppm), - die Art der Multipletts, - die Kopplungskonstanten J (Hz), - die relative Intensität der Absorptionssignale zu entnehmen und tabellarisch aufzulisten. Die Multipletts sind den entsprechend gekennzeichneten Protonengruppen des Moleküls zuzuordnen. • Skizzieren Sie die NMR-Spektren von 3 Substanzen, deren Strukturformeln gegeben sind. Berücksichtigen Sie dabei die chemischen Verschiebungen, die Multiplizitäten der Signale und deren relative Intensitäten (Integrationskurven) sowie die auftretenden Kopplungskonstanten. Die Werte für diese Effekte sind wiederum in Auswertetabellen aufzulisten. 14

![6.3.1 1-Oxa-spiro[2.5]octan - Institut für Organische Chemie](http://s1.studylibde.com/store/data/001356875_1-96e669e5c88ad586db9f9f199d424d05-300x300.png)