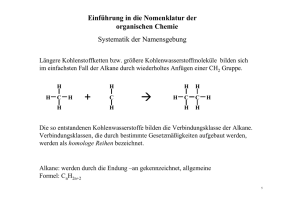
Alkan
Werbung
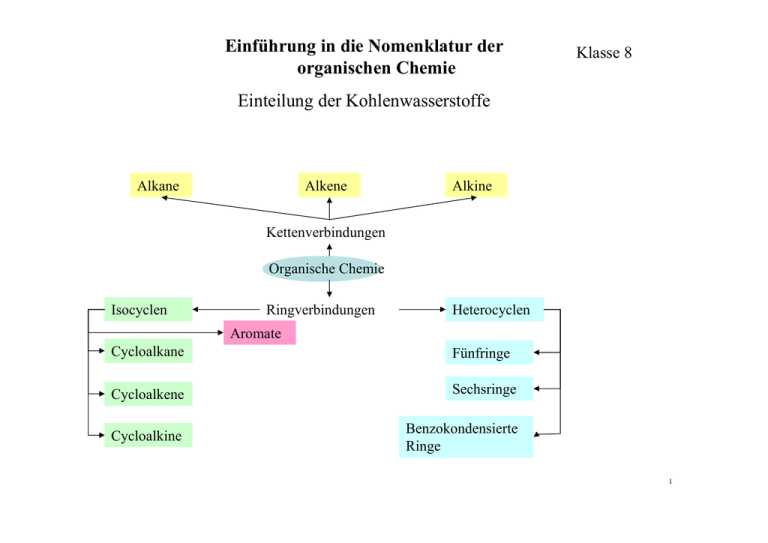
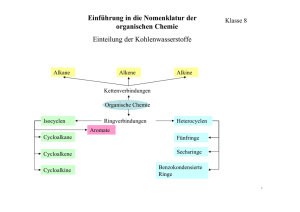
Einführung in die Nomenklatur der organischen Chemie Klasse 8 Einteilung der Kohlenwasserstoffe Alkane Alkene Alkine Kettenverbindungen Organische Chemie Isocyclen Ringverbindungen Heterocyclen Aromate Cycloalkane Fünfringe Cycloalkene Sechsringe Cycloalkine Benzokondensierte Ringe 1 Einführung in die Nomenklatur der organischen Chemie Allgemeiner Bauplan Ein C – Atom besitzt 4 Valenzelektronen und kann daher 4 Atombindungen aufbauen. Sind die C –Atome im Molekül nur über Einfachbindungen verbunden und die restlichen Bindungen mit H – Atomen belegt spricht man von gesättigten Kohlenwasserstoffen Alkane Einfachstes Molekül: Methan CH4 H H C H H Für die räumliche Struktur des Methanmoleküls sind die vier Elektronenpaare ausschlaggebend (VSEPR – Theorie). Die H – Atome ordnen sich in den Ecken eines Tetraeders an, in dessen Zentrum das C –Atom sitzt. 2 Einführung in die Nomenklatur der organischen Chemie Systematik der Namensgebung Längere Kohlenstoffketten bzw. größere Kohlenwasserstoffmoleküle bilden sich im einfachsten Fall der Alkane durch wiederholtes Anfügen einer CH2 Gruppe. H H C H H H + C H H H H C C H H H Die so entstandenen Kohlenwasserstoffe bilden die Verbindungsklasse der Alkane. Verbindungsklassen, die durch bestimmte Gesetzmäßigkeiten aufgebaut werden, werden als homologe Reihen bezeichnet. Alkane: werden durch die Endung –an gekennzeichnet, allgemeine Formel: CnH2n+2 5 Einführung in die Nomenklatur der organischen Chemie Systematik der Namensgebung Verzweigte Alkane Ist jedes C – Atom der Kette an höchstens 2 weitere C – Atome gebunden spricht man von unverzweigten Alkanen, andernfalls von verzweigten Alkanen. Moleküle mit gleicher Summenformel aber unterschiedlicher Struktur bezeichnet man als Isomere. Sind im Kohlenstoffgerüst die C – Atome unterschiedlich verknüpft, werden diese Strukturisomere genannt. Beispiel: C4H10 H H H H H C C C C H H H H H H H H H C C C H H C H H H 9 Einführung in die Nomenklatur der organischen Chemie Verzweigte Alkane Systematik der Namensgebung Regeln zur Benennung bei einer Seitenkette: CH3 I CH3 – CH – CH2 – CH2 – CH3 1 2 3 Anzahl der C – Atome der Hauptkette Pentan Die Seitenkette wird als Präfix angeführt Methylpentan 4 5 Die Hauptkette wird so nummeriert, dass das C – Atom, an dem die Seitenkette hängt, die kleinstmögliche Nummer erhält. Diese Nummer (Lokant) wird vor den Namen der Seitenkette gesetzt. 2-Methylpentan 10 Einführung in die Nomenklatur der organischen Chemie Systematik der Namensgebung Verzweigte Alkane Regeln zur Benennung mehrerer Seitenketten: Namen der Seitenketten (Präfixe) werden alphabetisch geordnet 3-Ethyl-2-Methylpentan Gleiche Seitenketten werden zusammengefasst und die Zahl durch Vorsilben angegeben 2,2-Dimethylpentan Bei der alphabetischen Reihung werden Vorsilben nicht betrachtet 3-Ethyl-2,2-Dimethylpentan CH3 I CH3 – CH – CH2 – CH2 – CH3 I C2H5 CH3 I CH3 – CH – CH2 – CH2 – CH3 I CH3 CH3 I CH3 – CH – CH2 – CH2 – CH3 I I CH3 C2H5 11 Einführung in die Nomenklatur der organischen Chemie Physikalische Eigenschaften der Alkane Name Pentan Methylbutan Gerüstformel Dimethylpropan Temperatur Zur Identifizierung und Klassifizierung von Alkanen sind deren physikalische Eigenschaften, wie Schmelz- und Siedepunkt, Dichte, Viskosität und der Temperaturgrenzwert der Filtrierbarkeit wichtig. Fp (°C) Kp (°C) -130 36 -160 28 -17 Siedepunkt Schmelzpunkt 9 Anzahl der Atome Temperatur Siedepunkte von Reinstoffen und Gemischen unterscheiden sich durch die Ausbildung eines Siedebereichs Temperatur Kohlenwasserstoffe sind lipophil (fettliebend) und hydrophob (wasserabstoßend) da sie nicht oder nur sehr schwach polar sind. Reinstoff Kp Gemisch Kpn Kp1 ∆T = Kpn - Kp 12 Zeit Zeit Einführung in die Nomenklatur der organischen Chemie Systematik der Namensgebung Alkane: Konformation - Konformationsisomere Atomgruppen können sich um die Achse von Einfachbindungen verdrehen. Dadurch entstehen verschiedene räumliche Formen desselben Moleküls. Diese unterschiedlichen Konformationen sind energetisch nicht gleichwertig. gestaffelte Konformation ekliptische Konformation 13 Einführung in die Nomenklatur der organischen Chemie Systematik der Namensgebung Cycloalkane: Kohlenstoffringe aus CH2 – Gruppen Ringförmige Alkane werden mit dem Präfix „Cyclo“ und dem Namen des Alkans mit der entsprechenden Anzahl C – Atome benannt. Die allgemeine Formel lautet: CnH2n H2 C CH2 CH2 H2C H2C CH2 CH2 H2C H2C CH2 CH2 CH2 H2C H2C H2C CH2 C C Cyclopropan: Cyclobutan: H2 H2 einfachste Form Bindungswinkel 90° Cyclopentan: Cyclohexan: eines Cycloalkans, Bindungswinkel 108° Bindungswinkel 120° Bindungswinkel 60° 14 Einführung in die Nomenklatur der organischen Chemie Systematik der Namensgebung Alkene Spaltet man aus einem Alkan zwei H – Atome ab, enthält die neue Verbindung eine Doppelbindung. Es entsteht ein Alken. Man spricht auch von ungesättigten Kohlenwasserstoffen. Die allgemeine Formel lautet CnH2n H Ethen (einfachstes Alken) C2H4 H Propen C3H6 Buten C4H8 Cycloalken hier: Cyclopenten C=C H H H H H C C=C C H H H H HC H (2 – Buten; But-2-en ) CH C5H8 H2C CH2 C H2 15 Einführung in die Nomenklatur der organischen Chemie Systematik der Namensgebung Systematik der Namensgebung in der organischen Chemie Kettenförmige (acyclische) Kohlenwasserstoffe 1. Alkane: werden durch die Endung –an gekennzeichnet, allgemeine Formel der homologen Reihe der Alkane: CnH2n+2 2. Die entsprechenden Radikale (ein H – Atom weniger) werden als Alkyle bezeichnet und mit der Endung –yl charakterisiert. Allgemeine Formel: CnH2n+1. 3. Alkene sind ungesättigte, acyclische Kohlenwasserstoffe mit einer oder mehreren Doppelbindungen (CnH2n). Die Endung lautet auf – en. Einwertige Radikale werden durch das Anhängsel –yl gekennzeichnet (CnH2n-1). 4. Alkine sind ungesättigte, acyclische Kohlenwasserstoffe mit einer oder mehreren Dreifachbindungen (C2H2n-2). Die Endung lautet auf –in. Einwertige Radikale werden durch das Anhängsel –yl gekennzeichnet. 22