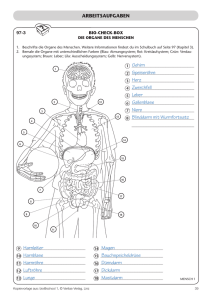
1.10 Leber - Thieme Connect
Werbung

⊙ B-1.194 B 1 Allgemein- und Viszeralchirurgie ⊙ B-1.194 ■ ■ MRCP: Gestaute Gallenwege bei kurzstreckiger präpapillärer Stenose ohne Aufstau des Pankreasganges Oberbauchsonografie und CT dienen dem Ausschluss einer Metastasierung. Mittels MRC können alternativ Veränderungen an den Gallengängen nachgewiesen werden. Therapie: Bei resektablen Tumoren erfolgt eine partielle Duodenopankreatektomie mit Lymphadenektomie, bei nicht resektablen Tumoren die Anlage einer biliodigestiven Anastomose und Gastroenterostomie. Therapie: Bei allen nicht metastasierten Tumoren wird eine partielle Duodenopankreatektomie mit radikaler Lymphadenektomie durchgeführt. Als palliative Maßnahme bei nicht resektablen Tumoren erfolgt eine Gallenableitung durch Anlage einer biliodigestiven Anastomose kombiniert mit der Anlage einer Gastroenterostomie (GE). Bei allgemeiner Inoperabilität ist die alleinige Pigtaildrainage zur Wiederherstellung des Gallenabflusses indiziert. Adjuvante Therapien (Chemo-Strahlentherapie) haben keinen Stellenwert in der Behandlung des Papillenkarzinoms. Prognose: Die Resektabilitätsrate liegt bei 75 %, die 5-Jahres-Überlebensrate bei 40 %. Prognose: Aufgrund der meistens frühen Manifestation liegt die Resektabilitätsrate der Papillenkarzinome mit ca. 75 % deutlich höher als die der Gallengangs- und Pankreaskopfkarzinome. Bei kurativer Resektion (partielle Duodenopankreatektomie) wird eine 5-JahresÜberlebensrate von ca. 40 % erreicht. 1.10 Leber 1.10 Leber Felix Braun, Thomas Becker, Dieter Bröring, Martin Heller 1.10.1 Anatomie der Leber 1.10.1 Anatomie der Leber Das Gewicht der Leber entspricht bei der Geburt 5 % und im Erwachsenenalter 2,5 % des Körpergewichtes. Die Leber als größtes parenchymatöses Organ des Menschen macht bei der Geburt etwa 5 % und beim Erwachsenen 2,5 % des Körpergewichtes aus. Ihr Gewicht beträgt durchschnittlich 1400–1600 g. Die geschützte Lage im rechten Subphrenium und die potenzielle Regenerationsfähigkeit unterstreichen ihre zentral lebenswichtige Funktion. Der intraabdominelle Druck sowie die Ligg. coronaria (Umschlag des parietalen zum visceralen Peritonealblatt der Leber) fixieren die Leber im rechten Oberbauch, dabei projiziert sich ventral die rechte Leberkuppe auf den proximalen Rand der V. Rippe und der proximale Rand des linken Leberlappens auf die VI. Rippe. Die Ligg. coronaria sind beidseits im Bereich des lateralen Umschlags von der ventralen zur viszeralen Seite der Leber verstärkt und bilden hier die Ligg. triangularia dexter und sinister. Das Lig. falciforme trennt anatomisch den rechten vom linken Leberlappen, zieht ventral zur Bauchdecke und bildet sich kranial aus der Zwerchfellaufhängung der Ligg. coronaria und geht kaudal in das Lig. teres hepatis über, welches sich mit der Chorda vena umbilicalis bis zum Nabel erstreckt. Entwicklungsgeschichtlich beinhaltet das Lig. teres hepatis die Umbilicalvene. Diese kann bei portaler Hypertension rekanalisiert werden, wobei diese aus dem linken Pfortaderast gespeist wird. Bei einer medianen Laparotomie sollte der Nabel deshalb immer linksseitig umschnitten werden. Die Blutversorgung der Leber erfolgt beim Gesunden zu ⅓ aus der A. hepatica und zu ⅔ aus der Pfortader. Der Gesamtblutdurchfluss der Leber beträgt ca. 25 % des Herzzeitvolumens (1500 ml/min). Die Leber wird im rechten Oberbauch durch die Ligg. coronaria (= peritonealer Umschlag), die Ligg. triangularia, das Lig. falciforme. das Lig. teres sowie über den intraabdominellen Druck fixiert. Das Lig. falciforme trennt anatomisch den rechten vom linken Leberlappen und geht kaudal in das Lig. teres hepatis über, welches die Umbilicalvene enthält. Die Blutversorgung der Leber erfolgt zu ⅓ über die A. hepatica und zu ⅔ über die Pfortader. Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. 460 B ⊙ B-1.195 461 1.10 Leber Segmentale Aufteilung der Leber nach Couinaud V. cava Lig. falciforme hepatis VIII VII Die Segmente I (parakaval links, nicht abgebildet), II, III, IVa + b repräsentieren die linke Leberhälfte, V, VI, VII und VIII die rechte. II IVa III IVb V D. choledochus ⊙ B-1.196 A Anatomische und chirurgische Lebergrenzen zur Definition der Leberresektion rechts VIII VII V links IVa IVb II I ⊙ B-1.196 Die Einteilung A entspricht der anatomischen Definition eines rechten und linken Leberlappens, die Einteilung B der chirurgischen Definition einer rechten und linken Leberhälfte (s.o.). III VI B rechts links aus: Kremer B., Henne-Bruns D.: Surgical technics. In: Lygidakis/Tytgat: Hepatobiliary and Pancreatic Malignancies. Thieme; 1989 Der venöse Abfluss der Leber erfolgt über den rechten, medianen und linken Lebervenenstamm subdiaphragmal direkt in die V. cava inferior. Neben den drei großen Lebervenen existiert eine variable Anzahl kleiner Lebervenen (Spieghel-Venen), über die insbesondere der Lobus caudatus in die V. cava drainiert. Entsprechend der segmentalen Versorgung durch je einen Gallengang, Pfortaderund Arterienast werden nach Couinaud an der Leber 8 Segmente unterschieden (Abb. B-1.195). Die Segmente I–IV bilden den linken Leberlappen und werden von der linken Leberarterie und dem linken Pfortaderast versorgt. Entsprechend werden die Lebersegmente V–VIII, die den rechten Leberlappen bilden, von der rechten Leberarterie und dem rechten Pfortaderast versorgt. Die Galledrainage des linken Leberlappens erfolgt über den linken Hauptgallengang und entsprechend die des rechten Leberlappens über den rechten Hauptgallengang. Das Lebersegment IV kann aufgrund seiner Gefäßversorgung und Gallenwegsdrainage in ein oberes und unteres Subsegment (Segment IVa und IVb) unterteilt werden. Es sei jedoch auf anatomische Variationen der Leberarterien, Pfortaderäste, Lebervenen und Gallenwege hingewiesen, die bei leberchirurgischen Eingriffen entsprechend berücksichtigt werden müssen. Die häufigsten anatomischen Varianten der Leberarterie sind eine akzessorische rechte Leberarterie aus der Arteria mesenterica superior und eine akzessorische linke Leberarterie aus der Arteria gastrica sinistra. Die Grenze zwischen rechter und linker Leberhälfte bildet der Sulcus medialis, welcher vom Gallenblasenbett zum rechten Rand der V. cava zieht und auch als CantlieLinie bezeichnet wird (Abb. B-1.196). Unmittelbar subphrenisch drainieren die rechte, mediane und linke Lebervene direkt in die V. cava inferior. Nach Couinaud werden an der Leber 8 Segmente unterschieden, die je von einem separaten Gallengang, Arterien- und Pfortadersegmentast und einer Segmentvene versorgt bzw. drainiert werden. Entsprechend ihrer Versorgung durch die rechte oder linke Leberarterie bzw. den rechten oder linken Pfortaderstammast werden die Segmente I–IV der linken Leberhälfte zugerechnet und die Segmente V–VIII der rechten Leberhälfte zugerechnet. Es gibt immer wieder anatomische Varianten von Leberarterien, Pfortaderästen, Lebervenen oder Gallenwege, die bei einer Operation in Betracht gezogen werden müssen. Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. V. portae A. hepatica V. lienalis V. mesenterica superior VI 462 B 1.10.2 Pathophysiologie der Leber 1.10.2 Pathophysiologie der Leber Die wesentlichen Funktionen der Leber können wie folgt zusammengefasst werden: ■ Speicherung von Glykogen, Fett, Vitaminen und anderen Substanzen. Die Leber repräsentiert das zentrale Stoffwechselorgan des Organismus. Die wesentlichen Leberfunktionen können wie folgt zusammengefasst werden: ■ Speicherfunktion: In der Leber werden Glykogen und Fett (Glukoneogenese; Fettsäureoxidation) gespeichert, weiterhin Vitamine und andere Substanzen z. B. für die Blutbildung oder Regeneration. ■ Syntheseleistung/Metabolismus: Die Leber synthetisiert Plasmaproteine (Albumin; Gerinnungsfaktoren; Cholinesterase; Transferrin), Cholesterin, Gallensäuren und Harnstoff. Eng verbunden mit dieser Syntheseleistung sind metabolische Stoffwechselleistungen wie Proteolyse und Lipolyse sowie ein der Entgiftung dienender Metabolismus. ■ Entgiftungsfunktion: Giftstoffe werden in der Leber durch Oxidierung und Glukuronierung metabolisiert und in wasserlöslicher Form (z. B. Koppelung an Sulfat = Steroidhormone) in der Galle ausgeschieden. Weiterhin werden Schadstoffe dem Blut durch Phagozytose der v.-Kupffer-Sternzellen entzogen. ■ Exkretionsfunktion: Die Leber produziert täglich 500–1500 ml Galle, die über die Gallenwege ausgeschieden wird. Die Galle enthält Gallensäuren, Bilirubin, Cholesterin, Phospholipide, Medikamente und Metabolite. Aufgrund der Komplexität und Heterogenität der Leberfunktionen kann ihre Funktion von keinem anderen Organ kompensatorisch übernommen werden. Der komplette Funktionsausfall führt unbehandelt (ohne Lebertransplantation) zwangsläufig zum Tode. Der partielle, komplette oder nahezu komplette Ausfall der Leberfunktion (z. B. bei der fulminant verlaufenden HBV-Infektion, beim primären Lebertransplantatversagen oder auch nach ausgedehnten Leberresektionen) ist deshalb ein gefürchtetes, immer lebensbedrohliches Krankheitsbild. Anhand der Leberfunktion können das klinische Bild und der Verlauf des Leberausfalls mit Hypoglykämie, Absinken des Harnstoffspiegels und der Cholinesterase, Anstieg des Bilirubins und Ammoniaks, zunehmender Blutgerinnungsstörung bei Abnahme der „leberabhängigen“ Gerinnungsfaktoren abgeleitet werden. Die terminale Situation der persistierenden Leberinsuffizienz ist gekennzeichnet von Niereninsuffizienz (hepatorenales Syndrom), Hypothermie, Azidose, respiratorischer und kardialer Insuffizienz sowie Coma hepaticum. Durch supportive Therapie der Einzelfunktionen wie Gabe von Frischplasmen und Gerinnungsfaktoren, „titrierte“ Glukosezufuhr, Hämofiltration, Leber-Albumin-Dialyse, Beatmung und medikamentöse Kreislaufunterstützung kann ein Funktionsausfall der Leber auf Zeit überbrückt werden, bis sich entweder die Funktion durch Regeneration des Leberparenchyms erholt oder der Patient im Rahmen eines Transplantationsprogramms lebertransplantiert werden kann. Künstliche Leberersatzverfahren wie die Leber-Albumin-Dialyse (z. B. MARS- oder Prometheus-Verfahren) können unterstützend zur Entgiftung eingesetzt werden. Bislang existiert jedoch noch kein künstliches Leberersatzverfahren, welches gleichzeitig die Synthese- und Entgiftungsfunktion der Leber ersetzt. Synthese von Plasmaproteinen, Cholesterin, Gallensäuren und Harnstoff. Eng damit verknüpft sind metabolische Leistungen wie Proteolyse, Lipolyse und Entgiftung. ■ Entgiftung durch Metabolisierung von Giftstoffen durch Oxidierung und Glukuronierung. Diese werden in wasserlöslicher Form mit der Galle eliminiert. Exkretion von Gallensäuren, Bilirubin, Cholesterin, Phospholipide, Medikamenten und Metaboliten über die Galle. Täglich werden ca. 500–1500 ml produziert. Die Funktion der Leber ist vital essenziell und kann von keinem anderen Organsystem kompensiert werden. ■ Ein partieller oder totaler Funktionsausfall der Leber ist immer lebensbedrohlich. Die Symptomatik der Leberinsuffizienz ergibt sich aus der Physiologie: Konzentrationsabfall von Blutzucker, Harnstoff, Gerinnungsfaktoren und Cholinesterase sowie Konzentrationsanstieg von Bilirubin und Endotoxinen. Das terminale Stadium des Leberversagens ist gekennzeichnet durch: Hypothermie, Niereninsuffizienz, respiratorische Insuffizienz, Herzinsuffizienz und Coma hepaticum. Die supportive Therapie des Leberversagens besteht in der Unterstützung der Einzelfunktionen. Künstliche Leberersatzverfahren können zur Unterstüzung der Detoxifikation eingesetzt werden. Falls die Regeneration der Eigenleber ausbleibt, ist eine Lebertransplantation indiziert. 1.10.3 Diagnostik 1.10.3 Diagnostik Anamnese und klinische Untersuchung Anamnese und klinische Untersuchung Die Anamneseerhebung beinhaltet zielgerichtete Fragen, die das Spektrum möglicher Lebererkrankungen betrifft. Anamnese: Um eine gründliche Anamnese erheben zu können, muss der Untersucher das Spektrum möglicher Erkrankungen und deren Ursachen vor Augen haben, da gerade in der Diagnostik von Lebererkrankungen richtig gestellte Fragen zu wegweisenden Hinweisen führen können. Verdachtsdiagnose: Virushepatitis, Leberzirrhose, Verschlussikterus → Fragen nach: Müdigkeit und Leistungsknick, Übelkeit und Juckreiz, Ikterus, Verfärbung von Stuhl (hell) und Urin (dunkel), Alkoholkonsum, Kontakt zu Patienten mit infektiöser Hepatitis, Auslandsreisen in Länder mit erhöhtem Infektionsrisiko, Schmerzen in Verbindung mit dem Auftreten des Ikterus (DD: Stein/Tumor), Bluterbrechen bei Ösophagusvarizen. Bei den Verdachtsdiagnosen Virushepatitis, Leberzirrhose oder Verschlussikterus sollte nach Müdigkeit, Leistungsknick, Übelkeit, Juckreiz, Ikterus, Dunkelfärbung des Urins, Hellfärbung des Stuhls, Alkoholkonsum, Kontakt zu Personen mit infektiöser Hepatitis, Auslandsreisen, Schmerzen und Bluterbrechen gefragt werden. Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. ■ 1 Allgemein- und Viszeralchirurgie 463 1.10 Leber Verdachtsdiagnose: Primäre und sekundäre Lebertumore → Fragen nach: Druckgefühl oder Schmerzen im rechten Oberbauch (nur wenn die Raumforderung in der Leber so groß ist, dass die Leberkapsel unter Spannung gerät), frühem Völlegefühl nach dem Essen (Raumforderung besonders in der linken Leber mit Verdrängung des Magens), Alkoholkonsum oder durchgemachter HBV oder HCV-Infektion mit bekannter Leberzirrhose (erhöhtes HCC-Risiko), vorausgegangenen Operationen (z. B. Status nach Operation eines intestinalen Malignoms mit möglicher sekundärer Lebermetastasierung), Kontrazeptivaeinnahme (FNH, Adenom). Bei der Verdachtsdiagnose eines primären oder sekundären Lebertumors sollte nach Druckgefühl, Schmerzen im rechten Oberbauch, schnellem Völlegefühl nach dem Essen, bekannter Leberzirrhose, vorausgegangenen Operationen und Kontrazeptiva gefragt werden. Klinische Untersuchung: Unter der Verdachtsdiagnose einer Lebererkrankung sind folgende Symptome bzw. Befunde besonders zu berücksichtigen: ■ Inspektion: „Foetor ex ore“, Farbe von Haut und Skleren (Ikterus ?), Kratzspuren besonders an den Extremitäten, Vorhandensein von Spider naevi und Palmarerythem, Zeichen eines Umgehungskreislaufes (Caput medusae), Aszites, fehlende Körperbehaarung, Muskelatrophie. ■ Bei der Palpation entspricht der distale Leberrand normalerweise dem Rippenbogen, bei tiefer Inspiration wird der Leberrand unter dem rechten Rippenbogen tastbar und beurteilbar, das heißt: Glatt und scharf = normal; fein- oder grobknotig mit Verplumpung des Randes = Leberzirrhose; Druckschmerzhaftigkeit = Verdacht auf entzündliche Veränderungen oder auch einen Lebertumor. ■ Durch die Perkussion („Leberdämpfung“) wird die Größenbestimmung des Organs vervollständigt. Klinische Untersuchung: auf eine Lebererkrankung hinweisende Symptome/Befunde sind: ■ Inspektion: Foetor ex ore, Ikterus, Kratzspuren der Haut, Spider naevi, Palmarerythem, Caput medusae, Aszites, fehlende Körperbehaarung und Muskelatrophie. ■ Palpation: Größe, Konsistenz und Oberflächenbeschaffenheit der Leber (Leberrand glatt u. scharf oder grobknotig bzw. druckschmerzhaft). ■ Perkussion: Bestimmung der Lebergröße („Leberdämpfung“). Labordiagnostik Labordiagnostik Entsprechend der vielfältigen Funktionen der Leber können „leberspezifische“ Laborparameter Hinweise auf eine z. B. gestörte Exkretions- oder Synthesefunktion oder auch den Grad einer entzündungsbedingten Leberzellschädigung widerspiegeln. Die in der Routine-Labordiagnostik erfassten Parameter können den verschiedenen grundsätzlichen Leberfunktionen zugeordnet werden und Abweichungen von Normalwerten auf eine Störung dieser speziellen Funktion hindeuten: ■ Speicherfunktion: Für diese Funktion gibt es in der Routinediagnostik keine verwertbaren Parameter. ■ Syntheseleistung: Erniedrigte Werte für Serumalbumin, Cholinesterase) (CHE) und Cholesterin insbesondere in Verbindung mit erniedrigten Werten der „leberabhängigen“ Gerinnungsfaktoren (Faktor II, V und VII) weisen auf eine Synthesestörung hin. Der Quickwert (bzw. INR-Wert) als orientierender Parameter lässt bei Ausschluss eines Vitamin-K-Mangels wegen seiner kurzen Halbwertszeit von wenigen Stunden auch kurzfristige Änderungen der Syntheseleistung der Leber erkennen. ■ Entgiftungsfunktion: Bei bewusstseinsgetrübten oder komatösen Patienten sollte der Ammoniakspiegel bestimmt werden. ■ Exkretionsfunktion: Eine Hyperbilirubinämie in Verbindung mit erhöhten Werten der alkalischen Phosphatase (AP) und der Gamma-Glutamyl-Transpeptidase (gGT) kann auf eine gestörte Exkretionsfunktion hinweisen. ■ Weitere spezifische Hinweise: – Eine Erhöhung „leberspezifischer“ Enzyme wie der Glutamat-Oxalazetat-Transaminase (GOT; angloamerikanisches Schrifttum: AST) und der Glutamat-Pyruvat-Transaminase (GPT; angloamerikanisches Schrifttum: ALT) weisen auf eine Störung der zellulären Integrität der Leberzelle hin. – Eine Erhöhung der Glutamat-Dehydrogenase (GLDH) im Serum ist hinsichtlich des vorliegenden Zellschadens schwerwiegender einzustufen als ein Anstieg der Transaminasen. Ein GLDH-Anstieg ist meist Ausdruck einer schweren hypoxischen Leberschädigung mit Zellnekrosen, da das Enzym ausschließlich in den Mitochondrien der Hepatozyten vorkommt. – Die Bestimmung von Tumormarkern ist insbesondere für den postoperativen Verlauf bedeutsam, da deren Wiederanstieg Anhalt für ein Tumorrezidiv sein kann. Klassische Tumormarker sind das AFP beim HCC, das CA19-9 beim Cholangiokarzinom und CEA und CA19-9 bei kolorektalen Lebermetastasen. Die Routinelaborparameter spiegeln im Sinne eines Rasters die wesentlichen Funktionen der Leber wider und lassen so Rückschlüsse auf die Ursachen einer gestörten Funktion zu. ■ Speicherfunktion: keine sicher verwertbaren Parameter. ■ Syntheseleistung: erhöhtes Serum-Bilirubin, erniedrigte Cholinesterase und Cholesterin. Vitamin-K-abhängige Gerinnungsfaktoren mit kurzer Halbwertszeit (Faktor II und V) spiegeln die aktuelle Syntheseleistung der Leber gut wider. ■ Entgiftungsfunktion: erhöhter Ammoniakspiegel. ■ Exkretionsfunktion: Erhöhte Cholestaseparameter (Bilirubin, AP, GGT). Weitere Hinweise liefern pathologische Werte „leberspezifischer“ Enzyme (GOT = AST; GPT = ALT). Diese sind Ausdruck einer gestörten zellulären Integrität der Hepatozyten. Da die GLDH zellulär in den Mitochondrien lokalisiert ist, spiegelt eine Serum-GLDH-Erhöhung eine schwerwiegende Zellschädigung wider. Tumormarker können im Verlauf Hinweise auf Rezidive geben. Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. B ▶ Merke. B 1 Allgemein- und Viszeralchirurgie ▶ Merke. Vor einem Eingriff an der Leber sollte auf eine suffiziente Gerinnung (Quick > 80 %, PTT < 40 Sekunden, Thrombozyten > 50 /nl) geachtet werden. Bildgebende Verfahren Bildgebende Verfahren Die bildgebenden Verfahren der Wahl sind gegenwärtig: Sonografie, Computertomografie (CT) und Magnetresonanztomografie (MRT). Die Aussagkraft kann durch Einsatz unterschiedlicher Kontrastmittel erhöht werden. Die szintigrafischen Verfahren sind heutzutage von untergeordneter Bedeutung. In Einzelfällen muss eine explorative Laparoskopie durchgeführt werden. In seltenen Fällen kann eine dreidimensionale Rekonstruktion der Bildgebung hilfreich sein. Als „Basisuntersuchung“ eignet sich die Sonografie. Computertomografie (CT) und Magnetresonanztomografie (MRT) sind die wichtigsten weiteren Verfahren zur Abklärung von Raumforderungen in der Leber. Durch Kontrastmittelgabe kann die Aussagekraft von Sonografie, CT und MRT erhöht werden. Szintigrafische Verfahren (hepatobiliäre Sequenzszintigrafie, Blutpool-Szintigrafie) sind heute von untergeordneter Bedeutung. Die explorative Laparoskopie aufgrund eines diagnostisch nicht zu klärenden Leberbefundes kann in Einzelfällen sinnvoll sein. Bei seltenen Fragestellungen kann eine dreidimensionale Rekonstruktion anhand der bildgebenden Verfahren (Ultraschall, CT, MRT) sinnvoll sein. In der Regel sind diese jedoch für die Indikationsstellung nicht erforderlich. Sonografie Sonografie ▶ Merke. ▶ Merke. Die Sonografie der Leber ist das Verfahren der Wahl zur orientierenden Abklärung – ohne Strahlenbelastung und jederzeit wiederholbar. Beurteilt werden können: Lebergröße, Leberparenchym (z. B. Steatose, Raumforderungen), intra- und extrahepatische Gallenwege (z. B. Cholestase), Gallenblase (z. B. Steine) und freie Flüssigkeit intraabdominell (z. B. Trauma, Ascites). Mittels Ultraschall wird die Sicherheit der Punktion von Aszites und der Drainage von Abszessen erhöht. Die Diagnostik mittels farbkodierter Duplex-/Doppler-Sonografie (FKDS) beinhaltet die Beurteilung von: Leberarterie, Pfortaderfluss und Lebervenenfluss. Die Aussagekraft der FKDS kann durch Verwendung von Kontrastmitteln (z. B. SonoVue) erhöht werden. Der Einsatzbereich der Sonografie umfasst die Beurteilung der Lebergröße (z. B. Hepatomegalie), des Leberparenchyms (Raumforderungen, Steatose, Fibrose, Cirrhose), der intra- und extrahepatischen Gallenwege (Cholestase, Gallengangszysten, Choledocholithiasis, Hepatolithtiasis) und der Gallenblase (Cholecystolithiasis, Cholecystitis). Der Nachweis freier intraabdomineller Flüssigkeit (Ascites) erfolgt ebenfalls sonografisch. Weiterhin hat die Sonografie die Peritoneallavage als Untersuchungsverfahren der ersten Wahl beim stumpfen Bauchtrauma mit Verdacht auf eine Leberverletzung abgelöst, da sie z. B. die Leberruptur direkt oder frisches Blut um die Leber herum nachweisen kann. Die Sicherheit von Punktionen (Ascites) und Drainagen (Abszess) kann durch ultraschallkontrolliertes Einführen der Punktionsnadel erhöht werden. Die farbkodierte Duplex-/Doppler-Sonografie (FKDS) der Leber erlaubt eine Beurteilung der arteriellen Perfusion, des quantitativen und qualitativen (hepatofugal vs. hepatopedal) Pfortaderflusses und der Durchgängigkeit der Lebervenen. Die Flusssignale der FKDS können durch intravenöse Gabe von Kontrastmittel verstärkt werden, welches der besseren Differenzierung von hepatischen Raumforderungen dient. Hepatozelluläre Karzinome zeigen typischerweise eine arterielle Hyperperfusion bei der kontrastmittelverstärkten FKDS. Fibroscan Fibroscan Kann durch Elastografie orientierend den Schweregrad bei Leberfibrose ermitteln. Die apparative Anwendung ähnelt der Sonografie. Der Fibroscan basiert auf einer Elastografie des Leberparenchyms und gibt dessen Steifheitsgrad an. Dieses noch junge Verfahren kann orientierend zur Ermittlung des Schwergrades einer Leberfibrose eingesetzt werden. Computertomografie (CT) Computertomografie (CT) Der wesentliche Indikationsbereich betrifft die primären und sekundären Lebertumore. Neben dem topografischen Nachweis eines Tumors lässt das CT bei „klassischem Befund“ auch Rückschlüsse auf die Genese zu. Die Verbindung mit einem Kontrastmittel-Bolus lässt Aussagen zur Lagebeziehung eines Tumors zu den großen Gefäßen der Leber zu. Eine weitere Indikation ist die Polytraumadiagnostik. Der diagnostische Schwerpunkt der CT ist die Abklärung primärer und sekundärer Lebertumoren. Im Rahmen der (Poly-)Traumadiagnostik ist die CT zum Nachweis oder Ausschluss von Organverletzungen wie z. B. einer Leberruptur ebenfalls indiziert. Bei den genannten Indikationen ist die intravenöse Gabe von Röntgenkontrastmittel obligat. Sie erfolgt als maschinell applizierter Bolus. Je nach Fragestellung sind die arterielle und/oder die portalvenöse Phase zu analysieren, da sich aus dem Perfusionsmuster Rückschlüsse auf einen Tumor ziehen lassen. Gelegentlich sind ergänzende Spätaufnahmen zur differenzialdiagnostischen Ergänzung erforderlich. Mit der CT-Angiografie gelingt darüber hinaus eine Aussage zur topografischen Beziehung eines Tumors zu den großen Gefäßen der Leber (Abb. B-1.197) und damit zur Operabilität bzw. zur Operations- oder Therapieplanung. (z. B. Embolisation vor Operation). Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. 464 B ⊙ B-1.197 465 1.10 Leber ⊙ B-1.197 CT der Leber Magnetresonanztomografie (MRT) Magnetresonanztomografie (MRT) Die Entwicklungen der letzten Jahre haben gezeigt, dass die Magnetresonanztomografie in der Diagnostik pathologischer Befunde der Leber einen ähnlichen Stellenwert einnimmt wie die Computertomografie. Der Vorteil der MRT ist die nicht vorhandene Strahlenexposition. Weiterhin ergeben sich durch spezielle Techniken (T 1/ T 2-Relaxationszeiten) und den Einsatz paramagnetischer Kontrastmittel Möglichkeiten, die Relaxationszeiten zwischen z. B. Tumorgewebe und normalem Lebergewebe so zu verändern, dass eine bessere Kontrastierung resultiert. So können unter bestimmten Voraussetzungen auch Aussagen über die Art einer tumorösen Veränderung in der Leber (z. B. Hämangiom) gemacht werden, sodass sich CT und MRT entsprechend der Fragestellung und Verdachtsdiagnose komplementär ergänzen. Ein wesentlicher Vorteil der MRT ist die fehlende Strahlenexposition der Untersuchung. Der diagnostische Indikationsbereich ist teilweise mit dem des CT kompatibel. Durch Veränderung der Relaxationszeiten und durch Einsatz z. B. paramagnetischer Kontrastmittel nehmen die Sensitivität und die Spezifität der Untersuchung pathologischer Leberbefunde weiter zu. Angiografie Angiografie Folgende Methoden sind zur Darstellung der Lebergefäße verfügbar: ■ Katheterangiografie in Form der digitalen Subtraktionsangiografie (DSA) und ■ CT- und MR-Angiografie (CT-A, MR-A). ■ (Auch mittels Ultraschall lassen sich die Gefäße der Leber abbilden). Während bei der klassischen Angiografie mittels eines Katheters der Truncus coeliacus, die Arteria hepatica und andere Arterien zur direkten Kontrastmittelinjektion sondiert werden, lässt sich mit der CT- oder MR-Angiografie die Gefäßsituation nicht invasiv mit einer intravenösen Kontrastmittelgabe darstellen. Grundsätzlich ist die Darstellung der arteriellen Strombahn (Coeliacografie) von der Darstellung des portalvenösen Gefäßsystems (indirekte Splenoporto- oder Mesentericoportografie) zu unterscheiden. Die Indikation zur Angiografie der Leber ist immer dann zu stellen, wenn folgende Fragen zu klären sind: ■ Ausmaß und topografische Zuordnung der Blutversorgung eines Lebertumors zu einem Gefäßterritorium. Methoden: Katheterangiografie als digitale Subtraktionsangiografie (DSA). ■ CT- und MR-Angiografie (CT-A, MR-A). Bei der Angiografie der Leber wird die Darstellung der arteriellen Strombahn (Coeliacografie) von der des portalen Stromgebietes (indirekte Splenoporto- und Mesentericoportografie) unterschieden. ⊙ B-1.198 ■ Indiziert bei folgenden Fragestellungen: ■ topografische Zuordnung eines Lebertumors (Blutversorgung). ⊙ B-1.198 Angiografie der Leber Darstellung eines zentralen, von der rechten Leberarterie versorgten, gut vaskularisierten Tumors (HCC) Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. Der zentrale Lebertumor ummauert die Pfortaderaufzweigung. B 1 Allgemein- und Viszeralchirurgie ■ Beziehung eines Lebertumors zum Gefäßsystem und Gefäßinfiltration. ■ Vaskularisation eines Lebertumors. ■ Abklärung alternativer oder adjuvanter Therapieverfahren. Eine grundsätzliche Notwendigkeit zur Angiografie vor einem leberchirurgischen Eingriff besteht nicht. Lage eines Leberherdes zum Gefäßsystem, besonders bei Tumoren im Bereich des Leberhilus oder der Lebervenen (Abb. B-1.198). ■ Grad der Vaskularisation eines Lebertumors. ■ Abklärung alternativer oder adjuvanter Therapieverfahren wie der lokoregionären Chemotherapie oder Embolisation. Eine grundsätzliche Indikation zur diagnostischen Angiografie vor einem leberchirurgischen Eingriff zur Abklärung der variablen Gefäßanatomie besteht nicht, da diese durch entsprechende intraoperative Präparation fast immer dargestellt werden kann. Leberszintigrafie Leberszintigrafie Sonografie, CT, MRT, CT-A und MR-A ersetzen heute in Verbindung mit modernen Kontrastmitteln die Rolle der Szintigrafie in der Diagnostik von Lebertumoren. Die Leberszintigrafie spielt heute für die Diagnostik von Lebertumoren keine Rolle mehr. Mittels sehr aufwendiger Verfahren können zwar in der Regel primäre von sekundären und überwiegend auch benigne von malignen Lebertumoren differenziert werden, dies gelingt jedoch besser mittels der vorgestellten Verfahren, CT, MRT und Sonografie unter Einsatz der heute verfügbaren Kontrastmittel (intravasale, interstitielle oder sich im RES anreichernde KM). Darüber hinaus sind die anatomisch-topografischen Informationen der Schnittbildverfahren denen der Nuklearmedizin weit überlegen. Positronemissionstomografie (PET) Positronemissionstomografie (PET) Die FDG-PET kann zur Abklärung extrahepatischer Tumoren verwendet werden, die mittels CT- und MR-Diagnostik primär nicht nachweisbar sind. Eine Tumorlokalisation kann durch Kombination von FDG-PET und CT erfolgen. Die Fluordeoxyglukose-Positronemissonstomografie FDG-PET (18-FDG-PET) kann zum Nachweis kolorektaler Lebermetastasen eingesetzt werden. Bei der Darstellung intrahepatischer Raumforderungen ist sie der MR und CT unterlegen. Die 18-FDGPET eignet sich jedoch zur extrahepatischen Tumorsuche. Eine Tumorlokalisation ist durch Kombination der PET- und CT-Technik möglich (PET-CT). 1.10.4 Lebertumoren 1.10.4 Lebertumoren Tumorartige Läsionen Tumorartige Läsionen Kongenitale Leberzysten Kongenitale Leberzysten Solitäre Leberzysten Solitäre Leberzysten ▶ Definition. Ätiologie: ■ Kongenitale Malformation. ■ Inzidenz 1 %. ■ Selten symptomatisch, w:m = 9:1. Klinik: In der Regel asymptomatisch. Bei entsprechender Größe selten Atrophie des betroffenen Leberlappens. Differenzialdiagnose: Abszesse, parasitäre Zysten. Therapie: erfolgt nur bei symptomatischen Zysten durch eine Resektion oder eine eröffnende partielle Zystenresektion mit Einbringen einer Netzplombe. ■ ▶ Definition. Solitäre Zysten werden in sonografischen oder autoptischen Untersuchungen bei etwa 1 % der Erwachsenen gefunden. Der Zysteninhalt besteht i. d. R. aus seröser Flüssigkeit. Ätiologie: Da die Zysten von einem einschichtigen kubischen Epithel ausgekleidet werden, geht man ätiologisch von einer kongenitalen Malformation des Gallengangssystem aus. Bei symptomatischen Leberzysten dominiert das weibliche Geschlecht (m:w = 1:9). Bei der Hälfte der Patienten sind derartige Zysten solitär, bei den übrigen Patienten sind weitere Zysten im Parenchym festzustellen. Klinik: Leberzysten sind i. d. R. asymptomatisch. In seltenen Fällen werden sie so groß, dass sie zu einer Atrophie des betroffenen meist rechten Leberlappens mit kompensatorischer Hypertrophie des gegenseitigen Leberlappens führen und Druck- oder Völlegefühl als Symptomatik verursachen. Differenzialdiagnose: Parasitäre Zysten und Abszesse sind auszuschließen. Therapie: Ein Therapiebedarf besteht nur bei symptomatischen Zysten, wobei immer abzuklären ist, ob eine bestehende Symptomatik wirklich durch die gefundene Leberzyste erklärt wird oder ob die Zyste nicht nur einen an sich asymptomatischen Zufallsbefund bei einer anderen die Symptome hervorrufenden Erkrankung darstellt. Als Therapie kommen die Resektion der Zyste oder die eröffnende partielle Resektion der oberflächlichen Zystenanteile mit Einbringen einer Netzplombe infrage. Da das letztgenannte Operationsverfahren fast immer laparoskopisch durchführbar ist, stellt es heute wegen des kleineren Operationstraumas das Verfahren der ersten Wahl dar. Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. 466 B Zystenleber Zystenleber ▶ Definition. Als Zystenleber wird ein diffuser polyzystischer Befall des gesamten Leberparenchyms bezeichnet (höchster Grad der dysontogenetisch-zystischen Fehlbildungen), der sich praktisch immer im Zusammenhang mit einer autosomal dominant vererbten polyzystischen Nierendegeneration vom adulten Typ findet. ⊙ B-1.199 467 1.10 Leber ▶ Definition. Zystenleber a b Klinik: Morphologisch gleicht die einzelne Zyste bei der Zystenleber der solitären Leberzyste, allerdings führen Zunahme an Zahl und Volumen zu erheblichen Beschwerden mit Druckgefühl, Schmerzen und einem häufig sichtbaren oder palpablen Tumor im rechten Oberbauch (Abb. B-1.199). In seltenen Fällen ist aufgrund der Lebergröße eine Immobilisation möglich. Klinik: Druckgefühl, Schmerzen, palpabler Tumor, selten Immobilisation (Abb. B-1.199). Therapie: Ein Therapiewunsch wird von vielen Patienten geäußert, was zu meist frustranen multiplen sonografisch gesteuerten Punktionen der Zysten mit Absaugen des meist klaren Zysteninhaltes und Instillation verschiedener Sklerosierungsmittel führt. Bei entsprechender Symptomatik kann eine dekompressive atypische Resektion eines Teils der Zysten und die multiple Fenestration der verbleibenden Zysten indiziert sein, da nach der Resektion mit Einsetzen der Leberregeneration sich nicht zwangsläufig neue Zysten bilden, sondern das entlastete verbliebene Parenchym hypertrophieren kann. In Einzelfällen (z. B. Immobilisation durch Zystenleber) kann eine Lebertransplantation indiziert sein. Therapie: Dekompressive, atypische Resektion von zystischen Arealen mit multiplen Fenestrationen, selten Lebertransplantation. Erworbene Leberzysten Erworbene Leberzysten Echinokokkuszysten Echinokokkuszysten ▶ Definition. Echinokokkuszysten sind Folge einer Infektion entweder durch den ▶ Definition. Echinococcus granulosus (Hundebandwurm) oder den Echinococcus multilocularis (Fuchsbandwurm). Relevante Endemiegebiete gibt es in Südamerika, Australien, Alaska, Kanada, Iran, Irak, Griechenland, Italien, Spanien, Frankreich, Süddeutschland, der Schweiz und den Balkanstaaten. Pathogenese: Im Wirtstier (Hund, Fuchs, Wolf usw.) entwickelt sich aus der mit der Nahrung aufgenommenen Finne der Bandwurm, dessen Eier mit dem Kot ausgeschieden werden. Fast alle Warmblüter und der Mensch dienen als Zwischenwirt für die Entwicklung vom Ei zur Finne. Nach oraler Aufnahme der Eier durch verunreinigte Nahrung oder auch durch Kontakt mit infizierten Hunden wird die Eihülle im oberen Gastrointestinaltrakt durch Galle und Pankreassaft unter Freisetzung der „Sechshaken-Larven“ zerstört. Diese durchbohren die Darmwand und gelangen überwiegend über die Pfortader in die Leber. Sie können aber auch über den Ductus thoracicus direkt in die Zirkulation gelangen, sodass Hydatiden praktisch in allen Organen wie Lunge, Milz, Hirn und Nieren auftreten können. Beim E. granulosus entwickelt sich aus der Larve die Hydatide, deren Hülle aus drei Schichten besteht: ■ Die äußere adventitielle Schicht besteht aus fibrösem Gewebe als Reaktion des Wirtsgewebes auf den Parasiten. Pathogenese: Das Wirtstier (z. B. Hund, Fuchs) nimmt die Finne über die Nahrung auf. Im Wirtstier entwickelt sich aus der Finne der Bandwurm, die Eier werden mit dem Kot ausgeschieden. Nach oraler Aufnahme der Eier durch den Zwischenwirt (Mensch) entwickelt sich die Sechshaken-Larve im Darm, welche die Darmwand durchdringt und portalvenös in die Leber oder lymphatisch in andere Organe gelangt, d. h. Hydatiden können in allen Organen auftreten. Beim Hundebandwurm entwickelt sich aus der Larve die Hyatide, deren Wand aus drei Schichten besteht. Beim Fuchsbandwurm ist im Gegensatz zum Hundebandwurm Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. a) CT-Befund einer Patientin mit Zystenleber und Zystennieren. b) Intraoperativer Befund der massiv vergrößerten Zystenleber. B aufgrund eines differenten Wandaufbaus ein infiltratives Zystenwachstum möglich. ■ ■ 1 Allgemein- und Viszeralchirurgie Die Außenschicht der Hydatide besteht überwiegend aus Mucopolysacchariden des Parasiten (= Kuticula). Die Innenauskleidung der Hydatide entspricht der Keimschicht, von der die infektiösen Scolices (> 100/cm³) gebildet werden. Durch Ablösen der Schichten voneinander bilden sich Tochterzysten. Bei zunehmendem Wachstum der Hydatiden können diese dem Weg des geringsten Widerstandes folgend in das Gallengangssystem einbrechen (bei ca. 15 % aller Fälle) oder auch durch das Zwerchfell in den Thorax perforieren. Wegen des differenten Wandaufbaus des E. multilocularis bildet dieser auch Blasen zur Außenseite hin mit infiltrativem Wachstum in das Wirtsgewebe. Klinik: ■ Unspezifisch, vorübergehendes Druckgefühl oder Schmerzen im rechten Oberbauch. ■ Ikterische Episoden. ■ Selten Fieberschübe bei Infektion der Zyste oder Cholangitis durch Gallengangseinbruch. ■ Anaphylaxie, Ikterus, Cholangitis oder spontane Zystenruptur mit akutem Therapiebedarf. Klinik: „In der Regel“ treten über lange Zeit hinweg keine oder nur sehr unspezifische, vorübergehende Symptome auf. Etwa 60 % der Patienten haben gelegentlich ein Druckgefühl im rechten Oberbauch oder Schmerzen im Bereich des rechten Rippenbogens. Bei ca. ¼ der Patienten wird die Echinokokkuszyste als Zufallsbefund entdeckt. Anamnestisch haben bis zu 15 % der Patienten ikterische Episoden (Kompression des Gallengangssystems oder Einbruch der Hydatide in einen Gallengang). Seltener sind Fieberschübe bei Infektion der Zyste oder Cholangitis beim Gallengangsbefall. Bis zu 10 % der Patienten sind akut als Notfälle therapiebedürftig, entweder wegen anaphylaktoider Reaktionen und Kollaps, Ikterus, Cholangitis oder spontaner Zystenruptur. Diagnostik: Sonografie und CT sind geeignet zum Nachweis von Scolices, membranösen Binnenstrukturen oder Verkalkungen der Zystenwand zu erbringen (Abb. B-1.200). Zur Erhärtung der Diagnose dienen serologische Tests (indirekte Immunfluoreszenz, ELISA). In Einzelfällen kann eine MRC oder ERC hilfreich sein. Diagnostik: Sowohl im Ultraschall als auch in der CT sind Echinokokkuszysten in einem sehr hohen Prozentsatz wegen ihres charakteristischen Erscheinungsbildes ohne weitere Maßnahmen zu diagnostizieren. Typischerweise sind die Scolices in der Zyste sichtbar oder eine membranöse Binnenstruktur der Zyste oder typische Kalkeinlagerungen in der Zystenwand sind Anlass der Verdachtsdiagnose Echinokokkuszyste (Abb. B-1.200). Zu Erhärtung der Diagnose sollten serologische Tests (indirekte Immunfluoreszenz, ELISA etc.) angeschlossen werden. In seltenen Fällen weisen ein erhöhtes Bilirubin oder eine erhöhte alkalische Phosphatase (AP) auf eine Kompression zentraler Gallengangsabschnitte oder auf einen Einbruch in das Gallenwegssystem hin. In diesen Fällen ist eine präoperative MRC (ggf. ERC) essenziell. ⊙ B-1.200 Intrahepatische Echinokokkuszyste a b a) Typischer CT-Befund. b) Aufgeschnittenes Resektionspräparat. ▶ Merke. Präoperative Vorbehandlung mit Albendazol oder Mebendazol. Therapie bei Echinococcus granulosus: kontrollierte Abtötung der Scolices (z. B. hypertone Glucose- oder NaCl-Lösung) und operative Entfernung der Keimschicht unter Belassen der Cuticula = Zystektomie oder Entfernung mit ganzer Cuticula = Perizystektomie. ▶ Merke. Eine Probepunktion eines unklaren Leberbefundes mit der Verdachtsdiagnose Echinokokkuszyste ist wegen der möglichen Verschleppung infektiösen Materials kontraindiziert. Therapie: Präoperative Vorbehandlung mit Albendazol oder Mebendazol (z. B. 2 Zyklen Albendazol 2 × 7,5 mg/kgKG/d p. o. über 4 Wochen mit 14-tägiger Pause). ■ Echinococcus granulosus: Ziel der chirurgischen Therapie ist die kontrollierte Abtötung und Entfernung aller Erreger unter sorgfältiger Vermeidung jeglicher Verschleppung infektiösen Materials. Die Abtötung der Scolices ist durch Instillation hyperosmolarer Lösungen (Glucose 50 %, NaCl 20 %) möglich. Das Operationsgebiet sollte nach vollständiger Mobilisation der Leber komplett gegen die übrige Perito- Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. 468 B ■ 469 1.10 Leber nealhöhle und die Operationswunde abgeschottet werden. Als operative Verfahren kommen die Entfernung der Keimschicht nach Eröffnung der Kutikula (Zystektomie) oder die Entfernung der Zyste mit Kutikula (Perizystektomie) infrage. Echinococcus multilocularis: Wegen des infiltrativen Wachstums besteht die chirurgische Therapie wie beim Malignom in einer Leberresektion mit einem mindestens 1 cm breiten Saum gesunden Leberparenchyms zwischen Befund und Resektionsfläche. Therapie bei Echinococcus multilocularis: Wegen infiltrativem Wachstums keine Perizystektomie, sondern Leberteilresektion wie bei einem Malignom. Prognose: Gut bei suffizienter intraoperativer Vermeidung jeglicher Kontamination. Bei Einbruch in das Gallengangssystem oder bei Rezidivoperationen sollte eine antiparasitäre Langzeittherapie (derzeit empfohlener Zeitraum: 0,5–2 Jahre) mit z. B. Mebendazol angeschlossen werden. Prognose: Bei Vermeidung jeder Kontamination gut. Bei Rezidivoperation oder Gallengangseinbruch parasitostatische Therapie mit Mebendazol anschließen. Leberabszesse Leberabszesse ▶ Definition. Man unterscheidet primäre Leberabszesse (z. B. parasitär, hämatogen ▶ Definition. Ätiologie: Die Mehrzahl der Leberabszesse entsteht hämatogen aus dem Pfortaderstromgebiet (z. B. Divertikulitis, M. Crohn, Colitis ulcerosa, Amöbenabszess) oder infolge einer aszendierenden Cholangitis (z. B. eitrige Cholecystitis oder Cholangitis, Caroli-Syndrom). Häufig manifestieren sich Leberabszesse mit einem deutlichen Intervall zur auslösenden Primärerkrankung. In einigen Fällen kann eine primäre Ursache nicht mehr eruiert werden. Ätiologie: Die Mehrzahl der Abszesse entsteht hämatogen aus dem Pfortaderstromgebiet durch Aszension bei eitriger Cholecystitis oder Cholangitis. Nicht immer ist ein extrahepatischer Herd eruierbar. Klinik: Auffälliges Krankheitsgefühl mit hohem septischen Fieber und oft deutlichem Druckschmerz im rechten Oberbauch auf dem Boden der Parenchymschwellung. Überwiegend ist die rechte Leber betroffen. Klinik: Schweres Krankheitsgefühl, septische Temperaturen, Druckschmerz im rechten Oberbauch bei Parenchymschwellung. Diagnostik: Sonografie und CT können den Befund lokalisieren und ermöglichen eine gesteuerte Punktion des Herdes zur Sicherung der Diagnose und bakteriologischen Abklärung. Bei etwa der Hälfte der Patienten findet sich eine positive Blutkultur. Die Thoraxaufnahme zeigt häufig (sympathische) Pleuraergüsse bei rechtsseitigem Zwerchfellhochstand. Diagnostik: Sonografie- oder CT-gesteuerte Lokalisation und Punktion des Abszesses zur Diagnosesicherung und bakteriologischen Abklärung. Therapie: Bei pyogenen solitären, nicht gekammerten Abszessen ist die interventionelle Einlage eines Spüldrainagekatheters das Therapieverfahren der Wahl (Abb. B-1.201). Bei ausgedehnten, gekammerten Abszessen und bei Patienten mit persistierender oder zunehmender klinischer Symptomatik nach interventioneller Drainage ist die operative Revision mit Eröffnung, Débridement, Spülung und Einbringen eines Spüldrainagesystems indiziert. In seltenen Fällen muss eine Resektion des betroffenen Leberanteiles erfolgen (Cave: Leberinsuffizienz beim septischen Patienten). Kann ein extrahepatischer Streuherd identifiziert werden, so ist dieser unbedingt zu sanieren. Ein Amöbenabszess wird im Gegensatz zum pyogenen Leberabszess im Allgemeinen medikamentös (Metronidazol 3 × 750 mg über 10 Tage) behandelt. Therapie: Bei pyogenen, nicht gekammerten Abszessen erfolgt die interventionelle Einlage eines Spüldrainagesystems. Bei großen gekammerten Abszessen oder bei Persistenz bzw. Zunahme der klinischen Symptome nach interventioneller Drainage muss die operative Sanierung mit Debridement, Spülung und Drainage folgen. Selten ist eine Leberresektion notwendig. Sanierung extrahepatischer Streuherde. Ein Amöbenabszess wird i. d. R. medikamentös behandelt. ⊙ B-1.201 Intrahepatischer Leberabszess a) CT-Befund. b) Gleicher Patient nach interventioneller Platzierung eines Spüldrainagekatheters (→). a b Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. oder Aszension von Keimen) von sekundären Abszessen (z. B. durch Infektion einer dysontogenetischen Leberzyste). 470 B Benigne Lebertumoren Benigne Lebertumoren Hämangiom Hämangiom ▶ Definition. 1 Allgemein- und Viszeralchirurgie ▶ Definition. Hämangiome repräsentieren abgesehen von Leberzysten den häufigs- ten benignen Lebertumor mit einer Inzidenz in Autopsieserien von 0,4–7,3 %. Man kann zwei Typen unterscheiden: Die häufigen kleinen (< 4 cm) kapillären und die seltenen großen (> 4 cm ) kavernösen Hämangiome. Epidemiologie, Ätiologie: Meist zwischen dem 30. und 70. Lebensjahr. Eine Schwangerschaft bzw. Östrogene können das Wachstum begünstigen. Histologie: fibröse Septen und cavernös erweiterte Sinus mit Endothelauskleidung, gute Abgrenzung gegenüber dem übrigen Lebergewebe. Klinik: Meist asymptomatisch. Bei entsprechender Größe oder Einblutung Druckgefühl oder Schmerzen im rechten Oberbauch. Selten freie Ruptur. Epidemiologie, Ätiologie: Kavernöse Hämangiome werden i. d. R. bei Erwachsenen zwischen dem 30. und 70. Lebensjahr diagnostiziert. Eine Schwangerschaft als auch Östrogene können das Wachstum von Hämangiomen begünstigen. Diagnostik: MRT (Goldstandard), CT und Duplexsonografie. Aufgrund hämangiomtypischer Strömungsverhältnisse und Kontrastmittelretention kann mit fast jedem bildgebenden Verfahren ein charakteristischer Befund erhoben werden (Abb. B-1.202). Diagnostik: Die richtige Verdachtsdiagnose kann aufgrund der Strömungscharakteristika und der Kontrastmittelretention von Hämagiomen mit fast jedem bildgebenden Verfahren gestellt werden (Abb. B-1.202). Die MRT stellt diagnostisch den Goldstandard dar. Die Duplex-Sonografie und CT können die Verdachtsdiagnose erhärten. Zusätzlich sollte ein Blutbild zur Abklärung einer Thrombozytopenie erfolgen. Die operative Exploration eines Hämagioms zur alleinigen Diagnosesicherung sollte die Ausnahme darstellen. Therapie: ■ Resektion bei großen oder symptomatischen Hämangiomen. ■ Interventionelle Embolisation bei multimorbiden Patienten oder ungünstiger sehr zentraler Lokalisation meist in mehreren Sitzungen. ■ Sehr selten Lebertransplantation bei riesigen, symptomatischen Hämangiomen, die nicht resektabel sind. Therapie: Kleine Hämangiome werden meist zufällig im Rahmen der Abklärung anders begründeter Beschwerden entdeckt und sollten allenfalls kontrolliert werden. ■ Symptomatische oder große kavernöse Hämagiome sollten primär reseziert oder bei erhöhtem operativem Risiko interventionell embolisiert werden. ■ Riesige, fast den ganzen Bauchraum ausfüllende Hämagiome können bei entsprechendem Leidensdruck des Patienten eine Indikation zur Lebertransplantation sein. Anmerkung. Das Kasabach-Merritt-Syndrom stellt eine Sonderform der Riesenzellhämangiome (Hämangiomatosis) dar, bei dem es zu einer Thrombozytopenie durch Thrombozytensequestration, Thrombosierung der Hämangiome und nachfolgender Ruptur kommen kann. Klinik: Die überwiegende Zahl der Hämangiome ist asymptomatisch. Die Häufigkeit von auftretenden Symptomen korreliert mit der Größe der Hämangiome. Es kommt zum Druck- und Völlegefühl bei linksseitiger Lokalisation sowie bei Größenzunahme und/oder Einblutung zu Schmerzen aufgrund der Kapselspannung. Freie Rupturen sind eine Rarität. Eine maligne Entartung wurde bisher nicht dokumentiert. ■ Intrahepatisches Hämangiom b a a) Angiografischer Befund eines großen, rechts intrahepatisch lokalisierten Hänangioms. b) Intraoperativer Befund des rechts lateral der Gallenblase liegenden Hämangioms. Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. ⊙ B-1.202 Histologie: Mikroskopisch bestehen Hämangiome aus kavernös erweiterten Sinus, ausgekleidet mit Endothel, die von fibrösen Septen unterschiedlicher Dicke begrenzt werden. Teilthrombosierungen sind die Regel. Die Tumoren sind gut begrenzt. B Fokal noduläre Hyperplasie (FNH) Fokal noduläre Hyperplasie (FNH) ▶ Definition. Die fokal noduläre Hyperplasie (FNH) der Leber imponiert makroskopisch als relativ fester rötlich bis gelblich brauner Tumor mit fibrösen Septen (Abb. B-1.203), die meist von einer zentralen fibrösen Narbe radiär nach außen verlaufen. In 20 % der Fälle sind multiple Herde in der Leber nachweisbar. ⊙ B-1.203 471 1.10 Leber ▶ Definition. ⊙ B-1.203 Fokal noduläre Hyperplasie (FNH) Intraoperativer Befund einer im linken Leberlappen lokalisierten FNH mit typischer Farbe und Gefäßzeichnung. Epidemiologie: Die FNH ist der zweithäufigste Lebertumor, der ganz überwiegend bei Frauen (w:m = 8:1) mit einer langjährigen Kontrazeptivaanamnese auftritt. Epidemiologie: Zweithäufigster Lebertumor, w:m = 8:1. Histologie: Mikroskopisch besteht die FNH aus Hepatozyten, Kupffer-Zellen und hyperplastischen Gallengängen sowie wandverdickten Blutgefäßen. Durch den septierten nodulären Aufbau gleicht sie einer „lokalen Leberzirrhose“. Histologie: Hepatozyten, Kupffer-Zellen, hyperplastische Gallengänge, wandverdickte Blutgefäße. Der septierte noduläre Aufbau gleicht einer „lokalen Leberzirrhose“. Ätiologie: Vermutlich Folge einer arterio-venösen Missbildung. Kontrazeptiva scheinen das Wachstum zu fördern. Ätiologie: Da das histologische Bild mehr einem reaktiven Vorgang denn einer Neoplasie gleicht, wird ätiologisch eine arteriovenöse Missbildung diskutiert. Die Läsion ist keine Präkanzerose und eine maligne Transformation ist bislang nicht bekannt. Kontrazeptiva scheinen das Wachstum zu fördern. Klinik: Die FNH wird häufig zufällig diagnostiziert. Bei entsprechender Größe können ein Druckgefühl oder rechtsseitige Oberbauchschmerzen auftreten. Spontane Rupturen und Einblutungen sind beschrieben. Klinik: Meist asymptomatisch. Druckgefühl bei großen Herden. Diagnostik: Farbkodierte Duplexsonografie, CT und MRT sind für die initiale Diagnostik geeignet. Die Diagnose basiert auf dem Nachweis einer zentralen Narbe in der Raumforderung. Eine sichere Diagnose ist jedoch mit bildgebenden Verfahren nicht möglich, da zum einem bei ca. 20 % der FNH keine zentrale Narbe vorhanden ist und zum anderen einige maligne Lebertumoren ebenso eine zentrale Narbe aufweisen können (fibrolamelläres HCC, Leberzelladenom, intrahepatisches Cholangiokarzinom). Der Nachweis einer solitären Zentralarterie mittels CT ohne portalvenöse Flusssignale ist typisch für die FNH und somit ein wichtiges differenzialdiagnostisches Kriterium zur Differenzierung von anderen Lebertumoren. Diagnostik: Nachweis einer zentralen Narbe durch farbkodierte Duplexsonografie, CT oder MRT. Zur Differenzierung von anderen Lebertumoren: Nachweis einer für die FNH typischen Zentralarterie ohne portalvenöse Flusssignale mit der Multidetektor-CT. Therapie. Bei symptomlosen Patienten sollte nur bei Größenzunahme unter Kontrolle die Indikation zur Resektion gestellt werden. Bei symptomatischen Patienten oder unklarem Befund ist die Indikation zur explorativen Laparotomie zu stellen, bei der dann in jedem Falle der Herd vollständig entfernt werden sollte. Hormonelle Kontrazeptiva sollten bei Frauen mit Nachweis einer FNH vermieden werden. Therapie: Bei asymptomatischen Patienten reicht Befundkontrolle. Hormonelle Kontrazeptiva sollten vermieden werden. Operative Exploration bei Größenzunahme oder unklarem Befund mit vollständiger Resektion. Hepatozelluläres Adenom (HCA, Leberzelladenom) Hepatozelluläres Adenom (HCA, Leberzelladenom) ▶ Definition. Im Gegensatz zur FNH hat das Leberzelladenom eine „leberähnliche“ ▶ Definition. Konsistenz, eine mehr gelblich braune Farbe und keine Septierungen (Abb. B-1.204). Histologie: Mikroskopisch ist das Leberzelladenom aus normalen Hepatozyten aufgebaut, Portalfelder fehlen, die Gefäße sind dünnwandig. Histologie: Normale Hepatozyten, keine Portalfelder, dünnwandige Gefäße. Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. aus: Kremer B., Henne-Bruns D.: Surgical technics. In: Lygidakis/Tytgat: Hepatobiliary and Pancreatic Malignancies. Thieme; 1989 472 ⊙ B-1.204 B 1 Allgemein- und Viszeralchirurgie ⊙ B-1.204 Leberzelladenom Ätiologie: Erhöhte Inzidenz in Verbindung mit Einnahme oraler Kontrazeptiva, aber auch bei Patienten mit Diabetes mellitus, Glykogenspeicherkrankheit, Hämochromatose und Akromegalie sowie bei Männern, die anabole Steroide einnehmen. Ätiologie: Schon vor den ersten Publikationen über den Zusammenhang zwischen Einnahme hormoneller Kontrazeptiva (ca. 1973) und Auftreten von Leberzell- und Funktionsveränderungen sowie Leberzelladenomen war eine ätiologisch-hormonelle Komponente aus Erfahrungen mit der Androgentherapie postuliert worden. Die Korrelation zwischen oraler Kontrazeption und Auftreten eines Leberzelladenoms ist nahezu 100 %. Die Inzidenz von Leberzelladenomen bei Frauen, die über einen langen Zeitraum Kontrazeptiva einnehmen, beträgt 4:100 000 Einwohner gegenüber 1:1 000 000 bei Frauen, die keine oder < 2 Jahre Kontrazeptiva eingenommen haben. Eine erhöhte Inzidenz wurde auch bei Patienten mit Diabetes mellitus, Glykogenspeicherkrankheit, Hämochromatose und Akromegalie sowie bei Männern, die anabole Steroide einnehmen, beobachtet. Klinik: Meist kommt es erst bei Leberzelladenomen ab einer Größe von 8 cm zu Symptomen. ⅔ der Patienten zeigen im Verlauf schwerwiegende Symptome. Bis zu ⅓ der Patienten erleiden eine spontane Ruptur mit Blutung und akuter Lebensbedrohung. Einblutung oder Größenzunahme führt zu Schmerzen und Druckgefühl im Oberbauch. Klinik: Kleine Leberzelladenome (< 1 cm) sind klinisch häufig stumm und werden zufällig entdeckt. Ab einer Größe von 8 cm kommt es meist zu klinischen Symptomen. Leberzelladenome treten in 80 % der Fälle solitär und in 20 % multipel auf. Im Gegensatz zur FNH werden ⅔ der Patienten mit einem Leberzelladenom im Verlauf der Erkrankung symptomatisch. Bis zu ⅓ der Patienten haben eine spontane Ruptur und Blutung in die freie Bauchhöhle mit einem akut lebensbedrohlichen Krankheitsbild. Da das Leberzelladenom i. d. R. sehr viel größer ist als die FNH, führen auch kleinere Einblutungen zu erheblichen Schmerzen. Meist bestehen aber schon vorher uncharakteristische rezidivierende Oberbauchschmerzen oder ein Druckgefühl. Diagnostik: Die Kombination aus multiphasischem CT und gadoliniumverstärkter MRT mit gleichzeitigem Nachweis eines arteriellen Enhancements, von Fett und Hämorrhagie ist unspezifisch charakteristisch. Die Differenzialdiagnose zum HCC ist oftmals schwierig. Auf eine Leberbiopsie sollte wegen eines potentiell falsch negativen Ergebnisses, des Blutungsrisikos und der möglichen Tumorzellverschleppung (HCC) verzichtet werden. Diagnostik: Geeignet für die Diagnostik ist eine Kombination aus multiphasischer CT und gadoliniumverstärkter MRT. Ein arterielles Enhancement mit gleichzeitigem Vorliegen von Fett und Hämorrhagie ist unspezifisch charakteristisch für das Leberzelladenom, sodass die Differenzialdiagnose zwischen Leberzelladenom und hochdifferenziertem hepatozellulären Karzinom (HCC) oftmals schwierig bleibt. Da in Leberzelladenomen maligne Herde im Sinne des HCC diagnostiziert werden, ist von der Möglichkeit einer malignen Transformation auszugehen. In der Differenzialdiagnose von Lebertumoren sollte auf eine Leberbiopsie verzichtet werden, da diese falsch negativ ausfallen kann, ein Blutungsrisiko aufweist und zur Tumorzellverschleppung führen kann. Therapie: Aufgrund des Komplikationsrisikos besteht die Indikation zur operative Entfernung. Selten ist eine Lebertransplantation notwendig. Therapie: Bei dem Leberzelladenom > 6 cm besteht aufgrund der möglichen Spontanblutung die Indikation zur Resektion. Beim Vorliegen multipler Leberzelladenome kann in seltenen Fällen eine Lebertransplantation indiziert sein. Regenerative noduläre Hyperplasie (RNH) Regenerative noduläre Hyperplasie (RNH) ▶ Definition. Epidemiologie: Prävalenz ca. 2,6 %, Inzidenz ca. 0,34/100 000 Patienten. ▶ Definition. Die hepatozellulären Regeneratknoten können über die gesamte Leber verteilt sein. Charakteristisch ist das Fehlen fibröser Septen zwischen den Knoten. Eine präneoplastische Komponente wird für das HHC bei nichtzirrhotischen Patienten vermutet, da bei 42 % der Patienten mit RNH dysplastische Hepatozyten gefunden wurden. Epidemiologie: Die Prävalenz der RNH wird in einer Autopsieserie mit 2,6 % angegeben. Die Inzidenz liegt bei 0,34/100 000 Patienten. Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. Intraoperativer Aspekt eines Leberadenoms rechts lateral der Gallenblase 473 Ätiologie: Die Obliteration kleiner Portalvenenäste impliziert eine vaskuläre Genese. Bei der Hälfte der Patienten liegt eine prothrombotische Erkrankung vor. Eine RNH tritt gehäuft bei Patienten mit Pfortaderthrombose auf und ist oft mit Autoimmunerkrankungen assoziiert. Außerdem wird ein gehäuftes Auftreten nach Nierentransplantation, bei hämatologischen Erkrankungen, Malignomen, rheumatischen Erkrankungen, Sarkoidose und bei Einnahme hepatotoxischer Medikamente (z. B. Azathioprin) festgestellt. Ätiologie: Eine vaskuläre Genese wird vermutet. Es besteht eine Assoziation zu Autoimmunerkrankungen. Gehäuftes Auftreten nach Nierentransplantation, bei hämatologischen Erkrankungen, Malignomen, rheumatischen Erkrankungen, Sarkoidose und nach hepatotoxischen Medikamenten. Klinik: Je nach Schweregrad kann die RNH zu einer portalen Hypertension führen, ohne dass eine Leberzirrhose vorliegt. Klinik: Je nach Schweregrad der portalen Hypertension. Diagnostik: Laborchemisch fallen die Patienten meist durch eine Erhöhung der Cholestaseparameter auf, evtl. begleitet von einem mäßigen Transaminasenanstieg. Im Ultraschall fallen die knotigen Leberparenchymveränderungen auf, die oftmals als Zirrhose und Pseudotumor interpretiert werden. Die Pseudotumoren lassen sich auch MR-morphologisch nachweisen. Bei den meisten Patienten liegen Antiphospholipidantikörper vor, deren Bedeutung für das Krankheitsbild jedoch noch unklar ist. Diagnostik: Meist erhöhte Cholestaseparameter. Songrafisch knotige Veränderungen des Leberparenchyms. Therapie: Die Therapie richtet sich hauptsächlich nach den Symptomen der portalen Hypertension und umfasst die Gabe von Betablockern, endoskopische Interventionen (Sklerotherapie, Gummibandligatur von Ösophagusvarizen), chirurgische Shunts und TIPS. Eine Splenektomie sollte wegen der erhöhten Gefahr einer Pfortaderthrombose vermieden werden. In seltenen Fällen kann aufgrund einer spontanen akuten Dekompensation eine Lebertransplantation indiziert sein. Bei Patienten mit nachgewiesener Koagulopathie kann eine lebenslange Antikoagulation notwendig sein. Therapie: Sie richtet sich hauptsächlich nach den Symptomen der portalen Hypertension. Bei nachgewiesener Koagulopathie kann eine lebenslange Antikoagulation notwendig sein. Maligne Lebertumoren Maligne Lebertumoren In der Systematik der Lebermalignome werden grundsätzlich zwei Gruppen unterschieden: ■ Primäre Lebermalignome: Im Wesentlichen das hepatozelluläre Karzinom und das cholangiozelluläre Karzinom (als weitere primäre Lebermalignome sind das Hepatoblastom und die sehr seltenen mesenchymalen Malignome (z. B. Angiosarkom) zu erwähnen. ■ Metastatische, sekundäre Lebermalignomen. Primäre Malignome der Leber sind definitionsgemäß aus leberspezifischen Zellen entstanden (z. B. hepatozelluläres Ca = HCC; cholangiozelluläres Ca = CCC). Als sekundäre Malignome werden alle in der Leber vorkommenden Metastasen definiert. Hepatozelluläres Karzinom (HCC) Hepatozelluläres Karzinom (HCC) Epidemiologie: Die Inzidenz variiert weltweit erheblich und erreicht in Asien und Afrika Inzidenzen zwischen 20 und 100 Fällen/100 000 Einwohner, während in Westeuropa 1–2 Fälle/100 000 Einwohner registriert werden. Bei etwa 70 % der Patienten entwickelt sich das HCC nach einer bestehenden Leberzirrhose, wobei erhebliche regionale Unterschiede mit Angaben zwischen 40 und 85 % bestehen (Abb. B-1.205). Epidemiologie: Die Inzidenz variiert weltweit erheblich, sie ist in Asien und Afrika hoch, in Westeuropa wesentlich niedriger. Bei etwa 70 % der Patienten besteht vor dem HCC eine Leberzirrhose (Abb. B-1.205). Ätiologie: An einem Zusammenhang zwischen Hepatitis-B-Infektion und HCC-Entstehung bestehen kaum Zweifel. In Regionen mit hoher HCC-Inzidenz sind bis zu 15 % der Bewohner HbsAg-positiv, in Westeuropa dagegen nur 1 % der Bevölkerung. ⊙ B-1.205 Ätiologie: Assoziation mit Hepatitis-B-Infektion. ■ Leberzirrhose als Präkanzerose. ■ m:w = 3–8:1. ■ ⊙ B-1.205 Hepatozelluläres Karzinom (HCC) Intraoperativer Aspekt eines primären HCC in einer nicht zirrhotischen Leber. Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. 1.10 Leber B 474 B 1 Allgemein- und Viszeralchirurgie Klinik: Meist Spätsymptome wie tastbarer Tumor, Schmerzen oder zunehmende Leberinsuffizienz. Klinik: Mit Ausnahme der Patienten, die z. B. wegen einer bekannten Leberzirrhose fortlaufend betreut werden (Sonografie, AFP), kommen Patienten mit einem HCC i. d. R. erst mit Spätsymptomen wie tastbarem Tumor, Schmerzen im rechten Oberbauch oder Zeichen der zunehmenden Leberinsuffizienz zur Diagnostik. Diagnostik: Die Lokalisation erfolgt sonografisch, mit CT oder MRT sowie Laborparametern (Tab. B-1.47, Tab. B-1.48, Abb. B-1.206). In der KM-Bildgebung zeigt sich eine arterielle Hyperperfusion. Ein erhöhtes alpha-Fetoprotein (AFP) als Tumormarker sichert die Diagnose weiter ab, es gibt aber auch AFP-negative HCC. Außerdem kann das AFP auch bei einer Leberzirrhose erhöht sein. Diagnostik: Die Befundlokalisation erfolgt sonografisch und/oder mit der CT oder MRT sowie Laborparametern (Tab. B-1.47, Tab. B-1.48, Abb. B-1.206). Typischerweise findet sich in der KM-Bildgebung eine arterielle Hyperperfusion. Ein erhöhtes alpha-Fetoprotein (AFP) als Tumormarker sichert die Diagnose eines HCC weiter ab, jedoch gibt es auch AFP-negative HCC. Außerdem kann das AFP auch bei einer Leberzirrhose mit Regeneratknoten erhöht sein. Als neuerer Tumormarker wird gegenwärtig Des-gamma-Carboxyprothrombin (DCP, = PIVKA-II) evaluiert. ≡ B-1.47 ≡ B-1.48 ≡ B-1.47 Hinweise auf eine pathologische Leberfunktion Parameter Wert Serum-Bilirubin > 1,5 mg/dl Quick < 50 % Faktor II < 50 % Faktor V < 50 % CHE im Serum < 2000 U/l Serum-Cholesterin < 100 mg/dl Serum-Albumin < 2,5 mg/dl Aszites ++ Bildgebende Diagnostik von Lebertumoren Raumforderung Ultraschall (FKDS) CT (nativ, KM) MRT Labor Echinokokkus echoarm hypodens hypointens KBR Zyste echofrei, scharfrandig hypodens, scharfrandig T 1: hypointens T 2: hyperintens unauffällig Abszess echoreich, verdickte Randstruktur nativ: hypodens T 1: hypointens Leukozytose, CRP KM: hyperdense Wandstruktur T 2: hyperintens Hämangiom echoreich, homogen, scharfrandig Irisblendenphänomen T 1: hypointens variabel, vermehrt arterielle Signale nativ: iso-/hyperdens T 1: isointens KM: frühe KM-Anreicherung, spät zentrale Narbe T 2: iso-/hyperintens echogleich/arm, unscharfer Rand nativ: isodens T 1: variabel KM: wie FNH ohne zentrale Narbe T 2: iso-/hyperintens FNH Adenom unauffällig T 2: hyperintens unauffällig zentrale Narbe unauffällig HCC echoarm, vermehrt arterielle KM: frühe KM Anreicherung Signale T 2: hyperintens AFP CCC echoarm KM: keine frühe KM Anreicherung T 2: fokale Cholestase CA19-9, CEA Metastase echoarm KM: meist keine Anreicherung, ggf. zentral hyperdens (TargetPhänomen) T 1: hpointens Tumormarker Primärtumor T 2: hyperintens Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. Sowohl bei „lebergesunden“ Virusträgern als auch im HCC-Gewebe kann nachgewiesen werden, dass Virus-DNA-Sequenzen in das Wirtsgenom integriert werden. Es wird vermutet, dass diese eingebauten DNA-Sequenzen Promotoren einer ungeregelten Proliferation sind. Neben der Hepatitis-B-Infektion werden weitere disponierende und zum Teil genetisch fixierte Faktoren untersucht. Hierzu gehören die unterschiedlichen Ätiologien der Leberzirrhosen, die 3- bis 8-fache Prävalenz des männlichen Geschlechtes und die bei einer vergleichbar weiß/schwarzen Bevölkerungen bis zu 8-fach höhere Inzidenz in der schwarzen Bevölkerung. Weitere hormonelle und toxische Risikofaktoren werden diskutiert. B ⊙ B-1.206 475 1.10 Leber CT-Befund eines hepatozellulären Karzinoms (HCC) ⊙ B-1.206 Die perkutane Leberbiopsie kann zu einem falsch negativen Ergebnis, Tumorzellverschleppung und Blutung führen. Damit bei Kandidaten für eine Lebertransplantation auf dies verzichtet werden kann, ist die Diagnosestellung HCC bei einem AFP > 400 μg/l und dem Nachweis einer hypervaskularisierten Raumforderung in einem bildgebenden Verfahren mit KM zulässig. Bei AFP-negativem HCC ist der Nachweis einer hypervaskularisierten Raumforderung in zwei bildgebenden Verfahren notwendig. Liegt ein potentiell resektables HCC vor, muss zur Indikationsstellung die funktionelle Leberreserve insbesondere bei Patienten mit einer Leberzirrhose evaluiert werden. Die perkutane Leberbiopsie kann zu einem falsch negativen Ergebnis, Tumorzellverschleppung und Blutung führen. Deshalb gilt die Diagnose HCC auch bei AFP > 400 µg/l und dem Nachweis in einer Bildgebung, bzw. bei AFP-negativem HCC der Nachweis in zwei bildgebenden Verfahren. Ermittlung von Leberfunktion und Restlebervolumen bei potenziell resektablen Tumoren, insbesondere bei Koinzidenz einer Leberzirrhose zur Abschätzung der Funktionsreserve. Therapie: Das Therapieverfahren der Wahl mit kurativer Intention ist die Resektion des Tumors (Abb. B-1.205). Diese kann wegen der z. B. auf dem Boden einer bestehenden Leberzirrhose begründeten Funktionseinschränkung trotz technischer Resektabilität oftmals kontraindiziert sein (Abb. B-1.206). Im Allgemeinen wird eine Lebertransplantation bei einer limitierten HCC-Situation in Cirrhose nach den sogenannten Milan-Kriterien (≤ 3 Raumforderungen < 3 cm oder eine Raumforderung < 5 cm) empfohlen. Mittlerweile gibt es auch gut begründbare wissenschaftliche Argumente diese restriktive Indikationsstellung auszuweiten und auch erweiterte Indikationen (z. B. San Francisco Kriterien) zu akzeptieren, wenn diese durch eine spezifische Tumorvorbehandlung ein gutes Ansprechen auf die Therapie haben. Bei nicht resektablen Tumoren können als palliative Therapieverfahren die transarterielle Chemoembolisation (TACE), die perkutane Alkoholinjektion (PAI) und ablative Verfahren wie z. B. Radiofrequenzablation (RFA) und laserinduzierte Thermotherapie (LITT) eingesetzt werden. Kurative Therapie: ■ Leberresektion ist Therapie der Wahl mit kurativer Intention. ■ Bei vorbestehender Funktionseinschränkung und kleinem Tumor Indikation zur Lebertransplantation. Palliative Therapie: ■ Transarterielle Chemoembolisation (TACE). ■ Perkutane Alkoholinjektion (PAI). ■ Ablative Verfahren wie Radiofrequenztherapie (RFA), Laser-induzierte Thermotherapie (LITT). Prognose: Unbehandelt führt die Erkrankung innerhalb kurzer Zeit (2–4 Monate) nach Diagnosestellung zum Tode. Die Resektion verbessert die mediane Überlebenszeit etwa um den Faktor 6, wobei verschiedene prognostische Faktoren wie Tumorgröße, Existenz einer Kapsel, Gefäßeinbruch, Differenzierungsgrad und Resektionsausmaß eine Rolle spielen. Entsprechend breit streuen die 5-Jahres-Überlebensraten von 10–60 %. Hinsichtlich der Prognose nimmt das fibrolamelläre HCC eine Sonderstellung ein. Da die Patienten überwiegend jünger als 40 Jahre sind und keine Leberzirrhose haben, ist die Resektabilitätsrate und Prognose in fast allen Serien deutlich besser. Eine Resektion sollte deshalb unbedingt angestrebt werden. Prognose: Der Spontanverlauf führt ab Diagnosestellung innerhalb von 2–4 Monaten zum Tode. Die Resektion verbessert die medianen Überlebenschancen etwa um den Faktor 6. Die 5-Jahres-Überlebensraten liegen breit gestreut zwischen 10 und 60 %. Das fibrolamelläre HCC wird i. d. R. bei jungen Patienten unter 40 Jahren ohne Leberzirrhose diagnostiziert. Resektionsraten und Prognose scheinen deutlich besser zu sein. Cholangiozelluläres Carcinom (CCC) Cholangiozelluläres Carcinom (CCC) ▶ Definition. Der Ursprung geht vom Gallengansepithel aus, sodass es sich histologisch um ein meist mucinöses Adenokarzinom handelt. Wegen der unterschiedlichen therapeutischen Konsequenzen und einem unterschiedlichen Wachstumsverhalten wird es von den Gallengangskarzinomen und dem Gallenblasenkarzinom (siehe Kap. Gallenwege) abgegrenzt. Den Tumoren gemeinsam ist eine ausgesprochen fibröse Komponente, wobei sich das CCC charakteristischerweise gegen das gesunde Leberparenchym wesentlich schlechter abgrenzen lässt. ▶ Definition. Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. CT-Befund eines kleinen HCC im rechten Leberlappen (→) einer zirrhotischen Leber. Der bestehende Aszites weist bei technischer Resektabilität auf eine eingeschränkte Funktionsreserve hin. Splenomegalie, kontrastierter Magen. 476 B 1 Allgemein- und Viszeralchirurgie Ätiologie: Unbekannt. Erhöhtes Risiko bei parasitärem Gallengangsbefall, angeborener Gallengangsdilatation, kongenitalen Gallengangszysten und angeborener Leberfibrose. Ätiologie: Die Ätiologie des CCC ist unbekannt, unterscheidet sich aber in jedem Falle von der des HCC. In Regionen mit hoher HCC-Inzidenz ist die Inzidenz des CCC eher niedrig und umgekehrt. Insgesamt macht das CCC 2,5–30 % aller primären Leberkarzinome aus. Die Geschlechtsverteilung ist fast ausgeglichen. Verschiedene Beobachtungen deuten darauf hin, dass parasitärer Gallengangsbefall, angeborene Gallengangsdilatation und Gallengangszysten sowie die kongenitale Leberfibrose ein erhöhtes Risiko für die Entstehung eines cholangiozellulären Karzinoms beinhalten. Klinik: Ikterus bei zentraler Lokalisation. Spätsymptome sind Druckgefühl und Schmerzen im rechten Oberbauch. Klinik: Je zentraler die Lokalisation, desto eher tritt als führendes Symptom ein Ikterus auf. Bei peripherer Lage treten Druckgefühl oder Schmerzen wie beim HCC erst als Spätsymptome auf. Diagnostik: Sonografie oder CT/MRT (Abb. B-1.207). Bei Ikterus kann eine MRC oder ERC notwendig sein. Diagnostik: Der Tumornachweis erfolgt durch Sonografie, CT oder MRT (Abb. B-1.207). Bei dem Leitsymptom Ikterus kann eine MRC oder ERC indiziert sein. Die schwierige Differenzialdiagnose zur Metastase kann eine erheblich aufwendige Primärtumorsuche erforderlich machen, da die Diagnose auch durch Biopsie nicht eindeutig zu stellen sein kann. Therapie: Bei kurativem Ansatz Resektion. In seltenen Fällen Lebertransplantation. Therapie: Die Therapie der Wahl ist die Resektion. Wegen der im Gegensatz zum HCC nicht vorhandenen Assoziation zur Leberzirrhose ist die Resektabilitätsrate höher und die Prognose besser. In seltenen Fällen besteht die Indikation zur Lebertransplantation. ⊙ B-1.207 ⊙ B-1.207 CT-Befund cholangiozelluläres Karzinom (CCC) IVa VIII CT nach i. v. KM-Gabe: Vom Leberhilus ausgehend hypodense Raumforderung der Segmente VIII und IVa. Es handelt sich um ein cholangiozelluläres Karzinom zentral im rechten Leberlapen (↑), Metastase im linken Leberlappen (Doppelpfeil). hilär/suprahilär Sekundäre Lebertumoren – Lebermetastasen In Europa sind Lebermetastasen die häufigsten Malignome und der Grund für die meisten Leberresektionen. Die Lebermetastasierung ist portal, arteriell und per continuitatem möglich. Der Nutzen der Resektion bei kolorektalen Lebermetastasen ist belegt. Das 5Jahres-Überleben liegt bei 20–45 %. Sekundäre Lebertumoren – Lebermetastasen Lebermetastasen sind in Europa mit weitem Abstand die häufigsten Lebermalignome und machen 50–80 % der Indikationen zu leberchirurgischen Eingriffen aus. Die Metastasierung in die Leber kann portal, arteriell, lymphogen oder per continuitatem erfolgen. Deshalb scheint die Resektion von Lebermetastasen prognostisch günstiger, wenn Metastasen des portalen Metastasierungsweges reseziert werden, da hier die Leber den ersten Filter darstellt. Bei Patienten mit Lebermetastasen kolorektaler Primärkarzinome liegen Langzeiterfahrungen über den therapeutischen Nutzen der Resektion von Metastasen vor. Je nach Indikationsstellung (Selektion!) liegen die 5-Jahres-Überlebensraten der leberresezierten Patienten zwischen 20 und 45 %. Klinik: Wird i. d. R. durch den Primärtumor (meist kolorektales Karzinom) verursacht. Klinik: Nur ausnahmsweise führen synchrone Lebermetastasen eines unbekannten Primärtumors mit Druckgefühl oder Schmerzen im rechten Oberbauch zur Abklärung und Primärtumorsuche. Meist ist das primäre kolorektale Karzinom symptomführend, sodass synchron bestehende Lebermetastasen im Rahmen des Primärtumor-Stagings gefunden werden bzw. metachron auftretende Metastasen in der Nachsorge diagnostiziert werden. Diagnostik: Lebermetastasen werden meist im Rahmen der Tumornachsorge (sonografisch oder per CT) festgestellt. Gegebenenfalls kann eine Szintigrafie indiziert sein. Diagnostik: Meistens werden Lebermetastasen im Rahmen der Nachsorgeuntersuchungen einer Karzinomerkrankung sonografisch oder computertomografisch diagnostiziert. Bei gezielten Fragestellungen können szintigrafische Verfahren ergänzend eingesetzt werden. Ein Wiederanstieg von Tumormarkern im Verlauf (z. B. CEA, CA19-9) kann auf ein Tumorrezidiv hinweisen. Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. Die Differenzialdiagnose zur Metastase eines Adenokarzinoms kann schwierig bis unmöglich sein. B ⊙ B-1.208 477 1.10 Leber Lebermetastasen a b Vor der Indikationsstellung zu einem z. B. resezierenden Therapieverfahren bei Lebermetastasen hat die folgende Diagnostik vorrangige Bedeutung: ■ Ausschluss eines Lokalrezidivs des Primärkarzinoms (z. B. Koloskopie, MRT des kleinen Beckens). ■ Ausschluss einer extrahepatischen, metastatischen Tumormanifestation (z. B. Knochenszintigramm, CT-Thorax). ■ Feststellung der lokalen Resektabilität (z. B. CT, MRT). Für die Indikation zur Resektion ist nötig: ■ Ausschluss eines Lokalrezidivs des Primärkarzinoms. ■ Ausschluss einer zusätzlichen, extrahepatischen Metastasierung. ■ Festlegung der potenziellen Resektabilität. Therapie: Die Indikationsstellung zur Resektion von Lebermetastasen (Abb. B-1.208) ist beim kolorektalen Primärkarzinom durch Langzeitergebnisse abgesichert, bei anderen Primärkarzinomen wie z. B. beim Mammakarzinom nicht. Als Resektionskriterien kolorektaler Metastasen gelten: ■ R0-Resektion von intra- und extrahepatischen Metastasen möglich. ■ Erhalt von mindestens zwei angrenzenden Lebersegmenten. ■ Ungestörter vaskulärer Zu- und Abfluss sowie ungestörte biliäre Drainage des verbleibenden Lebergewebes. ■ Adäquates Restlebervolumen entsprechend 0,5 % des Körpergewichts (siehe individuelle Risikokalkulation S. 477). Die Anzahl der resezierten Lebermetastasen hat keinen Einfluss auf das Patientenüberleben. Eine selektive Lymphadenektomie scheint prognostisch von Vorteil zu sein. Der heutige Standard ist die parenchymsparende Leberresektion. Lungenmetastasen sind keine Kontraindikation, da diese lungenparenchymsparend reseziert werden können. Bei synchroner Lebermetastasierung sollte die Resektion des kolorektalen Primärkarzinoms mit der Resektion der Lebermetastasen gleichzeitig vorgenommen werden. Bei metachronen Lebermetastasen kann die Resektion ein- oder zweizeitig erfolgen. Das zweizeitige Vorgehen bei bi-lobärer Metastasierung beinhaltet die Sanierung der residualen Lebersegmente, anschließend eine Pfortaderligatur oder -embolisation. Nach ausreichender Hypertrophie der residualen Lebersegmente erfolgt die Resektion der embolisierten Lebersegmente. Bei Irresektabilität werden palliativ die systemische und lokoregionale Chemotherapie sowie die Chemoembolisation eingesetzt. Therapie: Die Resektion von Lebermetastasen (Abb. B-1.208) ist nur für das kolorektale Primärkarzinom gesichert. Der heutige Standard ist die parenchymsparende Leberresektion. Wichtig ist, dass postoperativ ein adäquates Restvolumen verbleibt. Palliativ kommen systemische und lokoregionale Chemotherapie sowie Chemoembolisation zum Einsatz. 1.10.5 Therapieverfahren an der Leber 1.10.5 Therapieverfahren an der Leber Individuelle Risikokalkulation Individuelle Risikokalkulation Vor einem leberchirurgischen Eingriff muss eine Kalkulation des individuellen Risikos erfolgen, um das Risiko einer postoperativen Leberinsuffizienz zu minimieren. Als Risikofaktoren für eine postoperative Leberinsuffizienz gelten neben dem zu erwartenden Resektionsausmaß insbesondere eine eingeschränkte Leberfunktion und Regenerationsfähigkeit. Diese können durch eine vorbestehende Leberfibrose, Leberzirrhose, Cholestase, Cholangitis, Steatosis hepatitis oder eine präoperative Chemotherapie bedingt sein. Wichtig ist die Kalkulation des individuellen Risikos vor leberchirurgischen Eingriffen zur Vermeidung einer postoperativen Leberinsuffizienz. Risikofaktoren: ■ Resektionsausmaß. ■ Eingeschränkte Leberfunktion. ■ Leberfibrose oder -zirrhose. Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. a) CT-Befund einer großen solitären Lebermetastase im rechten Leberlappen mit zentraler Tumornekrose (→) und Hypertrophie der Restleber, zusätzlich 2 kleine Zysten im linken Leberlappen. b) Intraoperativer Befund einer großen Lebermetastase im rechten Leberlappen mit typischer zentraler Einziehung infolge der Tumornekrose. B 1 Allgemein- und Viszeralchirurgie Bei normaler Qualität des Leberparenchyms können bis zu 80 % entfernt werden. Bei einer normalen Leberparenchymqualität können bis zu 80 % des Gesamtvolumens entfernt werden. Bei einer Steatose, Hepatitis oder präoperativen Chemotherapie sollten nicht mehr als 40–50 % reseziert werden. Bei Vorliegen einer Steatose muss der Grad der Verfettung bei der Kalkulation des verbleibenden Lebergewebes prozentual abgezogen werden. Eine präoperative Chemotherapie mit Oxaliplatin kann zu einer sinusoidalen Dilatation führen, welches nach einer Leberresektion zu einem gestörten venösen Abfluss führen kann. Bei einer höhergradigen Leberfibrose kann anhand der Child-Pugh-Klassifikation (Tab. B-1.51 S.488) das Risiko abgeschätzt werden. Eine Leberresektion mit Verlust von mehr als 20 % des Leberparenchyms ist ab dem Stadium Child B kontraindiziert. Bei primären Lebermalignomen in einer Leberzirrhose ist die Indikation für eine Lebertransplantation zu prüfen. Bei einer Cholestase ist die Regenerationsfähigkeit der Leber ab einem Bilirubin > 4 mg/dl deutlich eingeschränkt und erfordert vor der Leberresektion eine interventionelle Entlastung der Cholestase (z. B. perkutane transhepatische Cholangiografie mit Drainage). Bei einer Cholangitis ist abzuwägen, ob die Leberresektion den Infektfokus saniert. Operative Therapieverfahren Operative Therapieverfahren Durch die Regenerationsfähigkeit der Leber unterscheidet sich die Leberresektion grundsätzlich von allen anderen Resektionen an parenchymatösen Organen. Anatomische Resektionen werden von nicht anatomischen unterschieden. Anatomische Resektionen orientieren sich am segmentalen Aufbau der Leber. Standardverfahren sind: Die Leberresektion unterscheidet sich grundsätzlich von der Resektion anderer Anteile parenchymatöser Organe, da sie von einer schrittweisen Regeneration des verbliebenen Lebergewebes gefolgt ist (Ausnahme: Leberzirrhose!). Über die ersten Leberresektionen wurde bereits Ende des 19. Jahrhunderts berichtet. So führte Langenbuch 5 Jahre nach seiner erstmaligen Cholecystektomie 1882 die erste Resektion eines linken Leberlappens durch. Grundsätzlich werden heute bei den Operationsverfahren an der Leber anatomische von nichtanatomischen Resektionen unterschieden. Anatomische Resektionen orientieren sich am segmentalen Aufbau der Leber, der über das arterioportale und biliäre System einerseits und den venösen Abstrom zur Vena cava inferior andererseits definiert ist. Nichtanatomische Resektionen werden überwiegend nur bei gutartigen Tumoren als auch bei bösartigen Tumoren, bei diagnostischen Keilresektionen kleiner Tumore oder zum Débridement bei schweren Leberverletzungen durchgeführt. Die Resektion beim Malignom verlangt bei kurativer Intention eine R0-Resektion, das heißt eine mikro- und makroskopische Entfernung des Tumors im Gesunden. Minimale Resektionsabstände werden heute akzeptiert, der ehemals verlangte Sicherheitsabstand von 1 cm bei kolorektalen Lebermetastasen erbrachte gegenüber der R0-Resektion keinen Überlebensvorteil. Bei symptomatischen neuroendokrinen Lebermetastasen kann eine R2-Resektion, das heißt mit makroskopischem Verbleib von Tumorgewebe, als ausgedehnte Tumormassenreduktion zur Linderung der Symptome indiziert sein. Falls das residuale Lebervolumen einer geplanten Resektion zu klein wäre, kann durch eine präoperative Unterbindung des Pfortaderflusses (z. B. Ligatur oder Embolisation) des tumorständigen Leberlappens eine Hypertrophie des residualen Lebergewebes erreicht werden, welches zweizeitig eine Resektion ermöglichen kann. Die Zielgröße für das residuale Lebervolumen beträgt 0,5 % des Körpergewichts, welches meist 4–6 Wochen nach Ligatur oder Embolisation der Pfortader erreicht wird. Folgende Operationsverfahren werden unterschieden: Segmentektomie Segmentektomie Segmentektomie: Nach Anzahl entfernter Segmente und spezifiziert durch Angabe der Segmentzahl I-VIII. Entsprechend der Zahl der entfernten Segmente werden Mono-, Bi- und Mehrsegmentektomien unter Angabe der Zahlenbezeichnungen der entfernten Segmente klassifiziert. Bei der atypischen Leberresektion erfolgt die Bezeichnung des Lebersegments durch den Zusatz p (z. B. Segment pV). Monosegmentektomie: Entfernung eines einzelnen Lebersegments. Monosegmentektomie: Diese bezeichnet die Entfernung eines einzelnen Lebersegments. Eine Besonderheit ist die isolierte Resektion des Segments I, welches über die kleinen Lebervenen drainiert. Bisegmentektomie: Entfernung von zwei Lebersegmenten. Bisegmentektomie: Diese bezeichnet die Entfernung von zwei Lebersegmenten. Ein typisches Beispiel ist die linkslaterale Leberresektion (Segmente II + III). Die nicht anatomische Resektion ist das Verfahren der Wahl bei benignen Tumoren und diagnostischen Eingriffen. Bei kurativer Intention beim Malignom ist eine R0-Resektion notwendig. Bei symptomatischen neuroendokrinen Lebermetastasen kann eine R2-Resektion zur Linderung der Symptome helfen. Falls das residuale Lebervolumen einer geplanten Resektion zu klein wäre, kann durch eine präoperative Unterbindung des Pfortaderflusses des tumorständigen Leberlappens eine Hypertrophie des residualen Lebergewebes erreicht werden. Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. 478 B 479 1.10 Leber Mesohepatektomie Mesohepatektomie Hierunter versteht man eine zentrale Leberresektion, welche die Segmente IV, V und VIII beinhaltet. Der Begriff „Meso“ ist jedoch irreführend und sollte besser als zentrale Leberresektion bezeichnet werden. Zentrale Leberresektion der Segmente IV, V und VIII. Hemihepatektomie Hemihepatektomie Die Resektion der Segmente V–VIII wird als rechte, die der Segmente I–IV als linke Hemihepatektomie definiert. Die Definition orientiert sich am Versorgungsgebiet der rechten bzw. linken arterioportalen Strombahn. Die transparenchymatöse Resektionsebene folgt einer Linie, die vom Gallenblasenbett ausgeht und zur rechten Lebervene und der retrohepatischen V. cava führt. Bei der Hemihepatektomie rechts werden etwa 60–70 % des Parenchymvolumens entfernt, bei der Hemihepatektomie links ca. 30–40 % (Abb. B-1.209). Rechts: Segmente V–VIII; links: Segmente I– IV. Die Resektion erfolgt vom Gallenblasenbett aus bis zur retrohepatischen V. cava und der rechten Lebervene (Abb. B-1.209). Präparierter Hilus (a) und Hemihepatektomie (b) a b a Intraoperativer Befund vor einer linksseitigen Hemihepatektomie; Präparation der Strukturen im Lig. hepatoduodenale (gelbe Zügel = D. choledochus und linker D. hepaticus; roter Zügel = Aa. hepatica propria und dextra; blauer Zügel = linker Pfortaderstammast). b Intraoperativer Befund bei einer rechtsseitigen Hemihepatektomie zur Resektion einer großen Lebermetastase. Livide Verfärbung des Parenchyms nach Durchtrennung der rechten Leberarterie und des rechten Pfortaderstammastes. aus: Kremer B., Henne-Bruns D.: Surgical technics. In: Lygidakis/Tytgat: Hepatobiliary and Pancreatic Malignancies. Thieme; 1989 Erweiterte Hemihepatektomie Erweiterte Hemihepatektomie Eine erweiterte Hemihepatektomie rechts liegt vor, wenn zusätzlich zu den Segmenten V–VIII das Segment IV komplett oder partiell (Segment IVa oder IVb) reseziert wird. Bei dieser Form der Leberresektion werden ca. 70–85 % des gesamten Leberparenchyms entfernt. Erfolgt zusätzlich zu einer Hemihepatektomie links die Resektion der Segmente V und/oder VIII, spricht man von einer erweiterten Hemihepatektomie links, die einen Parenchymverlust von ca. 65–75 % ausmacht. Als Voraussetzung für eine erweiterte Hemihepatektomie muss geprüft werden, ob das verbleibende Lebergewebe ein ausreichendes Restvolumen (0,5 % des Körpergewichts), eine suffiziente Leberfunktion (Bilirubin < 4 mg/dl, Child A) und Regenerationsfähigkeit (Ausschluss höhergradige Fibrose) besitzt. Als Ausdruck einer vorübergehenden Leberinsuffizienz kann postoperativ übergangsweise ein Ikterus auftreten. Rechts: Segmente V–VIII + IVa und IVb; das entspricht ca. 75–80 % des Leberparenchyms. Links: Segmente I–IV + V, das ist ein Parenchymverlust von 65–75 %. Voraussetzung ist ein ausreichendes Restvolumen bei guter Funktion und Regenerationsfähigkeit. Lobektomie Lobektomie Der im deutschen Sprachgebrauch gelegentlich benutzte Begriff orientiert sich am Ligamentum falciforme, sodass eine rechtsseitige Lobektomie einer erweiterten Hemihepatektomie rechts entspricht und eine linkseitige Lobektomie nur eine linkslaterale Bisegmentektomie (Segmente II–III) repräsentiert. Da sich der Begriff nicht an den wesentlichen anatomischen Strukturen orientiert und im Zusammenhang mit dem englischen Begriff „lobectomy“ zur Begriffsverwirrung führt, sollte der deutsche Begriff Lobektomie nicht mehr verwendet werden. Da sich der Begriff nicht an den wesentlichen anatomischen Strukturen orientiert und im Zusammenhang mit dem englischen Begriff „lobectomy“ zur Begriffsverwirrung führt, sollte der deutsche Begriff Lobektomie nicht mehr verwendet werden. Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. ⊙ B-1.209 480 B Grundprinzipien der Operationstechnik Grundprinzipien der Operationstechnik Ein hoher Grad an Standardisierung hat in der Leberchirurgie zu erheblicher Risikominderung geführt. Die operationsbedingte Letalität liegt je nach Grunderkrankung zwischen 0 und 15 %. Wichtig ist eine ausführlich präoperative Diagnostik. Leberchirurgische Eingriffe haben heute einen hohen Grad an Standardisierung und Sicherheit erreicht, sodass in Abhängigkeit von der Grunderkrankung das Letalitätsrisiko zwischen 0 und 15 % liegt. Voraussetzungen zur Minimierung des Operationsrisikos sind eine angemessene präoperative Diagnostik mit Erfassung allgemeiner, aber insbesondere auch potenziell operationstechnischer Risiken wie sie in Abb. B-1.197 am Beispiel einer Tumorummauerung der Pfortaderaufzweigung dargestellt sind. Ein wesentlicher operationstechnischer Sicherheitsfaktor bei allen Leberresektionen ist die grundsätzlich vollständige Mobilisation der Leber, um jederzeit alle versorgenden Gefäße und die infra- und suprahepatische V. cava kontrollieren zu können. Für eine Hemihepatektomie werden alle Strukturen im Lig. hepatoduodenale (A. hepatica communis, A. hepatica propria, rechte und linke Leberarterie, Gallengang mit Hepaticusgabel, Pfortader mit Pfortadergabel (Abb. B-1.209) dargestellt. Im ersten Präparationsschritt werden meist Ductus cysticus und Arteria cystica durchtrennt und die Gallenblase entfernt. Anschließend werden die Leberarterie und der zentrale Pfortaderstammast der zu entfernenden Seite unterbunden. Als Folge verfärbt sich das Parenchym der unterbundenen Seite livide und gibt so die vom Gallenblasenbett zur rechten Lebervene und zur V. cava verlaufende transparenchymatöse Resektionsebene vor (Abb. B-1.209). Für die Durchtrennung des Leberparenchyms stehen verschiedene Techniken zur Verfügung: CUSA, Ultracision, Hydrojet, Radiofrequenz-Dissektion, Sealer oder Stapler-Dissektion. Beim CUSA z. B. weicht das Lebergewebe auseinander, wodurch sich die Gefäße und Gallenwege darstellen, welche dann unterbunden und durchtrennt werden können. Während der Resektion kann der arterioportale Zufluss zur gesunden, verbleibenden Leberseite durch Okklusion des Ligamentum hepatoduodenale unterbrochen werden. Dieses „Pringle-Manöver“ (S. 483) genannte Verfahren reduziert den potenziellen Blutverlust erheblich und wird von gesundem Leberparenchym unter den Bedingungen der warmen Ischämie bis zu 60 Minuten bei intermittierender Anwendung toleriert. Die Ischämietoleranz der Leber kann durch eine ischämische Präkonditionierung erhöht werden. Hierbei wird das Ligamentum hepatoduodenale vor Beginn der Resektion 2–3-mal intermittierend für 10 Minuten ausgeklemmt. Dieses führt über die Freisetzung von Hitze-Schock-Proteinen zu einer Stabilisierung der sinusoidalen Endothelzellen. Die Resektionsfläche bleibt nach vervollständigter Blutstillung entweder offen oder wird mit einer Netzplombe, Fibrinkleber oder Kollagen etc. gedeckt. Zur Reduktion des Blutverlustes kann eine komplette Unterbrechung des Blutzuflusses mit einem Tourniquet auf dem Lig. hepatoduodenale erfolgen (Pringle-Manöver). Die warme Ischämietoleranz gesunden Leberparenchyms beträgt bis zu 60 Minuten. Palliative und adjuvante Therapieverfahren Palliative und adjuvante Therapieverfahren Bei Irresektabilität können folgende palliativen Therapieverfahren angewendet werden: Perkutane Alkoholinjektion (PAI), ablative Verfahren, transarterielle Chemoembolisation (TACE), systemische Chemotherapie und lokoregionäre Chemotherapie. Palliative Verfahren kommen bei irresektablen primären und sekundären malignen Tumoren der Leber infrage. Neben der systemischen Chemotherapie liegen nennenswerte Erfahrungen mit der perkutanen Alkoholinjektion (PAI) beim HCC, den lokal ablativen Verfahren bei primären und sekundären Lebertumoren, der transarteriellen Chemoembolisation (TACE) beim HCC und mit der lokoregionären Chemotherapie bei Metastasen kolorektaler Primärkarzinome vor. Diese Verfahren werden im Folgenden nur prinzipiell dargestellt. Perkutane Ethanolinjektion (PEI) Perkutane Ethanolinjektion (PEI) Die perkutane Ethanolinjektion ist eine ausschließlich palliative Therapieoption beim HCC. Die perkutane Ethanololinjektion kann palliativ beim HCC eingesetzt werden und eignet sich insbesondere bei Vorliegen einer Pseudokapsel, wodurch der injizierte Alkohol eine lokale Tumordestruktion verursacht und nicht abströmt. Die Injektion des Alkohols erfolgt ultraschallgestützt in das Zentrum des Tumors. Lokal ablative Verfahren Lokal ablative Verfahren Lokal ablative Verfahren zerstören über eine in das Zentrum der Raumforderung eingebrachte Sonde lokal Gewebe durch applizierte Kälte oder Wärme. Die Platzierung der Sonde erfolgt mit einem bildgebenden Verfahren Die ablativen Verfahren ermöglichen eine lokale Tumordestruktion und werden fast ausschließlich palliativ eingesetzt. Das Prinzip der Ablation basiert auf einer Tumordestruktion durch lokale Anwendung von Kälte (Kryo) oder Wärme (RFA, LITT). Hierzu wird eine Sonde in das Zentrum der zu abladierenden Raumforderung eingeführt, an deren Spitze die Energie freigesetzt wird. Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. Vorgehen bei Hemihepatektomie: ■ Mobilisation der Leber und Präparation aller Lebergefäße (Abb. B-1.209). ■ Entfernung der Gallenblase. ■ Unterbinden von Arterie und Pfortaderstammast der zu resezierenden Seite mit livider Verfärbung des zu resezierenden Gewebes. ■ Präparation durch das Lebergewebe mit schrittweisem Unterbinden oder Clippen von Gefäßen und Gallengängen. 1 Allgemein- und Viszeralchirurgie B 1.10 Leber Bei der Kryotherapie erfolgt eine Vereisung des Tumorgewebes, welches zur Nekrose führt. Bei der Radiofrequenzablation (RFA) (Abb. B-1.210) versetzen die Radiofrequenzwellen die umgebenden Moleküle in Schwingung. Die dadurch entstehende Wärme destruiert das umgebende Gewebe. Bei der laserinduzierten interstitiellen Thermotherapie (LITT) erfolgt die Gewebezerstörung durch die Lichtenergie des Lasers. Die präzise Platzierung der Sonde erfolgt ultraschallgestützt intraoperativ oder perkutan, CT-gestützt perkutan oder MR-gestützt perkutan. Bei größeren Raumforderungen kann bei der RFA eine Sonde mit mehreren Nadeln verwendet werden, wodurch Raumforderungen bis 7 cm Durchmesser abladiert werden können. Die induzierte Nekrose führt postinterventionell oftmals zu einer Zytokinfreisetzung mit Fieber und erhöhten Leberwerten, die innerhalb von 1–2 Tagen rückläufig ist. ⊙ B-1.210 481 (Sono, MR, CT) oder intraoperativ. Möglich sind: ■ Kryotherapie (Kryo). ■ Radiofrequenzablation (RFA) (Abb. B-1.210). ■ Laser-induzierte interstitielle Thermotherapie (LITT). Die induzierte Nekrose führt postinterventionell oft zu kurzzeitigem Fieber und reversiblen erhöhten Leberwerten. Therapie des HCC a b c Transarterielle Chemoembolisation d Lokoregionäre Chemotherapie e f a HCC in Zirrhose, CT. b Radiofrequenzablation, CT mit Ablationssonde im Tumor. c Radiofrequenzablation, CT Kontrolle nach 2 Wochen, vollständige Tumordestruktion. d Transarterielle Chemoembolisation (TACE). e, f Lokoregionäre Chemotherapie: (e) Implantation eines Kathetersystems in die A.gastroduodenalis. Nach Injektion von Methylenblau färben sich Lebergewebe und ein Segment des Duodenums homogen. Die ebenfalls angefärbte Gallenblase wird zur Vermeidung therapiebedingter entzündlicher Komplikationen entfernt. (f) Das Portsystem wird subkutan platziert und kann leicht punktiert werden. Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. Radiofrequenzablation 482 B Transarterielle Chemoembolisation (TACE) Transarterielle Chemoembolisation (TACE) Bei der TACE (Abb. B-1.210) werden zwei therapeutische Verfahren synchron eingesetzt: ■ Intraarterielle Embolisation zur Unterbindung der Sauerstoffversorgung des Tumors. ■ Intraarterielle Gabe eines Chemotherapeutikums mit hoher lokaler Konzentration im Tumorgebiet. Die TACE (Abb. B-1.210) vereinigt zwei therapeutische Prinzipien. Das erste, die Embolisation, hat das Ziel, die Sauerstoffversorgung des Tumors möglichst vollständig zu unterbinden. Dabei kommt dem Verfahren das Phänomen zu Hilfe, dass das HCC überwiegend arteriell versorgt wird und somit das Embolisat anzieht. Die Applikation des Embolisats (z. B. Lipiodol) erfolgt superselektiv über einen Katheter, der über die Femoralarterie bis in die Lebersegmentarterien vorgeschoben wird. Die Effizienz der Embolisation wird durch gleichzeitige intraarterielle Applikation eines Chemotherapeutikums (z. B. Adriamycin) über den Katheter gesteigert. Die TACE kann im Verlauf wiederholt angewendet werden. Limitierend ist die Toxizität des Chemotherapeutikums. Lokoregionäre Chemotherapie Lokoregionäre Chemotherapie Bei der lokoregionären Chemotherapie wird ein Kathetersystem in die A. gastroduodenalis so implantiert, dass ein Chemotherapeutikum kontinuierlich oder intermittierend direkt über die Leberarterie die Lebermetastasen oder das Karzinom in hoher Konzentration erreicht (Abb. B-1.210). Die lokoregionäre Chemotherapie versucht das duale arterioportale Versorgungssystem der Leber zu nutzen. Als Indikation werden nicht resektable Metastasen kolorektaler Primärkarzinome und irresektable primäre Leberzellkarzinome angesehen. Besonders geeignet sind Patienten, bei denen angiografisch eine überwiegend arterielle Blutversorgung der Metastasen besteht. Ein Verweilkatheter wird in die Arteria gastroduodenalis implantiert, welcher mit einem in einer subkutanen Tasche fixierten Port- oder Pumpensystem konnektiert wird (Abb. B-1.210). Über das direkt punktierbare System können Chemotherapeutika kontinuierlich oder sequenziell appliziert werden. Der Vorteil liegt in der Höhe der Zytistatikakonzentration bei dieser Art der Applikation einerseits und andererseits in der Tatsache, dass ein Teil der Zytostatika schon bei der ersten Leberpassage metabolisiert wird, was zu einer Reduktion der Nebenwirkungen zum Beispiel im Vergleich zur systemischen Applikation führt. Bei Lebermetastasen kolorektaler Karzinome werden in 30–70 % der Fälle Remissionen oder ein Krankheitsstillstand beobachtet, bei ⅓ der Patienten ist der Krankheitsverlauf weiter progredient. Ob die lokoregionäre Chemotherapie im Vergleich zur systemischen Applikation einen Vorteil hinsichtlich einer Lebensverlängerung bietet, konnte bisher keine Studie sicher klären. 1.10.6 Lebertrauma 1.10.6 Lebertrauma Einteilung und Schweregrade Einteilung und Schweregrade Ursachen von Leberverletzungen: ■ Schussverletzungen, Stichverletzungen. ■ Parenchymberstungen nach stumpfem Bauchtrauma und Dezelerationstraumen mit Ausriss der Leber aus dem Halteapparat. Die Letalität des Lebertrauma liegt heute dank verbesserter Techniken zur Kontrolle von Blutungen bei 10 %. Ausgehend von den Ursachen einer Leberverletzung sind perforierende Schuss- und Stichverletzungen von Leberparenchymberstungen infolge eines stumpfen Bauchtraumas und Dezelerationstraumen (Sprung aus großer Höhe; Auffahrunfall) mit Ausriss der Leber aus den Aufhängebändern zu unterscheiden. Bei der Einschätzung einer Schussverletzung muss berücksichtigt werden, dass der Grad der Parenchymverletzung von der Größe und Splitterwirkung sowie der Geschwindigkeit des Geschosses abhängt. Noch Mitte dieses Jahrhunderts lag die Letalität des Lebertraumas bei etwa 65 %. Mit zunehmender Erfahrung in der resezierenden Leberchirurgie sowie der Lebertransplantation stieg die Zahl technischer Möglichkeiten zur Kontrolle und Versorgung von Blutungen der Leber und die Zahl damit vertrauter Chirurgen. Die Folge war eine erhebliche Verbesserung der Ergebnisse auch bei schweren Leberverletzungen mit einer mittleren Letalität, die heute bei etwa 10 % liegt. Komplikationen: Blutung, Galleleckage, Abszesse, Zeichen einer Leberinsuffizienz, Hämobilie, Bilhämie. Komplikationen: Typische Komplikationen, die nach einem schweren Lebertrauma (Grad III–IV) auftreten können, sind: ■ Blutung. ■ Galleleckage und Fistel. ■ Subphrenischer, subhepatischer und intraheaptischer Abszess. ■ Zeichen der Leberinsuffizienz (z. B. Ikterus, mangelhafte Syntheseleistung). ■ Hämobilie (Falschverbindung vom Gefäßssystem zum Gallengangsystem führt zur Blutung aus der Papille). ■ Bilhämie (Falschverbindung vom Gallengangsystem zu den Lebervenen führt zur exzessiven Bilirubinerhöhung). Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. Vorteilhaft ist hier die Höhe der Zytistatikakonzentration und dass ein Teil der Zytostatika bei der ersten Leberpassage metabolisiert wird, mit einer Reduktion der Nebenwirkungen. Bei ⅓ der Patienten ist der Krankheitsverlauf trotzdem weiter progredient. 1 Allgemein- und Viszeralchirurgie B Diagnostik: Diese erfolgt im Rahmen des Polytraumamanagements durch einen orientierenden Ultraschall im Schockraum sowie anschließend anhand der CT-Polytraumaspirale. Zur Einteilung der Schweregrade des Lebertraumas siehe Tab. B-1.49. Diagnostik: Polytraumamanagement mit orientierendem Ultraschall und anschließender CT-Polytraumaspirale. Einteilung der Schweregrade siehe Tab. B-1.49. Einteilung des Lebertraumas nach Schweregraden Schweregrad Art der Leberverletzung I Kapselriss/Kapseldefekt, Parenchymriss < 1 cm Tiefe II Parenchymriss 1–3 cm Tiefe, subkapsuläres Hämatom < 10 cm, penetrierende Verletzung peripher III Parenchymriss > 3 cm Tiefe, subkapsuläres Hämatom > 10 cm, penetrierende Verletzung zentral IV Parenchymzerreißung eines Lappens, expandierendes zentrales Hämatom V Verletzung der retrohepatischen V. cava, ausgedehnte Lappenzerstörung beidseits Therapie Therapie Leberverletzungen als Folge eines stumpfen Bauchtraumas gehören zu 70–80 % der Schweregradkategorie I und II an. Damit erfordert ihre Versorgung keine spezielle leberchirurgische Erfahrung. Meist sind temporäre Kompression und einzelne Kapselnähte ausreichend, um oberflächliche Lazerationen und Parenchymeinrisse definitiv zu versorgen. Da derartige Verletzungen häufig bei der Exploration schon spontan nicht mehr bluten, werden heute zunehmend derartige Patienten bei kreislaufstabiler Ausgangssituation intensivmedizinisch nur beobachtet und im Verlauf eine sonografisch festgestellte intraabdominelle Blutansammlung kurzfristig kontrolliert. Bei Zunahme der Flüssigkeitsmenge oder größerem Flüssigkeitsbedarf des Patienten zur Stabilisierung sollte allerdings die Indikation zur Exploration gestellt werden. Leberverletzungen der Schweregrade III–V bedürfen speziellerer Erfahrung und Techniken zur vorläufigen oder definitiven Versorgung. Im Folgenden seien nur die wichtigsten kurz aufgezählt und erklärt: Nach stumpfem Bauchtrauma gehören 70– 80 % aller Leberverletzungen der Schweregradkategorie I und II an und bedürfen daher zu ihrer Versorgung keiner speziellen leberchirurgischen Erfahrung. Derartige Patienten werden bei stabiler Ausgangssituation zunehmend nur noch intensivmedizinisch überwacht und sonografisch kurzfristig kontrolliert. Bei Zunahme der intraabdominellen Flüssigkeit oder beginnender Kreislaufinstabilität ist die Indikation zur Exploration zu stellen. Leberverletzungen der Schweregrade III–V bedürfen zu Versorgung meist spezieller Techniken: Pringle-Manöver Pringle-Manöver Die Okklusion des Ligamentum hepatoduodenale (Abb. B-1.211) und damit des arterioportalen Zuflusses der Leber ermöglicht eine kontrollierte Revision z. B. eines tiefen Parenchymrisses mit Naht zerrissener Blutgefäße und Gallengänge. Auch beim Lebertrauma wird meist eine warme Ischämie von 30–45 Minuten toleriert. Die Okklusion des Lig. hepatoduodenale unterbricht den arterio-portalen Zufluss zur Leber und ermöglicht so die Exploration tiefer Parenchymverletzungen mit Naht zerstörter Gefäße oder Gallengänge. ▶ Merke. Eine Milzverletzung muss zuerst versorgt sein, da sie sonst bei einem ▶ Merke. Pringle-Manöver wegen der Stauung heftig bluten kann. ⊙ B-1.211 ⊙ B-1.211 Pringle-Manöver Zur Verringerung des Blutverlustes und zur besseren Übersicht kann die Leberdurchblutung durch Okklusion des Lig. hepatoduodenale unterbrochen werden. Lig. hepatoduodenale Tourniquet Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. ≡ B-1.49 483 1.10 Leber 484 B Tamponade der Leber („Packing“) Tamponade der Leber („Packing“) Die temporäre perihepatische Tamponade mit Tüchern stellt die einfachste Methode zur vorläufigen oder oft definitiven Blutstillung dar. Damit ist es zumindest meist möglich, den Patienten in einen transportfähigen Zustand zu bekommen. Die temporäre perihepatische Tamponade mit Bauchtüchern stellt die technisch einfachste und nicht selten auch effektivste Maßnahme zur Kontrolle der Blutung bei einer schweren Leberverletzung dar (Abb. B-1.212). Für den Fall, dass die Verletzung bei der Primärversorgung nicht definitiv versorgt werden kann, ist damit fast immer der Transport in ein Zentrum möglich. ⊙ B-1.212 1 Allgemein- und Viszeralchirurgie Tamponade bei Leberruptur a b Vollständige vaskuläre Exklusion Vollständige vaskuläre Exklusion Dezelerationsverletzungen der Leber führen nicht selten zu Ein-/Ausrissen der Lebervenen an der Einmündung in die V. cava. Derartige Verletzungen können nur durch vollständige Mobilisation der Leber aus dem Halteapparat mit Okklusion der V. cava proximal und distal der Leber bei gleichzeitigem Pringle-Manöver kontrolliert und versorgt werden. Besonders Dezelerationstraumen können zu einem Ausriss einer oder mehrerer Lebervenen aus der Vena cava führen. Als Folge kann mit einem Pringle-Manöver keine wesentliche Reduktion der oft primär schwer zu lokalisierenden heftigen Blutung erreicht werden. Erst die vollständige Mobilisation der Leber aus ihren Aufhängebändern mit Okklusion der Vena cava infra- und suprahepatisch führt in Kombination mit einem Pringle-Manöver zur Kontrolle der Blutung. Selten muss das Zwerchfell über der Vena cava gespalten werden, um die Vena cava auf Höhe des rechten Vorhofes kontrollieren zu können. Atypische Leberresektion Atypische Leberresektion Da anatomische Leberresektionen bei schweren Leberverletzungen eine hohe Letalität aufweisen, sollte bei vollständiger Zerstörung von Parenchymanteilen nur ein möglichst sparsames Débridement als nicht anatomische Resektion durchgeführt werden. Bei völliger Parenchymzerreißung eines Leberanteiles sollte dieser im Sinne eines Débridements entfernt werden. Anatomische größere Resektionen haben beim Lebertrauma eine sehr hohe Letalität und sollten deshalb zugunsten nicht anatomischer, parenchymsparender Débridements unterlassen werden. Da schwere Leberverletzungen fast nie isoliert, sondern fast immer im Rahmen eines Polytraumas auftreten, benötigt der Patient zur Bewältigung von Schock, Massentransfusionen und möglichen septischen Komplikationen möglichst viel Leberparenchym. Hepatotomie Hepatotomie Unter der Hepatotomie ist die Erweiterung eines Parenchymrisses oder die Spaltung des Gewebes über einem Schusskanal zur Versorgung verletzter Strukturen zu verstehen. Als Hepatotomie wird die Erweiterung eines Parenchymrisses bezeichnet, um an verletzte Strukturen in der Tiefe besser herankommen zu können. Weiterhin wird darunter auch die Spaltung gesunden Parenchyms über einem Schusskanal zu dessen Versorgung verstanden. Hepatostomie Hepatostomie Die Hepatostomie wird überwiegend von amerikanischen Chirurgen zur Versorgung von Schussverletzungen der Leber angegeben. Dabei wird ein Schlauchdrain in den Kanal eingebracht und transkutan ausgeleitet. Die Drainage komprimiert und drainiert. Alternativ zur Hepatotomie in der Versorgung von Schusskanälen wird von amerikanischen Chirurgen die Hepatostomie als weiteres Verfahren beschrieben, bei dem eine schlauchförmige Drainage mit vielen Drainagelöchern in den Schusskanal eingebracht und transkutan ausgeleitet wird. Der Effekt besteht einerseits in der Kompression des verletzten Parenchyms um den Kanal herum bei gleichzeitiger Drainage von evtl. Blut und Galle nach außen. Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. a Zentrale Leberruptur bei stumpfem Bauchtrauma b Perihepatische Tamponade der Leber: Die Tücher zur Blutstillung werden überwiegend subhepatisch platziert, um eine Stauung der Lebervenen zu vermeiden. 485 1.10 Leber 1.10.7 Spezielle Komplikationen in der Leberchirurgie Jeder größere leberchirurgische Eingriff birgt alle allgemeinen Risiken postoperativer Komplikationen, wie sie für abdominalchirurgische Operationen in einem bestimmten Prozentsatz beschrieben werden, wie Nachblutungen, Infektionen der Bauchhöhle oder Wunde sowie thromboembolische Komplikationsmöglichkeiten. Bei einigen leberchirurgischen Eingriffen ist dieses Risiko jedoch deutlich erhöht und wird durch zusätzliche weitere und sehr typische Komplikationen charakterisiert, die im Folgenden kurz aufgelistet und erklärt werden. 1.10.7 Spezielle Komplikationen in der Leberchirurgie Neben den allgemeinen Risiken chirurgischer Eingriffe gibt es für leberchirurgische Eingriffe typische Komplikationen, die nachfolgend kurz aufgelistet und charakterisiert werden sollen. Pleuraerguss Pleuraerguss In bis zu 20 % der Fälle, insbesonders nach ausgedehnteren resezierenden Eingriffen der Leber, ist ein rechtsseitiger Pleuraerguss zu beobachten, der ggf. therapiert werden muss. Ursachen sind die Mobilisation der rechten Leber mit Durchtrennung von Verwachsungen mit der Zwerchfellkuppe einerseits und andererseits bei erweiterten Resektionen eine vorübergehende Leberinsuffizienz mit Ausbildung eines Aszites und Pleuratranssudates. Entsprechend benötigen die Patienten eine entwässernde Therapie und evtl. eine Pleurapunktion oder -drainage. Ein rechtsseitiger Pleuraerguss wird nach Leberresektionen in bis zu 20 % der Fälle beobachtet. Ursache sind die Mobilisation der Leber und evtl. eine vorübergehende Leberinsuffizienz. Die Therapie besteht aus Entwässerung und Pleuradrainage oder Punktion. Abszess/Sepsis Abszess/Sepsis Die häufigste Ursache von postoperativen, meist subphrenisch oder subhepatisch gelegenen Abszessbildungen sind Gallefisteln. Trotz subtiler chirurgischer Techniken sind diese aufgrund von sekundären Ischämien mit Nekrosen am Resektionsrand nicht immer vermeidbar. Die Wegbereiter der zunächst meist lokalen Infektion sind Leckagen aus nicht ausreichend umstochenen kleinsten Gallengängen oder auch zu weit greifende Umstechungen mit Ischämie und Nekrose von Lebergewebe. Die Therapie besteht i. d. R. in der interventionell eingebrachten Spüldrainage des Infektionsherdes. Eine endoskopische Papillotomie zur Verbesserung des Galleabflusses und vorübergehenden Drainage des Gallenganges führt meist zum spontanen Verschluss der Gallefistel. Septische Komplikationen werden bei ausgedehnten Leberresektionen durch den zeitweiligen Verschluss der Pfortader (Pringle-Manöver) und die Reduktion des portalen Gefäßbettes (z. B. Resektion des rechten Pfortaderstammastes) begünstigt. Aus dem Krankheitsbild der akuten Pfortaderthrombose hat man lernen müssen, dass die mit dem portalen Verschluss verbundene akute venöse Kongestion im Abstromgebiet des Darmes zu einer massiven Translokation von Bakterien in die Blutbahn führen kann. Bei entsprechend positiver Blutkultur besteht die Therapie in der Applikation ausgetesteter Antibiotika. Die meist subphrenisch oder subhepatisch gelegenen Abszesse sind die Folge von Galleleckagen oder Gewebsnekrosen an der Resektionsfläche der Leber. Therapie: Interventionell eingebrachte Spüldrainage, endoskopische Papillotomie und evtl. auch Pigtail-Drainage des Gallenganges. Postoperative Leberinsuffizienz Postoperative Leberinsuffizienz Bei Fehleinschätzung der funktionellen Reserven des Restparenchymes können schon kleine Segmentresektionen z. B. bei Patienten mit einer Leberzirrhose zu postoperativer lebensbedrohlicher Leberinsuffizienz mit steigenden Bilirubinwerten und grenzwertiger Syntheseleistung z. B. von Gerinnungsfaktoren führen. Als supportive Therapie kann eine Albumin-Dialyse zur Detoxifikation durchgeführt werden. Da ansonsten eine aktive Therapie mit Ausnahme einer meist nicht indizierten Notfall-Lebertransplantation nicht möglich ist, kann nur versucht werden, durch Aussetzung jeglicher lebertoxischer Medikation und intensivmedizinischen Maßnahmen die Leberfunktion zu stabilisieren. Durch Fehleinschätzungen der Funktionsreserven des Leberparenchyms können schon nach Segmentresektionen lebensbedrohliche Zeichen der Leberinsuffizienz mit Bilirubinanstieg und Abfall der Gerinnungsfaktoren auftreten. Bei fehlender aktiver Therapiemöglichkeit kann nur das Weglassen potenziell lebertoxischer Medikamente zur Funktionsstabilisierung beitragen. Letalität Letalität Die Letalität der Leberresektion wird in großen Serien mit 0–15 % angegeben. Das Risiko ist sehr gering bei lokalen Resektionen von Lebermetastasen und steigt erheblich bei erweiterten Resektionen in Abhängigkeit vom Parenchymschaden bzw. vom verbleibenden Lebergewebe. Die Letalität der Leberresektion schwankt in Korrelation zur Grunderkrankung und damit evtl. verbundener Vorschädigung des Leberparenchyms zwischen 0 und 15 %. Septische Komplikationen werden durch den zeitweiligen Verschluss der Pfortader (PringleManöver) und die Reduktion des portalen Gefäßquerschnittes (z. B. Resektion des rechten Pfortaderstammastes) begünstigt. Analog zur akuten Pfortaderthrombose führt die portale Stauung zur erhöhten Translokation von Darmbakterien in die Blutbahn. Die Therapie besteht in der gezielten Antibiotikagabe. Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. B