Photochemie von Carbonylverbindungen
Werbung
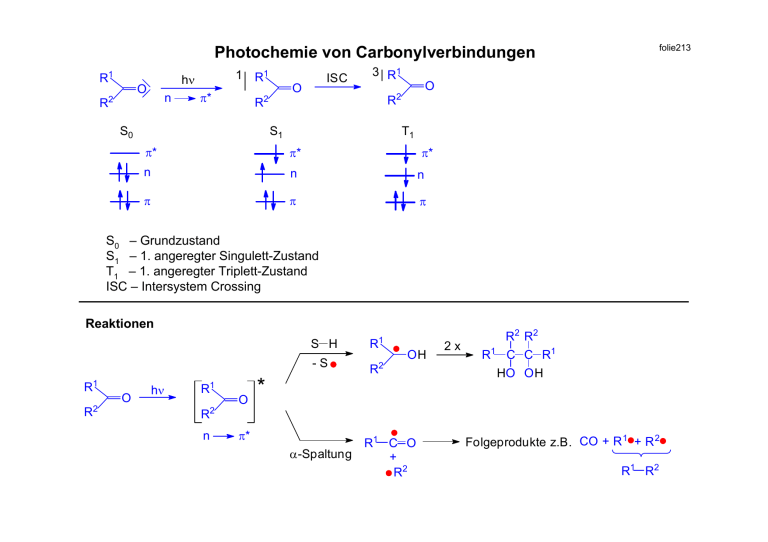
folie213 Photochemie von Carbonylverbindungen R1 O R2 1 R1 hν n π* ISC O 2 3 R1 R R S0 S1 O 2 T1 π* π* n n n π π π π* S0 – Grundzustand S1 – 1. angeregter Singulett-Zustand T1 – 1. angeregter Triplett-Zustand ISC – Intersystem Crossing Reaktionen R 1 R2 O hν 1 R R2 n O S H R1 -S R2 * π* α-Spaltung OH R1 C O + R2 2x R1 R2 R2 C C R1 HO OH Folgeprodukte z.B. CO + R 1 + R 2 R1 R2 folie214 Beispiel für einen intermolekularen H-Transfer Ph 2C O hν Ph 2C O * H OH Ph 2C OH + Ph 2C O OH 2 Ph C OH + 2 Ph 2 C C PH HO OH Beispiel für einen intramolekularen H-Transfer CH 2R C hν O * H R R H H~ O Ph Ph Ph R H R H D O Ph 1,5-D ~ thermisch R'OD H OH C R D O Ph hν R'OD D C D O Ph 2 O Beispiele für die α-Spaltung (Norrish-Typ I) folie215 a) intramolekular Ph Ph ~~ hν O thermisch Ph ~ O Ph - CO cis, trans-Gemisch Ph O hν Ph O H H b) intermolekular hν ~ Ph CH 2 O Ph C CH Ph Ph CH 2 O C + CH Ph - CO Ph Ph CH 2 + CH Radikalpaar ~ Ph CH 2 CH O hν Ph Ph + Ph CH 2 CH 2 Ph + + H3 C C O Ph Ph CH CH Ph Ph O + H3 C C H + H Ph Ph folie216 Photoeliminierung (Norrish-Typ II) (konkurriert mit der α-Spaltung, Norrish-Typ I) Beispiel HO R' R H Ringschluß R α H γ R' O hν R γ - H-Transfer β H H ~ O R' H R OH R O Spaltung Wenn R = Alkyl, dann verläuft die Reaktion sowohl aus dem S1 als auch T1-Zustand; bei R = Aryl ⇒ T1 R' + H Sensibilisierte Photolyse Sens S0 hν 1 Sens* S1 ISC 3 Sens* T1 S0 + Reaktand Sens + S0 3 Reaktand* Reaktion T1 +ISC Produkte S0 Die Anregungsenergie des Sensibilisators "Sens" muß größer sein als die Anregungsenergie des Reaktanden. 3O , 2 1,3-Pentadien (CH2=CH-CH=CH-CH3) sind Triplett-“Quencher“, die die Triplett-Reaktion unterdrücken. Anregungsenergien einiger gebräuchlicher Sensibilisatoren und Quencher (Löscher) Substanz O Singulett Es [kcal/mol] Aceton Triplett ET (τT) [µs] molarer Extinktionskoeffizient ε254 ε313 ε366 88 79-82 (0.94) 7 3 0 78.7 73.7 (3.5) 103 40 5 75.4 68.6 (12) 104 50 70 110 84.3 90 0 0 92 60.9 3·103 110 0 76.3 42.0 105 103 103 40.6 30.9 (1) 104 104 30 O Acetophenon O Benzophenon Φisc=1 (τs=5ps=5·10-12s) Benzol Naphthalin Anthracen Azulen folie217 folie218 Substanz Singulett Es [kcal/mol] Triplett ET (τT) (µs) molarer Extinktionskoeffizient ε254 ε313 ε366 52.4 6·103 - 60.1 - - ca. 97 110 0 40 0 0 58.3 20 0 0 59.2 50 0 0 1,3-Cyclohexadien Isopren cis-1,3-Pentadien trans-1,3-Pentadien Photochemische Reaktion von Diazomethan CH 2 N N S0 hν 1 hν CH 2 N N S1 - N2 * Sens Ph 2C O ISC CH 2 S1 T0 H H CH 3 H H Folgeprodukte CH 3 CH 3 CH 3 CH 2 H H "Quench"-Vorgang schnell 3 O2 CH 2 CH 2 O O CH 3 CH 3 CH 2 H H H3 C CH 2 CH 3 H CH 3 cheletrope Reaktion stereospezifisch CH 2 CH 3 CH 3 CH 3 ISC ISC H H H CH 2 + H3 C H H CH 3 Mehrstufenprozess stereounspezifisch folie219 folie220 [2+2]Cycloadditionen von Acenaphthylen S1 π hν (S 1) (Excited Dimer) π* S0 syn hν Sens (T 1) anti Excimer folie221 Festphasen-Photochemie Topochemische Kontrolle, die durch die Kristallmodifikation vorgegeben wird H COOH hν Ph H 0.36 nm H Ph HOOC H COOH hν H 0.36 nm H COOH H Ph H H Ph H Ph COOH H COOH H β-Truxillsäure H β-Form Ph CH CH COOH > 0.4 nm Ph CH CH COOH γ-Form Zimtsäure Ph H HOOC COOH α-Truxillsäure H α-Form Ph Ph H hν keine [2+2]-Addition folie222 [2+2]Cycloadditionen von Acrylnitril und 1,3-Butadien NC CN + + hν NC NC CN NC CN + Sens cis hν + + Sens trans cis CN [4+2]Cycloaddition trans folie223 Paterno-Büchi-Reaktion Ph O Ph 3 1) hν 2) ISC Ph O Ph S0 3 * O Ph cis-2-Buten T1 CH 3 H Ph H CH 3 ISC 3 O Ph Ph CH 3 H CH 3 H ISC O CH 3 H CH 3 H Ph Ph trans O + CH 3 H H CH 3 Ph Ph cis folie224 Beispiele: a) Synthese des Pheromons der Mittelmeer-Fruchtfliege O hν H2 , Pd O hν O O ~ ~ H H 80°C, Rh(CO 2)Cl2 oder 240-340°C OH Pheromon LiAlH4 O b) H2 O O + OMe Me O hν Me Me OMe H + OH Me Me Me H + MeOH OH Me Me O H (Acetalspaltung) Me OMe OMe H Me folie225 Intramolekulare [2+2]Cycloaddition E hν E ∆T E exotherm Energiespeicher von Licht E E = COOR Photoeliminierung von Azoverbindungen a. acyclisch hν N N antiAzomethan Sens: Ph 2C O ∆T N N N2 + 2 CH 3 H3 C CH 3 syn b. cyclisch E + CH 2 N N Diazomethan E ∆T 1,3-dipolare Cycloaddition hν N N E + N N folie226 N N bei 77K stabil hν ESR-Spektrum - N2 25°C + Dimere + hν S0 - N2 N N hν Sens T1 + S1 Prisman N N + DewarBenzol Benzualen Diazacyclooctatetraen folie227 Photoisomerisierung retroD.-A.R. hν S0 hν ~ Barrelen S1 Sens (Aceton) T1 Di-π-Methan-Umlagerung entartete Cope-Umlagerung thermisch: EA ≈ 4 kcal mol-1 ⇒ Dynamische NMR-Spektroskopie Semibullvalen folie228 Photoisomerisierung Di-π-Methan-Umlagerung allgemeiner Mechanismus: 3 3 2 4 1 5 hν 2 ~ 2 4 1 1 5 4 3 2 1 5 4 3 5 Vinylcyclopropan Die unsensibilisierte photochemische Di-π-Methan-Umlagerung ist stereospezifisch. Et Me Me Et Me Ph hν + Ph Ph Ph opt.-aktiv Et Ph Ph σa 2 + πa2 + πa2 Me Et Ph Ph Me Ph Ph Et Dienon-Umlagerung Ar Ar O Ar hν folie229 Ar Ar O Ar Ar O Ar therm. sigmatrope [1,4]C~ Sigmatrope [1,4]C-Verschiebung H O HH Br Ph Ph Ar Ar Ar si-Prozess KO-t-Bu. - HO-t-Bu - KBr O πs2 + ωs0 + σa 2 1 + 0 + 0= 1 Ph O O Barton-Reaktion δ CH 2 O γ N O OH N H C hν (300nm) folie230 OH α β Oxim hν H CH 2 + O H CH 2 CH 2 O + N O OH O N CH 2 OH N O Nitrosoverbindung An Steroiden können über die Barton-Reaktion gezielt Methyl-Gruppen am Steroid-Gerüst funktionalisiert werden, was synthetisch z.B. bei der Partialsynthese des Nebennierenrindenhormons Aldosteron aus Corticosteronacetat-11β-nitritester genutzt wird. CH 2OAc ONO H3 Cδ C O β α γ CH 2OAc HON HO CHC O hν (Toluol) O O HO CH 2OH CHC O (H +/H2O) O O Halbacetal folie231 Elektronische Zustände von Sauerstoff E [kcal/mol] S2 37.5 angeregte Zustände Singulett 22.5 S1 Triplett Grundzustand Photochemische Generierung von Singulett-Sauerstoff S S0 hν S* 1 ISC S1 S* + 3 T1 3 O2 1 S..... O 2 T0 S + 1O 2 S - Sensibilisator E 43.0 37.5 32.9 22.5 1 cal ≡ 4.184 J * Sensibilisierung - ISC folie232 Quantenausbeuten (φ∆) der photosensibilisierten Bildung von Singulett-Sauerstoff (unter Luft oder Sauerstoff) folie233 Ph Verbindung Bengalrosa Lösungsmittel EtOH φ∆ 0.68 Chlorophyll a C6H5CH3 0.60 Chlorophyll b C6H5CH3 0.75 Methylenblau EtOH 0.52 N Ph N Porphyrin, meso-Tetraphenyl -Zn(II) C6H6 0.68 -metallfrei C6H6 0.63 H N H Ph N Ph meso-Tetraphenylporphorin Singulett-Sauerstoff (1∆g) Lebensdauern in einigen Lösungsmitteln Lösungsmittel Aceton τ∆ [µs] 34-65 1 µs = 10-6s Aceton-d6 588-838 Benzol 25-32 τ∆ = 45 min (Gasphase) Benzol-d6 550-790 CCl4 26-35 Hexafluorbenzol 25000 Blutplasma 1.0 Leukemia-Zellen 0.17-0.32 Strahlungslose Desaktivierung von 1O2 durch Kopplung von Schwingungsmoden an Strukturelemente des Lösungsmittels. folie234 R3 R4 HO OH R1 O R2 O NH N N HN S S 1O 2 ist cytotoxisch. In Tumorzellen bewirkt 1O2 den Zelltod. Es ist wichtig, den Photosensibilisator S selektiv in die Tumorzelle zu bringen und dann dort durch Bestrahlung 1O 2 zu erzeugen. Übersicht: Chem. Eur. J. 1999, 5, 587 und zitierte Literatut Chemische Wege zur Erzeugung von 1O2 OCl + H2O 2 Hypochlorit Ph 3P + O 3 Ozon 1 O 2 + H2 O + Cl O tiefe Temperatur Ph 3P O ∆T Ph 3P O + O O O Ph Ph ∆T + Ph Ph 1 O2 1 O2 folie235 folie236 Reaktionen von 1O2 H 1 H O2 O O En-Reaktion Mechanismus: H H pericyclisch O πs 2 + πs 2 + σ s 2 O O H O oder mehrstufig O O Zwischenstufe + O [4+2]Cycloaddition O O R X + O O O [2+2]Cycloaddition R X Endoperoxid O O ∆T R X O + O Dioxetan, thermisch wenig stabil H CH 3 H H CH 3 1. O2 , PS, hν H 2. Na2 SO 3 OH OH Lichtquelle 5 kW-Quecksilberstrahler H (-)-Citronellol HO + OH CH 3 OH [H +] H H CH 3 CH 3 - H 2O wichtig für die Parfümindustrie (Dragoco, Gerberding & Co.,Holzminden): 60% Gesamtausbeute OH hν (Sonne), Chlorophyll (aus Brennesselblättern), Luft O OH (-)-Rosenoxid Duftstoff O O 73% Ascaridol α-Terpinen H5 C2 O H5 C2 O 1 O2 H5 C2 O H5 C2 O O O Anthelmintikum anti-Wurmmittel folie237 folie238 Chemoluminiszens ↔ Bioluminiszens O N HO S N OH Luciferase S0 2+ O 2, Mg , ATP S hν Lumophore of firefly HO N N S S S1 * O + CO2 ΦCl = 1.0 Lichtausbeute O N HO S N S Peroxyacetone intermediate "Dioxetanon" ~ ~O O folie239 [2+2]Cycloreversion ~ ~ O O ∆T 2 Reaktionsenthalpie ∆HR ≈ -63 kcal mol-1 stark exotherm Aceton Tetramethyl1,2-dioxetan TMD CN + O O Aktivierungsenthalpie ∆H‡ ≈ +27 kcal mol-1 O 1 φ* ~ 0.5% 1 O* CN + NC S1 3 3 φ* ~ 50% "Chemische Titration" der angeregten Zustände O O* T NC CN CN CN CN 1 O + NC S0 cis + CN trans-Isomerisierung Thermochemie von Tetramethyl-1,2-dioxetane ∆H A – Aceton folie240 folie241 Elektroluminiszens LED – Licht-Emittierende Displays Chemie in unserer Zeit 1997, 31, 76 folie242 folie243 Organischer Film: konjugiertes Polymer ITO – Indium Tin Oxide Indium-Zinn-Oxid Leitfähiges Material, das im sichtbaren Spektralbereich transparent ist. folie244