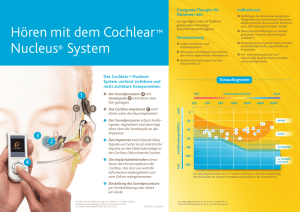
Einfluss der cochleären Morphologie auf die
Werbung

Aus der Klinik für Hals-, Nasen- und Ohrenheilkunde des Universitätsklinikums Freiburg i.Br. -Ärztlicher Direktor: Prof. Dr. Dr. h.c. mult. R. Laszig- Einfluss der cochleären Morphologie auf die Dislokationswahrscheinlichkeit des Elektrodenträgers des Cochlea Implantates INAUGURAL-DISSERTATION zur Erlangung des Medizinischen Doktorgrades der Medizinischen Fakultät der Albert-Ludwigs-Universität Freiburg im Breisgau Vorgelegt 2015 von Manuel Christoph Ketterer geboren in Titisee - Neustadt _____________________________________________________________ Dekanin Frau Professor Doktor Kerstin Krieglstein 1. Gutachter Frau Professor Doktor Antje Aschendorff 2. Gutachter Herr Professor Doktor Hansjürgen Agostini Jahr der Promotion 2017 _____________________________________________________________________ „Sein Unglück Und Sinn haben Ausatmen können Und die man selbst noch Tief ausatmen Verstehen kann Und vielleicht auch Und die vielleicht sogar Sein Unglück sagen können Irgendwer sonst versteht In Worten Oder verstehen könnte In wirklichen Worten Und weinen können. Die zusammenhängen Das wäre schon Fast wieder Glück.“ „Aufhebung“ von Erich Fried Inhaltsverzeichnis: 1. Einleitung:..........................................................................................................................................1 2.Einführung:..........................................................................................................................................2 2.1. Anatomie:.....................................................................................................................................2 2.1.1. Anatomische Umgebung:......................................................................................................2 2.1.2. Äußeres Ohr:.........................................................................................................................3 2.1.3. Mittelohr:...............................................................................................................................4 2.1.4. Innenohr:...............................................................................................................................5 2.1.5. Corti- Organ:.........................................................................................................................6 2.2. Physiologie:..................................................................................................................................7 2.2.1. Äußeres Ohr:.........................................................................................................................7 2.2.2. Mittelohr:...............................................................................................................................8 2.2.3. Innenohr:...............................................................................................................................9 2.2.4. Corti- Organ:.......................................................................................................................10 2.3. Schwerhörigkeit:........................................................................................................................12 2.3.1 Schallleitungs- / Schallempfindungsstörung:.......................................................................12 2.3.2. Prälinguale Ursachen:..........................................................................................................13 2.3.3. Postlinguale Ursachen:........................................................................................................14 2.4. Das Cochlea Implantat:..............................................................................................................16 2.4.1. Das Implantat:.....................................................................................................................16 2.4.2. Der Elektrodenträger:..........................................................................................................18 2.4.3. Die Operation:.....................................................................................................................21 2.4.4. Indikation:...........................................................................................................................22 2.5. Radiologie:.................................................................................................................................23 2.5.1. Präoperative Bildgebung:....................................................................................................24 2.5.2. Intraoperative Bildgebung:..................................................................................................26 2.5.3. Postoperative Bildgebung:...................................................................................................27 2.6. Literaturstand der Anatomie und des Cochlea Implantates:.......................................................29 2.6.1 Cochleäre Größe:..................................................................................................................30 2.6.2. Lage des Elektrodenträgers in der Cochlea:........................................................................31 2.6.4. Anpassung des Elektrodenträgers an die Cochlea:..............................................................33 3. Zielsetzung:......................................................................................................................................34 4.Methode:...........................................................................................................................................35 4.1. Patientenkollektiv:......................................................................................................................35 4.2. Radiologische Evaluation:..........................................................................................................36 4.3. Statistik:......................................................................................................................................40 5.Ergebnisse:........................................................................................................................................41 5.1. Patientenkollektiv:......................................................................................................................41 5.2. Cochleäre Größe:........................................................................................................................42 5.3. Geschlechtsvergleich der cochleären Größen:............................................................................43 5.4. Elektrodenträgervermessung:.....................................................................................................44 5.5. Vergleich der Größe und der Elektrodenträgervermessung:......................................................45 5.6. Vergleich der cochleären Größe und der Elektrodenlage:...................................................47 5.7. Vergleich des Wrapping Factors und der Elektrodenlage:...................................................49 6.Diskussion:.........................................................................................................................................51 6.1. Diskussion der Messungen und Ergebnisse:...............................................................................51 6.1.1. Cochleäre Größe:.................................................................................................................51 6.1.2. Geschlechtsspezifische Unterschiede der Cochlea:.............................................................54 6.1.3. Elektrodenlage:....................................................................................................................55 6.1.4. Skaläre Lage des Elektrodenträgers:...................................................................................58 6.1.5. Exkurs: Der neue „Slim Straight“ – Elektrodenträger und die Diskussion des Zugangsweges:..............................................................................................................................59 6.2. Weitergehende Diskussion der Ergebnisse und Forschungslage:...............................................61 6.2.1. Der Einfluss der Elektrodenlage auf das Sprachverstehen:.................................................61 6.2.2. Der Einfluss biographischer Faktoren auf das Sprachverstehen:.........................................63 6.2.3. Der Einfluss von Intellekt und Kognition auf das Sprachverstehen:...................................65 7. Zusammenfassung:..........................................................................................................................67 8. Verzeichnisse:..................................................................................................................................68 8.1. Abkürzungsverzeichnis:.............................................................................................................68 8.2. Tabellarverzeichnis:...................................................................................................................69 8.3. Darstellungsverzeichnis:............................................................................................................70 8.4. Literaturverzeichnis:...................................................................................................................73 9. Danksagung:.....................................................................................................................................84 10.EidesstattlicheVersicherung:..........................................................................................................85 1.Einleitung 1. Einleitung: Die berühmte taub- blinde Autorin Helen Keller (1880- 1968) formulierte einst: „Nicht sehen trennt, von den Dingen, nicht hören, trennt von den Menschen.“ (Adelt, 2014, S.74; Original Immanuel Kant, zitiert von Helen Keller). Kaum vorstellbar mag es sein, nichts zu hören. Die Welt um sich herum nur zu sehen, zu tasten, zu riechen, aber den Klang der Welt nicht mehr wahrzunehmen oder nie wahrgenommen zu haben. Besonders die Tatsache gewisse Frequenzen nicht mehr wahrnehmen zu können, welche für das Sprachverstehen wichtig sind und somit für die Tatsache ein Gespräch zu verstehen und es zu erwidern, ist sehr beeinträchtigend. Ein vermindertes Hörvermögen schränkt Menschen im Straßenverkehr, beim Telefonieren, im zwischenmenschlichen Umgang, im Restaurant und somit sowohl im Berufs- als auch Privatleben enorm ein. Weltweit nutzen über 300.000 Menschen ein Cochlea Implantat (CI) (O´Donoghue, 2013). Es ist wahrlich faszinierend wie selbst prälingual ertaubte Kinder durch das CI mit anschließender Rehabilitation einen Zugang zu Sprache, Sprechen und Sprachverstehen erlangen können. Das Gehör wird zwar nicht wieder hergestellt und somit kein Wunder vollbracht, dennoch erleichtert das CI das Hören und Verstehen insgemein. Wie erfolgreich dies postoperativ jedoch erreicht wird, ist interindividuell unterschiedlich und hängt abgesehen von medizinischen Fakten auch viel mit der Erwartung an das neue Hören zusammen. Vor allem aber spielen die Taubheitsdauer, die Ursache der Ertaubung und einige weitere Faktoren eine bedeutende Rolle (Holden et al. 2013). Unfassbar scheint es, dass ein zuvor tauber Patient nach einigen Wochen bis Monaten des Übens und der Rehabilitation erneut Zugang zum Telefonieren oder gar zur Musik erhält. Viele erlangen einen offenen Zugang zum Sprachverständnis, anderen ist die Kommunikation in Kombination des Gehörs und des Lippenlesens zumindest deutlich erleichtert. Mittels neuer Technologie und sich stetig verbessernder Technik ist dem Patienten zunehmend mehr Zugang in die auditorische Welt möglich. Monomodale und bimodale Hörtechnologie ermöglicht es dem CI Träger simultan beispielsweise Mobiltelefonie und Fernsehen zu streamen, ohne dass Umgebungsgeräusche ihn allzu sehr ablenken. Das Cochlea Implantat ist ein faszinierender, fantastischer und begeisternder Fortschritt der Medizin und ich freue mich es dem Leser dieser Arbeit etwas näher bringen zu dürfen. 2. Einführung: 2. Einführung: 2.1. Anatomie: Die Anatomie des Ohres lässt sich in drei Teile gliedern: das äußere Ohr, das Mittelohr und das Innenohr. Das Innenohr beherbergt das Gleichgewichtsorgan und den Hörapparat (Franzen 2007, S.1). Darstellung 1: Überblick über die Anatomie des Ohres, unterteilt in äußeres Ohr, Mittelohr und Innenohr bestehend aus vestibulärem Labyrinth und der Cochlea. (Schmidt Lang 2010, S.319). 2.1.1. Anatomische Umgebung: Das Mittel- und Innenohr liegen im Os temporale, dem Schläfenbein, welches aus den drei Anteilen der Pars tympanica, squamosa und mastoidea besteht (Lenarz 2012, S. 9). Die Pars tympanica enthält das Mittelohr und somit das Cavum tympani sowie den knöchernen Meatus acusticus externus (Schiebler 2007, S.707). Sie ist nach dorsal durch die Pars mastoidea begrenzt, welche das Antrum mastoideum mit anschließenden, pneumatisierten Cellulae mastoideae und den Processus mastoideus beherbergt (Schiebler 2007, S.707). 2 2. Einführung: Angrenzend an die Pars mastoidea befindet sich der Sinus sigmoideus, welcher ein venöser Blutleiter des Gehirns in der hinteren Schädelgrube darstellt und im angrenzenden Foramen jugulare in die Vena jugularis interna übergeht (Benninghoff 2004, S.495). Das Foramen jugulare wird begrenzt von der Pars petrosa des Os temporale und dem Os occipitale (Aumüller 2007, S.953). Die Pars petrosa des Schläfenbeins beinhaltet das Innenohr und wird auch als Felsenbein betitelt. Durch die Pars petrosa zieht der Canalis caroticus, in welchem die Arteria carotica interna verläuft, die das Gehirn mit Blut versorgt (Benninghoff 2004, S.495- 497). Von besonderer Bedeutung ist der Verlauf des Nervus facialis für diesen anatomischen Bereich und auch für die Implantation des CIs (Fayad et al. 2003). Die Anteile des N. facialis, welcher unser Gesicht motorisch innerviert, kommen am Kleinhirnbrückenwinkel zusammen, ziehen gemeinsam mit dem N. vestibulocochlearis, welcher Gehör- und Gleichgewichtsinformation enthält, durch den Porus acusticus internus um im inneren Gehörgang zum Innenohr zu ziehen (Trepel 2008, S. 72). Während der N. vestibulocochlearis hier seinen Ursprung nimmt, zieht der N. facialis durch den Canalis facialis im Felsenbein weiter und neigt sich um fast 90 Grad nach dorsal, was als äußeres Facialisknie bezeichnet wird (Benninghoff 2004, S.557). Im Canalis facialis zieht er über die Paukenhöhle abwärts und tritt im Foramen stylomastoideum aus der Schädelbasis um sich zu entsprechenden Gesichtsmuskeln hin aufzufächern (Trepel 2008, S.72). Im Verlauf durch den Canalis facialis gibt der N. facialis zahlreiche Äste ab, wie den Nervus stapedius, welcher zum gleichnamigen Muskel im Mittelohr zieht (Benninghoff Band 2 2004, S.558). Wenig später im Verlauf zweigt die Chorda tympani vom N. facialis ab, welche den Hauptteil der Geschmacksfasern der Zunge enthält (Lenarz 2012, S.17). Die Chorda tympani zieht nun in einem eigenen Kanal zum Mittelohr zurück, verläuft unter einer aufgeworfenen Schleimhautfalte zwischen Manubrium mallei und Incus, um über die Fossa infratemporalis zur Zunge zu ziehen und diese mit viszerosensiblen Fasern zu versorgen (Trepel 2008, S.74). 2.1.2. Äußeres Ohr: Das äußere Ohr besteht aus der Ohrmuschel, welche aus elastischem Knorpel besteht und dem äußeren Gehörgang, dem Meatus acusticus externus (Probst 2008, S. 144). Die Ohrmuschel mit ihrem konvexen Rand, der Helix, welcher sich nach innen fortsetzt (Anthelix), dient dem Schutz, dem Einfangen der Schallwellen und ist auch für das Richtungshören funktionell bedeutend (Lenarz 2012, S. 9). Der Meatus acusticus externus verläuft vom Porus acusticus externus bis zum Trommelfell, der Membrana tympani (Trepel 2008, S.358). 3 2. Einführung: Er besteht im äußeren Drittel aus Knorpel und geht in das knöcherne Gerüst des Pars tympanica des Os temporale über (Benninghoff Band 2 2004, S.712). Der äußere Gehörgang ist leicht nach unten vorne gekrümmt und verengt, mit Epidermis ausgekleidet und enthält unter anderem apokrine Zeruminaldrüsen, welche für das Cerumen, den Ohrenschmalz, zuständig sind (Lenarz 2012, S.10). Der äußere Gehörgang dient der Schallweiterleitung und der Resonanzbildung (Probst 2008, S.145). 2.1.3. Mittelohr: Das Mittelohr besteht aus der Paukenhöhle, in welcher sich die Gehörknöchelchen befinden (Benninghoff Band 2 2004, S.714). Nach lateral ist das Mittelohr durch die Membrana tympani, das Trommelfell, abgegrenzt. Es erfüllt die Funktion der Schallübertragung auf die Gehörknöchelchen (Klinke 2010, S.678), sowie den Schutz der Paukenhöhle vor Keimbesiedlung. Die Paukenhöhle, das Cavum tympani, ist lufthaltig und mit Epithel ausgekleidet. Nach ventral geht sie in die Tuba auditiva über, welche eine Verbindung zum Nasopharynx darstellt und zur Belüftung und zum Druckausgleich funktionell bedeutend ist (Benninghoff Band 2 2004, S.719). Weiterhin dient die Tuba auditiva dem Sekretabfluss und somit der Reinigung (Trepel 2008, S.363/ 364). Nach dorsal geht die Paukenhöhle in das Antrum mastoideum über, was eine recht dünnwandige Begrenzung zum Sinus sigmoideus darstellt (Aumüller 2007, S. 1089). Das Antrum mastoideum stellt die Verbindung zu den luftgefüllten Cellulae des Processus mastoideus dar (Franzen 2007, S.3). Das Os mastoideum mit seinem Planum dient bei Implantation des CIs auch als Zugangsweg zum Mittelohr (Lenarz 2012, S.132). Nach medial folgt die Cochlea und das Fenestra vestibuli (Benninghoff Band 2 2004, S.715). Darstellung 2: Überblick über das Mittelohr, begrenzt von dem Trommelfell und dem Innenohr, mit den Gehörknöchelchen und dem weiteren Verlauf der Hörschnecke (Schmidt Lang 2010, S.320). 4 2. Einführung: Innerhalb der Paukenhöhle sind vor allem die drei Gehörknöchelchen von funktioneller Relevanz, da sie den Schall vom Trommelfell auf das Fenestra vestibuli, das ovale Fenster, übertragen und somit den Schall in die Cochlea einspeisen (Probst 2008, S.145). Malleus, Incus und Stapes sind miteinander gelenkartig verbunden und essentiell um die Schwingung des Trommelfells und somit die Schallwellen auf die Cochlea zu übertragen (Lenarz 2012, S.15). 2.1.4. Innenohr: Das Innenohr ist eingelassen in das knöcherne Labyrinth der Pars petrosa des Os temporale (Felsenbein) und ist mit Perilymphe gefüllt (Benninghoff Band 2 2004, S.721). Es besteht aus Vestibulum, Cochlea sowie den Canales semicirculares, den drei Bogengängen (LüllmannRauch 2009, S.560). Diese verlaufen in jeweils annähernd senkrecht aufeinander stehenden Ebenen und sind Teil des Gleichgewichtsorgans. Verbunden sind Cochlea und Vestibulum über den Ductus reuniens (Franzen 2007, S.5). Das Hörorgan selbst liegt in der Gehörschnecke, der Cochlea. Der Canalis spiralis cochleae ist durchschnittlich 35 mm lang und windet sich 2.5 mal um die knöcherne Achse des Modiolus, in welchem der Nervus cochlearis und Blutgefäße ziehen und das Ganglion spirale gelegen ist (Lüllmann-Rauch 2009, S.562 / 563). Darstellung 3: Übersicht der Anatomie des Innenohrs mit Darstellung der anatomischen Anordnung des hinteren, vorderen und horizontalen Bogengangs (Schmidt Lang 2010, S.338). Die Cochlea ist zur Paukenhöhle hin abgegrenzt durch zwei Fenster, welche mit einer Membran verschlossen sind (Benninghoff Band 2 2004, S.722). Das ovale Fenster dient wie oben beschrieben der Schalleinspeisung über die Gehörknöchelchen, während das runde Fenster bei Schalltransduktion ausgebeult wird und somit kompensatorisch die Eindellung des Ductus cochlearis ausgleicht (siehe Physiologie) (Lüllmann-Rauch 2009, S.563). 5 2. Einführung: Der cochleäre Gang wird durch zwei Membranen in drei Skalen unterteilt. Die Scala vestibuli und die Scala tympani, welche jeweils mit Perilymphe gefüllt sind und über das Helicotrema miteinander verbunden sind und die Scala media, welche mit Endolymphe gefüllt ist und dazwischen liegt (Lenarz 2012, S.19). Darstellung 4: Querschnitt durch die Cochlea zur Darstellung von Scala tympani, vestibuli und media (Schiebler, Anatomie 2007, S.713). Die Reissnermembran bzw. Membrana vestibularis trennt Scala vestibuli und media, während die Basilarmembran Scala media von tympani trennt. Die Basilarmembran ist die eigentlich entscheidende Struktur, da auf ihr das Corti- Organ liegt (Lüllmann-Rauch 2009, S.564). 2.1.5. Corti- Organ: Das Corti- Organ sitzt wie beschrieben der Basilarmembran auf und enthält die wichtigsten Zellen des Hörorgans, die Haarsinneszellen (Lenarz 2012, S.19). Diese unterteilen sich in innere und äußere Haarsinneszellen und tragen jeweils circa 50 bis 100 Stereocilien an ihrer apikalen Oberfläche, während sie basal Synapsen mit Neuronen ausbilden (Lüllmann-Rauch 2009, S.564). Während die inneren Haarsinneszellen der Wahrnehmung des Schalls dienen und somit die afferenten Nervenendigungen des N. cochlearis mit Glutamat erregen, sind die äußeren Haarsinneszellen vor allem für einen cochleären Verstärkungsmechanismus funktionell bedeutsam (Lüllmann-Rauch 2009, S.566). 6 2. Einführung: Darstellung 5: Querschnitt durch das Corti- Organ mit Darstellung der inneren und äußeren Haarsinneszellen, der Tektorialmembran, sowie dem Ausgang des N. cochlearis (Hörnerv) (Schmidt Lang 2010, S.323). 2.2. Physiologie: Der Sinn des Hörens ist neben dem Sehsinn einer der wichtigsten Zugangswege zu zwischenmenschlicher Kommunikation und Interaktion. Wie bei anderen Sinnen unterscheidet die Physiologie auch beim Hören eine Quantität, in dem Fall die Lautstärke, von einer Qualität, in diesem Fall die Frequenz, also die Tonhöhe (Deetjen 2004, S.135). Der menschliche Hörbereich umfasst 20 bis 20.000 Herz, was ungefähr zehn Oktaven entspricht, da eine Oktave als Frequenzverdopplung definiert wird (Schmidt Lang 2010, S.318). Der sogenannte Hauptsprachbereich liegt zwischen 200 und 5.000 Herz und 40 bis 80 dB(A) und somit ist dieser Frequenz- und Schalldruckpegelbereich für den Umgang, das Verständnis und das Erlernen der normalen Umgangssprache elementar (Schmidt Lang 2010, S.318). Die Physiologie des Hörens ist äußerst komplex und kann ebenfalls der Anatomie entsprechend in die drei anatomischen Bereiche des Ohres gegliedert werden. 2.2.1. Äußeres Ohr: Die Ohrmuschel dient als Schalltrichter, welcher den Schall aufnimmt und ihn weiterleitet. Sie hat beim Richtungshören eine spezifische Funktion, auch weil der Schall innerhalb der Ohrmuschelfurchen leicht verzerrt wird, was der späteren Schallquellenlokalisierung dient (Probst 2008, S.145). Schallwellen sind Druckwellen in der Luft, welche sich nur in Materie (Deetjen 2004, S.135) wellenförmig durch die Komprimierung und Dekomprimierung von Molekülen ausbreiten. Sie werden als Longitudinalwellen klassifiziert, da sie, wie der Name schon verrät, entlang ihrer Ausbreitungsrichtung schwingen (Schmidt Lang 2010, S.319). 7 2. Einführung: 2.2.2. Mittelohr: Das Mittelohr entspricht einem mit Luft gefüllten Hohlraum, welcher über die Ohrtrompete, die Tuba eustachii mit dem Rachenraum verbunden ist (Lenarz 2012, S.14). Diese Verbindung dient dem Druckausgleich und öffnet sich aktiv durch den Musculus tensor veli palatini beispielsweise beim Schlucken oder Kieferabsenken, um das Mittelohr ausreichend zu belüften. Dies dient dazu den Übergangswiderstand am Trommelfell möglichst gering zu halten (Lüllmann-Rauch 2009, S.560). Das Mittelohr erfüllt die überaus wichtige Funktion der sogenannten Impedanzanpassung also der Schallverstärkung und –einkopplung ins Innenohr (Schmidt Lang 2010, S.320). Da das Mittelohr ein mit Luft gefüllter Raum ist und das Innenohr mit inkompressibler Flüssigkeit, der Perilymphe, gefüllt ist, würde der Schall am ovalen Fenster aufgrund des Schallwellenwiderstandes der Flüssigkeit gegenüber Luft reflektiert werden und kaum ins Innenohr eingespeist werden (Klinke 2010, S.678). Hauptgrund dafür ist die höhere Dichte der Perilymphe und die damit verbundene Inkompressibilität dieser Flüssigkeit (Deetjen 2004, S.139). Da das Trommelfell gegenüber dem ovalen Fenster einen Flächenunterschied von 90 mm² zu 3mm² aufweist, erfolgt eine 30 fache Erhöhung der wirkenden Kraft, was die Reflexion und somit den Energieverlust bei der Übertragung deutlich reduziert (Deetjen 2004, S.139). Zusätzlich zu dieser Krafterhöhung sorgt die Hebelwirkung der Gehörknöchelchen für eine Impedanzanpassung, da Hammer, Amboss und Steigbügel beweglich miteinander verbunden sind und der Steigbügel dem ovalen Fenster wiederum aufsitzt und dieses schwingungsfähig ist (Schmidt Lang 2010, S.320). Das runde Fenster stellt ebenfalls eine schwingungsfähige Membran dar, welche mit der Perilymphe mitschwingt und somit überhaupt ein Bewegen dieser inkompressiblen Flüssigkeit ermöglicht (Deetjen 2004, S.142). Das Mittelohr ist jedoch nicht nur zur Weiterleitung des Schalls nützlich, sondern auch um die Übertragung zu hoher Schalldrücke zu dämpfen. Durch das Ansetzen des Musculus stapedius am Steigbügel (Stapes) und des Musculus tensor tympani am Hammer (Malleus) kann die vom Trommelfell übertragene Schwingung auf die Gehörknöchelchen bei Überstimulierung durch Kontraktion dieser Muskeln gedämpft werden (Trepel 2008, S.362 / 363). 8 2. Einführung: 2.2.3. Innenohr: Das Innenohr wird unterteilt in den Vestibularapparat als vestibulären Teil und die Cochlea als auditiven Teil. Dem Thema dieser Arbeit entsprechend wird im Folgenden der auditive Teil des Innenohrs erläutert. Die im Felsenbein liegende Cochlea ist Ort der Schallübertragung von der Luft im Mittelohr auf die Perilymphe in der Gehörschnecke (Deetjen 2004, S.140). Darstellung 6: Deflektion und Reflektion der Haarsinneszellen bei Sogwirkung auf die Endolymphe (Schmidt Lang 2010, S.323). Die Schwallwellen, welche das Trommelfell und die Gehörknöchelchen in Schwingung versetzen, sorgen für eine Vibration des Stapes (Lenarz 2012, S.24). Da der Steigbügel mit dem ovalen Fenster verbunden ist, wird dieses in Schwingung versetzt und die inkompressible Perilymphe wird in Richtung des runden Fensters und wieder zurück bewegt (Franzen 2007, S.8). Durch die Bewegung der Perilymphe entsteht eine Wanderwelle, welche sich von basal nach apikal bewegt und auf der Basilarmembran abgebildet wird. Dadurch entsteht ein Wechseldruck zwischen Scala tympani und vestibuli, was dazu führt, dass auch die Basilarmembran in Schwingung versetzt wird (Schmidt Lang 2010, S.322). Die Basilarmembran erstreckt sich von der Basis, an der sich das ovale Fenster befindet, bis hin zum Helicotrema und nimmt in ihrem Verlauf an Dicke ab und an Breite zu (Deetjen 2004, S.142). Sie wird also zum Helicotrema hin dünner, breiter und somit flexibler (Klinke 2010, S.682). Entsprechend dieser zunehmenden Compliance und abnehmenden Steifigkeit wird das Amplitudenmaximum einer Schallwelle je nach Frequenz an unterschiedlicher Stelle erreicht, was als Frequenzdispersion bezeichnet wird (Deetjen 2004, S. 142). 9 2. Einführung: Wie die Saiten einer Harfe, die umso straffer und kürzer sie gespannt sind, desto höher klingen, sind auch auf der Basilarmembran die hohen Töne, bzw. die hohen Frequenzen in der Nähe der Basis kodiert, da die Membran basisnah noch dicker und somit starrer ist (Schmidt Lang, 2010, S.326). Der Ort des Schwingungsmaximums ist also frequenzabhängig. Während der hochfrequente Bereich an der Basis liegt, sind tieffrequente Töne am Helicotrema abgebildet (Lenarz 2012, S.25). So hat jede spezifische Frequenz eine entsprechende Stelle auf der sie ein Amplitudenmaximum der Schwingung erreicht. Dass folglich jede Resonanz einen anderen Ort besitzt, wird als Tonotopie bezeichnet (Lenarz 2012, S.27). 2.2.4. Corti- Organ: Das Corti- Organ ist im Detail aufgebaut aus den inneren und äußeren Haarsinneszellen, Stützzellen, Axonen und weiteren Zelltypen (Klinke 2010, S.681). Die inneren Haarsinneszellen liegen in einer Reihe angeordnet, kommen auf eine Anzahl von circa 3500 Zellen pro Cochlea und besitzen zahlreiche Stereozilien (Deetjen 2004, S.140), welche in die Endolymphe ragen. Die äußeren Haarsinneszellen sind dreireihig angeordnet. Man vermutet circa 12.000 äußere Haarsinneszellen pro Gehörschnecke und auch sie besitzen zahlreiche Stereozilien (Probst 2008, S.150). Diese Stereozilien sind orgelpfeifenartig der Größe nach geordnet und untereinander durch das Protein Cadherin, in Form der Tip Links, verbunden (Deetjen 2004, S.140), sodass sich eine Deflektion einer Stereocilie auf die anderen überträgt (Lüllmann-Rauch 2009, S.567). Im Gegensatz zu den vestibulären Haarsinneszellen degeneriert das Kinozilium der cochleären Haarsinneszelle bei Säugetieren, sodass sie nur Stereozilien auf ihrer Oberfläche tragen (Deetjen 2004, S.140). Bedeckt ist diese Anreihung von Zellen verschiedenen Aufbaus und verschiedener Funktion von der Tektorialmembran (Schmidt Lang 2007, S.351). Die mechanische Einwirkung, welche die Basilarmembran bei Schalleinspeisung in Schwingung versetzt, sorgt dafür, dass die Basilarmembran quasi entgegen der Tektorialmembran bewegt wird (Klinke 2010, S.682). Ein Abknicken und Auslenken der Stereozilien der Haarsinneszellen abwechselnd in beide Richtungen ist die Folge, wobei zu beachten ist, dass nur die Stereozilien der äußeren Haarsinneszellen in der Tektorialmembran verankert sind (Schmidt Lang 2007, S.352). Die Haarsinneszellen besitzen in der Membran der Stereozilien nichtselektive, mechanosensitive Kaliumkanäle, welche von Stereozilie zu Stereozilie untereinander mit Tip Links verbunden sind (Klinke 2010, S.683). Ein Abknicken der Stereozilien in Richtung des größten Stereoziliums führt nun zur Öffnung dieser Kanäle und somit zur Depolarisation der Zelle, entgegen des größten Stereoziliums zum Schließen der Kanäle und der Hyperpolarisation der Zelle (Schmidt Lang 2007, S.354). Diesen Vorgang nennt man Transduktion (Klinke 2010, S.681/682). 10 2. Einführung: Bei Kaliumeinstrom und Depolarisation der Haarsinneszelle wird das Schwellenmembranpotential für die spannungsabhängigen Calciumkanäle erreicht und es folgt der Calciumeinstrom. Über den Snare- Komplex und die Calciumbindung daran folgt der Transmitterrelease von Glutamat in den synaptischen Spalt (Schmidt Lang 2007, S.354). In Folge dessen kommt es zur postsynaptischen Glutamatbindung mit anschließender Depolarisation, Ausbildung eines erregenden postsynaptischen Potentials und in Folge eines Aktionspotentials (Schmidt Lang 2010, S.325). Dieser Prozess wird als Transformation bezeichnet. Hierbei ist auf das oben beschriebene Prinzip der Tonotopie zu verweisen, also die Codierung der Tonhöhe durch den Ort. Dieses Prinzip setzt sich bis ins zentrale Nervensystem fort (Lenarz 2012, S.27). Da die inneren Haarsinneszellen nun spezifisch an dem Punkt der maximalen Auslenkung der Basilarmembran depolarisieren und Glutamat freisetzen, wird ein Aktionspotential der nachgeschalteten Neurone auch nur an spezifischer Stelle gebildet (Schmidt Lang 2010, S.327). Die Neurone haben ihre Axone, also ihre afferenten Nervenenden nur jeweils an einer Stelle der Basilarmembran, sodass sie frequenzspezifisch erregt werden können (Schmidt Lang 2010, S.327). Darstellung 7: Mechanismus der Depolarisation der inneren Haarsinneszelle (Schmidt Lang 2010, S.325). 11 2. Einführung: 2.3. Schwerhörigkeit: Die Einschränkung oder gar der Verlust des Hörens kann vielerlei Ursachen haben. Nicht jeder Patient wird bei Schwerhörigkeit automatisch mit einem Cochlea Implantat versorgt. Abhängig von der Ursache und der Erfolgsaussicht ist es vor allem dann indiziert, wenn ein Hörgerät, welches extern, voll- oder teilimplantierbar ist, nicht mehr ausreicht um dem Menschen Kontakt zu seiner Umwelt zu gewährleisten. Rein funktionell wird zwischen einer Schallleitungsstörung und einer Schallempfindungsstörung unterschieden. 2.3.1 Schallleitungs- / Schallempfindungsstörung: Die Schallleitungsstörung ist definiert als eine Störung der Übermittlung des Schalls von außen zur Cochlea (Schmidt Lang 2010, S.319). Ursächlich hierfür ist eine Störung oder Schädigung im Gehörgang oder deutlich häufiger im Mittelohr (Probst 2008, S.163), beispielsweise in Form eines Paukenergusses, Cholesteatoms, einer chronischen Otitis media eventuell mit Fortsetzung in eine Mastoiditis (Lenarz 2012, S.82- 98), einer Otosklerose und vieler anderer Ursachen (Lenarz 2012, S. 108). Schallleitungsstörungen werden nicht mittels CI versorgt, sondern mit einer Tympanoplastik oder einem aktiven Mittelohrimplantat, da nur das Mittelohr geschädigt, das Innenohr inklusive der Haarsinneszellen jedoch noch völlig intakt ist (Schmidt Lang 2010, S.319). Eine Schallempfindungsstörung dagegen ist definiert als eine Störung der cochleären Innenohrfunktion oder retrocochleärer, nachgeschalteter Strukturen, bei welcher die Physiologie des Hörens bis zur Einspeisung ins Innenohr entlang der Schallleitung noch intakt ist, sprich der Schall noch für die Schwingung des ovalen Fensters sorgt (Probst 2008, S.233). Die Empfindung dieses weitergeleiteten Schalls ist jedoch gestört oder nicht vorhanden, da die Schallwellen beispielsweise nicht mehr in elektrische Signale übersetzt werden können und somit die Hörempfindung ausbleibt (Schmidt Lang 2010, S.321). Nur cochleäre Schäden können mit einem CI ausgeglichen werden, da der Hörnerv intakt sein muss, um den Schall vom CI über das Ganglion spirale und den Hörnerv in höhere Zentren zu übermitteln (Lenarz, 2012, S.131). Die Unterteilung nach zeitlichem Auftreten einer cochleären Schallempfindungsstörung in präund postlinguale Ursachen ist hier sinnvoll, da es einen großen Unterscheid macht, ob der Patient vor oder nach Spracherwerb, also dem Erlernen der Sprache, des Sprachverständnisses und des Sprechens ertaubte. In der Festlegung auf ein konkretes Alter unterscheiden sich die bisherigen Studien jedoch (Nicholas and Geers 2007; Uziel et al. 2007; Artieres et al. 2009; Geers 2004; Holt and Svirsky 2008; Waltzman et al. 2002). 12 2. Einführung: 2.3.2. Prälinguale Ursachen: Schwerhörigkeit und Taubheit sind oft nicht Folge von Krankheiten oder Begebenheiten im Laufe des Lebens, sondern häufig im Rahmen von Syndromen, Mutationen oder Fehlbildungen bereits bei Geburt vorhanden. Auch toxische, infektiöse oder genetische Einflüsse können dazu führen, dass das Innenohr wie von Jackler et al. (1987) beschrieben in seiner Größe nicht bis zum Ende des ersten Schwangerschaftstrimenons (Jackler et al. 1987) oder funktionell nicht bis zum Ende der Schwangerschaft (Pujol et al. 2003) ausgereift ist, sondern in seiner Entwicklung behindert wurde und folglich funktionseingeschränkt oder gar funktionslos bleibt. Eine Lues-, konnatale Röteln- oder Toxoplasmoseinfektion (Probst 2008, S.184), eine Thalidomidintoxikation (Jorgensen et al. 1964) oder auch ein fetales Alkoholsyndrom (Church et al. 1988) sind mögliche Ursachen. Es gibt zahlreiche klinische Syndrome, welche mit Schwerhörigkeit assoziiert sind. Das AlportSyndrom, bei welchem zusätzlich eine progrediente Niereninsuffizienz auftritt oder das JervellLange- Nielsen Syndrom, bei welchem zusätzlich ein Long- QT- Syndrom am Herzen beobachtet wird (Probst 2008, S.182), gehören zu den bekanntesten. Weiterhin ist eine Mutation des Connexins 26 mit die häufigste mit Taubheit assoziierte Mutation, bei welcher das Protein Connexin Nummer 26 defekt ist (Lenarz 2012, S.124; Kelsell et al. 1997), welches für die Aufrechterhaltung des endocochleären Potentials über die Kaliumrezirkulation mitverantwortlich ist (Lüllmann- Rauch 2009, S. 568/569). Eine interessante Sonderform der cochleären Fehlbildungen stellt die Mondini Dysplasie dar (Franzen 2007, S.51), bei der die Cochlea nur 1.5 Windungen aufweist und stattdessen ein erweitertes Vestibulum mit erweitertem vestibulärem Aquädukt aufweist (Pediatric Radiology, Reid, 2013). Das Besondere dieser Dysplasie ist, dass die Schwerhörigkeit nicht von Geburt an auftritt, sondern sich oft verzögert und progredient manifestiert (Usami et al. 1999). Darstellung 8: Darstellung eines linken Felsenbeins mit dysplastischer Cochlea (Pfeil) und dysplastisch vergrößertem Vestibulum (Pfeilspitze) (Pediatric Radiology, Reid, Oxford University Press, 2013, Seite 441). 13 2. Einführung: 2.3.3. Postlinguale Ursachen: Eine postlingual erworbene Schwerhörigkeit oder Taubheit kann vielerlei Ursachen haben. Am häufigsten findet sich jedoch keine Ursache oder aber genetische / familiäre Ursachen mit schubweisem Fortschreiten der (beidseitigen) Schwerhörigkeit bis zur Taubheit. Eine andere Ursache der Schwerhörigkeit bis zur Ertaubung ist die Labyrinthitis, eine Entzündung des häutigen Labyrinths (Lenarz 2007, S.90). Sie wird durch das Übergreifen einer Otitis media, oder als Komplikation eines Cholesteatoms mit eher ungünstiger Prognose verursacht (Lenarz 2012, S.99 / 100). Zusätzlich kann Drehschwindel und Spontannystagmus auftreten (Lenarz 2007, S.90). Auch eine virale, bakterielle oder autoimmune Ursache für die Labyrinthitis ist nicht außer Acht zu lassen (Franzen 2007, S.55). Die Gefahr des Fortschreitens der Entzündung und Übergreifens auf die Hirnhäute bis hin zur Meningitis ist nicht zu verachten und unter antibiotischer Therapie und chirurgischer Ausräumung der Entzündung heilt die eitrige Labyrinthitis oft unter Verlust des Hörvermögens aus, sodass bei diesen Patienten die Versorgung mit einem CI indiziert sein kann (Lenarz 2012, S.99 / 100). Eine bakterielle Meningitis selbst, also eine Entzündung der Hirnhäute durch Bakterien, löst häufig trotz erfolgreicher antibiotischer Behandlung besonders bei Kindern Sklerosierungsprozesse und Bindegewebsvermehrung im Bereich des Innenohrs aus, was ebenso zu einer Schallempfindungsstörung bis hin zur Taubheit führen kann und dann meist eine Indikation zur beidseitigen CI- Versorgung darstellt (De Barros A. et al. 2014). Darstellung 9: axiales CT Schnittbild eines Felsenbeins eines Patienten mit partieller Ossifikation der cochleären Basalwindung bei Zustand nach Meningitis (De Barros A. et al. 2014). 14 2. Einführung: Postlingual kann auch ein Vestibularisschwannom zur erworbenen Schwerhörigkeit führen. Das Vestibularisschwannom enspricht einem Tumor, welcher von den Schwannzellen ausgeht, die den Nervus vestibularis auskleiden (Lenarz 2012, S.134). Dieser nicht metastasierende Tumor sitzt meist am Kleinhirnbrückenwinkel oder im inneren Gehörgang (Probst 2008, S.279). Er mindert bei progredientem Wachstum zum einen durch Komprimierung der Arteria labyrinthi die Blutversorgung der Cochlea und führt somit zur Degeneration der Haarsinneszellen, zum anderen zur direkten Komprimierung und Schädigung des Hörnerven mit anschließender Schwerhörigkeit oder Taubheit (Slattery et al. 1998, Brackmann et al. 2001, Lustig et al. 2006). Auch Schwindel (Wiegand et al. 1996) oder gar eine Fazialisparese, eine partielle Lähmung der Gesichtsmuskulatur, kann auftreten (Lenarz 2012). Das Akustikusneurinom kann chirurgisch entfernt werden und der Patient kann nach einiger Zeit meist mit einem CI versorgt werden (Arriaga et al. 1995; Lustig et al. 2006). Im Rahmen syndromaler Krankheiten wie einer Neurofibromatose Typ 2 wächst das Vestibularisschwannom oft beidseits (Lustig et al. 2006). Darstellung 10: a) Darstellung eines Vestibularisschwannoms im Kleinhirnbrückenwinkel (links im axialen MRT, rechts als Schemazeichnung). b) Darstellung eines Vestibularisschwannoms Meatus acusticus im internus (links im koronaren MRT mit Gadolinium, rechts Schemazeichnung) als (Hals- Nasen-Ohrenheilkunde, Probst, Grevers, 2008, S.279). Ursache für eine progrediente Innenohrschwerhörigkeit kann auch der sogenannte Morbus Ménière sein, welcher sich durch seine einseitige Trias aus Hörminderung, Drehschwindel und Tinnitus kennzeichnet (Lenarz 2012, S. 112). Ein Hydrops des häutigen Labyrinths wird hier durch eine gestörte Endolymphresorption mit erhöhtem Endolymphvolumen verursacht (Franzen 2007, S.57). 15 2. Einführung: Eine dadurch bedingte Ruptur der Reissnermembran führt zu Permeabilitätsstörungen und einem Potentialzusammenbruch mit Folge der Intoxikation der Haarsinneszellen (Lenarz 2012, S.112). Bezüglich der Hörminderung kann eine direkte Versorgung mit einem CI erfolgen, da der Hörnerv durch den Morbus Ménière nicht beschädigt wird (Samy et al. 2014). Auch ein Trauma des Innenohrs bei einem sehr lauten Knall oder einer Explosion mit irreversiblem Verlust der Haarsinneszellen, welche aufgrund fehlender Stammzellen nicht regenerieren, ist als Ursache für eine Schwerhörigkeit oder gar Taubheit denkbar (Lenarz 2012, S.120). Weiterhin kann auch ein Schädel- Hirn- Trauma eine sogenannte Commotio labyrinthi verursachen, welche zur Taubheit oder Schwerhörigkeit führen kann (Probst 2008, S.239). Teils irreversible Schäden der Haarsinneszellen können auch durch ototoxische Medikamente, gerade durch Antibiotika oder Chemostatika wie Cisplatin (Lenarz 2012, S.122), aber auch durch Blei- oder Quecksilberverbindungen verursacht werden (Probst 2008, S.240). 2.4. Das Cochlea Implantat: 2.4.1. Das Implantat: Das CI dient dem Ersatz einer ausgefallenen Innenohrfunktion durch direkte elektrische Reizung des Hörnervs. Es besteht aus zwei Teilen, dem Sprachprozessor und dem Implantat selbst (O´Donoghue, 2013). Der Sprachprozessor mit sich daran befindender Sendespule wird extern getragen und enthält ein Mikrophon für die Aufnahme der Schallwellen, sowie eine Batterie zur Stromversorgung (O´Donoghue, 2013). Er ist für die Verschlüsselung in digital kodierte Signale zuständig, welche mit Hilfe von elektromagnetischer Induktion transkutan über die Sendespule durch die intakte Haut übermittelt werden (Lehnhardt 2001, S.293/294). Das Implantat dient als Empfangsspule zur Umwandlung in und Weiterleitung der elektrischen Signale zu einzelnen Elektroden innerhalb der Gehörschnecke (Lenarz 2012, S. 130/131). Auch hierfür ist Energie notwendig, welche mittels Induktion vom Sprachprozessor ebenfalls transkutan übermittelt wird (Lehnhardt 2001, S.293/294). Die Elektroden auf einem Elektrodenträger reichen unterschiedlich weit in die Scala tympani hinein, wodurch die tonotope Ordnung und die Orts- Transformation durch Reizung verschiedener Abschnitte grob erhalten bleibt und stimulieren die Nervenfasern des Nervus cochlearis, welcher die Hörinformation in das zentrale Nervensystem weiterleitet und somit einen Höreindruck vermittelt (Lenarz 2012, S.130/131). 16 2. Einführung: Darstellung 11: Transversalschnitt durch das Ohr mit Darstellung des Cochlea Implantates, vom Sprachprozessor über den Korpus: hier „Cochlear bis Implant“ zum Elektrodenträger (Berghaus, Duale Reihe S.193, 1996). Die Firma Cochlear™ stellte eine Weiterentwicklung dieses Prinzips mit dem Nucleus 6 System vor, welches vor allem den hochfrequenten Bereich über den oben beschriebenen herkömmlichen Weg in die Cochlea einspeist, während der niederfrequente zusätzlich über den physiologischen Weg über das Mittelohr durch einen Soundprozessor im Meatus acusticus externus verstärkt wird (Carlson et al. 2012). Durch diese sogenannte Hybridfunktionalität ist das Implantat quasi gleichzeitig als Hörgerät nutzbar und unterstützt den Erhalt und das Verwenden von Restgehör in besonderer Form (Gantz et al. 2010, Fitzgerald et al. 2008, Carlson et al. 2012, Yawn et al. 2015). Die zu implantierende Seite ist umstritten. Zum einen führt ein Cochlea Implantat in der besseren Seite auch zu besseren Rehabilitationsergebnissen, da auch das Ganglion spirale und der Nervus cochlearis bei fehlender Stimulation langsam degenerieren (Holden et al. 2013). Zum anderen ist bei Implantation des schlechteren Ohres, noch eine Zweitversorgung beim besseren zu einem späteren Zeitpunkt möglich und eventuell auch eine Hörgeräteversorgung sinnvoll. Vor allem Kinder mit beidseitiger Taubheit werden mittlerweile bilateral implantiert, wodurch auch ein Zugang zum Richtungshören ermöglicht wird (Lenarz 2012, S.130/131). Bilateral versorgte Patienten zeigten in zahlreichen Studien bessere Ergebnisse im Sprachverständnis sowie der Sprachlokalisation in Störlärm (Venail et al. 2008, Dunn et al. 2012, Yawn et al. 2015), wobei bei Kindern simultan bilateral versorgte Patienten bessere Resultate zeigten verglichen mit sequentiell versorgten (Lammers et al. 2014, Yawn et al. 2015). 17 2. Einführung: Darstellung Überblick Cochlea 12: über das Implantat (Lenarz 2012, S. 131). 2.4.2. Der Elektrodenträger: Es gibt die drei großen namhaften Herstellerfirmen MED- EL™, Cochlear™ und Advanced Bionics™, welche unterschiedliche Arten an Elektrodenträgern anbieten. Während ein perimodiolarer Elektrodenträger dazu geschaffen ist vor allem modiolusnah und zentripetal in der Cochlea, also so nah wie möglich am Ganglion spirale, zu liegen und dementsprechend vorgeformt ist, zielt die Außenwandelektrode auf wie der Name sagt eine modiolusferne zentrifugale Lage in der Gehörschnecke ab (Yawn et al. 2015; Frisch et al. 2015). 18 2. Einführung: Bezüglich der Lage des Elektrodenträgers untersuchten neuere Studien auch einen neu entwickelten mitt-skalären Elektrodenträger, welcher die Traumarate der Außenwand, sowie des Modiolus bei Insertion vermindern soll (Hassepass et al. 2014). Um die Perforation oder Verletzung der sensiblen cochleären Strukturen bei Insertion des Elektrodenträgers zu vermindern, entwickelte Cochlear™ vor einigen Jahren die Contour Elektrode durch eine Silikonspitze zur Contour Advance Elektrode weiter, wobei der Mechanismus den Hörnerv zu stimulieren identisch blieb (Aschendorff et al. 2007). Hierdurch wurden deutlich weniger Dislokationen und mehr Insertionen in die gewünschte Scala tympani erreicht, was auch mit besserem Sprachverstehen assoziiert ist und das Risiko für Verletzungen der sensiblen cochleären Strukturen tatsächlich verringert (Aschendorff et al. 2007). Darstellung 13: Röntgenübersichtsaufnahmen verschiedener derzeit auf dem Markt erhältlicher Elektrodenträger. A) MED-El Pulsar und B) Neurelec Digisonic als Außenwandelektroden im Vergleich zu C) Advanced Bionics Helix und D) Cochlear Contour Advance als perimodiolare Elektrodenträger. (Boyd 2011). Weiterhin besitzen die neueren CI- Modelle eine Versteifung des Elektrodenträgers, welche mit Insertion in die Cochlea zurückgeschoben wird, um die individuellen anatomischen Verhältnisse der Cochlea und die sensiblen Strukturen weitestgehend zu schonen, um so eine Dislokation zu verhindern, einen perimodiolaren Sitz nahe des Ganglion spirale zu garantieren und das Restgehör des Patienten weitestgehend zu erhalten (Schurzig et al. 2010). Diese Technik wird „Advance off stylet“ genannt (Schurzig et al. 2010) und findet besonders bei den perimodiolaren Elektrodenträgern von Cochlear ™ Verwendung. 19 2. Einführung: Darstellung 14: a) Digitale Volumentomographie zur Darstellung eines ideal inserierten Elektrodenträgers in die Scala tympani (Aschendorff et al. 2005). b) Histologie zur Darstellung eines ideal inserierten Elektrodenträgers in die Scala tympani (Aschendorff et al. 2005). c) Schemazeichnung zur Darstellung des Elektrodenträgers (ET) mit optimaler Lage in der Scala tympani (ST) (Gerard O´Donoghue 2013). 20 2. Einführung: Um sich der individuellen Form und Länge der Cochlea besser anzupassen, sind bereits Elektrodenträger verschiedener Länge erhältlich. Während MED- EL™ vier verschiedene Längen zwischen 20 und 31.5 mm ihrer FLEX© Elektrodenträger anbieten, hat Cochlear™ 3 Elektrodenträger zwischen 15 und 20 mm Länge im Sortiment (Quelle: Cochlear™; MEDEL™). Weiterhin sind spezielle Elektrodenträger für fehlgebildete Cochleae und für Patienten entwickelt worden, bei denen eine zusätzliche Abdichtung und ein Verschließen der Cochlea von Nöten sein könnte, wie beispielsweise die FORM- Serie© von MED- EL™. Nicht nur in der Länge, sondern auch im Durchmesser soll der Elektrodenträger des CIs immer mehr an die individuelle Ausprägung der Cochlea angepasst werden, um das Outcome im Hören und Sprachverstehen weiter zu optimieren. Individuelle Unterschiede der Cochlea und das Ziel des Restgehörerhalts bestimmen meist die Elektrodenwahl. Ziel der derzeitigen Entwicklung ist also folglich nicht den einen Elektrodenträger für alle, sondern den einen Elektrodenträger für den einen Patienten zu finden. 2.4.3. Die Operation: Nach Schnittsetzung hinter der Ohrmuschel und parallel zum äußeren Gehörgang, erfolgt zunächst eine Mobilisierung der drei durchtrennten Schichten, der Haut, des Musculus temporalis und des Periosts nach kaudal (Lenarz 1998, S.33/34). Anschließend wird mittels Mastoidektomie, bei welcher das Os mastoideum mit Planum ausgeräumt wird, Platz und zeitgleich ein Zugangsweg zum Mittelohr geschaffen (Yawn et al. 2015). Hierbei erfolgt die Darstellung des Sinus sigmoideus, der Dura innerhalb der mittleren Schädelgrube, des horizontalen Bogengangs und des Incus (Waltzman, Roland, 2014, Cochlear Implants, Kapitel 10). Über eine posteriore Tympanotomie, also eine Eröffnung des Mittelohrs von dorsal erfolgt der Zugang zur Cochlea. Hierbei hat die Darstellung und Schonung des Nervus facialis äußerste Priorität (Lenarz 1998, S.33/34). Es wird ein dreieckiges Operationsgebiet zwischen Chorda tympani, horizontalem Bogengang und dem N. facialis gebildet, wobei hierbei das Fazialismonitoring äußerst wichtig ist, um eine eventuelle Schädigung mit nach sich ziehender Fazialisparese zu vermeiden (Yawn et al. 2015). Somit erhält der Chirurg Zugang zum Mittelohr und dem runden Fenster. Vor Eröffnen der Cochlea selbst wird eine Tasche zwischen Knochen und Periost dorsolateral der Mastoidektomie für den Korpus des CIs geschaffen (Yawn et al. 2015). Nach Darstellung der Cochlea und Identifizierung aller relevanten anatomischen Strukturen erfolgt die Eröffnung der Cochlea um den Elektrodenträger zu inserieren. 21 2. Einführung: Hierfür gibt es abhängig von den anatomischen und chirurgischen Begebenheiten die Möglichkeit die Cochlea mittels Cochleostomie zu eröffnen oder den Elektrodenträger durch das runde Fenster zu inserieren (Yawn et al. 2015). Der Elektrodentypus wird je nach Zugangsweg in die Cochlea bestimmt, so dass es Elektrodenträger gibt, die zur Cochleostomie und welche, die zur Rundfensterinsertion geeignet sind (Ernst 2009, S.43). Die Kontrolle der Elektrodenlage erfolgt neben weiteren elektrophysiologischen Messungen über Betrachtung des Musculus stapedius bzw. seiner Sehne (Battmer et al. 1990; Hodges et al. 1997). Dieser Fremdreflex funktioniert nur bei vorhandener Stimulation des N. cochlearis. Wenn die Implantation also erfolgreich war, kann intraoperativ über Kontrolle der Kontraktion des Musculus stapedius die Stimulation des Ganglion spirale und somit des N. cochlearis überprüft werden (Battmer et al. 1990; Hodges et al. 1997). 2.4.4. Indikation: Die Reifung der Hörbahn und der Hörrinde im zentralen Nervensystem erfolgt in Zeit- oder Entwicklungsfenstern, welche vor allem bis zum dritten Lebensjahr „geöffnet sind“ und spätestens ab ungefähr dem zehnten Lebensjahr dauerhaft „verschlossen sind“ (Strutz, 2010, S.366). Das funktionelle Ergebnis der Hörentwicklung ist umso besser, je mehr dieser Zeitfenster genutzt werden konnten (Strutz, 2010, S.366). Es zeigte sich, dass die Langzeitergebnisse von schwerhörigen oder tauben Kindern dann hinsichtlich der Sprachdiskrimination am besten sind, wenn sie so früh als möglich mit einem CI versorgt wurden, wobei sich Autoren in der Festlegung eines „kritischen Alters“ deutlich unterscheiden (Geers et al. 2004; Uziel et al. 2007; Laszig et al. 2009; Haensel et al. 2005; Colletti 2009). Auch bei einseitig ertaubten Kindern wird eine frühzeitige Cochlea Implantation als vorteilhafter angesehen (Arndt et al. 2015). Dagegen haben taub geborene Erwachsene wenig Nutzen durch Cochlea Implantation, da Entwicklungsdefizite und fehlende Plastizität und Funktionalität der zentralen Hörbahn über Jahre das Outcome deutlich einschränken (Lenarz 2012, S.131). Bei hochgradiger Schwerhörigkeit oder gar Taubheit wird die Möglichkeit des CIs erwogen (Lenarz 2012, S.131). Nach einer Voruntersuchung, der Ursachenfeststellung, Audiometrie, einer BERA (brainstem evoked response audiometry) als objektivem Hörtest, präoperativer Schnittbildgebung in Form des CTs (Computertomographie) und des MRTs (Magnetresonanztomographie) und einer Beratung durch Ärzte, Logopäden und oft auch Pädagogen wird die Entscheidung für oder gegen eine CI Operation gefällt (Lehnhardt; Laszig 2001; S.298-301). 22 2. Einführung: Das zunächst wichtigste ist der Nachweis, dass die Hörminderung cochleär im Innenohr liegt und somit der N. cochlearis, der Hörnerv, angelegt, intakt und funktionsfähig ist, da der Patient sonst nicht von einem CI profitieren kann, was einerseits durch das vorhandene Restgehör des Patienten bestätigt, andererseits über eine BERA und eine Elektrocochleographie überprüft werden kann (Lehnhardt, Laszig; 2001; S.297). Etwa vier bis sechs Wochen nach Implantation erfolgt die erste individuelle Anpassung mit dem externen Teil des Implantates, dem Sound Prozessor. Die anschließende Rehabilitation sollte von einem Hör- und Sprachtraining begleitet sein. Bis der Patient jedoch wirklich zu hören vermag ist es ein langer Prozess, sodass eine Nachsorge über Jahre durch ein multidisziplinäres Team erforderlich ist (Konsenspapier von ACIR 2011; Diller 2009 ADANO - Leitlinien 2002). 2.5. Radiologie: Cochlea- implantierte Patienten stellen besondere Anforderungen an die bildgebenden Verfahren dar. Während früher häufig konventionelle Röntgenaufnahmen des Felsenbeins angefertigt wurden, werden heute weitgehend die Verfahren der Computertomographie und der Kernspintomographie (Franzen 2007, S.13) angesichts ihrer geringeren bzw. fehlenden Strahlenbelastung eingesetzt, auch da sie eine weitestgehend überlagerungsfreie Darstellung der Strukturen ermöglichen (Lenarz 2012, S.61). Die Patienten werden einerseits normalerweise sowohl präoperativ auf beispielsweise Malformationen gescreent, andererseits intra- bzw. postoperativ durchleuchtet, um den Sitz des Elektrodenträgers in der Cochlea zu kontrollieren (Aschendorff 2011). Während die hochauflösende Computertomographie (HRCT – high resolution computed tomography) oder die Magnetresonanztomographie (MRT) ihre Indikation vor allem im präoperativen Screening findet, wurde in den letzten Jahren an einer präziseren postoperativen Bildgebung gearbeitet, der digitalen Volumentomographie (DVT), welche besonders der Kontrolle der intracochleären Position des Elektrodenträgers dient (Aschendorff 2011). Der Fortschritt der chirurgischen Cochlea Implantation ist eng verknüpft mit und abhängig von bildgebenden Verfahren und ihrer höchstmöglichen Auflösung (Lenarz 2012, S.61). 23 2. Einführung: Darstellung 15: Computer-tomographie des Felsenbeins mit axialer Schnittführung (oben) und koronarer Schnittführung (unten), wobei jeweils der Pfeil die Cochlea und der Stern den inneren Gehörgang anzeigt (Lenarz 2012, S.61). 2.5.1. Präoperative Bildgebung: Sowohl die hochauflösende Computertomographie als auch das MRT werden für die präoperative Bildgebung eingesetzt, bei welcher besonders bei Kindern cochleäre Malformationen und andere Anomalien festgestellt werden (Aschendorff 2011). 24 2. Einführung: Darstellung 16: a) HRCT eines Patienten mit bilateraler cochleärer Hypoplasie (Durchmesser kleiner als 20 mm) und einer sehr kurzen Basalwindung (Pfeil). b) MRT desgleichen Patienten mit Darstellung des Nervus vestibulocochlearis (Pfeil). (Aschendorff 2011). Besonders die Darstellung des N. vestibulocochlearis spielt hier eine bedeutende Rolle, da er bei langwieriger Taubheit eventuell degeneriert oder durch Tumore wie ein Vestibularisschwannom in Mitleidenschaft gezogen worden sein könnte (Papsin BC 2005; Aschendorff et al. 2009a; De Foer B. et al. 2010; Aschendorff 2011). Das CT und das MRT zeigen bei bis zu 15 Prozent der kindlichen Patienten cochleäre Malformationen auf (Papsin BC 2005; Aschendorff et al. 2009a; Aschendorff 2011). Hierbei ist der Begriff der Malformation von einfachen Dysplasien des Vestibularorgans bis hin zu komplexen Fehlbildungen wie dem CHARGE- Syndrom anzusehen (Arndt et al. 2010). Besonders das HRCT eignet sich zur Darstellung knöcherner Strukturen, was zur Planung der chirurgischen Insertion von großer Bedeutung ist, da entsprechend der cochleären Morphologie über die Länge des Elektrodenträgers entschieden werden kann (Aschendorff 2011), sodass bei einer hypoplastischen Cochlea ein kürzerer Elektrodenträger gewählt werden würde, als bei einer normalen oder hyperplastischen Cochlea (Aschendorff 2011). Trotz derzeitiger Diskussionen um die Verwendung des MRTs, welches bindegewebige Strukturen und Nervenverläufe wie die des N. vestibulocochlearis und N. facialis deutlich besser darzustellen vermag (Lenarz 2012, S.63) als das HRCT, gilt dieses weiterhin als Goldstandard (Aschendorff 2011). 25 2. Einführung: Dennoch ist das MRT bei mittlerweile allen Patienten indiziert, besonders wenn Tumore wie das Vestibularisschwannom (Trotter et al. 2010; Helbig et al. 2009) oder eine Aplasie des N. vestibulocochlearis vermutet werden (De Foer et al 2010). Darstellung 17: Magnetresonanztomographie des Felsenbeins in axialer Schnittführung (links) in T2 Wichtung, in weiß flüssigkeitsgefüllte Liquorräume und Innenohr (Pfeil). Rechts: MRT nach Gadolinium- Gabe mit deutlichem Enhancement bei Vestibularisschwannom in koronarer Schnittführung (Lenarz 2012, S.62). 2.5.2. Intraoperative Bildgebung: Eine intraoperative Bildgebung gehört nicht zum Standardprozedere, kann aber in bestimmten Fällen, beispielsweise bei Fehlbildungen (Aschendorff 2011), indiziert sein. Bis vor nicht allzu langer Zeit erfolgte die intraoperative Bildgebung über klassische Röntgenaufnahmen, wobei diese mittlerweile vom HRCT und DVT abgelöst wurden (Aschendorff 2011), um eine korrekte intracochleäre Position des Elektrodenträgers zu überprüfen (Aschendorff et al. 2009b). Nachteilig ist hierbei ein großer Zeit- und vor allem Kostenaufwand, weshalb sich diese intraoperativen Bildgebungsverfahren vor allem an Zentren mit vielen Implantationen lohnen (Bischoff 2004; Aschendorff 2011). Es besteht die Möglichkeit kritische Phasen der Operation wie die Cochleostomie oder die Insertion des Elektrodenträgers mittels Navigation zu kontrollieren (Lenarz 2012, S.61). Weiterhin besteht hierdurch die direkte Kontrolle nach Insertion intraoperativ durch mobile DVTs (Aschendorff 2011). Die intraoperative Bildgebung wird auch in Zukunft eine zunehmend größere Rolle spielen, da bereits an Robotern gearbeitet wird, welche atraumatisch und minimal-invasiv den Elektrodenträger inserieren und dabei auf ständige intraoperative Bildgebung und Navigation angewiesen sein werden (Manrique et al. 2007; Klenzner et al. 2009; Majdani et al. 2009; Aschendorff 2011). 26 2. Einführung: 2.5.3. Postoperative Bildgebung: Die postoperative Bildgebung dient der intracochleären Lagekontrolle des Elektrodenträgers, als Qualitätskontrolle der Implantation und der Beurteilung des Felsenbeins bei Komplikationen oder zentralen Erkrankungen wie einem Vestibularisschwannom oder anderen zerebralen Raumforderungen, wobei verschiedene Formen der Bildgebung vom HRCT, DVT bis zum MRT genutzt werden (Aschendorff 2011). Bei Kindern wird meist eine transorbitale einfache Röntgenaufnahme gemacht (Xu et al. 2000, Aschendorff 2011), welche dem späteren Vergleich der Lage des Elektrodenträgers über Jahre hinweg dienen soll und welche aufgrund ihrer geringen Strahlenbelastung bei Kindern ohne größere Malformationen ausreichend ist (Aschendorff 2011). Bei Erwachsenen ist der Einsatz eines DVTs bzw. HRCTs in der postoperativen Bildgebung noch immer Gegenstand der Diskussion. Wie bereits Wullstein 1945 feststellte, ist die Qualität eines bildgebenden Verfahrens direkt messbar am Vergleich der radiologischen Ergebnisse mit den entsprechenden histologischen Schnitten (Wullstein 1948). In zahlreichen Studien behauptete sich das DVT im Vergleich der radiologischen und histologischen Schnitte und gilt somit als äußerst geeignet, Strukturen des Felsenbeins adäquat darzustellen (Husstedt et al. 2002; Aschendorff et al. 2003; Klenzner et al. 2004; Richter et al. 2005). Darstellung 18: postoperative transorbitale konventionelle Röntgenaufnahme bei einem beidseits mit Cochlea Implantat versorgten Kind (Aschendorff 2011). Das DVT bietet verglichen mit dem HRCT den Vorteil einer geringeren Strahlenbelastung des Patienten, eines geringeren metallenen Artefakts durch den Elektrodenträger, ist aus technischen Gründen jedoch weniger geeignet zur klaren Darstellung von Weichteilgewebe (Lenarz 2012, S.61). 27 2. Einführung: Das HRCT bringt dagegen zwar eine stärkere Strahlenbelastung mit sich und hat größere Elektrodenartefakte in seiner Darstellung, ist aber auch geeignet um feinste Weichteilstrukturen darzustellen (Lenarz 2012, S.61). Dennoch zeigt die DVT klare Vorteile in der Evaluation der Elektrodenlage bei einer Auflösung bis zu 0.3 mm und aufgrund des deutlich geringeren Elektrodenartefakts (Majdani et al. 2009; Ruivo et al. 2009; Aschendorff et al. 2004; Kurzweg et al. 2010; Aschendorff 2011). Somit ist die Verwendung der DVT zur postoperativen Darstellung beim Erwachsenen klar indiziert, um die Lage des Elektrodenträgers zu kontrollieren (Aschendorff et al. 2005; Aschendorff et al. 2007). Dieser liegt idealerweise in der Scala tympani, da nur dort ein Restgehörerhalt möglich ist und somit dient die intracochleäre Lage des Elektrodenträgers auch der postoperativen Qualitätskontrolle der Insertion (Aschendorff 2011). Die DVT gilt dem HRCT gegenüber somit bei postoperativer Fragestellung als überlegen (Husstedt et al. 2002; Ruivo et al. 2009; Kurzweg et al. 2010; Aschendorff et al. 2005; Aschendorff et al. 2007) und ist weiterhin für CIs sämtlicher Hersteller und mit sämtlichen Elektrodenträgern zugelassen (Aschendorff 2011). Bei Verwendung des HRCTs wäre ein Vergleich der prä- und postoperativen Bildgebung notwendig, um die skaläre Lage des Elektrodenträgers weitestgehend bestimmen zu können (Lane et al. 2007; Skinner et al. 2007), was im klinischen Alltag zu viel Zeit beanspruchen würde (Aschendorff 2011). Ein großes Problem war in der Vergangenheit oft, dass der Magnet innerhalb der Silikontasche also im Korpus des Implantates bei der Magnetresonanztomographie dislozierte oder seine Magnetstärke verlor (Crane et al. 2010; Deneuve et al. 2008; Aschendorff 2011). Ein MRT kann aus verschiedensten medizinischen Gründen indiziert sein, ist bei manchen Fragestellungen nicht zu umgehen und wird in Zukunft aufgrund des demographischen Wandels und seiner Indikation besonders bei zentralen Raumforderungen zunehmend gefragt sein (Aschendorff 2011). Der Elektrodenträger und die Elektroden selbst bestehen zwar aus nichtmagnetischem Platin und / oder Titan (Angaben der Hersteller Cochlear™ und MEDEL™), dennoch ist ein Dislozieren des Magneten problematisch. Mit neueren Cochlea Implantaten ist die MRT Bildgebung unter bestimmten Bedingungen mit einer Feldstärke von 3.0 Tesla möglich, sodass ein Entfernen des Magneten vor dem MRT oft nicht mehr notwendig ist (Risi et al. 2004; Carlson et al. 2015). Trotzdem ist bei der Verwendung des MRTs mit besonders großen Artefakten durch den Elektrodenträger zu rechnen, sodass das Felsenbein oder der innere Gehörgang oft vollkommen überschattet sind (Aschendorff 2011). 28 2. Einführung: Darstellung 19: postoperatives MRT bei einem linksseitig CI versorgten Patienten zur Veranschaulichung des starken Elektrodenartefakts (Pfeile), welches Felsenbein und den inneren Gehörgang vollständig überlagert (Aschendorff 2011). 2.6. Literaturstand der Anatomie und des Cochlea Implantates: Die morphologische Variation der Cochlea kann Einfluss auf die finale Position des Elektrodenträgers nehmen. Von Malformationen der Gehörschnecke abgesehen wurde 1938 durch Hardy et al. erstmals gezeigt, dass die Ausprägung der Cochlea interindividuell verschieden ist und somit jeder Mensch eine etwas anders geformte Gehörschnecke besitzt, quasi einen Fingerabdruck des Ohres. Zahlreiche weitere Studien bekräftigten diese von Hardy aufgestellte These (Dimopoulos and Muren 1990; Xu et al. 2000). Weiterhin weist auch das Corti- Organ selbst eine Variation der Länge auf, was von Kawano et al. 1996, Ketten et al. 1998 und Xu et al. 2000 gezeigt wurde. Wie von Escudé et al. (2006) gezeigt und in dieser Studie weiter untersucht, variieren sowohl basale Windung als auch die entlang zweier Achsen gemessenen Durchmesser und somit die Form und Größe interindividuell (Escudé et al. 2006). Dennoch wurde immer wieder die Frage aufgeworfen inwiefern diese Unterschiede definiert und zuverlässig gemessen werden können und ob die interindividuell variierende Größe der Cochlea eine Rolle bei der Implantation spielt. Hat die Morphologie somit Einfluss auf die Insertion des Implantates, dessen Lage und somit eventuell auch dessen Funktion? 29 2. Einführung: 2.6.1 Cochleäre Größe: Darstellung 20: Darstellung der cochleären Größe in Form der gemessenen Distanzen A und B nach Escudé (Escudé et al. 2006). Escudé et al. (2006) zeigte als einer der Ersten wie diese Größe charakterisiert und gemessen werden kann. Er beschrieb eine Distanz A, welche vom runden Fenster durch den Modiolus bis zur lateralen Wand reichte und legte orthogonal dazu eine Distanz B fest, die ebenfalls durch den Modiolus reichte (Escudé et al. 2006). Die unterschiedliche Ausprägung der Cochlea kann Auswirkungen auf die lineare Insertionstiefe und den Insertionswinkel des Elektrodenträgers haben (Escudé et al. 2006). Wie von Xu et al. (2000) und Escudé et al. (2006) dargestellt, scheint der Insertionswinkel eine zuverlässigere postoperative Referenz für die Lage des Elektrodenträgers zu sein als die Insertionstiefe. Die von Escudé festgelegten Durchmesser A und B wurden von Van der Marel et al. (2013) aufgegriffen und ergänzt. Es wurden 8 Radien beschrieben, welche die Größe der Cochlea noch genauer definieren sollten (Van der Marel et al. 2013). Radius 1 und 5 zusammengenommen entsprachen Escudé´s Durchmesser A, während Radius 2 und 6 gemeinsam der Orthogonalen B entsprachen (Van der Marel et al. 2013). Für die anderen beiden Durchmesser orientierte sich van der Marel an dem sogenannten Leiden Koordinatensystem (Verbist et al. 2005), wobei er zum einen den horizontalen Bogengang und den Modiolus miteinander verband (Radius 4 und 8) und dazu eine Senkrechte (Radius 2 und 6) durch den Modiolus zog (Van der Marel et al. 2013). Wie sich zeigte sind sowohl Insertionstiefe als auch Insertionswinkel statistisch signifikant beeinflusst von der Größe der Cochlea und van der Marel gibt an, dass 13 Prozent der Varianz der Elektrodenposition durch die cochleäre Größe zu erklären sind (Van der Marel et al. 2013). 30 2. Einführung: Darstellung 21: Querschnitt und Vermessung der Cochlea bei van der Marel et al. 2013 (van der Marel et al. 2013). 2.6.2. Lage des Elektrodenträgers in der Cochlea: Das anatomische Verhältnis der Cochlea zu ihrem Implantat kann durch verschiedene Parameter beschrieben werden wie der Insertionstiefe, dem Insertionswinkel und der Elektrodenlage innerhalb der Scalae. Die Insertionstiefe variiert selbst bei Einhalten des gleichen chirurgischen Protokolls durch denselben Chirurgen und selbst Felsenbeinstudien im Labor zeigten diesbezüglich eine statistisch signifikante Varianz (Finley et al. 2008; Adunka et al. 2005; Ketten et al. 1998). Weiterhin korreliert die Insertionstiefe, welche die gemessene Länge des Elektrodenträgers von dem chirurgischen Zugangspunkt in die Cochlea und somit von dem runden Fenster oder der Cochleostomie bis hin zum apikalen Elektrodenartefakt darstellt, mit der Traumarate bei Cochlea Insertion (Welling 1993; Shepherd 1985, Adunka et al. 2006). Unter Traumarate ist hier die Dislokation des Elektrodenträgers von einer Scala in die andere aufgrund des Durchstoßens der Basilarmembran durch den Elektrodenträger gemeint. Weiterhin scheint die Insertionstiefe auch einen signifikanten Einfluss auf das postoperative Outcome zu nehmen und so nimmt man an, dass ein zu flach inserierter Elektrodenträger zu schlechterem Sprachverstehen führt (Hochmair 2003), während ein zu tief inserierter Elektrodenträger den Restgehörerhalt signifikant zu reduzieren scheint, wobei genaue Längenangaben hier noch Gegenstand der derzeitigen Diskussion sind (Adunka et al. 2004; Gstöttner et al. 1997 und 2005). 31 2. Einführung: Wie der Name Gehörschnecke schon sagt, handelt es sich bei der Cochlea um ein gewundenes Organ, sodass auch der gebildete Winkel zwischen dem inserierten Elektrodenträger innerhalb der Cochlea eine Aussagekraft über die Lage des Elektrodenträgers macht (Escudé et al. 2006). Nicht nur die Tiefe und der erreichte Winkel des Elektrodenträgers scheinen Einfluss auf die Ergebnisse nehmen zu können, sondern auch ihre Nähe zum Modiolus. So untersuchten Holden et al. (2013) das Verhältnis der Elektrodenlänge von der Cochleostomie bis zum apikalen Elektrodenartefakt zur Länge der lateralen Wand entsprechend diesen Abschnittes. Den gebildeten Quotienten nannten sie Wrapping Factor (WF), der die mediolaterale Position angeben soll und somit Aufschluss geben soll, wie eng oder locker der Elektrodenträger innerhalb der Cochlea in Betrachtung des Modiolus zu liegen scheint (Holden et al 2013). Darstellung 22: Übersicht der skalären Lagemöglichkeiten des Elektrodenträgers in der ST (Scala tympani – gefüllte Kreise) oder SV (Scala vestibuli – leere Kreise) mit Anschnitt des Hörnerven (VIII Nerve) (Holden et al. 2013). 2.6.3. Skaläre Lage des Elektrodenträgers: Ziel der Insertion ist es den Elektrodenträger ohne Dislokation in die Scala tympani einzubringen, da diese skaläre Lage mit einer besseren Sprachdiskrimination assoziiert ist (Aschendorff et al. 2005; Aschendorff et al. 2007). Dies gelingt jedoch nicht immer, da der Elektrodenträger manchmal in die Scala vestibuli eingebracht wird oder von einer Scala zur anderen disloziert (Aschendorff et al. 2007, Finley et al. 2008; Noble et al. 2013). Weiterhin ist aber vor allem die Erhaltung eines Restgehörs am ehesten möglich bei Insertion in die Scala tympani ohne Dislokation und somit ohne eine Penetration der Basilarmembran (James et al. 2005; Fraysse et al. 2006). Die Lage des Elektrodenträgers innerhalb der Cochlea scheint somit einer der definierenden Faktoren für das postoperative Outcome zu sein (Aschendorff et al. 2007; Finley et al. 2008). Weiterhin scheint die exakte intracochleäre Elektrodenlage Einfluss auf die subjektive Hörfunktion zu nehmen (Boéx 2006; Noble 2013). 32 2. Einführung: Dies führt zur Vermutung, dass eine bessere Kontrolle und Einflussnahme auf die Lage des Elektrodenträgers zu einem besseren Hörvermögen postoperativ führen könnte. Darstellung 23: Querschnitt einer Kadaverstudie eines Felsenbeins mit einer implantierten MED – EL Flex- Elektrode, welche die Basilarmembran in der mittleren, cochleären Wendung rupturiert (A) und die Lamina spiralis in der Basalwendung frakturiert (B) (Adunka et al. 2006; Boyd 2011). 2.6.4. Anpassung des Elektrodenträgers an die Cochlea: Studien zeigten wie oben beschrieben, dass die Elektrodenlage für den Erhalt der tonotopen Ordnung und des niederfrequenten Restgehörs wichtig zu sein scheint (James et al. 2005; Fraysse et al. 2006). Es stellte sich heraus, dass je länger der Elektrodenträger war bzw. je tiefer er inseriert wurde, desto höher war das Risiko der Penetration der Basilarmembran und der Minderung von präoperativ erfasstem Restgehör (James et al. 2005; Finley et al. 2008; Yawn et al. 2015). Mit abnehmender cochleärer Größe muss bei gleicher Elektrodenlänge die Insertionstiefe zunehmen, was in einem höheren Risiko der Dislokation resultiert. Die Dislokation des Elektrodenträgers und somit die Lage in der Scala vestibuli statt der Scala tympani wiederum korreliert mit einer reduzierten Worterkennung (CNC word score) und somit einem reduzierten postoperativen Hörvermögen (Finley et al. 2008). Folglich ist sowohl die Elektrodentiefe als auch der Umfang der Cochlea für das postoperative Outcome mitverantwortlich (Finley et al. 2008). In der CI Chirurgie und Rehabilitation gewinnt die präoperative Erfassung der individuellen Größe und Ausprägung der Cochlea zunehmend an Bedeutung. Sowohl die Anbieter von MEDEL™ als auch von Cochlear™ bieten ein zunehmend breiteres Spektrum an Elektrodenträgern an (Angaben: Cochlear™ und MED- EL™). Dabei unterscheidet sich weniger das Implantat oder der Prozessor. Die Hauptunterscheidung liegt in der Länge, dem Durchmesser und der Form des Elektrodenträgers (Angaben: Cochlear™ und MED- EL™). Der Eindruck, dass ein an die individuelle Cochlea angepasster Elektrodenträger eine bessere finale Elektrodenlage, ein verbesserter Erhalt des Restgehörs und am Ende ein höheres Sprachverstehen bewirken würde, zieht zunehmend das Augenmerk der Forschung auf sich. 33 Zielsetzung: 3. Zielsetzung: Die hier beschriebene Arbeit soll dem Zusammenhang von cochleärer Größe und Elektrodenlage des Cochlea Implantates näher kommen und diesen beschreiben. Sie soll sich somit in die bisherigen Studien einreihen, welche auf einen in der Zukunft individuell zur Cochlea und zum Patienten angepassten Elektrodenträger abzielen. Im Genauen soll • die Morphologie der Cochlea in Größe und Ausprägung dreidimensional erfasst, • die interindividuellen Differenzen beschrieben • und die gewonnenen Erkenntnisse mit der bisherigen Studienlage verglichen werden. Weiterhin soll • der Einfluss der Anatomie auf die finale Lage des Elektrodenträgers innerhalb der Gehörschnecke ermittelt • und der von Holden et al. (2013) beschriebene Wrapping Factor gebildet und verglichen werden. Diese Arbeit soll beantworten, ob und inwiefern sich die cochleäre Morphologie auf die Tiefe der Elektrodeninsertion, den Insertionswinkel, das Dislokationsrisiko und auf die finale Lage des Elektrodenträgers innerhalb der Scalae auswirkt. 34 4. Methode: 4. Methode: 4.1. Patientenkollektiv: In den Jahren 2003 bis 2010 wurden zahlreiche Patienten mit einem CI am Implant Center Freiburg (ICF) der Abteilung Hals- Nasen- Ohrenheilkunde des Universitätsklinikums Freiburg versorgt. In diese Studie wurden nur Patienten eingeschlossen, welche mit einer durch eine Cochleostomie inserierten perimodiolaren Cochlear™ Contour Advance® Elektrode (Cochlear Limited, NSW, Australia) versorgt wurden. Patienten, welche bei Zustand nach beispielsweise Meningitis oder Labyrinthitis Sklerosezeichen aufwiesen, wurden ausgeschlossen, da diese die Insertion und die Lage des Elektrodenträgers des CIs beeinflussen können. Weiterhin wurden cochleäre Aplasien, Hypoplasien und Malformationen ausgeschlossen. Es wurde nur ein Elektrodentypus in dieser Studie untersucht, um eine bestmögliche Vergleichbarkeit zu erreichen und den Einfluss durch unterschiedliche Begebenheiten der Elektrodentypen möglichst gering zu halten. Weiterhin wurden nur durch Cochleostomie versorgte Ohren in die Studie eingeschlossen, um die möglichen Unterschiede von Rundfensterinsertion und Cochleostomie zu exkludieren. Die Daten der Patienten wurden aus der Datenbank des ICF Freiburg gefiltert und deren postoperative Bilder retrospektiv ausgewertet. Zur grundsätzlichen präoperativen Versorgung erhielt jeder Patient eine digitale Volumentomographie (DVT) des Felsenbeins oder eine konventionelle DünnschichtComputertomographie des Felsenbeins um cochleäre Anomalien auszuschließen. Wie von Pein et al. 2014 überprüft gestattet die präoperative Bildgebung sowohl mit der DünnschichtComputertomographie aus auch mit der DVT äquivalente Ergebnisse und Felsenbeinstrukturen können auf beide Weisen der Bildgebung detailliert und exakt ermittelt und vermessen werden (Pein et al. 2014). Die postoperative Bildgebung erfolgte bei den Patienten durch digitale Volumentomographie (DVT, DynaCT-equipped Axiom Artis dTA angiography unit; Siemens Co., Erlangen, Germany) im Rahmen der regulären postoperativen Versorgung. Diese Art der Bildgebung wurde in zahlreichen Felsenbeinstudien sowohl bei histologischer Betrachtung (Aschendorff et al. 2003; Husstedt et al. 2002) als auch bei in vivo Insertionsstudien (Aschendorff et al. 2007; Aschendorff et al. 2005) beschrieben und als adäquat eingestuft. 35 4. Methode: Die Bilder wurden sowohl bezüglich der cochleären Größe und Ausprägung in Form zweier Durchmesser und der Höhe als auch bezüglich der Elektrodenposition in Form der Skalenlage (Scala tympani versus Scala vestibuli versus Dislokation), der Insertionstiefe, des Insertionswinkels und der entsprechenden Länge der lateralen Wand analysiert. 4.2. Radiologische Evaluation: Darstellung 24: horizontaler Schnitt der Cochlea auf Höhe der Basalwindung zur anschließenden Messung der cochleären Größe. Für die Bildrekonstruktion wurde Impax 6 von Agfa Healthcare verwendet. Wie von Escudé et al. (2006) beschrieben wurde initial ein koronares und sagittales Schnittbild verwendet um die basale Windung der Cochlea darzustellen. Durch entsprechende Rekonstruktion war es möglich die basale Windung gemeinsam mit dem runden Fenster, dem Modiolus, der lateralen Wand und dem Helicotrema darzustellen. Im Anschluss erfolgte die Analyse und Vermessung der zuvor dargestellten Strukturen. Dieser Schnitt ermöglichte es die von Escudé beschriebenen Distanzen A und B zu messen (Escudé et al. 2006). 36 4. Methode: Distanz A beschreibt den größtmöglichen Längsdurchmesser von dem runden Fenster durch den Modiolus zur lateralen Wand und Distanz B den orthogonal darauf liegenden Querdurchmesser durch den Modiolus (Escudé et al. 2006). Darstellung 25: beispielhafte Vermessung der cochleären Größe nach Escudé et al. (2006) mit Längsdurchmesser (rot) ab Cochleostomie (Pfeil) und orthogonal dazuliegendem Querdurchmesser (grün). Da die von Escudé entwickelten Distanzen die cochleäre Größe jedoch nur im zweidimensionalen Rahmen beschreiben, macht sich diese Studie zum Ziel den bisherigen Kenntnisstand durch radiologische Rekonstruktion um eine dritte Variable, die Höhe, zu ergänzen. Mit Hilfe von multiplanarer Rekonstruktion (EMPR) war es möglich durch einen Schnitt horizontal zu den Distanzen A und B nach Escudé eine dritte Ebene darzustellen und die Höhen in zwei daraus resultierenden Perspektiven aus zwei verschiedenen Ebenen zu messen, sodass die gemessenen Höhen a und b miteinander verglichen werden konnten. Diese Höhen aus zwei Perspektiven dienten auch als Gütekriterium für die Messgenauigkeit dieser Arbeit. 37 4. Methode: Oben: Darstellung 26a: multiplanare Rekonstruktion zur Vermessung der cochleären Höhe in zwei verschiedenen orthogonal zum horizontalen Schnitt stehenden Ebenen (oben links und oben rechts). Unten: Darstellung 26b: Vermessung der Insertionstiefe des Elektrodenträgers (rot) ab Cochleostomie (Pfeil). 38 4. Methode: Um die Insertionstiefe bestimmen zu können, wurde die Länge von der Cochleostomie entlang der Elektrodenartefakte bis zum apikalen Artefakt bestimmt. Weiterhin wurde die Länge der lateralen Wand von Cochleostomie bis auf Höhe des apikalen Elekrodenartefakts gemessen, um den von Holden et al. (2013) beschriebenen Wrapping Factor (WF) als Beschreibung für die mediolaterale Position des Elektrodenträgers und somit die Nähe zum Modiolus zu ermitteln. Dieser Wrapping Factor dient dazu einen Eindruck zu vermitteln wie eng oder locker der Elektrodenträger im Bezug zum Modiolus gewunden ist und ist als Quotient zwischen Elektrodenlänge zur lateralen Wandlänge definiert (Holden et al. 2013). Darstellung 27: Vermessung der Insertionstiefe des Elektrodenträgers (rot) im Vergleich zur entsprechenden lateralen Wandlänge (blau) ab Cochleostomie (Pfeil). Weiterhin wurde der Insertionswinkel mit Hilfe der Distanz A von Escudé (Escudé et al. 2006) bestimmt, wobei der Modiolus als Scheitelpunkt dient und die Gerade durch das apikale Elektrodenartefakt sowie die Gerade auf Distanz A liegend und durch die Cochleostomie ziehend als Strahlen des Winkels. 39 4. Methode: Darstellung 28: Vermessung des Insertionswinkels des Elektrodenträgers ab Cochleostomie (Pfeil). Um noch einen weiteren Parameter für die cochleäre Größe und Ausprägung zu erhalten, wurde mit Hilfe der Distanzen A und B und der Höhe a der Ellipsenumfang als Annäherung an den Umfang der Cochlea berechnet. Dieser Ellipsenumfang wurde mit der Annäherungsformel nach Ramanujan errechnet (Karl Strubecker, Oldenbourg 1984)und anschließend mit dem Wrapping Factor (Holden et al. 2013) verglichen. 4.3. Statistik: Die statistische Analyse erfolgte mit Hilfe von “Gnu R statistical computation and graphics system” (ANOVA, Tukey’s Honest Significant Difference; GNU R, Version 3.0.3, Core Team, Vienna, Austria, http://www.R-project.org). 40 5. Ergebnisse: 5. Ergebnisse: 5.1. Patientenkollektiv: Es wurden Schnittbilder von 403 Felsenbeinen ohne cochleäre Anomalie untersucht. Vorweg wurden sowohl Malformationen aussortiert als auch nur Patienten in die Studie inkludiert, welche mit einer perimodiolaren Cochlear™ Contour Advance® Elektrode (Cochlear Limited, NSW, Australia) implantiert wurden. Weiterhin wurden alle Patienten an dem Universitätsklinikum Freiburg in der Abteilung der Hals- Nasen- Ohrenheilkunde operiert und am Implant Center Freiburg (ICF) rehabilitativ betreut. Von ursprünglich 403 Ohren flossen 368 in diese Arbeit mit ein. Die Bildgebung für 13 Ohren wurde extern durchgeführt und somit waren die Bilder dieser Arbeit nicht mehr zugänglich. Bei 20 Fällen waren die in der Datenbank hinterlegten Bilder nicht für eine multiplanare Rekonstruktion geeignet und in 2 Fällen konnte das runde Fenster nicht aufgefunden werden, sodass keine zuverlässigen Durchmesser gemessen werden konnten. Für 368 Patienten konnten Daten gewonnen und die entsprechenden Schnittbilder betrachtet und ausgemessen werden. 184 linke und 184 rechte Cochleae wurden dabei gemessen. Es wurden 151 männliche und 217 weibliche Cochleae betrachtet. 276 Patienten wurden unilateral analysiert, während 46 Patienten bilateral ausgewertet wurden. Tabelle 1. Übersicht der in die Arbeit eingeschlossenen Patientendaten: Operationen postoperativeCBCT Aufnahmevorhanden Ausgeschlossen(aufgund mangelnderQualität) FüradäquateAuswertung ausreichend a) ImplantierteSeite b) Geschlecht c) UniversusBilateral d)PrimäreScalader Elektrodeninsertion e)KomplettinScala inseriert f)AusScaladisloziert 403 370(91.8%) 2 368(91.3%) 184links(50%) 151männlich(41%) 276unilateral(75%) S.tympani:319(87%) 184rechts(50%) 217weiblich(59%) 46bilateral(12.5%*2=25%) S.vestibuli:49(13%) S.tympani:250(68%) S.vestibuli:43(11%) S.tympani:69(19%) S.vestibuli:6(2%) Spalten a) bis f) beziehen sich auf die für die adäquate Auswertung ausreichenden Felsenbeine (368). 41 5. Ergebnisse: Bei diesen 368 Ohren wurde nun festgestellt, dass die meisten Elektrodenträger, nämlich 250, wie gewünscht in der Scala tympani (T) lagen, wohingegen 43 in der Scala vestibuli (V) positioniert wurden. 69 Elektrodenträger befanden sind ursprünglich in der Scala tympani, dislozierten aber im Verlauf durch die Basilarmembran in die Scala vestibuli (TD) und 6 Elektrodenträger lagen ursprünglich in der Scala vestibuli, dislozierten im Verlauf jedoch in die Scala tympani (VD). Ein Ohr wies eine dislozierte Scala media Position auf (MD), wird in weitere Analysen jedoch nicht weiter eingeschlossen und wurde in obiger Aufzählung auch nicht berücksichtigt, da weiterhin das runde Fenster nicht klar ersichtlich war. 5.2. Cochleäre Größe: Tabelle 2 zeigt die Resultate der Bildmessung der cochleären Größen. Distanz A vom runden Fenster durch den Modiolus bis zur lateralen Wand der Cochlea und die orthogonal dazu liegende Distanz B durch den Modiolus (Escudé et al. 2006) sind mit Mittelwert, Standardabweichung, Minimum und Maximum angegeben. Um ein Maß für den cochleären Größen- und auch Ausprägungsvergleich zu bekommen, wurden sowohl Quotient als auch Produkt der Distanzen A und B gebildet. Anhand des Quotienten A/B kann die Aussage getroffen werden, dass Distanz A 1.53mal länger ist als Distanz B und die Cochlea somit oval mit längerem Durchmesser entlang des Längsdurchmessers A ausgeprägt ist. Das Produkt der Distanzen A*B dient als Annäherung an die cochleäre Fläche bzw. die Ausdehnung auf Höhe der Basalwindung. Weiterhin wurde eine statistisch signifikante Korrelation zwischen Distanz A und Distanz B gefunden (r² = 0.5, p <= 0.0001) sowie eine signifikante Korrelation zwischen Distanz A und dem Quotienten A/B (r² = 0.326, p <= 0.0001). Orthogonal zu den Ebenen entlang der Distanz A und Distanz B nach Escudé et al. (2006) wurde eine dritte Variable, die Höhe, bestimmt, um erstmals dreidimensionale Eindrücke der Cochlea zu erhalten. Da die Höhe in zwei unterschiedlichen Ebenen messbar war, sind die Höhen a und b in Tabelle 2 angegeben und dienen als Gütekriterium für die Messgenauigkeit. Der Pearson Korrelationskoeffizient zeigte eine statistisch streng signifikante, lineare Korrelation zwischen Höhe a und b an (r² = 0.807, p <= 0.0001), was eine genaue aber unabhängige Messung verdeutlicht. 42 5. Ergebnisse: Tabelle 2. Bildmessungen der Cochlea: Cochleäre Messung Mittelwert Standardabweichung min / max Distanz A (mm) 9.95 0.59 7.8 / 11.7 Distanz B (mm) 6.54 0.48 5.0 / 8.0 Quotient A/B 1.53 0.11 1.23 / 2.08 Produkt A*B (mm²) 65.2 7.50 45.4 / 91.2 Höhe a (mm) 3.85 0.34 3.0 / 5.0 Höhe b (mm) 3.95 0.33 3.0 / 5.1 5.3. Geschlechtsvergleich der cochleären Größen: Die gemessenen Werte wurden weiterhin in Tabelle 3 geschlechterspezifisch aufgeteilt und miteinander verglichen. Es wurde ein statistisch signifikanter Unterschied bei den geschlechtergetrennten Mittelwerten für Distanz A (two-sample t- test, p < 0.05) gefunden, jedoch weder für Distanz B (p > 0.05) noch für den Quotienten A/B. Männliche Cochleae erwiesen sich bezüglich ihrer Distanz A um durchschnittlich 1.99 % größer als weibliche, absolut ausgedrückt um 0.2 mm. Da nur für Distanz A eine statistische Signifikanz gefunden wurde, könnte die Vermutung entstehen, dass weibliche Cochleae etwas runder wären und männliche etwas ovaler. Da jedoch der Quotient weder statistisch signifikant unterschiedlich ist (p > 0.05), noch bemerkenswert voneinander abweicht (1.54 versus 1.52) ist diese Annahme der unterschiedlichen Morphologie eher zu verwerfen. Für das Produkt der beiden Distanzen A*B wurde eine statistische Signifikanz gefunden (p < 0.05), was wohl mit der Signifikanz der Distanz A zusammenhängt. Die cochleäre Fläche auf Höhe der Basalwindung scheint bei männlichen Cochleae um 2.87 % größer zu sein als bei weiblichen Gehörschnecken, absolut ausgedrückt ist das Produkt A*B also bei männlichen Cochleae um 1.9 mm² größer. Jedoch zeigte sich weder für die gemessene Höhe a noch für Höhe b ein statistisch signifikant unterschiedlicher Wert zwischen Mann und Frau. 43 5. Ergebnisse: Tabelle 3. Geschlechtsvergleich männlich versus weiblich: alle männlich weiblich T-test: männlich/weiblich (p-Wert) Distanz A (mm) 9.95+-0.59 10.06+-0.549 9.86+-0.607 0.001126 Distanz B (mm) 6.54+-0.40 6.57+-0.495 6.52+-0.472 0.2659 Quotient A/B 1.53+-0.11 1.54+-0.113 1.52+-0.101 0.1007 Produkt A*B (mm²) 65.2+-7.50 66.3+-7.362 64.4+-7.518 0.01926 Höhe a (mm) 3.85+-0.34 3.88+-0.329 3.84+-0.349 0.2869 Höhe b (mm) 3.95+-0.33 3.96+-0.309 3.94+-0.341 0.4905 Bezeichnung: (Mittelwert +/- Standardabweichung). 5.4. Elektrodenträgervermessung: Tabelle 4. Messungen des Elektrodenträgers: Mittelwert Standardabweichung min/max (SD) Insertionstiefe (mm) 16.6 1.13 14.1/ 21.4 Laterale Wandlänge 23.0 1.67 18.4/ 27.8 0.723 0.048 0.6/ 0.886 348 36.3 254/ 511 (mm) Wrapping Factor (Insertionstiefe/laterale Wandlänge) Insertionswinkel 44 5. Ergebnisse: Tabelle 4 zeigt die gemessenen Daten für den Elektrodenträger, die laterale Wand und den Insertionswinkel, ebenso wie den berechneten Wrapping Factor (WF; Holden et al. 2013). Er liegt durchschnittlich bei 0.723, mit einem Maximum bei 0.886 und einem Minimum bei 0.6. Wird der WF nur für Scala tympani Insertionen berechnet liegt er bei durchschnittlich 0.717, bei gleichem Maximum und Minimum. Bei Berechnung des WF nur für Scala vestibuli Insertionen liegt er durchschnittlich bei 0.738, mit einem Maximum von 0.86 und Minimum von 0.61. Der WF ist definiert als Quotient der linearen Insertionstiefe zur entsprechenden lateralen Wandlänge und soll dazu dienen darzustellen, wie nahe der Elektrodenträger am Modiolus liegt. Desto eher der WF sich also dem Wert 1.0 nähert, desto näher liegt der Elektrodenträger an der lateralen Wand und desto weiter entfernt ist er vom Modiolus. 5.5. Vergleich der Größe und der Elektrodenträgervermessung: Darstellung 29: Wrapping Factor versus Produkt der Distanzen A*B (cochleäre Fläche). 45 5. Ergebnisse: Bei Gegenüberstellung des WF mit dem Produkt der Distanzen A und B, ersichtlich in Darstellung 29, wurde eine geringe abnehmende lineare Korrelation gefunden (Pearson's Korrelation: r² = -0.15879) mit statistischer Signifikanz (p = 0.002249). Auch Darstellung 30 zeigt eine gering abnehmende Korrelation (p = 0.03438, r² = -0.11032) zwischen dem WF und dem Umfang der cochleären Ellipse, welche mit der Annäherungsformel nach Ramanujan berechnet wurde. Zusammenfassend kann vermutet werden, dass mit zunehmender Größe bzw. zunehmendem Umfang der Cochlea der Elektrodenträger dazu neigt näher am Modiolus zu liegen und somit einen abnehmenden WF aufzuweisen. Für diese Vermutung konnte aber wie oben beschrieben nur eine geringe statistische Korrelation gefunden werden. Darstellung 30: Wrapping Factor versus Umfang der cochleären Ellipse. 46 5. Ergebnisse: Darstellung 31 zeigt eine Gegenüberstellung des Insertionswinkels mit der cochleären Fläche in Form des Produktes von A*B. Hier zeigt sich eine geringe abnehmende lineare Korrelation (r²= -0.20188, p = 0.00009629) zwischen cochleärer Größe und dem Insertionswinkel des Elektrodenträgers. Folglich kann vermutet werden, dass der Insertionswinkel mit zunehmender cochleärer Größe abnimmt. Darstellung 31: Insertionswinkel versus Produkt der Distanzen A*B (cochleäre Fläche). 5.6. Vergleich der cochleären Größe und der Elektrodenlage: Weiterhin verglich diese Arbeit ihre gemessenen Ergebnisse mit der Lage des Elektrodenträgers innerhalb der Skalen (Darstellung 32). Dabei wurden die gewünschte Position der Scala tympani (T), die Scala vestibuli (V), dislozierte Elektrodenträger der Scala tympani (TD) und der Scala vestibuli (VD) unterschieden. 47 5. Ergebnisse: Elektrodenträger innerhalb der Scala tympani schienen häufiger in kleinen Cochleae zu dislozieren. Für diese Annahme wurde jedoch für die Distanz A keine statistische Signifikanz errechnet (p > 0.05). Der Elektrodenträger dislozierte häufiger aus der Scala tympani heraus bei Cochleae mit kleiner Distanz B (T-TD: p = 0.0039, ANOVA, posthoc) und kleiner Höhe b (TTD: p = 0.0096, ANOVA, posthoc), jeweils mit statistischer Signifikanz. Es kann daraus gefolgert werden, dass eine kleinere Distanz B und eine kleinere Höhe b eher mit der Dislokation des Elektrodenträgers aus der Scala tympani heraus assoziiert sind. 90 Produkt 80 70 60 50 T TD V VD Elektrodenlage Darstellung 32: Boxplot des Produktes A*B mit der Elektrodenlage innerhalb der Skalen. Die Cochleae, welche einen Scala vestibuli inserierten Elektrodenträger aufwiesen, zeigten eine kleinere Höhe a (3.9 mm für T versus 3.7 für V) verglichen mit den Scala tympani Insertionen. Hier wurde sowohl für Höhe a (p = 0.00013, ANOVA, posthoc) als auch für Höhe b (p = 0.00148, ANOVA, posthoc) ein statistisch signifikanter Unterschied errechnet, sodass gefolgert werden kann, dass Elektrodenträger bei Verwendung einer Cochleostomie eher in die Scala vestibuli inseriert werden bei Cochleae mit kleineren Höhen. 48 5. Ergebnisse: 5.7. Vergleich des Wrapping Factors und der Elektrodenlage: 0.9 WrappingFactor 0.8 0.7 0.6 T TD V VD Elektrodenlage Darstellung 33: Boxplot von Wrapping Factor versus Elektrodenlage. Weiterhin untersuchte diese Arbeit den Zusammenhang der Elektrodenlage mit dem Wrapping Factor (Holden et al. 2013). Je eher ein Elektrodenträger disloziert war, desto näher befand sich der Wrapping Factor am Wert 1.0, sprich desto näher lag der Elektrodenträger an der lateralen Wand und desto weiter entfernt vom Modiolus. Das Risiko, dass der Elektrodenträger lateral zu liegen kommt, ist folglich umso höher, desto eher er bei Insertion disloziert, was plausibel ist. Entsprechend weist ein dislozierter Elektrodenträger durch die lamina spiralis einen größeren WF auf. Da die meisten Elektrodenträger an spezifischen Stellen innerhalb der Cochlea wie der cochleären Basalwindung (Verbist et al. 2009; Hüttenbrink et al. 2002; O`Leary et al. 1991) oder bei annähernd 180 Grad Insertionswinkel (Verbist et al. 2009; Tykocinski et al. 2001) dislozieren und die Basilarmembran dort nicht exakt mittig verläuft, ist eine Dislokation und eine Penetration der Basilarmembran genau dann am wahrscheinlichsten, wenn sich die Cochlea windet, was bei der Basalwindung erstmals der Fall ist (Verbist et al. 2009). 49 5. Ergebnisse: Je näher nun also der Elektrodenträger am Modiolus liegt, desto mehr Spielraum hat er innerhalb dieser Windung nicht allzu sehr zu lateralisieren und desto geringer ist das Risiko der Dislokation, was mit einem entsprechend kleineren WF assoziiert ist. Besonders bei den Scala tympani Insertionen war dies statistisch signifikant deutlich verglichen mit den Scala tympani Dislokationen (post hoc analysis: p = 0.04927). Zusätzlich wurde ein statistisch signifikanter Unterschied zwischen Scala tympani und vestibuli Insertionen gefunden (post hoc analysis: p = 0.03243), woraus zu folgern ist, dass Scala vestibuli Insertionen mit einem höheren WF und folglich einer zentrifugalen Elektrodenlage assoziiert sind. 50 6. Diskussion: 6. Diskussion: 6.1. Diskussion der Messungen und Ergebnisse: 6.1.1. Cochleäre Größe: Eines der Ziele dieser Arbeit war es die Variabilität der cochleären Größe zu untersuchen. Es wurden DVT- Bilder von 368 Ohren analysiert um eine adäquate Datenmenge zu erhalten. Die von Escudé et al. (2006) etablierten Distanzen A von dem runden Fenster durch den Modiolus zur lateralen Wand und die orthogonale Distanz B durch den Modiolus wurden gemessen. Distanz A wies einen Mittelwert bei 9.95 mm auf, während Distanz B bei 6.54 mm lag. Die erhaltene Datenmenge über die cochleäre Größe wurde mit den berichteten Werten von Escudé et al. (2006) und van der Marel et al. (2013) verglichen. Wie auch in dieser Arbeit schloss Escudé cochleäre Malformationen und andere Auffälligkeiten von seiner Analyse aus und untersuchte 42 Patienten bilateral und legte dar, dass die basale Windung der Cochlea in ihrer Größe variabel zu sein scheint. Escudé berichtete von einer gemessenen Distanz A mit einem Mittelwert von 9.23 mm und einer senkrecht dazu verlaufenden Distanz B von 6.99 mm (Escudé et al. 2006). Diese durchschnittlichen Durchmesser weichen nur gering von den in dieser Arbeit gemessenen Werten ab. Weiterhin beschrieben Escudé et al. (2006) eine statistisch signifikant zunehmende Korrelation zwischen den Distanzen A und B (r²=0.57, p < 0,001). In dieser Arbeit wurde ebenfalls eine statistisch signifikante Korrelation zwischen Distanz A und Distanz B gefunden (r² = 0.5, p <= 0.0001) sowie eine signifikante Korrelation zwischen Distanz A und dem Quotienten A/B (r² = 0.326, p <= 0.0001). Die von Escudé vorgeschlagenen Messungen wurden von van der Marel et al. (2013) aufgegriffen und erweitert. Van der Marel schlug 8 Radien vor, welche die Cochlea ebenfalls zweidimensional vermessen sollten. Radius 1 und 5 entsprachen dabei Distanz A nach Escudé und kamen auf einen Mittelwert von 8.85 mm, während Radius 3 und 7 Distanz B entsprachen und einen Mittelwert von 6.58 mm aufwiesen (van der Marel et al. 2013). Im Gegensatz zu dieser Studie, welche nur Cochleostomie versorgte Ohren berücksichtigte, inkludierte van der Marel nur Patienten, welche mit einem erweiterten Rundfensterzugang versorgt wurden, sodass auch ein anderer Elektrodentyp inseriert wurde (Advanced Bionics™, HiFocus1© oder HiRes90K mit HiFocus1J©Elektrode) (van der Marel et al. 2013). Die in dieser Arbeit gemessene Distanz A war größer als die von van der Marel et al. (2013) und auch etwas größer als die von Escudé et al. (2006) berichtete Distanz A. 51 6. Diskussion: Distanz B dieser Arbeit lag sehr nahe an der von van der Marel et al. (2013) gemessenen Distanz B, war jedoch kleiner als von Escudé et al. (2006) angegeben. Mit den Distanzen A und B wurde nun der Quotient A / B gebildet und betrug in dieser Arbeit 1.53, was größer ist, als der Quotient von 1.32, welcher von Escudé et al. (2006) berechnet wurde. Weiterhin wurde erstmals in dieser Arbeit auch das Produkt der Distanzen A*B mit einem Mittelwert von 65.2 mm² gebildet, um ein zweites Maß für die cochleäre Größe und Ausdehnung in der Ebene der Basalwindung zu erhalten. Die Tabelle 4 liefert einen Vergleich der gemessenen cochleären Größen in dieser Studie, bei Escudé et al. (2006), van der Marel et al. (2013) und Ketten et al. (1998). Tabelle 5. Überblick verschiedener Studien zu den Distanzen A und B und der cochleären Höhe: Cochleäre Ergebnisse Ketten et al. Escudé et al. Van der Marel Größe dieser Studie (1998) (2006) et al. (2013) Distanz A 9.95 mm 7.91 mm 9.23 mm 8.85 mm (SD 0.59) (SD 0.53) (SD 0.53) (SD 0.45) 6.54 mm Nicht 6.99 mm 6.58 mm (SD 0.48) gemessen (SD 0.37) (SD 0.40) 1.53 Nicht zu 1.32 1.35 (SD 0.11) berechnen (SD nicht (SD nicht angegeben) angegeben) Distanz B Quotient A / B Würfel et al. (2014) etablierten neben Escudé und van der Marel eine zweite Methode die cochleäre Größe präoperativ zu evaluieren. Sie definierten die cochleäre Länge als die Route vom lateralsten Punkt des runden Fensters entlang der lateralen Wand bis hin zum Helicotrema und berichteten über eine durchschnittliche cochleäre Länge von 37.6 mm (SD 1.93 mm) (Würfel et al. 2014). Es wurden 218 Patienten bilateral untersucht und somit wurde die cochleäre Länge von 436 Felsenbeinen gemessen (Würfel et al. 2014). Dennoch sind die eingeschlossenen Patienten in der hier vorgestellten Studie repräsentativer, da Würfel et al. zwar 218 Patienten vermessen hatten, jedoch alle bilateral betrachtet wurden (Würfel et al. 2014), sodass interindividuelle Differenzen weniger Berücksichtigung fanden, als in dieser Arbeit, welche 278 Patienten unilateral und 46 Patienten bilateral berücksichtigte. 52 6. Diskussion: Somit ist die Varianz bei Würfel et al. (2014) als eingeschränkt zu beurteilen, da zahlreiche Studien zeigten, dass intraindividuell keine statistisch signifikanten Unterschiede zwischen linker und rechter Seite bestehen (Hochmair et al. 2003; Lenarz et al. 2006; Escudé et al. 2006; van der Marel et al. 2013; Würfel et al. 2014). Es ist zu bezweifeln, dass die cochleäre Größe lediglich anhand eines einzelnen Messwertes nämlich der cochleären Länge beschrieben werden kann, da dabei vor allem die Variabilität der Steigung innerhalb der basalen Windung keine Berücksichtigung findet, diese aber intraoperativ eine entscheidende Rolle für Insertion und anschließende Elektrodenlage spielt (Verbist et al. 2009; Hüttenbrink et al. 2002; O`Leary et al. 1991). Weiterhin ist die cochleäre Länge (Würfel et al. 2014) als singuläres Maß für die Größe der Cochlea zu hinterfragen, da international keine anatomischen Orientierungspunkte einheitlich festgelegt sind und auch keine Einigung über eine einheitliche Nomenklatur besteht. Bisher wurde die cochleäre Größe meist nur zweidimensional betrachtet. Mit dieser Arbeit wurde ein dritter Parameter eingeführt, nämlich die Höhe der Cochlea. Mit Hilfe einer multiplanaren Rekonstruktion wurde die Ebene von Escudé (2006) um zwei weitere Schnittbilder erweitert. Nun senkrecht auf Escudés Ebene liegend, eignen diese sich, um die Höhe in jeweils zwei unterschiedlichen Schnitten zu messen und anschließend miteinander zu vergleichen. Für Höhe a wurde ein Mittelwert von 3.85 mm gemessen, Höhe b lag bei 3.95 mm. Die gemessenen Höhen dienten auch als Gütekriterium für die Messgenauigkeit. Der Pearson Korrelationskoeffizient zeigte eine statistisch streng signifikante, lineare Korrelation zwischen Höhe a und b an (r² = 0.807, p <= 0.0001), was unterstreicht, dass mit äußerster Sorgfalt gemessen wurde. Höhe a lag in dieser Studie minimal bei 3.0 und maximal bei 5.1 mm, während die Messbreite der Höhe b bei 3.1 und 5.1 mm lag. Ketten et al. (1998) ermittelten bei 20 Patienten, welche mit einem Nucleus Cochlear Implant System © versorgt wurden, eine Höhe, welche im Mittelwert 2.75 mm (SD 0.52) ausmachte. Die Messbreite der Höhe bei Ketten et al. (1998) lag dabei jedoch zwischen 1.93 und 4.0 mm. Die Diskrepanz der gefundenen durchschnittlichen Höhen in dieser Arbeit zur ermittelten Höhe bei Ketten et al. (1998) lässt sich zum einen durch das kleine Patientenkollektiv von nur 20 Cochleae bei Ketten et al. erklären, zum anderen ist die Messgenauigkeit durch die hier verwendete digitale Volumentomographie als deutlich höher anzusehen (Aschendorff 2011; Aschendorff et al. 2005). 53 6. Diskussion: Zusammenfassend kann die Aussage getroffen werden, dass die cochleäre Form und Größe variabel ist und die gemessenen Daten dieser Studie weitestgehend mit den angegebenen Werten von Escudé (2006) und van der Marel (2013) übereinstimmen. Diese Arbeit baute die Erkenntnisse der beiden noch um einen dritten Messwert, die Höhe, aus, um die Gehörschnecke dreidimensional in allen drei Ebenen erfassen zu können. 6.1.2. Geschlechtsspezifische Unterschiede der Cochlea: Weiterhin wurden die gemessenen Daten zur cochleären Größe nicht nur mit anderen Studien verglichen, sondern auch untereinander. Besonders der morphologische Unterschied zwischen männlichen und weiblichen Cochleae sollte untersucht werden, wie in Tabelle 3 dargestellt. Es wurde ein statistisch signifikanter Unterschied für Distanz A gefunden (p < 0.05), jedoch weder für Distanz B (p > 0.05) noch für Höhe a oder b. In dieser Studie war die Distanz A bei männlichen Cochleae um 1.99 % größer, also um absolut betrachtet 0.2 mm länger. Weiterhin wurde ein statistisch signifikanter Unterschied für das Produkt der Distanzen A*B gefunden (p < 0.05), woraus folgt, dass männliche Cochleae in ihrer Fläche um 2.87 % größer sind, absolut betrachtet um 1.9 mm². Hervorzuheben ist jedoch, dass die Messbreite der Werte zwischen männlichen und weiblichen Cochleae für Distanz A dennoch relativ gering war (Mittelwert 10.05 versus 9.86), für Distanz B nur marginal ersichtlich (Mittelwert 6.57 versus 6.52). Escudé et al. (2006) berichten von einem statistisch signifikanten Unterschied zwischen männlichen und weiblichen Cochleae für Distanz A (Mittelwert 9.43 versus 9.05), aber im Gegensatz zu den Erkenntnissen dieser Arbeit auch für Distanz B (Mittelwert 7.15 versus 6.86). Hervorzuheben ist aus den Resultaten beider Studien, dass zwar geschlechterspezifische Größenunterschiede vorhanden sind, jedoch nur in relativ geringem Umfang die weibliche Cochlea kleiner zu sein scheint. Würfel et al. (2014) beschrieben die Messung der cochleären Länge vom runden Fenster entlang der lateralen Wand bis hin zum Helicotrema und fanden einen statistisch signifikanten Längenunterschied zwischen männlichen und weiblichen Cochleae (p < 0.05), wobei sich weibliche Cochleae als kürzer herausstellten. Van der Marel et al. (2013) berichten ebenfalls einen Größenvorteil zugunsten männlicher Cochleae gefunden zu haben, was wir mit den gefundenen Daten dieser Arbeit unterstreichen können. Doch während van der Marel (2013) von einem 4 prozentigen Größenunterschied sprechen, wurde in dieser Arbeit lediglich ein Längenunterschied der Distanz A um 1.99 % und ein Flächenunterschied des Produktes A*B um 2.87 % zugunsten der männlichen Cochleae festgestellt. 54 6. Diskussion: Wie von Escudé (Escudé et al. 2006) und van der Marel (van der Marel et al. 2013) berichtet, wurde auch in dieser Arbeit kein signifikanter Unterschied im Quotienten A/B gefunden (1.54 versus 1.52), sodass von keinem grundsätzlichen Unterschied der cochleären Form zwischen weiblichen und männlichen Cochleae ausgegangen werden kann. 6.1.3. Elektrodenlage: Von der cochleären Form und Größe abgesehen, scheint auch die Elektrodenlage einen definierenden Einfluss auf das Outcome nach Cochlea Implantation zu haben (Aschendorff et al. 2007; Finley et al. 2008). In dieser Arbeit wurde nicht nur die Cochlea vermessen, sondern postoperativ auch der Elektrodenträger selbst. Zum einen wurden die Insertionstiefe und die entsprechende Länge der lateralen Wand gemessen, um den von Holden et al. (2013) beschriebenen Wrapping Factor (WF) zu bilden, zum anderen auch der Insertionswinkel. Für die Insertionstiefe der vermessenen Elektrodenträger ergab sich eine Messbreite zwischen 14.1 und 21.4 mm mit einem errechneten Mittelwert von 16.6 mm. Die entsprechend vermessene laterale Wandlänge, gemessen vom runden Fenster entlang der lateralen Wand bis auf Höhe des apikalen Elektrodenartefakts, ergab ein Mittelwert bei 23.0 mm mit einer Spanne zwischen 18.4 und 27.8 mm. Aus dem Quotienten von Insertionstiefe und lateraler Wandlänge erhielt man den WF (Holden et al. 2013), welcher bei Betrachtung der Contour Advance Elektrode von Cochlear™ bei dieser Arbeit einen Mittelwert von 0.723 mit einem Minimum bei 0.6 und einem Maximum bei 0.886 ergab. Bei Gegenüberstellung des WF sowohl mit dem Produkt der Distanzen A und B (Darstellung 29 (Pearson's correlation: r² = -0.15879)), als auch mit dem Umfang der cochleären Ellipse (Darstellung 30 (r² = -0.11032)) wird eine abnehmende jedoch nur geringe Korrelation ersichtlich. Es kann folglich angenommen werden, dass mit zunehmender Größe und damit verbunden zunehmendem Umfang der Cochlea, der Elektrodenträger dazu neigt näher am Modiolus zu liegen. Für diesen Zusammenhang zwischen zunehmender cochleärer Größe und abnehmendem WF wurde jedoch nur eine geringe statistische Korrelation gefunden (r² < 0.16). Holden et al. (2013) unterteilten die betrachteten Patienten in ihrer Arbeit in drei Gruppen. Je nach WF wurde zwischen einem eng und einem locker gewundenen Elektrodenträger, sowie einem tief inserierten Elektrodenträger unterschieden (Holden et al. 2013). Für den WF der auch in dieser Studie untersuchten Contour Advance Elektrode beschrieben sie eine Spanne von 0.53 bis 0.74 (Holden et al. 2013), was sich von den in dieser Arbeit ermittelten Werten deutlich unterscheidet. 55 6. Diskussion: Die Messbreite des WF bei Holden ist insgesamt deutlich kleiner und vor allem das Maximum deutlich unter dem gefundenen Maximum in dieser Arbeit (Holden WFmax: 0.74 versus Ketterer WFmax: 0.886) (Holden et al. 2013). Zum einen inkludierten Holden et al. (2013) nur 63 Cochleae mit einer vergleichbaren Contour Advance Elektrode, während in dieser Arbeit 368 Ohren mit diesem Elektrodentyp verglichen wurden. Weiterhin wurde der WF von Holden nur für die Scala tympani Insertionen berechnet (Holden et al. 2013), was bedeutet, dass dislozierte Elektrodenträger und Scala vestibuli Insertionen nicht in die WF Berechnung mit einflossen. Da in dieser Arbeit Elektrodenträger aller Lagen in die Berechnung des WF einbezogen wurden, ist bei genauerer Überlegung logisch, dass der errechnete Quotient größer sein muss. Da die Scala vestibuli weiter zentrifugal liegt als die Scala tympani, nähert sich der WF zunehmend dem Wert 1.0 an, wenn auch Scala vestibuli Insertionen berücksichtigt werden. Bei bloßer Betrachtung der Scala tympani Insertionen wurde in dieser Arbeit ein durchschnittlicher WF von 0.717 errechnet, wobei der WFmax weiterhin bei 0.886 und der WF min bei 0.6 liegt. Der Unterschied in der Spanne der Messwerte des WF für reine Scala tympaniInsertionen im Vergleich zu Holden et al. (2013) ist durch die hier einbezogenen 250 Cochleae versus 63 bei Holden et al. (2013) zu erklären. Wird der berechnete WF für reine Scala tympani Insertionen (Durchschnitt: 0.717) dem für reine Scala vestibuli Insertionen (Durchschnitt: 0.738) in dieser Arbeit gegenübergestellt, zeigt sich, dass Scala vestibuli Insertionen einen größeren WF aufweisen, was mit der zentrifugalen Lage der Scala vestibuli zu erklären ist. Nicht nur der WF und die Insertionstiefe geben Einblick in die genaue Lage des Elektrodenträgers, sondern auch der Insertionswinkel. In dieser Arbeit wies der Insertionswinkel eine recht große Spannweite zwischen 254 und 511 Grad auf, mit einem durchschnittlichen Mittelwert bei 348 Grad. Bei Gegenüberstellung der cochleären Größe (Produkt A*B) und des Insertionswinkels wurde ein statistisch signifikanter Zusammenhang (p < 0.05) gefunden, wenn auch nur mit geringer linear abnehmender Korrelation (r²= -0.20188). Diese Erkenntnis führt zur Vermutung, dass der Insertionswinkel mit zunehmender cochleärer Größe abnimmt. Escudé et al. (2006) unterteilten 15 mit einer Contour Advance Elektrode implantierte Ohren in 2 Gruppen und unterschieden dabei die Insertionstiefe (17 versus 19 mm). Es wurde dabei eine Spannweite des Insertionswinkels zwischen 330 und 495 Grad gemessen und gezeigt, dass zwischen der 17 und der 19 mm Insertionstiefe ein statistisch signifikanter Unterschied des Insertionswinkels von circa 80 Grad liegt (Escudé et al. 2006). Somit zeigte Escudé in seiner Arbeit, dass der Insertionswinkel negativ mit der Insertionstiefe des Elektrodenträgers korreliert (Escudé et al. 2006). 56 6. Diskussion: Trieger et al. (2010) verglichen sieben Ohren, welche mit einer vergleichbaren Contour Advance Elektrode versorgt wurden und fanden einen mittleren Insertionswinkel von 469 Grad mit Messwerten von 374 bis 537 Grad und einem statistisch signifikanten Unterschied zwischen männlichen und weiblichen Cochleae (Trieger et al. 2010). Van der Marel et al. (2013) dagegen berichten von einem mittleren Insertionswinkel von 480 Grad, was auch damit zusammenhängen mag, dass keine Contour Advance Elektrode sondern ein anderer Elektrodenträger von Advanced Bionics™ vermessen wurde. Weiterhin stellten van der Marel et al. (2013) den Insertionswinkel für unterschiedliche cochleäre Größen dar um deren Beziehung untereinander darzustellen. Es wurde ein statistisch signifikanter Unterschied zwischen kleinen und großen Cochleae gefunden (p < 0.05) und festgestellt, dass große Cochleae 68 Grad an Insertionswinkel weniger aufweisen (van der Marel et al. 2013). Zusammenfassend zeigen die Studien von Escudé (2006), van der Marel (2013) und Trieger (2010) ähnliche Resultate wie diese Arbeit und führen zu der Schlussfolgerung, dass der Insertionswinkel von der cochleären Größe abhängt und mit zunehmender Größe abnimmt. Die Spannweite der in dieser Arbeit gemessenen Insertionswinkel zwischen 254° und 511° scheint doch sehr groß zu sein, besonders angesichts der Tatsache, dass nur vergleichbare Elektrodenträger gleicher Länge miteinander verglichen wurden. Es stellt sich also durchaus die Frage inwiefern der Insertionswinkel von der cochleären Größe überhaupt abhängig ist. Betrachtet man eine durchschnittliche Insertionslänge des Elektrodenträgers von 17.8mm (Angabe: Cochlear™) und berechnet über die Distanzen A und B mithilfe der Näherungsformel nach Ramanujan den elliptischen Umfang der Cochlea, lässt sich eine Insertionstiefe in mm pro Grad Insertionswinkel berechnen (16.4°/mm für die kleinste gemessene versus 11.8°/mm für die größte gemessene Cochlea). Multipliziert man nun diesen Quotienten mit der durchschnittlichen Insertionslänge von 17.8mm lässt sich der Insertionswinkel für die kleinste (291.9°) und die größte Cochlea (210.9°) errechnen. Somit wäre für die hier gemessene kleinste und größte Cochlea eine Spannweite des Insertionswinkels in reiner Abhängigkeit von der cochleären Morphologie von 81° möglich. Die tatsächliche Spannweite zwischen 254° und 511° muss jedoch auf eine andere Weise betrachtet werden, da perimodiolar liegende Elektrodenträger nicht entlang der Außenwand und dem somit errechenbaren Umfang der Cochlea liegen und mit zentripetalem Verlauf automatisch höhere Insertionswinkel aufweisen. Die mögliche Spannweite der Insertionswinkel, die entlang des errechenbaren Umfangs (siehe oben) liegen, lässt sich durch Extrapolieren über den WF nach Holden et al. (2013) errechnen. 57 6. Diskussion: Die Cochlea mit dem kleinsten Insertionswinkel wies einen WF von 0.7663 auf. Somit würde sie einen Insertionswinkel entlang der Außenwand von 194.6° aufweisen, entsprechend die Cochlea mit dem größten Winkel 391°. Die extrapolierte Spannweite liegt folglich bei 196.4°. Da die errechnete Spannweite des möglichen Insertionswinkels bei 81° liegt, die tatsächliche jedoch bei 196.4°, liegt die Schlussfolgerung nahe, dass rund 115° des Insertionswinkels, also circa 59% von anderen Faktoren als der cochleären Größe wie der Insertionstechnik, dem Chirurgen, der innerskalären Lage etc. abhängen. Bestätigt wird dieser Gedanke durch die Gegenüberstellung des Insertionswinkels mit der cochleären Fläche in Form des Produktes von A*B. Hier zeigt sich eine geringe abnehmende lineare Korrelation (r²= -0.20188, p = 0.00009629) zwischen cochleärer Größe und dem Insertionswinkel des Elektrodenträgers. 6.1.4. Skaläre Lage des Elektrodenträgers: Die Größe und Form der Cochlea scheint auch Einfluss darauf zu nehmen, welche Position der Elektrodenträger innerhalb der Cochlea einnimmt und ob er eventuell sogar disloziert. Diese Arbeit ist die erste ihrer Art, welche untersucht inwiefern die Position des Elektrodenträgers innerhalb der cochleären Skalen mit der Größe der Gehörschnecke und der Nähe zur Außenwand in Form des WF nach Holden et al. (2013) zusammenhängt. Die Ergebnisse führen zu der Vermutung, dass der Elektrodenträger innerhalb der Scala tympani in kleineren Cochleae eher disloziert, jedoch ohne gefundene statistische Signifikanz (p > 0.05). Außerdem zeigen die Ergebnisse dieser Arbeit, dass der Elektrodenträger mit abnehmender Distanz B und abnehmender Höhe eher zur Dislokation neigt, wobei Distanz A nicht mit einer skalären Dislokation assoziiert zu sein scheint. Cochleae mit Scala vestibuli Insertionen wiesen eine kleinere Höhe a im Vergleich zu Scala tympani Insertionen auf, wobei ein statistisch signifikanter Unterschied gefunden wurde (t- Test: p = 0.00013). Zusammenfassend kann die Aussage getroffen werden, dass die in dieser Arbeit etablierte Höhe der Cochlea als neuer präoperativer Faktor gesehen werden kann, um die cochleäre Größe vor Insertion des Elektrodenträgers zu erfassen und so das Risiko einer Dislokation oder einer Scala vestibuli Insertion besser einschätzen zu können. Die cochleäre Größe, besonders die Höhe, nimmt folglich Einfluss auf die Dislokationswahrscheinlichkeit und die finale Position des Elektrodenträgers. Dies erscheint auch einleuchtend angesichts der Tatsache, dass mit zunehmender Höhe der gesamten Cochlea der skaläre Verlauf zwar steiler aber insgesamt auch weitläufiger ist, da auch die Skalen selbst bei größeren Cochleae größer sind und somit das Dislokationsrisiko geringer ist. 58 6. Diskussion: Weiterhin wurde das Verhältnis zwischen der Elektrodenposition und dem WF nach Holden et al. (2013) untersucht und somit die Frage ob dislozierte Elektrodenträger auch modiolusfern zum Liegen kommen. Die Ergebnisse dieser Arbeit zeigen, dass dislozierte Elektrodenträger eher zentrifugal und modiolusfern liegen und dementsprechend einen höheren WF aufweisen. Hierbei wurde ein statistisch signifikanter Unterschied sowohl zwischen Scala tympani Insertionen und tympani Dislokationen (p < 0.05) als auch zwischen Scala tympani und vestibuli Insertionen (p < 0.05) gefunden. Hieraus lässt sich folgern, dass ein Elektrodenträger, der eine Dislokation oder Scala vestibuli Insertion aufweist, eher zentrifugal liegt und einen höheren WF aufweist. 6.1.5. Exkurs: Der neue „Slim Straight“ – Elektrodenträger und die Diskussion des Zugangsweges: Darstellung 34: Veranschaulichung der Lage des Außenwand- Elektrodenträgers („Slim Straight“) versus eines perimodiolaren „Slim“- Elektrodenträgers in Entwicklung (von Wallenberg, E., Briggs, R. (2014)). Die derzeitige Diskussion um individuell ausgewählte Elektrodenträger brachte auch einen neuen, weitaus schlankeren Elektrodenträger auf den Markt, welcher besonders bei erwünschtem Restgehörerhalt in Frage kommt. Eine atraumatische Insertion des Elektrodenträgers ist nämlich Voraussetzung für den perioperativen intracochleären Strukturund somit auch Restgehörerhalt (Kiefer et al. 2004). 59 6. Diskussion: Sowohl perimodiolare als auch Außenwand- Elektrodenträger weisen ihre Vor- und Nachteile bei der Insertion, wie auch dem Risiko der Dislokation und Strukturdestruktion auf (Rebscher et al. 2008; Hassepass et al. 2015). Auf Grundlage der Annahme, dass ein deutlich schmalerer Elektrodenträger eine feinere Insertion und somit geringere Destruktions- und Dislokationsrate aufweisen müsste, wurde in den letzten Monaten ein neuer Elektrodenträger von der Firma Cochlear™ auf den Markt gebracht. Die sogenannte „Slim Straight“ Elektrode ist als Außenwand- Elektrodenträger mit besonders geringem Durchmesser entwickelt worden. So weist dieser Elektrodenträger einen Durchmesser von basal 0.6mm und apikal 0.35mm auf (von Wallenberg et al. 2014). Im Vergleich hat ein Nucleus Contour Advance Elektrodenträger beispielsweise einen basalen Durchmesser von 0.8mm und misst apikal circa 0.5mm (Angaben Firma Cochlear™). Darstellung 35: Veranschaulichung eines Nucleus Contour Advance Elektrodenträgers mit einer durchschnittlichen Insertionslänge von 17.8mm (bis zu den sogenannten „Ribs“ (3). (Quelle: Cochlear™). (1) Versteifung für Insertion im Rahmen der Advance-off stylet- (AOS) Technik (2) Griff für den Chirurgen bei Insertion (3) Ringe (Ribs), welche die Insertionstiefe markieren (4) Basaler Durchmesser von 0.8mm (5) Markierung für AOS- Technik zwischen Elektrode 10 und 11 (6) Vorgeformter, perimodiolarer Elektrodenträger (7) 22 Platinum Elektroden auf 15mm Länger verteilt (8) Apikaler Durchmesser von 0.5mm (9) Softtip aus Silikon, um Insertionstraumata zu reduzieren 60 6. Diskussion: Dieser besonders schmale und deutlich flexiblere Elektrodenträger soll sich den individuellen Bedingungen der Cochlea noch besser anpassen. Dies führt zu einer verminderten cochleären Strukturdestruktion und besserem Restgehörerhalt zumindest bei Rundfensterinsertion (Skarzynski et al. 2010; Skarzynski et al. 2012; Lenarz et al. 2013). Doch auch bei Insertion via Cochleostomie, welche je nach anatomischer Lage (besonders bei schmalen Durchmessern) des runden Fensters notwendig ist, zeigen sich ähnliche Ergebnisse (Hassepass et al. 2015), sodass keiner der Zugangswege generell zu präferieren ist. Der entscheidende Parameter des „Slim Straight“ Elektrodenträger ist der geringere Durchmesser, wobei Friedmann et al. 2015 zeigten, dass auch bei diesem Elektrodenträger die Länge und somit die Insertionstiefe eine entscheidende Rolle spielen. Während kürzere Elektrodenträger zu verbessertem Restgehörerhalt führen, zeigen Patienten mit längeren ein signifikant besseres Sprachverständnis (Friedmann et al. 2015). Inwiefern präoperative Parameter wie die cochleäre Morphologie Einfluss auf die individuell angepasste Wahl des Elektrodenträgers bezüglich Länge und Durchmesser nehmen können, bleibt zu zeigen. Weiterhin wird sich zeigen, ob die besonders schlanken „Slim Straight“ Elektrodenträger eine Ergänzung zum verbesserten Restgehörerhalt oder eine Ablösung der bisherigen Elektrodenträger darstellen. 6.2. Weitergehende Diskussion der Ergebnisse und Forschungslage: Die Idee eines an die Cochlea individuell angepassten Elektrodenträgers ist keine akademische Spielerei, sondern eine Möglichkeit auch das individuelle Outcome im Sprachverstehen zu verbessern, da Insertionstraumata vermindert und Restgehörerhalt verbessert werden könnten. Denn selbst bei Optimieren der chirurgischen Insertion, des Programmierens und der Rehabilitation sind wesentliche Unterschiede im Sprachverstehen festgestellt worden (Heydebrand et al. 2007; Finley et al. 2008; Gifford et al. 2008; Lazard et al. 2012). Zahlreiche Studien identifizierten weitere Einflussfaktoren des postoperativen Sprachverstehens abgesehen von der in dieser Arbeit untersuchten Elektrodenlage und cochleären Größe. 6.2.1. Der Einfluss der Elektrodenlage auf das Sprachverstehen: Die Position der Elektrode innerhalb der Cochlea scheint deutlichen Einfluss auf das Sprachverstehen zu nehmen und wurde von Aschendorff et al. (2007) durch die Verwendung von digitaler Volumentomographie untersucht. 61 6. Diskussion: Die Elektroden wurden in verschiedene Gruppen ihrer Lage entsprechend unterteilt und wie in dieser Arbeit betitelt (Aschendorff et al. 2007). Es wurde zwischen einem Scala tympani- (ST), einem Scala vestibuli- (SV) und einem Dislokations- Elektrodenträger unterschieden (Aschendorff et al. 2007). Zum einen wurde gezeigt, dass Contour Elektrodenträger häufiger dislozierten oder in der Scala vestibuli zu liegen kamen als Contour Advance Elektrodenträger, zum anderen zeigten die Patienten mit einer eindeutigen Scala tympani Insertion die mit Abstand am besten Ergebnisse im Sprachverstehen (Aschendorff et al. 2007). Auch Skinner et al. (2007), Finley et al. (2008) und Holden et al. (2013) fanden eine negative Korrelation zwischen der Anzahl der Elektroden, welche sich in der Scala vestibuli befanden und dem postoperativen Sprachverstehen. Wanna et al. (2011) dagegen berichten von keinem gefundenen statistischen Zusammenhang zwischen postoperativer einsilbiger Worterkennung und der Elektrodenlage, haben jedoch auch nur 16 Patienten bilateral untersucht, wodurch die Übertragbarkeit der Studie zu hinterfragen ist. Zusammenfassend kann die Korrelation der Elektrodenlage innerhalb der Scala tympani mit einem besseren postoperativen Hörverstehen nahe gelegt werden und ist aufgrund der somit größeren Nähe zu den Zellen des Spiralganglions auch einleuchtend. Da eine in der Scala vestibuli liegende Elektrode unter Umständen größere Areale des Ganglion spirale stimulieren könnte, als eine in der Scala tympani liegende, kommt es bei SV inserierten Elektroden häufiger zu Überlagerungen und in der Folge potentiell zu vermindertem Sprachverstehen (Finley et al. 2008; Holden et al. 2013). Zusätzlich kann eine in die Scala vestibuli inserierte Elektrode und vor allem eine von der Scala tympani in die Scala vestibuli inserierte Elektrode zu Schäden an cochleären Strukturen wie der Reissner-, der Basilarmembran oder der Lamina spiralis führen (Skinner et al. 2007; Holden et al. 2013). Tierstudien (Leake et al. 1999) zeigten, dass mit dem Schaden cochleärer Strukturen ein Zelluntergang im Ganglion spirale verbunden ist, was folglich auch zu verschlechtertem Sprachverstehen in diesen Abschnitten der Cochlea führen müsste (Holden et al. 2013), von post mortem Studien (Khan et al. 2005; Fayad and Linthicum 2006) jedoch nicht bestätigt werden konnte. Wobei hier zu erwähnen ist, dass diese post mortem Studien zum einen eine sehr geringe Fallzahl (Khan et al. 2005: n = 15 / Fayad and Linthicum 2006: n = 14) und zum anderen viele Ossifikationen und Scala vestibuli Insertionen aufwiesen, sodass die Vergleichbarkeit sehr zu hinterfragen ist (Khan et al. 2005; Fayad and Linthicum 2006). 62 6. Diskussion: Die Insertionstiefe wird in zahlreichen Arbeiten als mit dem postoperativen Hörverstehen zusammenhängend beschrieben (Skinner et al. 2002b; Yukawa et al. 2004; Khan et al. 2005; Lee et al. 2010). Skinner et al. (2002b) beschreiben einen wenn auch schwachen aber dennoch statistisch signifikanten positiven Einfluss der Insertionstiefe mit dem Einsilberverstehen, was von Yukawa et al. (2004) bestätigt wurde. Diesen Studien zu Folge wäre das Sprachverstehen also besser, mit zunehmender Insertionstiefe. Dagegen konnten jedoch weder Khan et al. (2005) noch Lee et al. (2010) in ihren jeweiligen post mortem Studien einen statistisch signifikanten Zusammenhang ermitteln (Holden et al. 2013). Im Gegensatz hierzu fanden Finley et al. (2008) jedoch eine negative statistisch signifikante Korrelation, welche die Verschlechterung des Sprachverstehens mit zunehmender Insertionstiefe vermuten ließe und von Holden et al. (2013) bekräftigt wurde. Der auch in dieser Arbeit untersuchte und von Holden et al. (2013) etablierte WF zeigte in gleicher Studie eine negative, signifikante Korrelation mit dem Sprachverstehen. Daraus folgt, dass ein verbessertes Hörverständnis mit einer zunehmend näheren Elektrodenlage am Modiolus vergesellschaftet ist. Erklärt werden könnte dies dadurch, dass die nähere Lage der Elektrode am Ganglion spirale eine spezifischere tonotope Stimulierung ermöglicht und die Elektroden dadurch besser voneinander unterschieden werden könnten (van der Beek et al. 2005; Holden et al. 2013). 6.2.2. Der Einfluss biographischer Faktoren auf das Sprachverstehen: Blamey et al. (1996) untersuchten retrospektiv die Einflussnahme biographischer Faktoren von über 800 Patienten und identifizierten, dass die Dauer der Taubheit eine strenge negative Korrelation mit dem entsprechenden CI Outcome aufweist. Aktuellere Arbeiten bestätigten Blamey et al. (1996) besonders in der negativen Korrelation der Taubheitsdauer mit dem Sprachverstehen (Rubinstein et al. 1999; Friedland et al. 2003; UK Cochlear Implant Study Group 2004; Leung et al. 2005; Holden et al. 2013). Green et al. (2007) untersuchten über 100 Patienten retrospektiv und trafen die Aussage, dass die Taubheitsdauer zu circa 9 Prozent ursächlich am CI Outcome ist. Weiterhin werden das Alter bei Implantation und das Alter bei Taubheitsbeginn von Blamey et al. (1996) als schwächere negative Einflussfaktoren bei Patienten über dem sechzigsten Lebensjahr aufgeführt. Friedland et al. (2010) deklarieren ebenso einen statistisch signifikanten Unterschied im CI Outcome zwischen den nach Alter unterteilten Gruppen und vermuten eine verminderte kognitive Anpassungsfähigkeit der zentralen auditorischen Fähigkeiten als Ursache für die schlechteren Resultate in der Gruppe älterer Patienten. 63 6. Diskussion: Gerade das Alter bei Implantation ist als prädiktiver Faktor sehr umstritten, mit Sicherheit auch, da die Unterteilung der Studiengruppen zwischen Jung und Alt bisher sehr heterogen gemacht wurde (Holden et al. 2013). Bestritten wird Blamey et al. (1996) durch die Arbeit von Budenz et al. (2011), welcher nach Kontrolle der Taubheitsdauer keine statistisch signifikanten Unterschiede im Hörverstehen zwischen der in jüngere und ältere Patienten unterteilten Kohorte finden konnte. Während Blamey et al. (1996) die Grenze beim sechzigsten Lebensjahr zog und einen signifikanten Einfluss fand, legte sich Budenz et al. (2011) auf das siebzigste Lebensjahr fest, was zumindest einen Einfluss auf das Ergebnis gehabt haben könnte (Holden et al. 2013). Folglich gab es zahlreiche Studien, welche Blamey et al. (1996) einerseits bestätigten (Friedland et al. 2010; Holden et al. 2013) andererseits widerlegten (Green et al. 2007; Budenz et al. 2011; Carlson et al. 2010). Insgesamt fand dennoch die Mehrheit der bisherigen Studien keine Relation zwischen höherem Alter und dem Sprachverstehen, sodass hier eher keine ursächliche Korrelation angenommen werden kann. Die Ätiologie wurde ebenfalls als statistisch signifikante Korrelation zum postoperativen Sprachverstehen benannt, wobei Meningitis Patienten eher schlechtere, Morbus Ménière Patienten eher bessere Ergebnisse im Hörverstehen aufwiesen (Blamey et al. 1996). Auch wenn die Studie von Blamey et al. (1996) zahlreiche Einflussfaktoren aufzeigte, ist dennoch zu kritisieren, dass sie zentrumsübergreifend angelegt wurde und somit von Zentrum zu Zentrum einige Variabilität in der Diagnostik des Sprachverstehens und in der Interpretation der Studienauflagen selbst möglich waren. Weiterhin wurde an manchen Kliniken eine Sprachrehabilitation durchgeführt und an anderen nicht, was das postoperative Hörverstehen deutlich beeinträchtigt haben könnte (Holden et al. 2013). Ebenso wird die Frage, ob Satz- und Worterkennung vor Implantation und somit Residualgehör eine Rolle für das Sprachverstehen nach Implantation spielt, stark diskutiert. Sowohl Rubinstein et al. (1999) als auch Holden et al. (2013) fanden ein statistisch signifikant besseres Ergebnis im postoperativen Sprachverstehen bei erhöhter Satzerkennung vor Implantation. Ein wenn auch gering ausgeprägtes, intaktes Residualgehör könnte Einfluss auf das Überleben der Zellen im Ganglion spirale haben (Rubinstein et al. 1999), auf ein funktionierendes auditorisches Gedächtnis (Heydebrand et al. 2007) und auf Prozesse entlang der Hörbahn im zentralen Nervensystem (Lazard et al. 2010), was zu einem besseren CI Outcome beitragen könnte (Holden et al. 2013). 64 6. Diskussion: Studien zeigten, dass Restgehörerhalt mittlerweile bei mehr als 50 Prozent der Patienten möglich ist (Carlson et al. 2011) und dass Steroidgabe und zunehmend verbesserte Anpassungen des Elektrodenträgers auch positive Korrelation zum Restgehörerhalt zeigen können (Gifford et al. 2013; Bruce et al. 2011). Besonders die Elektrodenlage in der Scala tympani spielt auch beim Erhalt des Residualgehörs eine entscheidende Rolle (Vlastarakos et al. 2014). Gegenstand der derzeitigen wissenschaftlichen Diskussion ist, ob der Insertionsweg via Cochleostomie oder die Rundfensterinsertion einen positiven Einfluss auf Restgehörerhalt und postoperatives Sprachverstehen haben oder nicht (Yawn et al. 2015; Vlastarakos et al. 2014; Adunka et al. 2014; Havenith et al. 2013). 6.2.3. Der Einfluss von Intellekt und Kognition auf das Sprachverstehen: Bereits Blamey et al. (1996) diskutierten den potentiellen Einfluss intellektueller und kognitiver Fähigkeiten auf das Sprachverstehen, mussten jedoch feststellen, dass diese Faktoren nicht routinemäßig bei CI Patienten gemessen wurden und konnten somit keine gesicherte Aussage treffen (Blamey et al. 1996). Außerdem verändern sich zentrale Prozesse im Laufe des Älterwerdens und könnten das Sprachverstehen ebenfalls beeinflussen (Wingfield et al. 2005; Gates et al. 2008). Dem Zusammenhang zwischen intellektuellen und sprachlichen Fähigkeiten und dem CI Outcome widmeten sich 2004 Collison et al., welche 15 postlingual ertaubte Patienten untersuchten. Hierbei ging man von der Hypothese aus, dass ein gut funktionierendes Gedächtnis und ein großes Vokabular zu besseren Ergebnissen führen würden (Collison et al. 2004). Es wurde jedoch festgestellt, dass kognitive und sprachliche Fähigkeiten zu keinem besseren CI Outcome führen (Collison et al. 2004), was durch Heydebrand et al. (2007) bestätigt wurde. Dennoch betiteln sie das verbale Lernvermögen in Kombination mit der Fähigkeit Lippen lesen zu können als eine stark positive Korrelation mit besserem Sprachverstehen, was bis zu 80 Prozent in den ersten sechs Monaten ausmachen kann (Heydebrand et al. 2007). Somit sind Intellekt und Kognition zwar eher weniger direkt ursächlich für ein besseres Sprachverstehen, bei postlingual ertaubten CI Patienten dennoch nicht ganz außer Acht zu lassen (Holden et al. 2013). Zahlreiche Studien zeigen den Zusammenhang zwischen Hörverlust und dem Verlust kognitiver Funktionen im Alter auf (Lin et al. 2011; Peelle et al. 2011; Holden et al. 2013) und kommen zur Hypothese, dass Hörverlust mit verminderten sozialen, kommunikativen und zwischenmenschlichen Interaktionen einhergeht, welche normalerweise die kognitiven Fähigkeiten fördern und fordern. 65 6. Diskussion: Holden et al. (2013) zeigten, dass kognitive Fähigkeiten durchaus innerhalb der Outcome Gruppen variierten, insbesondere zwischen den Extremen. Nebenbei korrelierte jedoch auch das Alter mit den gemessenen kognitiven Werten, sodass bei Auslassung der beiden Randgruppen weder Alter noch kognitive Messwerte einen signifikanten Einfluss auf das Sprachverstehen zu haben schienen (Holden et al. 2013). Besonders die Gruppe der über 65 Jährigen schien deutlich schlechtere kognitive Werte gehabt zu haben und es ist bekannt, dass Altersveränderungen sowohl das periphere als auch zentrale auditorische System beeinträchtigen können (Gates et al. 2008; Holden et al. 2013). Weiterhin ist die altersbezogene abnehmende Kognition bekannt (Schneider et al. 2010). Dennoch zeigten Schneider et al. (2010), dass die Kognition alleine das Sprachverstehen älterer Menschen in ruhiger Umgebung nicht einzuschränken scheint. Trotzdem könnte besonders bei älteren CI Patienten selbst in ruhiger Umgebung eine absolut intakte Kognition erforderlich sein, um die Fähigkeit auszubilden Sprache vollständig zu verstehen. 66 Zusammenfassung: 7. Zusammenfassung: Vielen ertaubten Menschen und taub geborenen Kindern ermöglichte das CI bereits Zugang zur Gesellschaft, zu Bildung und einem weitestgehend uneingeschränkten Leben. Hierbei wird das Implantat immer weiter entwickelt, um das Outcome im Sprachverstehen und der Geräuschwahrnehmung zunehmend zu steigern. Inwiefern der Elektrodenträger des CIs individuell ausgewählt werden sollte, ist Gegenstand der derzeitigen Diskussion. Die Spannbreite der Form der Cochlea zu kennen, ist daher wesentlich. In dieser Arbeit wurde die cochleäre dreidimensionale Größe ermittelt, interindividuelle Unterschiede ausfindig gemacht und der Zusammenhang der cochleären Morphologie mit der Insertionstiefe des Elektrodenträgers und der Dislokationswahrscheinlichkeit aus der Scala tympani heraus verglichen. In den Jahren 2003 bis 2010 wurden 368 Ohren mit einem perimodiolaren Elektrodenträger (Cochlear Contour Advance) über eine Cochleostomie implantiert. Die postoperativ durchgeführten DVT- Aufnahmen wurden hinsichtlich der Durchmesser und Höhe der Cochlea sowie der skalären Elektrodenlage als auch Insertionstiefe und Modiolusnähe analysiert. Erwartungsgemäß zeigte sich eine statistisch signifikante Korrelation beider Durchmesser. Mit steigender Größe der Cochlea lag der Elektrodenträger signifikant näher am Modiolus. Cochleae mit kleinerem Durchmesser und kleinerer Höhe wiesen häufiger dislozierte Elektrodenträger auf. Cochleae mit kleinerer Höhe zeigten außerdem statistisch signifikant mehr nicht favorisierte Scala vestibuli Insertionen. Die Größe der Cochlea scheint sich wie angenommen auf die Lage des Elektrodenträgers auszuwirken. Mit geringerer Größe der Cochlea und abnehmender Nähe zum Modiolus tritt eine Dislokation mit höherer Wahrscheinlichkeit auf. Insbesondere bei geringer cochleärer Höhe scheint das Risiko der skalären Dislokation erhöht. Im Vergleich zu international publizierter Literatur fanden sich ähnliche Ergebnisse bezüglich der cochleären Durchmesser, sowie der Lage des Elektrodenträgers. Diese Arbeit untersuchte den Zusammenhang dieser Parameter jedoch an einem der größten Patientenkollektive zum derzeitigen Zeitpunkt der wissenschaftlichen Diskussion und konnte diesen auch nachweisen. Zusammenfassend hat die cochleäre Morphologie durchaus Einfluss auf die Lage des Elektrodenträgers und die Dislokationswahrscheinlichkeit dessen aus der Scala tympani heraus, wobei zu zeigen bleibt, inwiefern Elektrodenträger mit anderen Abmessungen (insbesondere anderer Länge) die beobachteten Phänomene ausgleichen können. 67 Verzeichnisse: 8. Verzeichnisse: 8.1. Abkürzungsverzeichnis: • CI: Cochlea Implantat • WF: Wrapping Factor nach Holden et al. 2013 • T: Scala tympani • V: Scala vestibuli • TD: disloziert aus Scala tympani • VD: disloziert aus Scala vestibuli • DVT: digitale Volumentomographie • MRT: Magnetresonanztomographie • CT: Computertomographie • HRCT: high resolution computed tomography • BERA: brainstem evoked response audiometry 68 Verzeichnisse: 8.2. Tabellarverzeichnis: • Tabelle 1. Übersicht der in die Arbeit eingeschlossenen Patientendaten. • Tabelle 2. Bildmessungen der Cochlea. • Tabelle 3. Geschlechtsvergleich männlich versus weiblich. • Tabelle 4. Messungen des Elektrodenträgers. • Tabelle 5. Überblick verschiedener Studien zu den Distanzen A und B und der cochleären Höhe. 69 Verzeichnisse: 8.3. Darstellungsverzeichnis: • • • • • • • • • • Darstellung 1: Überblick über die Anatomie des Ohres, unterteilt in äußeres Ohr, Mittelohr und Innenohr bestehend aus vestibulärem Labyrinth und der Cochlea. (Schmidt, R., Lang, F., Heckmann, M. (2010). Physiologie des Menschen mit Pathophysiologie; 31. Auflage, Springer Medizin Verlag Heidelberg. S.319). Darstellung 2: Überblick über das Mittelohr, begrenzt von dem Trommelfell und dem Innenohr, mit den Gehörknöchelchen und dem weiteren Verlauf der Hörschnecke (Schmidt, R., Lang, F., Heckmann, M. (2010). Physiologie des Menschen mit Pathophysiologie; 31. Auflage, Springer Medizin Verlag Heidelberg. S.320). Darstellung 3: Übersicht der Anatomie des Innenohrs mit Darstellung der anatomischen Anordnung des hinteren, vorderen und horizontalen Bogengangs (Schmidt, R., Lang, F., Heckmann, M. (2010). Physiologie des Menschen mit Pathophysiologie; 31. Auflage, Springer Medizin Verlag Heidelberg. S.338). Darstellung 4: Querschnitt durch die Cochlea zur Darstellung von Scala tympani, vestibuli und media (Schiebler, T.H., Korf, H.W. (2007). Anatomie; 10. Auflage, Steinkopff Verlag. S.713). Darstellung 5: Querschnitt durch das Corti- Organ mit Darstellung der inneren und äußeren Haarsinneszellen, der Tektorialmembran, sowie dem Ausgang des N. cochlearis (Hörnerv) (Schmidt, R., Lang, F., Heckmann, M. (2010). Physiologie des Menschen mit Pathophysiologie; 31. Auflage, Springer Medizin Verlag Heidelberg. S. 323). Darstellung 6: Deflektion und Reflektion der Haarsinneszellen bei Sogwirkung auf die Endolymphe (Schmidt, R., Lang, F., Heckmann, M. (2010). Physiologie des Menschen mit Pathophysiologie; 31. Auflage, Springer Medizin Verlag Heidelberg. S. 323). Darstellung 7: Mechanismus der Depolarisation der inneren Haarsinneszelle (Schmidt, R., Lang, F., Heckmann, M. (2010). Physiologie des Menschen mit Pathophysiologie; 31. Auflage, Springer Medizin Verlag Heidelberg. S. 325). Darstellung 8: Darstellung eines linken Felsenbeins mit dysplastischer Cochlea (Pfeil) und dysplastisch vergrößertem Vestibulum (Pfeilspitze) (Reid, J., Paladin, A., Davros, W., Lee, E., Carrico, C. (2013). Pediatric Radiology, erste Auflage; Oxford University Press. Seite 441). Darstellung 9: axiales CT Schnittbild eines Felsenbeins eines Patienten mit partieller Ossifikation der cochleären Basalwindung bei Zustand nach Meningitis (De Barros, A., Roy, T., Amstutz, Montadert, I., Marie, J.P., Marcolla, A., Obstoy, M.F., Choussy, O., Dehesdin, D., Lerosey, Y. (2014). Rapidly progressive bilateral postmeningitic deafness in children: Diagnosis and management. European Annals of Otorhinolaryngology, Head and Neck diseases. 2014;131:107–112). Darstellung 10: a) Darstellung eines Vestibularisschwannoms im Kleinhirnbrückenwinkel (links im axialen MRT, rechts als Schemazeichnung). (Probst, R., Grevers, G., Iro, H. (2008). Hals- Nasen- Ohrenheilkunde; 3. Auflage, Georg Thieme Verlag KG Stuttgart. S. 279). b) Darstellung eines Vestibularisschwannoms im Meatus acusticus internus (links im koronaren MRT mit Gadolinium, rechts als Schemazeichnung) (Probst, R., Grevers, G., Iro, H. (2008). Hals- Nasen- Ohrenheilkunde; 3. Auflage, Georg Thieme Verlag KG Stuttgart. S. 279). 70 Verzeichnisse: • • • • • • • • • Darstellung 11: Transversalschnitt durch das Ohr mit Darstellung des Cochlea Implantates, vom Sprachprozessor über den Korpus (hier „Cochlea Implant“ bis zum Elektrodenträger (Berghaus, A., Rettinger, G., Böhme, G. (1996). Duale Reihe, HalsNasen- Ohrenheilkunde, Thieme Verlag, Stuttgart, 1996, S. 193). Darstellung 12: Überblick über das Cochlea Implantat (Lenarz, T., Boenninghaus, H. G. (2012). HNO; 14. Auflage, Springer Verlag Berlin Heidelberg. S. 131). Darstellung 13: Röntgenübersichtsaufnahmen verschiedener derzeit auf dem Markt erhältlicher Elektrodenträger. A) MED-El Pulsar und B) Neurelec Digisonic als Aussenwandelektroden im Vergleich zu C) Advanced Bionics Helix und D) Cochlear Contour Advance als perimodiolare Elektrodenträger. (Boyd, P.J. (2011). Potential benefits from deeply inserted cochlear implant electrodes. Ear Hear. 2011 JulAug;32(4):411-27). Darstellung 14: a) Digitale Volumentomographie zur Darstellung eines ideal inserierten Elektrodenträgers in die Scala tympani (Aschendorff, A., Kubalek, R., Turowski, B., Zanella, F., Hochmuth, A., Schumacher, M., Klenzner, T., Laszig R. (2005). Quality control after cochlear implant surgery by means of rotational tomography. Otol Neurotol. 2005 Jan;26(1):34-7). b) Histologie zur Darstellung eines ideal inserierten Elektrodenträgers in die Scala tympani (Aschendorff, A., Kubalek, R., Turowski, B., Zanella, F., Hochmuth, A., Schumacher, M., Klenzner, T., Laszig R. (2005). Quality control after cochlear implant surgery by means of rotational tomography. Otol Neurotol. 2005 Jan;26(1):34-7). c) Schemazeichnung zur Darstellung des Elektrodenträgers (ET) mit optimaler Lage in der Scala tympani (ST) (O´Donoghue, G. (2013). Cochlear Implants – Science, Serendipity and Success. N Engl J Med. 2013 Dec 26;369(26):2564). Darstellung 15: Computertomographie des Felsenbeins mit axialer Schnittführung (oben) und koronarer Schnittführung (unten), wobei der Pfeil jeweils den Bogengang und der Stern den inneren Gehörgang anzeigt. (Lenarz, T., Boenninghaus, H. G. (2012). HNO; 14. Auflage, Springer Verlag Berlin Heidelberg. S. 61). Darstellung 16: a) HRCT eines Patienten mit bilateraler cochleärer Hypoplasie (Durchmesser kleiner als 20 mm) und einer sehr kurzen Basalwindung (Pfeil). (Aschendorff, A. (2011). Imaging in cochlear implant patients. GMS Curr Top Otorhinolaryngol Head Neck Surg. 2011;10). b) MRT desgleichen Patienten mit Darstellung des Nervus vestibulocochlearis (Pfeil). (Aschendorff, A. (2011). Imaging in cochlear implant patients. GMS Curr Top Otorhinolaryngol Head Neck Surg. 2011;10). Darstellung 17: Magnetresonanztomographie des Felsenbeins in axialer Schnittführung (links) in T2 Wichtung, in weiß flüssigkeitsgefüllte Liquorräume und Innenohr (Pfeil). Rechts: MRT nach Gadolinium- Gabe mit deutlichem Enhancement bei Vestibularisschwannom in koronarer Schnittführung (Lenarz, T., Boenninghaus, H. G. (2012). HNO; 14. Auflage, Springer Verlag Berlin Heidelberg. S.62). Darstellung 18: postoperative transorbitale konventionelle Röntgenaufnahme bei einem beidseits mit Cochlea Implantat versorgten Kind (Aschendorff, A. (2011). Imaging in cochlear implant patients. GMS Curr Top Otorhinolaryngol Head Neck Surg. 2011;10). Darstellung 19: postoperatives MRT bei einem linksseitig CI versorgten Patienten zur Veranschaulichung des starken Elektrodenartefakts (Pfeile), welches Felsenbein und den inneren Gehörgang vollständig überlagert (Aschendorff, A. (2011). Imaging in cochlear implant patients. GMS Curr Top Otorhinolaryngol Head Neck Surg. 2011;10). 71 Verzeichnisse: • • • • • • • • • • • • • • • • • Darstellung 20: Darstellung der cochleären Größe in Form der gemessenen Distanzen A und B nach Escudé (Escudé, B., James, C., Deguine, O., Cochard, N., Eter, E., & Fraysse, B. (2006). The size of the cochlea and predictions of insertion depth angles for cochlea implant electrodes. Audiol. Neurootol., 11 Suppl 1, 27-33). Darstellung 21: Querschnitt und Vermessung der Cochlea bei van der Marel et al. 2013 (Van der Marel, K., Briaire, J. J., Wolterbeek, R., Snel-Bongers, J., Verbist B. M., Frijns, J. H. M. (2013). Diversity in cochlear morphology and its influence on cochlear implant electrode position. Ear Hear., 35, 9-20). Darstellung 22: Übersicht der skalären Lagemöglichkeiten des Elektrodenträgers in der ST (Scala tympani – gefüllte Kreise) oder SV (Scala vestibuli – leere Kreise) mit Anschnitt des Hörnerven (VIII Nerve) (Holden, L. K., Finley, C. C., Firszt, J. B., Holden, T. A., Brenner, C., Potts, L. G., Gotter, B.D., Vanderhoof, S.S., Mispagel, K., Heydebrand, G., Skinner, M.W. (2013). Factors affecting open-set word recognition in adults with cochlear implants. Ear Hear., 34, 342-360). Darstellung 23: Querschnitt einer Kadaverstudie eines Felsenbeins mit einer implantierten MED – EL Flex- Elektrode, welche die Basilarmembran in der mittleren, cochleären Wendung rupturiert (A) und die Lamina spiralis in der Basalwendung frakturiert (B) (Adunka, O., Kiefer, J. (2006). Impact of electrode insertion depth on intracochlear trauma. Otolaryngol Head Neck Surg. 2006 Sep;135(3):374-82. und Boyd, P.J. (2011). Potential benefits from deeply inserted cochlear implant electrodes. Ear Hear. 2011 Jul-Aug;32(4):411-27). Darstellung 24: horizontaler Schnitt der Cochlea auf Höhe der Basalwindung zur anschließenden Messung der cochleären Größe. Darstellung 25: beispielhafte Vermessung der cochleären Größe nach Escudé et al. (2006) mit Längsdurchmesser (rot) ab Cochleostomie (Pfeil) und orthogonal dazuliegendem Querdurchmesser (grün). Darstellung 26a: multiplanare Rekonstruktion zur Vermessung der cochleären Höhe in zwei verschiedenen orthogonal zum horizontalen Schnitt stehenden Ebenen (oben links und oben rechts). Darstellung 26b: Vermessung der Insertionstiefe des Elektrodenträgers (rot) ab Cochleostomie (Pfeil). Darstellung 27: Vermessung der Insertionstiefe des Elektrodenträgers (rot) im Vergleich zur entsprechenden lateralen Wandlänge (blau) ab Cochleostomie (Pfeil). Darstellung 28: Vermessung des Insertionswinkels des Elektrodenträgers ab Cochleostomie (Pfeil). Darstellung 29: Wrapping Factor versus Produkt der Distanzen A*B (cochleäre Fläche). Darstellung 30: Wrapping Factor versus Umfang der cochleären Ellipse. Darstellung 31: Insertionswinkel versus Produkt der Distanzen A*B (cochleäre Fläche). Darstellung 32: Boxplot des Produkts A*B mit der Elektrodenlage innerhalb der Skalen. Darstellung 33: Boxplot von Wrapping Factor versus Elektrodenlage. Darstellung 34: Veranschaulichung der Lage des lateralen Elektrodenträgers („Slim Straight“) versus eines perimodiolaren „Slim“- Elektrodenträgers in Entwicklung (Von Wallenberg, E., Briggs, R (2014). Cochlear's unique electrode portfolio now and in the future. Cochlear Implants Int. 2014 May;15 Suppl 1:S59-61). Darstellung 35: Veranschaulichung eines Nucleus Contour Advance Elektrodenträgers mit einer durchschnittlichen Insertionslänge von 17.8mm (bis zu den sogenannten „Ribs“ (3). (Quelle: Cochlear™). 72 Verzeichnisse: 8.4. Literaturverzeichnis: • • • • • • • • • • • • • • • Adelt, A., Fritzsche, T., Roß, J., Düsterhöft, S. (2014). Spektrum Patholinguistik. Band 07, 2014, Universitätsverlag Potsdam. Adunka, O., Kiefer, J. (2006). Impact of electrode insertion depth on intracochlear trauma. Otolaryngol Head Neck Surg. 2006 Sep;135(3):374-82. Adunka, O., Kiefer, J., Unkelbach, M.H., Radeloff, A., Lehnert, T., Gstöttner, W. (2004). Evaluation of an electrode design for the combined electric-acoustic stimulation. Laryngorhinootologie. 2004 Oct;83(10):653-8. German. Adunka, O., Unkelbach, M.H., Mack, M.G., Radeloff, A., Gstoettner, W. (2005). Predicting basal cochlear length for electric-acoustic stimulation. Arch Otolaryngol Head Neck Surg. 2005 Jun;131(6):488-92. Adunka, O., Dillon, M.T., Adunka, M.C., King, E.R., Pillsbury, H.C., Buchman, C.A. (2014). Cochleostomy versus round window insertions: influence on functional outcomes in electric-acoustic stimulation of the auditory system. Otol Neurotol. 2014 Apr;35(4):613-8. Andrade K.C., Leal, Mde, C., Muniz L.F., Menezes ,Pde, L., Albuquerque, K.M., Carnaúba, A.T. (2014). The importance of electrically evoked stapedial reflex in cochlear implant. Braz J Otorhinolaryngol. 2014 Jan-Feb;80(1):68-77. Arndt, S., Prosse, S., Laszig, R., Wesarg, T., Aschendorff, A., Hassepass, F. (2015). Cochlear implantation in children with single-sided deafness: does aetiology and duration of deafness matter? Audiol Neurootol. 2015;20 Suppl 1:21-30. Arndt, S., Laszig, R., Beck, R., Schild, C., Maier, W., Birkenhäger, R., Kroeger, S., Wesarg, T., Aschendorff, A. (2010). Spectrum of hearing disorders and their management in children with CHARGE syndrome. Otol Neurotol. 2010 Jan;31(1):6773. Arriaga, M.A., Marks, S. (1995). Simultaneous cochlear implantation and acoustic neuroma resection: imaging considerations, technique, and functional outcome; Otolaryngol Head Neck Surg. Feb;112(2):325-8. Artieres, F., Vieum, A., Mondain, M., Uziel, A., Venail, F. (2009). Impact of early cochlear implantation on the linguistic development of the deaf child. Otol Neurotol 30(6): 736-742. Aschendorff, A. (2011). Imaging in cochlear implant patients. GMS Curr Top Otorhinolaryngol Head Neck Surg. 2011;10:Doc07. Aschendorff, A., Kromeier, J., Klenzner, T., Laszig, R. (2007). Quality control after insertion of the nucleus contour and contour advance electrode in adults. Ear Hear., 28, 75S-79S. Aschendorff, A., Laszig, R., Maier, W., Beck, R., Schild, C., Birkenhäger, R., Wesarg, T., Kröger, S., Arndt, S. (2009a). Cochlear implant for malformations of the inner ear. HNO. 2009 Jun;57(6):533-41. 2009a. Aschendorff, A., Maier, W., Jaekel, K., Wesarg, T., Arndt, S., Laszig, R., Voss, P., Metzger, M., Schulze, D. (2009b). Radiologically assisted navigation in cochlear implantation for X-linked deafness malformation. Cochlear Implants Int. 2009;10 Suppl 1:14-8. doi: 10.1002/cii.379. 2009b. Aschendorff, A., Klenzner, T., Richter, B., Kubalek, R., Nagursky, H., Laszig, R. (2003). Evaluation of the HiFocus electrode array with positioner in human temporal bones. J Laryngol Otol. 2003 Jul;117(7):527-31. 73 Verzeichnisse: • • • • • • • • • • • • • • • Aschendorff, A., Kubalek, R., Hochmuth, A., Bink, A., Kurtz, C., Lohnstein, P., Klenzner, T., Laszig, R. (2004). Imaging procedures in cochlear implant patients – evaluation of different radiological techniques. Acta Otolaryngol Suppl. 2004 May;(552):46-9. Aschendorff, A., Kubalek, R., Turowski, B., Zanella, F., Hochmuth, A., Schumacher, M., Klenzner, T., Laszig R. (2005). Quality control after cochlear implant surgery by means of rotational tomography. Otol Neurotol. 2005 Jan;26(1):34-7. Aumüller, G., Aust, G., Doll, A., Engele, J., Kirsch, J., Mense, S., Reißig, D., Salvetter, J., Schmidt, W., Schmitz, F., Schulte, E., Spanel-Borowski, K., Wolff, W., Wurzinger, L.J., Zilich, H.G. (2007). Duale Reihe Anatomie, Georg Thieme Verlag 2007, erste Auflage, Stuttgart. Battmer, R.D., Laszig, R., Lehnhardt, E. (1990). Electrically Elicited Stapedius Reflex in Cochlear Implant Patients. Ear Hear. 1990 Oct;11(5):370-4. Benninghoff, Drenckhahn, D. (2004); Anatomie, Makroskopische Anatomie, Embryologie und Histologie des Menschen - Band 2: Herz-Kreislauf-System, Lymphatisches System, Endokrine Drüsen, Nervensystem, Sinnesorgane, Haut. 16. Auflage, Urban & Fischer Verlag/ Elsevier GmbH. Bischoff, M., Hebecker, A., Hartwig, E., Gebhard, F. (2004). Wirtschaftlichkeit der intraoperativen 3D- Bildgebung mit einem mobilen chirurgischen C- Bogen. Unfallchirurg. 2004;107:712-715. Blamey, P., Arndt, P., Bergeron, F., Bredberg, G., Brimacombe, J., Facer, G., Larky, J., Lindström, B., Nedzelski, J., Peterson, A., Shipp, D., Staller, S., Whitford, L. (1996). Factors affecting auditory performance of postlinguistically deaf adults using cochlear implants. Audiol Neurootol. 1996; 1:293–306. Boëx, C., Baud, L., Cosendai, G., Sigrist, A., Kós, M.I., Pelizzone, M. (2006). Acoustic to electric pitch comparisons in cochlear implant subjects with residual hearing. J Assoc Res Otolaryngol. 2006 Jun;7(2):110-24. Brackmann, D.E., Kesser, B.W., Day, J.D. (2001). Microvascular decompression of the vestibulocochlear nerve for disabling positional vertigo: the House Ear Clinic experience. Otol Neurotol. 2001 Nov;22(6):882-7. Bruce, I.A., Bates, J.E., Melling, C., Mawman, D., Green, K.M. (2011). Hearing preservation via a cochleostomy approach and deep insertion of a standard lengthcochlear implant electrode. Otol Neurotol. 2011 Dec;32(9):1444-7. Budenz, C.L., Cosetti, M.K., Coelho, D.H., Birenbaum, B., Babb, J., Waltzman, S.B., Roehm, P.C. (2011). The effects of cochlear implantation on speech perception in older adults. J Am Geriatr Soc. 2011; 59:446–453. Burton, M.J., Miller, J.M., Kileny, P.R. (1989). Middle-latency responses. I. Electrical and acoustic excitation. Arch Otolaryngol Head Neck Surg. 1989 Jan;115(1):59-62. Carlson M.L., Driscoll C.L., Gifford, R.H., Service, G.J., Tombers, N.M., HughesBorst, B.J., Neff, B.A., Beatty, C.W. (2011). Implications of minimizing trauma during conventional cochlear implantation. Otol Neurotol. 2011 Aug;32(6):962-8. Carlson, M.L., Breen, J.T., Gifford, R.H., Driscoll, C.L., Neff, B.A., Beatty, C.W., Peterson, A.M., Olund, A.P. (2010). Cochlear implantation in the octogenarian and nonagenarian. Otol Neurotol. 2010; 31:1343–1349. Carlson, M.L., Archibald, D.J., Gifford, R.H., Driscoll, C., Beatty, C.W. (2012). Reimplantation with a conventional length electrode following residual hearing loss in four hybrid implant recipients. Cochlear Implants Int. 2012 Aug; 13(3): 148–155. 74 Verzeichnisse: • • • • • • • • • • • • • • • • • Carlson, M.L., Neff, B.A., Link, M.J., Lane, J.I., Watson, R.E., McGee, K.P., Bernstein, M.A., Driscoll, C.L. (2015). Magnetic Resonance Imaging With Cochlear Implant Magnet in Place: Safety and Imaging Quality. Otol Neurotol. 2015 Jul;36(6):965-71. Church, M.W., Gerkin, K.P. (1988). Hearing disorders in children with fetal alcohol syndrome: findings from case reports. Pediatrics. 1988 Aug;82(2):147-54. Colletti, L. (2009) Long-term follow-up of infants (4-11 months) fitted with cochlear implants. Acta Otolaryngol. 2009 Apr;129(4):361-6. Collison, E.A., Munson, B., Carney, A.E. (2004). Relations among linguistic and cognitive skills and spoken word recognition in adults with cochlear implants. J Speech, Lang Hear Res. 2004; 47:496–508. Crane, B.T. Gottschalk, B., Kraut, M., Aygun, N., Niparko, J.K. (2010). Magnetic resonance imaging at 1.5 T after cochlear implantation. Otol Neurotol. 2010 Oct;31(8):1215-20. De Barros, A., Roy, T., Amstutz, Montadert, I., Marie, J.P., Marcolla, A., Obstoy, M.F., Choussy, O., Dehesdin, D., Lerosey, Y. (2014). Rapidly progressive bilateral postmeningitic deafness in children: Diagnosis and management. European Annals of Otorhinolaryngology, Head and Neck diseases. 2014;131:107–112. De Foer, B., Kenis, C., Van Melkebeke, D., Vercruysse, J.P., Somers, T., Pouillon, M., Offeciers, E., Casselman, J.W. (2010). Pathology of the vestibulocochlear nerve. Eur J Radiol. 2010 May;74(2):349-58. Deetjen, P., Speckmann, E.-J., Hescheler, J. (2004) Physiologie; 4. Auflage; Urban & Fischer Verlag/Elsevier GmbH. Deneuve, S., Loundon, N., Leboulanger, N., Rouillon, I., Garabedian, E.N. (2008). Cochlear implant magnet displacement during magnetic resonance tomography. Otol Neurotol. 2008 Sep;29(6):789-190. Diller, G. (2009). (Re)habilitation nach Versorgung mit einem Kochlea- implantat. HNO (7), 649-656. Dimopoulos, P., Muren, C. (1990). Anatomic variations of the cochlea and relations to other temporal bone structures. Acta Radiol., 31, 439-444. Dunn, C.C., Tyler, R.S., Witt, S., Ji, H., Gantz, B.J. (2012). Sequential bilateral cochlear implantation: speech perception and localization pre- and post-second cochlear implantation. Am J Audiol 2012, 21:181-9. Ernst, A., Battmer, RD., Todt, I. (2009). Cochlear Implant heute. Erste Auflage. Springer Berlin Heidelberg. Escudé, B., James, C., Deguine, O., Cochard, N., Eter, E., & Fraysse, B. (2006). The size of the cochlea and predictions of insertion depth angles for cochlea implant electrodes. Audiol. Neurootol., 11 Suppl 1, 27-33. Fayad, J.N., Wanna, G.B., Micheletto, J.N., Parisier S.C. (2003). Facial nerve paralysis following cochlear implant surgery. Laryngoscope. 2003 Aug;113(8):13446. Fayad, J.N., Linthicum, F.H. Jr. (2006). Multichannel cochlear implants: relation of histopathology to performance. Laryngoscope. 2006 Aug;116(8):1310-20. Finley, C. C., Holden, T. A., Holden, L. K., Whiting, B. R., Chole, R. A., Neely, G. J. et al. (2008). Role of electrode placement as a contributor to variability in cochlear implant outcomes. Otol. Neurotol., 29, 920-928. 75 Verzeichnisse: • • • • • • • • • • • • • • • • Fitzgerald, M.B., Sagi, E., Jackson, M., Shapiro, WH., Roland, JT Jr., Waltzman, SB., Svirsky, MA. (2008). Reimplantation of hybrid cochlear implant users with a full-length electrode after loss of residual hearing. Otol Neurotol. 2008 Feb;29(2):16873. Franzen, A. (2007). Kurzlehrbuch Hals- Nasen- Ohrenheilkunde; 3. Auflage, Elsevier / Urban- Fischer Verlag GmbH; München / Jena. Fraysse, B., Ramos, A., Sterkers, O., Burdo, S., Ramsden, R., Deguine, O., Klenzner, T., Lenarz, T., Rodriguez, M.M., Von Wallenberg, E, James C. (2006). Residual hearing conservation and electro-acoustic stimulation with the Nucleus 24 Contour Advance cochlear implant. Otol. Neurotol., 27, 624-633. Friedland, D.R., Runge-Samuelson, C., Baig, H., Jensen, J. (2010). Case-control analysis of cochlear implant performance in elderly patients. Arch Otolaryngol Head Neck Surg. 2010; 136:432–438. Friedland, D.R., Venick, H.S., Niparko, J.K. (2003). Choice of ear for cochlear implantation: The effect of history and residual hearing on predicted postoperative performance. Otol Neurotol. 2003; 24:582–589. Friedmann, D.R., Peng, R., Fang, Y., McMenomey, S.O., Roland, J.T., Waltzman, S.B. (2015). Effects of loss of residual hearing on speech performance with the CI422 and the Hybrid-L electrode. Cochlear Implants Int. 2015 Apr 26. Frisch, C.D., Carlson, M.L., Lane, J.I., Driscoll, C.L. (2015). Evaluation of a new midscala cochlear implant electrode using microcomputed tomography. Laryngoscope. May 6. doi: 10.1002/lary.25347. Gantz, B.J., Dunn, C.C., Walker, E.A., Kenworthy, M., Van Voorst, T., Tomblin, B., Turner, C. (2010). Bilateral cochlear implants in infants: a new approach--Nucleus Hybrid S12 project. Otol Neurotol. 2010 Oct;31(8):1300-9. Gates, G.A., Feeney, M.P., Mills, D. (2008). Cross-sectional age-changes of hearing in the elderly. Ear Hear. 2008; 29:865–874. Geers, A. E. (2004). Speech, language, and reading skills after early cochlear implantation. Arch Otolaryngol Head Neck Surg 130(5): 634-638. Gifford, R.H., Shallop, J.K., Peterson, A.M. (2008). Speech recognition materials and ceiling effects: Considerations for cochlear implant programs. Audiol Neurootol. 2008; 13:193–205. Gifford, R.H., Dorman, M.F., Sheffield, S.W., Teece, K., Olund, A.P. (2013). Availability of binaural cues for bilateral implant recipients and bimodal listeners with and without preserved hearing in the implanted ear. Audiol Neurootol. 2014;19(1):5771. Green, K.M.J., Bhatt, Y.M., Mawman, D.J., O'Driscoll, M.P., Saeed, S.R., Ramsden, R.T., Green, M.W. (2007). Predictors of audiological outcome following cochlear implantation in adults. Cochlear Implant Int. 2007; 8:1–11. Gstoettner, W., Plenk, H. Jr., Franz, P., Hamzavi, J., Baumgartner, W., Czerny, C., Ehrenberger, K. (1997). Cochlear implant deep electrode insertion: extent of insertional trauma. Acta Otolaryngol. 1997 Mar;117(2):274-7. Gstoettner, W., Pok, S.M., Peters, S., Kiefer, J., Adunka, O. (2005). Cochlear implantation with preservation of residual deep frequency hearing; HNO. 2005 Sep;53(9):784-90. Haensel, J., Engelke, J.C., Ottenjann, W., Westhofen, M. (2005). Long-term results of cochlear implantation in children. Otolaryngol Head NeckSurg.2005 Mar;132(3):4568. 76 Verzeichnisse: • • • • • • • • • • • • • • • Hardy, M. (1938). The length of the organ of Corti in man. Am J Anat., 62, 291-311. Hassepass, F., Aschendorff, A., Bulla, S., Arndt, S., Maier, W., Laszig, R., Beck, R. (2015). Radiologic Results and Hearing Preservation With a Straight Narrow Electrode via Round Window Versus Cochleostomy Approach at Initial Activation. Otology & Neurotology 2015; 36:993-1000. Hassepass, F., Bulla, S., Maier, W., Laszig, R., Arndt, S., Beck, R., Traser, L., Aschendorff, A. (2014). The new mid-scala electrode array: a radiologic and histologic study in human temporal bones. 2014, Otol Neurotol. Sep;35(8):1415-20. Havenith, S., Lammers, M.J., Tange, R.A., Trabalzini, F., della Volpe, A., van der Heijden, G.J., Grolman, W. (2013). Hearing preservation surgery: cochleostomy or round window approach? A systematic review. Otol Neurotol. 2013 Jun;34(4):667-74. Helbig, S., Rader, T., Bahmer, A., Baumann, U. (2009). A case of bilateral cochlear implantation in single-sided untreated acoustic neurinoma. Acta Otolaryngol. 2009 Jun;129(6):694-6. Heydebrand, G., Hale, S., Potts, L., Gotter, B., Skinner, M. (2007). Cognitive predictors of improvements in adults’ spoken word recognition six months after cochlear implant activation. Audiol Neurootol. 2007; 12:254–264. Hochmair, I., Arnold, W., Nopp, P., Jolly, C., Müller, J., Roland, P. (2003). Deep electrode insertion in cochlear implants: apical morphology, electrodes and speech perception results. Acta Otolaryngol. 2003 Jun;123(5):612-7. Hodges, A. V., Balkany, T. J., Ruth, R. A., Lambert, P. R., Dolan- Ash, S., Schloffman, J. J. (1997). Electrical Middle Ear Muscle Reflex: Use in Cochlear Implant Programming; Otolaryngol Head Neck Surg September 1997 vol. 117 no. 3 255-261. Holden, L. K., Finley, C. C., Firszt, J. B., Holden, T. A., Brenner, C., Potts, L. G., Gotter, B.D., Vanderhoof, S.S., Mispagel, K., Heydebrand, G., Skinner, M.W. (2013). Factors affecting open-set word recognition in adults with cochlear implants. Ear Hear., 34, 342-360. Holt, R. F., Svirsky, M.A. (2008). An exploratory look at pediatric cochlear implantation: is earliest always best? Ear and hearing 29(4): 492-511. Husstedt, H.W., Aschendorff, A., Richter, B., Laszig, R., Schumacher, M. (2002). Nondestructive three- dimensional analysis of electrode to modiolus proximity. Otol Neurotol. 2002 Jan;23(1):49-52. Hüttenbrink, K.B., Zahnert, T., Jolly, C., Hofmann, G. (2002). Movements of cochlear implant electrodes inside the cochlea during insertion: an x-ray microscopy study. Otol Neurotol. 2002 Mar; 23(2):187-91. Jackler, R.K., Luxford, W.M., House, W.F. (1987). Congenital malformations of the inner ear: a classification based on embryogenesis. aryngoscope Mar;97(3 Pt 2 Suppl 40):2-14. James, C., Albegger, K., Battmer, R., Burdo, S., Deggouj, N. Deguine, O., Dillier, N., Gersdorff, M., Laszig, R., Lenarz, T., Rodriguez, M.M., Mondain, M., Offeciers, E., Macías, A.R., Ramsden, R., Sterkers, O., Von Wallenberg, E., Weber, B., Fraysse, B. (2005). Preservation of residual hearing with cochlear implantation: how and why. Acta Otolaryngol., 125, 481-491. Jørgensen, M.B., Kristensen, H.K., Buch,, N.H. (1964). Thalidomide-induced Aplasia of The Inner Ear. The Journal of Laryngology & Otology / Volume 78 / Issue 12 / December 1964, pp 1095-1101. 77 Verzeichnisse: • • • • • • • • • • • • • • Kawano, A., Seldon, H. L., Clark, G.M. (1996). Computer- aided three- dimensional construction in human cochlear maps: measurement of the lengths of organ of Corti outer wall, inner wall and Rosenthal´s canal. Ann Otol. Rhinol. Laryngo., 105, 701709. Kelsell, D.P., Dunlop, J., Stevens, H.P., Lench, N.J., Liang, J.N., Parry, G., Mueller, R.F., Leigh, I.M. (1997). Connexin 26 mutations in hereditary non-syndromic sensorineural deafness. Nature. 1997 May 1;387(6628):80-3. Ketten, D.R., Skinner, M.W., Wang, G., Vannier, M.W., Gates, G.A., Neely, J.G. (1998). In vivo measures of cochlear length and insertion depth of Nucleus cochlear implant electrode arrays. Ann Otol. Rhinol. Laryngol., 107, 1-16. Khan, A.M., Handzel, O., Burgess, B.J., Damian, D., Eddington, D.K., Nadol, J.B. Jr. (2005). Is word recognition correlated with the number of surviving spiral ganglion cells and electrode insertion depth in human subjects with cochlear implants. Laryngoscope. 2005; 115:672–677. Kiefer, J., Gstoettner, W., Baumgartner, W., Pok, S.M., Tillein, J., Ye, Q., von Ilberg, C. (2004). Conservation of low-frequency hearing in cochlear implantation. Acta Otolaryngol 2004; 124: 272-80. Klenzner, T., Richter, B., Nagursky, H., Schipper, J., Laszig, R., Aschendorff, A. (2004). Evaluation des Insertionstraumas des Nucleus Contour Advance Elektrodenträgers im humanen Felsenbeinmodell. Laryngo-Rhino-Otol 2004; 83(12): 840-844. Klenzner, T., Ngan, C.C., Knapp, F.B., Knoop, H., Kromeier, J., Aschendorff, A., Papastathopoulos, E., Raczkowsky, J., Wörn, H., Schipper, J. (2009). New strategies for high precision surgery of the temporal bone using a robotic approach for cochlear implantation. Eur Arch Otorhinolaryngol. 2009 Jul;266(7):955-60. Klenzner, T., Richter, B., Nagursky, H., Schipper, J., Laszig, R., Aschendorff, A. (2004). Evaluation of the insertion-trauma of the Nucleus Contour Advance electrodearray in a human temporal bone model. Laryngorhinootologie. 2004 Dec;83(12):8404. German. Klinke, R., Pape, H.C., Kurtz, A., Silbernagl, S. (2010). Physiologie, sechste Auflage, Georg Thieme Verlag KG, Stuttgart. Konsenspapier der Arbeitsgemeinschaft Cochlear Implant Rehabilitation (ACIR) zur Rehabilitation nach Cochlea Implantat Versorgung verabschiedet am 12.11.2011 in Friedberg/Hessen. Kós, M.I., Broex, C., Sigrist, A., Guyot, J.P., Pelizzone, M. (2005). Measurements of electrode position inside the cochlea for different cochlear implant systems. Acta Otolaryngol. 125(5), 474-480. Kurzweg, T., Dalchow, C.V., Bremke, M., Majdani, O., Kureck, I., Knecht, R., Werner, J.A., Teymoortash, A. (2010). The value of digital volume tomography in assessing the position of cochlear implant arrays in temporal bone specimens. Ear Hear. 2010 Jun;31(3):413-9. Lammers, M.J., Venekamp, R.P., Grolman, W., van der Heijden, G.J. (2014). Bilateral cochlear implantation in children and the impact of the inter-implant interval. Laryngoscope 2014, 124:993-9. Lane, J.I., Witte, R.J., Driscoll, C.L., Shallop, J.K., Beatty, C.W., Primak, A.N. (2007). Scalar localization of the electrode array after cochlear implantation: clinical experience using 64-slice multidetector computed tomography. Otol Neurotol. 2007 Aug;28(5):658-62. 78 Verzeichnisse: • • • • • • • • • • • • • • • • • • Laszig, R., Aschendorff, A., Beck, R., Schild, C., Kröger, S., Wesarg, T., Arndt, S. (2009). Long-term functional outcomes of cochlear implants in children; HNO. 2009 Jul;57(7):657-62. Lazard, D.S., Giraud, A.L., Gnansia, D., Meyer, B., Sterkers, O. (2012). Understanding the deafened brain: Implications for cochlear implant rehabilitation. Eur Ann Otorhinolaryngol Head Neck Dis. 2012; 129:98–102. Lazard, D.S., Lee, H.J., Gaebler, M., Kell, C.A., Truy, E., Giraud, A.L. (2010). Phonological processing in post-lingual deafness and cochlear implant outcome. Neuroimage. 2010 Feb 15;49(4):3443-51. Leake, P.A., Hradek, G.T., Snyder, R.L. (1999). Chronic electrical stimulation by a cochlear implant promotes survival of spiral ganglion neurons after neonatal deafness. J Comp Neurol. 1999; 412:543–562. Lee, J., Nadol, J.B., Eddington, D.K. (2010). Depth of electrode insertion and postoperative performance in human with cochlear implants: A histopathologic study. Audiol Neurootol. 2010; 15:323–331. Lehnhardt, E., Laszig, R. (2001). Praxis der Audiometrie . Stuttgart; New York, Thieme. Leitlinien der Arbeitsgemeinschaft Deutschsprachiger Audiologen, Neurootologen und Otologen (ADANO) (2002) www.hno.org/adano/leitlinien.htm. Lenarz, T. (1998). Cochlea-Implantat: Ein praktischer Leitfaden für die Versorgung von Kindern und Erwachsenen, Springer- Verlag Berlin Heidelberg. Erste Auflage. Lenarz, T., Boenninghaus, H. G. (2012). HNO; 14. Auflage, Springer Verlag Berlin Heidelberg. Lenarz, T., Boenninghaus, H. G. (2007). HNO; 13. Auflage, Springer Verlag Berlin Heidelberg. Lenarz, T., James, C.J., Cuda, D., Fitzgerald-O’Connor, A., Frachet, B., Frijns, J.H., Klenzner, T., Laszig, R., Manrique, M., Marx, M., Merkus, P., Mylanus, E.A., Offeciers, E., Pesch, J., Ramos-Macias, A., Robier, A., Sterkers, O., Uziel, A. (2013). European multi-centre study of the Nucleus Hybrid L24 cochlear implant. International Journal of Audiology, 52(12): 838–48. Lenarz, T., Stover, T., Buechner, A., Paasche, G., Briggs, R., Risi, F., Pesch, J., Battmer, R.D. (2006). Temporal bone results and hearing preservation with a new straight electrode. Audiol Neurootol. 2006;11 Suppl 1:34-41. Epub 2006 Oct 6. Leung, J., Wang, N.-Y., Yeagle, J.D., Chinnici, J., Bowditch, S., Francis, H.W., Niparko, J.K. (2005). Predictive models for cochlear implantation in elderly candidates. Arch Otolaryngol Head Neck Surg. 2005; 131:1049–1054. Lin, F.R. (2011). Hearing loss and cognition among older adults in the United States. J Gerontol A Biol Sci Med Sci. 2011; 66:1131–1136. Lüllmann-Rauch Renate (2009); Histologie; 3. Auflage, Georg Thieme Verlag KG Stuttgart. Lustig, L.R., Yeagle, J., Driscoll, C.L., Blevins, N., Francis, H., Niparko, J.K. (2006). Cochlear implantation in patients with neurofibromatosis type 2 and bilateral vestibular schwannoma. Otol Neurotol. 2006 Jun;27(4):512-8. Majdani, O., Rau, T.S., Baron, S., Eilers, H., Baier, C., Heimann, B., Ortmaier, T., Bartling, S., Lenarz, T., Leinung, M. (2009). A robot- guided minimally invasive approach for cochlear implant surgery. Int J Comput Assist Radiol Surg. 2009 Sep;4(5):475-86. Manrique, M.J., Savall, J., Cervera-Paz, F.J., Rey, J., Der, C., Echeverria, M., Ares, M. (2007). Atraumatic surgical approach to the cochlea with a micromanipulator. Acta Otolaryngol. 2007 Feb;127(2):122-31. 79 Verzeichnisse: • • • • • • • • • • • • • • • • • • • Nicholas, J. G., Geers, A.E. (2007). Will they catch up? The role of age at cochlear implantation in the spoken language development of children with severe to profound hearing loss. J Speech Lang Hear Res 50(4): 1048-1062. Noble, J.H., Labadie, R.F., Gifford, R.H., Dawant, B.M. (2013). Image-guidance enables new methods for customizing cochlear implant stimulation strategies. IEEE Trans Neural Syst Rehabil Eng. 2013 Sep;21(5):820-9. O´Donoghue, G. (2013). Cochlear Implants – Science, Serendipity and Success. N Engl J Med. 2013 Dec 26;369(26):2564. O'Leary, M.J., Fayad, J., House, W.F., Linthicum, F.H. Jr. (1991). Electrode insertion trauma in cochlear implantation. Ann Otol Rhinol Laryngol. 1991 Sep;100(9 Pt 1):695-9. Papsin, B.C. (2005). Cochlear information in children with anomalous cochleovestibular anatomy. Laryngoscope. 2005 Jan;115(1 Pt 2 Suppl 106):1-26. Peelle, J.E., Troiani, V., Grossman, M., Wingfield, A. (2011). Hearing loss in older adults affects neural systems supporting speech comprehension. J Neurosci. 2011; 31:12638–12643. Pein, M.K., Brandt, S., Plontke, S.K., Kösling, S. (2014). Visualization of subtle temporal bone structures. Comparison of cone beam CT and MDCT. Radiol., 54, 271278. Probst, R., Grevers, G., Iro, H. (2008). Hals- Nasen- Ohrenheilkunde; 3. Auflage, Georg Thieme Verlag KG Stuttgart. Pujol, R., Lavigne-Rebillard, M. (2003). Development and plasticity of the human auditory system. In: Luxon L (ed.): Textbook of Audiological Medicine. M. Dunitz, London 2003:147-156. Rebscher, S.J., Hetherington, A., Bonham, B., Wardrop, P., Whinney, D., Leake, P.A. (2008). Considerations for design of future cochlear implant electrode arrays: electrode array; stiffness, size, and depth of insertion. J Rehabil Res Dev 2008; 45: 731-47. Reid, J., Paladin, A., Davros, W., Lee, E., Carrico, C. (2013). Pediatric Radiology, erste Auflage; Oxford University Press. Richter, B., Aschendorff A., Nagursky, H., Schipper, J., Laszig, R., Klenzner, T. (2005). Methodik der Evaluation perimodiolarer CI- Elektrodenträger im Felsenbeinmodell. Laryngo-Rhino-Otol 2005; 84(1): 42-50. Risi, F., Saldanha, A., Leigh, R., Gibson, R. (2004). Magnetic resonance imaging safety of Nucleus 24 cochlear implants at 3.0 T. International Congress Series; 1273 (2004) 394–398. Rubinstein, J.T., Parkinson, W.S., Tyler, R.S., Gantz, B.J. (1999). Residual speech recognition and cochlear implant performance: Effects of implantation criteria. Am J Otol. 1999; 20:445–452. Ruivo, J., Mermuys, K., Bacher, K., Kuhweide, R., Offeciers, E., Casselman, J.W. (2009). Cone beam computed tomography, a low-dose imaging- technique in the postoperative assessment of cochlear implantation. Otol Neurotol. 2009 Apr;30(3):299-303. Samy, R.N., Houston, L., Scott, M., Choo, D.I., Meinzen-Derr, J. (2014). Cochlear implantation in patients with Meniere's disease. Cochlear Implants Int. 2014 Dec 9. Schiebler, T.H., Korf, H.W. (2007). Anatomie; 10. Auflage, Steinkopff Verlag. Schmidt, R., Lang, F., Heckmann, M. (2007). Physiologie des Menschen mit Pathophysiologie; 30. Auflage; Springer Medizin Verlag Heidelberg. Schmidt, R., Lang, F., Heckmann, M. (2010). Physiologie des Menschen mit Pathophysiologie; 31. Auflage, Springer Medizin Verlag Heidelberg. 80 Verzeichnisse: • • • • • • • • • • • • • • • • • Schneider, B.A., Pichora-Fuller, K., Daneman, M. (2010). Effects of Senescent Changes in Audition and Cognition on Spoken Language Comprehension. In: GordonSalant, S., et al., editors. The Aging Auditory System. New York: Springer; 2010. p. 167-210. Schurzig, D., Webster, R.J. 3rd, Dietrich, M.S., Labadie, R.F. (2010). Force of cochlear implant electrode insertion performed by a robotic insertion tool: comparison of traditional versus Advance Off-Stylet techniques. Otol Neurotol. 2010 Oct;31(8):1207-10. Shepherd, R.K., Clark, G.M., Pyman, B.C., Webb, R.L. (1985). Banded intracochlear electrode array: evaluation of insertion trauma in human temporal bones. Ann Otol Rhinol Laryngol. 1985 Jan-Feb;94(1 Pt 1):55-9. Skarzynski, H., Lorens, A., Matusiak, M., Porowski, M., Skarzynski, P.H., James, C.J. (2012). Partial deafness treatment with the nucleus straight research array cochlear implant. Audiol Neurootol 2012;17:82-91. Skarzynski, H., Podskarbi-Fayette, R. (2010). A new cochlear implant electrode design for preservation of residual hearing: a temporal bone study. Acta Otolaryngol 2010; 130: 435-42. Skinner, M.W., Holden, T.A., Whiting, B.R., Voie, A.H., Brunsden, B., Neely, J.G., Saxon, E.A., Hullar, T.E., Finley, C.C. (2007). In vivo estimates of the position of Advanced Bionics electrode arrays in the human cochlea. Ann Otol Rhinol Laryngol. 2007; 197:2–24. Skinner, M.W., Ketten, D.R., Holden, L.K., Harding, G.W., Smith, P.G., Gates, G.A., Neely, J.G., Kletzker, G.R., Brunsden, B., Blocker, B. (2002). CT-derived estimation of cochlear morphology and electrode array position in relation to word recognition in Nucleus-22 recipients. J Assoc Res Otolaryngol. 2002; 3:332–350. Slattery, W.H., Brackmann, D.E., Hitselberger, W. (1998). Hearing preservation in neurofibromatosis type 2. Am J Otol. 1998 Sep;19(5):638-43. Strubecker, K. (1984). Einführung in die höhere Mathematik. 4. Grundzüge der linearen Algebra, Differential- und Integralrechnung der Funktionen von mehreren Veränderlichen (1984), Verlag: Oldenbourg. Strutz, J., Mann, W. (2009). Praxis der HNO-Heilkunde, Kopf- und Halschirurgie, Seite 366 bis 370, zweite Auflage, Georg Thieme Verlag KG Stuttgart. Strutz, J., Mann, W.J., Arndt, O. et al. (2009). Praxis der HNO-Heilkunde, Kopf- und Halschirurgie. 2., vollständig überarbeitete und erweiterte Auflage 2009. Thieme Verlag, Stuttgart. Tillmann, B., Sperlich, C., Franke, C., Cornford ,A. (2005). Tillmann Atlas der Anatomie; 1. Auflage, Springer Verlag Berlin Heidelberg. Trepel, M. (2008). Neuroanatomie; 4. Auflage, Elsevier GmbH München. Trieger, A., Schulze, A., Schneider, M., Zahnert, T., Mürbe, D. (2010). In vivo measurements of the insertion depth of cochlear implant arrays using flat-panel volume computed tomography. Otol Neurotol., 32, 152-157. Trotter, M.I., Briggs, R.J. (2010). Cochlear implantation in neurofibromatosis type 2 after radiation therapy. Otol Neurotol. 2010 Feb;31(2):216-9. Tykocinski, M., Saunders, E., Cohen, L.T., Treaba, C., Briggs, R.J., Gibson, P., Clark, G.M., Cowan, R.S. (2001). The Contour electrode array: safety study and initial patient trials of a new perimodiolar design. Otol Neurotol. 2001 Jan;22(1):33-41. UK Cochlear Implant Study Group. (2004). Criteria of candidacy for unilateral cochlear implantation in postlingually deafened adults I: Theory and measures of effectiveness. Ear Hear. 2004; 24:310– 335. 81 Verzeichnisse: • • • • • • • • • • • • • • • • Usami, S., Abe, S., Weston, M.D., Shinkawa, H., Van Camp, G., Kimberling, W.J. (1999). Non-syndromic hearing loss associated with enlarged vestibular aqueduct is caused by PDS mutations. Hum Genet. 1999 Feb;104(2):188-92. Uziel, A. S., M. Sillon, A. Vieu, F. Artieres, J. P. Piron, J. P. Daures and M. Mondain (2007). Ten- year follow-up of a consecutive series of children with multichannel cochlear implants. Otol Neurotol 28(5): 615-628. Van der Beek, F.B., Goermans, P.P., Verbist, B.M., Briaire, J.J., Frijns, J.H. (2005). Clinical evaluation of the Clarion CII HiFocus I with and without positioner. Ear Hear. 2005; 26:577–592. Van der Marel, K., Briaire, J. J., Wolterbeek, R., Snel-Bongers, J., Verbist B. M., Frijns, J. H. M. (2013). Diversity in cochlear morphology and its influence on cochlear implant electrode position. Ear Hear., 35, 9-20. Venail, F., Sicard, M., Piron, J.P., Levi, A., Artieres, F., Uziel, A., Mondain, M. (2008). Reliability and complications of 500 consecutive cochlear implantations. Arch Otolaryngol Head Neck Surg 2008, 134:1276-81. Verbist, B.M., Ferrarini, L., Briaire, J.J., Zarowski, A., Admiraal-Behloul, F., Olofsen, H., Reiber, J.H., Frijns, J.H. (2009). Anatomic considerations of cochlear morphology and its implications for insertion trauma in cochlear implant surgery. Otol Neurotol. 2009 Jun;30(4):471-7. Verbist, B.M., Skinner, M.W., Cohen, L.T., Leake, P.A., James, C., Boëx, C., Holden, T.A., Finley, C.C., Roland, P.S., Roland, J.T. Jr., Haller, M., Patrick, J.F., Jolly, C.N., Faltys, M.A., Briaire, J.J., Frijns, J.H. (2010). Consensus panel on a cochlear coordinate system applicable in histologic, physiologic, and radiologic studies of the human cochlea. Otol Neurotol. 2010 Jul;31(5):722-30. Verbist, B.M., Frijns, J.H., Geleijns, J., van Buchem, M.A. (2005). Multisection CT as a valuable tool in the postoperative assessment of cochlear implant patients. AJNR Am J Neuroradiol. 2005 Feb;26(2):424-9. Vlastarakos, P.V., Nazos, K., Tavoulari, E.F., Nikolopoulos, T.P. (2014). Cochlear implantation for single-sided deafness: the outcomes. An evidence-based approach. Eur Arch Otorhinolaryngol. 2014 Aug;271(8):2119-26. Von Wallenberg, E., Briggs, R (2014). Cochlear's unique electrode portfolio now and in the future. Cochlear Implants Int. 2014 May;15 Suppl 1:S59-61. Waltzman, S. B., Cohen, N.L., Green, J., Roland, J.T.Jr. (2002). Long-term effects of cochlear implants in children. Otolaryngol Head Neck Surg 126(5): 505-511. Waltzman, S.B., Roland ,JT.Jr., (2014). Cochlear Implants. Dritte Ausgabe; Thieme Medizin Verlag; New York. Wanna, G. B., Noble, J. H., McRrackan, T. R., Benoit, M., Dawant, M. S., Dietrich, L., Watkins, A., Rivas, T. A., Schuman, R., Labadie, F. (2011). Assessment of Electrode Placement and Audiologic Outcomes in Bilateral Cochlear Implantation. Otol Neurotol. 2011 Apr; 32(3): 428–432. Welling, D.B., Hinojosa, R., Gantz, B.J., Lee, J.T. (1993). Insertional trauma of multichannel cochlear implants. Laryngoscope. 1993 Sep;103(9):995-1001. Wiegand, D.A., Ojemann, R.G., Fickel, V. (1996). Surgical treatment of acoustic neuroma (vestibular schwannoma) in the United States: report from the Acoustic Neuroma Registry. Laryngoscope. 1996 Jan;106(1 Pt 1):58-66. Wingfield, A., Tun, P.A., McCoy, S.L. (2005). Hearing loss in older adulthood: What it is and how it interacts with cognitive performance. Curr Dir Psychol Sci. 2005; 14:144–148. 82 Verzeichnisse: • • • • • Wullstein, H. Die Klinik der Labyrinthitis und Paralabyrinthitis auf Grund des Röntgenbefundes. Stuttgart 1948 Würfel, W., Lanfermann, H., Lenarz, T., Majdani, O. (2014). Cochlear length determination using Cone Beam Computed Tomography in a clinical setting. Hear Res. 316, 65-72. Xu, J., Xu, S.A., Cohen, L. T., Clark, G.M. (2000). Cochlear view: postoperative radiography for cochlear implantation. Am J Otol., 21, 49-56. Yawn, R.., Hunter, J.B., Sweeney, A.D., Bennett, M.L. (2015). Cochlear implantation: a biomechanical prosthesis for hearing loss. F1000Prime Reports 2015, 7:45. Yukawa, K., Cohen, L., Blamey, P., Pyman, B., Tungvachirakul, V., O'Leary, S. (2004). Effects of insertion depth of cochlear implant electrodes upon speech perception. Audiol Neurootol. 2004; 9:163–172. 83 Danksagung: 9. Danksagung: Mein Dank gilt vielen Menschen, die mich in meinem Studium und während meiner Dissertation begleitet, beraten und ermuntert haben. Zuallererst möchte ich aber meiner Doktormutter Frau Professor Doktor Aschendorff danken, welche mich im Rahmen einer Famulatur vom Bereich der Otologie und des CIs begeisterte und mir ermöglichte in diesem meine Doktorarbeit zu bestreiten. Sie erklärte mir sehr viel und stand mir immer mit Rat und Tat zur Seite. Einige Male konnte ich ihr bei ihrer operativen Tätigkeit über die Schulter schauen und dabei sehr viel lernen und für meine weitere Laufbahn mitnehmen. Danke!! Ebenso danke ich Herrn Professor Doktor Agostini für die Erstellung des Zweitgutachtens. Ein besonders großer Dank gilt weiterhin meinem Betreuer Doktor Rainer Beck, welcher mich sowohl bei meiner Veröffentlichung als auch beim Verfassen dieser Arbeit enorm unterstützte. Ohne seine regelmäßige wertvolle, konstruktive und motivierende Rückmeldung wären weder Veröffentlichung noch Dissertation so geworden wie sie nun sind. Das weiß ich sehr zu schätzen und möchte mich dafür bedanken. Es ist sehr wertvoll und nicht selbstverständlich seine Familie immer hinter sich zu wissen und die volle Konzentration auf sein Studium und seine Promotion richten zu können. Ohne meine Familie, welche mir stets den Rücken frei hielt und hält, wäre dies nicht möglich gewesen. Meine Eltern und meine Schwester haben mich immer unterstützt, motiviert und wieder aufgebaut, wenn ich mit mir unzufrieden war. Dafür ist ein bloßes Danke eigentlich viel zu wenig. „Was immer Du tun kannst oder träumst es zu können, fang damit an.“ Von Johann Wolfgang Goethe 84 10. Eidesstattliche Versicherung: 10. Eidesstattliche Versicherung: gemäß § 8 Absatz 1 Nr. 3 der Promotionsordnung der Universität Freiburg für die Medizinische Fakultät: 1. Bei der eingereichten Dissertation zu dem Thema Einfluss der cochleären Morphologie auf die Dislokationswahrscheinlichkeit des Elektrodenträgers des Cochlea Implantates handelt es sich um meine eigenständig erbrachte Leistung. 2. Ich habe nur die angegebenen Quellen und Hilfsmittel benutzt und mich keiner unzulässigen Hilfe Dritter bedient. Insbesondere habe ich wörtlich oder sinngemäß aus anderen Werken übernommene Inhalte als solche kenntlich gemacht. Niemand hat von mir unmittelbar oder mittelbar geldwerte Leistungen für Arbeiten erhalten, die im Zusammenhang mit dem Inhalt der vorgelegten Dissertation stehen. 3. Die Dissertation oder Teile davon habe ich bislang nicht an einer Hochschule des In- oder Auslands als Bestandteil einer Prüfungs- oder Qualifikationsleistung vorgelegt. 4. Die Richtigkeit der vorstehenden Erklärungen bestätige ich. 5. Die Bedeutung der eidesstattlichen Versicherung und die strafrechtlichen Folgen einer unrichtigen oder unvollständigen eidesstattlichen Versicherung sind mir bekannt. 6. Teile dieser Dissertationsschrift habe ich in dem Journal: European Archives of Oto – Rhino - Laryngology als Erstautor eingereicht. Die Publikation befindet sich zum Zeitpunkt der Vorlage dieser Dissertationsschrift „under review“. Ich versichere an Eides statt, dass ich nach bestem Wissen die reine Wahrheit erklärt und nichts verschwiegen habe. ____________________________ ____________________________________________ Ort und Datum Unterschrift 85