Infektionen mit dem Epstein-Barr-Virus
Werbung

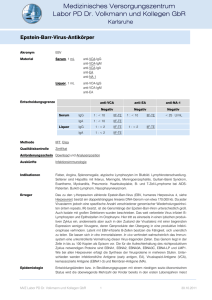
MEDIZIN DIE UBERSICHT Virus-Sehe (8) Infektionen mit dem Epstein-Barr-Virus Hans Georg Koch Erik Harms eit Ende des letzten Jahrhunderts sind Infektionen bekannt, die auf das EpsteinBarr-Virus (EBV) zurückgeführt werden können. Im Jahr 1889 prägte Emil Pfeiffer den Begriff des Drüsenfiebers. Durch Sprunt und Evans erfolgte im Jahr 1920 die erste im heutigen Sinne vollständige Beschreibung dieser Erkrankung, die sie in Anbetracht der beobachteten hämatologischen Veränderungen als infektiöse Mononukleose bezeichneten. Paul und Bunell konnten 1932 heterophile Antikörper nachweisen und ebneten den Weg zur serologischen Diagnose. Der Erreger selbst konnte erstmals im Jahr 1964 durch Epstein und Barr elektronenmikroskopisch in Tumorzellen eines Burkitt-Lymphoms dargestellt und als Herpesvirus identifiziert werden. Vier Jahre später erkannte man, daß das Epstein-Barr-Virus (EBV) auch als Erreger der infektiösen Mononukleose betrachtet werden konnte (7). Epidemiologische Untersuchungen zeigten, daß Erwachsene nahezu vollständig gegen EBV seropositiv sind. Die Infektion verläuft häufig inapparent, wobei der Schweregrad der klinischen Manifestation einer infektiösen Mononukleose mit dem Erkrankungsalter zunimmt. Der Zeitpunkt der Erstinfektion scheint von soziokulturellen Faktoren beeinflußt zu werden. In den Ländern der Dritten Welt sind bereits 80 bis 90 Prozent der Kinder im Alter von zwei bis drei Jahren seropositiv, im Vergleich zu 51 Prozent der vierjährigen Kinder in Mitteleuropa. Der frühe Zeitpunkt der Erstinfektion hat zur Folge, daß eine symptomatische EBV-Infektion in den Entwicklungsländern ungewöhnlich ist (10). S A 436 - Infektionen mit dem Epstein-Barr-Virus (EBV) sind seit langem bekannt und verlaufen in der Regel inapparent. Gelegentlich tritt eine akute Erkrankung auf, die sich als infektiöse Mononukleose manifestiert; aber auch chronische Verläufe werden beobachtet. Darüber hinaus besteht eine Assoziation zu bestimmten Malignomen und lymphoproliferativen Erkrankungen. Zellbiologische und molekularbiologische Forschungsergebnisse der letzten Jahre tragen wesentlich zum Verständnis des Infektionsablaufes bei und eröffnen neue Möglichkeiten der Diagnostik und Therapie. 1. Virologische Aspekte Als Mitglied der Familie Herpesviridae weist das Epstein-Barr-Virus eine für Herpesviren typische Morphologie auf (Abbildung 1). Das etwa 120 nm messende Virion ist umhüllt, 162 Kapsomere verleihen ihm eine ikosaedrische Struktur. Es enthält als Nukleinsäure eine lineare, doppelsträngige DNA, deren 172 000 Basenpaare für etwa 80 Polypeptide kodieren (Abbildung 2). Als charakteristisches Strukturmerkmal weist die EBV-DNA interne (IR1 bis IR4) und terminale repetitive Sequenzen (TR) auf, wobei Allgemeine Kinderheilkunde (Direktor: Prof. Dr. med. Erik Harms), Klinik und Poliklinik für Kinderheilkunde der Universität Münster (46) Deutsches Ärzteblatt 92, Heft 7, 17. Februar 1995 letztere eine Ringbildung der DNA zur Replikation ermöglichen (10). Die EBV-Infektion kann sowohl einen lytischen als auch einen latenten Verlauf nehmen. Eine Rezeptorfunktion für EBV übernimmt hierbei CD21, das auch als Rezeptor der C3dKomponente des Komplements bekannt ist. Nachgewiesen wurde dieser „EBV-Rezeptor" bisher auf epithelialen Zellen des Nasopharynx und der Cervix uteri, auf B-Lymphozyten, sowie in Tränendrüse und Hornhaut (5, 10). Die lytische Infektion, die typischerweise epitheliale Zellen betrifft, ist dadurch charakterisiert, daß sie zur Zerstörung der infizierten Zelle mit Freisetzung infektiöser Virionen führt. Dieser lytische Infektionszyklus ist dem anderer Herpesviren vergleichbar. Es werden in zeitlicher Abfolge Genprodukte gebildet, die für die DNA-Replikation (zum Beispiel virale DNA-Polymerase, Thymidinkinase) erforderlich sind oder Strukturkomponenten des Virions darstellen (beispielsweise viral capsid Antigen [VCA], gp350). Sie besitzen antigenen Charakter und lösen die Bildung von Antikörpern aus. Im Gegensatz zur lytischen Infektion epithelialer Zellen werden B Lymphozyten in der Regel latent infiziert, wobei das virale Genom im Zellkern der infizierten Zelle extrachromosomal in episomaler Ringform vorliegt (10). Solche durch EBV transformierten (immortalisierten) Lymphozyten besitzen in vitro die Eigenschaft zu kontinuierlichem Wachstum. Während der latenten Infektion werden lediglich virale Genprodukte gebildet, die EBV von anderen Herpesviren unterscheiden (zum Beispiel Epstein Barr Nuclear Antigen [EBNA], Latent Membran MEDIZIN DIE ÜBERSICHT Protein [LMP], Epstein Barr Encoded RNA [EBER]). Die Mechanismen der Viruslatenz waren in den letzten Jahren Gegenstand intensiver Forschung. Man vermutet, daß die Persistenz des episomalen viralen Genoms durch die Expression von EBNA-1 ermöglicht wird, das durch Bindung an die virale DNA deren Replikation verhindert. Als Schalter zwischen Latenz und permissivem Infektionszyklus scheint in vitro ZEBRA (Z EBV Replication Activator) zu agieren, ein ebenfalls viral kodiertes Genprodukt (10). Abbildung 1: Herpesvirionen; elektronenmikroskopisch dargestellt sind Virionen mit typischer Herpesvirus-Morphologie (Primärvergrößerung: 50 000fach). Die unterschiedlichen Mitglieder der Familie Herpesviridae lassen sich mit dieser Methode nicht differenzieren. (Diese Aufnahme verdanken wir Herrn Dr. H. G. Baumeister, Hygienisch-bakteriologisches Landesuntersuchungsamt, Münster.) 172 kb TR IR1 IR2 IR3 TR IR4 Abbildung 2: Struktur des EBV-Genoms (modifiziert nach Strauss et al. 1993). Das Genom des EpsteinBarr-Virus besteht aus einer linearen, doppelsträngigen DNA mit einer Länge von etwa 172 000 Basenpaaren, die für mehr als 80 unterschiedliche Genprodukte kodieren. Typisch für das Genom der Herpesviren sind interne und terminale repetitive Sequenzen (IR, TR). Dargestellt sind einige kodierende Regionen des viralen Genoms, die für Replikation oder Latenz des Virus verantwortlich sind (gp350 — Glykoprotein 350, ZEBRA-Z Epstein Barr Replication Activator, VCA — Viral Capsid Antigen, TK — Thymidinkinase, Pol — DNA-Polymerase, EAR — Early Antigen Restricted, EAD — Early Antigen Diffuse, ERNA — Epstein Barr Nuclear Antigen). Replikation gp350 ZEBRA VCA TK Latenz Pol 9 EA-R EA-D EBNA-1 2. Klinische Symptomatik Jugendliche / Erwachsene Kinder 2.1. Akute Infektion Die EBV-Infektion nimmt in Form der infektiösen Mononukleose ihren klassischen Verlauf. Sie wird durch Speichel übertragen und tritt meist im Schul- und jungen Erwachsenenalter auf. Nach einer durchschnittlichen Inkubationszeit von 10 bis 14 Tagen, die auch einige Wochen betragen kann, werden Fieber, Lymphadenopathie und Pharyngitis als typische Symptom-Trias beobachtet (4). Die Krankheit verläuft beim immunkompetenten Individuum selbstlimitierend, kann auch durch eine Viel- Abbildung 3: Relative Häufigkeit typischer Symptome der infektiösen Mononukleose bei Erwachsenen Fieber Abgeschlagenheit Halsschmerzen zervikale Lymphadenopathie — 100 % 90 % 80 % Splenomegalie Ampicillinexanthem Exsudative Pharyngotonsillitis Fieber zervikale Lymphadenopathie 70 % 60% Splenomegalie Exanthem 50 % Exsudative Pharyngotonsillitis 40 % Hepatomegalie generalisierte Lymphadenopathie 30 % Hepatomegalie Ikterus 20 % 10% Exanthem 0% Ikterus Halsschmerzen Abgeschlagenheit und Kindern Deutsches Ärzteblatt 92, Heft 7, 17. Februar 1995 (47) A-437 MEDIZIN DIE UBERSICHT Abbildung 4: Symptome der infektiösen Mononukleose, A) Akute Pharyngotonsillitis bei einem 2jährigen Kind mit typischen, weißlichen Belägen, B) Generalisiertes Exanthem zahl von Symptomen, die unterschiedlichste Organe betreffen, kompliziert werden (Tabelle I). Die Häufigkeit klinischer Symptome zeigt bei Kindern und Erwachsenen eine unterschiedliche Verteilung (3, Abbildung 3 und 4). 2.2. Chronische Infektion In seltenen Fällen nimmt die Infektion einen chronischen Verlauf und wird dann als chronische Mononukleose bezeichnet. Als führende Symptome werden rekurrierendes Fieber, reaktive Adenopathie und Hepatosplenomegalie, Uveitis, Pneumonitis und Polyneuropathie beschrieben. Patienten können bei fortschreitender zellulärer und humoraler Immundefizienz an opportunistischen Infektionen und bakteriellen Septikämien versterben. Es wurden bisher allerdings nur wenige Einzelfälle der chronischen Mononukleose beschrieben, deren Manifestationsalter zwischen 7 und 23 Jahren lag (10). ver Syndrome beschrieben. Diesen Erkrankungen liegen in der Regel mmundefizienzen zugrunde, die sowohl angeborener als auch erworbener Natur sein können. Bei dem X-chromosonial rezessiv vererbten, lymphoproliferativen Syndrom (XLP, Duncan's Disease, Purtilo-Syndrom) handelt es sich um eine genetische Prädisposition männlicher Individuen, keine adäquate Immunantwort gegen eine EBV-Infektion aufbauen zu können (4). Der XLPLokus wurde genetisch auf dem lan- 2.3. Lymphoproliferatives Syndrom In Assoziation zur latenten EBVInfektion wird eine Reihe proliferatiAbbildung 5: Typische Virozyten („Pfeiffer-Zellen") im Blutausstrich eines Patienten mit infektiöser Mononukleose A-438 (48) Deutsches Ärzteblatt 92, Heft 7, 17. Februar 1995 gen Arm des X-Chromosoms (Xq25 bis 26) kartiert. Betroffene Individuen zeigen im Falle einer EBV-Infektion einen besonders schweren Verlauf, der in der akuten Phase in mehr als der Hälfte der Fälle letal verläuft. Nach Überleben der akuten Krankheitsphase bleiben häufig hämatologische und immunologische Symptome bestehen (aplastische Anämie, Hyper- oder Hypogammaglobulinämie, Lymphome, opportunistische Infektionen). Die Prognose ist ungünstig. MEDIZIN DIE ÜBERSICHT 2.4. EBV-assoziierte Malignome Die Entstehung EBV-assoziierter B-Zell-Tumoren unter transplantationsbedingter Immunsuppression erweist sich zunehmend als Problem. Hier schient eine immunsuppressive Therapie zu einer Reaktivierung einer persistierenden EBV-Infektion mit Wachstum transformierter B-Zellen zu führen (1, 7, 10). Die Bedeutung der körpereigenen Immunabwehr für die Kontrolle der persistierenden EBV-Infektion wird auch dadurch deutlich, daß nach Beendigung der immunsuppressiven Therapie ein spontaner Rückgang der Neoplasien in Einzelfällen eintrat. EBV-assoziierte Lymphome werden auch bei AIDS und den seltenen hereditären Immundefekten beobachtet. Das mit EBV assoziierte Nasopharynx-Karzinom tritt endemisch im jungen Erwachsenenalter in China und Alaska, ebenso wie das Burkitt-Lymphom bei Kindern vor dem zehnten Lebensjahr in Afrika auf, wobei letzteres eine Assoziation zu einer Infektion mit Malaria falciparum aufweist. EBV läßt sich in diesen Tumoren regelmäßig nachweisen. Auffällig ist jedoch, daß einige Antigene des latenten Stadiums (EBNA-2, EBNA-3, LMP), die Zielstrukturen zum Abbau EBV-infizierter B-Lymphozyten durch zytotoxische T-Lymphozyten darstellen, bei dieser Erkrankung nicht exprimiert werden und transformierte B-Lymphozyten möglicherweise so die Immunkontrolle unterlaufen können (10). Die bevorzugt im Rahmen einer AIDS-Erkrankung auftretende Haarzell-Leukoplakie äußert sich durch weißliche Beläge im Bereich der Mundschleimhaut. Es handelt sich hier um eine benigne, epitheliale Proliferation, die nur selten im Kindesalter beschrieben wird (10). Reihe unspezifischer Symptome (Hepatosplenomegalie, Thrombozytopenie, Lymphozytose, Dystrophie, muskuläre Hypotonie, Katarakt, Herzfehler, Metaphysitis) beschrieben werden (2, 8). Aufgrund der hohen Durchseuchung mit EBV im Erwachsenenalter ist eine primäre Infektion schwangerer Frauen selten. Eine pränatale Infektion durch Reaktivierung einer latenten EBV-Infektion wurde bis heute nicht berichtet. bei der infektiösen Mononukleose im Differentialblutbild typische Virozyten (Abbildung 5), die aktivierte zytotoxische T-Zellen (CD8) repräsentieren. Serologisch lassen sich zunächst anti-VCA-Antikörper der IgM- und IgG-Klasse nachweisen, in 70 bis 80 Prozent der Fälle auch Antikörper gegen den Early Antigen Komplex (anti-EA) sowie heterophile IgM-Antikörper (Paul-BunellTest), die allerdings bei Kindern nur in 50 Prozent der Fälle nachweisbar sind (6, 10). Antikörper gegen EBNA treten erst nach der akuten Infektion im Stadium der Viruslatenz auf, bei XLP oder Immundefizienz sind sie häufig nicht nachweisbar. Positive anti-VCA-IgM-Titer können auch eine 3. Labordiagnostik Die Diagnostik der EBV-Infektion basiert auf unterschiedlichen Methoden. Klassischerweise zeigen sich 1 Inkubation Tage 3 5 7 Wochen 2 3 4 1/ Akute Phase Monate 2 3 4 // Rekonvaleszenz I Abgelaufene Infektion Klinik Lyrnphadenopathie Blutbild EB-Virus Pharynx Antikörper: transiente Heterophil e Antikörper IgM Anti-VCA Anti-EA D 2.5. Pränatale Infektion Die Bedeutung von EBV als Erreger einer konnatalen Infektion ist noch nicht geklärt. Es liegen nur vereinzelte Kasuistiken vor, wobei eine Abbildung 6: Zeitlicher Verlauf klinischer Symptome und diagnostischer Parameter der infektiösen Mononukleose persistierende 1 Tage 3 5 7 Wochen 2 3 4 1/ Monate 2 3 4 Deutsches Ärzteblatt 92, Heft 7, 17. Februar 1995 (51) A-439 DIE ÜBERSICHT Reaktivierung einer EBV-Infektion anzeigen. In der chronischen Verlaufsform der EBV-Infektion sowie bei Nasapharynx-Karzinom und Burkitt-Lymphom lassen sich in der Regel anti-EBNA-IgG, anti-EA- sowie anti-VCA-IgG-Antikörper nachweisen. Im Falle des Nasapharynx-Karzinoms auch anti-VCA-Antikörper der IgA-Klasse, die wahrscheinlich auf lokale Antikörperproduktion zurückzuführen ist. Hier scheint auch eine Korrelation des Antikörpertiters mit der Tumormasse zu bestehen. Doch gerade bei immundefizienten Individuen oder der chronischen Mononukleose treten häufig Probleme bezüglich der serologischen Diagnostik auf. Das Spektrum der diagnostischen Möglichkeiten wird hier sinnvoll durch Methoden des Virus-Nachweises ergänzt. Dieser kann mit Hilfe von Test-Antikörpern gegen virale Strukturen erfolgen (Immunoblot, Immunfluoreszenz) oder durch Nachweis vi- Tabelle 1: Serologische Befunde bei unterschiedlichen Manifestationen der EBV-Infektion IgM IgM IgG IgA + + ++ (+) Infektiöse Mononukleose Zustand nach EBV-Infektion + Chronische EBV-Infektion ++ Burkitt-Lymphom ++ Nasapharynx-Karzinom ++ Antikörper IgG IgG + + (+) (+) + ++ (+) (+) (+) ++ + ++ + +positiv ++stark positiv (+) möglicherweise positiv VCA = Viruskapsid-Antigen EA = early antigen (D = diffuse, R = restricted) EBNA =Kern-Antigene Seltene Komplikationen Hämatologie Hämolytische Anämie, Thrombozytopenie, Granulozytopenie, aplastische Anämie Neurologie Enzephalitis, Transversale Myelitis, Guillain-Barre-Syndrom, Neuritis nervi optici ~ Fieber ~ Abgeschlagenheit Herz Myokarditis, Perikarditis ~ Halsschmerzen Atemwege ~ Zervikale Lymphadenopathie Larynxobstruktion, Streptokokkenpharyngitis, Pneumonie, Nasapharynx-Karzinom ~ Splenomegalie Haut ~ Exsudative Pharyngotonsillitis Ampicillin-Rush, Vaskulitis, Kälteurtikaria, Haarzell-Leukoplakie ~ Hepatomegalie Niere ~ Ikterus Interstitielle Nephritis, Glomerulanephritis ~ Exanthem Leber Hepatitis, Lebernekrose, Reye-Syndrom A-440 EBNA- EAD EA-R Tabelle 2: Typische Symptome und seltene Komplikationen der infektiösen Mononukleose Typische Symptome EA-Antikörper Hetero- V CA-Antikörper phile Antikörper Milz Ruptur Augen Keratitis, Dakryozystitis, Konjunktivitis Immunologie Hypo-/Hypergammaglobulinämie, lymphoprolifera tive Syndrome (52) Deutsches Ärzteblatt 92, Heft 7, 17. Februar 1995 raler DNA (In-situ-Hybridisierung, PCR). Die direkte Darstellung des Virus kann elektronenmikroskopisch gelingen. Es läßt sich mit dieser aufwendigen Methode jedoch keine Differenzierung des EBV von anderen Viren der Herpesgruppe erzielen. Als Untersuchungsmaterial für den direkten Virusnachweis eignet sich besonders Rachenspülflüssigkeit Die Relevanz der Virusisolierung im Rahmen der Diagnostik sollte nicht überbewertet werden, da sie bei seropositiven Individuen allzuhäufig gelingt. Der serologische Status bei unterschiedlichen Manifestationen einer EBV-Infektion ist in Tabelle 1 dargestellt; Abbildung 6 zeigt den zeitlichen Verlaufklinischer Symptome und diagnostischer Parameter der infektiösen Mononukleose. 4. Therapie In-vitra-Versuche konnten zeigen, daß Virostatika wie beispielsweise Aciclovir (wie Zovirax®), Ganciclovir (wie Cymeven®) und Foscarnet sowie Interferone die EBV-Replikation hemmen. Diese Wirkung erfaßt allerdings nur die Replikation der linearen Form der viralen DNA in der lytischen Infektion. Die latente MEDIZIN DIE ÜBERSICHT / FÜR SIE REFERIERT Infektion kann durch diese Mittel nicht beeinflußt werden (9, 10, 11). Klinische Studien zeigten jedoch, daß in vivo die Behandlungserfolge auch der lytischen Infektion beim Menschen enttäuschend sind. In der Regel nimmt die infektiöse Mononukleose einen selbstlimitierenden Verlauf und bedarf nicht der virustatischen Behandlung. Man beschränkt sich im akuten Stadium auf Bettruhe und empfiehlt bei Splenomegalie körperliche Schonung, um einer Milzruptur vorzubeugen. Eine antibiotische Behandlung ist lediglich im Falle einer superinfizierten Tonsillitis in Erwägung zu ziehen, wobei Ampicillin und Amoxycillin kontraindiziert sind, da hierdurch regelmäßig ein Exanthem („Rush") induziert wird. Die Anwendung von Steroiden ist kritisch zu betrachten. Durch deren zytotoxische Wirkung auf T-Lymphozyten, die einen die Infektion kontrollierenden Einfluß haben, kann der Verlauf verschlechtert werden. Allerdings wird beobachtet, daß entzündliche Komplikationen der infek- tiösen Mononukleose unter Steroidanwendung günstig zu beeinflussen sind. Empfohlen wird im Falle einer komplizierten Mononukleose größte Zurückhaltung bezüglich einer Steroidtherapie. In diesem Fall kann die Kombination mit Virostatika in Erwägung gezogen werden. Der Erfolg dieses kombinierten Behandlungsregimes ist allerdings noch nicht in klinischen Studien bewiesen worden. Der fulminante Verlauf der infektiösen Mononukleose bei der X-chromosomal proliferativen Verlaufsform läßt sich zur Zeit noch nicht medikamentös aufhalten. Es wird berichtet, daß die Haarzell-Leukoplakie, eine EBV induzierte, benigne epitheliale Proliferation der Mundschleimhaut, die häufig bei erwachsenen AIDS-Patienten diagnostiziert wird, durch Aciclovir positiv zu beeinflussen ist. Die Rezidivrate ist allerdings hoch. Hoffnungen zur Prophylaxe EBV-induzierter Tumoren liegen in der Entwicklung eines Impfstoffes, wobei im Tierversuch bereits durch das EBVStrukturprotein gp350 neutralisierende Antikörper induziert werden Organerhaltende Behandlung beim lokal fortgeschrittenen Harnblasenkarzinom Die radikale Zystektomie gilt als Standardtherapie des fortgeschrittenen Blasenkarzinoms. Seit einigen Jahren gibt es mehrere Pilotstudien, in denen man durch Kombination von Radiotherapie und Chemotherapie einen Organerhalt anstrebt und die Zystektomie erst bei Versagen dieser konservativen Therapie einsetzt. Die Autoren berichten über die Ergebnisse eines prospektiven, seit 1982 an der Universität Erlangen durchgeführten Protokolls. Von 1982 bis 1991 wurden 245 Patienten, die aufgrund ihres Tumorstadiums Kandidaten für eine Zystektomie gewesen wären (T2 bis 4 oder T1 G3), behandelt. Das mittlere Alter betrug 66 Jahre. Die Therapie bestand aus einer möglichst kompletten transurethralen Resektion (TUR) mit anschließender Radiotherapie (50 Gy in 28 Fraktionen in sechs Wochen) oder Radiochemotherapie mit Cisplatin (n = 79) oder Carboplatin (n = 60). Sechs bis acht Wochen nach Radiotherapie überprüfte man den Behandlungserfolg durch Kontroll-TUR. Eine radikale Zystektomie erfolgte nur bei Tumorpersistenz oder bei invasiven Rezidiven. Die 5-Jahres-Überlebensrate im Gesamtkollektiv betrug 47 Prozent. Bei muskelinvasiven Tumoren erreichte man 5-Jahres-Überlebensraten von 64 Prozent bei T2 (n = 47), 43 Prozent bei T3 (n = 127) und 16 Prozent bei T4 (n = 23). Der wichtigste prognostische Faktor war eine komplette TUR vor Radiotherapie. 53 Patienten wurden im weiteren Verlauf zystektomiert, die übrigen 79 Prozent behielten eine normal funktionierende Blase. Die Rate der Blasenerhaltung bei den nach fünf Jahren konnten (9). Eine EBV-Impfung wäre allerdings auf Risikogruppen wie Patienten mit Immundefizienzen oder Transplantatempfänger zu begrenzen. Zur Prävention der Infektion sind die allgemeinen Hygienerichtlinien ausreichend. Direkter Speichelkontakt sollte vermieden werden. Eine Isolierung der Patienten ist in der Regel nicht erforderlich. Zitierweise dieses Beitrags: Dt Ärztebl 1995; 92: A-436-441 [Heft 7] Die Zahlen in Klammern beziehen sich auf das Literaturverzeichnis im Sonderdruck, anzufordern über die Verfasser . Anschrift für die Verfasser: Prof. Dr. med. Erik Harms Klinik und Poliklinik für Kinderheilkunde Albert-Schweitzer-Straße 33 48129 Münster noch lebenden Patienten betrug 83 Prozent. Die Autoren folgern, daß mit TUR und Radiochemotherapie Überlebensraten ähnlich wie bei radikaler Zystektomie erreicht werden können. Der Vorteil des Verfahrens ist der Erhalt einer funktionierenden Blase bei dem überwiegenden Teil der Patienten. Analog zu anderen Malignomen (Mammakarzinom, Weichteilsarkome der Extremitäten) erscheint ein primär organerhaltendes Therapiekonzept auch bei Blasenkarzinomen sinnvoll. Ptr Dunst J et al.: Organ-sparing treatment of advanced bladder cancer: A 10-year experience. Int J Radiat Oncol Biol Phys 1994; 30: 261-266 Prof. Dr. Jürgen Dunst, Strahlentherapeutische Klinik, Martin-Luther-Universität, Halle-Wittenberg, Dryanderstraße 4-7,06097 Halle Prof. Dr. Rolf Sauer, Prof. Dr. Karl M. Schrott, Universität Erlangen, Universitätsstraße 27,91054 Erlangen Deutsches Ärzteblatt 92, Heft 7, 17. Februar 1995 (55) A-441